Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Latinoamericana de Metalurgia y Materiales
versión impresa ISSN 0255-6952
Rev. LatinAm. Metal. Mater. vol.33 no.1 Caracas jun. 2013
Obtención de óxido de estaño en el sistema SnCl2-H2O: Mecanismo de formación de las partículas
Carol J. Aguilar, Yasser H. Ochoa, Jorge E. Rodríguez-Páez
Grupo de Ciencia y Tecnología de Materiales Cerámicos (CYTEMAC), Departamento de Física - FACNED Universidad Del Cauca. Calle 5 # 4 – 70. Popayán, Cauca/Colombia
* e-mail: carolaguilar@unicauca.edu.co; yasser8a@gmail.com; jnpaez@unicauca.edu.com
RESUMEN
Dada la importancia tecnológica de los óxidos de estaño, SnOx, es de gran interés optimizar las condiciones de síntesis para obtener partículas con características predeterminadas, tanto en tamaño como en forma. Durante el desarrollo de este trabajo se estudió el efecto de las condiciones de síntesis de polvos cerámicos, utilizando el método de precipitación controlada. La caracterización estructural y física de los polvos cerámicos sintetizados se efectuó mediante Difracción de Rayos X (DRX) y espectroscopia infrarroja con transformada de Fourier (FTIR). Adicionalmente, para obtener información que permita conocer más sobre los mecanismos de formación de las partículas de óxido, se realizó la deconvolución de los espectros IR correspondientes a muestras solidas recolectadas durante diferentes etapas del proceso de síntesis.
Palabras Claves: Óxido de estaño, caracterización química, estructura.
Obtaining of tin oxide in the system SnCl2-H2O: Mechanism of formation of particles
ABSTRACT
Given the technological relevance of the tin oxides, SnOx, is of great interest to optimize the synthesis conditions to obtain particles predetermined characteristics, both in size and shape. During the course of this work we studied the effect of the synthesis conditions of ceramic powders, using the controlled precipitation method. The structural and physical characterization of synthesized ceramic powders was carried out by X-ray diffraction (XRD) and Fourier transform infrared spectroscopy (FTIR). Additionally, to obtain information to learn more about the mechanisms involved in the oxide particles formation, we performed the deconvolution of IR spectra for solid samples collected during different stages of synthesis process.
Keywords: Tin oxide, chemical characterization, structure.
Recibido: 04-09-2011 ; Revisado: 17-10-2011
Aceptado: 01-02-2012 ; Publicado: 02-22-2012
1. INTRODUCCIÓN
El óxido de estaño SnO2 es un material semiconductor transparente con gran estabilidad química y mecánica. El SnO2 tiene una fase estable, conocida como casiterita, que presenta una estructura cristalina tetragonal, tipo rutilo con parámetros de red a= 4.737 Å y C=3.186 Å. La densidad de este óxido tiene un valor de 6.95 g.cm-3 y su punto de fusión es de 1630°C [1]. El SnO2 es un compuesto ampliamente utilizado en aplicaciones tecnológicas, destacándose como catalizador [2], sensor de gases [3], y en la fabricación de varistores [4], conductores transparentes, electrodos electrocatalíticos y celdas fotovoltaicas, entre otras [5,6].
Debido a los requerimientos actuales, se han sintetizado polvos de SnO2 para tener control tanto de la pureza química así como del tamaño, distribución y morfología de las partículas que lo conforman. Entre las diferentes técnicas se destacan sol-gel [7], spray pirolisis [8], magnetron sputtering [9], precursor polimérico [10] y precipitación controlada [11].
En este trabajo se sintetizó el SnO2, utilizando el método de precipitación controlada, se estudió la precipitación de SnO2 a partir de soluciones acuosas de cloruro de estaño, utilizando como precipitante hidróxido de amonio, NH4OH. Con base en las curvas de valoración potenciométrica se determinaron las diferentes etapas del método de síntesis y se analizaron los procesos fisicoquímicos que ocurren durante la adición del precipitante. Finalmente, los polvos cerámicos obtenidos se caracterizaron utilizando difracción de rayos X (DRX) y espectroscopia infrarroja (FTIR).
2. PARTE EXPERIMENTAL
Para sintetizar el óxido de estaño, se prepararon soluciones acuosas con diferentes concentraciones del precursor de estaño, SnCl2.2H2O (Mallinckrodt 99.6%), con 0.1M de HNO3 (Carlo Erba 99%).Las soluciones se agitaron constantemente a 200 r.p.m. y posteriormente se adicionó hidróxido de amonio (NH4OH -Mallincrodt 28%), a una velocidad de 0.034 mL/s. A medida que se adicionó el NH4OH al sistema, se registraron el pH y la conductividad específica del sistema, obteniéndose así las curvas de valoración potenciométrica y conductimétrica del sistema de estaño, curvas que se utilizaron para obtener información del valor más adecuado de pH al que se debería llevar el sistema. La suspensión obtenida se dejó envejecer durante quince días, y al gel obtenido se le realizó una etapa de lavado para eliminar impurezas o especies químicas, por ejemplo los aniones que acompañaban al Sn en el precursor; el lavado del sistema se realizó cuatro veces utilizando para ello una solución acuosa con dietilamina, en una concentración 0.05M. El sólido húmedo se secó en una estufa a 70°C, durante 48 horas, y luego se maceró en un mortero de ágata; el polvo obtenido se caracterizó mediante difracción de rayos X (DRX), equipo Philips PW1710 y espectroscopia infrarroja con transformada de Fourier (FTIR), equipo Termo Nicolet IR200.
3. RESULTADOS Y DISCUSIONES
3.1 Curvas de valoración
3.1.1 Valoración potenciométrica
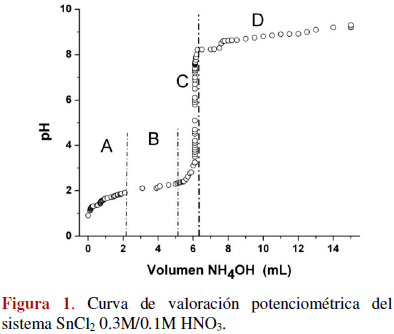
En la figura 1 se muestra la curva de valoración potenciométrica que se obtuvo para una solución 0.3M de cloruro de estaño, con 0.1M de HNO3, al adicionarle NH4OH de manera controlada. Considerando el cambio de pendiente de la curva, son evidentes 4 regiones.
La zona A representa, principalmente, las reacciones de neutralización de las especies ácidas y las de hidrólisis de los complejos de estaño. Por otro lado, como el NH4OH es una base débil, puede favorecer la precipitación de cloruros básicos de estaño a través de reacciones del siguiente tipo [1,12]:
SnCl2 + nNH4OH « Sn(OH)n Cl2-n + nNH4Cl (1)
En la zona B de la curva no se observan cambios apreciables del pH lo que indica un alto consumo del OH- suministrado por el hidróxido de amonio. En esta zona debe propiciarse, principalmente, la formación de especies poli-nucleares del tipo [Sn2(OH)2]2+, [Sn3(OH)4]2+ y [(OH)2SnO(OH)2]2-, como resultado del desarrollo de las reacciones de condensación de las especies de estaño hidrolizadas [1,12].
Las especies poli-nucleares, que se forman principalmente en la región B de la curva, interactúan para dar origen a los embriones y núcleos de la fase sólida [13]. Es de esperar, según la literatura [14], que a un valor de pH 2 precipite el SnO pero como existen otras especies en el sistema el óxido debe formarse a un pH mayor; la casiterita, SnO2, se produciría a través de la siguiente:
SnO + H2O ® SnO2 + H2 (2)
En la zona C ocurre un incremento abrupto del pH indicando la formación de complejos polinucleares, compuestos de estaño que conforman los núcleos de fase sólida disminuye notablemente.
En la zona D se presenta la saturación del sistema. Los fenómenos más importantes que ocurren en esta zona son: redisolución de la fase sólida, formación de complejos a través de reacciones del siguiente tipo [12]:
Sn(OH)nCl2-n + nNH4Cl + xNH4OH « SnCl2.(n+x)NH3 + (n+x)H2O (3)
y la conformación de aglomerados de nanopartículas.
3.1.2 Valoración conductimétrica
En la figura 2 se observa la gráfica de la variación de la conductividad específica en función del volumen de NH4OH adicionado al sistema 0.3M de SnCl2. En ella se distinguen cuatro regiones. La región 1, relacionada con la zona A de la curva potenciométrica (figura 1) y que correspondería a la neutralización del sistema.
Considerando la forma que presenta la región 2 de la curva, ésta representaría la valoración de grupos superficiales de naturaleza ácido débil con una base débil. Ya que los compuestos intermedios de estaño, y por lo tanto los núcleos de la fase sólida, se formarían en esta región (zona B de la curva de valoración potenciométrica), el número de iones en disolución se incrementaría ocasionando un aumento de la conductividad. La región 3, relacionada con la zona C de la curva potenciométrica, debe contener información sobre el proceso de nucleación, formación y crecimiento de los núcleos, y disminución de las reacciones de policondensación. La región 4 estaría relacionada con la zona D de la curva de la figura 1 y representaría la valoración del exceso de la base adicionada (zona de saturación). De las curvas 1 y 2 se define el pH de trabajo más adecuado, que debería encontrarse en la zona C de la figura 1, o en la región 3 de la figura 2; se decidió tomar el valor de pH correspondiente a un volumen de 6.5 mL adicionado al sistema, o sea un valor de pH 4.2.
3.2 Estudio del efecto de envejecimiento de la suspensión de estaño
Para realizar este estudio se utilizó la suspensión conformada a un valor de pH 4.2. Los espectros IR correspondientes a muestras sólidas del precursor, SnCl2.H2O, y las obtenidas de la suspensión después de adicionar hidróxido de amonio, y alcanzar el valor de pH de trabajo (pH 4.2), y de la suspensión envejecida quince días, se muestran en la figura 3.
Las bandas que predominan en las diferentes muestras, durante las diferentes etapas del proceso de síntesis, son las que corresponden al enlace Sn-OH (430-450 cm-1) y las asociadas a las vibraciones de tracción de los grupos hidroxilo así como del agua adsorbida (3190 y 1630 cm-1) [15]. Además, se observan bandas correspondientes al NH4+ (1458 cm-1), del NH4Cl, a algunos estannitos o estannatos formados, así como al ión nitrato NO3- (1380 cm-1), que puede existir en la red [15]. Las bandas por debajo de los 900 cm-1 son asociadas a grupos funcionales que contienen estaño: Sn-O, O-Sn-O y Sn-OH, principalmente, y que existen en las sales hidratadas formadas; estas bandas corresponden a enlaces que forma el estaño con otras especies y es por lo tanto la zona que da más información sobre la naturaleza de los complejos de estaño que existen en el sistema [12, 15, 16].
Para tener una información más precisa sobre la evolución de los grupos funcionales asociados a los complejos de estaño durante el envejecimiento del sistema, se realizó la deconvolución del espectro IR para dos zonas del mismo: zona 1, entre 400 y 800 cm-1, y zona 2, entre 3000 a 3650 cm-1, donde se ubican las bandas más representativas de estos complejos. La figura 4 ilustra la evolución de las bandas fundamentales en la zona 1, bandas atribuidas a los grupos funcionales que contienen estaño [11]; correspondientes a las muestras del primer día de preparación y al último día de envejecimiento. Estas porciones de espectro, y su deconvolución, son diferentes y hacen más evidente la presencia del grupo funcional Sn-O [12]: banda 541 cm-1 , n(Sn-O, terminal), y la banda ubicada a 658 cm-1 que se pueden asociar a la vibración fundamental n(Sn-O).
En la figura 4(b) aun está presente la banda a 541 cm-1 y la banda a 658cm-1 es intensa, la cual se asocia a la vibración fundamental n(Sn-O). Otro resultado interesante es que para la muestra envejecida, la vibración planar del oxígeno ~600 cm-1 presenta una intensidad importante.
La figura 5 ilustra la evolución de las bandas deconvolucionadas en la zona 2, bandas atribuidas a los grupos funcionales que contienen OH, entre ellos los de estaño y agua [11]. Observando la evolución de estas se puede obtener información sobre los complejos de Sn-OH que existen en las muestras para los diferentes pH estudiados. Las bandas entre 2500 a 3650 cm-1 se asocian a los enlaces Sn-OH y H-O [11,12], tal que al primero se pueden asociar las bandas entre 2915-3117 cm-1 nOH(Sn-OH, puente), para la muestra sin envejecimiento, y entre 2970-3119 cm-1, para la muestra envejecida durante 15 días. Al segundo grupo funcional se le puede asociar a la banda ubicada a 3422 cm-1 n(OH O, puente), para la muestra sin envejecimiento, y a 3405 cm-1 para la muestra envejecida. Los resultados muestran que con el envejecimiento se fortalece el enlace Sn-OH, bandas entre 2915-3119 cm-1 nOH(Sn-OH, puente), y la presencia de hidroxilos superficiales en el sistema, bandas entre 3405-3541 cm-1.
En la figura 6(a) se muestra el difractograma correspondiente al sólido del sistema obtenido a pH 4.2, sin envejecer, donde se indican las principales fases cristalinas presentes en la muestra.
Observando el difractograma de rayos X de la figura 6 se evidencia la presencia de las dos fases del óxido de estaño, romarchita (SnO) y casiterita (SnO2). Adicionalmente están presentes los compuestos de cloruro de estaño con amonio, hidratado, y la hidroromarchita. Estos resultados confirman las reacciones químicas propuestas en las ecuaciones 4 a 6 de este artículo, parte importante del mecanismo que permite la formación de partículas de óxido de estaño.
3.3 Efecto del lavado y del tratamiento térmico
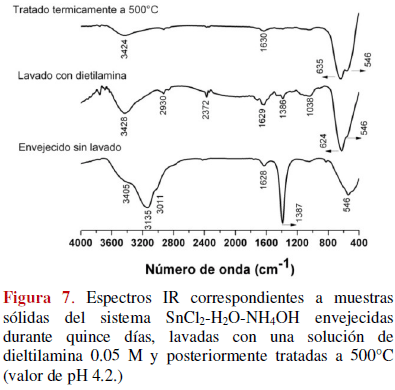
Con el fin de obtener el óxido de estaño, los polvos cerámicos envejecidos en su líquido madre fueron sometidos a lavado y tratamiento térmico. En la figura 7 se observan los espectros IR correspondientes a una muestra sólida del sistema SnCl2-H2O-NH4OH, pH 4.2, lavada cuatro veces con una solución 0.05 M de dietilamina y tratada térmicamente a 500 °C. En los espectros se pueden observar bandas a 624, 635 y 546 cm-1 , correspondientes al óxido de estaño [18], muy bien definidas y que evidencian la cristalización del SnO2. Además, se observa que al lavar la muestra la banda ubicada a ~1390cm-1 desaparece. Esta banda puede asociarse a la presencia de nitratos, provenientes del HNO3 que se utilizó para aumentar la disociación del precursor de estaño, y de compuestos de cloruro, por ejemplo cloruro de amonio, presentes en la muestra, tal como lo indican los resultados de espectroscopia IR, figura 3, y DRX, figura 6. Esto evidencia que el lavado del sólido con la solución de dietilamina 0.05M fue muy efectivo para eliminar impurezas del sistema (Figura 7). Por otro lado, considerando que en la muestra tratada a 500ºC debe existir SnO2 como fase cristalina mayoritaria [15,17], si se comparan los espectros IR correspondientes a la muestra solida lavada y la tratada térmicamente (figura 7), se puede concluir que en la primera debe existir SnO2 en buena cantidad.
También se analizó la evolución de los grupos funcionales asociados a los complejos de estaño, durante el lavado y tratamiento térmico, realizando la deconvolución de las regiones de los espectros IR de la figura 7, entre 400 a 800 cm-1 y entre 3000 a 3650 cm-1. La figura 8 ilustra la deconvolución de las bandas de la zona 1, que se atribuyen a los grupos funcionales que contienen estaño [11]. En los espectros deconvolucionados (figura 8) se observa la presencia, principalmente del grupo funcional Sn-O [12]: bandas a 555 y 573 cm-1 asociadas a la vibración fundamental n(Sn-O, terminal), y a 624 y 656 cm-1 correspondientes al modo n(Sn-O), mientras que la ubicada a 667 cm-1 se asocia a la vibración fundamental n(O-Sn-O).
Observando los resultados de la figura 8 se puede concluir que utilizando la espectroscopia IR es posible determinar el grado de cristalización de la muestra. Como se mencionó anteriormente, observando los espectros de la figura 6 se puede considerar la presencia de SnO2 en la muestra lavada pero, observando la figura 8, es evidente diferencias entre los enlaces O-Sn-O y Sn-O (desplazamiento de la ubicación de las bandas) que existen en las dos muestras; es de esperar que la muestra tratada a 500ºC contenga SnO2 mas cristalizado y por lo tanto más estable térmicamente.
En la figura 9 se muestra la deconvolución de la banda espectral de la zona 2 correspondiente a muestras solidas envejecida y lavada (figura 9(a)), y posteriormente tratada a 500ºC (figura 9(b)). Estos espectros no se observan grandes diferencias, son muy similares.
En la figura 6(b) se muestra el difractograma correspondiente al sólido lavado cuatro veces con dietilamina y luego tratado térmicamente a 500°C. Este difractograma indica que la fase cristalina más importante es la casiterita, SnO2, resultado coherente con los obtenidos con espectroscopia IR, figura 7, donde las bandas más intensas correspondían a los enlaces O-Sn-O y Sn-O. El desplazamiento de las bandas, así como la variación en su intensidad que se observa en los diferentes espectros IR, figuras 3-5 y 7-9, se pueden atribuir a la variación tanto en el tamaño como en la morfología de la partícula, tal como ocurre en otros sistemas [18].
4. CONCLUSIONES
El Método de precipitación controlada usado en este proyecto permitió sintetizar polvos cerámicos de óxido de estaño, fase casiterita. Utilizando espectroscopia IR se determinó la evolución de los grupos funcionales durante las diferentes etapas del proceso. La deconvolución de las bandas espectrales en ciertas regiones donde prevalecen las que estarían asociadas a los enlaces del Estaño, permitió determinar el desplazamiento de las bandas fundamentales de los enlaces Sn-O y O-Sn-O, así como el aumento y disminución de su intensidad, comportamiento que indican el fortalecimiento o debilitamiento de los mismos. Los resultados muestran que los enlaces Sn-O y O-Sn-O se van fortaleciendo con el envejecimiento del sistema y el tratamiento térmico al que fue sometido el sólido precipitado. Los resultados de DRX confirman lo anterior. Esta información es importante para establecer el mecanismo que permitiría explicar la formación de las partículas.
5. AGRADECIMENTOS
A la VRI de la Universidad del Cauca por la financiación del proyecto ID 2731 y su apoyo logístico. Y. Ochoa agradece a COLCIENCIAS la beca de Joven Investigador que le otorgó y que le ha permitido su participación activa en este proyecto.
6. REFERENCIAS
1. Serrini P., Briois V. "Chemical composition and crystalline structure of SnO2 thin films used as gas sensor". Thin Solid Films., 1997; 304 (1-2): 13-122. [ Links ]
2. Ararat C., Rodríguez-Páez J.E., Vargas L., Ramirez A., Urresta J.D. "SnO2 como catalizador y soporte de Ni y Sn en la alcoholisis del aceite de palma". Dyna. 2011; 165: 176-182. [ Links ]
3. Montenegro A., Rodríguez-Páez J.E. "Uso de Métodos Químicos para la Obtención de Sensores de Gas del Sistema Sn-Sb". Dyna. 2007; 151: 97-105. [ Links ]
4. Marques V. Influência do Óxido de Cromo nas Propiedades Varistoras do Óxido de Estanho. Tesis M.Sc., Universidade Estadual Paulista, Araraquara (Brasil), 2003. [ Links ]
5. Yang F., Stephen R.F. "Organic Solar Cells Using Transparent SnO2-F Anodes". Adv. Mater. 2006; 18: 2018-2022. [ Links ]
6. Deok-Woo H. "Texture, Morphology and Photovoltaic Characteristics of Nanoporous F: SnO2 Films". Journal of Electrical Engineering & Technology., 2009; 4(1): 93-97. [ Links ]
7. Manea E., Budianu E., Purica M., Podaru C., Popescu A., Ernica I. "SnO2 Thin Films Prepared by Sol Gel Method for "Honeycomb" Textured Silicon Solar Cells". Romanian Journal of Information Science and Technology, 2007; 10: 25-33. [ Links ]
8. Vadivel K., Arivazhagan V., Rajesh S. "Mn Doped SnO2 Semiconducting Magnetic Thin Films Prepared by Spray Pyrolysis Method". International Journal of Scientific & Engineering Research, 2011; 2(4): 1-5. [ Links ]
9. Lee S. "Synthesis and characterization of SnO2: Sb film by dc magnetron sputtering method for applications to transparent electrodes". Physica Scripta, 2007; 312. [ Links ]
10. Batista P. D., Mulato M., Graeff C. F. de O. "SnO2 Extended Gate Field-Effect Transistor as pH Sensor". Brazilian Journal of Physics, 2006; 36 (2A): 478-481. [ Links ]
11. Ararat C. E., Montenegro A., Rodríguez-Páez J.E. "Efecto de la Naturaleza del Precursor sobre las Características de las Nanopartículas de SnO2 Sintetizadas". Quim. Nova. 2007; 30(7): 1578-1583. [ Links ]
12. Amalric-Popescu D., Bozon-Verduraz F. "Infrared studies on SnO2 and Pd/SnO2". Catalysis Today, 2010; 70: 139-154. [ Links ]
13. Huamán F., Reyes L. "Detección de vapor de etanol por modificación de la conductividad eléctrica del dióxido de estaño". TECNIA. 1998; 8: 77-83. [ Links ]
14. Ponce M., Preparación y evaluación de sensores de gases de SnO2, Tesis de Doctorado en Ciencia de Materiales, Universidad Nacional de Mar del plata, Mar del Plata (Argentina), 2005. [ Links ]
15. Ararat C., Mosquera A., Parra R., Castro M.S., Rodríguez-Páez J.E. "Synthesis of SnO2 nanoparticles through the controlled precipitation route". Materials Chemistry and Physics, 2007;101: 433-440. [ Links ]
16. Ortiz A., Mendoza M., Rodríguez-Páez J.E. "Naturaleza y Formación de los Complejos Intermedios del Sistema SnCl2 -NH4OH -H2O". Materials Research, 2001; 4 (4): 265-272. [ Links ]
17. Ávila H.A., Rodríguez-Páez J.E. "Solvent effects in the synthesis process of tin oxide". Journal of Non-Crystalline Solids, 2009; 355: 885-890. [ Links ]
18. Farmer V.C. The Infrared Spectra of Minerals. Mineralogical Society: London, 1974; 10: 185-186. [ Links ]