Investigación Clínica
versión impresa ISSN 0535-5133
Invest. clín v.46 n.4 Maracaibo dic. 2005
Ciertos aspectos inmunológicos en los estados reaccionales en la enfermedad de Hansen. Revisión.
Elsa Rada, Nacarid Aranzazu y Jacinto Convit.
Laboratorio de Leprología y Patología Experimental, Instituto de Biomedicina, Facultad de Medicina, Universidad Central de Venezuela. Caracas 1010A, Venezuela, Apartado 4043. Correo eletrónico: erada@telcel.net.ve.
Resumen. El problema clínico crucial en la lepra son los episodios de inflamación aguda que conllevan a daño de los nervios. Aun cuando el Mycobacterium leprae ha sido eliminado mediante el uso de antibióticos, la muerte de la bacteria no es una solución completa al daño ocasionado en los nervios. Dos de los fenómenos inmunopatológicos más frecuentes son: Reacciones tipo I conocidas como reacciones de reversión (RR) y las Reacciones tipo II, como eritema nodoso leproso (ENL). Estas reacciones tipo II se han definido como: una complicación inmunológica en los pacientes multibacilares. Ambos tipos de reacciones están acompañadas por el incremento de citocinas pro-inflamatorias principalmente TNF-a, IL-1, IL-2, IL-4, IL-6, IL-8, INF-g, IL-10, IL-12, entre otras. En un análisis retrospectivo realizado en una población de 150 pacientes del Servicio Central de Dermatología del Instituto de Biomedicina sometidos a terapia multidroga (PQT) y PQT + inmunoterapia, ambos grupos presentaron fenómenos reaccionales tipo II, sólo el grupo que adicionalmente recibió inmunoterapia presentó además reacciones del tipo I. El grupo de pacientes que presentaron ENL estuvo asociado con presencia de gran cantidad de bacilos en las lesiones.
Palabras clave: Enfermedad de Hansen, episodios reaccionales, ENL, inmunopatología.
Some immunological aspects in the reaccional states of Hansen disease.
Abstract. The crucial clinical problem in leprosy is represented by episodes of intense inflammation that produce nerve damage. When Mycobacterium leprae has been eliminated by means of antibiotics, the death of the bacteria is not a complete solution to the damage caused in nerves. Two of the more frequent immunopathological phenomena in Hansen’s disease are Type I, reactions, known as Reversal Reactions (RR), and Type II reactions, of which the most frequent and well known are those called Erythema Nodosum Leprosum (ENL). Type II reactions have been defined as an immunologic complication in multibacillary patients. Both types of reactions are accompanied mainly by the increase of pro-inflammatory cytokines TNF-a, IL-1, IL-2, IL-4, IL-6, IL-8, INF-g, IL-10, IL-12, among others. In a retrospective analysis of a population of 150 patients of the Central Service of Dermatology, Institute of Biomedicine, where these patients were subjected to Multidrug Therapy (MDT) and MDT + inmunotherapy (IMT), both groups presented type II reactions, but the group that additionally received inmunotherapy also presented type I reactions. In the group of patients that presented ENL, it appeared to be associated with the large amount of bacilli in their lesions.
Key words: Hansen disease, reactions episodes, ENL, immunopathology.
Recibido: 22-10-2004. Aceptado: 06-05-2005
INTRODUCCIÓN
La lepra o Hanseniosis es una enfermedad granulomatosa crónica causada por una micobacteria intracelular, el Mycobacterium leprae que reside y se multiplica principalmente dentro de los macrófagos tisulares y células de Schwann en nervios periféricos.
Las manifestaciones clínicas e histopatológicas tan variables en la lepra, indudablemente reflejan la naturaleza inmunológica del individuo frente al Mycobacterium leprae.
ESTADOS REACCIONALES EN HANSEN
La progresión de la enfermedad es lenta e indolente, pero en algunos casos hay cambios en el estado inmunológico desarrollando los estados reaccionales. Los estados reaccionales se presentan cómo desviaciones de los polos estables del espectro de la enfermedad de Hansen, resultando un cambio en la respuesta de la inmunidad mediada por células y una inapropiada inducción de la inmunidad humoral. Dos de los fenómenos inmunopatológicos más frecuentes son: Reacciones tipo I, conocidas como reacciones de reversión (RR) y las Reacciones tipo II, como eritema nodoso leproso (ENL). Sus características inmunológicas e histopatológicas de ambas reacciones se muestran en la Tabla I. Las reacciones de reversión son frecuentemente observada en los estadíos temprano de la terapia antileprosa pero también en otros estadíos (1) se presentan como una mejoría en la inmunidad del hospedero frente a la infección, hay un aumento de la actividad bactericida y una reducción de la carga bacterial. Este tipo de reacción sucede en pacientes borderline: borderline lepromatoso (BL) y borderline borderline (BB), y ocasionalmente, en borderline tuberculoide (BT) donde desarrollan nuevas lesiones debido al reconocimiento inmunológico de los focos ocultos de M. leprae; así los pacientes BL pueden cambiar a BB e inclusive a BT (2) En ENL hay una mejoría transitoria en la inmunidad mediada por células en pacientes lepromatosos (BL y lepra lepromatosa, LL). Su ubicación en el espectro de la enfermedad la podemos observar en la Fig. 1, Las reacciones tipo II se han definido como: una complicación inmunológica en los pacientes multibacilares. Se presentan cómo nódulos eritematosos subcutáneos dolorosos que pueden ulcerar. También puede haber señales de compromiso sistémico como fiebre, inflamación de los linfonódulos, poliartralgia, paniculitis, neuritis, ginecomastia por atrofia testicular y problemas oculares como iritis, iridociclitis, uveitis, lagofstalmo entre otras (3).
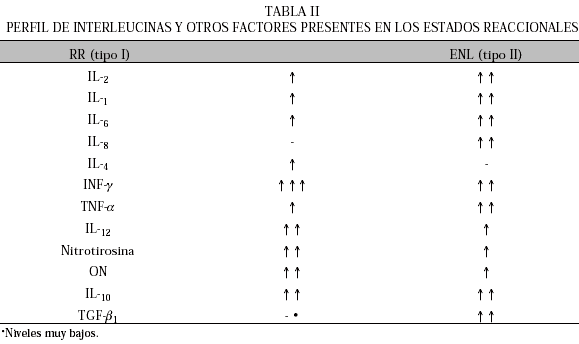
Ambos tipos de reacciones están acompañadas por el incremento de citocinas pro-inflamatorias principalmente TNF-a, IL-1 (4), IL-2, IL-8, IL-4, INF-g, IL-12, IL-10, entre otras como se muestra en la Tabla II (5-9). El daño al nervio causado por estos episodios es el principal problema clínico en la lepra, siendo considerado un desorden inmunológico y una de las causas más importantes de morbilidad y de incapacidad física (10).
DISCUSIÓN
El eritema nodoso leproso (ENL) es el fenómeno reaccional más frecuente en la enfermedad de Hansen. En un estudio donde se examinaron las proteínas de fase aguda, los niveles de lípidos, los niveles de sustancia amieloide A y de proteína C reactiva como elementos medidos en un proceso inflamatorio agudo, las proteínas de fase aguda y la proteína C estuvieron elevadas con respecto a los individuos controles, sin embargo, no hubo diferencias estadísticamente significativas con relación a las encontradas en los pacientes lepromatosos sin reacción (11).
Con relación a la inmunidad celular (IMC) ciertos investigadores han reportado la presencia de una inmunoreactividad transitoria. Pruebas de transformación linfocitaria dan índices de estimulación en pacientes con episodios reaccionales en el rango de lo encontrado en pacientes tuberculoides (TT) y borderline tuberculoide (BT) (12).
En cuanto al perfil de citocinas, podemos decir que ellas pueden modificar el tipo de respuesta inmune frente a antígenos micobacterianos (13, 14). El paradigma Th1/Th2 es utilizado para explicar la resistencia frente a patógenos intracelulares. En base a los patrones de producción de citocinas, los linfocitos T activados han sido dividido en dos tipos: Linfocitos T tipo 1 (Th1) producen INF-g, IL-2 pero no IL-4. Los linfocitos T tipo 2 (Th2) producen IL-4, IL-5 y IL-13 pero no INF-g, las células tipo 0 (Th0) no están polarizadas y secretan ambas citocinas Th1 y Th2. Estudios previos realizados en las formas estable de la enfermedad específicamente en lepra lepromatosa mostraron una mezcla de patrones de citocinas 40% Th2 (IL-4+, INFg–), 50% Tho (IL-4+, INFg+) y el resto no mostró ninguna de estas citocinas. Es importante señalar que células accesorias (macrófagos, células dendríticas) pueden alterar el perfil de citocinas en cultivos reconstituidos sugiriendo la importancia en la diferenciación de sub-poblaciones de linfocitos T cooperadores (15).
Existen controversias con respecto a la citosina TGF-b1, algunos autores indican su presencia en la forma lepromatosa (16-18) mientras que otros reportan su ausencia (19, 20). Gran cantidad de antígeno micobacteriano estimula la expresión de altos niveles de TGF-b y como consecuencia hay una supresión de la activación de los macrófagos. El balance entre TGF-b y citocinas pro-inflamatorias cómo TNF-a podría orientar sobre el estado clínico del paciente. Altos niveles de TNF-a en asociación con niveles bajos de TGF-b promovería a un elevado riesgo de presentar un episodio reaccional. Un aumento en la citocina TGF-b induce a la fibrosis tardía afectando a los nervios periféricos. Además, el TGF-b regula la producción de IL-1, IL-6 y TNF-a estando estas citocinas en mayor proporción en los pacientes con estado reaccional tipo II (ENL) (17).
TRATAMIENTO
El tratamiento de los episodios reaccionales constituye una de las principales prioridades en el manejo de los pacientes con enfermedad de Hansen para prevenir incapacidades. Este tratamiento debe ser individualizado con las drogas antiinflamatorias no esteroideas (AINES) para el caso de cuadros leves y esteroideas para los procesos neuríticos. La prednisona es suministrada inicialmente a razón de 1 a 1,5 mg por kg de peso por día, descendiendo la dosis gradualmente hasta lograr una dosis de mantenimiento de 0,15 mg diarios de 1 a 3 meses hasta yugular el cuadro reaccional presente. Es muy importante la disminución lenta para evitar cuadros de rebote. La talidomida es la droga de elección en las reacciones de tipo II, la cual es mucho más potente que otras drogas inmunosupresoras, pero requiere de un control para su uso y no es permitida en muchas partes del mundo. La talidomida (a-N-pthalimido glutarimida) derivado del ácido glutámico, una droga que reemergió recientemente, desde 1998 la US FDA la consideró como tratamiento alternativo en las manifestaciones cutáneas, entre ellas para el tratamiento de ENL. La talidomida se presenta en tabletas de 100 mg. En casos severos se puede comenzar utilizando dosis de 400 mg diarios hasta que los signos y síntomas hayan disminuidos. Se prefiere dar dosis día y noche en pacientes hospitalizados y en horas nocturnas en pacientes con actividad laboral. La dosis habitual es de 300 mg diarios con disminución cada tres días si la evolución es satisfactoria, la dosis de mantenimiento de 100-50 mg diarios, hasta administrar una dosis interdiaria durante 3 a 6 meses. Su acción es antiinflamatoria provoca una alteración de la síntesis y liberación de citocinas como TNF-a, IL-1, IL-2, IL-4, IL-6, IL-8, IL-10, IL-12 y INF-g. Las células blanco de la talidomida son los leucocitos, células endoteliales y keratinocitos, produciendo diferentes alteraciones a cada uno de ellos, por ejemplo cambios en la densidad de las moléculas de adhesión, con alteración en la extravasación celular y por consiguiente en la respuesta inflamatoria de los tejidos involucrados. También inhibe la Inmunoglobulina M de novo (21, 22). Una alternativa a la falta de tolerancia al tratamiento con esteroides es el uso de Pentoxifilina PTX (metilxantina) recomendada por la disminución de citocinas pro inflamatorias en el torrente sanguíneo y sus beneficios son a corto plazo (7-15 días). PTX es considerado un importante inhibidor de IFN-g, TNF-a, IL-6, IL-12 y moléculas de adhesión (23-26). A pesar del efecto inmunosupresor de estas drogas, la modificación del infiltrado leucocitario ha permitido hacer estudios secuenciales de patrones de ARNm de citocinas donde evidencian que hay una fuerte correlación entre el infiltrado celular y la persistencia de inflamación y expresión de ARNm de citocinas (27). En el Instituto de Biomedicina se realizó un estudio con 15 pacientes utilizando PTX, con resultados no favorables.
La mejor combinación disponible para el control de la lepra en sus diferentes manifestaciones es la poliquimioterapia donde se utilizan tres drogas (Sulfonas, Clofazimina y Rifampicina) según esquema recomendado por la Organización Mundial de la Salud (OMS). En nuestro programa de lepra en Venezuela desde 1982, se estableció 2 años para los casos multibacilares y 6 meses para los paucibacilares. Recientemente, la OMS en su 7 reunión del Comité de Expertos de la Lepra, aceptó como eficaz el tratamiento durante 12 meses para la lepra multibacilar (MB) (28). En los pacientes lepromatosos que presentan reacciones del tipo ENL, resulta de interés hacer un buen seguimiento durante su tratamiento e inclusive después de finalizar la poliquimioterapia.
Es de importancia tener un breve resumen de las características de la inmunopatología de ENL, uno de los episodios más frecuente en la enfermedad:
- Estímulo no específico.
- Activación policlonal de linfocitos B.
- Presencia de antígenos en los tejidos. Desintegración de M. leprae y liberación de material antigénico debido a la utilización de drogas antileprosas. Otros factores cómo infecciones interrecurrentes, stress, vacunación, embarazo entre otros pueden precipitar el episodio reaccional (29).
- Formación de complejos inmune. Aunque esto no es una causal para lesiones ENL porque ocurre en la misma frecuencia en pacientes LL con o sin ENL (30, 31).
- Activación de complemento. Presencia de elevados niveles de C3 producto de la lisis de C3d.
- Quimiotaxis de granulocitos y finalmente.
- Destrucción de tejidos (32).
El ENL ocurre antes y después de la instauración de una quimioterapia e inclusive hasta mucho después de haber terminado el tratamiento antibacteriano. Se hace necesario establecer diferencias con recaídas (33).
En cuanto al número de casos que puedan presentar estos episodios a nivel mundial es variable, tenemos porcentajes promedio de pacientes, casos MB, que oscilan entre 31-50% en Brasil, Nepal 19%, Tailandia 12% y Etiopía 5% donde en todos los casos presentan manifestaciones sistémicas de fiebre, nódulos dermales eritematoso y artritis (34, 35). Aquí en nuestro país es importante establecer diferencias en cuanto a frecuencia de aparición de este tipo de reacción inmunológica. Nosotros hicimos un análisis retrospectivo en una población de 150 pacientes del Servicio Central de Dermatología, Instituto de Biomedicina. Estos pacientes fueron sometidos a terapia multidroga (PQT) y PQT + inmunoterapia (IMT), Rada y col. (36). Del primer grupo 68,66% presentaron reacciones y del segundo grupo el 72,92% presentaron reacciones. Ambos grupos presentaron fenómenos reaccionales tipo II sólo el grupo que adicionalmente recibió inmunoterapia presentó adicionalmente reacciones del tipo I. El grupo de pacientes que presentaron ENL estuvo asociado con presencia de gran cantidad de bacilos en las lesiones. De los pacientes que presentaron reacción la primera vez, la probabilidad de presentar un nuevo fenómeno fue de 0.67 es decir que existe alta probabilidad de repetición de fenómenos reaccionales en los pacientes que presentan un primer episodio. El 70.5% de los pacientes de sexo masculino y 71.9% del sexo femenino presentaron fenómenos reaccionales (p = 0.86). Con lo expuesto anteriormente podemos decir que los fenómenos reaccionales se presentan independientemente del tratamiento aplicado. No hay diferencia por género en la posibilidad de presentar un fenómeno reaccional y los fenómenos reaccionales de tipo II son los más frecuentemente observados en nuestros pacientes (37).
Los estados reaccionales en lepra, evaluados por el perfil de citocinas comparten una respuesta de IMC bastante similar. La relación entre bacteria viva o muerta, la selección por células presentadoras a diferentes antígenos y la estimulación de diferentes sub-poblaciones contribuyen a determinar el tipo de inflamación.
REFERENCIAS
1. Saunderson P, Gebre S, Byass P. Reversal reactions in the skin lesions of AMFES patients: incidence and risk factors. Lepr Rev 2000; 71:318-324. [ Links ]
2. Rose P, Waters MFR. Reversal reactions in leprosy and their management. Lepr. Rev 1991; 62:113-121. [ Links ]
3. Aranzazu N. Enfermedad de Hansen, Etiología, Clínica y Clasificación. Derm Venz 1994; 32:145- 151. [ Links ]
4. Khanolkar-Young S, Rayment N, Brickell PM, Katz DR, Vinayakumar S, Colston MJ, Lockwood DNJ. Tumor necrosis factor-alpha (TNF-a) synthesis is associated with the skin and peripheral nerve pathology of leprosy reversal reactions. Clin Exp Immunol. 1995; 99:196-202. [ Links ]
5. Sarno EN, Grau GE, Viera LMM, Nery JAC. Serum levels of tumor necrosis factor-alpha and interleukin-1b during leprosy reactional states. Clin Exp Immunol 1991; 84:103-108. [ Links ]
6. Sarno EN, Sampaio EP. The role of inflammatory cytokines in the tissue injury of leprosy. Int J Lepr 1996; 64:S69-73. [ Links ]
7. Sreenivasan P, Misra RS, Wilfred D, Nath I. Lepromatous leprosy patients show T helper 1-like profile with differential expression of interleukin-10 during type 1 and 2 reactions. Immunol 1998; 76:357-362. [ Links ]
8. Moraes MO, Sarno EN, Almeida AS, Saraiva BC, Nery JA, Martins RC, Sampaio EP. Cytokine mRNA expression in leprosy reaction: a possible role for INF-g and IL-12 in reactions (RR and ENL). Scand J Immunol 1999; 50:541-549. [ Links ]
9. Teles RM, Moraes MO, Geraldo NT, Salles AM, Sarno EN, Sampaio EP. Differential TNFalpha mRNA regulation detected in the epidermis of leprosy patients. Arch Dermatol Res 2002; 294:355-362. [ Links ]
10. Reyes O. La reacción leprosa. Una revisión. Derm Venez 2000; 38: 53-63. [ Links ]
11. Memon RA, Hussain R, Raynes JG, Lateff A, Chiang TJ. Alterations in serum lipids in lepromatous leprosy patients with and without ENL reactions and their relationship to acute phase proteins. Int J Lepr 1995; 64:115-122. [ Links ]
12. Rea TH, Sieling PA. Delayed-type hypersensitivity reactions followed by erythema nodosum leprosum. Int J Lepr 1998; 66: 316-327. [ Links ]
13. Modlin RLJ. Th1-Th2 Paradigm: Insights from leprosy. J Invest Dermatol 1994; 102: 828-832. [ Links ]
14. Salgame P, Bloom BR. Immunoregulation and cytokine patterns in leprosy in: Mustafa AL, Al-Attiyah RJ, Nath I, Chugh TD. Eds. T-cell subsets and cytokines interplay in infectious diseases. Basel, Karger., 1996. p. 181. [ Links ]
15. Nath I, Vemuri N, Reddi AL, Jain S, Brooks P, Colston MJ, Misra RS, Ramesh V. The effect of antigen presenting cells on the cytokine profiles of stable and reactional lepromatous leprosy patients. Immunol Lett 2000; 75:69-76. [ Links ]
16. Goulart IMB, Figueiredo F, Coimbra T, Foss NT. Detection of transforming growth factor-beta 1 in dermal lesions of different clinical forms of leprosy. Am J Pathol 1996; 148:911-917. [ Links ]
17. Goulart IMB, Mineo JR, Foss NT. Production of transforming growth factor-beta 1 (TGF-b1) by blood monocytes from patients with different clinical forms of leprosy. Clin Exp Immunol 2000; 122:330-334. [ Links ]
18. Kiszewski CA, Becerril E, Baquera J, Aguilar LD, Hernández-Pando R. Expression of transforming growth factor-beta isoforms and their receptors in lepromatous and tuberculoid leprosy. Scand J Immunol 2003; 57:279-285. [ Links ]
19. Yamamura M, Uyemura K, Deans RJ, Weinberg K, Rea TH, Bloom BR, Modlin RL. Defining protective responses to pathogens: cytokine profiles in leprosy lesions. Science 1991; 254:277-279. [ Links ]
20. Yamamura M, Wang X-H, Ohmen JD, Uyemura TH, Bloom BR, Modlin RL. Cytokine patterns of immunologically mediated tissue damage. J Immunol 1992; 149:1470-1475. [ Links ]
21. Meierhofer C, Dunzendorfer S, Wiedermann CJ. Theoretical basis for the activity of thalidomide. Biodrugs 2001; 15:681- 703. [ Links ]
22. Perri AJ, Hsu SA. Review of thalidomide´s history and current dermatological applications. Dermatol Online J 2003; 9:5-7. [ Links ]
23. Sarno EN, Nery JAC, Sampaio EP. Is pentoxifylline a viable alternative in the treatment of ENL? Int J Lepr 1995; 63: 570-571. [ Links ]
24. Sampaio EP, Moraes MO, Nery JAC, Santos AR, Matos HC, Sarno EN. Pentoxifylline decreases in vivo and in vitro tumour necrosis factor-alpha (TNF-alpha) production in lepromatous leprosy patients with erythema nodosum leprosum (ENL). Clin Exp Immunol 1998; 111:300-308. [ Links ]
25. Thanhauser A, Reiling N, Bohle A, Toellner KM, Duchrow M, Scheel D, Schluter C, Ernst M, Flad HD, Ulmer AJ. Pentoxifyline: a potent inhibitor of IL-2 and INF-g biosynthesis and BCG-induced cytotoxicity. Immunol 1993; 80:151-156. [ Links ]
26. Neuner P, Klosner G, Pourmojib M, Knobler R, Schwarz T. Pentoxifylline in vivo and in vitro down-regulates the expression of the intercellular adhesion molecule-1 in monocytes. Immunol 1997; 90: 435-439. [ Links ]
27. Moraes MO, Sarno EN, Teles RM, Almeida AS, Saraiva BC, Nery JA, Sampaio EP. Anti-inflammatory drugs block cytokine mRNA accumulation in the skin and improve the clinical condition of reactional leprosy patients. J Invest Dermatol 2000; 115:935-941. [ Links ]
28. World Health Organization,1998. World Health Organization Expert Committee on Leprosy. Seventh Report. WHO Technical Report series 874. [ Links ]
29. Bhargava P, Kuldeep CM, Mathur NK. Recurrent erythema nodosum leprosum precipitated by antileprosy drugs. Int J Lepr 1996; 64:458-459. [ Links ]
30. Modlin RL, Mehra V, Jordan R, Bloom BR, Rea TH. In situ and in vivo characterization of the cellular immune response in erythema nodosum leprosum. J Immunol 1986; 136:883-886. [ Links ]
31. Laal S, Bhutani LK, Nath I. Natural emergence of antigen-reactive T cells in lepromatous leprosy patients during erythema nodosum leprosum. Infect Immun 1985; 50:887-892. [ Links ]
32. Ridley MJ, Ridley DS. The immunopathology of erythema nodosum leprosum: the role of extravascular complexes. Lepr Rev 1983; 54:95-107. [ Links ]
33. Rodríguez G, Pinto R, Laverde C, Sarmiento M, Riveros A, Valderrama J, Ordonez N. Relapses after multibacillary leprosy treatment. Biomédica 2004; 24: 133-139. [ Links ]
34. Wemambu SNC, Turk JL, Waters MFR, Rees RJ. Erythema nodosum leprosum: a clinical manifestation of the Arthus phenomenon. Lancet 1969; 2:933-935. [ Links ]
35. Nery JAC, Vieira LM, De Matos HJ, Gallo ME, Sarno EN. Reactional states in multibacillary Hansen disease patients during multidrug therapy. Rev Inst Med Trop Sao Paulo 1998; 40:363-370. [ Links ]
36. Rada E, Ulrich M, Aranzazu N, Rodríguez V, Centeno M, González I, Santaella C, Rodríguez M, Convit J. A follow-up study of multibacillary Hansen´s disease patients treated with multidrug therapy (MDT) or MDT + immunotherapy (IMT). Int J Lepr 1997; 65:320-327. [ Links ]
37. Aranzazu N, Zerpa O, Rada E, Rivera T, Blanco B, Borges R, Convit J. Análisis de los estados reaccionales en pacientes con enfermedad de Hansen. Estudio retrospectivo en una población de pacientes del Servicio Central de Dermatología Instituto de Biomedicina (Resumen). Memorias de LIII Convención Anual de AsoVAC, 2003. Maracaibo, Venezuela. p 112. [ Links ]
Autor de correspondencia: Elsa Rada. Laboratorio de Leprología y Patología Experimental, Instituto de Biomedicina, Universidad Central de Venezuela, Apartado 4043. Caracas 1010A, Venezuela. Correo electrónico: erada@telcel.net.ve












 uBio
uBio