Investigación Clínica
versión impresa ISSN 0535-5133versión On-line ISSN 2477-9393
Invest. clín v.49 n.3 Maracaibo sep. 2008
Respuesta inmunitaria en tuberculosis y el papel de los antígenos de secreción de Mycobacterium tuberculosis en la protección, patología y diagnóstico. Revisión.
Zaida Araujo 1, Mariana Acosta2, Hemir Escobar2, Ricardo Baños2, Carlos Fernández de Larrea3 y Bruno Rivas-Santiago4.
1Laboratorio de Inmunología de Enfermedades Infecciosas, Instituto de Biomedicina, 2Escuela de Medicina “José María Vargas”, 3Hospital Vargas de Caracas, Facultad de Medicina, Universidad Central de Venezuela, Caracas, Venezuela y 4Unidad de Investigación Médica de Zacatecas, Instituto Mexicano del Seguro Social, Zacatecas, México.
Autor de correspondencia: Zaida Araujo. Laboratorio de Inmunología de Enfermedades Infecciosas, Instituto de Biomedicina, Apartado 4043. Caracas 1010A, Venezuela. Teléf: 58-212-860-4636/0414-248-0215, Fax: 58-212-861-1258. Correo elecetrónico: zaraujogarcia@yahoo.com
Resumen. La tuberculosis (TB) es una de las principales causas de muerte por infección con Mycobacterium tuberculosis en seres humanos en el ámbito mundial, y es preocupante que su incidencia esté aumentado en los últimos años, debido principalmente a la infección por el virus de inmunodeficiencia humano (VIH). Considerando que los métodos diagnósticos utilizados actualmente para detectar la enfermedad no son totalmente efectivos y rápidos, debido a que el cultivo no es útil como primera opción diagnóstica porque ya que requiere más de 4 semanas y el examen microscópico tiene una sensibilidad de 50 a 60% y es aún más baja en pacientes pediátricos, múltiples esfuerzos se realizan con el objetivo de caracterizar cada vez más los antígenos de M. tuberculosis asociados con protección y para desarrollar rápidos y mejores métodos de diagnóstico. Entre los antígenos secretados de M. tuberculosis y que han sido descritos como inductores de la secreción de mediadores asociados a protección contra la infección por M. tuberculosis están CPF-10, ESAT-6, 27 kDa y 38 kDa, por inducir la producción de IFN-γ, TNF-α y óxido nítrico, todos estos relacionados con una respuesta inmunitaria protectora. A través del estudio de las funciones y composición de estos antígenos, se hacen esfuerzos por encontrar métodos más efectivos en el diagnóstico de la enfermedad, en sus diversas etapas de evolución. La presente revisión tiene como finalidad describir los antígenos que han sido reportados como antígenos relevantes de M. tuberculosis por participar en la respuesta inmunitaria protectora frente a la infección y su posible utilidad en el diagnóstico.
Palabras clave: Tuberculosis (TB), antígenos de secreción, Mycobacterium tuberculosis, respuesta inmunitaria, diagnóstico.
Immunitary response in Tuberculosis and the role of Mycobacterium tuberculosis secretion antigens in its protection, pathology and diagnosis. Review.
Abstract. Tuberculosis (TB) is one of the main causes of death by M. tuberculosis infection in humans worldwide and, it is worrying that the number of cases have been increasing in recent years, largely due to HIV infection. Since the diagnostic methods for detecting the disease are not totally effective because of their lack of specificity and sensitivity, efforts are being made to characterize the M. tuberculosis antigens associated with protection and, thereby develop better diagnostic methods. Among the antigens which are secreted by M. tuberculosis –and which have been described as inducers of the secretion of mediators associated with protection– are CPF-10, ESAT-6, 27 kDa and 38 kDa, which induce the production of IFN-γ; TNF-α and nitric oxide. By means of the study of the functions and composition of these antigens, which are mainly secreted by the bacteria, efforts are being made to find more effective methods of diagnosing the disease in its different stages of evolution. The present review aims to describe the antigens which have been reported as being relevant in the case of M. tuberculosis, since they participate in the immune response to infection and therefore, may be important in terms of diagnosis.
Key words: Tuberculosis (TB), secreted antigen, Mycobacterium tuberculosis, the immune response, diagnosis.
Recibido: 26-06-2007. Aceptado: 17-01-2008.
INTRODUCCIÓN
Durante la última década, en todo el mundo ha aumentado el número de casos de tuberculosis de una manera preocupante. Estimados de la Organización Mundial de la Salud (OMS) refieren que en 2005 hubo 8,8 millones de nuevos casos de TB, de los cuales 7,4 millones en Asia, África subsahariana y que la TB causó la muerte de 1,6 millones de personas, entre las cuales 195.000 infectadas por el VIH (1,2). El letal síndrome de inmunodeficiencia adquirida (SIDA), el cual es característico por el establecimiento de infecciones oportunistas y por la aparición de un tipo agresivo de sarcoma de Kaposi fue reportado por primera vez en mayo de 1981 (3). La epidemia de SIDA ha sido responsable de la activación de TB latente y se ha asociado con emergencia de casos de TB resistente a los fármacos utilizados de rutina. Finalmente, la eficacia tan variable de la vacuna y la ausencia de un método diagnóstico rápido, sensible y específico hacen de la enfermedad un reto para los médicos responsables del tratamiento de estos pacientes, por tal razón, es de gran importancia contar con antígenos apropiados para ser usados en pruebas confiables de diagnóstico precoz (4). Otro problema emergente es la farmacorresistencia en TB, la cual se define como los casos de TB, generalmente pulmonar, que excretan bacilos resistentes a uno o más de los medicamentos antituberculosos. Si el paciente no ha recibido tratamiento previo, se le denomina resistencia primaria (5). En los pacientes con historia de tratamiento anterior, de más de un mes de duración, la resistencia bacteriana se denomina resistencia adquirida o secundaria. El término multirresistente (TB-MR) define los pacientes que excretan bacilos resistentes a varios medicamentos, especialmente a los dos de mayor efectividad, como son Rifampicina (R) e Isoniazida (H). La OMS estima que alrededor de 50 millones de personas están infectados con cepas de M. tuberculosis resistentes a las drogas anti-tuberculosas. Acorde con los datos de los estudios de resistencia a drogas antituberculosas aportados por el Programa Global de la OMS, los países que no aplican la estrategia de supervisión del tratamiento o DOTS (Directly Observed Therapy Short Course) cuyos programas de control son ineficientes en sus acciones presentan las mayores tasas de MDR/TB, representando una amenaza para el control de la TB en sus países al diseminar cepas de bacilos resistentes, para los cuales resultan ineficaces las drogas existentes en la actualidad para tratar los enfermos en esta situación. La bacteria multirresistente ha sido detectada en 17 países del mundo, entre los que están Argentina, Perú, Ecuador, Chile, Estados Unidos, Reino Unido, España, Rusia. El brote comenzó, en una provincia de Sudáfrica asociado a pacientes VIH-positivos (5).
El Boletín Epidemiológico de la Organización Panamericana de la Salud para 1998, publicó un reporte sobre el control de la TB en América, en el cual destaca la importancia del desarrollo y la puesta en práctica de la vigilancia de la farmacorresistencia en TB (5). Los resultados de los estudios de resistencia primaria a drogas antituberculosas realizados en los países de la Región, aunque aun no alarmantes, evidencian sin embargo, algo totalmente comprobado a escala mundial y es que cuando los programas son eficientes en sus acciones de control y aplican la estrategia del tratamiento supervisado o DOTS desde hace cierto numero de años, las tasas de prevalencia de resistencia a los medicamentos y en específico la multiresistencia son muy bajas, no constituyendo por lo tanto un problema para el control de la TB en sus respectivos países, una situación totalmente distinta se presenta en países que no aplican la estrategia DOTS, (5). El informe sobre el control de la TB de la Organización Mundial de la Salud (WHO) del año 2007 reportó que el número de casos de multirresistencia al tratamiento de TB aumentó con los casos de pacientes VIH-positivos para el año 2005 (1). Finalmente la WHO sugiere que sólo la prevención con buenos esquemas iniciales y con supervisión estricta del tratamiento, es la mejor manera de evitar el tener que enfrentarse al delicado, difícil y costoso problema de la multirresistencia (1).
Hoy día, el cultivo específico para M. tuberculosis permanece como el método estándar para el diagnóstico de la infección, sin embargo se trata de una técnica dispendiosa y demorada. Así, las decisiones terapéuticas, siempre urgentes frente a una infección que amenaza la vida del paciente, pueden ser inaceptablemente postergadas, mientras se aguarda el reporte de un cultivo. Hasta ahora la única prueba rápida para detectar la micobacteria es la identificación directa de bacilos ácido-alcohol resistentes, en extendidos de diversas secreciones corporales. Sin embargo, como método único de diagnóstico paraclínico, la baciloscopía no posee un perfil satisfactorio de sensibilidad y especificidad, sobre todo en los casos de infecciones no cavitantes.
Las pruebas utilizadas para el diagnostico de TB incluyen además de la baciloscopía y el cultivo, la intradermoreacción a la tuberculina que ha sido utilizada y aceptada por más de 85 años. A esta prueba se le cuestiona la pobre especificidad contra M. tuberculosis aunque cada vez más se realizan estudios con proteínas recombinantes purificadas que ha demostrado mayor especificidad de especie en la prueba de intradermoreacción (6). Otra posibilidad diagnóstica interesante es la detección de material genético de la micobacteria, mediante técnicas de amplificación genética basadas en el uso de la reacción en cadena de la polimerasa (PCR) (6). La utilidad de esta prueba es mayor cuando la baciloscopía es positiva, circunstancia en la cual la especificidad y sensibilidad son superiores a 95%. Sin embargo, cuando la baciloscopía es negativa, la sensibilidad se reduce entre 40% y 70%. Si bien el valor diagnóstico de las pruebas genéticas rápidas es indiscutible, su aplicabilidad en la práctica clínica diaria depende del valor pronosticador que posean (6).
Entre la pruebas inmunológicas están el uso de los anticuerpos, para realizar diagnóstico de TB a través de pruebas serológicas. En los últimos años, un alto número de investigadores han orientado sus esfuerzos a diseñar nuevas pruebas diagnósticas y a mejorar el rendimiento de los métodos serológicos. Estos métodos de diagnóstico de TB se han venido realizando con el fin de lograr un máximo en la sensibilidad y especificidad para la detección de pacientes infectados con el bacilo de la TB, tanto en niños como en adultos (7-9). La principal ventaja de éstos es que no se necesita de una prueba clínica proveniente del sitio de la infección. Además permite obtener resultados en un corto período de tiempo, lo cual permite la aplicación de un tratamiento lo más pronto posible. Igualmente, este tipo de prueba no requiere que el paciente asista de nuevo a la consulta para chequear la evolución de la respuesta, como es el caso de la prueba de la tuberculina. La principal desventaja que presentan las pruebas serológicas, es la variabilidad de respuesta de los anticuerpos frente a un antígeno, que puede darse en la población mundial. Nuestro grupo y los grupos de Ginsberg AM, 1998 y Bothamley G, 1995 han reportado la realización de combinaciones de tanto isotipos como de antígenos que permiten conseguir aumentar la sensibilidad de los métodos serológicos, los cuales pueden mostrar una sensibilidad suficientemente alta para la detección de pacientes con infecciones tuberculosas. (8-10).
Se ha postulado que la forma heterogénea de reconocimiento del antígeno entre diferentes personas más que el reconocimiento de un antígeno en particular, es la clave de la respuesta humoral en la TB. La sensibilidad de la prueba depende también de la fase de la enfermedad y de la presencia de la micobacteria en el esputo ya que los casos crónicos y con cultivo positivo muestran mayor sensibilidad en las pruebas serológicas (11). Se ha reportado la caracterización y disponibilidad de varios antígenos específicos de M. tuberculosis en el diagnostico serológico, los cuales detectan por arriba del 85% de los casos de TB positivos por frotis, pero la sensibilidad disminuye en los casos de TB con frotis negativo, además de que la mayoría de los antígenos caracterizados tienen sensibilidad y especificidad más bajas en pacientes coinfectados con HIV (10, 11). El antígeno de 38 kDa ha sido frecuentemente estudiado, este está utilizado como componente en tres pruebas inmunocromatográficas comercialmente disponibles, cuyas sensibilidades varían del 16% al 80% dependiendo de la población estudiada y del resultado de la baciloscopia (11). Otros antígenos que han sido estudiados en pruebas serológicas son CFP, ESAT, MPT-63 y MPT-64. ESAT y CFP son dos antígenos recombinantes que se han utilizado para medir inmunidad celular y humoral contra el bacilo tuberculoso (12). Muchos de estos antígenos han demostrado buena sensibilidad y especificidad para identificar pacientes con TB pulmonar (12).
La seguridad diagnóstica de una prueba depende del antígeno y del isotipo utilizado, así como de la población estudiada. Se ha reportado una especificidad de 97-99% para medir IgG contra antígenos recombinantes 38 kDa y 16 kDa mientras que para los antígenos nativos disminuye a 81%, lo que puede ser resultado de la reactividad cruzada con antígenos nativos de micobacterias ambientales; igualmente la seguridad diagnóstica medida por los valores predictivos positivo y negativo es mayor cuando se utilizan antígenos recombinantes. En lo que respecta a isotipos de inmunoglobulinas la sensibilidad es mayor en las pruebas que se mide IgG y es baja con IgA e IgM (10, 12).
En relación con el desarrollo de métodos de diagnóstico alternativos, nuestro grupo ha realizado estudios recientes de métodos con la utilización de la saliva para medir la IgA secretora contra antígenos de M. tuberculosis (13). También hay estudios sobre la detección de antígenos secretados en orina en la fase inicial de la enfermedad y que serian buenos candidatos para detectar infección activa; todos estos métodos han sido reportados como útiles para evaluar, con la posibilidad de desarrollar métodos de diagnósticos pocos invasivos y rápidos (14).
ETIOPATOGENIA DE LA INFECCIÓN POR M. tuberculosis
La TB causada por M. tuberculosis es considerada como una infección bacteriana crónica, caracterizada por la formación de granulomas en los tejidos comprometidos y relacionada con hipersensibilidad mediada por células (15). Aunque los pulmones son los órganos afectados por excelencia, se considera que es una entidad sistémica, cuya evolución natural conduce a un síndrome crónico de deterioro, que en caso de no ser tratada adecuadamente o de abandonar el tratamiento, la patología es más severa y puede conllevar a la muerte. M. tuberculosis es un bacilo delgado, ácido resistente, de forma ligeramente curvada, con una longitud que oscila entre 1 y 4 micras. Al microscopio, los conglomerados bacilares adquieren una forma característica, descrita como “en cuentas de rosario” y las propiedades estructurales de la pared bacteriana hacen que sea poco vulnerable a la acción de los agentes antimicrobianos de uso corriente y a los mecanismos de defensa naturales del hospedero (15).
La constitución de la pared celular de M. tuberculosis es una de las más complejas entre los microorganismos conocidos. Es dos veces más gruesa y fuerte que la de los gérmenes Gram negativos y constituye una verdadera coraza lipídica, difícilmente penetrable, que otorga a la micobacteria su típica resistencia a la acción del alcohol y los ácidos (15). Los principales componentes de dicha pared son peptidoglicanos y ácidos micólicos, unidos entre sí por medio de enlaces covalentes, D-arabino-D-galactán. Además, posee un alto contenido de glicolípidos, en particular a-a´-trehalosa dimicolato (TDM) y a-a´-trehalosa monomicolato (TMM). La organización de estos componentes ácidos en la pared celular bacteriana determina ciertas características de permeabilidad limitada, de manera que la mayoría de agentes antimicrobianos son incapaces de atravesar la pared. Por otro lado, esta fuerte coraza, en muchos sentidos es similar a la cápsula de las esporas, protege a la micobacteria de las fluctuaciones ambientales y le permite subsistir por tiempo prolongado en los tejidos. La pared es tan importante para la viabilidad de la bacteria, que la isoniacida, uno de los agentes antituberculosos más efectivos, actúa inhibiendo la síntesis de ácidos micólicos, evento que conduce a la desintegración de esta estructura.
M. tuberculosis posee propiedades de adaptación que permiten diferenciarla de otras bacterias. En primer lugar, se trata de un parásito estricto y por ello, la transmisión es directa de persona a persona; por otra parte, puede permanecer en un estado bacteriostático dentro de las células infectadas por largos períodos, ya que no posee toxinas y en tercer lugar, crece en condiciones aerobias, lo que determina que el grado de proliferación difiera, según las presiones parciales de oxígeno de los tejidos infectados; la baja tasa de replicación explica la tendencia a la cronicidad y por último, la micobacteria posee numerosos antígenos capaces de inducir respuestas inmunológicas variables, que contribuyen al daño tisular (15).
SUSCEPTIBILIDAD FRENTE A LA INFECCIÓN POR M. tuberculosis
La respuesta inmunitaria controla, pero no elimina al patógeno. La falta de una respuesta inmunitaria apropiada, da como resultado una TB aguda activa. En la mayoría de los casos de infección por M. tuberculosis, el individuo permanece asintomático y no infeccioso. Esta latencia clínica a menudo se extiende durante toda la vida del individuo. Sin embargo, la reactivación de la infección latente puede ocurrir en respuesta a perturbaciones de la respuesta inmunitaria, produciendo enfermedad activa. La infección por VIH, la diabetes mellitus, el tratamiento con corticosteroides, el envejecimiento y el abuso de drogas u alcohol, aumentan el riesgo potencial de reactivación de enfermedad latente (15).
Los mecanismos por medio de los cuales en algunos individuos se logra una respuesta inmunitaria suficiente para contener la infección micobacteriana, mientras que en otros, ésta es ineficaz y permite la progresión de la enfermedad hacia TB clínicamente manifiesta, aún no han sido esclarecidos. Los datos de algunos estudios epidemiológicos sugieren la posible existencia de factores genéticos, teniendo en cuenta que la enfermedad afecta con particular intensidad a ciertos grupos familiares y raciales (16).
En animales de experimentación se han identificado genes específicos que determinan una mayor susceptibilidad a la infección; por ejemplo, los ratones con una deficiencia congénita del receptor para interferón gamma (IFN-g), son muy susceptibles a la infección tuberculosa, los animales homocigotos para dicho defecto genético experimentan una forma mucho más agresiva de la enfermedad (17). La importancia del IFN-g también ha sido puesta de manifiesto en pacientes con alteraciones genéticas del receptor de IFN-g (IFN-gR), al mostrar que estas personas tienen una gran susceptibilidad a infecciones diseminadas y que los monocitos y/o macrófagos (MN/ MF) no pueden ser activados adecuadamente (17). La diseminación es consecuencia de una falla en la formación de granuloma, debido a que no hay producción de las citocinas, principalmente Factor de Necrosis Tumoral-alfa (TNF-a) y quimiocinas involucradas en este proceso. Además de las alteraciones genéticas en el IFN-gR, otros estudios han demostrado que las alteraciones genéticas de la subunidad p40 de IL-12 y de una subunidad de su receptor provocan una deficiente producción de IFN-g facilitando las infecciones diseminadas por micobaterias (17). Adicionalmente, la deficiencia de otros genes tal como el Nramp ha sido también asociada a la susceptibilidad o resistencia a padecer de TB (18).
PATOGENIA DE LA TUBERCULOSIS
Período Primario o Tuberculosis Primaria
La historia natural de la TB es compleja. La infección primaria ocurre en personas sin inmunidad específica, generalmente niños sanos y adultos jóvenes quienes no habían estado anteriormente expuestos a M. tuberculosis. La adolescencia es la edad de mayor riesgo. La enfermedad primaria se desarrolla dentro de los primeros cinco años de la infección inicial, la cual estimula a la inmunidad específica, demostrada por el surgimiento de una respuesta cutánea positiva al derivado proteico purificado del cultivo de M. tuberculosis o PPD (18).
La habilidad de M. tuberculosis para mantener una infección crónica y causar enfermedad en un subgrupo de aquellos sujetos infectados, depende de sus productos (factores de virulencia) que capacitan al microorganismo para entrar y sobrevivir indefinidamente dentro de las células fagocíticas mononucleares, además por subvertir los mecanismos celulares antimicrobianos (15, 16). Esta infección primaria puede evolucionar hacia: 1) la cura (hay una cura bacteriológica), 2) la estabilización (foco latente), permanece así durante meses, años, incluso durante toda la vida del individuo, no hay cura bacteriológica, ya que hay bacilos virulentos enquistados en las lesiones, pero por diversas circunstancias puede ocurrir una reactivación y evolucionar hacia el período secundario o posprimario o 3) la generalización precoz inmediata, donde ocurre una diseminación bacilar por vía linfática o hemática a todo el organismo, produciendo lesiones tuberculosas en diversos órganos, siendo la lesión en los órganos linfáticos una constante. Puede darse un proceso agudo en aquellos individuos que presenten baja resistencia, hay diseminación de los bacilos hacia diversos órganos dando lugar a lesiones uniformes (con el mismo estado evolutivo) produciéndose una TB miliar aguda o lesiones exudativas tipo neumonía o meningitis. También puede evolucionar como un proceso moderado, en individuos donde hay resistencia parcial, la diseminación linfohemática es de pocos bacilos, dando lesiones polimórficas en diversos órganos, típicas de TB nodular y TB perlada (15, 16).
Período Posprimario o Tuberculosis Secundaria
La diseminación del bacilo ocurre por vía canalicular (bronquios y bronquiolos en el pulmón, túmulos renales en el riñón, conductos galactóforos en la glándula mamaria, etc). Las lesiones se asientan en un solo órgano (aquel lesionado en el período primario), por lo tanto se le denomina TB crónica de órgano. Generalmente se observan lesiones caseosas o reblandecidas, con formación de úlceras o nódulos (15, 16). Esta forma puede estabilizarse, sin compromiso inmediato de la vida del individuo. Pero como consecuencia de la pérdida total de la resistencia (inmunosupresión) puede evolucionar hacia una generalización aguda tardía, diseminándose el bacilo por vía linfohemática, con compromiso de los nódulos regionales. Son características la TB miliar tardía y la TB acinosa galopante (15, 16).
RESPUESTA INMUNITARIA FRENTE A LA INFECCIÓN POR M. tuberculosis
La inmunidad innata en tuberculosis
El descubrimiento de familias de proteínas receptores de superficie como son los receptores de reconocimiento de patrones (PRRs), los cuales están presentes en los linfocitos B, MN/MF y en la células dendríticas son afines con las estructuras invariables de patógenos (PAMPs) (19). Los PRRs en estas células, desde el punto de vista funcional, pueden ser secretados, endocíticos o de señalización (receptores toll-like: TLR). El descubrimiento de la familia de proteínas receptores TLR, en la respuesta inmunitaria, ha ofrecido nueva luz sobre el vínculo entre inmunidad innata e inmunidad adaptativa. Hay evidencia que sugiere que, los TLR juegan un papel importante en la activación de las células inmunes por los patógenos, incluyendo M. tuberculosis. Se ha reportado que la inducción de IL-12 y la actividad promotora in vitro de la sintetasa del óxido nítrico (NOS2) por la lipoproteína micobacteriana 19 kDa es dependiente del TLR2 humano. Se ha reportado que M. tuberculosis puede actuar vía TLR2 y TLR4 humanos, a través de un enlace específico (19). Estudios recientes demostraron que tanto M. tuberculosis como antígenos propios de la micobacteria tales como lipoarbinomanan y la lipoproteína de 19 kDa inducen la expresión y secreción de ciertos péptidos antimicrobianos a través de TLR´s en células epiteliales de pulmón, los cuales son capaces de eliminar a la micobacteria. Sin embargo, se observó que cepas avirulentas no inducen la expresión de estos péptidos antimicrobianos. Es posible que la presencia de estos péptidos antimicrobianos esté ligada a factores de resistencia natural y pueda variar entre individuos debido a polimorfismos genéticos (20). También ha sido reportado que el antígeno 38 kDa a través de TLR2 y TLR4, induce las vías de activación de ERK1/2 y p38 MAPK, las cuales juegan un papel esencial en la expresión de TNF-a e IL-6 durante la infección por M. tuberculosis (21). Estos receptores que se expresan sobre las células dendríticas tanto de ratones como de humanos interactúan con M. tuberculosis y generalmente se asocian con la molécula CD14 para producir señales intracelulares que conducen a la activación de la inmunidad innata a través de la secreción de citocinas y quimiocinas muy importantes, tanto en la inflamación, como en la regulación de la respuesta inmunitaria adaptativa (20).
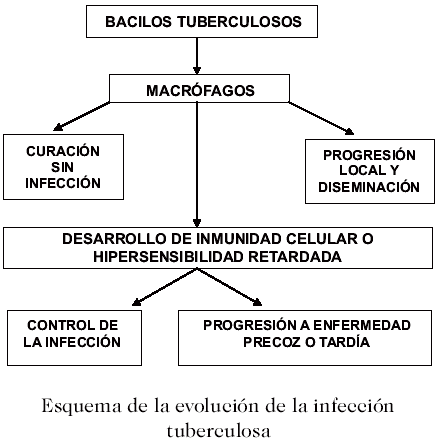
M. tuberculosis persiste en los macrófagos dentro de un granuloma en los huéspedes infectados. El granuloma está constituido de macrófagos y células gigantes, células T, células B y fibroblastos. En las infecciones latentes, se desconoce el estado de actividad de la bacteria dentro del granuloma o tubérculo (3, 6). La diseminación es consecuencia de una falla en la formación de granuloma, debido a que no hay producción de las citocinas (principalmente TNF-a) y quimiocinas involucradas en este proceso. En este caso, el IFN-g exógeno no tiene la capacidad de activar a los MN/MF que son el hábitat preferido de la micobacteria, y como consecuencia pasan a ser células permisivas dentro de las cuales se multiplica la micobacteria (15, 17). El microorganismo puede estar en un estado inactivo sin replicarse, replicándose activamente pero limitado por la respuesta inmunitaria, o metabólicamente alterado con ciclos replicativos infrecuentes o limitados. La alteración de la respuesta inmunitaria puede resultar en la reactivación y replicación del bacilo, con necrosis y daño al tejido pulmonar. La respuesta inmunitaria es capaz de prevenir la enfermedad activa en la mayoría de las personas, pero no elimina la infección. El microorganismo ha desarrollado mecanismos para evadir la respuesta inmunológica mediada por células. A pesar de que se ha pensado que el primer evento en el alveolo es la fagocitosis de M. tuberculosis por los MA, también se ha sugerido que inicialmente la micobacteria está en contacto e infecta a las células epiteliales alveolares, como una alternativa para evadir las agresiones del medio y escapar de los MA. En el macrófago, la función fagolisosomal en la infección por M. tuberculosis se encuentran algo afectada. Dentro del lisosoma existen enzimas hidrolíticas potentes capaces de degradar todo un rango de macromoléculas, incluyendo microbios. Estas enzimas actúan óptimamente en un pH ácido (4,5-5,0; mantenido por la bomba de protones dependiente de ATP, las H+-ATP- asas vacuolares), a condición de encontrarse dentro de un medio intralisosomal (22). Por su capacidad de producir cantidades significativas de amoníaco, el bacilo tuberculoso puede evadir el ambiente tóxico dentro de la vacuola lisosomal, inhibiendo el fagolisosoma y disminuyendo la potencia de las enzimas intralisosomales a través de la alcalinización del medio. Dos enzimas que pertenecen al metabolismo del amoníaco, la ureasa micobacteriana y la glutamino-sintetasa, han sido asociadas a la interrupción de la fusión fagolisosomal y a la sobrevida micobacteriana (22). Otro mecanismo mediante el cual las micobacterias patógenas son capaces de inhibir la fusión de los fagosomas y lisosomas está asociado a la liberación bacteriana de derivados sulfatados a partir de una glicoproteína de su pared (trehalosa 2-sulfato), que detiene la maduración del lisosoma en el estadío de endosoma temprano. También la retención de la proteína de cubierta que contiene aspartato y triptofano (TACO) en el fagosoma previene la fusión con los lisosomas maduros (23).
Estudios realizados en sangre periférica y linfocitos bronquio alveolares (LBA) de pacientes con TB han demostrado que la infección por M. tuberculosis induce una disminución de la población de linfocitos T Vg9+/Vd2+ en pacientes con TB, en comparación con sujetos sanos y pacientes con enfermedades granulomatosas como la sarcoidosis (24), esto como consecuencia de la apoptosis inducida por la vía de Fas/Fas ligando de los linfocitos TVg9+/Vd2+ reactivos a antígenos de M. tuberculosis (24). Este mecanismo de apoptosis de los linfocitos T gd ha sido explotado por M. tuberculosis como un mecanismo de evasión de la respuesta inmunitaria (25).
La elevada producción de óxido nítrico (NO) por los macrófagos activados es un mecanismo antimicrobiano potente. Estos fagocitos, bajo la activación por agentes apropiados tales como el IFN-g y TNF-a, generan NO e intermediarios reactivos de nitrógeno (RNI-relacionados) vía NOS2 usando L-arginina como sustrato. La actividad de estos óxidos de nitrógeno tóxicos en la defensa del huésped ha sido bien documentada, tanto in vitro como in vivo, particularmente en el sistema murido (26). En el ratón, los RNI juegan un papel protector en la infección tuberculosa aguda y crónica persistente. Se ha detectado inmunohistoquímicamente un elevado nivel de expresión de NOS2 en macrófagos obtenidos por lavado pulmonar alveolar de individuos con TB pulmonar activa. Además, se ha observado que el nivel de NO exhalado aumenta en los pacientes con TB (26).
El papel del oxígeno tóxico (ROI) en el control de la infección micobacteriana permanece en controversia ya que no se ha confirmado su habilidad para matar a M. tuberculosis. Además, las micobacterias son capaces de evadir su efecto tóxico de diferentes maneras. Por ejemplo los componentes micobacterianos lipoarabinomanan (LAM) y el fenolicoglicolípido-I (PGL-I) son potentes destructores de los radicales de oxígeno (20). Asimismo, los sulfátidos micobacterianos interfieren con el mecanismo antimicrobiano dependiente de radicales de oxígeno del macrófago (25, 26).
La inmunidad adaptativa en tuberculosis
La respuesta a la infección por micobacterias es el ejemplo clásico de una respuesta inmunitaria mediada por células a un parásito intracelular facultativo. La respuesta celular en la TB es generada cuando los linfocitos T CD4+ (ab TCR) reconocen antígenos de M. tuberculosis presentados por los Mf en el contexto de moléculas MHC II. Estos antígenos provienen del fagosoma, el cual constituye el hábitat preferido de la micobacteria al mismo tiempo que tienen fácil acceso a la vía de las moléculas MHC II, de manera que pueden ser acoplados y presentados a los linfocitos T CD4+ (15, 17). Como resultado de esto, los linfocitos TCD4+ son activados y empiezan a producir IFN-g, una citocina de gran importancia por su capacidad de incrementar la función microbicida de los Mf. Por otra parte, otra citocina, la IL-1 producida por Mf, promueve la producción de IL-2 y la expresión del receptor para IL-2 (IL-2R) con la subsecuente expansión clonal de los linfocitos T CD4+, así como también la IL-12 producida por Mf (15, 17).
En humanos, algunas evidencias experimentales sugieren que los linfocitos CD4+ pueden tener además una función citolítica, particularmente en la respuesta inmunitaria en el pulmón (15, 17). Además de los linfocitos CD4+ y las células NK, otra fuente importante de IFN-g la constituye los linfocitos T CD8+ (ab TCR), los cuales reconocen antígenos micobacterianos en el contexto de moléculas MHC I o CD1 de las células dendríticas, y además, tienen funciones citotóxicas sobre las células infectadas a través de un mecanismo dependiente de gránulos. Lo cual implica el reconocimiento por las células CD8+ de los antígenos presentados por las APC en el contexto de moléculas MHC I o CD1 conllevando esto a la activación del linfocito, la producción de IFN-g, la síntesis y producción de gránulos que son secretados al espacio intercelular y que, posteriormente, entran a la célula infectada para ejercer su acción citolítica (15, 17).
Las moléculas CD1 son moléculas presentadoras de antígenos no polimórficas; el Grupo I de moléculas CD1 incluyen CD1a, b y c, mientras el Grupo II incluye CD1d. Las moléculas CD1 tienen similitud estructural con las moléculas MHC clase I, con un puente no covalente de b2-microglobulina en ambas moléculas. Sin embargo, el puente de CD1 es mucho más profundo y mucho más hidrofóbico que las moléculas del Complejo Mayor de Histocompatibilidad clase I y II (MHC-I y MHC-II). Los CD1 presentan lípidos y glicolípidos a las células T. Las células T CD1-restringidas son a menudo CD4–8– o CD8+, pero un estudio reciente indicó que CD1 podría también presentar antígeno a las células T CD4+ (27). Este estudio ofreció la primera evidencia de una respuesta de memoria de las células T a un antígeno CD1-restringido en sujetos PPD+ expuestos a M. tuberculosis (28). Las células mononucleares de sangre periférica (PBMC) de estos sujetos proliferaron a un glicolípido isoprenoide, en contraste a las PBMC de sujetos PPD- y esta proliferación fue inhibida por anticuerpos anti-CD1c (27). Las funciones efectoras de células CD8+ CD1-restringidas incluyeron la producción de IFN-g y actividad citotóxica, pero el objetivo de estas células in vivo pudiera no ser los Mf. Los datos in vitro indican que las células dendríticas pueden ser infectadas con M. tuberculosis y quizá las células CD1-restringidas sirvan para monitorear este reservorio de infección (28).
En la inmunidad contra las micobacterias están implicados diferentes grupos de células T, incluyendo las células T CD4+ alfa/beta (a/b), las células T CD8+ alfa/beta (a/b) y las células T gamma/delta (g/d) (16, 19, 28). Datos recientes muestran una fuerte correlación entre la producción de interferón gamma (IFN-g) en las células T g/d y la manifestación de TB pulmonar primaria, lo cual es consistente con la hipótesis de que estas células tienen un efecto inmune protector en la infección (29). Las células T CD8+, han mostrado ser protectoras en contra de M. tuberculosis en el ratón. Los datos obtenidos por experimentación sugieren que el modo primario de acción de estas células es la secreción de citocinas, más que una actividad lítica directa de las células CD8+ (29, 30).
CITOCINAS EN TUBERCULOSIS
El control inmunológico de la infección por M. tuberculosis está basado en una respuesta Th1. La producción de IL-12 es inducida (después de la fagocitosis de M. tuberculosis), por los Mf y células dendríticas, las cuales inducen el desarrollo de una respuesta TH1 con producción de IFN-g (17,31). La importancia de IL-12, en el control de la infección por M. tuberculosis se puede observar en el ratón deficiente del gen-IL-12p40. Cuando estos ratones se infectan, muestran una carga bacteriana importante y una disminución del tiempo de sobrevida en relación con los ratones del grupo control. Esto probablemente se debe a, una reducción sustancial en la producción de IFN-g. Los humanos con mutaciones en los genes IL-12p40 o en el receptor de IL-12 presentan una disminución en la producción de IFN-g a partir de células T y son más susceptibles a la diseminación de BCG y a las infecciones por M. avium (31). Existe evidencia de que la vacuna DNA-IL-12 podría reducir sustancialmente el número de bacterias en el ratón con una infección tuberculosa crónica, sugiriendo que la inducción de esta citocina pudiera ser un factor importante en el diseño de una vacuna antituberculosa (32).
El IFN-g es clave en el control de la infección por M. tuberculosis. Esta citocina es producida por las células CD4+ y CD8+ durante la infección tuberculosa y por las células citocidas naturales (NK). Recientemente, se ha reportado la producción de IFN-g dependiente de IL-12 en los Mf alveolares infectados con micobacterias. El ratón deficiente en IFN-g (knock-out, GKO) es más susceptible a M. tuberculosis virulentos (33). Estudios in vitro con células mononucleares de pacientes con infecciones micobacterianas causadas por BCG, M. avium, M. abscessus y otras micobacterias atípicas han demostrado la existencia de alteraciones genéticas que incluyen mutaciones puntuales, deleciones y sustituciones en los genes que codifican las subunidades del IFN-gR (IFN-g R1 y R2), generando proteínas no funcionales que impiden la activación de los MN/MF, lo cual determina la susceptibilidad a infecciones diseminadas causadas por patógenos intracelulares (34). La diseminación es consecuencia de una falla en la formación de granuloma, debido a que no hay producción de las citocinas (principalmente del TNF-a) y quimiocinas involucradas en este proceso. En este caso, el IFN-g exógeno no tiene la capacidad de activar a los MN/MF (34, 35). El efecto de la falta IFN-g es el crecimiento sin control del bacilo en los órganos del ratón GKO, y aunque se forman granulomas, éstos se vuelven rápidamente necróticos. En estos ratones la activación de los Mf es defectuosa y la expresión de NOS2 es baja, factores que posiblemente contribuyan en gran medida a la susceptibilidad (35). En tuberculosis, la IL-12 también ha sido detectada en granulomas (36).
M. tuberculosis, es un potente inductor de IL-12 y debido a que la producción de IFN-g es dependiente de IL-12, la respuesta de IFN- g es detectada siempre en huéspedes infectados (37). Aunque la producción de IFN-g, por sí sola es insuficiente para el control de la infección por M. tuberculosis, se requiere de esta citocina para tener una respuesta protectora a este patógeno. El IFN- g es producido tanto por sujetos PPD positivos sanos como por enfermos. Si bien, la producción de IFN-g puede variar mucho entre sujetos y algunos estudios sugieren que los niveles de IFN-g están disminuidos en pacientes con TB activa (37), la medición únicamente de esta citocina puede no ser un correlato confiable de respuesta inmunitaria protectora. De hecho, un estudio reciente mostró que M. tuberculosis puede impedir a los Mf responder adecuadamente al IFN-g. Esta capacidad de M. tuberculosis para limitar la activación de los Mf por el IFN-g sugiere que la cantidad de IFN-g producida por las células T, no es tan predictiva del resultado como lo es la habilidad de las células para responder a esta citocina (35, 37).
La presencia de respuesta Th2 y de IL-4 en TB está sujeta a controversia. Sin embargo, la detección de IL-4 es variable y aunque algunos reportes indican que existen varias respuestas Th2 en la enfermedad tuberculosa (38), esto no ha sido fehacientemente demostrado.
Se ha reportado que aunque exista una respuesta inmunitaria Th1 deprimida, no existe incremento en una respuesta Th2 de las PBMC en pacientes tuberculosos. La elevada expresión de IFN-g se detecta en granulomas dentro de nódulos linfáticos de pacientes con linfadenitis tuberculosa, pero sólo se ha detectado una pequeña cantidad de IL-4 mRNA (35). Estos resultados y otros indican que al parecer en humanos no existe una respuesta Th2 asociada a la TB. En el ratón BALB/c, más susceptible que el ratón C57BL/6 a M. tuberculosis, no se produce una respuesta Th2 consistente, aún cuando su resistencia pueda estar aumentada por IL-12 exógena. No se ha observado tampoco un cambio a una respuesta Th2 en los ratones GKO o IL-12p40-deficientes infectados con M. tuberculosis. Estos datos sugieren que la ausencia de una respuesta Th1 a M. tuberculosis no necesariamente promueve una respuesta Th2, y que es la deficiencia de IFN-g la que evita el control de la infección y no la presencia de IL-4 u otras citocinas Th2 (35). En un estudio de expresión de genes de citocinas en los granulomas de pacientes con TB avanzada mediante hibridización in situ, IL-4 fue detectada en 3/5 partes de los pacientes, pero nunca en ausencia de expresión de IFN-g (35). Los granulomas examinados en este estudio corresponden a pacientes con enfermedad tuberculosa avanzada y representan esencialmente un fracaso del sistema inmunológico para contener la infección. La presencia o ausencia de IL-4 no se correlaciona con un resultado de mejoría clínica o en diferencias en las etapas del granuloma o en su patología (35, 36).
El TNF-a se requiere para generar la respuesta granulomatosa y para una inmunidad mediada por células efectiva. Sin embargo, en grandes cantidades, puede producir fiebre, pérdida de peso, debilidad muscular y necrosis en los pulmones (39). En modelos animales, la ausencia de TNF-a impide cualquier control del crecimiento de M. tuberculosis. La eliminación intracelular de M. tuberculosis está mediada por la producción de NO inducida por el TNF-a, sin esta inducción M. tuberculosis crece sin control. Sin embargo el exceso del TNF-a puede ser, como ya se mencionó, en extremo dañino. Si en el modelo experimental, el animal recibe una dosis grande de este factor, el animal muere. El análisis histopatológico muestra inflamación pulmonar tan grave que, aun cuando las micobacterias hayan sido eliminadas, el daño al huésped debido a inflamación no regulada ocasiona la muerte (40).
En contraste con el TNF-a, la Interleuquina 10 (IL-10) es generalmente considerada una citocina antiinflamatoria, la cual es producida por Mf y células T durante la infección por M. tuberculosis. Posee propiedades desactivantes de Mf, incluyendo la alteración de la producción de IL-12, la cual a su vez disminuye la producción de IFN-g por las células T (15). El efecto regulatorio de las citocinas IL10, Factor de Crecimiento de Células T (TGF-b), IFN-g y TNF- a sobre la IL-12 fue estudiado en monocitos humanos infectados in vitro con M. tuberculosis H37Ra. Los resultados mostraron que el pretratamiento de los monocitos con IFN-g induce un incremento en la producción del IL-12, siendo más marcado el efecto sobre la subunidad p40, mientras que el pretratamiento con la IL-10 causa reducción en los niveles de la IL-12, confirmando de esta manera el efecto antagónico de esta citocina sobre la producción de IL-12 (41).
Los Mf de pacientes tuberculosos son supresores de la proliferación de las células T in vitro, y la inhibición de IL-10 revierte parcialmente esta supresión (42). La IL-10 inhibe directamente las respuestas de los linfocitos T CD4+, así como también la presentación de antígenos por las células presentadoras infectadas con micobacterias. Estudios recientes sugieren que IL-10 puede actuar en contra de las propiedades de activación del macrófago por parte del IFN-g, sin embargo experimentos realizados en ratones con deficiencia de IL-10 demuestran que la susceptibilidad a la infección aguda por M. tuberculosis es igual tanto en el ratón control como en el del grupo experimental. El papel de la IL-10 en la respuesta inmunitaria protectora está en espera de experimentación posterior (42).
La Interleuquina 6 (IL-6), tiene múltiples papeles en la respuesta inmunitaria, incluyendo inflamación, hematopoyesis y diferenciación de las células T. Se ha reportado un papel potencial de la IL-6 en la supresión de la respuesta de las células T frente a micobacterias (43). Se ha reportado que los Mf infectados con BCG, son incapaces de estimular las respuestas de células T a un antígeno no relacionado, efecto que puede ser revertido parcialmente por la neutralización de la IL-6 (43).
En otro modelo experimental, después de infectar con dosis bajas a través de la vía respiratoria, se observó un aumento temprano en la carga de bacilos a nivel pulmonar, así como la disminución de la producción de IFN-g en los ratones deficientes de IL-6, lo cual sugiere que esta es importante en la respuesta innata inicial al patógeno (44). Una vez que la inmunidad adquirida se desarrolló, los ratones IL-6-deficientes controlaron y sobrevivieron a la infección. El ratón IL-6-deficiente sucumbe a la infección con una dosis alta de bacilos de M. tuberculosis. En este caso, se considera que la respuesta innata defectuosa podría haber sido rebasada por el gran número de bacterias introducidas en los pulmones (44).
Se ha implicado al TGF-b, citocina antiinflamatoria en la supresión de las células T en pacientes con TB (45). La TGF-b está presente en las lesiones granulomatosas de estos pacientes y es producida por monocitos humanos después de la estimulación con M. tuberculosis o lipoarabinomanan. Se ha reportado que además de inhibir la respuesta de células T a M. tuberculosis también participa en la desactivación del Mf al inhibir la producción de NOS2 inducida por IFN-g (46). La regulación de esta citocina es muy compleja y ocurre a varios niveles. No se ha probado directamente el papel de la TGF-b in vivo en la protección o patología en la TB (45).
M. tuberculosis es un fuerte inductor de quimiocinas (47). Hasta ahora la mayoría de los estudios se han enfocado a la producción de quimiocinas una vez que el Mf ha sido infectado por la micobacteria. M. tuberculosis induce expresión de quimiocinas inclusive dos horas después de la infección con M. tuberculosis (48) los Mf humanos infectados normalmente producen CCL2, CCL3, CCL4 y CCL5 (MCP1, MIP1a, MIP1b y RANTES) en respuesta a cepas virulentas de M. tuberculosis (48). Mientras que tejido linfático y monocitos CD14+ aislado de pacientes tuberculosos expresan más CCL2. Los Mf alveolares cuando son infectados aumentan significativamente la expresión de CCL3, CCL2 y CCL5 inclusive más que monocitos de sangre periférica (48). Esto sugiere que las quimiocina que se unen a CCR1, CCR2 y CCR5 juegan un papel importante en la infección temprana de M. tuberculosis, sin embargo el papel real de estas quimiocinas en la inmunopatogenia de la TB necesita ser estudiado.
Los Mf no son los únicos productores de quimiocinas durante la infección por M. tuberculosis, las células epiteliales juegan un papel importante ya que son capaces de producir CXCL8 (IL-8) y CCL2 no así CCL3, CCL4, o CCL5. La producción de citocinas tanto en Mf como en células epiteliales se ve incrementada en la presencia de IFN-g, y disminuida a niveles cercanos a cero con la presencia de IL-4 (48).
ANTÍGENOS DE Mycobacterium tuberculosis
Las proteínas del M. tuberculosis son las que le confieren la propiedad antigénica; ciento cincuenta de sus 1000 proteínas han sido caracterizadas (49). Las más predominantes han sido aisladas, caracterizadas y copiadas por síntesis química o sus genes han sido insertados en huéspedes como Escherichia coli, para la reproducción en gran escala de proteínas recombinantes (50). Para su estudio se han agrupado en cuatro grupos de acuerdo a su función, secuencia y características físico químicas:
El primer grupo formado por proteínas de choque térmico (hsp, del inglés heat shock protein), son polipéptidos esencialmente citoplasmáticos, que incrementan su síntesis frente a estímulos estresantes como los cambios de temperatura, el incremento de daño oxidativo y la disminución de nutrientes; esta respuesta probablemente protege a la micobacteria durante situaciones adversas, manteniendo la conformación funcional de proteínas esenciales y asistiendo en la reducción de proteínas desnaturalizadas (Tabla I). Se agrupan en familias dependiendo del peso molecular: hsp65 kDa o GroEL, hsp 10 kDa o GroES, hsp 70 kDa o DnaK, hsp 90 kDa, hsp 16 kDa entre otras (51). Estas proteínas están presentes tanto en células procarióticas como eucarióticas; se conoce que están altamente conservadas dentro y a través de las especies, lo que ha llevado a plantear la hipótesis de la respuesta de células T a determinantes compartidos de las hsp propias, donde las del M. tuberculosis tienen un papel importante en el desarrollo de las enfermedades autoinmunes (51).
ACCIONES MODULADAS POR LOS ANTÍGENOS DE Mycobacterium tuberculosis
| Antígenos | Acción |
| CPF-10 ESAT-6 27-kDa | Aumenta la secreción de interferón gamma |
| 65-kDa CPF-10 70-kDa 90-kDa | Incrementan su síntesis ante estímulos estresantes, la disminución de nutrientes y el incremento de temperatura |
| 38-kDa 27-kDa 19-kDa | Induce una respuesta humoral |
| 38-kDa 27-kDa | Induce respuesta TH1 |
| 27-kDa Complejo 30/32-kDa MPT-64 | Son utilizados en inmunización |
| 27-kDa 16-kDa CPF-10 | Aumenta la producción de óxido nítrico |
| 40-kDa | Inhibe a las enzimas lisosomales |
| 16-kDa | Elimina células T CD8+ |
| 19-kDa | Inhibe la expresión del MHC clase II |
| 19-kDa | Inhibe la presentación antigénica |
| 19-kDa | Activa los neutrófilos |
| CPF-10 ESAT-6 | Aumenta la secreción de factor de necrosis tumoral |
| CPF-10 | Aumenta la secreción de IL-10 |
| ESAT-6 CPF-10 40-kDa MPT-64 | Diagnóstico |
| ESAT-6 CPF-10 (en recidivas) | Inhibe la producción de óxido nítrico |
| ESAT-6 | Disminución de la expresión de cofactores en CPA. |
| Complejo 30/32-kDa | Mantiene la hidrofobicidad e integridad de la pared celular |
| Complejo 30/32-kDa | Permite la unión de la bacteria a la fibronectina |
El segundo grupo son las lipoproteínas, incluye a las de 19 kDa, 26 kDa, 27 kDa y 38 kDa, fundamentalmente constitutivas de la pared celular pero pueden ser encontradas en el citoplasma, las de 19 y 38 kDa son las más importantes. Se considera que estas lipoproteínas están involucradas en la inducción de respuestas humoral y celular, en especial de la respuesta de las células T de memoria in vitro, y tienen un papel funcional en el transporte de nutrientes a través de la pared celular (Tabla I) (52).
Un tercer grupo son las proteínas secretorias, están constituidas principalmente por proteínas de 15, 18, 23, 26, 27, 30, 31, 31.5 y 41 kDa, algunas de éstas forman el complejo 85 que es uno de los mayores constituyente del sobrenadante de los cultivos del M. tuberculosis. El último grupo está constituido por las enzimas, la L-alanina deshidrogenasa de 40 kDa y la superóxidodismutasa de 23 kDa, que están involucradas en los mecanismos de defensa del bacilo dentro de los Mf (Tabla I) (53, 54).
Se está tratando de definir qué antígeno o epítopo estimula las diferentes respuestas de las células T; la gran mayoría de los antígenos micobacterianos son timodependientes, ya que necesitan de la participación de los linfocitos T cooperadores para generar suficientes respuestas humorales (18, 51). M. tuberculosis presenta 30 diferentes sustancias antigénicas que son capaces de despertar reacciones de hipersensibilidad con destrucción celular (55).
ANTÍGENOS DE SECRECIÓN DE Mycobacterium tuberculosis
38 kDa
El antígeno 38 kDa es probablemente el antígeno estudiado de manera más exhaustiva. La codificación del antígeno a partir del ADN es conocida (Tabla II). Este contiene epítopes de una lipoproteína secretada que son específicos del complejo M. tuberculosis. El antígeno 38 kDa antes conocido como antígeno 78, antígeno 5, antígeno proteico “pab” o LPAM, es una proteína de 38,000 daltones, que se ha identificado como una de las de más alta especificidad para la detección de la enfermedad. Es el mayor constituyente del líquido de cultivo de M. tuberculosis. Varios métodos serológicos que usan este antígeno han demostrado buena sensibilidad y especificidad para el diagnóstico de la enfermedad (12, 56).
CODIFICACIÓN DE ALGUNOS ANTÍGENOS SECRETADOS POR Mycobacterium tuberculosis
| Antígeno | DNA codificante |
| CPF-10 | VAKVNIKPLE DKILVQANEA ETTTASGLVI PDTAKEKPQE GTVVAVGPGR WDEDGEKRIP LDVAEGDTVI YSKYGGTEIK YNGEEYLILS ARDVLAVVSK |
| ESAT-6 | P1 MTEQQWNFAGIEAAAS P4 AAASAIQGNVTSIHSL P6 NVTSIHSLLDEGKQSL P8 LDEGKQSLTKLAAAWG P20 STEGNVTGMFA |
| 38 kDa | 38G DQVHFQPLPPAVVKLSDALI 38K DAATAQTLQAFLHWAITDGN |
| Ag85A | MQLVDRVRGA VTGMSRRLVV GAVGAALVSG LVGAVGGTAT AGAFSRPGLP VEYLQVPSPS MGRDIKVQFQ SGGANSPALY LLDGLRAQDD FSGWDINTPA FEWYDQSGLS VVMPVGGQSS FYSDWYQPAC GKAGCQTYKW ETFLTSELPG WLQANRHVKP TGSAVVGLSM AASSALTLAI YHPQQFVYAG AMSGLLDPSQ AMGPTLIGLA MGDAGGYKAS DMWGPKEDPA WQRNDPLLNV GKLIANNTRV WVYCGNGKPS DLGGNNLPAK FLEGFVRTSN IKFQDAYNAG GGHNGVFDFP DSGTHSWEYW GAQLNAMKPD LQRALGATPN TGPAPQGA |
| Ag85B | MTDVSRKIRA WGRRLMIGTA AAVVLPGLVG LAGGAATAGA FSRPGLPVEY LQVPSPSMGR DIKVQFQSGG NNSPAVYLLD GLRAQDDYNG WDINTPAFEW YYQSGLSIVM PVGGQSSFYS DWYSPACGKA GCQTYKWETF LTSELPQWLS ANRAVKPTGS AAIGLSMAGS SAMILAAYHP QQFIYAGSLS LLDPSQGMG PSLIGLAMGD AGGYKAADMW GPSSDPAWER NDPTQQIPKL VANNTRLWVY CGNGTPNELG GANIPAEFLE NFVRSSNLKF QDAYNAAGGH NAVFNFPPNG THSWEYWGAQ LNAMKGDLQS SLGAG |
| Ag85C | MTFFEQVRRL RSAATTLPRR LAIAAMGAVL VYGLVGTFGG PATAGAFSRP GLPVEYLQVP SASMGRDIKV QFQGGGPHAV YLLDGLRAQD DYNGWDINTP AFEEYYQSGL SVIMPVGGQS SFYTDWYQPS QSNGQNYTYK WETFLTREMP AWLQANKGVS PTGNAAVGLS MSGGSALILA AYYPQQFPYA ASLSGFLNPS EGWWPTLIGL AMNDSGGYNA NSMWGPSSDP AWKRNDPMVQ IPRLVANNTR IWVYCGNGTP SDLGGDNIPA KFLEGLTLRT NQTFRDTYAA DGGRNGVFNF PPNGTHSWPY WNEQLVAMKA DIQHVLNGAT PPAAPAAPAA |
| 27-kDa | APYENLMVPS PSMGRDIPVA FLAGGPHAVY LLDAFNAGPD VSNWVTAGNA NTLAGKGIS VVAPAGGAYS MYTNWEQDGS KQWDTFLSAE LPDWLAANRG AAQGGYGAMA AAFHPDRFG FAGSMSGFLY PSNTTTNGAI A AGMQQFGGV |
Entre las especies de micobacterias, este antígeno se encuentra sólo presente en Mycobacterium bovis y M. tuberculosis, su concentración en este último es 10 veces superior. La secuencia de aminoácidos de la proteína 38 kDa posee un 30% de homología con una proteína (PhoS) relacionada con la fijación y el transporte de fósforo en Escherichia coli, la cual se incrementa durante la disminución de fosfato en el citoplasma (Tabla II).
El antígeno 38 kDa de la micobacteria posee diferentes epítopes localizados en la porción central de la molécula y en el carboxilo terminal, los cuales son capaces de inducir la proliferación de clones de células T específicos para M. tuberculosis, aunque algunos pueden tener reactividad cruzada. Una respuesta humoral excesiva al 38 kDa parece tener significado patogénico (55). En un estudio llevado a cabo en el Instituto de Tecnología Microbiana de la India con ratones de 3 diferentes haplotipos (H-2d, H-2k y H-2b), los cuales fueron sensibilizados de manera subcutánea con la cepa H37Ra o 38 kDa de M. tuberculosis y cuyos linfocitos fueron colocados in vitro con el antígeno 38 kDa, se encontró que en ambos casos se indujo un patrón dominante de las citocinas tipo Th1 (IL-2 e IFN-g), además de que se observó la producción preferencial del anticuerpo específico de 38 kDa tipo IgG2a (57). Fue interesante observar que en los ratones C3H/HeJ, que expresan los alelos de resistencia a BCG, mostraron una alta proliferación así como un patrón de citocinas asociadas a resistencia en comparación con los ratones BALB/c y a C57BL/6, que llevan los alelos de susceptibilidad de BCG. Estos resultados sugieren no solamente las respuestas de memoria durante la inducción, sino también una respuesta inmunitaria predominantemente de tipo Th1 (57).
Los anticuerpos dirigidos contra la proteína 38 kDa se presentan en un alto porcentaje de pacientes con TB con una alta especificidad para la enfermedad activa. La mayoría de pacientes produce anticuerpos contra la proteína 38 kDa, mientras que en los controles sanos no se encuentra estos resultados (57). Recientemente se demostró que la vacuna DNA de 38 kDa está induciendo una inmunidad protectora en ratones vacunados que se exponen a bacilos tuberculosos virulentos, lo que resulta en una disminución de la carga bacteriana (54). Los anticuerpos se unen sólo al antígeno hallado en M. tuberculosis y en BCG de M. bovis, no produce una reacción visible con otros sueros, por lo que el antígeno de 38 kDa parece ser serológicamente específico. Finalmente, la importancia del antígeno 38 kDa en la TB ha sido demostrado por muchos investigadores. Se han diseñado diversas pruebas para la detección de estos antígenos en los sueros de los pacientes con TB mediante el método de ELISA directo o sandwich ELISA usando FF11 (anti-38 kDa m-Ab) para la detección del 38 kDa. Esta prueba ha encontrado tener una especificidad de 84-88% con valores predictivos positivos de 80-84% que, aunque no es ideal, es absolutamente provechoso para desarrollar alguna nueva prueba de diagnóstico específica. Esta prueba con ELISA tiene la ventaja de que los antígenos pueden ser detectados en los inicios de la infección y se ha demostrado que puede ser utilizada para supervisar la terapia eficaz detectando la declinación en el antígeno 38 kDa en pacientes previamente positivos. Sin embargo, se requiere de mejores estudios que puedan discriminar entre los casos confirmados de TB activa y latente.
16 kDa
El antígeno 16 kDa (alpha-crystallin) es una proteína de superficie, el más potente inmunógeno, una herramienta de gran valor en el estudio del Mycobacterium, puesto que es altamente específico. La localización celular es desconocida, aunque se considera que está en la parte externa de la pared celular; en otras palabras, esta proteína está probablemente asociada con la membrana de manera periférica (57).
La alfa-crystallin (acr) 16 kDa, proteína homologa de M. tuberculosis es principalmente producida por los cultivos de estas bacterias en la fase estacionaria in vitro, es imperceptible el incremento logarítmico cada vez mayor de este antígeno. Utilizando cultivos de estos bacilos que crecen en concentraciones de oxígeno definidas, se demostró la fuerte inducción de la transcripción de alfa-crystallin 16 kDa en condiciones medianamente hipóxicas. La inducción de la expresión de acr también fue demostrada durante el curso de la infección in vitro de Mf. El gen que codifica la acr fue intercambiado por una porción de un alelo de una cepa H37Rv de M. tuberculosis que presentaba resistencia a la higromicina. Además de su papel propuesto en el mantenimiento de la viabilidad a largo plazo durante las infecciones latentes, asintomáticas, estos resultados certifican el papel de la proteína acr en la replicación durante la infección inicial por M. tuberculosis. Cuando hay infección por M. tuberculosis, la respuesta al NO produce el incremento en la síntesis del homólogo de la alfa cristalino sHsp 16, que es una proteína mayor de M. tuberculosis producida por la exposición a intermediarios de nitrógeno reactivos (Tabla I) (58, 59). El antígeno 16 kDa es inmunodominante con valor serodiagnóstico, se eleva en casos de enfermedad activa o cuando se ha desarrollado una recaída o el bacilo se ha vuelto resistente a los fármacos, disminuye en caso de que exista una respuesta adecuada al tratamiento. Los anticuerpos contra 16 kDa podrían elevarse en respuesta a la infección aún sin que la TB sea clínicamente aparente, por lo que se considera como un marcador temprano de enfermedad, además de que puede utilizarse también en el diagnóstico de TB en niños (60).
19 kDa
La infección de Mf con M. tuberculosis o exposición de los mismos a la lipoproteína 19 kDa por más de 16 horas, inhibe la expresión del Complejo Mayor de Histocompatibilidad clase II (MHC-II) inducida por el IFN-g, a través de un mecanismo que involucra a los receptores TLRs (Tabla I) (61). La señalización de TLRs en forma prolongada por M. tuberculosis y la lipoproteína (LP) 19 kDa, inhibe ciertas respuestas del macrófago al IFN-g, particularmente aquellas relacionados a la expresión de MHC-II y la presentación de antígenos. Esta inhibición posiblemente promueve la evasión del M. tuberculosis a la respuesta inmunitaria mediada por las células T, lo que implica la persistencia de la infección en la enfermedad (Tabla I) (61).
M. tuberculosis y la LP19 kDa tienen la capacidad para inhibir las actividades de procesamiento antigénico y la expresión del MHC-II en el Mf, sólo con la condición de que estas sean estimuladas por IFN-g, porque si el proceso es estimulado por la IL-4, el mecanismo de inhibición no se lleva a cabo, lo que sugiere que la inhibición se realiza a nivel de genes cuya expresión está regulada por el IFN-g (61). La inhibición de la activación de los Mf, provocada por el M. tuberculosis y su lipoproteína 19 kDa se demostró cuando se tomó dos grupos de macrófagos provenientes de muridos, los cuales se infectaron con el bacilo de Koch e incubaron con la lipoproteína 19 kDa respectivamente, transcurridas 24 horas añadieron a las dos preparaciones IFN-g. A través de microradiografía estudiaron la relación entre la activación de los TLRs por los antígenos (M. tuberculosis y lipoproteína) y la ausencia de expresión de moléculas codificadas por genes estimulados por el IFN-g sobre la superficie del Mf. Se obtuvo como resultado una inhibición del 42 y 36% de los 347 genes inducidos por el IFN-g, según fueran tratados con M. tuberculosis o LP 19 kDa, respectivamente (61). Estos y otros genes distintos a los estimulados por el IFN-g también fueron estudiados, a través de técnicas como PCR y citometría de flujo, confirmando los resultados obtenidos por los estudios de microradiografía, es decir sólo es inhibida la expresión de algunos de los genes regulados por el IFN-g. Debido a estas evidencias se puede decir que M. tuberculosis por sí mismo o a través de la LP 19 kDa inhibe la inducción de genes involucrados en el procesamiento y presentación de antígenos, expresión de MHC-II y activación de linfocitos T, a través de una hiperestimulación de TLRs, lo cual provee a la bacteria de una mayor capacidad evasiva y de invasión (61).
La LP 19 kDa de M. tuberculosis también promueve la activación de los neutrófilos; a través de cambios fenotípicos característicos en estas células que inducen el proceso, como lo son la disminución en la expresión de la L-selectina (CD62 ligando) y el aumento en la expresión de CR1(CD35) y CD11/CD18 (CR3 y Mac-1 respectivamente) (Tabla I) (62). Además, la exposición de los neutrófilos a esta lipoproteína incrementa la explosión oxidativa en respuesta al péptido quimiotáctico secretado por bacterias N-formyl-Met-Leu-Phe (fMLP), así como la oxidación de la dihidrodamina 123. A diferencia de los LPS, la LP19 kDa de M. tuberculosis no requiere de la presencia de factores séricos para activar los neutrófilos, lo cual sugiere que existen dos receptores sobre la superficie de la membrana de esta célula o dos tipos de señales heterogéneas que promueven la activación de los neutrófilos en forma disímil en presencia de LPS y la LP 19 kDa de M. tuberculosis (62).
CPF-10
El antígeno 10 kDa pertenece a la familia de las chaperoninas GroES. La codificación para el antígeno a partir del ADN es conocida (Tabla II). Estas proteínas citoplásmicas se requieren para el plegamiento correcto y montaje subsecuente de algunas proteínas bacterianas dentro de la célula. Son inducidas por estrés y actúan estabilizando o protegiendo de una posible desestabilización cuando se encuentra en condiciones de calor (choque térmico). El tipo I de estas chaperoninas se encuentra en eubacterias, mitocondrias y cloroplastos, en donde se requiere generalmente la acción concertada de la chaperonina 60 (Cpn60, GroEL) y la chaperonina 10 (Cpn10, GroES) (63, 65). En presencia de Mg-ATP, Cpn10 se enlaza a Cpn60 y suprimen la actividad de esta bomba ATPasa. El genoma de M. tuberculosis contiene dos proteínas homologas Cpn60 y Cpn10, que probablemente actúan de la misma manera. Sin embargo, en este caso el ensamblamiento de los complejos de proteínas heptaméricas Cpn10 y su enlace a otros sustratos de Cpn10 parece ser posible aun en ausencia de Cpn60 (63-65).
Cpn10 (10 kDa) es una molécula integrada por 14 subunidades, que le dan la apariciencia de un cubo de paredes sólidas e interior vacío. La forma tetradecamérica de Cpn10 podría tener un papel in vivo en el plegamiento de los dominios estructurales de la proteína y en el transporte de esta. Consiste en dos copias de un heptamero en forma de cúpula. La molécula completa contiene sólo un sitio de unión para el calcio en cada heptámero. Cada uno de los dos heptámeros tiene una cavidad interna hidrofílica. Durante la infección por M. tuberculosis, Cpn10 se comporta como un anfitrión, siendo secretado en el espacio extracelular donde contribuye a la patología de la enfermedad. La chaperonina de 10 kDa de M. tuberculosis presenta una gran capacidad de inducir respuestas inmunitarias mediadas por células T y en la modificación de la actividad formadora de hueso, inhibe el crecimiento de osteoblastos y recluta osteoclastos, dando por resultado la reabsorción de las vértebras en el caso de tuberculosis espinal. Esto libera nutrientes y macrófagos que pueden servir como nuevas células hospedadoras para la bacteria (66).
Se ha demostrado que el antígeno CPF-10 del M. tuberculosis puede unirse a la superficie de los macrófagos y estimular la secreción de citocinas proinflamatorias como el TNF-a. El antígeno a diferencia de otros secretados por el M. tuberculosis tiende a establecer sinergia con el IFN-g, provocando la producción de agentes microbicidas por parte del fagocito mononuclear, como lo es el NO (Tabla I) (66). Sin embargo si el individuo ha sido expuesto con anterioridad al antígeno, este va a reducir la cantidad de NO producida por los macrófagos aunque exista una gran cantidad de IFN-g en el medio celular, pero seguirá induciendo la producción de citocinas proinflamatorias como el TNF-a e interleuquinas de tipo Th2 como IL-10 (66).
ESAT-6
El antígeno ESAT-6 (early secretory antigenic target-6) es encontrado específicamente como proteína secretada en los cultivos de M. tuberculosis. Esta se encuentra ausente dentro de la BCG proveniente de M. bovis y en las demás micobacterias ambientales. La secuenciación para el antígeno a partir del ADN es conocida (Tabla II). ESAT-6 estimula las células T de pacientes con TB activa, al inducir un aumento en la producción de IFN-g (Tabla I), (67). Esta proteína y la de 16 kDa están entre las varias moléculas producidas por las bacterias en condiciones relativas de hipoxia y dentro de los granulomas artificiales y animales, condiciones sospechadas para ser análogo a los presentes dentro de granulomas humanos, pero no durante el crecimiento logarítmico de la fase (67).
Datos de investigaciones recientes indican que el antígeno de secreción de M. tuberculosis ESAT-6 actúa en la respuesta inmunitaria frente a la TB. Este puede promover el desarrollo de inmunidad protectora frente al bacilo de Koch mediante la activación de los macrófagos, células dendríticas y mastocitos, provocando la liberación de mediadores proinflamatorios, TNF-a e histamina por parte de estas células (67). Además puede inducir el proceso de maduración de las células dendríticas, a través de la secreción de IFN-g, las cuales posteriormente serán las encargadas de presentar los antígenos de la bacteria a los linfocitos T, promoviendo una respuesta inmunitaria de tipo celular (Tabla I). La modulación de estos procesos y la inmunodominancia de esta proteína dentro de los antígenos derivados de M. tuberculosis son los posibles responsables de la protección obtenida al vacunar a un individuo con estas sustancias (68). Sin embargo aunque esta proteína le brinda una inmunidad protectora al individuo infectado, posiblemente también participe en los métodos de evasión de la respuesta inmunitaria usados por el bacilo para subsistir en el organismo y en la generación de las complicaciones inusuales que se presentan de forma individual (66, 67). Entre los mecanismos de evasión modulados por esta proteína se encuentran, la regulación negativa ejercida sobre la producción de NO en los macrófagos y la disminución de la expresión de factores coestimuladores como B7.1 en las células presentadoras de antígeno (Tabla I), (67). Aunque este antígeno puede contribuir con la supervivencia de la bacteria dentro de las células del huésped susceptible, así como en las reacciones diagnósticas de hipersensibilidad de tipo retardado (Tipo IV), se debe hacer un mayor énfasis en su estudio porque puede servir en el futuro como opciones terapéuticas distintas a las empleadas en la actualidad. (68). En animales de experimentación infectados con M. tuberculosis, tratado y reinfectado, se observó que al momento de la reinfección los animales desarrollaron una fuerte respuesta de células T al ESAT-6, haciendo así a esta proteína relevante como fuente de inmunidad protectora (69).
30/32 kDa
Son un conjunto de tres enzimas, transferasas de ácido micólico expresadas y secretadas por el M. tuberculosis, poseen un peso molecular entre 30 y 32 kDa. Estas enzimas también se conocen en conjunto como el complejo antigénico 85 de M. tuberculosis (70). Está conformado por las siguientes proteínas: Ag85A, Ag85B y Ag85C o 32A kDa; 30 kDa y 32B-kDa, respectivamente. La secuencia de la codificación para el antígeno a partir del ADN es conocida (Tabla II). Las tres proteínas son ampliamente secretadas, sin embargo al cuantificar las secreciones de M. tuberculosis, el Ag85B es la proteína que se encuentra en mayor concentración en el filtrado y el Ag85A es el segundo en abundancia (70). Las tres enzimas se expresan en gran cantidad en macrófagos infectados con M. tuberculosis, su expresión dentro de los fagosomas y sobre la pared celular de la bacteria permite el mantenimiento de la integridad de la misma y el crecimiento de la bacteria, después de ser ingeridas por los macrófagos por activación del proceso de fagocitosis. Algunas investigaciones sugieren que sin la presencia de este complejo antigénico la bacteria no sería capaz de sobrevivir y reproducirse dentro del fagosoma (70).
Las proteínas del complejo 30/32 kDa son uno de los principales candidatos para el desarrollo de nuevas vacunas contra la TB. Los modelos experimentales se han desarrollado en cobayos con el Ag85B purificado, después de varias pruebas se ha detectado actividad inmunitaria protectora contra la forma pulmonar del M. tuberculosis (71). Cuando se une un extracto de la proteína 30 kDa y los componentes de la BCG se obtiene una respuesta inmunitaria más adecuada que la vacuna BCG comúnmente usada, la cual no induce protección contra la TB pulmonar (Tabla I), (70). Este complejo antigénico ayuda a mantener la alta hidrofobicidad e integridad de la pared celular de M. tuberculosis, es decir, actúa sobre una de las estructuras que se encarga de la supervivencia de la bacteria en el organismo del huésped. Este proceso es mediado a través de la transferencia de ácidos micólicos (sustancias hidrofóbicas) hacia la pared celular para que interaccionen con las moléculas de arabinogalactan presente en ella, y la síntesis de factor cordonal (tetrhalosa dimicolato) (70). Las dos vías activadas por el complejo 85 son de gran importancia, la primera porque es la encargada de brindarle alta hidrofobicidad a la pared celular de M. tuberculosis y la otra porque genera una de las moléculas que permite que la pared se conserve íntegra a pesar de las agresiones del medio. Además los productos finales de ambas vías son los encargados de dotar de alta selectividad a la pared de la bacteria, permitiendo sólo la difusión de solutos pequeños, que normalmente sirven para cubrir los requerimientos metabólicos de la bacteria (70).
Es importante destacar que además de realizar estas funciones a nivel de pared celular, el complejo antigénico es el responsable de la alta afinidad de la bacteria por la fibronectina y la pared celular de la célula eucariota, debido a que los antígenos que lo conforman también son proteínas ligadoras de fibronectina, lo cual permite en el caso de las infecciones respiratorias, la invasión del parénquima pulmonar por parte de macrófagos que causaran un colapso a nivel pulmonar junto a las otras sustancias que traspasan la barrera hematorespiratoria (71).
40 kDa
El antígeno 40 kDa de M. tuberculosis, es el primer antígeno reportado de la bacteria que se encuentra relacionado con el proceso patológico, y no se encuentra en la BCG. Funciona como una deshidrogenasa de L-alanina, lo que le confiere la característica de ser uno de los pocos antígenos que posee actividad enzimática. Las características anteriormente citadas hacen de este antígeno, una de las opciones más atractivas para diseñar nuevas estrategias diagnósticas y terapéuticas (Tabla I), (72). A través del estudio de extractos purificados de proteína, se han descrito las propiedades bioquímicas de la proteína (72).
Debido a procesos de desaminación oxidativa es, como la proteína contribuye con el M. tuberculosis en la evasión de la respuesta inmunitaria del huésped, ya que el producto de esta reacción, el amoniaco, el cual aumenta el pH a nivel del fagolisosoma, impide la acción de las enzimas lisosomales que son las encargadas de mediar la destrucción celular, así el M. tuberculosis puede escapar de uno de los mecanismos usados por el sistema inmunológico para protegerse (72).
27 kDa
El antígeno 27 kDa ha sido clasificado como un buen candidato para la protección de las respuestas inmunitarias contra patógenos intracelulares. Hovav y colaboradores en el 2003 estudiaron en ratones de BALB/c la inmunogenecidad y la protección ofrecida por la lipoproteína recombinante de M. tuberculosis 27 kDa y la vacuna correspondiente de DNA (73). La secuencia de codificación para este antígeno a partir del ADN es conocida (Tabla II). La inmunización con el antígeno 27 kDa resultó con altos títulos de inmunoglobulina G1 (IgG1) e IgG2a con un perfil típico Th1 y una respuesta de hipersensibilidad retrasada fuerte (Tabla I). Una alta proliferación fue observada en esplenocitos, y la producción de cantidades significativas de NO, aumenta la secreción del IFN-g, pero la secreción de interleuquina 10 no fue medida. De acuerdo con éstos investigadores, el antígeno 27 kDa induce una respuesta inmunitaria de tipo Th1 protectora. Asombrosamente, en los ratones vacunados con 27 kDa, obtenido de M. tuberculosis H37Rv o de infusiones de BCG, se obtuvo un aumento significativo en los números de unidades formadoras de colonia (CFU) en el bazo comparado esto con los grupos de control. Además, la protección proporcionada por BCG u otros antígenos micobacterianos fueron suprimidos una vez que el antígeno 27 kDa fue agregado a las preparaciones de vacunas. Este estudio indica que el antígeno 27 kDa tiene un efecto nocivo en la protección producida por este tipo de vacunas (73).
ANTÍGENOS DE Mycobacterium tuberculosis Y EL DIAGNÓSTICO DE TUBERCULOSIS EXTRAPULMONAR
La TB pleural representa aproximadamente el 5 por ciento de todas las enfermedades asociadas a infección por M. tuberculosis (74). Constituye la primera causa de derrame pleural en áreas con elevada prevalencia de TB (75). Existen dificultades diagnósticas en TB pleural, tanto desde el punto de vista clínico y paraclínicas. El cultivo de líquido, considerado como el estándar de oro, sólo es positivo en el 40 por ciento de los líquidos, mientras que el cultivo de la biopsia puede serlo en los dos tercios (76). Aunque la combinación de la biopsia pleural más el cultivo para micobacterias resulta con una sensibilidad del 95 por ciento, esto representa un diagnóstico invasivo, que requiere de tiempo para obtener los resultados del cultivo (mínimo dos a tres semanas, llegando hasta ocho) y con elevado costo-beneficio (77). El retraso en el diagnóstico trae como consecuencia la pérdida del seguimiento del paciente. Por tanto, métodos especiales como la determinación de adenosina desaminasa (ADA), lisozima, reacción en cadena de la polimerasa (PCR), inmunoensayos y citocinas en el líquido han sido usados para incrementar estos parámetros, sin embargo, estos aún no son de empleo rutinario.
El tópico relacionado a la respuesta inmunitaria celular o humoral frente a antígenos a nivel sistémico o local, que pudiera ser utilizada como elemento diagnóstico, se remonta a hace más de dos décadas, cuando ya se demostraba la menor reactividad a nivel sistémico contra antígenos crudos como el PPD, frente a las células T del derrame, atribuido a la presencia de células supresoras (78, 79).
Los resultados en suero no resultaban prometedores, ya que la sensibilidad contra antígenos de alto peso molecular no alcanzaba ni el 15% en pacientes con derrame pleural tuberculoso (80), por lo que se buscaron identificar antígenos peptídicos de menos tamaño (81, 82). La infección por VIH no parecía modificar la sensibilidad de estos métodos multiantigénicos, en la detección de pacientes con TB pleural, ya que esta enfermedad comenzó a tomar relevancia en los fenómenos de reactivación tuberculosa (82).
Los anticuerpos contra antígenos tuberculosos han sido encontrados elevados en pacientes con TB pleural; sin embargo no han demostrado su utilidad debido a falsos positivos con otras entidades (83, 84). Variaciones en respuestas a anticuerpos específicos contra antígenos de micobacterias en diferentes poblaciones humanas puede estar relacionado a la presencia de distintos antígenos de histocompatibilidad como HLA-DR (del inglés human leukocyte antigens relacionado con DR). Pruebas designadas a detectar respuestas a un antígeno particular pueden mostrar variabilidad geográfica importante y una sensibilidad limitada, por lo cual se han creado pruebas multi-antigénicas para resolver estos problemas (84).
El uso de múltiples antígenos incrementa la sensibilidad con respecto al uso de una solo banda como la respuesta contra el antígeno 38 kDa; sin embargo esto es aún controversial. Esto también varía según el isotipo. Un diagnóstico definitivo de TB pulmonar debe establecerse solamente en pacientes que muestran inmunoglobulina G (IgG) positivo más IgA o IgM, dando una eficacia diagnóstica de 90 por ciento (85). Esto puede aplicarse de forma similar con la determinación de IgM en el líquido pleural contra el antígeno A60, independientemente de si la población se encuentra vacunada con BCG, un agente común que altera la interpretación de las pruebas serológicas diagnósticas (86). De forma similar, se han encontrado títulos detectables de anticuerpos anti 38 kDa y 16 kDa, del isotipo IgG, tanto en líquido cefalorraquídeo así como líquido pericárdico. Estas determinaciones fallan a nivel pleural, pero podrían utilizarse en conjunto con otros métodos (87).
En general, las pruebas serológicas tienen un alto valor predictivo negativo, lo que los hace potencialmente útiles como pruebas para descartar TB activa. La prueba de ELISA puede usarse como una prueba de soporte en el diagnóstico de laboratorio de TB extrapulmonar activa en adultos, sin discriminar la zona afectada. Sin embargo, niveles séricos de IgG contra el 38 kDa puede ser útil en el diagnóstico de TB con un alto valor predictivo positivo (88, 89), así como una prueba de ELISA para detectar antígenos circulantes para PPD negativa no excluye TB pero un resultado positivo es indicativo de enfermedad. Además, se han intentado el desarrollo de ensayos en saliva.
Se ha demostrado la presencia de células T secretoras de IFN-g específicas para el antígeno ESAT-6 en líquidos pleurales de pacientes con TB, en una concentración mucho más elevada que en sangre periférica, estando ausentes en derrames de otras etiologías (90). Esta producción logra discriminar frente a pacientes con lepra, produciendo una reacción cruzada con vacunación BCG incluso menor que el propio PPD (90).
Se ha llegado a la caracterización de antígenos recombinantes como el MPT-64 y el MT-10.3, en cuyo caso la reactividad de IgA en el derrame pleural muestra una sensibilidad similar a los estudios anatomopatológicos, considerados en muchos casos como uno de los estándares junto con el cultivo (91).
La importancia de encontrar evidencia en cuanto a la inmunogenicidad de los antígenos de M. tuberculosis, radica no solo en el diagnóstico, sino que podría trasladarse a la capacidad de crear vacunas que produzcan protección a nivel de lugares extrapulmonares frecuentes, como lo es el espacio pleural (92). Al igual que en otras ubicaciones, falta camino por recorrer, y se perfilan siempre como elementos accesorios al diagnóstico, colaborando al aumentar la probabilidad diagnóstica en un paciente o descartarla en grupos poblacionales, dependiendo del caso (92).
UTILIDAD DE LOS ANTÍGENOS SECRETADOS DE M. tuberculosis EN EL DIAGNÓSTICO DE LA INFECCIÓN EN SUS DIVERSAS ETAPAS DE EVOLUCIÓN
La identificación de estos individuos con infección latente es crucial para el control de la transmisión de la enfermedad y la eliminación de la TB; esto ha impulsado la investigación en agentes determinantes para el diagnóstico temprano de la infección cuya importancia epidemiológica es incalculable (1, 2).
La invención en los campos de inmunología, microbiología y medicina se relaciona con los métodos para la detección temprana y rápida de la enfermedad por micobacterias en los seres humanos basados en la presencia de anticuerpos “tempranos” contra los antígenos micobacterianos que no han sido previamente reconocidos para este propósito. Análisis de tales anticuerpos en preparaciones purificadas de micobacterias que contienen tales antígenos tempranos permite el diagnóstico de TB (8, 10).
Las pruebas basadas en PPD no poseen siempre la capacidad para distinguir entre la infección por M. tuberculosis, la vacunación de BCG con Mycobacterium bovis, o la exposición a micobacterias saprófitas ambientales. Pinxteren y colaboradores en el 2000 estudiaron el potencial de diagnóstico de dos antígenos específicos de M. tuberculosis (ESAT-6 y CPF-10) en animales de experimentación así como durante la infección natural en seres humanos y ganados (65). Ambos antígenos se identificaban frecuentemente in vivo e in vitro basándose en la inducción de respuestas de tipo hipersensibilidad retardada y la capacidad de estimular la producción por parte de los linfocitos de IFN-g. Con esta combinación de ESAT-6 y de CPF10 encontraron una alta sensibilidad y especificidad en función del diagnóstico. En seres humanos, la combinación tenía una alta sensibilidad (73%) y una especificidad más elevada (93%) que PPD (7%) (93).
El antígeno PPD, el cual es una mezcla mal definida de antígenos micobacterianos que contiene proteínas secretadas y somáticas, ha sido utilizado para el diagnóstico de TB y en estudios epidemiológicos durante muchos años, utilizándose como reactivo in vivo de la prueba cutánea en seres humanos y ganado. Se han investigado otras alternativas para este tipo de pruebas cutáneas, en 1990 fue desarrollada una prueba de diagnóstico in vitro para la infección por M. bovis en ganado, basado en la detección del IFN-g liberado en los cultivos de sangre entera incubados in vitro con PPD (94). En 1994, esta prueba fue adaptada para el diagnóstico de la infección por M. tuberculosis y M. avium en seres humanos, usando otra vez el PPD-tipo antígenos (94). PPD contiene muchos antígenos micobacterianos, algunos de los cuales se comportan como patógenos de micobacterias que pertenecen al complejo M. tuberculosis (M. tuberculosis, M. bovis, y M. africanum), las micobacterias no tuberculosas ambientales, y el sustrato de la vacuna M. bovis bacille Calmette-Guerin (BCG). Aunque la sensibilidad a PPD es una importante ayuda en el diagnóstico de TB y puede dar una indicación de exposiciones anteriores a micobacterias, a menudo es imposible que éste sea capaz de distinguir entre la vacunación y la exposición de BCG o infección por micobacterias no tuberculosas ambientales o por M. tuberculosis. Ha sido evidente que es necesario superar las limitaciones que trae consigo el uso de PPD para conseguir un reactivo nuevo para el diagnóstico, con alta especificidad para M. tuberculosis y M. bovis (94).
Las pruebas de serología no han demostrado suficientemente utilidad en le diagnóstico de la infección en sus diversas etapas, sin embargo, se han investigado extensivamente, lo cual ha permitido una mejor comprensión de la respuesta humoral en TB y la identificación de nuevas proteínas específicas de M. tuberculosis. La respuesta inmunitaria heterogénea observada, junto con la ausencia de reactividad a un solo antígeno o a un grupo específico de antígenos, sugiere la existencia de variaciones entre individuos, así como influencia de la etapa de la enfermedad (95). La mezcla de antígenos mejoraría la prueba de funcionamiento permitiendo el reconocimiento simultáneo de los diversos epítopes exhibidos en cada uno de las proteínas empleadas (95). El perfil del anticuerpo y su reactividad se ha estudiado exhaustivamente usando diversas preparaciones del antígeno (95).
Según estudios hechos por Beck y colaboradores en 2005, se demostró que incluso antes de la iniciación del tratamiento, el 57% de los pacientes presentó anticuerpos contra la 6 kDa, y después de dos meses de la terapia el 73% de los pacientes produjeron anticuerpos específicos contra 16 kDa y fracciones de 38 kDa. Después de este aumento inicial, seguía habiendo los niveles del anticuerpo constante hasta el final de la terapia (96). Datos similares fueron obtenidos en estudios realizados identificando la respuesta específica al antígeno 38-kDa. No fue observado ningún cambio en el perfil de la reactividad que permitiría determinar la evolución del tratamiento (96). Por otro lado, la proteína 26 kDa antes y después del tratamiento era reconocida en el 98% de los pacientes estudiados, el 40% de los contactos y el 33% de los pacientes con otras enfermedades del pulmón también reaccionaban con estos antígenos (96).
La respuesta al 16 kDa, o al antígeno 6 kDa era más alta en pacientes (50,9% y 57%, respectivamente) que en los contactos (16% para ambos antígenos) o sanos (6,6% y 3%, respectivamente). La presencia de estos anticuerpos en pacientes con TB se han asociado a un pronóstico más favorable o con TB espontáneamente curada, puesto que son estos anticuerpos los primeros en desaparecer después de 2 años del tratamiento (97). Se ha reportado un aumento en los anticuerpos de anti-14 kDa y anti-16 kDa para individuos sanos después de la exposición ocupacional, y para los contactos directos de pacientes con TBC. Así, la presencia de estos anticuerpos en contactos puede sugerir la infección por M. tuberculosis, que no es clínica ni evidente (98).
A pesar de que la secuencia de codificación para el antígeno ESAT-6 es conocida (Tabla II), poco se sabe sobre la respuesta de anticuerpo contra este antígeno. El antígeno posee varios epítopes específicos reconocidos por las células T que inducen una respuesta celular y conducen al aumento de IFN-g en pacientes con infección subclínica o con TB activa, pero no en individuos sanos no expuestos. Esta respuesta transmitida por células también ha estado asociada al riesgo creciente de la enfermedad (99). Un estudio reciente demostró que la respuesta humoral a ESAT-6 se puede asociar con TB inactiva pero no con la TB activa (100).
Un estudio reciente que evaluó la respuesta humoral a los antígenos recombinantes de M. tuberculosis, 38 kDa, 14 kDa y ESAT-6, demostró la asociación de los últimos dos antígenos con riesgo en los factores desencadenantes de la enfermedad activa, lo cual sugiere la posibilidad de identificar el subconjunto de personas con infección de TB latente, es decir, que puede estar en alto riesgo para desarrollar enfermedad activa (100). Estos datos proporcionan evidencia importante aunque ellos no pueden ser considerados definitivos, en vista de que el reconocimiento heterogéneo de los antígenos por los anticuerpos del suero en TB puede ser el resultado de factores múltiples, entre los cuales está el uso de la vacunación con BCG (101).
CONCLUSIONES
Los hallazgos reportados en relación a la utilidad de los diversos antígenos de M. tuberculosis, sugieren que los antígenos ESAT-6, CPF-10, 27 kDa y 38 kDa están relacionados con la estimulación de la secreción de citocinas tipo Th1 (IFN-g y TNF- a) y la producción de óxido nítrico, todos estos de gran importancia para generar la respuesta granulomatosa y una inmunidad mediada por células efectiva contra la infección por M. tuberculosis. Los antígenos ESAT-6, CPF-10, 40 kDa y MPT-64 podrían ser usados para crear métodos diagnósticos más sensibles y específicos, y antígenos como MPT-64, Ag85 y 27 kDa deben ser mejor estudiados para ser utilizados como medios profilácticos contra la TB pulmonar.
REFERENCIAS
1. World Health Organization (WHO) Report 2007. Global TB control, Survillance, Planning, Financing. Geneva WHO: WHO/ HTM/TB/2005. Geneva. [ Links ]
2. Meya DB, McAdam KPWJ. The TB pandemic: an old problem seeking new solutions. J Int Med 2007; 261:309-329. [ Links ]
3. Melbye M. The natural history of human T lymphotropic virus-III infection: the cause of AIDS. British Med J 1986; 292:5-12. [ Links ]
4. Sharma SK, Mohan A. Multidrug-resistant tuberculosis: A menace that threatens to destabilize tuberculosis control. Chest 2006; 130:261-272. [ Links ]
5. Organización Panamericana de la Salud (OPS). Boletín Epidemiológico: El control de la tuberculosis en las Américas. 1998; 9(2):1-15. [ Links ]
6. American Thoracic Society. Diagnostic standards and classification of tuberculosis in adults and children. Am J Respir Crit Care Med 2000; 161:1376-1395. [ Links ]
7. American Thoracic Society and Centers for Disease Control. Diagnosis standard and classification of tuberculosis. Am Rev Respir Dis 1991; 142:725-735. [ Links ]
8. Araujo Z, de Waard JH, Fernández de Larrea C, López D, Fandiño C, Maldonado A, Hernández E, Ocaña Y, Ortega R, Singh M, Ottenhoff THM, Arend SM, Convit J. Study of the Antibody Response against Mycobacterium tuberculosis Antigens in Warao Amerindian Children in Venezuela. Mem Inst Oswaldo Cruz 2004; 99(5):517-524. [ Links ]
9. Ginsberg AM. The tuberculosis epidemic. Scientific challenges and opportunities. Public Health Rep 1998; 113:128-136. [ Links ]
10. Bothamley G. Serological diagnosis of tuberculosis. Eur Resp J 1995; 8(20):676-688. [ Links ]
11. Castro CM, Porras TB, Guerrero MI, León CI, Mojica MA, Lara M, Parada MC, Espitia C. Utilidad de una prueba serológica multiantigénica en el diagnóstico de tuberculosis. Biomédica 2005; 258:222-228. [ Links ]
12. Wang, BL, Xu Y, Li ZM, Xu YM, Weng XH, Wang HH. Antibody response to four secretory proteins from Mycobacterium tuberculosis and their complex antigen in TB patients. Int J Tuberc Lung Dis 2005; 9: 1327-1334. [ Links ]
13. Fernández de Larrea C, de Waard JH, Araujo Z. The secretory immunoglobulin a response to mycobacterium tuberculosis in a childhood population. Rev Soc Bras Med Trop 2006; 39(5):456-461. [ Links ]
14. Mukherjee S, Daifalla N, Zhang Y, Douglass J, Brooks L, Vedvick TH. Potential serologic use of a recombinant protein that is a replica of a Mycobacterium tuberculosis protein found in the urine of infected mice. Clin Diag Lab Immunol 2004; 11:280-286. [ Links ]
15. Rivas-Santiago B, Vieyra-Reyes P, Araujo Z. The Cellular Immune Response in Pulmonary Tuberculosis. Invest Clin 2005; 46(4):391-412. [ Links ]
16. Skamene E. Genetic control of host resistance to mycobacterial infection. Curr Top Microbiol Immunol 1986; 124:49-66. [ Links ]
17. Jouanguy E, Doffinger R, Dupuis S, Pallier Altare F, Casanova LJ. IL-12 and IFN-g host defense against mycobacteria and salmonella in mice and men. Curr Op Immunol 1999; 11:346-351. [ Links ]
18. Milburn HJ. Primary tuberculosis. Curr Opin Pulm Med 2001; 7:133-141. [ Links ]
19. Kaufmann SHE, Ulrich ES. A dangerous liaison between two major killer: Mycobacteriun tuberculosis and HIV target dendritic cells through DC-SIGN. J Exp Med 2003; 197:1-5. [ Links ]
20. Rivas-Santiago B, Schwander S, Sarabia C, Diamond G, Klain-Patel M, Hernández-Pando R, Ellner J, Sada E. Human b-defensin-2 is expressed and associated with Mycobacterium tuberculosis during infection of human aleveolar epithelial cells. Infect Immun 2005; 73(8):4505-4511. [ Links ]
21. Jung SB, Yang CS, Lee JS, Shin AR, Jung SS, Son JW, Harding CV, Kim HJ, Park JK, Paik TH, Song CH, Jo EK. The Mycobacterial 38-kilodalton glycolipoprotein antigen activates the mitogen-activated protein kinase pathway and release of proinflammatory cytokines through Toll-like receptors 2 and 4 in human monocytes. Infect Immun 2006; 74(5): 2686-2696. [ Links ]
22. Harth G, Clemens DL, Horwitz MA. Glutamine synthetase of Mycobacterium tuberculosis: extracellular release and characterization of its enzymatic activity. Proc Natl Acad Sci USA 1999; 91:9342-9346. [ Links ]
23. Keane J, Katarzyna M, Balcewicz S, Remold H. Infection by Mycobacterium tuberculosis promotes human alveolar macrophages apoptosis. Infect Immun 1997; 298:298-304. [ Links ]
24. Li B, Rossman MD, Imir T, Oner-Eyuboglu F, Lee ChW, Biancaniello R, Carding SR. Disease-specific changes in gd T cell repertorie and function in patients with pulmonary tuberculosis. J Immunol 1996; 157:4222-4229. [ Links ]
25. Li. B, Bassiri H, Rossman MD, Kramer P, Oner Eyuboglu F, Torres M, Sada E, Imir T, Carding SR. Involvement of the Fas/Fas Ligand pathway in activation-induced cell death of Mycobacteria-reactive human gd T cells: A mechanism for the loss of gd T cell in patients with pulmonary tuberculosis. J Immunol 1998; 161:1558-1567. [ Links ]
26. Nicholson S, Bonecini-Almeida M, Lapa e Silva JR, Nathan C, Xie QW, Mumford R. Inducible nitric oxide synthase in pulmonary alveolar macrophages from patients with tuberculosis. J Exp Med 1996; 183: 2293-2302. [ Links ]
27. Tan JS, Canaday DH, Boom WH, Balaji KN, Schwander SK, Rich EA. Human alveolar T cell response to Mycobacterium tuberculosis antigens: role for CD4+ and CD8+ cytotoxic T Cells and relative resistance of alveolar macrophages to lysis. J Immunol 2000; 159:290-297. [ Links ]
28. Ulrichs T, Branch Moody D, Grant E, Kaufmann SHE, Porcelli SA. T-cell responses to CD1-presented lipid antigens in humans with Mycobacterium tuberculosis. Infect Immun 2003; 71:3076-3087. [ Links ]
29. Yoshida N. Role of gamma/delta T-cells in the peripheral blood of patients with pulmonary tuberculosis. Kurume Med J 2001; 48:175-181. [ Links ]
30. Feng CG, Jankovic D, Kullberg M, Cheever A, Scanga CA, Hieny S. Maintenance of pulmonary Th1 effector function in chronic tuberculosis requires persistent IL-12 production. J Immunol 2003; 174: 4185-4192. [ Links ]
31. Ottenhoff TH, Kumararatne D, Casanova JL. Novel human immunodeficiencies reveal the essential role of type-1-citokines in immunity to intracellular bacteria. Immunol Today 1998; 19:491-494. [ Links ]
32. Lowrie DB, Tascon RE, Bonato VL, Lima VM, Faccioli LH. Therapy of tuberculosis in mice by DNA vaccination. Nature 1999; 400:269-271. [ Links ]
33. Cooper AM, Dalton DK, Stewart TA, Griffen JP, Russell DG, Orme IM. Disseminated tuberculosis in interferon-gamma gene disrupted mice. J Exp Med 1993; 178:2243-2248. [ Links ]
34. Dupuis S, Doffinger R, Picar C, Fieschi C, Altare F, Jouanguy E, Abel L, Casanova LJ. Human interferon g mediated immunity is a genetically controlled continuous trait that determines the outcome of mycobacterial invasion. Immunol Rev 2000; 178:129-137. [ Links ]
35. Fenhalls G, Wong A, Bezuidenhout J, van Helden P, Bardin P, Lukey PT. In situ production of gamma interferon, interleukin-4, and tumor necrosis factor alpha mRNA in human lung tuberculous granuloma. Infect Immun 2000; 68: 2827-2836. [ Links ]
36. Bergeron A, Bonay M, Kambouchner M, Lecossier D, Riquet M, Soler P, Hance A, Tazi A. Cytokine patterns in tuberculous and sarcoid granulomas: correlations with histopathologic features of the granulomatous response. J Immunol 1997; 159: 3034-3043. [ Links ]
37. Pai RK, Pennini ME, Tobian AA, Canaday DH, Boom WH, Harding CV. Prolonged toll-like receptor signaling by Mycobacterium tuberculosis and its 19-kilodalton lipoprotein inhibits gamma interferon-induced regulation of selected genes in macrophages. Infect Immun 2004; 72(11): 6603-6614. [ Links ]
38. Lin Y, Zhang MF, Hofman FM, Gong J, Barnes PF. Absence of a prominent Th2 cytokine response in human tuberculosis. Infect Immun 1996; 64:1351-1356. [ Links ]
39. Hernandez PR, Rook GA. The role of TNF-alpha in T-inflammation depends on the Th1/Th2 cytokine balance. Immun 1994; 82:591-595. [ Links ]
40. Arriaga AK, Orozco EH, Aguilar LD, Rook GA, Hernandez Pando R. Immunological and pathological comparative analysis between experimental latent tuberculous infection and progressive tuberculosis. Clin Exp Immunol 2002(2); 128:229-237. [ Links ]
41. Munk ME, Mayer P, Anding P, Feldmann K, Kaufmann SH. Increased numbers of Interleukin-12-producing cells in human tuberculosis. Infect Immun 1996; 64: 1078-1080. [ Links ]
42. Gong JH, Zhang M, Modlin RL, Linsley PS, Iyer D, Lin Y, Barnes PF. Interleukin-10 downregulates Mycobacterium tuberculosis-induced Th1 responses and CTLA-4 expression. Infect Immun 1996; 64(3):913-918. [ Links ]
43. VanHeyningen TK, Collins HL, Russell DG. IL-6 produced by macrophages infected with Mycobacterium species suppresses T cell responses. J Immunol 1997; 158:330-337. [ Links ]
44. Sauders BM, Frank AA, Orme IM, Cooper AM. Interleukin-6 induces early gamma interferon production in the infected lung but is not required for generation of specific immunity to Mycobacterium tuberculosis infection. Infect Immun 2000; 68: 3322-3326. [ Links ]
45. Hirsch CS, Ellner JJ, Blinkhorn R, Toossi Z. In vitro restoration of T cell responses in tuberculosis and augmentation of monocyte effector function against Mycobacterium tuberculosis by natural inhibitors of transforming growth factor beta. Proc Natl Acad Sci USA 1997; 94:3926-3931. [ Links ]
46. Rojas M, Olivier M, Gros P, Barrera LF, Garcia LF. TNF-alpha and IL-10 modulate the induction of apoptosis by virulent Mycobacterium tuberculosis in murine macrophages. J Immunol 1999; 162:6122-6131. [ Links ]
47. Rhoades ER, Cooper AM, Orme IM. Chemokine response in mice infected with Mycobacterium tuberculosis. Infect Immun 1995; 63:3871-3877. [ Links ]
48. Sadek MI, Sada E, Toossi Z, Schwander SK, Rich EA. Chemokines induced by infection of mononuclear phagocytes with mycobacteria and present in lung alveoli during active pulmonary tuberculosis. Am J Respir Cell Mol Biol 1998; 19:513-521. [ Links ]
49. Koneman W. En: Med Panamer Eds. Diagnóstico microbiológico de mycobacterias. 1992. p 62. [ Links ]
50. Rose N. Manual of clinical laboratory in immunology. Citokines and immune cells products. NOMBRE REVISTA 1997; 5:536. [ Links ]
51. Chang Z, Choudary A, Lathigra R, Quiocho FA. The immunodominant 38-kDa lipoprotein antigen of Mycobacterium tuberculosis is a phosphate-binding protein. J Biol Chem 1994; 269:1956-1958. [ Links ]
52. Rees AD, Roman E, Moreno C. The effect of lipoylation on human epitope specific CD4 T-cell recognition of the 19 kDa mycobacterial antigen. Immun 1993; 80: 407-414. [ Links ]
53. Wiker HG, Harboe M. The antigen 85 complex: a majors secretion product of Mycobacterium tuberculosis. Microbiol Res 1992; 56:648-661. [ Links ]
54. Rojas EO, Cabrera CR. Desarrollo de inmunógenos y vacunas contra lepra y tuberculosis. Vacunas 2000; 249-260. [ Links ]
55. Pérez TR. Patología de las enfermedades Infecciosas. Princip Patol 1991; 3:325-329. [ Links ]
56. Jackett PS, Bothamley GH, Batra HV, Mistry A, Young DB, Ivanyi J. Specificity of antibodies to immunodominant mycobacterial antigens in pulmonary tuberculosis. J Clin Microbiol 1988; 26(11): 2313-2318. [ Links ]
57. Agrewala JN, Mishra GC. A 38-kDa antigen of Mycobacterium tuberculosis predominantly induces the secretion of interleukin-2, interferon-gamma and IgG2a antibodies. Microbiol Immunol 1995; 39(10):801-808. [ Links ]
58. Anderson PA, Daniel TM. The isolation by immunosorbent affinity chromatography and physicochemical characterization of Mycobacterium tuberculosis antigen 5. Am Rev Respir Dis 1978; 117:533-539. [ Links ]
59. Quiocho FA, Chang Z, Primm TP, Jakana J, Lee IH, Serysheva I, Chiu W, Gilbert HF. Mycobacterium tuberculosis 16-kDa antigen (Hsp16.3) functions as an oligomeric structure in vitro to suppress thermal aggregation. J Biol Chem 1996; 271:7218-7223. [ Links ]
60. Imaz M, Zerbini SE. Antibody response to culture filtrate antigens of Mycobacterium tuberculosis during and after treatment of tuberculosis patients. Intern J Tuberc Lung Dis 2000; 4:562-569. [ Links ]
61. Pai RK, Pennini M, Tobian AA, Canaday DH, Boom WH, Harding CV. Prolonged Toll-like Receptor signaling by Mycobacterium tuberculosis and its 19-kDa lipoprotein inhibits Interferon-g-induced regulation of selected genes in macrophages. Infect Immun 2004; 72(11):6603-6614. [ Links ]
62. Neufert C, Pai RK, Noss EH, Berger M, Boom WH, Harding CV. Mycobacterium tuberculosis 19-kDa lipoprotein promotes neutrophil activation. J Immunol 2001; 167(3):1542-1549. [ Links ]
63. Scarpellini P, Tasca S, Galli L, Beretta A, Lazzarin A, Fortis C. Selected Pool of Peptides from ESAT-6 and CFP-10 Proteins for Detection of Mycobacterium tuberculosis infection. J Clin Microbiol 2004; 42(8): 3469-3474. [ Links ]
64. Roberts MM, Coker RA, Fossati G, Mascagni P, Anthony R, Coates M, Wood SP. Mycobacterium tuberculosis Chaperonin 10 Heptamers Self-Associate through Their Biologically Active Loops. J Bacteriol 2003; 185(14):4172-4185. [ Links ]
65. Pinxteren LA, Ravn P, Agger EM, Pollock J, Andersen P. Diagnosis of Tuberculosis Based on the Two Specific Antigens ESAT-6 and CFP10. Clin Diagn Lab Immunol 2000; 7(2):155-160. [ Links ]
66. Trajkovic V, Singh G, Singh B, Singh S, Sharma P. Effect of Mycobacterium tuberculosis-specific 10-kilodalton antigen on macrophage release of tumor necrosis factor alpha and nitric oxide. Infect Immun 2002; 70(12):6558-6566. [ Links ]
67. Arend SM, Engelhard AC, Groot G, Boer DK, Andersen P, Ottenhoff TH, Jaap TD. Tuberculin Skin Testing Compared with T-Cell Responses to M. tuberculosis-Specific and Nonspecific Antigens for Detection of Latent infection in Persons with Recent Tuberculosis Contact. Clin Diagn Lab Immunol 2001; 8(6):1089-1096. [ Links ]
68. Cardoso F, Antas P, Milagres A, Geluk A, Franjen K, Oliveira E. T-Cell Responses to the M. tuberculosis-Specific Antigen ESAT-6 in Brazilian Tuberculosis Patients. Infec Immun 2002, 70:6707-6714. [ Links ]
69. Huebner RE. BCG Vaccination the Control of Tuberculosis in: Tuberculosis. Ed. Barry Bloom. American Society for Microbiology; 1994 p 263-279. [ Links ]
70. Harth G, Horwitz MA, Tabatadze D, Zamecnik PC. Targeting the Mycobacterium tuberculosis 30/32-kDa mycolyl tranferase complex as therapeutic strategy against tuberculosis: Proof of principle by using antisense technology. PNAS 2002; 99:15614-15619. [ Links ]
71. Kremer L, Baulard A, Estaquier J, Content J, Capron A, Locht C. Analysis of the Mycobacterium tuberculosis 85A antigen promoter region. J. Bacteriol 1995; 177(3):642-653. [ Links ]
72. Hutter B, Singh M. Properties of the 40 kDa antigen of Mycobacterium tuberculosis, a functional L-alanine dehydrogenase. Biochem J 1999; 343:669-672. [ Links ]
73. Hovav AH, Mullerad J, Davidovitch L, Fishman Y, Bigi F, Cataldi A, Bercovier H. The Mycobacterium tuberculosis recombinant 27-kilodalton lipoprotein induces a strong Th1-type immune response deleterious to protection. Infect Immun 2003; 71(6):3146-3154. [ Links ]
74. Seibert AF, Haynes J Jr, Middleton R, Bass JB. Tuberculous pleural effusion: Twenty- year experience. Chest 1991; 99: 883-886. [ Links ]
75. Promkiamon B. Comparison of various diagnostic tests in tuberculous pleuritis. Thorac Soc Thai News 1997; 6:5-9. [ Links ]
76. Levine H, Metzger W, Lacera D, Kay L. Diagnosis of tuberculous pleurisy by culture of pleural biopsy specimen. Arch Intern Med 1970; 126:269-271. [ Links ]
77. Sahn SA. State of the art. The pleura. Am Rev Respir Dis 1988; 138:184-234. [ Links ]
78. Fujiwara H, Okuda Y, Fukukawa T, Tsuyuguchi I. In vitro tuberculin reactivity of lymphocytes from patients with tuberculous pleurisy. Infect Immun 1982; 35(2): 402-409. [ Links ]
79. Ellner JJ, Barnes PF, Wallis RS, Modlin RL. The immunology of tuberculous pleurisy. Semin Respir Infect 1988; 3(4):335-342. [ Links ]
80. Sada E, Ferguson LE, Daniel TM. An ELISA for the serodiagnosis of tuberculosis using a 30,000-Da native antigen of Mycobacterium tuberculosis. J Infect Dis 1990; 162(4):928-931. [ Links ]
81. Barnes PF, Mehra V, Rivoire B, Fong SJ, Brennan PJ, Voegtline MS, Minden P, Houghten RA, Bloom BR, Modlin RL. Immunoreactivity of a 10-kDa antigen of Mycobacterium tuberculosis. J Immunol 1992; 148(6):1835-1840. [ Links ]
82. Lorgat F, Keraan MM, Ress SR. Compartmentalization of the cellular immune response to the recombinant 65 kDa protein of Mycobacterium bovis BCG in patients with tuberculous pleuritis. Reg Immunol 1992; 4(1):12-17. [ Links ]
83. Chierakul N, Damrongchokpipat P, Chaiprasert A, Arjratanakul W. Antibody detection for the diagnosis of tuberculous pleuritis. Int J Tuberc Lung Dis 2001; 5(10):968-972. [ Links ]
84. Niculescu D, Stefanoiu V, Stavri H, Teodor I, Calin C, Teodor M. Serodiagnosis of extrapulmonary tuberculosis by enzyme- linked immunosorbent assay (ELISA). Int J Tuberc Lung Dis 2000; 80: 131-140. [ Links ]
85. Demkow U, Zielonka TM, Strzalkowski J, Michalowska-Mitezuk D, Augustynowicz-Kopec E, Bialas-Chromiec B. Diagnostic value of IgG antibody levels against 38kDa mycobacterial antigen. Vojnosanit Pregl 2002; 59:23-28. [ Links ]
86. Sanchez M. Serodiagnosis in pulmonary tuberculosis. Clinical evaluation. Pediatr Infect Dis J 1989; 8:763-767. [ Links ]
87. Kunter E, Cerrahoglu K, Ilvan A, Isitmangil T, Turken O, Okutan O, Kartaloglu Z, Cavuslu S. The value of pleural fluid anti-A60 IgM in BCG-vaccinated tuberculous pleurisy patients. Clin Microbiol Infect 2003; 9(3):212-220. [ Links ]
88. Demkow U, Filewska M, Bialas B, Szturmowicz M, Zielonka T, Wesolowski S, Kus J, Ziolkowski J, Augustynowicz-Kopec E, Zwolska Z, Skopiniska-Rabewska E, Rowinska-Zakrzewska E. Antimycobacterial antibody level in pleural, pericardial and cerebrospinal fluid of patients with tuberculosis. Pneumonol Alergol Pol 2004; 72(3-4):105-110. [ Links ]
89. Perkins MD, Conde MB, Martins M, Kritski AL. Serologic diagnosis of tuberculosis using a simple commercial multiantigen assay. Chest 2003; 123:107-112. [ Links ]
90. Wilkinson KA, Wilkinson RJ, Pathan A, Ewer K, Prakash M, Klenerman P, Maskell N, Davies R, Pasvol G, Lalvani A. Ex vivo characterization of early secretory antigenic target 6-specific T cells at sites of active disease in pleural tuberculosis. Clin Infect Dis 2005; 40(1):184-187. [ Links ]
91. Kaisermann MC, Sardella IG, Trajman A, Coelho LV, Kampfer S, Jonas F, Singh M, Saad MH. IgA antibody responses to Mycobacterium tuberculosis recombinant MPT-64 and MT-10.3 (Rv3019c) antigens in pleural fluid of patients with tuberculous pleurisy. Int J Tuberc Lung Dis 2005; 9(4):461-466. [ Links ]
92. Jung YJ, North RJ. Immunity to tuberculosis. Annu Rev Immunol 2004; 22:599-623. [ Links ]
93. Ferrara G, Losi M, Meacci M. Routine Hospital Use of a New Commercial Whole Blood Interferon-(gamma) Assay for the Diagnosis of Tuberculosis Infection. Am J Respir Crit Care Med 2005; 172(5):631-635. [ Links ]
94. Fogan L. PPD antigens and the diagnosis of mycobacterial diseases. Arch Intern Med 1969; 124:49-54. [ Links ]
95. Lyashchenko KP, Singh M, Colangeli R, Gennaro ML. A multi-antigen print immunoassay for the development of serological diagnosis of infectious diseases. J Immun Meth 2000; 242:91-100. [ Links ]
96. Beck ST, Leite OM, Arruda RS, Ferreira AW. Humoral response to low molecular weight antigens of Mycobacterium tuberculosis by tuberculosis patients and contact. Braz J Med Biol Res 2005; 38:587-596. [ Links ]
97. Camarena JJ, Franco J, Nogueira JM, Blanquer R, Ruiz MJ, Marin J. Serological response (Western blot) to fractions of Mycobacterium tuberculosis sonicate antigen in tuberculosis patients and contacts. Tuberc Lung Dis 2001; 5:958-962. [ Links ]
98. Bothamley GH, Rudd R, Festenstein F, Ivanyi J. Clinical value of the measurement of Mycobacterium tuberculosis specific antibody in pulmonary tuberculosis. Thorax 1992; 47:270-275. [ Links ]
99. Doherty TM, Demissie A, Olobo J, Wolday D, Britton S, Eguale T, Ravn P, Andersen P. Immune responses to the Mycobacterium tuberculosis-specific antigen ESAT-6 signal subclinical infection among contacts of tuberculosis patients. Journal of Clin Microbiol 2002; 40:704-706. [ Links ]
100. Silva VMC, Kanujia G, Gennaro ML, Menzies D. Factors associated with humoral response to ESAT-6, 38 kDa and 14 kDa in patients with a spectrum of tuberculosis. Intern J Tuberc Lung Dis 2003; 7:478-484. [ Links ]
101. Pottumarthy S, Wells VC, Morris AJ. A comparison of seven tests for serological diagnosis of tuberculosis. J Clin Microbiol 2000; 38:2227-2231. [ Links ]












 uBio
uBio 

