Investigación Clínica
versión impresa ISSN 0535-5133versión On-line ISSN 2477-9393
Invest. clín v.50 n.4 Maracaibo dic. 2009
Respuesta inmunitaria de la enfermedad de Hansen. Revisión.
Elsa Rada, Nacarid Aranzazu y Jacinto Convit.
Laboratorio de Bioquímica, Instituto de Biomedicina, Universidad Central de Venezuela, Ministerio de Salud. Caracas, Venezuela.
Autor de correspondencia: Elsa Rada. Laboratorio de Bioquímica, Instituto de Biomedicina, Universidad Central de Venezuela, Apartado 4043. Caracas 1010A, Venezuela. Correo electrónico: elsa.rada@gmail.com
Resumen. La enfermedad de Hansen presenta un amplio espectro de manifestaciones clínicas e histopatológicas, las cuales son un reflejo de la naturaleza de la respuesta inmunológica del individuo ante diversos componentes del Mycobacterium leprae. El sistema inmunológico, integrado por la existencia de una inmunidad innata y adaptativa, ofrece protección frente a infecciones de diversas etiologías, entre ellas las bacterianas. Por supuesto las bacterias han logrado desarrollar múltiples estrategias para evadir las defensas del hospedador, que se basan en mecanismos algunos muy complejos y otros más simples, pero con una sola finalidad de “resistir” el ataque del hospedador y lograr sobrevivir. Estudios realizados en la enfermedad de Hansen han podido determinar los diferentes componentes que puedan estar actuando tanto en la inmunidad innata cómo en la adquirida. En este trabajo se trata de resumir algunos estudios recientes en la enfermedad de Hansen con mayor énfasis en el área de inmunología, sin dejar de considerar que toda enfermedad debe estar muy ligada a otros aspectos tan igual de importantes cómo son los sociales, ambientales y otros de muy difícil resolución en un laboratorio.
Palabras clave: Enfermedad de Hansen, respuesta inmune, inmunidad innata, inmunidad adquirida, citocinas, aspectos genéticos, estados reaccionales.
Immune response of Hansen´s disease. Review.
Abstract. Hansen’s disease presents a wide spectrum of clinical and histopathological manifestations that reflect the nature of the immunological response of the host towards diverse Mycobacterium leprae components. The immunological system, composed by both innate and adaptive immunology, offers protection towards infections of various etiologies, among them bacterial. Bacteria, of course, have developed multiple strategies for evading host defenses, based on either very complex or simple mechanisms, but with a single purpose: to “resist” host attacks and to be able to survive. We have tried to summarize some recent studies in Hansen’s disease, with more emphasis in the inmunology area. We think that in the future, all illnesses should also be very strongly related to other important aspects such as the social, environmental and economic, and whose development is not solved in a laboratory.
Key words: Hansen’s disease, immune response, innate immunity, adaptative immunity, genetic influences, reaction leprosy.
Recibido: 21-10-2008. Aceptado: 12-03-2009.
INTRODUCCIÓN
La lepra continúa siendo un problema de salud pública en muchas partes del mundo. El control de la enfermedad ha mejorado con la introducción del tratamiento con la terapia multidroga, reduciendo dramáticamente la prevalencia. Sin embargo, el número de nuevos casos detectado anualmente (incidencia) ha permanecido relativamente constante en los últimos 20 años (1).
En este trabajo se trata de resumir algunos estudios recientes en la enfermedad de Hansen con mayor énfasis en el área de inmunología.
La enfermedad de Hansen presenta un amplio espectro de manifestaciones clínicas e histopatológicas, las cuales son un reflejo de la naturaleza de la respuesta inmunológica del individuo ante el Mycobacterium leprae. Tomando en cuenta la clasificación Ridley-Jopling (2) según su respuesta inmunológica, tenemos la lepra lepromatosa (LL), forma polar severa y progresiva, la cual se caracteriza por un largo período de incubación (latencia) con un promedio de siete años o más y con una expresión histológica de un granuloma formado fundamentalmente por macrófagos no diferenciados, con enormes números de bacilos en el interior de los macrófagos mostrando un grado variable de vacuolización (“células espumosas”). En la lepra tuberculoide (TT), forma polar de cierta resistencia, las lesiones se presentan en menor cantidad con características histopatológicas bien definidas; y está formada por granulomas epitelioides que ocupan toda la dermis con un importante número de linfocitos, sobre todo en la periferia, macrófagos diferenciados (células epitelioides) y células gigantes tipo Langhans. Existe un grupo intermedio: el borderline lepromatoso (BL), el borderline tuberculoide (BT) y la forma intermedia que puede progresar hacia el polo tuberculoide o lepromatoso (2).
INMUNOLOGÍA EN LEPRA
En relación a la población general aproximadamente un 80% es naturalmente resistente a la enfermedad. Del 20% restante, 16-18% constituye el grupo que se define como reactores lentos (grupo tuberculoide) y el 2-4% constituye el grupo de anérgicos (grupo lepromatoso).
El sistema inmunológico, integrado por la existencia de una inmunidad innata y adaptativa, ofrece protección frente a infecciones de diversas etiologías, entre ellas las bacterianas. Por supuesto las bacterias han logrado desarrollar múltiples estrategias para evadir las defensas del hospedador, que se basan en mecanismos algunos muy complejos y otros más simples, pero con una sola finalidad de “resistir” el ataque del hospedador y lograr sobrevivir.
CARACTERÍSTICAS Y COMPONENTES DE LOS ELEMENTOS DE LA INMUNIDAD INNATA
La inmunidad innata constituye la primera línea de defensa que opera en la fase temprana y se refiere a la protección contra la infección que depende de mecanismos eficientes existentes en el hospedador antes de que esta ocurra. Los mecanismos de inmunidad innata son capaces de dar una respuesta rápida pero inespecífica a los microorganismos. Se fundamenta principalmente en:
- La respuesta inflamatoria, con la activación de ciertas vías de complemento y la fagocitosis (participación de diferentes tipos de receptores).
- La respuesta inflamatoria es estimulada por productos bacterianos como polisacáridos, carbohidratos, los peptidoglicanos, activando a los macrófagos, los cuales secretan factor de necrosis tumoral (TNF-a), interleucina 1 (IL-1) y quimiocinas que inducen la infiltración leucocitaria en los focos de infección.
En cuanto a la activación del complemento es un sistema de proteínas del suero y de la superficie celular que interaccionan entre sí y con otras del sistema inmunitario. La activación del complemento tiene múltiples resultados, pues permite: la neutralización, la opsonización, estimula la fagocitosis y conduce a la formación del complejo de ataque a la membrana (CAM), que induce la lisis de las bacterias. Además, los productos liberados del complemento (entre ellos, C5a y C3a, que son anafilotoxinas) participan en las respuestas inflamatorias reclutando y activando leucocitos. Otros compuestos solubles tales como C3b, C3bi y C3d, actúan como opsoninas que facilitan la fagocitosis.
Hay una serie de estudios realizados en la enfermedad de Hansen donde se ha podido profundizar los diferentes componentes que pueden estar actuando en la inmunidad innata.
CÉLULAS PRESENTADORAS DE ANTÍGENOS Y CÉLULAS DENDRÍTICAS
Las células dendríticas (CDs) juegan un importante rol en la respuesta inmune innata frente al M. leprae (3). En la piel y otras superficies epiteliales como la mucosa nasal las CDs pueden ser el primer punto de encuentro con el M. leprae. Algunos investigadores reportan una disminución en la expresión de las moléculas de superficie del complejo mayor de histocompatibilidad (MHC) clase I y clase II en dichas células. Otros investigadores encuentran un aumento en la expresión de las moléculas MHC clase II y en CD40 ligando con la producción de IL-12 cuando las CDs son estimuladas con antígenos de membrana de M. leprae, sugiriendo que la presencia del bacilo completo puede suprimir la interacción entre las CDs y los linfocitos T en las diferentes formas clínicas de la enfermedad (4-6).
RECEPTORES DE RECONOCIMIENTO DE PATRONES
Además, existen los patrones moleculares asociados a patógenos (PAMPs), como los peptidoglicanos, los ácidos lipoteicoicos, los mananos, la endotoxina lipopolisacárido de bacterias Gram negativas, glicanos, ARN de doble cadena y ADN bacteriano (7), que son moléculas expresadas con mucha frecuencia por los patógenos microbianos y no se encuentran en las células del hospedador. Sí son reconocidas por las células presentadoras de antígenos (CPA), ya que éstas utilizan varios receptores de reconocimiento de patrones que expresan en su superficie, entre los cuales se podrían mencionar:
a) Receptor Lectina tipo C
El receptor de la manosa, llamado CD206, que facilita la fagocitosis de los microorganismos, se expresa principalmente en células de la línea mieloide, especialmente macrófagos maduros donde el mayor ligando micobacterial es el lipoaraminomanosa (uno de los componentes de la capsula bacilar) actuando como inmunomoduladora de la respuesta inmune (8). Se conoce que la penetración de la bacteria vía el receptor de la manosa no permite que suceda el desarrollo del estallido respiratorio (9, 10). Otra lectina tipo C son las moléculas de adhesión intercelulares no integrina-específica de las CD (CD-SIGN o llamadas CD209) (11). Algunos investigadores proponen que micobacterias virulentas pueden destruir la función de las CD vía CD-SIGN, posiblemente a través de la inhibición en la producción de IL-12 y en la inducción de IL-10 (12, 13). La Langerina ó CD207 es otro receptor expresado en células de Langerhans que reconoce patrones tipo C donde carbohidratos micobacterianos son endocitados vía langerina y son transportados a los gránulos de Birbeck para su procesamiento (14).
b) Receptores Toll-Like (TLR)
Son una familia de proteínas transmembranas que forma parte de la mayoría de las células que conforman el sistema inmunitario, tales como monocitos/macrófagos y neutrófilos. La evidencia indica que los TLR reconocen distintos componentes microbianos y regulan la activación de la inmunidad innata así como también la adquirida (15) donde los homodímeros TLR2 y TLR4 son los de mayor reconocimiento de micobacterias (16-19). Recientemente, se encontró la participación del receptor TLR2 aunado al papel que desempeña las CD en el reconocimiento frente al M. leprae, de acuerdo a la producción de citocinas (20-22).
La activación de los monocitos provenientes de pacientes TT vía TLR2 inducen a la diferenciación de los macrófagos a CD-SIGN+ y a células dendríticas CD1b+. A diferencia de los monocitos de sangre periférica estimulados con antígenos micobacterianos, solo los macrófagos se diferencian al fenotipo CD-SIGN+. La estimulación de los monocitos vía TLRs es activada tanto en paciente tuberculoides como en lepromatosos pero estos últimos son incapaces de desarrollar una respuesta inmune adaptativa (23).
c) Receptores del complemento
El complemento es un sistema de proteínas del suero y de la superficie celular que interaccionan entre sí y con otras del sistema inmunitario. La activación del complemento tiene múltiples resultados, pues permite la neutralización, la opsonización, estimula la fagocitosis y conduce a la formación del complejo de ataque a la membrana, que induce la lisis de algunas bacterias. Sería pertinente comentar la existencia de receptores del complemento (CR1, CR2, CR3 y CR4 presentes en los fagocitos que permiten unir a las bacterias opsonizadas, cobrando una importante función en el desarrollo de la respuesta protectora del individuo (24).
Evidentemente, la presencia de receptores de la inmunidad innata que facilitan la entrada de los bacilos al interior de células fagocitarias podría conducir a la digestión del bacilo de M. leprae si se activan los mecanismos apropiados. En la ausencia de estos mecanismos, los receptores tendrian el efecto opuesto de facilitar el alojamiento del bacilo en su celula hospedador e iniciar su multiplicación. La observación señalada arriba, la resistencia de un 80% de la población a la infección clínica con M. leprae podría reflejar la alta eficacia de los mecanismos de inmunidad innata en esta enfermedad, siempre asociada con la constitutión génetica del hospedador.
En cuanto a los mecanismos bactericidas que presenta el macrófago frente al M. leprae tenemos la producción de intermediarios reactivos oxigenados y nitrogenados (Fig. 1). La bacteria presenta mecanismos de evasión donde se observa la baja producción de radicales de oxígenos por parte del macrófago en presencia del glicolípido fenólico-1 (25, 26).
ÓXIDO NÍTRICO (ON)
El óxido nítrico (ON) radical libre juega un papel importante en la respuesta inmune innata del huésped; la producción elevada de ON estaría asociada a cuadros inflamatorios agudos. El ON es altamente inestable y se transforma en nitritos/nitratos. Aun cuando escasos, algunos trabajos han demostrado la elevada producción de oxido nítrico en células humanas in vitro. Los macrófagos activados indudablemente juegan un papel importante en la resistencia del huésped a infecciones bacterianas. La iNOS es la enzima sintasa inducible del óxido nítrico responsable de la síntesis sostenida y elevada de ON por macrófagos activados. Muchos datos sobre desórdenes con reacciones pro-inflamatorias Th1 involucran a macrófagos activados y neutrófilos, señalando una actividad destructiva por la expresión de la iNOS, contribuyendo así al daño tisular local (27). El ON podría jugar un papel microbicida que ha sido poco investigado en Hansen (28). La persistencia in vivo por parte de organismos micobacterianos demuestra de un mecanismo enzimático oxido-redox eficiente que contribuye a evadir la respuesta inmune por parte del hospedador (29).
CARACTERÍSTICA Y COMPONENTES DE LA INMUNIDAD ADAPTATIVA
En contraposición con la inmunidad innata y sus mecanismos de defensa, existen otros que también son estimulados tras la exposición a agentes infecciosos pero que son mucho más evolucionados, específicos, diversos, autolimitados y cuya capacidad e intensidad defensiva aumenta después de la exposición repetida a un microorganismo; es decir, ofrecen al individuo “inmunidad protectora” ya que posee memoria. Este tipo de respuesta constituye el sistema inmune adaptativo, el cual a su vez se divide en: Inmunidad celular, en la que participan los linfocitos T e Inmunidad humoral (mediada por anticuerpos).
INMUNIDAD MEDIADA POR CÉLULAS
El reconocimiento de antígenos por parte de los linfocitos T es un evento indispensable para el desarrollo de la respuesta inmune específica. La falta de respuesta en pacientes con lepra lepromatosa es específica para los antígenos de M. leprae (30). Actualmente está en estudio la búsqueda de antígenos micobacterianos específicos que permitan hacer un diagnóstico temprano de las formas resistentes de la lepra (paucibacilares, con pocos bacilos) (31, 32); como se verá mas adelante las formas multibacilares frecuentemente presentan altos niveles de anticuerpos contra el GLP-1 de M. leprae en el momento del diagnóstico.
Desde el punto de vista inmunológico en la respuesta inmune celular, se observa una disminución altamente especifica a M. leprae (33, 34) que se expresa con intensidad variable en las diferentes formas clínicas de la enfermedad, estructurando un espectro que va desde la lepra lepromatosa, en el cuál hay una ausencia total de fenómenos de inmunidad mediada por células hacia el M. leprae, hasta la lepra tuberculoide, donde estan presentes los fenómenos de inmunidad celular cuyo defecto es moderado; es decir, los linfocitos T de sangre periférica de estos pacientes proliferan en respuesta al estímulo con el microorganismo intacto y con el extracto soluble de M. Ieprae (35).
Algunos componentes específicos del M. leprae podrían jugar un papel en el desarrollo de una respuesta protectora mediada por linfocitos T. Recientemente, se ha avanzado en la búsqueda de antígenos que tengan un potencial inmunogénico con la finalidad de desarrollar una inmunidad protectora en el hospedador (36).
Los mecanismos de anergia que suceden específicamente en lepra lepromatosa han sido sujeto a una intensa investigación en los últimos 20 años. Hay mucha discusión sobre la naturaleza del estado de anergia y su inducción; hay varios modelos que soportan este punto. El modelo más relevante es el caracterizado por la dicotomía Th1 y Th2, basado en la producción de perfiles diferentes de citocinas supresoras o protectoras (37-39) Otro modelo postula la presencia de subpoblaciones de linfocitos T (linfocitos reguladores) que son activadas por epítopes supresores del M. leprae (30).
Más recientemente, se conoce que los linfocitos T pueden presentar apoptosis. Hay varias condiciones que la inducen, entre ellas tenemos: la eliminación de ciertas citocinas (40), la presencia del receptor de alta afinidad de TNF-a (41) y la tercera forma de inducción de la apoptosis sería la llamada muerte celular inducida por activación (AICD) (42). La apoptosis ocurre en pacientes con enfermedad de Hansen tanto en pacientes multibacilares cómo en paucibacilares, pero es mucho más frecuentes en pacientes con alta carga bacilar y en pacientes en presencia de reacciones tipo 2 (43-45).
Recientemente, se demostró la importancia de la vía proteasoma-ubiquitina en relación a la respuesta inmune frente a patógenos bacterianos. Células mononucleares provenientes de sangre periférica (PBMC) tratadas con un inhibidor de proteasoma reducen significativamente la apoptosis mediada por el M. leprae e igualmente hubo una disminución de los niveles de producción de TNF-a e IL-10 (46).
POBLACIÓN DE LINFOCITOS T
La relación T CD4+CD3+/ TCD8+CD3+ es de 1.9 a 1 en lesiones de pacientes tuberculoides donde las poblaciones de linfocitos T CD4+ están distribuidas en toda la lesión y las T CD8+ se encuentran en la periferia. En contraste, en las lesiones de pacientes lepromatosos la relación CD4+CD3+/ CD8+CD3+ es de 0.6 a 1 donde los linfocitos T CD8+ CD3+ se distribuye dentro de la lesión (47).
CÉLULAS CITOTÓXICAS
La lisis de la célula blanco por parte de los linfocitos T citotóxicos CD8+CD3+ es realizado por gránulos citotóxicos y perforinas así como la granzyme B, una proteasa de serina. La granulosina es otra proteína antimicrobiana presente en los linfocitos T y está expresada en pacientes con tuberculosis y lepra. La presencia de granulosina está presente en las lesiones de pacientes con Hansen siendo más frecuente en biopsia de pacientes TT (48-50).
MACRÓFAGOS
Los mecanismos de defensa frente a bacterias intracelulares requieren la participación de macrófagos, células asesinas naturales y diversas poblaciones de linfocitos T. El macrófago es una de las primeras células en captar al M. leprae y en ausencia de un mecanismo efectivo de inmunidad mediada por células los bacilos se multiplican dentro de las células macrofágicas.
CITOCINAS EN LEPRA
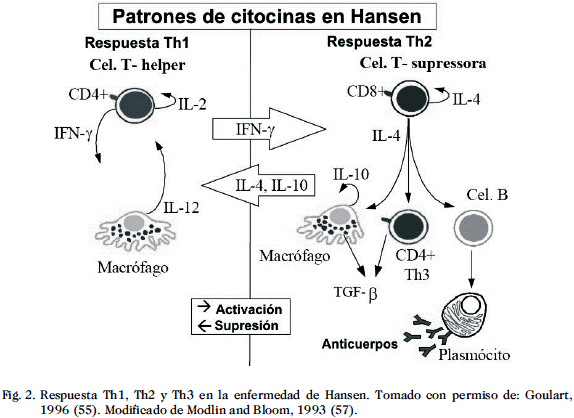
El paradigma Th1/Th2 se ha postulado para intentar explicar resistencia o susceptibilidad frente a patógenos intracelulares. Se basa en los patrones de producción de citocinas en diversos estados infecciosos. Los linfocitos T que producen interleucina 2 (IL-2) e interferon g (IFN-g), IL-7, IL-12, IL-15, IL-18, asociados con la respuesta tipo Th1, aumenta la inmunidad mediada por células (38, 48, 51, 52). Los linfocitos T que producen IL-4, IL-5, IL-10, IL-13, respuesta Th2 (37) aumentan la respuesta humoral (53). Las subpoblaciones celulares tipo Th1 y Th2 provienen de un precursor común, los linfocitos Th0, estas células no están diferenciadas y secretan ambas citocinas tipo Th1 y Th2. Estudios previos realizados en la forma estable de lepra lepromatosa polar, mostraron una mezcla de patrones de citocinas: 40% con un perfil Th2, 50% con perfil Th0 y el resto no mostró ninguno de estos patrones. Es importante señalar que células accesorias pueden alterar el perfil de citocinas en cultivos reconstituidos, sugiriendo su importancia en la diferenciación de sub-poblaciones de linfocitos T cooperadores (Th) (54). Una tercera subpoblación de linfocitos T CD4+ CD3+ (Th3), población supresora o reguladora de la inmunidad mediada por células, puede ser activada en la forma de lepra lepromatosa en la presencia de grandes cantidades de IL-4, induciendo la producción de TGF-b1 (55, 56) (Fig. 2).
FACTOR ALFA DE NECROSIS TUMORAL Y INTERFERÓN GAMMA (TNF-a Y IFN-G)
En cuanto a citocinas de interés como el factor de necrosis tumoral-a (TNF-a) y el interferón gamma (IFN-g), el TNF-a es una citocina liberada por monocitos, macrófagos, células NK, mastocitos y neutrófilos (PMN) en respuesta a infección, sepsis, a ciertos antígenos ó a daño (57-60). Ésta y otras citocinas proinflamatorias, incluyendo la IL-1b son liberadas in vivo e in vitro durante los episodios reaccionales en lepra (61, 62). Una elevada liberación de TNF-a en pacientes con la forma tuberculoide (paucibacilar) comparada con la forma multibacilar sugiere que esta citocina contribuye al proceso de resistencia de la respuesta inmune frente a la infección micobacteriana. Sin embargo, una elevada liberación en pacientes con estado reaccional tipo ENL indica que el TNF-a pueda mediar efectos inmunopatológicos así cómo fiebre y daño a tejido (63). La evidencia de receptores TNF-a soluble presentes en el suero de los pacientes con lepra podría indicar la presencia de un mecanismo regulatorio para modular la actividad excesiva de TNF-a alcanzado en respuesta al daño severo ó infección. Se ha encontrado un elevado número de receptores tipo I de factor de necrosis tumoral-a soluble (sTNF-RI) en pacientes con lepra lepromatosa en estado reaccional tipo 2, a diferencia de los receptores tipo II (sTNF-RII); los cuales se hallaron incrementados en pacientes con la forma tuberculoide (64, 65).
El IFN-g es bien conocido por su habilidad de aumentar la producción de intermediarios reactivos de oxígeno y de nitrógeno por parte del macrófago, estimulando a dicha célula y por consiguiente restringiendo la proliferación de las micobacterias u otros patógenos intracelulares (66, 67). En este sentido ciertos antígenos micobacterianos tanto de la pared celular cómo del citosol inducen una buena respuesta de IFN-g (36, 68).
ESTADOS REACCIONALES Y SU AMBIENTE DE CITOCINAS
Los estados reaccionales pueden ocurrir antes, durante e incluso después de tratamiento cuando el paciente es considerado curado bacteriológicamente. Las reacciones en Hansen pueden ser definidas cómo manifestaciones clínicas resultado de alteraciones del balance inmunológico debido a la interacción entre el sistema inmune del hospedador y el agente infectante. Estas reacciones agudas afectan principalmente piel y nervios y son la primera causa de morbilidad e incapacidad, principalmente por alteraciones en las funciones de los nervios periféricos.
Reacciones tipo 1 ó reacciones de reversión ocurren frecuentemente en pacientes paucibacilares. Cómo habíamos mencionado anteriormente, parecen estar asociadas a un aumento abrupto de la respuesta inmune mediada por células contra antígenos de M. leprae (69). Usando la técnica de RT-PCR, se ha demostrado un aumento en la expresión de RNA mensajeros que codifican para citocinas IL-1b, TNF-a, IL-2 e IFNg, dando un patrón típico de una respuesta Th1, mientras que el patrón tipo Th2 (IL-4, IL-5 e IL-10) se encontró disminuido. Mediante inmunohistoquímica se ha demostrado la presencia de citocinas cómo IFN-g y TNF-a asociadas a la detección de la enzima óxido nítrico sintasa inducible (iNOS) (39).
En referencia a las reacciones del tipo 2, la más frecuente es la del tipo eritema nodoso leproso (ENL) que ocurre en pacientes multibacilares y es característico de una reacción inflamatoria sistémica, presentando una inmunopatología más compleja. En algunos pacientes estas reacciones pueden ser crónicas y puede suceder una vez terminado el tratamiento. Ha sido demostrado que durante el ENL hay un aumento selectivo de la expresión de RNA mensajero para IL-6, IL-8 e IL-10 en las lesiones, indicando una respuesta tipo Th2 (39).
Es importante señalar que el tratamiento de los episodios reaccionales constituye una de las principales prioridades en el manejo de los pacientes con enfermedad de Hansen para prevenir incapacidades. El tratamiento debe ser individualizado con las drogas anti-inflamatorias no esteroideas (AINES) para el caso de cuadros leves y esteroideas para los procesos neuríticos. Es importante señalar la talidomida, un derivado del ácido glutámico, una droga altamente efectiva en el fenómeno reaccional y es usada con precaución en mujeres en edad fértil debido a su efecto teratogénico. Desde 1998 la US FDA la consideró como tratamiento alternativo de elección en las manifestaciones agudas cutáneas, entre éllas podemos citar para tratamiento de ENL (70) se utiliza 400mg diarios durante una semana hasta atenuación del fenómeno reacciona. Su acción es antiinflamatoria, provoca una alteración de la síntesis y liberación de citocinas cómo TNF-a, IL-1, IL-2, IL-4, IL-6, IL-8, IL10, IL-12 y IFN-g. Las células blanco de la talidomida son los leucocitos, células endoteliales y queratinocitos afectándolos de una manera diferente a cada uno de ellos. Se observan cambios en la densidad de las moléculas de adhesión, con alteración en la extravasación celular y por consiguiente en la respuesta inflamatoria de los tejidos involucrados (71-74).
Otro aspecto de tomar en cuenta en la enfermedad de Hansen es en referencia a la inmunogenética. La influencia genética en la susceptibilidad o resistencia de los individuos en esta enfermedad ha sido discutida desde hace muchas décadas. Actualmente, esta interrogante esta siendo vista de dos formas: existe un control genético de la susceptibilidad a la lepra?, ó existe un control genético de la expresión clínica de la enfermedad?
INFLUENCIAS GENÉTICAS SOBRE LA RESPUESTA INMUNE ADQUIRIDA
Antígenos leucocitarios humanos (HLA)
Estudios previos realizados en diferentes partes del mundo entre ellos Venezuela y China, demostraron que en los pacientes de la forma clínica tuberculoide el HLA que predomina es el HLA-DR2 y HLA-DR3 a diferencia de la forma lepromatosa (incapaz de controlar la multiplicación del bacilo) donde el HLA más frecuente es el D-Q1 (75-78).
Cromosoma 10P13
Estudios realizados pacientes con enfermedad de Hansen en el sur de la India encontraron marcadores genéticos en el cromosoma 10p13. Muchos de estos pacientes presentaron lepra paucibacilar y no está claro si estos marcadores están relacionados con susceptibilidad a la enfermedad ó con el tipo de lepra de la forma tuberculoide (79).
Proteínas asociadas a transporte (TAP)
La proteína asociada a transporte en el procesamiento de antígenos (TAP) es una proteína compuesta de dos polipeptidos, TAP1 y TAP2. El gen de TAP2 está asociada con lepra tuberculoide. Este gen está muy estrechamente asociado con los genes de HLA, así que los resultados dificultan su interpretación (80).
Factor alfa de necrosis tumoral
El factor de necrosis tumoral es asociado con resistencia frente al M. leprae; por ejemplo los niveles de TNF- a en suero son elevados en pacientes con lepra tuberculoide. En reacciones del tipo 1 ó de reversión, la expresión de esta citocina está igualmente incrementada en las lesiones en estas manifestaciones de lepra. El gen de TNF- a está localizado en el cromosoma 6p21 y el polimorfismo de la región promotora es de gran interés como modulador de la respuesta del hospedador y de la forma clínica presente en la enfermedad. Estudios genéticos realizados en la India y Brasil asocian las diferencias encontradas en los alelos de TNF- a con el tipo de lepra (81, 82).
Receptores toll-like (TLR)
Estos receptores lo hemos mencionado anteriormente en la inmunidad innata. Los genes que regulan los receptores TLR influyen de una manera importante en los eventos tempranos de la respuesta inmune específica. Estudios realizados en pacientes con lepra indican que la producción de citocinas, señalización celular y otros aspectos en la resistencia a la infeción por M. leprae están controlado por los receptores TLR-2 (83).
Receptor de la vitamina D
Estudios previos sugieren que el polimorfismo del gen para el receptor de la vitamina D fue asociado con susceptibilidad a tuberculosis (84). Diferentes estudios en pacientes con lepra indican que los alelos de este gen están asociados con lepra tuberculoide y con la forma lepromatosa (85).
No es fácil resumir la influencia de los factores généticos en las diversas manifestaciones de la lepra. Parece evidente, basándose en la evidencia presentada arriba, que la composición genética ejerce una influencia sobre la inmunidad innata y la adaptativa frente M. leprae. Hay un consenso ampliamente aceptado que algunos de los factores genéticos determinan la susceptibilidad o resistencia frente al microorganismo y se podría postular que la inmunidad innata tendría un papel preponderante en esta reactividad inicial. En cambio, las distintas manifestaciones clínicas aparentemente reflejan la modulación de una infección ya establecida.
Hasta los momentos se ha hecho un gran avance en las diferentes disciplinas que estudian la enfermedad tomando en cuenta que la bacteria hasta los momentos no se ha podido cultivar en vitro. Hay aspectos de mucho interés que hay que seguir estudiando entre ellas las reacciones en lepra: del tipo 1 y del tipo 2 porque hay cierta afinidad en algunos pacientes y otros no. Un aspecto de suma importancia es el estudiar los mecanismos de daño a nivel de nervios para prevenir las discapacidades.
Es importante señalar que el conocimiento y secuenciación del genoma micobacteriano ha dado nueva directrices para la búsqueda y síntesis de nuevas proteínas que nos permitan desarrollar nuevas alternativas para realizar un diagnótico temprano dando un tratamiento oportuno y reducir la trasmisión de la enfermedad.
Los principios básicos para el control de la lepra más allá del año 2008 seguirán basándose en la detección y el tratamiento temprano de los pacientes. Actualmente la meta de la estrategia mundial por parte de la OMS es reducir más la carga de la lepra y brindar acceso de control a todas las comunidades afectadas. Si se toma en cuenta que el período latente de incubación de las formas más graves de la lepra puede ser de siete años o más y que puede haber transmisión durante la etapa pre-clínica de la enfermedad, se reconoce la necesidad de vigilancia continua durante un tiempo prolongado para lograr esta meta.
REFERENCIAS
1. WHO. 2007. Global leprosy situation, 2007. Wkly. Epidemiol. Rec 82a:225-232. [ Links ]
2. Ridley DS, Jopling WH. Classification of leprosy according to immunity- a five group system. Int J Lepr 1966; 34:255-273. [ Links ]
3. Demangel C, Britton WJ. Interaction of dendritic cells with mycobacteria: where the action starts. Immunol Cell Biol 2000; 78:318-324. [ Links ]
4. Hashimoto K, Maeda Y, Kimura H, Susuki K, Masuda A, Matsnoka M, Makino M. Mycobacterium leprae infection in monocyte-derived dendritic cells and its influence on antigen-presenting function. Infect Immun 2002; 70:5167-5176. [ Links ]
5. Maeda Y, Gidoh M, Ishii N, Mukai C, Makino M. Assessment of cell mediate immunogenicity of Mycobacterium leprae- derived antigens. Cell Immunol 2003; 222: 69-77. [ Links ]
6. Miranda A, Amadeu TP, Schuller G, Alvarenga FBF, Duppre N, Ferreira H, Nery JAC, Sarno EN. Increased Langerhans cell accumulation alter mycobacterial stimuli. Histopathology 2007; 51:649-656. [ Links ]
7. Tobian AA, Potter NS, Ramachandra L, Pai RK, Convery M, Boom WH, Harding CV. Alternate class I MHC antigen processing is inhibited by Toll-like receptor signaling pathogen-associated molecular patterns: Mycobacterium tuberculosis 19-kDa lipoprotein, CpG DNA, and lipopolysaccharide. J Immunol 2003; 171:1413-1422. [ Links ]
8. Pitarque S, Larrouy-Naumus G, Payre B, Jackson M, Puzo G, Nigou S. The immunomodulatory lipoglycans, lipoarabinomannan and lipomannan, are exposed at the mycobacterial cell surface. Tuberculosis 2008; 88:560-565. [ Links ]
9. Prigozy TL, Sieling PA, Clemens D, Stewart PL, Behar SM, Porcelli SA, Brenner MB, Modlin RL, Konenberg M. The manose receptor delivers lipoglycan antigens to endosomes for presentation to T cells by CD1b molecules. Immunity 1997; 6:187-197. [ Links ]
10. Astarie-Dequeker C, N´Diaye EN, Le Cabec V, Rittig MG, Prandi J, Mariconneau- Parini I. The mannose receptor mediates uptake of pathogenic and nonpathogenic mycobcteria and bypasses bactericidal responses in human macrophges. Infect Immun 1999; 67:469-477. [ Links ]
11. Ochoa MT, Loncaric A, Krutzik Sr, Becker TC, Modlin RL. “Dermal dendritic cells” comprise two distinct populations: CD1+ dendritic cells and CD209+ macrophages. J Invest Dermatol 2008; 128: 2225-2231. [ Links ]
12. Nigou J, Zelle-Rieser C, Gilleron M, Thuruher M, Puzo G. Mannosylated lipoarabinomannans inhibit IL-12 production by human dendritic cells: evidence for a negative signal delivered through the mannose receptor. J Immunol 2001; 166: 7477-8485. [ Links ]
13. Geijtenbeek TB, Van Vliet SJ, Koppel EA, Sanchez-Hernández M, Vandenbroucke-Grauls CM, Appelmelk B, Van Kooyk Y. Mycobacterial target DC-SIGN to suppress dendritic cell function. J Exp Med 2003; 197:7-17. [ Links ]
14. Hunger RE, Sieling PA, Ochoa MT, Sugaya M, Burdick AE, Rea TH, Brennan PJ, Belisle JT, Blauvelt A, Porcelli SA, Modlin RL. Langehans cells utilize CD1a and langerin to efficiently present nonpeptide antigens to T cells. J Clin Invest 2004; 113:701-708. [ Links ]
15. Méndez-Samperio P, Belmont L, Miranda E. Mycobacterium bovis BCG toll-like receptors 2 and 4 cooperation increases the innate epithelial immune response. Arch Med Res 2008; 39:33-39. [ Links ]
16. Brightbill HD, Libraty DH, Krutzik SR, Yang RB, Yelisle JT, Bleharski JR, Maitland M, Norgard MV, Plevy SE, Smale ST, Brennan PJ, Bloom BR, Godowski PJ, Modlin RL. Host defense mechanisms triggered by microbial lipoproteins trough toll-like receptors. Science 1999; 285:732- 736. [ Links ]
17. Underhill DM, Osinsku A, Smith KD, Aderem A. Toll-like receptor-2 mediates mycobacteria induced proinflammatory signals in macrophages. Proc Natl Acad Sci USA 1999; 96:14459-14463. [ Links ]
18. Marrakchi H, Mari B, Duteyyrat JL, Guerardel Y, Kremen L, Barbry P, Puzo G, Altare F. Mycobacterial lipomannan induces granuloma macrophage fusion via a TLR2 dependent, ADAM9- and beta 1 integrin-mediated pathway. J Immunol 2007; 178:3161-3169. [ Links ]
19. Nigou J, Vasselon T, Ray A, Constant P, Gilleron M, Berra GS, Sutcliffe I, Tiraba G, Puzo G. Mannan chain length controls lipoglycans signaling via and binding to TLR2. J Immunol 2008; 180:6696-6702. [ Links ]
20. Kang TJ, Chae GT. Detection of Toll-like receptor 2 (TLR2) mutation in the lepromatous leprosy patients. FEMS Immunol Med Microbiol 2001; 31:53-58. [ Links ]
21. Kang TJ, Lee SB, Chae GT. A polymorphism in the toll-like receptor 2 is associated with IL-12 production from monocyte in lepromatous leprosy. Cytokine 2002; 20:56-62. [ Links ]
22. Kang TJ, Yeum CE, Kim BC, You EY, Chae GT. Differential production of interleukin-10 and interleukin-12 in mononuclear cells from leprosy patients with a toll-like receptor 2 mutation. Immunology 2004; 112:674-680. [ Links ]
23. Krutzik SR, Tan B, Li H, Ochoa MT, Liu PT, Sharfstein SE, Graeber TG, Sieling PA, Liu YJ, Rea TH, Bloom BR, Modlin RL. TLR activation triggers the rapid differentiation of monocytes into macrophages and dendritic cells. Nat Med 2005; 11:653-660. [ Links ]
24. Schlesinger LS, Horwitz MA. Phenolic glycolipid-1 of Mycobacterium leprae binds complement component C3 in serum and mediates phagocytosis by human monocytes. J Exp Med 1991; 174:1031-1038. [ Links ]
25. Chan J, Fujiwara T, Brennan P, Mc Neil M, Turco SJ, Sibille JC, Snapper M, Aisen P, Bloom BR. Microbial glicolipids: possible virulence factors that scavenge oxygen radicals. Proc Natl Acad Sci USA 1989; 86:2453-2457. [ Links ]
26. Thangaraj HS, Lamb FI, Davis EO, Jenner PJ, Jeyakumar LH, Colston MJ. Identification, sequencing, and expression of Mycobacterium leprae superoxide dismutase, a major antigen. Infect Immun 1990; 58:1937-1942. [ Links ]
27. Kroncke KD, Fehsel K, Kolb-Bachofen V. Inducible nitric oxide synthase in human diseases. Clin Exp Immunol 1998; 113: 147-156. [ Links ]
28. Schon T, Hernandez-Pando RH, Negesse Y, Leekassa R, Sundqvist T, Britton S. Expression of inducible nitric oxide synthase and nitrotyrosine in borderline leprosy lesions. Br J Dermatol 2001; 145: 809-815. [ Links ]
29. Ascenzi P, Visca P. Scavenging of reactive nitrogen species by mycobacterial truncated hemoglobins. Methods enzymol 2008; 436:317-337. [ Links ]
30. Mehra V, Brennan PJ, Rada E, Convit J, Bloom BR. Lymphocyte suppression in leprosy induced by unique M. leprae glycolipid. Nature 1984; 308:194-195. [ Links ]
31. Duthie M, Goto W, Ireton G, Reece S, Cardoso LP, Martelli CM, Stefani MM, Nakatani M, De Jesus RC, Netto EM, Balagon MV, Tan E, Gelber RH, Maeda Y, Makino M, Mihoft D, Reed SG. Use of protein antigens for early serological diagnosis of leprosy. Clin Vaccine Immunol 2007; 14:1400-1408. [ Links ]
32. Duthie M, Ireton GC, Kanaujia GV, Goto W, Liang H, Bhatia A, Busceti JM, Macdonald M, Neupane KD, Ramjit C, Sapkota BR, Balagon M, Esfandiari J, Carter D, Reed SG. Selection of antigens and development of prototype tests for point-of-care leprosy diagnosis. Clin Vaccine Immunol 2008; 15:1590-1597. [ Links ]
33. Rada E, Convit J, Ulrich M, Gallinoto ME, Aranzazu N. Immunosuppression and cellular immunity reactions in leprosy patients treated with a mixture of Mycobacterium leprae and BCG. Int J Lepr 1987; 55:646-650. [ Links ]
34. Rada E, Ulrich M, Aranzazu N, Rodríguez V, Centeno M, González l, Santaella C, Rodríguez M, Convit J. A follow-up study of multibacillary Hansen´s disease patients treated with multidrug therapy (MDT) or MDT + immunotherapy (IMT). Int J Lepr 1997; 65:320-327. [ Links ]
35. Rada E, Ulrich M, Aranzazu N, Santaella C, Gallinoto ME, Centeno M, Rodríguez V, Convit J. A longitudinal study of immunologic reactivity in leprosy patients treated with immunotherapy. Int J Lepr 1994; 62:552-558. [ Links ]
36. Duthie MS, Goto W, Ireton GC, Reece ST, Sampaio LH, Grassi AB, Sousa AL, Martelli CM, Stefani MM, Reed SG. Antigen-specific T-cell responses of leprosy patients. Clin Vaccine Immunol 2008; 15:1659-1665. [ Links ]
37. Sieling PA, Abrams JS, Yamamura M, Salgame P, Bloom BR, Rea TH, Modlin RL. Immunosupressive roles for IL-10 and IL-4 in human infection: in vitro modulation of T cell responses in leprosy. J Immunol 1993; 150:5501-5510. [ Links ]
38. Sieling PA, Wang X-H, Gately MK, Oliveros JL, McHugh T, Barnes PF, Wolf SF, Golkar L, Yamamura M, Yogi Y, Uyemura K, Rea TH, Modlin RL. IL-12 regulates T helper type cytokine responses in human infectious disease. J Immunol 1994; 153:3639-3647. [ Links ]
39. Yamamura M, Wang X-H, Ohmen JD, Uyemura TH, Bloom BR, Modlin RL. Cytokine patterns of immunologically mediated tissue damage. J Immunol 1992; 149:1470-1475. [ Links ]
40. Gupta A, Sharma VK, Vohra H, Ganguly NK. Spontaneous apoptosis in peripheral blood mononuclear cells of leprosy patients: role of cytokines. FEMS Immunol Med Microbiol 1999; 24:49-55. [ Links ]
41. Tartaglia LA, Goeddel DV. Two TNF receptors. Immunol Today 1992; 13:151-153. [ Links ]
42. Varadhachary AS, Perdow SM, Hu C, Ramanarayanan M, Salgame P. Differential ability of T cell subsets to undergo activation-induced cell death. Proc Natl Aca Sci USA 1997; 94:5778-5783. [ Links ]
43. Hernandez MO, Neves I, Sales JS, Carvalho DS, Sarno EN, Sampaio EP. Induction of apoptosis in monocytes by Mycobacterium leprae in vitro: a possible role for tumour necrosis factor-alpha. Immunology 2003; 1091:156-164. [ Links ]
44. Walsh DS, Lane JE, Abalos RM, Myint KS. TUNEL and limited immunophenotypic analyses of apoptosis in paucibacillary and multibacillary leprosy lesions. FEMS Immunol Med Microbiol 2004; 41: 265-269. [ Links ]
45. Ajith C, Gupta S, Radotra BD, Arora SK, Kumar B, Dogra S, Kaur I. Study of apoptosis in skin lesions of leprosy in relation to treatment and lepra reactions. Int J Lepr 2005; 73:269-276. [ Links ]
46. Fulco TO, Lopes UG, Sarno EN, Sampaio EP, Saliba AM. The proteasome function is required for Mycobacterium leprae-induced apoptosis and cytokine secretion. Immunol Lett 2007; 15:82-85. [ Links ]
47. Modlin RL, Hofman FM, Taylor CR, Rea TH. T lymphocyte subsets in the skin lesions of patients with leprosy. J Am Acad Dermatol 1983; 8:182-189. [ Links ]
48. Cher DJ, Mosmann TR. Two types of murine helper T cell clone. Delayed-type hypersensitivity is mediated by Th1 clones. J Immunol 1987; 138:3688-3694. [ Links ]
49. Ochoa MT, Stenger S, Sieling PA, Toma-Uszynski S, Sabet S, Cho S, Krensky AM, Rollinhoff M, Nunes Sarno E, Burdick AE, Rea TH, Modlin RL. T-cell release of granulosin contributes to host defense in leprosy. Nat Med 2001; 7:174-179. [ Links ]
50. Sabet S, Ochoa MT, Sieling PA, Rea TH, Modlin RL. Functional characterization of a T-cell receptor BV6+ T-cell clone derived from a leprosy lesion. Immunology 2007; 120:354-361. [ Links ]
51. García VE, Uyemura K, Sieling PA, Ochoa MT, Morita CT, Okamura H, Kurimoto M, Rea TH, Modlin RL. IL-18 promotes type 1 cytokine production from NK cells and T cells in human intracellular infection. J Immunol 1999; 162:6114-6121. [ Links ]
52. Jullien D, Sieling PA, Uyemura K, Mar ND, Rea TH, Modlin RL. IL-15, an immunomodulator of T cell responses in intracellular infection. J immunol 1997; 158:800-806. [ Links ]
53. Stevens TL, Bossie A, Sanders VM, Fernandez-Botran R, Coffman RL, Mosmann TR, Vitetta ES. Regulation of antibody isotype secretion by subsets of antigen-specific helper T cells. Nature 1988; 334:255-258. [ Links ]
54. Nath I, Vemuri N, Reddi AL, Jain S, Brooks P, Colston MJ, Misra RS, Ramesh V. The effect of antigen presenting cells on the cytokine profiles of stable and reactional lepromatous leprosy patients. Immunol Lett 2000; 75:69-76. [ Links ]
55. Goulart IMB, Figueiredo F, Coimbra T, Foss NT. Detection of transforming growth factor-beta 1 in dermal lesions of different clinical forms of leprosy. Am J Pathol 1996; 148:911-917. [ Links ]
56. Goulart IMB, Mineo JR, Foss NT. Production of transforming growth factor-beta 1 (TGF-β1) by blood monocytes from patients with different clinical forms of leprosy. Clin Exp Immunol 2000; 122:330-334. [ Links ]
57. Modlin RL, Hofman FM, Taylor CR, Rea TH. T lymphocyte subsets in the skin lesions of patients with leprosy. J Am Acad Dermatol 1983; 8:182-189. [ Links ]
58. Tomioka H, Shimizu T, Maw WW, Ogasawara K. Roles of tumour necrosis factor-alpha (TNF-α), transforming growth factor-beta ( TGF-β), and IL-10 in the modulation of intercellular adhesion molecule-1 (ICAM-1) expression by macrophages during mycobacterial infection. Clin Exp Immunol 2000; 122:335-342. [ Links ]
59. Beutler B, Cerami A. Tumor necrosis, cachexia, shock and inflamation: a common mediator. Annu Rev Biochem 1988; 57:505-518. [ Links ]
60. Dubravec DB, Spriggs DR, Mannick JA, Rodrick ML. Circulating human peripheral blood granulocytes synthesize and secrete tumor necrosis factor. Proc Natl Acad Sci USA 1990; 87:6758-6761. [ Links ]
61. Cooper CL, Mueller C, Sinchaisri T, Pirmez C, Chan J, Kaplan G, Young SMM, Weissman IL, Bloom BR, Rea TH, Modlin R. Analysis of naturally ocurring delayed-type hypersensitivity reactions in leprosy by in situ hybridization. J Exp Med 1989; 169:1565-1581. [ Links ]
62. Santos DO, Suffys PN, Bonifacio K, Marques MA, Sarno EN. Serum tumor necrosis factor and interleukin 1 in leprosy during lepra reactions. Clin Immunol Immunopathol 1992; 63:23-27. [ Links ]
63. Barnes PF, Chatterjee D, Brennan PJ, Rea TH, Modlin R. Tumor necrosis factor production in patients with leprosy. Infect Immun 1992; 60:1441-1446. [ Links ]
64. Munk ME, Anding P, Schettini APM, Cunha MGS, Kaufmann SHE. Soluble tumor necrosis factor alpha receptor in sera from leprosy patients. Infect Immun 1999; 67:423-425. [ Links ]
65. Van Zee KJ, Kohno T, Fischer E, Rock CR, Moldawer LL, Lowry SF. Tumor necrosis factor soluble receptors circulate during experimental and clinical inflammation and can protect against excessive tumor necrosis factor a in vitro and in vivo. Proc Natl Acad Sci USA 1992; 89:4845-4849. [ Links ]
66. Nathan CF, Kaplan G, Levis WR, Nusrat A, Wintmer MD, Sherwin SA, Job CK, Horowitz CR, Steinman RM, Cohn ZA. Local and systemic effects of intradermal recombinant interferon-gamma in patients with lepromatous leprosy. N Engl J Med 1986; 315:6-15. [ Links ]
67. Nathan CF, Murray HW, Wiebe ME, Rubin BY. Identification of interferon-gamma as the lymphokine that activates human macrophage oxidative metabolism and antimicrobial activity. J Exp Med 1983; 172:670-689. [ Links ]
68. Dockreell HM, Young SK, Britton K, Brennan PJ, Rivoire B, Waters MFR, Lucas SB, Shahid F, Dojki M, Chiang TJ, Ehsan Q, Mc Adam KPW, Hussain R. Induction of the cytokine responses by mycobacterial antigens in leprosy. Infect Immun 1996; 64:4385-4389. [ Links ]
69. Modlin RL, Melancon-Kaplan J, Young SMM, Pirmez C, Kino H, Convit J, Rea TH, Bloom BR. Learning from lesions: patterns of tissu+e inflammation in leprosy. Proc Natl Acad Sci USA 1988; 85:1213-1217. [ Links ]
70. Walker SL, Waters MF, Lockwood DN. The role of thalidomide in the management of erythema nodosum leprosum. Lepr Rev 2007; 78:197-215. [ Links ]
71. Meierhofer C, Dunzendorfer S, Wiedermann CJ. Theoretical basis for the activity of thalidomide. Biodrugs 2001; 15:681-703. [ Links ]
72. Perri AJ, Hsu S. A review of thalidomide´s history and current dermatological applications. Dermatol Online J 2003; 9:5-7. [ Links ]
73. Rada E, Aranzazu N, Convit J. Ciertos aspectos inmunológicos en los estados reaccionales en la enfermedad de Hansen. Revisión. Invest Clin 2005;46:381-389. [ Links ]
74. Iyer A, Hatta M, Usman R, Luiten S, Oskam L, Faber W, Geluk A, Das P. Serum levels of interferon-gamma, tumour necrosis factor-alpha, soluble interleukin-6R and soluble cell activation markers for monitoring response to treatment of leprosy reactions. Clin Exp Immunol 2007; 150:210-216. [ Links ]
75. Sergeantson S. HLA and susceptibility to leprosy. Immunol Rev 1983; 70:8-112. [ Links ]
76. Ottenhoff TH, de Vries RR. HLA class II immune response and suppression genes in leprosy. Int J Lepr 1987; 55:521-534. [ Links ]
77. Van Eden W, Gonzalez NM, de Vries RRR, Convit J, van Rood JJ. HLA linked control of predisposition to lepromatous leprosy. J Infect Dis 1985; 151:9-14. [ Links ]
78. Ottenhoff THM, Gonzalez NM, de Vries RRP, Convit J, van Rood JJ. Association of HLA-LB-E12 (MB1, DC1, MT1) with lepromatous leprosy in a Venezuelan population. Tissue Antigens 1984; 24:25-29. [ Links ]
79. Siddiqui MR, Meisner S, Tosh K, Balakrishnan K, Ghei S, Fisher SE, Golding M, Shanker-Narayan NP, Sitaraman T, Segupta U, Pitchappan R, Hill AV. A major susceptibility locus for leprosy in India maps to chromosome 10p13. Nat Genet 2001; 27:439-441. [ Links ]
80. Rajalingam R, Singal DP, Mehra NK. Transporter associated with antigen-processing (TAP) genes and susceptibility to tuberculoid leprosy and pulmonary tuberculosis. Tissues Antigens 1997; 49:168-172. [ Links ]
81. Roy S, McGuire W, Mascie-Taylor CGN, Hazra S, Hill AVS, Kwiatkowski D. Tumor necrosis factor promoter polymorphism and susceptibility to lepromatous leprosy. J Infect Dis 1997; 176:530-532. [ Links ]
82. Santos AR, Suffys PN, Vanderborght PR, Moraes MO, Vieira LM, Cabello PH, Bakker AM, Matos HJ, Huizinga TW, Ottenhoff TH, Sampaio EP, Sarno EN. Role of tumor necrosis factor-alpha and interleukin-10 promoter gene polymorphisms in leprosy. J Infect Dis 2002; 186: 1687-1691. [ Links ]
83. Bochud PY, Hawn TR, Aderem A. Cutting edge: a Toll like receptor 2 polymorphism that is associated with lepromatous leprosy is unable to mediate mycobacterial signaling. J Immunol 2003; 170:3451-3454. [ Links ]
84. Rook GA. The role of vitamin D in tuberculosis. Am Rev Resp Dis 1998; 138:768-770. [ Links ]
85. Roy S, Frodsham A, Saha B, Hazra S, Mascie-Taylor CGN, Hill AVS. Association of vitamin D receptor genotype with leprosy type. J Inf Dis 1999; 179:187-191. [ Links ]












 uBio
uBio