Revista de la Sociedad Venezolana de Microbiología
versión impresa ISSN 1315-2556
Rev. Soc. Ven. Microbiol. vol.34 no.2 Caracas dic. 2014
Actividad antifúngica del aceite esencial de naranja (Citrus sinensis L.) sobre hongos postcosecha en frutos de lechosa (Carica papaya L.)
Clemencia Guédeza,*, Luis Cañizaleza, Laura Avendañob, José Scorzab, Carmen Castilloa, Rafael Olivarc, Yolanda Méndezd, Libert Sáncheza
a Laboratorio de Fitopatología y Control Biológico Dr. Carlos Díaz Polanco, Mérida, Venezuela.
b Laboratorio de Síntesis y Extracción de Principios Activos (LABSEPA), Núcleo Rafael Rangel (NURR), Universidad de Los Andes (ULA). Mérida, Venezuela.
c Escuela Técnica Agropecuaria Robinsoniana Adolfo Navas Coronado, Ministerio del Poder Popular para la Educación. Estado Trujillo, Venezuela.
d Laboratorio de Lutzomía, NURR-ULA. Mérida, Venezuela.
* Correspondencia:E-mail
: clemencia.guedez@gmail.comResumen:
Los hongos postcosecha causan pudriciones que afectan la calidad de los frutos de lechosa (Carica papaya L.). Actualmente los aceites esenciales son considerados una alternativa a los fungicidas químicos para controlar estos hongos. En este estudio se evaluó la actividad antifúngica del aceite esencial de naranja (Citrus sinensis L.) sobre los hongos Colletotrichum gloeosporioides, Penicillium indicum, Fusarium solani, Rhizopus stolonifer y Aspergillus flavus, en medio de cultivo Papa Dextrosa Agar (PDA) en un diseño completamente al azar. Los resultados mostraron que existe un efecto inhibidor del aceite esencial de naranja (AEN) en el crecimiento micelial de los hongos in vitro, superior al 80% a concentración de AE de 1%, y 100% de inhibición a concentraciones de 2,5% y 5% de AE (p<0,05). Al ser utilizado como recubrimiento de los frutos, a concentraciones de 2,5% y 5%, disminuye la presencia de lesiones en los mismos, sin diferencias significativas (p<0,05), con igual comportamiento en efectividad in vitro e in vivo. El AEN puede ser una alternativa factible, para el control natural y eficaz de hongos postcosecha, causantes de grandes pérdidas en frutas para exportación y consumo.Palabras clave:
aceite esencial de naranja, recubrimientos, fungicida natural, postcosecha, Carica papaya.Anti-fungal activity of essential orange oil (Citrus sinensis L.) over post-harvest fungi in papaya fruits (Carica papaya L.)
Abstract:
Post-harvest fungi produce rotting that affects the quality of papaya fruits (Carica papaya L.) At present, essential oils are considered an alternative to chemical anti-fungal substances for controlling these fungi. In this study we evaluated the antifungal activity of essential orange oil (Citrus sinensis L.) over Colletotrichum gloeosporioides, Penicillum indicum, Fusarium solani, Rhizopus stolonifer and Aspergillus flavus, in Potato Dextrose Agar (PDA) culture medium in a completely random design. The results showed that there is an inhibitory effect of essential orange oil (EOO) over the in vitro mycelium growth of fungi, higher than 80% at a 1% EOO concentration and 100% inhibition at 2.5% and 5% EOO concentrations (p<0.05). When used as covering over the fruits at 2.5% and 5% concentrations, it decreased the presence of lesions without significant differences (p<0.05), with similar effectiveness in vitro and in vivo. EOO can be a feasible alternative for the natural and effective control of post-harvest fungi, which cause great losses in exportation and consumption fruits.Keywords:
essential orange oil, covering, natural fungicide, post-harvest, Carica papaya.Recibido 29 de abril de 2014; aceptado 20 de octubre de 2014
Introducción
La lechosa (Carica papaya L.) es una fruta climatérica, muy perecedera y rica en vitaminas A, C, polifenoles y antioxidantes [1]; la maduración ocurre inmediatamente después de la cosecha y su conservación debe ser por periodos máximos de 2 a 4 semanas a temperaturas de 8 y 10 ºC, o de 5 a 7 días si la temperatura es de 22 ºC; durante este tiempo es susceptible al ataque de microorganismos patógenos, que causan grandes pérdidas en postcosecha [2].
Los hongos son los patógenos más importantes en las pudriciones postcosecha de frutas y hortalizas durante el transporte, el almacenamiento y la comercialización [3].
Estas pudriciones causadas en postcosecha reducen la vida útil y afectan negativamente el valor comercial de las frutas [4]. Además de las pérdidas económicas que causan los hongos, éstos son capaces de producir micotoxinas y metabolitos secundarios que tienen efectos adversos en humanos y animales [5,6].
Las pérdidas postcosecha de frutas y hortalizas causadas por microorganismos están por el orden de 5-25% en países desarrollados y en un 40% en países en desarrollo, siendo los hongos Colletotrichum sp., Rhizopus stolonifer, Botrytis cinerea, Penicillium italicum y P. digitatum los causantes de enfermedades postcosecha más comunes en frutas y hortalizas [3,4,7]. En C. papaya, el hongo más importante en postcosecha es el C. gloeosporioides, cuya infección comienza en el campo y permanece en reposo o latente hasta la fase climatérica o maduración [10]; los hongos como Fusarium solani y Penicillium sp. causan daño al fruto a través del pedúnculo e invaden la parte interna del fruto, destruyendo la semilla y tejido circundante [8].
El control de las enfermedades causadas por hongos postcosecha se ha basado principalmente en el uso de fungicidas sintéticos, con efectos nocivos para seres humanos y ambiente; debido a esto, se ha propuesto la utilización de otras alternativas solas o combinadas: aplicación de irradiaciones y el uso de antagonistas y compuestos naturales como los extractos y aceites esenciales, que han venido mostrando resultados prometedores. Al respecto, Barrera y García [9], sostienen que existe la necesidad de reducir el uso de químicos sintéticos en la agricultura e incrementar el uso de alternativas naturales, entre ellas la utilización de aceites esenciales para el control de fitopatógenos.
Basados en los efectos nocivos de los plaguicidas, y en vías de concretar la seguridad agroalimentaria, la tendencia actual es la formulación y utilización de compuestos naturales que actúen como antimicrobianos y/o antioxidantes, capaces de reducir el deterioro de las frutas y hortalizas, aumentando su vida útil; estos compuestos pueden ser aromáticos volátiles, ácido acético jasmónico, glucosinolatos, aceites esenciales y extractos de plantas, porque cumplen con los estándares para el consumo de los alimentos naturales y sanos [10- 12].
La mayoría de los compuestos naturales para el control de hongos postcosecha en frutas se consideran inocuos para el ambiente y los consumidores, con un gran potencial para el control de enfermedades postcosecha de frutas y hortalizas, y se utilizan como recubrimientos solos o combinados en forma de películas, con ceras u otro soporte de aditivos. Estas cubiertas o recubrimientos comestibles se han utilizado para mantener la calidad y extender la vida de las frutas y hortalizas en el mercado. Según Eissa-Heisham, las frutas y hortalizas son frecuentemente cubiertas al sumergir o asperjar un variado número de cubiertas comestibles, con el objetivo de formar una membrana semipermeable en la superficie de los frutos para reducir la respiración y controlar la pérdida de humedad [13]. La búsqueda de alternativas de conservación, se ha asociado con la utilización de antimicrobianos de origen vegetal como los extractos y aceites esenciales, que garanticen frutos de mejor calidad y sin contaminantes químicos.
El mecanismo de acción de los aceites esenciales no está claro, sin embargo se les atribuye la destrucción de la membrana microbiana debido a sus constituyentes lipofílicos [14]. Sin embargo, estudios recientes indican otros efectos de estos aceites, como: cambios en la morfología del hongo, daños sobre estructuras reproductivas (conidias e hifas) y disminución de la producción de toxinas [15].
El aceite esencial de naranja (Citrus sinensis L.) presenta un alto contenido de monoterpenos cuyo componente mayoritario es el limoneno (90%-96%), y otros monoterpenos oxigenados como linalol (1%-2%) y cineol (1%), que se encuentran en menor proporción. Todos estos componentes han demostrado actividad inhibitoria de crecimiento en diferentes hongos postcosecha como: Aspergillus niger, A. flavus, P. verrucosum, P. chrysogenum, P. digitatum y P. italicum [16]. El objetivo de esta investigación fue determinar la actividad antifúngica in vitro del aceite esencial de naranja (AEN) sobre hongos postcosecha en frutos de lechosa (C. papaya L.).
Materiales y métodos
La investigación se realizó en el laboratorio de Fitopatología y Control Biológico Dr. Carlos Díaz Polanco, del Núcleo Rafael Rangel, Universidad de Los Andes.
Material vegetal: Se utilizaron 50 kg de naranjas frescas sanas (C. sinensis), variedad Valencia, procedente de una plantación ubicada a 530 msnm, 9°49´35N y 70°11´24O. Los frutos se lavaron con agua por 10 min, se secaron al aire, se separaron las cáscaras de la fruta y se pesaron en una balanza electrónica.
Extracción del aceite: El aceite se extrajo de las cáscaras de las naranjas a través de la técnica de hidrodestilación a vapor asistida por microondas (HDMO), utilizando 500 g de cáscaras cortadas en un procesador de alimentos (Oster) y se colocaron en un balón de destilación de 2 L de capacidad con 800 mL de agua; el proceso de extracción duró 20 minutos. El aceite esencial se separó de la fase acuosa con sulfato de sodio anhidro y se mantuvo refrigerado a 4 °C en frasco ámbar hasta su utilización. Se determinó el rendimiento porcentual del aceite esencial de acuerdo al peso en gramos del material vegetal y tiempo de operación.
Identificación de hongos postcosecha en lechosa: Se tomaron cinco frutos de lechosa cv. Maradol, procedentes de un mercado local (Mérida), y se sometieron a una evaluación fitopatológica de la superficie del fruto para identificar los hongos presentes. La observación e identificación de los hongos se realizó mediante la técnica de cinta adhesiva, colocada en un portaobjeto para observar las estructuras fúngicas en un microscopio óptico (Olympus CX 21). Simultáneamente, cortes de la epidermis se colocaron en cajas de Petri (9 cm) con medio de cultivo PDA (Potato Dextrose Agar, DIFCOTM) para su crecimiento. La identificación de los mismos fue corroborada con preparaciones microscópicas de los hongos crecidos en PDA, a través del empleo de las claves taxonómicas para hongos imperfectos. Finalmente, se comprobó la presencia de la enfermedad causada por estos hongos realizando una prueba de patogenicidad, inoculando 5 frutos sanos con cada hongo aislado e identificado y se compararon entre sí los síntomas iniciales.
Efecto del AEN en el crecimiento micelial de los hongos in vitro: Se utilizaron concentraciones de 0%; 1%; 2,5% y 5% del AEN en medio de cultivo PDA. Se colocaron 10 mL de PDA (pH 6,1) en cada caja de Petri (9cm) y cantidades determinadas de aceite esencial, según la concentración utilizada. Después de dos horas en reposo se colocó un disco de 0,5 cm de diámetro del micelio de cada hongo en el centro de cada caja de Petri. Como control absoluto se usó el medio de cultivo PDA sin aceites esenciales.
A partir de las 24 horas de la siembra se realizaron mediciones del diámetro de crecimiento de las colonias que permitieron obtener los porcentajes de inhibición.
%I = Ø Testigo - Ø Tratamiento x 100
Ø Testigo
Donde:
%I: Porcentaje de inhibición.
Ø Diámetro testigo en medio de cultivo PDA.
Ø Diámetro tratamiento (Dosis de AEN en medio PDA).
Las mediciones del crecimiento micelial se realizaron diariamente hasta que cada hongo en el control completara su crecimiento en la placa.
Efecto del AEN como recubrimiento de frutos de lechosa:
Tratamiente previo: Se utilizaron 12 lechosas cv. Maradol procedentes de un mercado local (3 lechosas por tratamiento) con un índice de maduración 2 (coloración verde con trazas amarillas en proporción inferior al 25% del área total), tamaño y color uniforme, libres de daños físicos e infecciones fúngicas, según la técnica propuesta por Rueda [17]. Los frutos se lavaron con agua, se desinfectaron con hipoclorito de sodio (0,2%) y se secaron a temperatura ambiente para su posterior recubrimiento.
Recubrimiento: Los frutos de lechosa fueron separados e impregnados por aspersión con el recubrimiento de cada dosis de AEN, y para el tratamiento control se asperjaron con agua destilada estéril. Los frutos se dejaron secar al aire a temperatura ambiente y se mantuvieron en envases plásticos a 25 ± 1 ºC con humedad relativa (HR) entre el 65 y 70%, durante 7 días.
Presencia de hongos: Durante el estudio se realizaron observaciones diarias durante 7 días para el análisis fitopatológico. Al observarse la presencia de hongos estos se aislaron y fueron pasados al medio de cultivo PDA.
Diseño experimental y análisis estadístico: Para el estudio in vitro se realizó un diseño completamente al azar, con 4 tratamientos (Dosis 0%; 1%; 2,5%; 5%) y 5 repeticiones por tratamiento. Para el estudio in vivo se realizó un diseño completamente al azar, con 4 tratamientos y 3 repeticiones. Los datos fueron sometidos a un análisis de varianza (ANOVA) entre tratamientos para la variable porcentaje de inhibición de hongos, utilizando el programa SAS 9.1.
Resultados y discusión
Extracción y rendimiento del AEN: De la HDMO se obtuvo un aceite traslúcido de cáscaras de naranjas de 0,5% (p/p) de rendimiento; para 500 g de cáscara de naranja fresca se obtuvieron alrededor de 3 mL (2,65 g) de aceite, tras un proceso de destilación de 20 min. Blanco et al [18] observaron que los rendimientos del AEN están alrededor de 0,4%. La extracción asistida por microondas es una técnica relativamente novedosa que ofrece ventajas ambientales, como son: el uso de menores cantidades de solvente, disminución del consumo de energía, baja toxicidad de los solventes y menor cantidad de productos de desecho. Esto permite la obtención de extracciones más selectivas y rápidas con recuperación similar o mejor, comparada con procesos convencionales [19,20]. Zhang et al [19] y Proestos y Komaitis [21] señalaron altos rendimientos en la extracción de sustancias de interés como aceites, polifenoles, flavonoides, quinonas, terpenoides y alcaloides.
Hongos postcosecha en lechosa: En el análisis fitopatológico preliminar, de frutos de lechosa procedentes de mercados locales, se observó la presencia de diversos hongos postcosecha, identificados como: C. gloeosporioides, P. indicum, F. solani, R. stolonifer y A. flavus (Tabla 1).
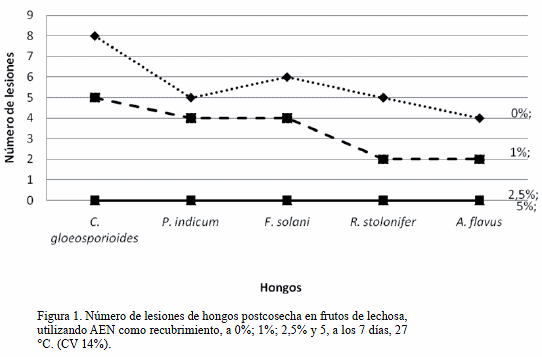
Efecto fungistático del AEN en el crecimiento micelial de hongos postcosecha in vitro: El micelio de todos los hongos se inhibió en un 100% cuando se utilizaron las concentraciones de 2,5% y 5% del aceite esencial (p>0,05), no presentando diferencias entre las concentraciones. La concentración del aceite esencial al 1% inhibió el crecimiento micelial de los hongos entre el 80,9% y 83,5%, sin diferencias significativas (p>0,05), pero presentando diferencias significativas con respecto al control y a las concentraciones de 2,5% y 5% (p<0,05) (Tabla 2 y figura 1).
Fisher y Phillips [22], encontraron que los componentes de los aceites esenciales de limón (Citrus limon L.), naranja (Citrus sinensis L.) y bergamota (Citrus bergamia) son efectivos para el control de patógenos en frutos; la efectividad se debe a que los aceites de cítricos presentan en su composición química terpenos como el limoneno (92,52 a 97,3%) y β-pineno (1,37 a 1,82%) [23]. Asimismo, Di Vaio et al. [24] determinaron que el componente principal del aceite esencial de limón fue el limoneno, que representó entre 72,5 y 76,4%, seguido de β-pineno (11,6-18,7%). Por otra parte, Marei et al [25] informaron que tres monoterpenos (timol, (S)-limoneno y 1,8-cineol) tienen propiedades antifúngicas efectivas, al inhibir el crecimiento micelial de los hongos Rhizoctonia solani, F. oxysporum, P. digitatum y A. niger. Igualmente, Chuah et al [26] notificaron que los aceites esenciales del limón tienen actividad antifúngica contra los hongos como F. oxysporum y Glomerella cingulata, causantes de enfermedades en frutos.
Efecto del recubrimiento de los frutos de lechosa con el AEN sobre los hongos postcosecha: Las concentraciones del AEN de 2,5% y 5% resultaron efectivas en un 100%, evitando daños por hongos postcosecha en frutos de lechosa, no presentando diferencias significativas (p>0,05), pero si se obtuvieron diferencias con respecto al tratamiento del aceite esencial al 1% y el control (con presencia de lesiones en número entre 2 y 8 por fruto). Rico et al [27], utilizaron recubrimientos en frutos de mangos y encontraron que el AEN al 1% redujo significativamente la presencia de bacterias, hongos y levaduras.
El AEN utilizado en el recubrimiento al 2,5% y 5% inhibió el crecimiento de hongos postcosecha como C. gloeosporioides, P. indicum, F. solani, R. stolonifer y A. flavus en los frutos durante los primeros 7 días de almacenamiento a 25 ± 2 ºC y 70% de HR (Figura 1). Asimismo, disminuyó el deterioro de los frutos, reflejado en una mejor calidad visual de los mismos con un proceso de maduración ligeramente tardío respecto al control. En el control los daños se incrementaron con el periodo de almacenamiento, sin embargo, las lesiones observadas fueron superficiales.
Velasquez-Nuñez et al [28] encontraron que la adición directa del AEN al medio de crecimiento PDA tiene un efecto rápido en el control de A. flavus, sin embargo, la exposición de este aceite esencial fue más efectiva requiriendo concentraciones más bajas para lograr un efecto similar. Por su parte, Barrera-Necha et al [29] comprobaron que los aceites esenciales de Cinnamomum zeylanicum y Syzygium aromaticum tienen actividad antifúngica sobre C. gloeosporioides en frutos de lechosa cuando son aplicados por inmersión al 1%, con cambios mínimos en la calidad en 10 días de conservación.
La importancia de los aceites esenciales radica en que son biodegradables y efectivos para el control de enfermedades en condiciones de campo y almacenamiento, reduciendo las aplicaciones de fungicidas químicos sintéticos, garantizando la seguridad alimentaria en países en desarrollo [30].
Conclusiones
El aceite esencial de naranja fue efectivo inhibiendo el crecimiento micelial de los hongos postcosecha. Al ser utilizado como recubrimiento de frutos de lechosa redujo las pudriciones por microorganismos. Se considera una alternativa de control de hongos postcosecha efectiva y sin contaminantes, tanto preventiva como curativa, capaz de preservar por más tiempo los frutos de lechosa.
Referencias
1. Adetuyi FO, Ayileye TA, Dada IBO.Comparative study of quality changes in shea butter coated pawpaw Carica papaya fruit during storage. Pak J Nutr. 2008; 7:658-62. [ Links ]
2. Paull RE, Nishijima W, Reyes M, Cavaletto C. Postharvest handling and losses during marketing of papaya (Carica papaya L.). Postharvest Biol Technol. 1997; 11:165-79. [ Links ]
3. Gatto MA, Ippolito A, Linsalata V, Cascarano NA, Nigro F, Vanadia S, Di Venere D. Activity of extracts from wild edible herbs against postharvest fungal diseases of fruit and vegetables. Postharvest Biol Technol. 2011; 61:72-82. [ Links ]
4. Tripathi P, Dubey NK, Shukla AK. Use of some essential oils as post-harvest botanical fungicides in the management of grey mould of grapes caused by Botrytis cinerea. World J Microbiol Biotechnol. 2008; 24:39-46. [ Links ]
5. Zain ME. Impact of mycotoxins on humans and animals. J Saudi Chem Soc. 2011;15:129-44. [ Links ]
6. Fernández-Cruz ML, Mansilla ML, Tadeo JL. Mycotoxins in fruits and their processed products: analysis, occurrence and health implications. J Adv Res. 2010; 1:113-22. [ Links ]
7. Solaimani B, Ramezani M, Saharkiz MJ. Biological control of postharvest disease caused by Penicillium digitatum and P. italicum on stored citrus fruits by Shiraz thyme essential oil. Adv Environ Biol. 2009; 3:249-54. [ Links ]
8. Alvarez A, Nishijima W. Postharvest diseases of papaya. Plant Dis. 2012; 71:681-6. [ Links ]
9. Barrera L, García L. Actividad antifúngica de aceites esenciales y sus compuestos sobre el crecimiento de Fusarium sp. aislado de papaya (Carica papaya). Revista Científica UDO Agrícola. 2008; 8:33-41. [ Links ]
10. Combrinck S, Regnier T, Kamatou GP. In vitro activity of eighteen essential oils and some major components against common postharvest fungal pathogens of fruit. Ind Crops Prod. 2011; 33:344-9. [ Links ]
11. Prakash-Srivastava M, Sharma N. Application of essential oils: an alternative method for controlling postharvest losses. Enviro News. 2013;19:3 [ Links ]
12. Gachango E, Kirk W, Schafer R, Wharton P. Evaluation and comparison of biocontrol and conventional fungicides for control of postharvest potato tuber diseases. Biol Control. 2012; 63:15-120. [ Links ]
13. Eissa-Hesham A. Effect of chitosan coating on shelf life and quality of fresh-cut mushroom. J Food Quality. 2007; 30:623- 45. [ Links ]
14. Shelz Z, Molnar J, Hohmann J. Antimicrobial and antiplasmid activities of essential oils. Fitoterapia. 2006; 77:279-85. [ Links ]
15. Park MJ, Gwaka KS, Yang KW, Kim EB, Jeung JW, Chang IG et al. Effect of citral, eugenol, nerolidol and α-terpineol on the ultrastructural changes of Trichophyton mentagrophytes. Fitoterapia. 2009; 80:290-6. [ Links ]
16. Caccioni RL, Guizzardi M, Biondi DM, Renda A, Giuseppe R. Relationship between volatile components of citrus fruit essential oils and antimicrobial action on Penicillium digitatum and Penicillium italicum. Int J Food Microbiol. 1998; 43:73-9. [ Links ]
17. Rueda MS. Manejo post-cosecha y comercialización de la papaya. Programa nacional de capacitación en manejo postcosecha y comercialización de frutas y hortalizas. Convenio SENA-Reino Unido: Serie de paquetes de capacitación sobre manejo post-cosecha de frutas y hortalizas. Centro Agroindustrial del SENA. Primera edición. Armenia, Quindío, Colombia: 1999; 198pp.
18. Blanco C, Stashenko EE, Combariza MY, Martínez JR. Comparative study of Colombian citrus oils by highresolution gas chromatography and gas chromatographymass spectrometry. J Chromatogr A. 1995; 697:501-13. [ Links ]
19. Zhang HF, Yang XH, Wang Y. Microwave assisted extraction of secondary metabolites from plants: current status and future directions. Trends Food Sci Tech. 2011; 22:672-88. [ Links ]
20. Chan CH, Yusoff R, Ngoh GC, Kung FWL. Microwaveassisted extractions of active ingredients from plants. J Chromatogr A. 2011; 1218:6213-25. [ Links ]
21. Proestos C, Komaitis M. Application of microwave-assisted extraction to the fast extraction of plant phenolic compounds. Food Sci Technol-LEB. 2008; 41:652-9. [ Links ]
22. Fisher K, Phillips. Potential antimicrobial uses of essential oils in food: is citrus the answer? Trends Food Sci Technol. 2008; 19:156-64. [ Links ]
23. Hosni K, Zahed N, Chrif R, Abid I, Medfei W, Karell M, et al. Composition of peel essential oils from four selected Tunisian citrus species: evidence for the genotypic influence. Food Chem. 2010; 123:1098-104. [ Links ]
24. Di Vaio C, Graziani G, Gaspari A, Scaglione G, Nocerino S, Ritieni A. Essential oils content and antioxidant properties of peel ethanol extract in 18 lemon cultivars. Sci Hortic. 2010; 126:50-5. [ Links ]
25. Marei G, Rasoul MA, Abdelgaleil SA. Comparative antifungal activities and biochemical effects of monoterpenes on plant pathogenic fungi. Pestic Biochem Physiol. 2012; 103:56-61. [ Links ]
26. Chuah TS, Tan YY, Ismail BS. In vitro evaluation of the antifungal activity of some essential oils on postharvest fungal pathogens of tropical fruits. Plant Prot Q. 2010; 25:162-4. [ Links ]
27. Rico F, Gutiérrez C, Díaz-Moreno C. Efecto de recubrimientos comestibles de quitosano y aceites esenciales en la calidad microbiológica de mango (Mangifera indica L.) mínimamente procesado. Vitae. 2012; 19:117-9. [ Links ]
28. Velázquez-Nuñez MJ, Avila-Sosa R, Palou E, López-Malo A. Antifungal activity of orange (Citrus sinensis var. Valencia) peel essential oil applied by direct addition or vapor contact. Food Control. 2013; 31:1-4. [ Links ]
29. Barrera-Necha L, Bautista-Baños S, Flores-Moctezuma E, Rojas Estudillo A. Efficacy of essential oils on the conidial germination, growth of Colletotrichum gloeosporioides (Penz.) Penz. y Sacc and control of postharvest diseases in papaya (Carica papaya L.). Plant Pathol J. 2008; 7:174-8. [ Links ]
30. Enyiukwu D, Awurum A, Nwaneri J. Efficacy of plant-derived pesticides in the control of myco-induced postharvest rots of tubers and agricultural products: a review. Net J Agric Sci. 2014; 2:30-46. [ Links ]












 uBio
uBio