Interciencia
versión impresa ISSN 0378-1844
INCI v.29 n.1 Caracas ene. 2004
Algunas características funcionales
de las comunidades bacterianas del mucus asociado
a tejidos sanos y con síndrome de banda amarilla
en Montastraea annularis
Adriana García, Aldo Cróquer y Nora Malaver
Adriana García. Licenciada en Biología, Universidad Central de Venezuela (UCV). Estudiante de Maestría en Ciencias Biológicas, Universidad Simón Bolívar (USB), Venezuela. Dirección: Departamento de Biología de Organismos, USB. Apartado Postal 89000, Caracas 1080, Venezuela. e-mail: adriana@intecmar.usb.ve
Aldo Cróquer. Licenciado en Biología, UCV. Estudiante de Doctorado en Ciencias Biológicas, USB. Investigador Asociado, Fundación Científica Los Roques. Dirección: Intecmar, USB. Apartado Postal 89000, Caracas 1080, Venezuela. e-mail: croquer@telnet.net.ve
Nora Malaver. Doctora en Ecología, UCV. Directora, Instituto de Zoología Tropical, Facultad de Ciencias, UCV. e-mail: nmalaver@strix.ciens.ucv.ve
Resumen
Se caracterizaron y compararon algunas propiedades funcionales de las comunidades bacterianas asociadas a la capa de mucopolisacáridos en tejidos sanos y enfermos con banda amarilla del coral Montastraea annularis. Tres colonias con este síndrome fueron seleccionadas y se colectó una muestra de mucus asociado a tejidos normales y afectados de cada individuo, succionando cuidadosamente la superficie de cada colonia con jeringas estériles de 5ml. Se tomaron muestras de agua a 1m encima de cada colonia en frascos esterilizados de 10ml. Las muestras se trasladaron al laboratorio en cavas con hielo para el aislamiento de cepas bacterianas (48h) con métodos microbiológicos estándar. Se seleccionaron aleatoriamente 25 cepas de cada muestra para realizar pruebas bioquímicas y estudiar las características de las comunidades bacterianas heterotróficas en cada compartimiento. Se estudió la hidrólisis de azúcares, degradación de citrato, lípidos y proteínas, reducción de nitratos y actividad ureásica, y crecimiento aeróbico y anaeróbico. Las características funcionales de cada comunidad se compararon mediante análisis de agrupamiento. Las comunidades bacterianas asociadas al mucus de tejidos enfermos tuvieron mayor proporción (60%) de bacterias capaces de degradar lípidos y proteínas, y mostraron alta actividad ureásica (40%) comparada con las muestras de agua (10%). Más del 70% de las cepas estudiadas redujeron nitratos a nitritos y crecieron en condiciones aeróbicas y anaeróbicas. La alta actividad lipolítica y proteolítica, y la gran proporción de bacterias capaces de desdoblar úrea en el mucus asociado a tejidos enfermos pudieran estar relacionadas con el desarrollo del síndrome de banda amarilla y con la mortandad de tejidos en colonias enfermas.
Summary
Some biochemical properties of bacterial communities associated with mucopolysaccharides were described and compared in both healthy and diseased tissues of the coral Montastraea annularis attacked by the yellow blotch disease. Three colonies affected by this syndrome were selected. For each colony, a sample of mucus associated to normal and diseased tissues was carefully taken with a 5ml syringe. Water samples were collected in 10ml sterilized flasks, 1m away from each colony. Samples were transported in ice coolers for posterior isolation (48 h) of bacteria using standard microbiology methods. Eight biochemical tests (sugar and starch fermentation, citrate, protein and lipid degradation, nitrate reduction, urease reaction and aerobic-anaerobic growth), were performed for each of the 25 bacterial colonies randomly selected from each sample. The biochemical features of these bacterial communities were compared by cluster analysis. Bacterial communities associated with the mucopolysaccharide layer of diseased tissues showed a higher percentage (60%) of bacteria able to degrade both proteins and lipids. These bacteria also showed an important capacity to use urea (40%) as compared to water bacterial communities (10%). Most bacteria (70%) isolated from all samples were able to reduce nitrates to nitrites and growth in aerobic and anaerobic conditions. The ability of bacteria to degrade proteins, lipids and urea in the mucopolysaccharide layer might be related with the mechanisms that produce the tissue mortality observed in the yellow blotch syndrome.
Resumo
Se caracterizaram e compararam algumas propriedades funcionais das comunidades bacterianas associadas à capa de mucopolisacáridos em tecidos sãos e enfermos com banda amarela do coral Montastraea annularis. Três colônias con esta síndrome foram selecionadas e colectou-se uma amostra de mucus associado a tecidos normais e afetados de cada individuo, succionando cuidadosamente a superfície de cada colônia com seringas estéreis de 5ml. Se tomaram amostras de água a 1m encima de cada colônia em frascos esterilizados de 10ml. As amostras se trasladaram ao laboratório em caixas térmicas com gelo para o isolamento de cepas bacterianas (48h) com métodos microbiológicos estándar. Se selecionaram aleatoriamente 25 cepas de cada amostra para realizar provas bioquímicas e estudar as características das comunidades bacterianas heterotróficas em cada compartimento. Se estudou a hidrólisis de açúcares, degradação de citrato, lípidos e proteínas, redução de nitratos e atividade ureásica, e crescimento aeróbico e anaeróbico. As características funcionais de cada comunidade se compararam mediante análise de agrupamento. As comunidades bacterianas associadas ao mucus de tecidos enfermos tiveram maior proporção (60%) de bactérias capazes de degradar lípidos e proteínas, e mostraram alta atividade ureásica (40%) comparada com as amostras de agua (10%). Mais de 70% das cepas estudadas reduziram nitratos a nitritos e cresceram em condições aeróbicas e anaeróbicas. A alta atividade lipolítica e proteolítica, e a grande proporção de bactérias capazes de desdobrar úreia em mucus associado a tecidos enfermos puderam estar relacionadas com o desenvolvimento da síndrome de banda amarela e com a mortandad de tecidos em colônias enfermas.
PALABRAS CLAVE / Bacterias de Corales / Bacteriología / Banda Amarilla / Biología Marina /
Recibido: 22/09/2003. Modificado: 08/12/2003. Aceptado: 17/12/2003
Introducción
Las bacterias son importantes componentes del medio ambiente arrecifal. En condiciones naturales contribuyen a la producción de carbono (Ducklow, 1990), al reciclaje de nutrimentos (D'Elia y Wiebe, 1990) y representan fuentes de alimento para una gran variedad de organismos de los arrecifes (Sorokin, 1990). No obstante, cuando las condiciones ambientales cambian como resultado de algún disturbio, natural o antrópico, estas bacterias y especialmente las que se encuentran asociadas a la capa de mucopolisacáridos de los corales escleractínidos, pueden convertirse en patógenos potenciales, capaces de desencadenar epidemias en diferentes organismos arrecifales (Peters, 1997; Rohwer et al., 2001).
En las últimas décadas se ha reportado un incremento significativo en la incidencia de enfermedades infecciosas en comunidades arrecifales del Caribe (Goreau et al., 1998; Richardson, 1998; Weil, 2001; Weil et al., 2002; Croquer et al., 2003). Según Harvell et al. (1999, 2002). Este incremento puede estar relacionado con diversos factores que han cambiado las características ambientales en los arrecifes, entre los que se pueden mencionar los cambios climáticos globales que han ocasionado el incremento de la temperatura del agua, el incremento en la intensidad y frecuencia de eventos como el Niño (Glynn y Colgan, 1992; Rosemberg y Ben-Haim, 2002), el transporte de patógenos a través de las aguas de lastre de los barcos que atraviesan el Canal de Panamá, lo que representa la conexión de provincias biogeográficas separadas por millones de años y nuevos patógenos en contacto con nuevos hospedadores (Harvell et al., 1999, 2002), y la pérdida de la calidad del agua debida a la introducción frecuente de nutrientes y aguas servidas en los arrecifes (Tomascik y Sanders, 1987; Connell, 1997). Estos factores probablemente han contribuido a incrementar la susceptibilidad de los hospedadores y a amplificar la virulencia de los patógenos (Ritchie et al., 2001).
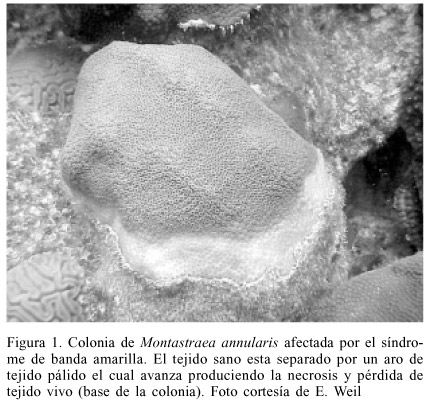
Las enfermedades que afectan a corales escleractínidos han sido reconocidas como importantes fuentes de mortandad en los arrecifes. Sin embargo, solo en algunos casos se ha logrado identificar los agentes causales de dichas enfermedades, como por ejemplo la enfermedad de banda negra (Antonius, 1973; Rützler y Santavy, 1983), la plaga blanca (Denner et al., 2003) y en el caso de los octocorales la aspergiliosis (Nagelkerken et al., 1997; Smith et al., 1998). El síndrome de banda amarilla (SBA) es uno de los más ampliamente distribuidos en todo el Caribe. Según Goreau et al. (1998), éste fue reportado por primera vez en 1990 por Hayes y Bush, asociado a corales blanqueados en las islas Caimán. No obstante, según Bruckner (2002), la primera observación fue realizada por Reeves (1994) en los cayos de Florida. Ha sido observado afectando a más de 10 especies (Garzón-Ferreira et al., 2001) en la mayor parte de las regiones de la cuenca del Caribe (Bruckner, 2002; Weil et al., 2002). Ataca principalmente a las especies del complejo Montastraea annularis (M. annularis, M. faveolata y M. franksi; Garzón-Ferreira et al., 2001). Se caracteriza por producir la mortalidad progresiva de los tejidos afectados, los cuales comienzan a palidecer y finalmente sufren necrosis (Figura 1). A pesar de su amplia distribución y de la mortalidad que produce sobre las colonias afectadas, hasta la fecha no se conoce con certeza la causa de la mortandad de los tejidos (Green y Bruckner, 2000). Cervino et al. (2001) encontraron una disminución significativa en el índice mitótico de las zooxantelas asociadas a tejidos enfermos con SBA, concluyendo que el patógeno putativo podría afectar a las zooxantelas y producir de manera indirecta la mortandad del tejido de coral.
Existen evidencias que sugieren que la composición y las características funcionales de las comunidades bacterianas asociadas al mucus de tejidos sanos de corales cambian significativamente en condiciones de estrés fisiológico (Ritchie y Smith, 1995). La comparación de las características funcionales de comunidades bacterianas asociadas al agua, y a las bacterias presentes en la capa de mucopolisacáridos de tejidos sanos y enfermos podría representar una herramienta útil para el posterior aislamiento e identificación de patógenos potenciales. En este sentido, si se conocen y describen los principales cambios que ocurren en estas comunidades y además se identifican las cepas bacterianas cuyo potencial bioquímico difiera de las bacterias asociadas a tejido sano, podrían seleccionarse algunos morfotipos para realizar posteriores experimentos de re-infección que cumplan con los postulados de Koch.
Si las comunidades bacterianas asociadas al mucus de tejidos sanos, enfermos con SBA y agua son diferentes, se esperaría que el potencial bioquímico de cada una de estas comunidades fuese de igual forma distinto. El objetivo de este trabajo fue analizar de forma comparativa algunas características funcionales de las comunidades bacterianas asociadas al agua y al mucus de los tejidos sanos y afectados por el SBA de la especie constructora de arrecifes M. annularis.
Área de Estudio
El presente trabajo se realizó en el Parque Nacional Archipiélago de Los Roques (PNALR), un complejo arrecifal situado a 110km al norte del puerto de La Guaira, Venezuela, entre 11º58'36'' y 11º44'30''N, y entre 66º33'30'' y 66º57'27''O (Hung, 1985; García et al., 2002). El PNALR es la formación coralina más importante de Venezuela. Es un sistema arrecifal con características oceánicas, coberturas coralinas ubicadas entre 17 y 38%, y poca influencia continental (Zubillaga, 2001). Este sistema arrecifal es considerado como uno de los más importantes de la región del Caribe en términos de diversidad y cobertura coralina, con valores ubicados entre 40 y 70% (Weil, 2002).
Materiales y Métodos
A fin de comparar las características funcionales de las comunidades bacterianas asociadas al mucus de tejidos sanos, de tejidos afectados por el SBA y del agua cercana a las colonias del coral Montastraea annularis Ellys & Solander, 1786 (Cnidaria, Scleractinea), se realizaron pruebas bioquímicas relacionadas con la capacidad de degradación de diferentes substratos por parte de las comunidades bacterianas asociadas a cada uno de los compartimientos mencionados.
Recolección de las muestras para cultivos bacteriológicos
Las muestras fueron recolectadas en el arrecife costanero del cayo de Dos Mosquises Sur, ubicado al SO del archipiélago, a 11º48'03''N y 66º53'30''O. Se seleccionaron tres colonias de M. annularis con signos de SBA, ubicadas a 5m de profundidad. Las muestras se recolectaron evitando la remoción de sedimentos en el agua y el depósito sobre la superficie de la colonia. El orden de recolección de muestras fue de agua circundante primero, luego de mucus asociado a tejido enfermo y finalmente de mucus asociado a tejido sano.
Las muestras de agua se colectaron con frascos estériles de 10ml, los cuales se abrieron y llenaron completamente a 1m por encima de cada colonia. Las muestras de mucus asociados a tejido sano y enfermo se extrajeron succionando cuidadosamente la superficie de las colonias con jeringas estériles de 5ml, evitando la producción excesiva de mucus de las colonias seleccionadas. Las muestras de mucus sobre tejido con signos de SBA fueron colectadas sobre el área intermedia de la banda, entre tejido necrótico y sano, mientras que las muestras de mucus en los tejidos aparentemente sanos se colectaron a 30cm de las áreas afectadas. Una vez colectadas, las muestras fueron almacenadas en hielo y trasladadas al laboratorio donde fueron procesadas en las próximas 24-48h.
Aislamiento de las cepas bacterianas
Las muestras de mucus del tejido y de agua de las tres colonias fueron colocadas, por separado, en fiolas estériles y homogeneizadas al ser sometidas a agitación manual por 30seg. A partir de cada muestra se realizaron diluciones seriadas (1:10 y 1:100), en solución salina peptonada (SSP). Posteriormente, se sembraron por inclusión alícuotas de 1ml de las muestras sin dilución, 1:10 y 1:100 por triplicado en agar nutritivo (AN) colocados en placas de Petri (Garassini, 1962, 1967; Harrigan y McCance, 1968). Las placas de AN fueron incubadas a temperatura ambiente por 48h.
Luego del período de incubación, se llevó a cabo el conteo y aislamiento de todas las colonias de bacterias, de cada triplicado, y se reportaron como unidades formadoras de colonias bacterianas (UFC). Cada UFC fue repicada para obtener cepas puras de acuerdo a procedimientos microbiológicos estándar (Garassini, 1962; 1967; Harrigan y McCance, 1968). Para cada triplicado, fueron seleccionadas 25 cepas al azar, utilizando una tabla de números aleatorios. Se obtuvo una muestra representativa de 75UFC, por cada colonia de M. annularis, 25 del tejido sano, 25 del tejido enfermo y 25 del agua circundante.
Caracterización funcional de las comunidades bacterianas heterotróficas (pruebas bioquímicas)
Para cada cepa seleccionada en cada compartimiento, se aplicaron 8 pruebas bioquímicas (Tabla I). La selección de estas pruebas se realizó en función de la composición química del mucus de los corales escleractínidos, reproduciendo alguna de las fuentes de carbono que frecuentemente se encuentran en el mucus. Éste representa un aporte importante de carbono y energía; tales como hidratos de carbono, lípidos, proteínas y otros compuestos nitrogenados, los cuales son utilizados por las bacterias heterotróficas asociadas a la capa de mucopolisacáridos de los escleractínidos (Ducklow y Mitchell, 1979a, b). Además, las pruebas seleccionadas son comunes en el estudio de la caracterización bioquímica de las comunidades bacterianas asociadas al mucus de tejidos sanos y enfermos de corales (Ritchie y Smith, 1995), así como también en la caracterización bioquímica de patógenos de enfermedades de corales (Denner et al., 2003).
Análisis estadísticos
Con la finalidad de determinar la similitud o disimilitud de los grupos funcionales aislados a partir de cada uno de los compartimentos (agua, tejido sano y enfermo) se aplicó un análisis de agrupamiento de distancias euclídeas (vecino más cercano). Para ello se construyeron matrices con valores asignados de 1 (cepas que respondieron positivamente a la prueba), 2 (cepas que respondieron negativamente), 3 (cepas con capacidad de hidrólisis total de almidón), 4 (cepas con hidrólisis parcial de almidón), 5 (cepas facultativas) 6 (cepas aeróbicas) y 7 (cepas anaeróbicas). A partir de estas matrices se generaron diagramas de agrupación por columnas (comparación de substratos independientemente del compartimiento: tejido sano, enfermo y agua) y diagramas de agrupación por filas (comparación entre cada compartimiento: tejido sano, enfermo y agua).
Resultados
En la Tabla II se muestra el porcentaje de UFC capaz de degradar cada uno de los substratos utilizados. La mayor parte de las cepas aisladas del mucus de tejidos sanos, enfermos y agua se caracterizaron por ser capaces de crecer en el medio de tioglicolato en condiciones aeróbicas y anaeróbicas. Por su parte, de las fuentes de N2, el nitrato fue más utilizado. Entre 38 y 96% de las cepas aisladas fueron capaces de reducirlo a nitritos, mientras que para la úrea los porcentajes oscilaron entre 0 y 8%. Con relación a los carbohidratos la fuente de C más utilizada fue el almidón, independientemente del compartimiento observado (tejido sano, enfermo y agua), con porcentajes que oscilaron entre 0 y 24%. La glucosa y la lactosa fueron poco utilizadas por las cepas aisladas de los tejidos sanos y el agua (0-4%), y más utilizadas por las cepas asociadas a los tejidos enfermos (0-20%). La actividad lipolítica y proteolítica de las bacterias se presentó en los tres compartimentos analizados, pero mayoritariamente en el mucus asociado a tejido enfermo al igual que la capacidad de degradar el citrato como única fuente de C.
En la Figura 2 se muestran los porcentajes de las colonias de bacterias aisladas capaces de utilizar las distintas fuentes de C y N2 en cada compartimiento estudiado. En el tejido enfermo el porcentaje de utilización de glucosa (69%), lactosa (67%) y almidón (40%) fue mayor comparado con el mucus extraído de tejido sano y en el agua. Asimismo, la actividad proteolítica (38%) y lipolítica (40%) en el mucus extraído del tejido enfermo fue mayor que en tejido sano y agua. La misma tendencia se observó en la utilización de citrato como única fuente de C, donde cerca del 60% de las colonias bacterianas asociadas al mucus de tejido enfermo fueron capaces de utilizarlo. Con relación a las fuentes de N2, en el mucus del tejido enfermo se observó una mayor actividad ureásica (40%) comparado con el agua (10%), mientras que la capacidad de reducir nitratos fue similar (33%) en los tres compartimientos. La proporción de cepas bacterianas capaces de crecer en tioglicolato fue similar (33%) entre los distintos compartimientos, indistintamente de las condiciones de anaerobiosis. Finalmente, la proporción de cepas productoras de sulfuro de hidrógeno fue menor en tejido enfermo.
En la Figura 3 se muestran los resultados del análisis de agrupamiento por substratos suministrados a las cepas bacterianas independientemente del compartimiento del que fueron aisladas. Con relación a los carbohidratos, el uso de lactosa y glucosa fue similar entre las comunidades bacterianas analizadas. El almidón fue el único hidrato de carbono que se diferenció del grupo de los azúcares en función de su preferencia. Por su parte, tanto el citrato como el Tween 80 se agruparon en el mismo nodo, indicando un porcentaje similar de cepas bacterianas capaces de utilizar estos sustratos. En cuanto a las fuentes de N2, el nitrato y la úrea se ubicaron en posiciones diferentes del espacio representado en el análisis de agrupamiento, indicando que las comunidades bacterianas asociadas al mucus de tejido enfermo y sano y el agua se diferenciaron en función del uso de estos sustratos. La mayor diferencia entre los substratos administrados, independientemente de los compartimentos muestreados, fue obtenida para el tioglicolato y el nitrato, los cuales se diferenciaron visiblemente de las restantes fuentes de C.
En la Figura 4 se muestran los resultados del análisis de agrupamiento por substratos suministrados para cada una de las comunidades bacterianas asociadas al mucus tejido sano, enfermo y agua. El crecimiento en los medios de tioglicolato y nitrato fue similar para los tres compartimientos y se diferenció de las restantes fuentes de C suministradas. De forma similar el uso de glucosa y lactosa fue similar entre las comunidades bacterianas asociadas al mucus de tejido sano, enfermo y agua. Por su parte, la actividad lipolítica, proteolítica, la capacidad de degradar polisacáridos como el almidón y de utilizar citrato fue similar para las comunidades bacterianas asociadas a tejidos sanos y agua y se diferenció de las comunidades asociadas a tejidos con signos de SBA.
Discusión
Las comunidades bacterianas asociadas al mucus de tejidos sanos, enfermos (con signos de SBA) y el agua resultaron funcionalmente diferentes con respecto a la capacidad de utilizar algunos substratos como fuentes de C y energía. Las comunidades bacterianas asociadas al mucus de tejidos enfermos se caracterizaron por presentar una mayor actividad lipolítica, proteolítica y ureásica, y por degradar citrato. La capacidad de crecer en condiciones aeróbicas y anaeróbicas y de utilizar nitrato fue común para las comunidades bacterianas asociadas a los compartimientos analizados (tejido sano, enfermo y agua), lo cual evidencia el potencial funcional de la comunidad bacteriana en el ciclo del N2 (reducción de nitratos a nitritos). Con relación a la capacidad de degradar carbohidratos, la preferencia entre cada una de las comunidades bacterianas no fue clara, en especial en el caso de la glucosa y la lactosa, en general la mayor parte de las bacterias aisladas del mucus de tejidos sanos, enfermos y agua fueron capaces de crecer en dicho medio de cultivo.
Las bacterias y otros microorganismos viven asociados al mucus producido por los corales, así como también a sus tejidos (Schiller y Herndl, 1989; Saffo, 1992; Paul et al., 1996; Rohwer et al., 2001). El mucus producido por estos organismos posee cantidades significativas de polisacáridos (hexosa, pentosa, glucosa y galactosa), proteínas y lípidos, entre otros componentes, ofreciendo substratos ideales para el crecimiento bacteriano (Pascal y Vacelet, 1981). No obstante, la estructura de las comunidades bacterianas puede cambiar dependiendo de las condiciones ambientales y el estado fisiológico del animal (Rohwer et al., 2001). Por ejemplo, durante el día el tejido de los corales representa un medio ambiente caracterizado por altos niveles de saturación de O2, debido a la actividad fotosintética de las zooxantelas que se encuentran alojadas en el gastrodermo, mientras que en la noche las condiciones pueden ser diferentes, con menores niveles de O2 en los tejidos (Lesser, 1997). Por lo tanto, las bacterias asociadas a estos ambientes se encuentran adaptadas a rápidos cambios micro-ambientales siendo capaces de utilizar diferentes substratos para su metabolismo en las condiciones que prevalecen en un momento determinado (Ducklow y Mitchell, 1979b; Ritchie y Smith, 1997).
Ducklow y Mitchell (1979a) demostraron que las respuestas fisiológicas de las bacterias asociadas al mucus de los corales se encuentran estrechamente ligadas al estatus metabólico del coral hospedador. La condición fisiológica de los corales es extremadamente variable y las características funcionales de las comunidades bacterianas pueden variar inclusive entre especies de coral que se ubican en distintas zonas del arrecife (Ritchie y Smith, 1997). Los factores ambientales que intervienen regularmente en la dinámica de los sistemas coralinos (sedimentación, temperatura, calidad de luz, salinidad, etc.) pueden inducir incrementos en la producción de mucus, eventos de blanqueamiento y mortalidad parcial sobre las colonias coralinas (Kushmaro et al., 1996). Ritchie y Smith (1995), propusieron que los cambios ambientales que producen alteraciones en el estatus fisiológico de los corales, como en el caso del blanqueamiento, pueden producir cambios significativos en la composición y abundancia de las comunidades bacterianas asociadas a las capas de mucopolisacáridos de los corales. Ésto a su vez podría conducir a patologías capaces de producir la mortalidad parcial de los tejidos.
En el caso específico del SBA, el tejido comienza a decolorarse y posteriormente se produce necrosis, llevando a la muerte del área afectada y con el tiempo, en algunos casos, de toda la colonia. Cervino et al. (2001) encontraron una disminución significativa de la densidad de zooxantelas y del índice mitótico de las mismas en áreas afectadas por SBA. Esto conduce a la pérdida de más de 90% del C, el cual es obtenido a partir de la actividad fotosintética de estas algas.
Las diferencias en la densidad de zooxantelas reportada entre los tejidos sanos y enfermos con SBA, podrían generar los cambios observados en las características funcionales de las comunidades bacterianas asociadas al mucus presente en tejidos sanos, enfermo y agua. En este estudio se evidenció un alto porcentaje de bacterias con metabolismo facultativo (uso de rutas metabólicas aeróbicas y/o anaeróbicas). Ritchie y Smith (1997) encontraron que las comunidades bacterianas normalmente asociadas a las especies M. annularis y Diploria strigosa eran capaces de oxidar más eficientemente compuestos complejos como el Tween 80 y el Tween 40 en comparación con comunidades bacterianas asociadas a otras especies de coral.
Como se mencionó anteriormente el porcentaje de cepas bacterianas con capacidad lipolítica y proteolítica (degradación de Tween 80 y gelatina) incrementó en más de 10% en tejidos afectados por SBA. Estos resultados sugieren que las bacterias asociadas al tejido enfermo hacen un mayor uso de fuentes de C provenientes de lípidos y proteínas del mucus, lo que podría estar relacionado con el deterioro de los tejidos.
Asimismo, las bacterias asociadas al mucus de tejido con SBA presentaron una alta actividad ureásica. Denner et al. (2003) observaron un comportamiento similar para Aurantimonas coralicida, el patógeno de la enfermedad de plaga blanca. En este trabajo se relacionó la actividad ureásica con el mecanismo que produce la mortalidad de los tejidos generado por dicha enfermedad
En cuanto a la preferencia en la degradación de citrato, Ritchie y Smith (1995) mencionan que las bacterias asociadas a la enfermedad de banda blanca (EBB) mostraron preferencia por los ácidos cítricos, los cuales son intermediarios metabólicos en los ciclos del glioxilato y del ácido tricarboxílico. Por su parte, el ácido acético, el D-L-láctico y el metilpirúvico, los cuales son substratos comunes para bacterias sulfo-reductoras, también fueron preferidos por las bacterias aisladas de los tejidos afectados por EBB (Ritchie y Smith, 1995).
El análisis de las características metabólicas de las comunidades bacterianas apenas comienza a ser utilizado en el estudio de las enfermedades que afectan a corales escleractínidos (Ritchie y Smith, 1995; Denner et al., 2003). Los cambios en las características metabólicas normales de las comunidades bacterianas, esto es, en la preferencia de utilización de fuentes de C y otros sustratos, podría ser una respuesta a cambios ambientales, a la introducción de algún patógeno o también un indicativo del estado fisiológico del hospedador (Ritchie y Smith, 1995). La identificación de cepas bacterianas cuyas habilidades bioquímicas difieran de las características metabólicas de la comunidad presente en mucus de los tejidos sanos, podría facilitar la selección de patógenos potenciales en experimentos de reinfección, lo que contribuiría a su identificación a través de los postulados de Koch.
En conclusión, las características metabólicas de las comunidades asociadas al agua y al mucus presente en tejidos sanos y enfermos con SBA, fueron diferentes. Las comunidades bacterianas asociadas al SBA se caracterizaron por presentar una mayor proporción de bacterias capaces de degradar citrato y con actividad lipolítica y proteolítica en comparación con las comunidades bacterianas asociadas al mucus de los tejidos sanos y agua. La capacidad de reducir nitratos a nitritos y de crecer en condiciones aeróbicas o anaeróbicas fue una característica común de las comunidades bacterianas asociadas a los compartimientos analizados. Se requiere de más estudios que exploren el uso de otras fuentes de C para una mejor caracterización bioquímica de las comunidades bacterianas normales, lo que contribuiría a detectar de forma más precisa los cambios que en éstas ocurren cuando se presenta el SBA. Es necesario identificar las cepas que difieran del comportamiento natural de las comunidades bacterianas en mucus de tejido sano, y posteriormente incluirlas en experimentos de reinfección que satisfagan los postulados de Koch.
AGRADECIMIENTOS
Los autores agradecen a Sheila Marques por su contribución en los muestreos de campo, a Juan Carlos Fernández y la Fundación Científica Los Roques por el apoyo logístico prestado, a Ernesto Weil por la facilitación de material fotográfico y bibliográfico, a Jesús Ramos y Andreina Arias del IZT, UCV por su ayuda en el trabajo microbiológico, a Pablo Mata, Melchor, Francisco, Jesús y Alex, de la Estación de Biología Marina de Dos Mosquises Sur, por su apoyo en las campañas de muestreo, y al Instituto Nacional de Parques Nacionales (INPARQUES).
REFERENCIAS
1. Antonious A (1973) New observations in coral destruction in reefs. Assoc. Isl. Mar. Lab. Carib. 10:3. [ Links ]
2. Bruckner AW (2002) Priorities for effective management of coral diseases. NOAA Technical Memorandum NMFS-OPR-22. US Dept. of Commerce. Washington DC, EEUU. 54 pp. [ Links ]
3. Cervino J, Goreau TJ, Nagelkerken I, Smith GW, Hayes R (2001) Yellow band and dark spots syndromes in Caribbean corals. Hydrobiologia 460: 53-63. [ Links ]
4. Connell JH (1997) Disturbance and recovery of coral assemblages. Coral Reefs 16 (Suppl.): S101-S113. [ Links ]
5. Cróquer A, Pauls SM, Zubillaga AL (2003) Coral disease outbreak in a coral reef at Los Roques National Park. Rev. Biol. Trop. 51 (Supl. 6): 39-45. [ Links ]
6. Denner EBM, Smith GW, Busse HJ, Schumann P, Narzt T, Polson SW, Lubitz W, Richardson LL (2003) Aurantimonas coralicida gen. nov. sp. nov., the causative agent of white plague type II on Caribbean scleractinian corals. Int. J. Syst. Evol. Microbiol. 53: 1115-1122. [ Links ]
7. D'Elia CF, Wiebe WJ (1990) Biogeochemical nutrient cycles in coral-reef ecosystems. En Dubinsky Z (Ed.) Ecosystems of the world (coral reefs). Elsevier. Amsterdam, Holanda. pp. 49-70. [ Links ]
8. Ducklow HW (1990) The biomass production and fate of bacteria in coral reef. En Dubinsky Z (Ed.) Ecosystems of the world (coral reefs). Elsevier. Amsterdam, Holanda. pp. 265-296 [ Links ]
9. Ducklow HW, Mitchell R (1979a) Composition of mucus released by coral reef coelenterates. Limnol. Oceanogr. 24: 706-714. [ Links ]
10. Ducklow HW, Mitchell R (1979b) Bacterial populations and adaptation in the mucus layers on living corals. Limnol. Oceanogr. 24: 715-725. [ Links ]
11. Garassini L (1962) El suelo y su microflora. Facultad de Agronomía. Universidad Central de Venezuela. Maracay, Venezuela. 225 pp. [ Links ]
12. Garassini L (1967) Microbiología Agraria. Facultad de Agronomía. Universidad Central de Venezuela. Maracay, Venezuela. 646 pp. [ Links ]
13. García A, Cróquer A, Pauls SM (2002) Relación entre la incidencia de enfermedades y la estructura de tallas y especies en corales del Parque Nacional Archipiélago de Los Roques. Interciencia 27: 448-453. [ Links ]
14. Garzón-Ferreira J, Gil-Aguledo DL, Barrios LM, Zea S (2001) Stony coral disease observed in southwestern Caribbean reefs. Hydrobiologia 460: 65-69. [ Links ]
15. Glynn PW, Colgan MW (1992) Sporadic disturbances in fluctuating coral reef environments: El Niño and coral reef development in the Eastern Pacific. Am. Zool. 32: 707-718. [ Links ]
16. Goreau TJ, Cervino J, Goreau M, Hayes R, Hayes M, Richardson LL, Smith GW, DeMeyer K, Nagelkerken I, Garzón-Ferreira J, Gil-Aguledo DL, Peters EC, Garrison G, Williams GH, Bunkley J, Quirolo C, Patterson K (1998) Rapid spread of disease in Caribbean coral reefs. Rev. Biol. Trop. 46: 157-172. [ Links ]
17. Green EP, Bruckner AW (2000) The significance of coral disease epizootiology for coral reef conservation. Biol. Conser. 96: 347-361. [ Links ]
18. Harrigan WF, McCance M (1968) Métodos de laboratorio en microbiología. Editorial Academia. León, España. 458 pp. [ Links ]
19. Harvell CD, Kim K, Burkholder JM, Colwell RR, Epstein PR, Grimes DJ, Hofmann EE, Lipp EK, Osterhaus ME, Overstreet RM, Porter JM, Smith GW, Vasta GR (1999) Emerging marine diseases–Climate links and anthropogenic factors. Science 285: 1505-1510. [ Links ]
20. Harvell CD, Mitchell CE, Ward JR, Altizer S, Dobson AP, Ostfeld RS, Samuel MD (2002) Climate warming and disease risk for terrestrial and marine biota. Science 296: 2158-2162. [ Links ]
21. Hayes RL, Bush P (1990) Microscopic observations of recovery in the reef building scleractinean coral, Montastrea annularis, after bleaching on a Cayman reef. Coral Reefs 5: 201-204. [ Links ]
22. Hayes RL, Goreau NI (1998) The significance of emerging diseases in the tropical coral reef ecosystem. Rev. Biol. Trop. 46 (Supl. 5): 173-185. [ Links ]
23. Hung M (1985) Los corales pétreos del Parque Nacional Archipiélago Los Roques. Tesis. Escuela de Biología. Universidad Central de Venezuela. Caracas, Venezuela. 150 pp. [ Links ]
24. Kushmaro A, Loya Y, Fine M (1996) Bacterial infection and coral bleaching. Nature 380: 396. [ Links ]
25. Lesser MP (1997) Oxidative stress causes coral Bleaching during exposure to elevated temperatures. Coral Reefs. 16: 187-192. [ Links ]
26. MacFaddin YF (1980) Pruebas Bioquímicas para la identificación de bacterias de importancia clínica. Panamericana. Argentina. 301 pp. [ Links ]
27. Merck (1994) Manual de medios de cultivo. Frankfurter Strasse. Alemania. 364 pp. [ Links ]
28. Nagelkerken I, Buchan K, Smith GW, Bonair K, Bush P, Garzón-Ferreira J, Botero L, Gayle P, Harvell CD, Heberer C, Kim K, Petrovic C, Pots L, Yoshioka P (1997) Widespread disease in Caribbean sea fans: II Pattern of infection, and tissue loss. Mar. Ecol. Prog. Ser. 160:255-263. [ Links ]
29. Pascal H, Vacelet E (1981) Bacterial utilization of mucus on the coral reef of Aqaba (red sea). Internat. Coral Reef Symp. (Manila). Vol 1. pp. 669-677. [ Links ]
30. Paul JH, DeFlaun MF, Jeffrey WH (1996) Elevated levels of microbial activity in the coral surface microlayer. Mar. Ecol. Prog. Ser. 33: 29-40. [ Links ]
31. Peters EC (1997) Disease of coral-reef organisms. En Birkeland C (Ed.). Life and death of coral reefs. Kluwer. Massachusetts, EEUU. pp. 114-136. [ Links ]
32. Reeves L (1994) Newly discovered: yellow band disease strikes keys reefs. Underwater USA 11: 16. [ Links ]
33. Richardson LL (1998) Coral diseases: what is really known? Trends. Ecol. Evol. 13: 438-443. [ Links ]
34. Ritchie KB, Smith GW (1995) Preferential carbon utilization by surface bacterial communities from water mass, normal and white-band diseased Acropora cervicornis. Mol. Mar. Biol. 4: 345-352. [ Links ]
35. Ritchie KB, Smith GW (1997) Physiological comparison of bacterial communities from various species of scleractinean corals. Proc. 8th Coral Reef Symp. (Panamá). Vol 1. pp. 521-526. [ Links ]
36. Ritchie KB, Shawn W, Polson W, Smith GW (2001) Microbial disease causation in marine invertebrates. Hydrobiologia 460: 131-139. [ Links ]
37. Rohwer FM, Breitbart J, Azam-Jara, F, Knowlton N (2001) Diversity of bacteria associated with the Caribbean coral Montastraea franksi. Coral Reef. 20: 85-91. [ Links ]
38. Rosemberg E, Ben-Haim Y (2002) Microbial diseases of corals and global warming. Environ. Microbiol. 4: 318-326. [ Links ]
39. Rützler K, Santavy DL (1983) The black band disease of Atlantic reef corals. I. Description of the cyanophyte pathogen. P.S.Z.N.I: Mar Ecol 4: 301-319. [ Links ]
40. Saffo MB (1992) Invertebrates in endosymbiotic associations. Amer. Zool. 32: 557-565. [ Links ]
41. Schiller C, Herndl JH (1989) Evidence of enhanced microbial activity in the interstitial space of branched corals: possible implication for coral metabolism. Coral Reef. 7: 179-184. [ Links ]
42. Smith GW, Harvell CD, Kim K (1998) Observations on the pathogenesis of sea fans infected with Aspergillus sp. Rev. Biol. Trop. 46: 205-208. [ Links ]
43. Sorokin YI (1990) Aspects of trophic relations, productivity and energy balance in coral reef ecosystems. En Dubinsky Z (Ed.) Ecosystems of the world (coral reefs). Elsevier. Amsterdam, Holanda. pp.401-408. [ Links ]
44. Tomascik T, Sanders F (1987) Effects of eutrophication on reef-building corals II. Structure of scleractinean coral communities on fringing reefs, Barbados, West Indies. Mar. Biol. 94: 53-75. [ Links ]
45. Weil E (2001) Caribbean coral reef diseases. En McManus J (Ed.) Status and research needs. In Priorities for Caribbean Coral Reef Research. National Center for Caribbean Coral Reef Research. RSMAS. University of Miami. Florida, EEUU. 10 pp. [ Links ]
46. Weil E (2002) The corals and coral reefs of Venezuela. En Cortes J (Ed.) Latin American Coral Reefs. Elsevier. Amsterdam, Holanda. pp. 305-330. [ Links ]
47. Weil E, Urreiztieta I, Garzón-Ferreira J (2002) Geographic variability in the incidence of coral and octocoral diseases in the wider Caribbean. Proc. 9th Internat. Coral Reef Symp. (Bali, Indonesia). Vol 2. pp. 1231-1238. [ Links ]
48. Zubillaga AL (2001) Evaluación del efecto de las actividades de buceo recreativo en la estructura comunitaria de algunos arrecifes coralinos del Parque Nacional Archipiélago de Los Roques. Tesis. Escuela de Biología. Universidad Central de Venezuela. Caracas, Venezuela. 121 pp. [ Links ]












 uBio
uBio