Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Facultad de Ciencias Veterinarias
versión impresa ISSN 0258-6576
Rev. Fac. Cienc. Vet. v.53 n.1 Maracay jun. 2012
Efectos cardiovasculares de la xilazina en conejos: estudios in vivo e in vitro
Elena del C. Briceño*,1, Sergio A. Flores*, Simón G. Comerma-Steffensen**, Andrés E. Rodríguez** y Héctor A. Zerpa**
*Cátedra de Farmacología. Facultad de Ciencias Veterinarias, Universidad Central de Venezuela. República Bolivariana de Venezuela.
**Cátedra de Fisiología. Facultad de Ciencias Veterinarias, Universidad Central de Venezuela. República Bolivariana de Venezuela, Apartado 4563, Maracay, 2101A, estado Aragua, Venezuela
Correo-E: edelcbf@gmail.com
Resumen
La xilazina es un agonista de receptores a2-adrenérgicos, la cual ha sido ampliamente utilizada como sedante y analgésico en Medicina Veterinaria. Sus efectos cardiovasculares han sido atribuidos a acciones directas y/o indirectas, actuando sobre sus órganos blancos y/o modulando el tono autonómico, respectivamente. El objetivo de esta investigación fue determinar los efectos de la xilazina in vivo sobre la presión arterial media (PAM) y la frecuencia cardiaca (FC) en conejos albinos Nueva Zelanda, y evaluar sus efectos in vitro en aurícula derecha y en vena safena aisladas. Se anestesiaron e instrumentaron cuatro conejos, para medir la PAM en forma directa y la FC mediante electrocardiografía. Una vez estabilizadas las variables hemodinámicas, se evaluaron dosis crecientes-acumulativas de xilazina intravenosa. Se determinó el efecto de concentraciones crecientes-acumulativas de xilazina sobre la aurícula derecha y vena safena en órganos aislados convencionales. Se evaluaron los efectos de xilazina sobre la frecuencia cardiaca (lat/min) y la fuerza de contracción (g) auricular, y sobre la vena safena, en ausencia y presencia de prazosín (30nM) y yohimbina (0,1µM). La xilazina in vivo, causó una respuesta bifásica en la PAM, caracterizada por un aumento ligero, seguido de una profunda hipotensión dosis-dependiente, acompañada de bradicardia. En la aurícula derecha, la xilazina no causó modificaciones en su actividad espontánea, aunque en la vena safena produjo contracciones concentración-dependiente sensibles a yohimbina, pero resistentes a prazosín. Los resultados sugieren que la xilazina endovenosa causa reducción en la PAM y bradicardia en el conejo anestesiado, sin modificar las propiedades cronotrópicas e inotrópicas de la aurícula derecha aislada. Sin embargo, en la vena safena aislada, se demuestra que la xilazina causa vasocontracción, primordialmente a través de la acción sobre receptores a2-adrenérgicos. La xilazina ejerce efectos cardiovasculares en el conejo, probablemente a través de la modulación del sistema nervioso autónomo y no por acción directa sobre el corazón.
(Palabras clave: Conejo (oyctolagus), xilazina, sistema cardiovascular, presión sanguínea, frecuencia cardiaca, venas)
Cardiovascular Effects of Xylazine in Rabbits: In vivo and In vitro Studies
Abstract
Xylazine is an a2-adrenoceptor agonist widely employed in Veterinary Medicine as a sedative and analgesic compound. Xylazine cardiovascular effects have been attributed to direct and/or indirect actions, acting on target organs and/or modulating the autonomic outflow, respectively. The aim of this investigation was to determine the in vivo effect of xylazine on mean blood pressure (MBP) and heart rate (HR) in albino New Zealand rabbits and to assess the in vitro effects of xylazine on the isolated right atrium and saphenous vein. Four rabbits were anesthetized and instrumentalized for directly measuring MBP; and HR by electrocardiography respectively. After the stabilization of haemodynamic variables, intravenous cumulative increasing doses of xylazine were administered and evaluated.The effects of xylazine cumulative concentration-response curves on the isolated right atrium and on the saphenous vein in conventional in vitro organ bath studies were assessed. Contraction rate (beats/min) and contraction force (g) were measured in the right atrium. Xylazine-induced contraction (g) in the absence and presence of prazosin (30nM) and yohimbine (0.1µM) was measured in the isolated saphenous vein. The intravenous administration of xylazine caused a biphasic response on the MBP, characterized by slight increase followed by a profound dose-dependent hypotension along with bradycardia. Xylazine did not modify the spontaneous activity of the isolated right atrium, although, yohimbine-sensitive and prazosin-resistant concentration-dependent contractions by xylazine were observed in the isolated saphenous vein. The results suggest that intravenous administration of xylazine causes a reduction in the MBP and bradycardia in the anesthetized rabbit, without a clear modification on the chronotropic and inotropic properties of the isolated right atrium. Nevertheless, xylazine caused vasocontraction of the isolated saphenous vein, primarily by activating a2-adrenoceptors. Xylazine appears to exert its cardiovascular effects in the rabbit by modulating the autonomic nervous system outflow and not by a direct action on the heart.
(Key words: Rabbits, xylazine, cardiovascular system, blood pressure, heart rate, blood veins)
Recibido: 08/07/11 - Aprobado: 07/12/11
Introducción
La xilazina es uno de los agentes sedantes con propiedades analgésicas, de mayor uso en Medicina Veterinaria. Desde su introducción en el siglo pasado, la xilazina ha formado parte de la combinación de agentes farmacológicos usados en la anestesia balanceada en múltiples especies animales. La mayoría de los estudios sobre los efectos farmacológicos de la xilazina han sido realizados en especies animales de interés veterinario, particularmente en perros, caballos y rumiantes (Luna et al., 1992; Van Metre, 1992; Young y Taylor, 1993; Vega, 1996; Martínez et al., 2004). Su acción agonista sobre receptores a2-adrenérgicos pre-sinápticos en el sistema nervioso central, es aparentemente responsable de la reducción del tono simpático y aumento del tono parasimpático, lo cual caracteriza los efectos farmacológicos de la xilazina (Clark y Hall, 1969; Schmitt et al., 1970; Antonaccio et al., 1973; Mc Call et al., 1983; Van Zwieten y Timmermans, 1983; Martínez et al., 2004). Simultáneamente, la acción agonista sobre receptores a1-adrenérgicos y a2-adrenérgicos post-sinápticos también puede contribuir a sus efectos farmacológicos (Savola et al., 1985; Sarazan et al., 1989).
Además de los efectos sedantes sobre el sistema nervioso central, se ha propuesto que muchos de los efectos farmacológicos de la xilazina son el resultado de la modulación de los componentes motores del sistema nervioso autónomo (Schmitt et al., 1970; Antonaccio et al., 1973). La administración intravenosa de xilazina causa bradicardia dosis- dependiente, acompañada de hipertensión arterial transitoria seguida de hipotensión (Schmitt et al., 1970; Keer et al., 1972; Antonaccio et al., 1973; Hsu, 1981; Martínez, 1986). Martínez et al. (2004), obtuvieron resultados similares y sugirieron que estos efectos de la xilazina eran atribuibles a su acción agonista sobre receptores a2-adrenérgicos a nivel del sistema nervioso central, disminuyendo el flujo simpático. Vega (1996) realizó experimentos en perros a los cuales se les bloqueó el sistema nervioso autónomo a través de métodos químicos y quirúrgicos, y evidenciándose un aumento en la magnitud y duración de la hipertensión dosis dependiente, mientras que el índice de contractilidad miocárdica exhibió una tendencia opuesta, por lo que el autor sugirió evaluar el efecto de la xilazina in vitro sobre el miocardio y sobre el músculo liso en diferentes redes vasculares. Al ser un agonista de receptores a2-adrenérgicos, su acción contráctil sobre el músculo liso vascular dependerá de la distribución de estos receptores en la pared media de los vasos sanguíneos, en especial de las venas. El objetivo de este ensayo fue describir los efectos cardiovasculares de la xilazina en conejos, tanto in vivo como in vitro.
Materiales y Métodos
Todos los experimentos se condujeron siguiendo las normas de bioética dictadas por la Facultad de Ciencias Veterinarias de la Universidad Central de Venezuela y el Código de Bioética y Bioseguridad dictado por el Ministerio del Poder Popular para Ciencia, Tecnología e Industrias Intermedias y el Fondo Nacional de Ciencia, Tecnología e Innovación de la República Bolivariana de Venezuela.
Protocolo 1. Experimentos in vivo
Se utilizaron cuatro conejos machos albinos, raza Nueva Zelanda (2,5-3,0 kg). Los conejos fueron anestesiados con pentobarbital sódico (30 mg/kg) a través de un catéter implantado en la vena marginal de la oreja. Una vez anestesiados, se ventilaron artificialmente a través de un tubo endotraqueal colocado en la tráquea cervical. La arteria femoral fue cateterizada para medir la presión arterial a través de un transductor de presión estándar posicionado a nivel de la base del corazón (modelo P23XL, Grass Instruments Co., Quincy, MA, EUA). A nivel subcutáneo, se colocaron electródos de agujas, conectados a un amplificador para variables de bipotenciales eléctricos (ML 136, Power Lab, ADI Instruments, Castle Hill, Australia) para realizar un registro electrocardiográfico en derivación II (Vega y Szabuniewicz, 1977; 1978). Ambas señales biológicas se registraron simultáneamente en un sistema de adquisición de datos digital (Power Lab, ADI Instruments, Castle Hill, Australia).
Luego de transcurrida media hora, cuando las variables presión arterial y frecuencia cardiaca presentaron estabilidad, se inyectaron a través de la vena marginal de la oreja, dosis crecientes (0,1-0,3-1,0-3,0 mg/kg) y acumulativas de xilazina (Rompun, Bayer®) con intervalos de 5-10 min entre cada dosis. Se obtuvieron registros basales de presión arterial y frecuencia cardiaca, previo a la inyección de cada dosis de xilazina.
Protocolo 2. Experimentos in vitro
Similar que en el protocolo 1 (in vivo), en el protocolo 2 (in vitro) se utilizaron conejos (n=8) machos albinos, raza Nueva Zelanda del mismo peso, pero destinados al consumo humano. Se obtuvieron tiras de aurícula derecha y anillos de vena safena, los cuales se suspendieron en cámaras aisladas en solución modificada de Krebs–Henseleit (composición en mM: CaCl2 1,27; MgS04 1,19; NaHCO3 25,0; NaCl 118,0; KH2P04 1,19; KCl 4,57; glucosa 5,55) mantenida a 36°C y aireada con gas carbógeno: 95% O2 y 5% CO2 (Zerpa et al., 2010). Se aplicó 1 g de tensión basal para cada preparación y se dejó equilibrar por 1 h. Las tiras de aurícula derecha se contrajeron espontáneamente. La respuesta contráctil se registró a través de transductores isométricos (modelo FT03; Grass Instruments Co., Quincy, MA, EUA) acoplados a un sistema digital de adquisición de datos (Power Lab, ADI Instruments, Castle Hill, Australia). Seguidamente, se construyeron curvas concentración-efecto (crecientes, logarítmicas y acumulativas) con xilazina (1nM-100µM) en cada preparación. En el caso de la aurícula aislada, también se elaboraron curvas concentración-efecto para otro agonista selectivo de receptores a2-adrenérgicos, la clonidina (1nM-100µM). El orden de los agonistas xilazina y clonidina, fue aleatorizado en la misma preparación de aurícula derecha aislada. Al final, la preparación de la aurícula derecha se expuso a una concentración fija de adrenalina (55µM) para garantizar la viabilidad del tejido. Con fines similares, en el caso de la vena safena, la contracción inducida por una solución despolarizante rica en potasio (SDK 118mM KCl) fue determinada al inicio y final del experimento. En la vena safena, el efecto de antagonistas selectivos de receptores a1-adrenérgicos (prazosín 30nM) y a2-adrenérgicos (yohimbina 0,1µM) sobre la acción de la xilazina, fue evaluado en anillos venosos, colocados en paralelo y provenientes del mismo animal (Zerpa et al., 2010).
Análisis Estadístico
Protocolo 1. Experimentos in vivo
La presión arterial media (PAM) fue calculada a partir del registro digital de presión arterial directa, aplicando la siguiente ecuación: PAM=PD+1/3PP, donde PP representa la presión de pulso, la cual se estima como la diferencia entre la presión máxima o sistólica (PS) y la presión mínima o diastólica (PD) (Curiel et al., 1980; Briceño-Fereira et al., 2010). Considerando que la xilazina causó un aumento transitorio sobre la PAM al inicio de la administración intravenosa, este aumento fue excluido del efecto hipotensor y se analizó individualmente. La frecuencia cardiaca se estimó a partir del electrocardiograma usando el intervalo R-R y siguiendo el algoritmo para el análisis del electrocardiograma del conejo dentro del programa del sistema de adquisición de datos digital (Power Lab, ADI Instruments, Castle Hill, Australia). Adicionalmente, se midió el intervalo PQ y se cuantificó el número de bloqueos aurículo-ventriculares de segundo grado (número de bloqueos en 30 seg) para cada dosis de xilazina. Estos bloqueos se evidenciaron como aquellas ondas P no conducidas hacia los ventrículos (Vega y Szabuniewicz, 1977,1978). Los indicadores de las variables para PAM (mmHg), frecuencia cardiaca (latidos/min) e intervalo PQ (milisegundos), fueron expresados como la media aritmética ± su error estándar (X ± EEM). El efecto de las dosis de xilazina se comparó con los valores basales inmediatamente antes de la administración, mediante un ANAVAR (Versión 5,1 para Windows; GraphPad Sofware, San Diego, California, EUA) con P≤0,05 como valor de probabilidad considerado significativo.
Protocolo 2. Experimentos in vitro
Sólo se utilizaron aquellas preparaciones de aurícula derecha aislada que respondieron con un aumento de la frecuencia de contracciones (lat/min) y de la fuerza de contracción (g) frente a una concentración fija de adrenalina (55µM). Esta respuesta se utilizó para normalizar los efectos ante xilazina y clonidina, los cuales se expresaron como porcentaje de la respuesta obtenida ante adrenalina (55µM) en la misma preparación.
En forma similar a la aurícula derecha aislada, los anillos de vena safena que generaron una contracción ante SDK 118 mM KCL menor a 0,5 g, fueron descartados. Las curvas concentración-efecto ante xilazina en los anillos de vena safena fueron ajustadas a través de regresión logística no lineal computarizada (Versión 5,1 para Windows; GraphPad Sofware, San Diego, California, EUA). La ecuación utilizada fue:
E=Emax x AnH / (AnH + CE50)
Donde E representa la respuesta observada y A es la concentración del agonista usado. El valor mejor ajustado para CE50 (la concentración del agonista capaz de producir el 50% de la respuesta máxima) expresado como pD2 (-log [CE50]), Emax (la respuesta contráctil máxima) y el coeficiente de Hill (nH), se obtuvieron para cada anillo de vena safena y se usaron para calcular la media aritmética y el 95% de intervalo de confianza (pD2) o la media aritmética ± E.E.M. (Emax y coeficiente de Hill). La razones de concentraciones (RC) se calcularon para los antagonistas a través de la división del valor CE50 obtenido en presencia del antagonista entre la CE50 en ausencia del antagonista. Para estimar la potencia de los antagonistas, se calculó un pKb aparente, según la ecuación propuesta por Furchgott en 1972.
pKb = -log [B] + log (RC - 1)
Donde B representa la concentración del antagonista y RC la razón de concentración.
El análisis estadístico de los datos para probar las diferencias entre dos valores de media se realizó a través de pruebas de t de Student de dos colas para datos pareados o no pareados según fuese apropiado (Versión 5.1 para Windows; GraphPad Sofware, San Diego, California, EUA), con P≤0,05 como valor de probabilidad considerado significativo.
Resultados
Protocolo 1. Experimentos in vivo
En la Figura 1, se muestran los trazados originales del registro de presión arterial directa (Figura 1A) y de electrocardiografía (Figura 1B), al momento de administrar una dosis (1mg/kg) de xilazina. En la Figura 1B, después del tercer complejo del electrocardiograma, se destaca la presencia de una onda P no seguida del complejo QRS, durante el registro del efecto de 1mg/kg de xilazina intravenosa. Este hallazgo es un indicador del desarrollo de bloqueo aurículo-ventricular de segundo grado, efecto ampliamente descrito para la xilazina en otras especies. La administración intravenosa de xilazina en conejos anestesiados con pentobarbital, produjo un efecto bifásico caracterizado por un incremento inicial transitorio de la PAM, sobre los valores basales obtenidos antes de la administración en 3 de 4 conejos (Figura 2A), seguido de una reducción dosis-dependiente tanto de la PAM como de la FC (Figura 2B). A partir de los valores basales para las variables PAM y FC (91,9±4,6 mmHg; 259,6±13,0 lat/min, respectivamente), la administración de dosis crecientes y acumulativas de xilazina vía intravenosa, causó una reducción significativa (P<0,05) tanto para la variable PAM (dosis mg/kg: 0,1=53,3±5,4 mmHg; 0,3=41,6±2,7 mmHg; 1,0=41,2±1,9 mmHg; 3,0=48,9±3,2 mmHg) como para la FC (dosis mg/kg: 0,1=215,3±9,0 lat/min; 0,3=184,5±4,0 lat/min; 1,0 = 161,6±6,0 lat/min; 3,0=142,5±12,6 lat/min). La dosis máxima de xilazina (3 mg/kg) causó un ligero incremento de la PAM con respecto al efecto acumulativo alcanzado en la dosis anterior (1 mg/kg) como se señala en la Figura 2B.
Figura 1. Trazados originales de la presión arterial directa (panel A) y el electrocardiograma (panel B) en conejos anestesiados con pentobarbital sódico después de administrar 1mg/kg de xilazina vía intravenosa
Figura 2. Efecto de la administración intravenosa de dosis crecientes y acumulativas de xilazina sobre la presión arterial media (PAM: mmHg), frecuencia cardiaca (FC: lat/min) e intervalo PQ (mseg) en conejos (n=4) anestesiados con pentobarbital sódico. En el panel A, se expresa la tasa de cambio (Δ) durante el incremento transitorio de la presión arterial media, inmediatamente después de la administración de xilazina intravenosa en tres de cuatro conejos estudiados. En el panel B, la frecuencia cardiaca está expresada en el eje de las abscisas ubicado a la izquierda y la presión arterial media en el eje de la derecha. En el panel C se observa las variaciones dosis dependientes del intervalo PQ (mseg)
El intervalo PQ (basal: 56,1±2,5 mseg) se prolongó en forma dosis dependiente con la administración de xilazina (dosis mg/kg: 0,1=59,7±3,4 mseg; 0,3=62,7±2,7 mseg; 1,0=70,5±4,3 mseg; 3,0=80,5±6,5 mseg), observándose diferencias significativas (P<0,05) solo a la dosis máxima (Figura 2C). Se destaca que se observaron bloqueos aurículo-ventriculares de segundo grado, los cuales aumentaron su frecuencia de aparición en forma dosis dependiente (dosis mg/kg: 0,1=3 bloqueos/30 seg; 0,3=8 bloqueos/30 seg; 1,0=13 bloqueos/30 seg; 3,0=15 bloqueos/30 seg).
Protocolo 2. Experimentos in vitro
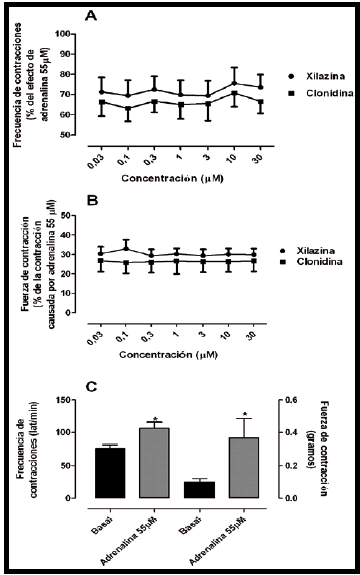
La aurícula derecha aislada del conejo no respondió frente a concentraciones acumulativas y crecientes de xilazina y clonidina, tanto para la variable frecuencia como para la variable fuerza de contracción (Figura 3A-B). Sin embargo, se observó un incremento significativo (P<0,05) para la variable frecuencia (basal: 75,94±5,6 lat/min vs adrenalina: 106,0±9,3 lat/min. n=6) y fuerza (basal: 0,098±0,02 gramos vs adrenalina: 0,366±0,11 gramos. n=8) frente a una concentración fija (55µM) de adrenalina.
Figura 3. Curvas concentración-efecto ante xilazina y clonidina en la aurícula derecha aislada de conejos. En el panel A, se muestra la variable frecuencia de contracción y en el panel B la variable fuerza de contracción. En el panel C, se observa el efecto de una concentración única de adrenalina (55µM) sobre las variables frecuencia de contracciones (eje abscisas de la izquierda) y fuerza de contracción (eje de las abscisas de la derecha) en la aurícula derecha aislada de conejo. La respuesta ante adrenalina se usó para normalizar la respuesta ante xilazina y clonidina
La xilazina causó contracciones concentración-dependiente en la vena safena aislada de conejo (Figura 4). La respuesta contráctil se expresó como porcentaje de la contracción máxima obtenida en la misma preparación frente a una solución despolarizante rica en K+ (SDK 118mM KCl). Esta respuesta contráctil fue resistente a la acción de prazosin (30nM); sin embargo, la yohimbina (0,1µM) causó un desplazamiento significativo hacia la derecha de la curva concentración-efecto para xilazina, obteniéndose un pKb aparente de 7,2 (6,3-8,0), como se observa en la Tabla 1.
Figura 4. Efecto del prazosin (panel A: 30nM) y de la yohimbina (panel B: 0,1µM) sobre las curvas concentración-efecto ante xilazina en la vena safena aislada de conejos
Tabla 1. Efecto del prazosín (30nM) y yohimbina (0,1µM) sobre la respuesta contráctil ante xilazina en la vena safena aislada de conejo (agonista de receptores a2-adrenérgicos)

Discusión
El uso del conejo como modelo experimental, permitió analizar los efectos cardiovasculares in vivo e in vitro de la xilazina, agonista de receptores a2-adrenérgicos de amplio uso en Medicina Veterinaria, incluso en anestesia de conejos (Kilic, 2004). La administración de xilazina disminuyó de manera dosis-dependiente, tanto la PAM como la FC en la preparación in vivo, mientras que en las preparaciones in vitro, no se evidenció ninguna respuesta a concentraciones crecientes de xilazina en la aurícula derecha aislada; sin embargo, en la vena safena aislada, la xilazina produjo contracciones concentración-dependiente sensibles a yohimbina.
La respuesta bifásica que caracterizó el comportamiento de la PAM, frente a las dosis de xilazina utilizadas, confirma los hallazgos reportados por diversos investigadores en perros y equinos (Martínez, 1986; Vega, 1996; Yamashita et al., 2000; Martínez et al., 2004) y sugiere que en el conejo, así como en las especies citadas, la hipotensión in vivo, asociada a la administración de xilazina, podría estar relacionada con una reducción del tono simpático vía estimulación de receptores a2-adrenérgicos presinápticos a nivel del sistema nervioso central (Marini et al., 1999). De igual forma, la acción depresora cardiaca, caracterizada por bradicardia dosis-dependiente, podría estar asociada al mismo mecanismo de acción, donde la reducción del tono simpático se traduzca en un aumento del tono vagal, lo cual coincide con bradicardia y aparición de bloqueos aurículo-ventriculares de segundo grado Mobitz tipo 1. Sin embargo, se ha sugerido que es posible que la acción directa sobre receptores a-adrenérgicos postsinápticos sobre el miocardio, también pueda contribuir en los efectos cardiovasculares de la xilazina (Fedida y Bouchard, 1992; Fedida et al., 1993; Vega, 1996; Zhao y Ren, 2003). Es más, el aumento ligero de la PAM causado por la dosis máxima (3mg/kg) empleada en este ensayo in vivo, acompañado de bradicardia, sugiere que un eventual aumento en la resistencia periférica total, mediado por la acción de la xilazina sobre receptores a-adrenérgicos postsinápticos en el músculo liso vascular, también podría contribuir al desarrollo de los efectos cardiovasculares de esta molécula.
En la aurícula aislada de conejo, no se observó ningún efecto sobre su actividad espontánea a las concentraciones exploradas de los dos agonistas imidazólicos, xilazina y clonidina, sobre los receptores a2-adrenérgicos. En contraste, esta preparación respondió con un aumento de la fuerza y frecuencia de las contracciones ante una concentración fija de adrenalina, la cual se comporta como un agonista no selectivo de los receptores ß-adrenérgicos. Estos hallazgos sugieren que los receptores a2-adrenérgicos en la aurícula derecha aislada, no parecieran estar ligados al control de las propiedades cronotrópicas e inotrópicas en la aurícula derecha aislada de conejo. Sin embargo, otros autores sugieren que la xilazina es capaz de reducir la tasa de disparo del nódulo sino-auricular aislado de conejo (Zhao y Ren, 2003) e incluso, se sugiere que la clonidina modula la respuesta espontánea de la aurícula aislada de ratones, independientemente de la expresión de receptores a2-adrenérgicos en esta preparación (Knau et al., 2007). Cai et al. (2002) describieron receptores a2-adrenérgicos presentes en las fibras de Purkinje del corazón de caninos y no en el miocardio. Zhao y Ren (2003), disecaron la preparación nodo sino-auricular de aurículas derechas de conejos y observaron que la xilazina disminuye la velocidad de disparo del marcapaso, pero este efecto no es afectado por el pretratamiento con yohimbina, lo cual indica que aparentemente el efecto de la xilazina sobre el potencial de acción no está relacionado con receptores a2-adrenérgicos, hecho que también se ha observado en ratas (Dong y Hu, 1996). Es probable que los efectos observados en el nodo sino-auricular del conejo, que no son aparentemente mediados por receptores a2-adrenérgicos, se desarrollen a concentraciones elevadas (en el orden mM) de xilazina, las cuales no fueron alcanzadas en nuestros experimentos. Al mismo tiempo, nuestros resultados ratifican que en las concentraciones evaluadas, la xilazina no modula la actividad espontánea de la aurícula derecha aislada de conejo.
La presencia de receptores a2-adrenérgicos en la musculatura lisa de los vasos sanguíneos, ha sido demostrada y caracterizada desde los años 80, en particular en el territorio venoso (Dignes y Summers, 1983; Zhao y Ren, 2003; Zerpa et al., 2010). En nuestros experimentos, se observó un efecto contráctil concentración-dependiente de la xilazina en la vena safena aislada de conejo, el cual fue resistente a la acción del prazosín (antagonista selectivo de receptores a1-adrenérgicos) pero sensible a la yohimbina (antagonista selectivo de receptores a2-adrenérgicos), resultando en valores de potencia para la yohimbina cercanos a los referidos por otros autores en la misma vena safena de conejo ante agonistas a2-adrenérgicos (Alabaster et al., 1986). En el músculo liso de la vena safena aislada de los mismos conejos de donde se obtuvieron las aurículas derechas aisladas, se logró demostrar que, en el rango de concentraciones escogidas, la xilazina es capaz de promover un efecto contráctil concentración-dependiente, mediado principalmente por receptores a2-adrenérgicos, permitiendo sugerir que la ausencia de efectos sobre la aurícula derecha aislada, es poco probable que sea debida a algún artefacto en la preparación experimental.
Se ha sugerido que la xilazina podría causar cardiotoxicidad en el conejo, debido a un eventual efecto vasoconstrictor coronario (Marini et al., 1999). Sin embargo, diferentes autores sostienen que la proporción de receptores a2-adrenérgicos en el músculo liso del territorio venoso es mayor que en el arterial (De Mey y Vanhoutte, 1981; Vanhoutte, 1982; Hieble y Woodward, 1984), por lo tanto, al observar la baja eficacia y potencia mostradas por la xilazina en la vena safena aislada de conejo, se podría sugerir que, en el rango de concentraciones evaluadas, es menos probable que se promueva vasoconstricción en lechos arteriales, lo cual sustentaría la hipótesis de que la cardiotoxicidad asociada a la xilazina en el conejo, podría estar más vinculada a un efecto directo de la droga o a alguno de sus metabolitos sobre el miocardio del conejo, y menos al efecto vasoconstrictor eventual sobre las arterias coronarias. En dosis elevadas, es probable que la xilazina pierda su selectividad sobre receptores a2-adrenérgicos y actúe sobre receptores a1-adrenérgicos ubicados en el músculo liso del lecho arterial, en ese caso, la hipótesis de cardiotoxicidad asociada a vasoconstricción coronaria en conejos, podría desarrollarse. Se requieren estudios adicionales en este sentido para analizar estas hipótesis.
Finalmente, la xilazina es capaz de modular la PAM y la FC cuando es administrada vía intravenosa en conejos anestesiados, efecto que parece no depender de una acción directa de la xilazina sobre la aurícula derecha, lo cual sugeriría que la acción hipotensora y bradicárdica, podría estar mediada principalmente a través de la modulación del tono autonómico a través de receptores a2-adrenérgicos o imidazólicos en el sistema nervioso central.
Agradecimientos
Los autores desean expresar su agradecimiento al Consejo de Desarrollo Científico y Humanístico de la Universidad Central de Venezuela (CDCH-UCV), por el financiamiento del proyecto de investigación Nº PI 11-10-4953-2002 y al Laboratorio SEDICOMVET por la donación de los conejos.
Referencias
1. Alabaster, V.A.; Keir, R.F.; Peters, C.J. 1986. Comparison of potency of a2-adrenoceptor antagonists in vitro: evidence for heterogeneity of a2-adrenoceptor. Br. J. Pharmac., 88: 607-614. [ Links ]
2. Antonaccio, M.J.; Robson, R.D; Kerwin, L. 1973. Evidence for increased vagal tone and enhanced baroreceptor reflex activity after Xilazine (2-(2, 6-dimethyl-phenylamino)-4-H-5,6-di-hydro-1-3-thiazine) in anesthetized dogs. Eur. J. Pharmacol., 23:311-315. [ Links ]
3. Briceño-Fereira, E. del C.; Zerpa-Gónzalez, H.A.; Ascanio-Evanoff, E.R.; Flores-Chona, S.A.; Maniglia-Mérida, G.C.; Comerma-Steffensen, S.G. 2010. Efecto del azul de metileno en la hipotensión y bradicardia asociadas a la administración de una dosis letal del veneno total de cascabel venezolana (crotalus durissus cumanensis) en ratas. Rev. Científ. FCV-LUZ. 20:347-352. [ Links ]
4. Cai, J.J.; Morgan, D.A.; Haynes, W.G.; Martins, J.B.; Lee, H. 2002. a2-Adrenergic stimulation is protective against ischemia-reperfusion-induced ventricular arrhythmias in vivo. Am. J. Physiol. Heart. Circ. Physiol., 283:H2606–H2011. [ Links ]
5. Clark, K.W.; Hall, L.W. 1969. Xilazine a new sedative for horses and catlle. Vet. Rec., 85:512-517. [ Links ]
6. Curiel, R.; Ostojic, K.; Condado, J.; Gómez, J.; Octavio, J. 1980. Evaluación no invasiva de la función ventricular durante la hipoxemia aguda. Acta Cient. Venez., 31:281-286. [ Links ]
7. De Mey, J.; Vanhoutte, P.M. 1981. Uneven distribution of postjunctional alpha-1 and alpha-2 like adrenoceptors in canine arterial and venous smooth muscle. Circ.Res., 48:875-884. [ Links ]
8. Digges, K.G.; Summers, R.J. 1983. Characterization of postsynaptic a adrenoceptors in rat aortic strips and portal veins. Br. J. Pharmac., 79:655-665. [ Links ]
9. Dong, H.J.; Hu, D.H. 1996. Effect of xylazine on isolated working heart in rats. Bull Acad. Milit. Med. Sci., 20: 91-93. [ Links ]
10. Fedida, D.; Bouchard, M. 1992. Mechanisms for the positive inotropic effect of a1-adrenoceptors stimulation in rat cardiac myocytes. Circ. Res., 71:673-688. [ Links ]
11. Fedida, D.; Braun, A.; Giles, W.R. 1993. a1-adrenoceptors in myocardium: functional aspects and transmembrane signaling mechanisms. Phys. Rev., 73:469-487. [ Links ]
12. Furchgott, RF (1972). The classification of adrenoceptors (adrenergic receptors). An evaluation from the standpoint of receptor theory. Catecholamines, Handbook of Experimental Pharmacology. Blaschko H., Muscholl, E.. Berlin, Heidelberg, New York, Springer. 33:283-335. [ Links ]
13. Hieble, J.P.; Woodward, D.F. 1984. Different characteristics of postjunctional alpha-adrenoceptor on arterial and venous smooth muscle. Naunyn-Schmiedebergs Arch. Pharmacol., 328:44-50. [ Links ]
14. Hsu, W.H. 1981. Xylazine induced depression and its antagonism by alpha adrenergic blocking agents. J. Pharmacol. Exp. Ther., 218:188-192. [ Links ]
15. Keer, D.D.; Jones, E.W.; Huggins, K.; Edwards, W.C. 1972. Sedative and other effects of xylazine given intravenously to horses. Am. J. Vet. Res., 33:525-532. [ Links ]
16. Kilic, N. 2004. A comparison between medetomidine-ketamine and xylazine-ketamine anaesthesia in rabbits. Turk. J. Vet. Anim. Sci., 28:921-926. [ Links ]
17. Knaus, A.; Zong, X.; Beetz, N.; Jahns, R.; Lohse, M.J.; Biel, M.; Hein, L. 2007. Direct inhibition of cardiac hyperpolarization-activated cyclic nucleotide–gated pacemaker channels by clonidine. Circulation,115:872-880. [ Links ]
18. Luna, S.P.L.; Beale, N.J.; Taylor, P.M. 1992. Effects of atipamezole on xylazine sedation in ponies. Vet. Rec., 130:268-271. [ Links ]
19. Marini, R.P.; Li, X.; Harpster, N.K.; Dangler, C. 1999. Cardiovascular pathology possibly associated with ketamine/xylazine anesthesia in dutch belted rabbits. Lab. Anim. Sci., 49:153-160. [ Links ]
20. Martínez, A. 1986. Un análisis sobre la acción de la xilazina (Rompúm®) en la hemodinamía cardiovascular en perros. Trabajo de Ascenso. Universidad Central de Venezuela. Facultad de Ciencias Veterinarias. pp. 1-43. [ Links ]
21. Martínez, A.; Ascanio, E.; Sogbe, E.; Zerpa, H.; Martínez, J.; Ascanio, C. 2004. Evaluación de la acción de la xilazina endovenosa en la hemodinamia cardiovascular en perros. Memorias del XIX Congreso Panamericano de Ciencias Veterinarias. Buenos Aires, 24-28 de Octubre. [ Links ]
22. McCall, R.B.; Schuette, M.R; Humphrey, S.J. 1983. Evidence for a central sympatho-excitatory action of a2-adrenergic antagonists. J. Pharmacol. Exp. Ther., 224:501-507.
23. Sarazan, R.D.; Sarke, W.A.; Krause, G.F.; Garner, H.E. 1989. Cardiovascular effects of detomidine, a new a2-adrenoceptor agonist in the conscious pony. J. Vet. Pharmacol. Ther., 12:378-388.
24. Savola, J.M.; Ruskoano, H.; Pourumen, J. Karki, N.T. 1985. Cardiovascular action of detomidine, a sedative and analgesic imidazole derivative with a agonistic properties. Eur. J. Pharmacol.,118:69-76. [ Links ]
25. Schmitt, H.; Fornadjiev, G.; Schmitt, H. 1970. Central and peripherals effects of 2-(2,6-dimethyl-phenylamino)-4-H-5,6-di-hydro-1-3-thiazine (Bayer 1470) on the sympathetic system. Eur. J. Pharmacol.,10:230-238. [ Links ]
26. Van Metre, D.C. 1992. A case report of the treatment of an overdose of xylazine in a cow. Cornell Vet., 82:287-291. [ Links ]
27. Van Zwieten, P.A.; Timmermans, P.B. 1983. Cardiovascular alpha-2 adrenoceptors. J. Moll. Cell. Cardiol., 15:717-733. [ Links ]
28. Vanhoutte PM. 1982. Heterogeneity of postjunctional vascular alpha-adrenoceptors and handling of calcium. J. Cardiovasc. Pharmacol., 4:591-596. [ Links ]
29. Vega, F. 1996. Efecto de dosis crecientes de hidrocloruro de xilazina (Rompúm®) sobre las variables presión arterial, fuerza de contracción y contractilidad miocárdica, en perros reserpinizados y vagotomizados. Trabajo de Ascenso. Universidad Central de Venezuela. Facultad de Ciencias Veterinarias. pp. 5-98. [ Links ]
30. Vega, F.; Szabuniewicz, M. 1977-1978. La electrocardiografía en clínica veterinaria. I parte: Aspectos normales del electrocardiograma. Rev. Fac. Cs. Vets. UCV., 27:79-102. [ Links ]
31. Yamashita, K.; Tsubakishita, S.; Futaok, S.; Ueda, I.; Hamaguchi, H.; Seno, T.; Katoh, S.; Izumisawa, Y.; Kotani, T.; Muir, W.W. 2000. Cardiovascular effects of medetomidine, detomidine and xylazine in horses. J. Vet. Med. Sci., 62:1025-1032. [ Links ]
32. Young, S.S.; Taylor, P.M. 1993. Factors influencing the outcome of equine anaesthesia: a review of 1314 cases. Equine Vet. J., 25:147-151. [ Links ]
33. Zerpa, H.; Berhane, Y.; Elliott, J.; Bailey, S.R.. 2010. Functional role of a2-adrenoceptor subtypes in the cooling-enhanced vasoconstriction of isolated cutaneous digital veins of the horse. Eur. J. Pharmacol., 627:194–202 [ Links ]
34. Zhao, D.; Ren, L-M. 2003. Electrophysiological responses to imidazoline/ a2-receptor agonists in rabbit sinoatrial node pacemaker cell. Acta Pharmacol. Sin., 24:1217-1223. [ Links ]