Investigación Clínica
versión impresa ISSN 0535-5133versión On-line ISSN 2477-9393
Invest. clín v.45 n.1 Maracaibo mar. 2004
Mediadores de inflamación (Proteína C Reactiva) en el niño con desnutrición proteico-energética y en el niño eutrófico.
Alis Amesty-Valbuena1, Nayda Pereira1, José L. Castillo1, Doris García1, José R. Nuñez1, Neyda Cayama2, Aida Morán3, María A. Parra3 y Carmen Troconiz3.
1Facultad de Medicina. Universidad del Zulia, Maracaibo, 2Unidad de Recuperación Nutricional, Hospital General, Cabimas, 3Laboratorio Clínico, Escuela de Bioanálisis, Facultad de Medicina, Universidad del Zulia, Maracaibo, Venezuela.
Resumen
Con la finalidad de investigar la síntesis de Proteína C Reactiva (PCR) en niños con diferentes grados de desnutrición y entre desnutridos graves infectados y eutróficos infectados; así como en un grupo control de niños eutróficos, se determinó las concentraciones de esta proteína por el método turbidimétrico en 109 niños venezolanos en edades comprendidas entre 6 meses y 6 años. Los resultados encontrados mostraron que el desnutrido grave infectado aumenta su valor de PCR de manera significativa (80,80 ± 38,39 mg/L) en relación con el no infectado (8,17 ± 3,06 mg/L) (p < 0,001). Igualmente hubo diferencias estadísticamente significativas entre los desnutridos graves infectados y el grupo de eutróficos infectados (p < 0,001) quienes presentaron valores más elevados. En relación con los grupos de desnutridos no infectados se encontró diferencia significativa entre los desnutridos graves con el resto de los grupos y el grupo control eutrófico (p < 0,05), no obstante, sus concentraciones permanecieron dentro del valor normal. Estos resultados permiten concluir que el desnutrido infectado es capaz de sintetizar PCR en respuesta a procesos infecciosos graves pero que difiere significativamente cuando sus valores se comparan con los del eutrófico infectado. Por otra parte el desnutrido libre de infección cualquiera que sea su grado de desnutrición mantiene sus valores de PCR en límites normales.
Palabras clave: Proteína C Reactiva, desnutrición proteico-energética, infección.
Inflammation mediators (C Reactive protein) in children with proteic-energetic malnutrition and in eutrophic children.
Abstract
A multicentrical clinical study was designed with the purpose of measuring C-reactive protein (CRP) in normal and malnourished children, with and without infection. Blood samples were collected without anticoagulant from 109 venezuelan children, between the ages of 6 months and 6 years. The statistical analysis was carried out using the t Student and ANOVA. The values of CRP were higher (80.80 ± 38.39 mg/L) in severe malnourished infected than non-infected malnourished children (8.17 ± 3.06 mg/L, p < 0.001). There were statistical differences between severe malnourished infected and eutrophic infected children (p<0.001). There was also a difference between the non infected, severely malnourished children and the rest of them, although they kept their values within a normal range. These findings indicate that the malnourished child is able to produce CRP in response to infection but in a different way that the eutrophic child. In children without infection, the CRP levels were kept within the normal range.
Key words: C Reactive protein, proteic-energetic malnutrition, and infection.
Recibido: 17-02-2003. Aceptado: 22-10-2003.
INTRODUCCIÓN
En la actualidad uno de los principales problemas que afectan a la población infantil es la Desnutrición Proteico Energética (DPE), término que define un síndrome nutricional caracterizado por un estado multifactorial donde predomina el déficit energético y proteico (1). Como consecuencia de este déficit nutricional se producen en el desnutrido alteraciones en sus mecanismos de defensa tales como deficiencia de Ig A secretora y de los componentes del complemento especialmente del C3, una actividad disminuida de macrófagos y polimorfonucleares, así como también una disminución importante de las subpoblaciones de linfocitos CD3 y CD4 (2-6).
Otro aspecto que puede estar modificado en el desnutrido es la respuesta de fase aguda. De todas las proteínas inducidas durante dicha respuesta, una de las más importantes es la Proteína C Reactiva (PCR), proteína que ha sido utilizada como ayuda diagnóstica y en la evolución de enfermedades que cursan con procesos inflamatorios, infecciosos o de destrucción de tejidos (7-9).
La PCR es una proteína no glicosilada producida exclusivamente por el hepatocito y cuya síntesis está modulada por citocinas proinflamatorias tales como interleuquina 1 (IL-1), interleuquina 6 (IL-6) y el Factor de Necrosis Tumoral (FNT) (10-12), producidas como respuesta a los estímulos antes mencionados (7-9). La magnitud de su elevación refleja la extensión del estado inflamatorio o infeccioso y su disminución es representativa de la mejoría clínica y de la eficacia de la intervención terapéutica (8, 13, 14).
Numerosos son los estudios realizados sobre la respuesta de fase aguda especialmente la PCR en diversas situaciones clínicas (7-9, 13, 14), sin embargo, son escasos los estudios sobre esta proteína en situaciones de daño tisular o infecciones en el niño desnutrido. A este respecto los trabajos existentes no son coincidentes y en su totalidad han sido realizados en niños con desnutrición severa o grave. Morlese y col. (15) reportan concentraciones elevadas de PCR en desnutridos marasmáticos infectados. Sawerwin y col. (16) por el contrario reportan un marcado aumento de esta proteína en niños con kwashiorkor no así en niños marasmáticos. Por otra parte, Doherty y col. (17) señalan una disminución de las proteínas de fase aguda en niños severamente desnutridos.
Dado que la infección actúa como un potente estímulo antigénico para la síntesis de PCR y que en los niños desnutridos existe una alta prevalencia de infecciones, y aunado a que en la literatura revisada existen escasos reportes sobre la producción de PCR, los cuales sólo evalúan un grado de desnutrición en particular, los objetivos de la presente investigación fueron: 1) Determinar las concentraciones séricas de PCR en niños desnutridos graves con y sin infección; 2) Comparar las concentraciones séricas de PCR de estos niños desnutridos con sus respectivos controles eutróficos infectados o no; 3) Determinar las concentraciones séricas de PCR en niños con desnutrición leve, moderada y grave.
PACIENTES Y MÉTODOS
Se realizó un estudio de tipo analítico, transversal, no experimental, en el cual se seleccionaron de acuerdo a criterios de inclusión clínicos y antropométricos 129 niños en edades comprendidas entre 6 meses y 6 años, con sexo y condición socioeconómica comparables, pertenecientes a familias de bajos ingresos (estratos IV y V) según Método de Graffar modificado (18).
Dichos pacientes provenían de la Unidad de Recuperación Nutricional del Hospital General de Cabimas, del Departamento de Pediatría del Hospital Universitario de Maracaibo (HUM) y de diferentes hogares de cuidado diario del Municipio Maracaibo, Estado Zulia (Venezuela), definidos estos últimos como centros de atención integral en nutrición, salud, cuidado y socialización para hijos de madres trabajadoras, financiados por el Gobierno Nacional (Ministerio de la Familia).
La evaluación antropométrica se llevó a cabo utilizando las variables edad, sexo, peso y talla, las cuales al ser relacionadas entre sí permitieron obtener los indicadores corporales tradicionales: peso para la edad (P/E), talla para la edad (T/E) y peso para la talla (P/T). El estado nutricional se determinó utilizando el indicador P/E en los menores de 2 años y el indicador P/T en los mayores de esta edad.
La estimación del déficit nutricional se realizó sobre la base de las tablas de la Organización Mundial de la Salud (OMS) (19) graficadas para Venezuela por el Instituto Nacional de Nutrición (INN) avaladas por la Sociedad Venezolana de Puericultura y Pediatría (20) y la Fundación para el Crecimiento y Desarrollo (FUNDACREDESA) (21). Las gráficas elaboradas de P/E, T/E y P/T combinan las distribuciones de los percentiles 3-10-50-90-97, con la desviación estándar –3 y –4 (–3 DE y –4 DE) (20), lo cual permitió distribuir el grupo de desnutridos en: desnutridos leves, desde £ percentil 3 hasta > –3 DE, desnutridos moderados, desde £ –3 DE hasta > –4 DE y desnutridos graves desde £ –4 DE. Los niños eutróficos se distribuyeron entre los percentiles > p 10 £ p 90.
De acuerdo a estos criterios los pacientes de la presente investigación fueron divididos de la manera siguiente: desnutridos graves infectados (DGI, n = 20) y sin infección (DGSI, n = 20); eutróficos infectados (EI, n = 20), eutróficos sin infección (ESI, n = 25), desnutridos leves (n = 22) y moderados (n = 22).
La evaluación antropométrica y clínica permitió ubicar a todos los desnutridos graves dentro del grupo de marasmáticos o desnutridos no edematosos. Los síntomas y signos clínicos de cada patología así como los exámenes de laboratorio, los estudios radiológicos, hemocultivo y cultivos de LCR permitieron hacer el diagnóstico del proceso infeccioso agudo (neumonía, meningitis o sepsis) tanto en los desnutridos infectados como en los eutróficos infectados. Igualmente los exámenes clínicos y de laboratorio en los otros grupos de desnutridos y en los eutróficos que sirvieron como control, permitieron descartar o confirmar si alguno de ellos presentaba un proceso infeccioso.
Previa autorización de la Coordinación de los diferentes hogares de cuidado diario, del Jefe de la Unidad de Recuperación Nutricional y del Departamento de Pediatría del HUM y con el consentimiento de los padres, se procedió a la obtención de las muestras de sangre por punción de vena antecubital en niños mayores de 2 años y de vena femoral en los menores, extrayéndose el suero por centrifugación a 1000 rpm. En el caso de los pacientes infectados se realizó durante las siguientes 12 horas del ingreso hospitalario. La determinación de la PCR se realizó por el método turbidimétrico (Laboratorio Orion Diagnostic), analizándose cada muestra por duplicado y cuya concentración era el promedio de las mismas. El valor de referencia normal para esta proteína es hasta 10 mg/L.
Los resultados obtenidos se expresaron en términos de media ± desviación estándar (X±DE), estudiados mediante el análisis de la varianza en una sola dirección (ANOVA) con post test de Tukey y la t de Student. Se tomó el 95% como índice de confiabilidad estadística (P < 0,05).
RESULTADOS
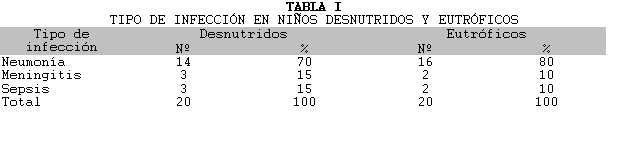
El tipo de infección en los grupos de desnutridos y eutróficos se presentan en la Tabla I. Puede apreciarse que se trata de infecciones graves de etiología bacteriana (demostradas por cultivo bacteriológico), representadas en su mayoría en ambos grupos por neumonías.
La Tabla II muestra los valores de PCR en los desnutridos graves infectados y eutróficos infectados así como los del grupo control, observándose que en ambos grupos de infectados los valores promedios fueron significativamente superiores a los del control (p < 0,001). Sin embargo, los valores de PCR en los eutróficos infectados (241,60 ± 105,60 mg/L) fueron muy superiores al de los desnutridos infectados (80,80 ± 38,39 mg/L) con diferencias significativas (p < 0,001) entre ambos grupos.

En la Tabla III se presentan los valores de los desnutridos graves infectados y sin infección, mostrándose un incremento de los valores de PCR en los desnutridos infectados (80,80 ± 38,39 mg/L) comparados con el grupo de desnutridos no infectados (8,17 ± 3,06 mg/L) con diferencia significativa entre los dos grupos (p < 0,001).

La Tabla IV muestra los valores de PCR en los distintos grupos de desnutridos sin infección (leves, moderados y graves) y el grupo control, encontrándose diferencias significativas (p < 0,05) entre la concentración de los desnutridos graves en relación con el resto de los grupos estudiados; sin embargo, su concentración promedio se mantuvo dentro del valor normal.

La Fig. 1 muestra los valores promedios e individuales de todos los grupos estudiados. Puede observarse que 18 casos (90%) de los eutróficos infectados presentaron concentraciones de PCR superiores a 100 mg/L (con concentraciones máximas de 500 mg/L), y 2 casos (10%) concentraciones mayores de 60mg/L; mientras que de los desnutridos graves infectados sólo 6 casos (30%) presentaron concentraciones superiores a 100 mg/L, 8 casos (40%) concentraciones entre 60 y 80 mg/L y el 30% restante (16 casos) representados por 4 casos con valores entre 25mg/L y 40 mg/L y 2 casos con valores entre 12 mg/L y 15 mg/L. Sólo 2 pacientes alcanzaron una concentración máxima de 220 mg/L.

Fig. 1. Concentraciones séricas de PCR en niños con diferentes grados de desnutrición infectados o no.
Cada punto representa el valor individual del nivel de PCR en cada paciente.
la línea representa el promedio de cada grupo estudiado.
DISCUSIÓN
La DPE continúa siendo un factor determinante en la mortalidad infantil que ocurre en los diversos países en desarrollo. Los estudios realizados en Asia y África han demostrado que aproximadamente el 60% de los niños que se hospitalizan con desnutrición moderada o grave tienen un proceso infeccioso activo (22).
Una relación directa entre desnutrición e infección ha sido documentada en estudios clínicos y epidemiológicos (22, 23). Scrimsaw y col. (24) en su revisión sobre desnutrición introdujeron el concepto de que el estado nutricional afecta la función inmunitaria y ésta condiciona la respuesta del huésped frente a la infección. Estos conceptos fueron el punto de partida para las numerosas investigaciones que han sido realizadas en el desnutrido, en las cuales se han demostrado las alteraciones inmunitarias que éste presenta tanto en la inmunidad humoral como en la inmunidad celular (2-6).
Durante un proceso infeccioso no sólo son necesarios los mecanismos de respuesta adaptativa sino que también los mecanismos de defensa inespecífica son importantes, ya que éstos actúan en la fase temprana o inmediata de una infección. En esta fase, la infección constituye un fuerte estimulo para inducir la síntesis de proteínas de fase aguda, entre ellas la PCR (9).
Es bien conocida la alta frecuencia de procesos infecciosos que presenta el desnutrido por lo que la respuesta de fase aguda ha sido estudiada por varios autores. En las primeras investigaciones Razban y col. (25) utilizando un método semicuantitativo para detectar PCR en niños nigerianos desnutridos, encontraron que la PCR se detectó en el 93% de los niños estudiados y sólo en el 16% de los niños controles. Sin embargo, los datos aportados en el trabajo especialmente los correspondientes al estado clínico y en particular a la presencia de infecciones, no se detallaron en este estudio.
Doherty y col. (17) utilizando un método inmunoenzimàtico para medir PCR en desnutridos graves con y sin infección, reportaron un incremento significativo de los valores de esta proteína sólo en el 54% de los niños desnutridos infectados, estos resultados contrastan con los reportados por Morlese y col (15) y por Ekanen y col. (26) al mostrar valores incrementados de PCR en los desnutridos graves infectados con diferencias significativas al compararlos con los desnutridos no infectados. Estos últimos resultados son similares a los encontrados en la presente investigación donde se obtuvo una elevación significativa de PCR (p < 0,001) en el grupo de desnutridos infectados en comparación con el grupo de los no infectados y coinciden con un estudio reciente realizado en desnutridos venezolanos (27), al medir la respuesta de PCR en desnutridos no infectados e infectados.
Por otra parte, la diferencia encontrada en la producción de PCR del desnutrido grave infectado en relación con el eutrófico infectado pudiera explicarse por varias razones: 1.- la PCR es sintetizada exclusivamente en el hepatocito y estudios recientes han demostrado que en ratas desnutridas existe una disfunción de las células de Kupffer debido probablemente a una síntesis disminuida del factor estimulante de colonias, que provoca secundariamente una disminución significativa de la proliferación y diferenciación del hepatocito (30). 2.- La respuesta inflamatoria que ocurre durante los procesos infecciosos conlleva a un gasto metabólico, traducido en una movilización de aminoácidos del músculo esquelético al hígado para producir proteínas de fase aguda. Investigaciones llevadas a cabo por Golden y col (31) reportan que en el desnutrido marasmàtico (como nuestros pacientes) se reduce de manera apreciable la tasa de recambio proteico, con la finalidad de conservar energía y aminoácidos, por lo cual la síntesis proteica se encuentra disminuida. Otro aspecto importante, es el hecho de que la producción de PCR depende de manera directa de la síntesis de las citocinas proinflamatorias IL-1, IL-6 y FNT (10-12), especialmente de la IL-6 (32). Una disminución de la capacidad funcional de esta última citocina pudiera explicar la síntesis disminuida de PCR en el desnutrido infectado en comparación con el eutrófico infectado. Malavé y col. (28) reportan elevación de IL-6 de manera similar en desnutridos y eutróficos infectados. Sin embargo, en un estudio realizado en nuestro medio en desnutridos marasmáticos (33) se encontró que los desnutridos infectados elevaban sus valores iniciales de IL-6, pero en menor cuantía con diferencias estadísticamente significativas al compararlos con los eutróficos infectados, por lo que cabe asumir que este tipo de desnutrido presenta una síntesis reducida de PCR debido a una disminución de la capacidad funcional de la IL-6. Un resultado de PCR tiene significación cuando su valor es superior a 10 mg/L, no obstante, cuando se trata de procesos infecciosos su cuantificación permite distinguir un proceso bacteriano de un proceso viral, especialmente cuando se trata de meningitis, neumonía o sepsis (7, 14, 34), situaciones clínicas donde las concentraciones son superiores a los 20 mg/L. Algunos investigadores coinciden que valores mayores de 60 mg/L son los que permiten diferenciar verdaderamente una infección bacteriana de una infección viral (14, 35). En la presente investigación se encontró que el 100% de los eutróficos infectados tenían concentraciones de 60 mg/L o más, de los cuales el 90% tenían concentraciones superiores a 100 mg/L, mientras que en los desnutridos infectados sólo el 70% mostró valores mayores a 60mg/L, y de ellos sólo 6 (30%) presentaron concentraciones muy elevadas (más de 100 mg/L). Es importante señalar que sólo 2 casos presentaron valores (12mg/L y 15 mg/L) por debajo de 20 mg/L. Este ligero incremento sobre la concentración normal de PCR (10 mg/L) debe considerarse de valor en el desnutrido infectado marasmàtico, ya que su capacidad para sintetizar este reactante de fase aguda se encuentra disminuida. Con relación a las concentraciones de PCR en los grupos de desnutridos sin infección (leves, moderados y graves) es importante señalar que el valor promedio para los desnutridos graves mostró diferencias significativas con los otros grupos; sin embargo, las concentraciones de PCR estuvieron elevadas pero dentro del rango normal. Estos hallazgos pudieran explicarse por la presencia de infecciones subclínicas no demostradas para el momento de la evaluación por los estudios complementarios realizados y pudieran alertar al pediatra sobre la necesidad de una segunda determinación para confirmar o descartar una infección. Resulta importante señalar que en la literatura revisada, sólo el trabajo reportado por Doherty y col. (17) señala que los desnutridos moderados y graves presentan valores disminuidos de PCR (16). Los resultados de la presente investigación amplían la información sobre el niño desnutrido y permiten concluir que el desnutrido infectado conserva la capacidad para sintetizar PCR cuando presenta un proceso infeccioso, mostrando diferencias significativas cuando se compara con los no infectados. Sin embargo, frente al eutrófico infectado su respuesta es menor, ya que estos últimos presentan un incremento sustancial en la producción de esta proteína. A pesar de ello la cuantificación de PCR en el desnutrido grave infectado debe utilizarse de rutina como una prueba de ayuda en el diagnóstico de procesos infecciosos en estos pacientes. En relación con los desnutridos no infectados (leves, moderados y graves) se concluye que la síntesis de PCR se encuentra preservada en estos pacientes, dado que sus valores son similares a los del grupo control eutrófico. No obstante, cuando se trata de un desnutrido grave, la determinación de PCR debería incluirse dentro de los exámenes de laboratorio que se realizan en estos niños, tomando en consideración que un valor superior a 8 mg/L debe alertar al médico en este sentido y considerar el diagnóstico de infección y el uso de antibióticos, si en una determinación posterior (48 horas) las cifras se elevan. AGRADECIMIENTO Nuestro agradecimiento al Fondo Nacional para la Ciencia y Tecnología (FONACIT), por el soporte financiero de la presente investigación (Proyecto S1-96001377). REFERENCIAS 1. Amador M, Hernández M. Indicadores Bioquímicos para la Evolución del Estado de Nutrición. Instituto de Nutrición e Higiene de los Alimentos (INHA). La Habana. Cuba, 1993. pp. 83-133. [ Links ] 2. Amesty A, Diez-Ewald M, Villarroel M, Montiel N, Granados A, Díaz S, Salas D, Rivero M: Aspectos inmunológicos del desnutrido. I. El desnutrido en recuperación nutricional. Invest Clín 1996; 37(2): 95-111. [ Links ] 3. Chandra RK. Protein-energy malnutrition and immunological response. J Nutr 1992; 122(35):597-603. [ Links ] 4. Amesty A, Villarroel M, Adalberto G, Rivero M, Díaz S, Salas D. Aspectos inmunitarios del desnutrido infectado. Arch Venez Puer Ped 1997; 60(3):99-106. [ Links ] 5. Ozkan H, Olgun N, Sasman E, Abacaoglu H, Okuyan M, Cevik A. Nutrition, Immunity and Infection: T lymphocyte subpopulations in protein-energy malnutrition. J Trop Pediatr 1993; 39:257-260. [ Links ] 6. Chandra RK. Nutrition and Immunology: From the clinic to cellular biology and back again. Proc Nutr Soc 1999; 58(3): 681-683. [ Links ] 7. Dowton B, Colten H. Acute phase reactants in inflammation and infection. Seminars in Hematology 1998; 25(2):84-90. [ Links ] 8. Jaye Dl, Waites K. Clinical applications of C reactive protein in pediatrics. Pediatr Infect Dis J 1997; 16:735-744. [ Links ] 9. Kushner I. The phenomenon of acute phase response. Ann NY Acad Sci 1982; 389:39-48. [ Links ] 10. Moshage H. Cytokines and the hepatic acute phase response. J Pathol 1997; 181:257-266. [ Links ] 11. Pullicino E, Carl F, Pooles S, Rafferty B, Malek S, Elia M. The relationship between the circulating concentration of interleukin 6 (IL-6), tumor necrosis factor (TNF) and the acute phase response to elective surgery and accidental injury. Lymphokine Research 1990; 9:231-238. [ Links ] 12. Castell JV, Gòmez-Lechon MJ, David M, Fabra R, Trullenge R, Heinrich PC. Acute-phase response of human hepatocytes: regulation of acute-phase protein synthesis by interleukin-6. Hepatology 1990; 12(5): 1179-1186. [ Links ] 13. Santolaya M, Cofre J, Beresi V. C-reactive protein: A valuable aid for the management of febrile children with cancer and neutropenia. Clin Infect Dis 1994; 18: 589-595. [ Links ] 14. Sormunen P, Kallio MJ, Kilpit, Peltola H. C- reactive protein is useful in distinguishing Gram stain-negative bacterial meningitis from viral meningitis in children. J Pediatr 1999; 134(6):725-729. [ Links ] 15. Morlese JF, Forrester T, Hahoor F. Acute phase protein response to infection in severe malnutrition. Am J Physiol 1998; 275:112-117. [ Links ] 16. Sawerwein R, Mulder J, Mulder L, Lowe B, Peshu N, Pierre N, Vander Meer J, Marsh K. Inflamatory mediators in children with protein-energy malnutrition. J Clin Nutr 1997; 65:1536-1539. [ Links ] 17. Doherty M, Golden M, Raynes J, Griffin G, Mcadam K. Acute phase protein response is impaires in severely malnourished children. Clin Sci 1993; 84:169-175. [ Links ] 18. Méndez Castellano H. Estratificación Social. Método de Graffar Modificado para Venezuela. Arch Venez Puer Pediatr 1986; 49:93-104. [ Links ] 19. WHO. The World Health Report 1996; 6-15. [ Links ] 20. Espinoza I. Guía Práctica para la evaluación antropométrica del crecimiento, maduración y estado nutricional del niño y adolescente. Arch Venez Puer Pediatr 1998; 61(Supl 1):3-52. [ Links ] 21. Henríquez Pérez G, Hernández Valera Y, Correa Alfonso C. Evaluación nutricional y antropométrica. En López Blanco M, Landaeta Jiménez M Eds. Manual de Crecimiento y desarrollo. SVPP. Capítulo Crecimiento, Desarrollo, Nutrición y Adolescencia. FUNDACREDESA. Caracas: Serono, 1991; pp: 16-23. [ Links ] 22. Pellieter D. The potentiating effects of malnutrition on children mortality: Epidemiologic evidence and policy implications. Nutr Rev 1994; 52(12): 409-415. [ Links ] 23. Simeleos D, Lolseged S. Clinical profile and pattern of infection in Ethiopian children with calorie protein malnutrition. East Afr Med J 1994; 71(4):264-267. [ Links ] 24. Scrimshaw N, Taylor C, Gordon J. Interactions of nutrition and infections. Geneva World Health Organization 1968. [ Links ] 25. Razban S, Olusi S, Ade Serrano M, Osunkoya B, Adeshina H, Mcfarlanes H. Acute phase protein in children with protein-calorie malnutrition. J Trop Med Hyg 1975; 78(12):264-266. [ Links ] 26. Ekanem E, Umotong A, Raykundalia C, Catty D. Serum C-reactive protein and C3 complement protein levels in severely malnourished. Nigerian Children with and without bacterial infections. Acta Pediatr 1997; 86(12):1317-1320. [ Links ] 27. Campos I, Sotelo E, Gutierres H. Comportamiento de los reactores de fase aguda en pacientes desnutridos y eutróficos con y sin infección. Arch Venez Puer Pediatr 2001; 64(2):87-94. [ Links ] 28. Malave I, Vethencourt M, Pirela M, Cordero R. Serum levels of undernourished children and normal control without or with associated clinical. Infect J Trop Pediatr 1998; 44(5):256-262. [ Links ] 29. Reio M, Badaloo A, Forrester T, Morlese J, Heird W, Jahoor F. The acute-phase protein response to infection in edematous and nonedematous protein-energy malnutrition. Am J Clin Nutr 2002; 76: 1409-1415. [ Links ] 30. Lyoumi S, Tamion F, Petit J, Déchelotte P, Dauguet C, Scotte M, Hiron M, Lepligard A, Salier J, Daveau M, Lebreton J. Induction and modulation of acute-phase response by protein malnutrition in rats: Comparative effect of system and localized inflammation on interleukin-6 and acute-phase protein synthesis. J Nutr 1998; 128: 166-174. [ Links ] 31. Golden MH, Waterlow JC, Picou D. Turnover synthesis and breakdown before and after recovery from protein-energy malnutrition. Clin Sci Mol Med 1997; 53: 473-477. [ Links ] 32. Castell JV, Gòmez-Lechòn MJ, David M, Hirano T, Kishimoto T, Heinrich PC. Recombinant human interleukin-6 (IL-6/ BSF-2/HSF) regulates the synthesis of acute phase proteins in human hepatocytes. FEBS Lett 1988; 232(2): 347-350. [ Links ] 33. Amesty De V A, Castillo JL, Villarroel M, Núñez JR, Marcano H, Colmenares Y, Atencio R, Rivero M, Cayama N. Citocinas proinflamatorias y proteína C reactiva en niños desnutridos graves infectados y en un grupo control. Arch Ven Puer Pediatr 2002; 65(3):91-99. [ Links ] 34. Sasaki K, Fujita I, Hamasaki Y, Miyazaki S. Differentiating between bacterial and viral infection by measuring both C- reactive protein and 2`-5`-oligoademylate synthetase as inflammatory markers. J Infect Chemother 2002; 8(1):76-80. [ Links ] 35. Virkki R, Juren T, Rikalainen H, Svedstrom E, Mertsola J, Remskanen O.: Differentiation of bacterial on viral pneumonia in children. Thorax 2002; 57(5): 438-441. [ Links ]












 uBio
uBio 

