Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Facultad de Ingeniería Universidad Central de Venezuela
versión impresa ISSN 0798-4065
Rev. Fac. Ing. UCV v.25 n.1 Caracas mar. 2010
Síntesis de pigmentos del tipo azul ultramarino utilizando diversos tipos de materia prima
Lucy Goncalves1, Delfín Moronta2, Freddy Ocanto1, Carlos Linares1,*
1Universidad de Carabobo. Facultad de Ciencias y Tecnología. Departamento de Química. Laboratorio de Catálisis y Metales de Transición. Carabobo, Venezuela, e-mail: clinares@uc.edu.ve
2Universidad Central de Venezuela. Facultad de Ciencias. Escuela de Física. Caracas, Venezuela
RESUMEN
El objetivo principal de esta investigación fue sintetizar pigmentos inorgánicos del tipo azul ultramarino con diversas fuentes de materia prima. Se utilizaron dos tipos de caolines: uno nacional y otro español; pirofilita nacional, azufre elemental, carbonato de sodio y carbón; estos dos último de grado técnico. Previamente, las arcillas y la pirofilita fueron deshidratadas a 700 °C por 6, 12 y 24 horas, respectivamente, y luego se caracterizaron por medio de técnicas tales como: análisis químico (EDX), infrarrojo y rayos X. Luego de esto, se sintetizaron los pigmentos, utilizando relaciones variable S8/Na2CO3 y tiempos de reacción. Estos sólidos también se caracterizaron por infrarrojo, difracción de rayos X y resonancia electrónica paramagnética. La calidad de las arcillas empleadas fue un factor determinante en la sodalita obtenida ya que a mayor relación Si/Al mayor es la dificultad de obtener la zeolita deseada. Las condiciones óptimas para la obtención del azul ultramarino fueron: una relación ideal de S8/Na2CO3 = 0.3 y un tiempo de deshidratación de la materia prima de 24 horas.
Palabras clave: Pigmentos azul ultramarinos, Caolín, Sodalitas, Polisulfuros, Pirofilita.
Synthesis of ultramarine blue type pigments using several raw materials
ABSTRACT
The main goal of this study was to synthesize blue ultramarine-type inorganic pigments by using several raw materials. During the synthesis we used a national and Spanish kaolin, a national pirophilite, elemental sulphur, sodium carbonate and carbon. Previously, clays were dehydrated at 700°C for 6, 12 and 24 h, and then they were characterized by EDX analysis, FT-IR and powder-ray X diffraction. After that, pigments were synthesized by using variable S8/Na2CO3 ratio and different reaction times. These solids were also characterized by FT-IR, powder X-ray and EPR. The clay used was a key factor in the synthesis of sodalite-type zeolite due to the fact that a high Si/Al ratio does not allow the formation of the sodalite. The best conditions to synthesize blue ultramarine were a S8/Na2CO3 = 0.3 ratio and a 24 h dehydration time for the raw material.
Keywords: Ultramarine blue pigments, Kaolin, Sodalites, Polysulfides, Pirophilite.
Recibido: junio de 2009 Recibido en forma final revisado: diciembre de 2009
INTRODUCCIÓN
Los pigmentos son compuestos que pueden ser incoloros, coloreados o fluorescentes e insolubles, no son afectados física o químicamente por el medio al cual se incorporan. En general, están constituidos por una sustancia colorante orgánica o inorgánica y una base o portador en relación más o menos definida. Para aplicarse, deben dispersarse en un vehículo sin combinarse con él (por ejemplo las tintas y los barnices). En algunos casos el sustrato puede servir de vehículo como en la coloración de polímeros o alimentos (Marcano, 1990).
Los pigmentos más utilizados en la industria son del tipo inorgánico, estos se clasifican según su color en: blancos opacos, blancos extendedores, rojos y pardos, amarillos y naranjas, verdes, azules y negros; y en general, se caracterizan por tener un gran poder de recubrimiento y estabilidad
(Marcano, 1990). Gran parte de los pigmentos inorgánicos en el mercado venezolano son importados, costosos y en algunos casos perjudiciales para el medio ambiente, la salud de los trabajadores del área y de los usuarios. Dentro de estos pigmentos inorgánicos, los del tipo azul ultramarino son una buena alternativa. Estos pigmentos, químicamente, consisten en un silicoaluminato de sodio polisulfurado. La estructura general del azul ultramarina es una sodalita del tipo: Na8-X[SiAlO4]6.[S2,S3,SO4,Cl]2-X. Estos pigmentos presentan diversas aplicaciones, por su potente azul brillante, en las industrias del plástico, pintura y recubrimiento, del cemento y materiales de construcción; jabones y detergentes; productos de cuidado personal y cosmética; pintura artística, tintes y papel (Seel, 1984).
Durante la síntesis de estos materiales, se requiere de fuentes naturales que aporten Si y Al, carbonato de sodio que funda en sus componentes principales la fuente de Si y Al y generen los sulfuros de sodio, azufre responsable de la coloración azul, y carbón o aceites de alto peso molecular, que aseguren el ambiente reductor. Además, es fundamental que el proceso se realice a altas temperaturas (Kowalak et al. 2004).
Así, el propósito de esta investigación fue sintetizar pigmentos inorgánicos ecológicos de tipo ultramarino a partir de diversos tipos de materia prima. Todo ello, con el fin de contribuir en forma positiva, con el desarrollo de la industria nacional.
TÉCNICAS EXPERIMENTALES
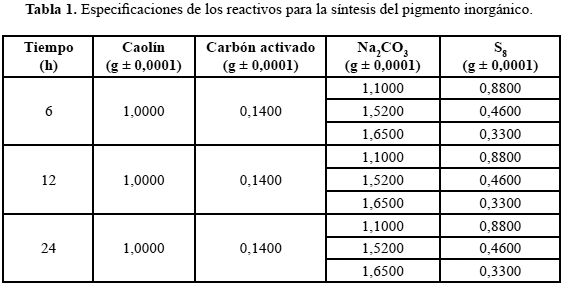
Para la síntesis del azul ultramarino se utilizaron los siguientes reactivos: caolín (proveniente del Estado Lara, Venezuela (CN), y de España (CE)); una pirofilita (PI) del Estado Trujillo (Venezuela); azufre S8 (residuo de la Refinería El Palito), carbonato de sodio y carbón activado grado técnico. Todos los reactivos fueron previamente molidos antes de su uso. Las arcillas y la pirofilita, antes de su uso en la síntesis de los pigmentos, se precalentaron a 700°C por 12 h para desestabilizarlas y remover los iones hidroxilos así como el agua contenida en ellas. En la síntesis de los pigmentos se trabajó con diferentes relaciones S8/Na2CO3 y una cantidad fija de arcilla y de carbón (tabla 1). La mezcla resultante fue colocada en un crisol con tapa a fin de generar la atmósfera reductora. Luego, los crisoles fueron introducidos en una mufla pre-calentada a 750°C a tiempos variables de reacción (6, 12 y 24h).
Los pigmentos asi obtenidos fueron pulverizados en un mortero, se lavaron con agua destilada caliente, se filtraron con el fin de remover los sulfoxidos y se secaron en la estufa a 80 ºC. Tanto las arcillas, en su estado inicial, como los pigmentos, se caracterizaron por diferentes metodos espectroscopicos: analisis quimico por EDX (equipo Jeol JXA-8900R WD/ED combinado con microanalisis), para determinar los componentes principales; infrarrojo con transformada de Fourier (espectrometro Perkin-Elmer 283) a fin de determinar los grupos funcionales presentes; y difraccion por rayos X (difractometro Siemens 5000 con radiacion CuKa (1.542 Å) con el fin de identificar la estructura cristalina inicial de las arcillas; y resonancia electronica paramagnetica (RPE) (Varian en modo TE102) a fin de determinar las especies cromoforas S3 - responsables del color azul. Durante el desarrollo del trabajo se establecio la siguiente nomenclatura: a(b,c), donde a, es el nombre del material de partida (caolin, pirofilita); b, es la relacion azufre/ carbonato de sodio; y c es el tiempo de deshidratacion de la arcilla (calcinacion).
RESULTADOS Y DISCUSIÓN
Caracterización de la materia prima
Antes de una caracterización profunda del material de partida para la síntesis de los pigmentos, se realizaron algunas pruebas correspondientes a la formación de los sólidos deseados. Partiendo de los resultados obtenidos, se observó, que en el caso del caolín nacional (CN) no se logró el color esperado, probablemente debido a la presencia de hierro ya que contiene el porcentaje más alto de las tres arcillas empleadas para la síntesis de los pigmentos (tabla 2). Cuando el hierro está presente en un porcentaje significativo, modifica el estado sólido y las propiedades del azul ultramarina, causando amorfización y cambio de color del producto final, provocando un sólido de color marrón y otros subproductos, como el sulfuro de hierro. La tabla 2 muestra, igualmente, la relación Si/Al que hay en cada uno de los materiales de partida. En ella, se puede observar que hay una mayor relación Si/Al en el caolín nacional. Esta alta relación en el caolín nacional tampoco contribuye a la formación de la sodalita ya que existe un excedente de silicio, el cual influye en la formación del sólido deseado (Dixon, 1997).
La figura 1 muestra los espectros de infrarrojo de las arcillas y la pirofilita empleadas. Tal como podemos observar, las bandas observadas son propias de las arcillas en estudio (caolín español y pirofilita). En ambos espectros, las bandas correspondientes a las vibraciones entre 1120-1045 cm-1 se deben al estiramiento asimétrico Si-O-Al y el enlace Si-OSi. Las bandas ubicadas a 950-914 cm-1 corresponden al enlace Al-OH, las bandas entre 799-670 cm-1 son asignadas al estiramiento simétrico Si-O-Al y por último, las bandas entre 538-477 cm-1 son adjudicadas a enlaces presentes en los tetraedros de silicio (Landman & Waal , 2003).
Por otra parte los solidos deshidratados fueron tambien analizados por difraccion de rayos X (figura 2). Las senales observadas, para el caso del caolin espanol, se pueden atribuir a la presencia de diversos minerales, principalmente la caolinita, como ya se hizo referencia en el espectro de infrarrojo. Ademas, la senal 2Q: 26,67 (CE) y 26,62 (PI), se atribuyeron al cuarzo presente en ambos materiales, con distancias interplanares a 3,33 y 3,34, para el CE y la PI (Kihara, 1990).
Caracterización de los pigmentos ultramarinos sintetizados
Se sintetizaron 18 productos variando la relación S8/Na2CO3 y tiempo de deshidratación del material de partida. En la tabla 3, se muestran algunos aspectos y observaciones correspondientes a cada uno de ellos. Para la caracterización se seleccionaron 9 muestras del total. Como se hace mención en la tabla anterior, las muestras descartadas se deben a que o no se obtuvo el color deseado (como el sólido CE (0.3, 6)) o bien sea, a que en algunos casos se obtuvieron tonos semejantes entre sí. Por ejemplo, el color azul del CE (0.3, 12) es muy parecido al de CE (0.3, 24), y así en otros casos.
Al comparar los colores azules alcanzados en las sodalitas, se puede observar que los tonos más fuertes se obtuvieron con la relación S8/Na2CO3 y tiempo de calcinación: 0.3, 24. Estas variables juegan sin duda, un papel importante en la obtención del azul ultramarino, ya que al variar el tiempo de deshidratación en las arcillas, en la síntesis de los pigmentos, cambia el producto final. En la tabla anterior se observa que los colores azules obtenidos son más intensos con un mayor tiempo de deshidratación de la arcilla (pirofilita y caolín español); es decir, a mayor tiempo de deshidratación de la arcilla hay una mayor deslaminación, lo que favorece una mejor cristalización de la sodalita y encapsulación del azufre dentro de su estructura (Landman & Waal, 2003; Booth et al. 2003). Con las relaciones S8/Na2CO3 0.8 y 0.2 no se obtuvieron los resultados deseados. Para la relación 0.8, la cantidad de Na2CO3 no fue suficiente para la fusión del caolín y por lo tanto para la formación de la sodalita y con la relación 0.2, en el caso del caolín español, no se obtuvo el color deseado probablemente debido a que la cantidad de azufre se transformó en su mayor parte en SO2 y no se formaron las especies cromóforas necesarias, como los polisulfuros de sodio, para ser encapsulados en la sodalita. Para el caso de la pirofilita, si llegó a determinarse un color azul claro, lo que indica que o no se formó la especie S3 -, responsable del color azul intenso o la cristalinidad de estos sólidos no fue la deseada.
En las figura 3 se muestran los espectros de infrarrojo correspondientes a la corrida de 12 horas de las ultramarinas sintetizadas a partir de la pirofilita.
En este espectro se pueden observar coincidencias y diferencias entre los cuatro espectros de IR de las muestras PI (0.2, 12), PI (0.3, 12), PI (0.8, 12) y PI (24). Tal como se puede observar hay una banda alrededor de los 1000 cm-1 coincidente en todos los sólidos. Esta banda está asociada a los enlaces Si-O-Al presentes tanto en las sodalitas (azul ultramarina) como en el material de partida (pirofilita PI (24)). Esta banda es típica en estos sólidos debido a la presencia de Al y Si en cada uno de ellos. A partir de los 600 hasta 200 cm-1 correspondiente a la zona de la huella digital, existen claras diferencias entre la pirofilita transformada en sodalita y la inicial. En el caso de las sodalitas, dos bandas anchas de intensidad media ubicadas alrededor de los 694 y 465 cm-1 son típicas de este tipo de sólidos; sin embargo, no aparecen bien definidas, ya que estas sodalitas están poco cristalizadas, tal como se observó en los análisis de rayos X. Una banda en 583 cm-1 correspondiente a la especie cromófora S3 - generalmente es identificada en los compuestos de azul ultramarina; sin embargo, en los espectros de las muestras obtenidas no aparece definida en ninguna de las tres sodalitas formadas, tal vez el ancho de la banda ubicada a 694 cm-1 solapa a la banda típica del S3 - (Landman & Waal, 2003). En un intento de determinar diferencias entre las tres sodalitas sintetizadas a distinta relaciones S8/Na2CO3 y tiempos de deshidratación, no observamos diferencias entre ellas. El IR infrarrojo determina la formación de la sodalita pero no diferencia las tonalidades alcanzadas por los pigmentos sintetizados. Sin embargo, los resultados obtenidos representan un gran avance en la síntesis de este tipo de pigmentos ya que no es usual su uso con este fin.
Un análisis semejante fue hecho en la figura 4, donde se observa la transformación del caolín español a azul ultramarina. Los espectros de IR de las muestras CE (0.8, 24), CE (0.3, 24), CE (0.2, 24), son semejantes entre sí pero muy diferentes al caolín en su estado inicial, evidentemente hubo transformación del caolín a sodalita. Los cambios más notables son los observados alrededor de la huella digital ubicada entre los 600 y los 200 cm-1. Ahora bien, entre los espectros de las azules ultramarinas sintetizadas existen algunas diferencias entre el grupo de bandas ubicadas a 600 y 400 cm-1. Para la muestra CE (0.8, 24) aparecen las bandas mencionadas pero poco divididas. Mientras para la muestra CE (0.3, 24), las bandas anteriores aparecen bien separadas. Esta multiplicidad de divisiones en estas bandas son indicios de una mayor cristalinidad aparente, CE (0.2, 24) > CE (0.3, 24) > CE (0.8, 24), la menor cristalinidad presentada por la muestra CE (0.8, 24) está relacionada con la menor cantidad de Na2CO3 en la composición de síntesis, componente esencial para la fusión del caolín y formación de la sodalita. Por otra parte, la banda típica de la especie cromófora S3 - generalmente ubicada en 583 cm-1 aparece como hombros discretos en la muestra CE (0.3, 24) responsable del color observado. Es claro que estas muestras son más cristalinas que aquellas en la que se utiliza pirofilita como materia prima para la síntesis de los pigmentos. La baja relación Si/Al presentada por estos caolines, debe ser la responsable de la alta cristalinidad observada en las muestras sintetizadas a partir del caolín español.
En la figura 5 se muestran los espectros de DRX pertenecientes a muestras sometidas a 12 horas de deshidratación y diferentes relaciones S8/Na2CO3 a fin de comparar los productos finales con la arcilla original. Se puede observar la aparición de nuevos picos que indican la formación de nuevos compuestos. En las muestras PI (0.8, 12) y PI (0.2, 12) están reflejados los picos que indican la formación de la sodalita, sin embargo no se alcanzó el color deseado. Para el caso de PI (0.2, 12) posiblemente no se llegó a formar la especie cromófora responsable del color S3 - debido quizás a la poca cantidad de azufre presente. Para la muestra PI (0.8, 12) la explicación es contraria, existe la mayor cantidad de azufre posible pero poca sal fundente lo que provoca la dificultad de sintetizar la sodalita con tanta intensidad como en la PI (0.2, 12). Los rayos X demuestran una serie de picos no identificados que pueden corresponder a restos de materia prima y a la formación de otros productos que no coinciden necesariamente con la formación de la sodalita. En la combinación PI (0.3, 12), se presentó el color azul deseado, semejante al azul ultramarino, y se observa en el espectro sus picos correspondientes a la sodalita, además de otras que se atribuyen a la formación de otros subproductos no identificados pero de menor intensidad que la fase sodalita. Estos resultados son concordantes con los espectros de IR, donde se observó que la sodalita no se formó por completo. A pesar de estos resultados alcanzados, se pudo obtener el azul ultramarino.
En la figura 6 se hace una comparación con dos sólidos obtenidos a partir de pirofilita a diferentes tiempos de calcinación pero con igual relación S8/Na2CO3 y se compara con la arcilla antes de la reacción. Tal como se puede observar, la muestra cuya arcilla fue deshidratada por 6 h condujo a un sólido menos cristalino que el obtenido a 24 h. En el difractograma de la muestra PI (0.2, 6) se observan los picos con una menor intensidad que en el correspondiente a la muestra PI (0.2, 24). Como se puede ver, estas muestras no alcanzaron el tono azul deseado, debido a que posiblemente no se formó la especie cromófora S3 - o por la composición de la pirofilita (relación Si/Al), que favoreció la formación de otros subproductos.
Algunos de estos sólidos también fueron caracterizados por resonancia paramagnética electrónica (RPE). Esta técnica permite determinar la presencia de radicales y electrones libres en diferentes muestras. Debido a que en las muestras de azul ultramarina, se encuentra azufre S3 - y S2 - (responsable del color azul) encapsulado dentro de la matriz de la sodalita, es muy probable que estas muestras sean paramagnéticas. Como fue mencionado anteriormente, el IR podría dar indicios de la presencia de estos radicales, pero en los espectros realizados, éstos nunca estuvieron presenten de manera contundente, y sólo aparecieron como hombros discretos. Por lo tanto la técnica de RPE permitió verificar la presencia de estos radicales.
Estos espectros están caracterizados por señales que sobresalen de líneas continuas. Estas señales sobresalientes corresponden a electrones o radicales libres y están relacionadas con el campo magnético aplicado. Cada señal, también tiene asociado un valor g, conocido como factor giromagnético del electrón libre. En nuestras muestras, el g determinado fue de 1,996 para la muestra CE (0.3, 24) y de 1,998 para la muestra PI (0.3, 12). Estos valores se corresponden con los obtenidos por el grupo de Arieli et al. (2004), y han sido asignados a especies S3 -. La especie S2 -, también paramagnética no fue determinada debido a la temperatura de trabajo (294 K). Generalmente esta especie es observada a bajas temperaturas (10 K). Los resultados obtenidos nos permiten corroborar la formación del azul ultramarina obtenida tanto del caolín español como de la pirofilita.
CONCLUSIONES
Se logró la síntesis de pigmentos del tipo azul ultramarino utilizando materia prima tal como caolín y pirofilita. Ésta última es de particular interés por sus pocas aplicaciones en el área. Estos materiales fueron caracterizados utilizando técnicas tales como difracción de rayos X, espectroscopía de IR, resonancia paramagnética electrónica y análisis químico por EDX. En el ensayo llevado a cabo se encontró que el tiempo de deshidratación del material y la relación azufre/carbonato de sodio tiene gran efecto en la síntesis de estos materiales.
AGRADECIMIENTOS
Los autores agradecemos al CDCH-UC por el financiamiento de este proyecto.
REFERENCIAS
1. Arieli, D., Vaughan, D.E.W., Goldfarb, D. (2004). New synthesis and insight into the structure of blue ultramarine pigments. JACS; pp. 5776-5788. [ Links ]
2. Booth, D., Dann, S.E., Weller, M.T. (2003). The effect of the cation composition on the synthesis and properties of ultramarine blue. Dyes and Pigments, 58; pp. 73-82. [ Links ]
3. Dixon, J.B. & Weed, S.B. (1977). Minerals in soil environments, Soil Science Society of America Journal, Madison, WI. p. 948. [ Links ]
4. Kihara, K. (1990). An X-ray study of the temperature dependence of the quartz structure. Eur J. Mineral, 2; pp. 63-77. [ Links ]
5. Kowalak, S., Jankowska, A., Laczkowka, S. (2004). Preparation of various color ultramarine from zeolite A under environment-friendly conditions. Catal Today, 90; pp. 167-172. [ Links ]
6. Landman, A. & De Waal, D. (2003). Fly ash as a potential starting reagent for the synthesis of ultramarine blue. Mater Res Bull, 39(4-5); pp. 655-667. [ Links ]
7. Marcano, D. (1990). Introducción a la química de los colorantes. Caracas: Editorial Reverte Venezolana. Venezuela. p. 205. [ Links ]
8. Seel, F. (1984). Sulphur in artwork: lapis lazuli and ultramarine pigments. Stud. Inorg. Chem, 5; p. 67. [ Links ]