Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Latinoamericanos de Nutrición
versión impresa ISSN 0004-0622versión On-line ISSN 2309-5806
ALAN v.54 n.4 Caracas dic. 2004
El té verde ¿una buena elección para la prevención de enfermedades cardiovasculares?
Tania T. Hernández Figueroa, Elena Rodríguez-Rodríguez, Francisco J. Sánchez-Muniz
Departamento de Nutrición y Bromatología I (Nutrición). Facultad de Farmacia. Universidad Complutense de Madrid. Madrid (Spain)
RESUMEN
El té (Camellia sinensis) ha sido usado durante siglos como bebida medicinal y es consumido por cerca de dos tercios de la población mundial diariamente. Es originario del sur de China y es cultivado extensamente en Asia y en los países de África central. Los tres principales tipos de son: negro, oolong y verde. El té verde es una bebida no fermentada y su consumo es habitual en los países asiáticos. Este último se produce a partir de las hojas frescas de la planta Camellia sinensis y en ellas existe: agua, proteínas, hidratos de carbono, minerales, vitaminas y polifenoles del tipo flavonoides. Los principales flavonoides en el té verde son las catequinas, las cuales constituyen cerca de un tercio de su peso seco total. La catequina más abundante es la galato de epigalocatequina (>50%). En los últimos años ha crecido el interés en el té verde y sus catequizas y su papel en la disminución de los factores de riesgo de las enfermedades cardiovasculares (ECV). El objetivo de este trabajo es revisar numerosos estudios acerca del té y su relación con diferentes factores de riesgo de ECV. De algunos de ellos puede resumirse que el té verde y sus catequinas (i) tienen efecto reductor del peso corporal, posiblemente a través de su interferencia sobre el sistema adrenosimpático y de enzimas que intervienen en la síntesis de ácidos grasos, (ii) presentan actividad antioxidante con incrementos de la fase de latencia en la oxidación de las LDL, (iii) reducen la absorción del colesterol y sus niveles plasmáticos, (iv) interfieren la expresión de moléculas de adhesión celular, (v) tienen actividad antitrombótica al inhibir la agregación plaquetaria y (vi) disminuyen la presión arterial sistólica y diastólica. Aunque estos efectos positivos sugieren que un consumo superior a 7 tazas de té verde al día (3,5 g de catequinas diarias) es una buena elección para prevenir las ECV, son aún necesarios más estudios que profundicen en los mecanismos de acción del té verde y sus catequinas en el ser humano, para así poder recomendar su uso en la prevención y tratamiento de las ECV en la población en general o sólo en individuos "diana".
Palabras clave: Agregación plaquetaria, aterosclerosis, catequinas, enfermedad cardiovascular, lesión endotelial, lipoproteínas, peroxidación, té verde.
SUMMARY
The green tea, a good choice for cardiovascular disease prevention?. Tea (Camellia sinensis) has been used for centuries as a medical drink. Around two-thirds of the worlds population drink tea. It is originated from southern China and entensive cultivated in Asia and in central African countries. Tea can be grouped into three main types, black, oolong, and green tea. Green tea is not fermented and is a major beverage consumed in Asian countries. Green tea is produced from freshly harvest leaves of the tea plant and they contain water, proteins, carbohydrates, minerals, vitamins and polyphenols of the flavonoid type. The major flavonoids in green tea are catechins which constitute about one third of its total dry weight. The major catechin present is epigallocatechin gallate (>50%). New data have increased the interest in green tea or its catechins and its role in treatment of cardiovascular disease (CHD) risk factors. The aim of the present paper is to review some studies that have found a relationship between green tea and CHD risk factors. From some of them it can be summarized that of green tea and its catechins consumptions (i) decrease body weight by interfering within the sympathoadrenal system and fatty acid synthesis, (ii) decrease cholesterol absorption and plasma levels, (iii) have strong free radical-scavenging activity inhibiting LDL oxidation, (iv) reduce the adhesion molecule expression, (v) have antitrombotic activities by inhibiting platelet aggregation and (vi) decrease systolic and diastolic blood pressures. The positive effects found suggest that a daily intake of 7 cups of green tea (3.5 g catechins) is a good choose for CHD prevention; however, it is still necessary more studies to check the action of the green tea and its catechins in humans in order to recommended its use in the general population or only in target subjects.
Key words: Atherosclerosis, catechins, cardiovascular diseases, endothelial lesion, green tea, lipoproteins, platelet aggregation, peroxidation.
Recibido:16-07-2004 Aceptado: 24-01-2005.
INTRODUCCION
El té es una de las bebidas más antiguas del mundo y sus extractos son uno de los agentes medicinales usados desde tiempos ancestrales (1). Después del agua es la bebida de preferencia y actualmente dos tercios de la población mundial lo ingieren (2-6). Durante siglos, tanto el té verde como el negro, constituyeron las bebidas seguras y de preferencia en los países asiáticos. Sin embargo, no fue hasta el siglo XVI cuando se popularizó en occidente, gracias a los exploradores y comerciantes europeos. Entonces era comercialmente muy caro y Rusia adquirió una gran importancia en "la ruta" del té (7). En China, se lleva consumiendo desde hace casi 3000 años, siendo este país su principal productor. Es ampliamente cultivado en el sur de Asia, incluyendo China, India, Japón, Taiwan, Sri Lanka e Indonesia (1). En Japón su consumo comenzó gracias a ser introducido por unos monjes budistas en el año 800 d.c. En la era Kamakura (1191-1333) los monjes describieron los efectos beneficiosos del té en su libro "Manteniendo la salud bebiendo té". De este pasaje podemos deducir que el té verde ha sido valorado como potente medicación desde tiempos remotos (1,8).
El té verde es consumido mayoritariamente en los países asiáticos, donde su significado va más allá del de una simple bebida, siendo sinónimo de bienestar, armonía, belleza, serenidad y su consumo se convierte en un ritual de gran importancia social y cultural. Por su parte, el té negro, es más consumido en los países occidentales (9) en donde su consumo, en términos generales, también tiene connotaciones de importancia socio- cultural.
Descripción de la planta y origen geográfico
El té pertenece a la familia Teácea. Es un árbol pequeño de hoja perenne que puede llegar a medir 5-10 m de alto en estado salvaje, aunque cuando se cultiva no suele sobrepasar los dos metros de altura. Sus hojas son de color verde oscuro, se disponen alternas y miden generalmente entre 5-10 cm de largo por 2-4 cm de ancho. Son pequeñas, dentadas en sus dos terceras partes superiores y se disponen aisladamente o en grupos de 2 ó 3. El fruto es una pequeña cápsula redondeada, en cuyo interior se localizan las semillas (10).
Aunque originario del sudeste asiático, desde la India y Sri Lanka hasta China o Japón, el té crece de manera extensa en las regiones tropicales y subtropicales. Para que el crecimiento del té sea óptimo, requiere suelos bien drenados, ricos en materia orgánica y con un pH ligeramente ácido. Las condiciones ideales de cultivo son clima húmedo, temperatura que oscile entre 14-27 ºC, irradiación solar de un mínimo de 5 horas diarias, humedad del aire entre 70-90% y lluvias abundantes y regulares durante todo el año. La recolección tiene lugar cuando la planta alcanza los 3 años de edad (11).
Tipos principales de té
Según el Código Alimentario Argentino, por té genéricamente se entiende exclusivamente el producto obtenido por el procesamiento conveniente de las yemas, hojas jóvenes, pecíolos y tallos tiernos de la especie Camellia sinensis (12). El Real Decreto 13547/ 1983 (España) define al té como las hojas jóvenes y las yemas sanas y limpias de distintas especies del género botánico Thea en buen estado de conservación, convenientemente preparadas para el consumo humano, y poseyendo el aroma y gusto característicos de su variedad y zona de producción.
Existen cuatro tipos principales de té, pero a ellos hay que sumar las múltiples variedades existentes dentro de cada categoría que suman más de 30 tés en todo el mundo (2):
- Té blanco: Se produce a escala muy limitada lo que explica el elevado precio que alcanza. China y Sri Lanka son los principales exportadores.
- Té semifermentado o té Oolong: Se elabora principalmente en China y en Taiwán.
- Té de fermentación completa: El té negro pertenece a esta categoría. Su manufactura incluye un paso de oxidación enzimática en el cual la mayoría de las catequinas (polifenoles) se convierten en productos de condensación complejos (teaflavinas y tearubiginas) (13).
- Té no fermentado: El té verde es un ejemplo de este tipo de té. Su elaboración proviene de las hojas frescas, secas y jóvenes de la Camellia sinensis; a diferencia de los anteriores, no se somete a proceso de oxidación enzimática (4,13). El té verde es poco aromático, de sabor amargo y la infusión obtenida es verdosa (7). También se le conoce como Thea sinensis L (4).
- Té descafeinado: es el té verde o negro o semifermentado, desprovisto de la mayor parte de su cafeína.
- Extracto soluble de té: es el producto soluble en agua, obtenido por total o parcial evaporación de la infusión de té.
- Té aromatizado: son los tés definidos anteriormente, los que por adicción de sustancias aromáticas autorizadas, plantas aromáticas o especias, se las comunica un aroma o sabor característicos.
Variedades y tipos de té verde
Existen numerosas variedades de té verde en China y Japón (7). Las más conocidas son:
- Lung Chen: Es la variedad más famosa y tal término significa "Pozo del Dragón".
- Bancha: Se extrae del tallo de la planta del mismo nombre.
- Gunpowdwer: Se hierve con menta y azúcar. Es agridulce.
- Sencha: Es de color amarillo y tiene sabor a verduras.
- Matcha: Se sirve en la ceremonia del té en Japón
- Gyokuro: Sabor a hierba cortada.
- Pi Lo Chun: Aroma a árboles frutales. Significa "caracol verde"
Fabricación del té verde
La importancia que se le atribuye al té verde en cuanto a sus propiedades saludables frente al resto de tés reside en su proceso de fabricación. Las hojas no fermentadas al sol contienen mayor número de polifenoles, ya que las enzimas que contribuyen a su oxidación quedan inactivas (14).
El proceso es el siguiente (7): 1. Inmediatamente después de recolectar las hojas se llevan a la fábrica. Se cuecen al vapor o por acción del aire caliente para detener el proceso de oxidación de las enzimas. 2. Se enrollan las hojas sobre placas o bandejas calientes para reducir el contenido de humedad. 3. Se retuercen las hojas, para adaptar el contenido de agua. 4. Se dejan secar y se envasan. Todos estos procesos no alteran la composición química del té verde.
Composición química del té
A pesar de que tanto el té verde como el té negro se obtienen a partir de las hojas de la especie Camellia sinensis, presentan diferente composición química debido a que, como ya se ha explicado, se aplican diferentes procedimientos para su obtención (9). En la hoja fresca de la planta destaca la presencia de agua, proteínas (15-20%), glúcidos (35%), sales minerales, vitaminas (ácido ascórbico y algunas del complejo B), bases púricas (cafeína, teobromina y teofilina) y derivados polifenólicos (flavonoides) (9) (Tabla 1).
Composición del té verde y negro (por 100 g).
| Té verde | Té negro | ||||
|
| Hoja | Infusión* | Hoja | Infusión* | |
| Macronutrientes (g) |
| ||||
| Proteínas | 24 | 0,1 | 20,6 | 0,2 | |
| Lípidos | 4,6 | 0 | 2,5 | 0 | |
| Azúcares | 35,2 | 0,1 | 32,1 | 0,1 | |
| Fibra | 10,6 | 0 | 10,9 | 0 | |
| Cenizas (g) | 5,4 | 0,1 | 5,2 | 0,1 | |
| Minerales (mg) |
| ||||
| Calcio | 440 | 2 | 470 | 2 | |
| Fósforo | 280 | 1 | 320 | 3 | |
| Hierro | 20 | 0,1 | 17,4 | 0 | |
| Sodio | 3 | 2 | 3 | 2 | |
| Potasio | 2200 | 18 | 2000 | 16 | |
| Vitaminas |
| ||||
| Vitamina A (UI) | 13000 | 0 | 900 | 0 | |
| Tiamina (mg) | 0,35 | 0 | 0,1 | 0 | |
| Riboflavina (mg) | 1,4 | 0,03 | 0,8 | 0,01 | |
| Niacina (mg) | 4 | 0,1 | 10 | 0,2 | |
| Vitamina C (mg) | 250 | 4 | 0 | 0 | |
| Cafeína (mg) | 2,3 | 0,02 | 2,7 | 0,05 | |
Infusión preparada con 3 gramos de hojas en 100 ml de agua hirviendo durante
2 minutos. Adaptado de Yamamoto et al (15)
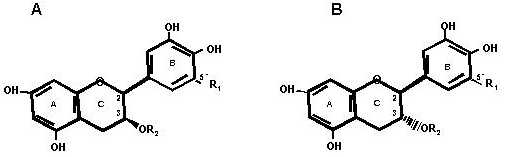
De los polifenoles totales, el 59,9% lo constituyen las catequinas (9). Las catequinas están formadas por 15 átomos de carbono y contiene dos núcleos fenólicos (anillos A y B) que están unidos por tres átomos de carbono que forman parte, junto con un átomo de oxígeno, del anillo C. Los carbonos 2 y 3 del anillo C son asimétricos y según la posición espacial de los sustituyentes del carbono 3, las catequinas pueden ser enantiómeros (+) o (-) (15). Se han definido ocho catequinas diferentes al extraer los polifenoles del té con etilacetato, siendo las mayoritarias el (-)-galato de epigalocatequina (EGCG) y (+)-galocatequina (GC), que representan el 51,8% de las ocho catequinas. En menor cantidad se encuentran otras catequinas (15,16) (Figura 1).
FIGURA 1
Estructura química de las catequinas del té
A: enantiómeros (+)
R1 R2 Catequina
H H catequina (C)
H galato galato de catequina (CG)
OH H galocatequina (GC)
OH galato galato de galocatequina (GCG)
B: enantiómeros (-)
R1 R2 Catequina
H H epicatequina (EC)
H galato galato de epicatequina (ECG)
OH H epigalocatequina (EGC)
OH galato galato de epigalocatequina (EGCG)
Según el método empleado en la obtención, la cantidad de estos flavonoides es diferente. En la obtención del té negro se dejan fermentar las hojas, lo que permite que el enzima polifenol oxidasa oxide las catequinas de la hoja a quinonas, que posteriormente condensan para formar flavanoles (F), tearubiginas (TR) y teaflavinas (TF), que son una mezcla de teaflavina 1 (TF1), 3-galato de teaflavina (TF2A), 3´-galato de teaflavina (TF2B) y 3,3´-digalato de teaflavina (TF3) (6). En el caso del té verde no se dejan fermentar las hojas y el enzima polifenoloxidasa no actúa, por lo que las catequinas apenas sufren transformación y son los componentes mayoritarios de la hoja, representando el 6-16% del peso seco de la misma (18,19) (Tabla 2). Si se considera que las catequinas constituyen el 10% del peso seco de la hoja del té y que para preparar una taza de infusión de té verde se utilizan aproximadamente 4-5 g de hojas secas, una taza de té contendrá aproximadamente 400-500 mg de catequinas (21).
Concentración (mg/100 g) de flavonoides en los diferentes tipos de té
|
| Té negro (infusión)1 | Té verde (infusión)1 |
| Catequina | 1,4 | 2,85 |
| Epicatequina | 2,34 | 8,66 |
| Galato de epicatequina | 7,15 | 21,96 |
| Epigalocatequina | 9,23 | 16,72 |
| Galato de epigalocatequina | 10,31 | 88,32 |
| Galocatequina | 1,26 | Trazas |
| Teaflavinas | 6,09 | 0,07 |
| Tearubiginas | 73,44 | 1,08 |
Los datos corresponden para cada flavonoide a la suma de los enantiómeros (+) y (-)
Adaptado de Bhagwat et al (20)
Procesos que afectan a la concentración de catequinas del té verde
La composición del té varía según la especie, estación del año, edad de las hojas, clima y prácticas hortícolas (22). Las hojas manufacturadas jóvenes contienen menos EGCG, (-)-epigalocatequina (EGC), EC y CT que las más viejas, no ocurriendo así con los niveles de cafeína, que son mayores en las primeras (23). La temperatura es uno de los parámetros más importantes que afectan a la estabilidad de las catequinas. En la preparación tradicional del té, en la que se deja enfriar el agua previamente hervida, la disminución en el contenido de catequinas es muy pequeña. En algunos estudios se ha comprobado que cuando una solución de catequinas se deja reposar durante 7 horas a temperatura ambiente no se producen pérdidas importantes de las mismas. Sin embargo, cuando esta misma solución se deja durante 15 minutos a 98 ºC se produce una pérdida del 10 al 15 % (21).
Efectos fisiológicos y terapéuticos del té verde
Vía de administración y biodisponibilidad de las catequinas del té
Como se ha comentado, el té es muy rico en catequinas (Tabla 2). En particular, los extractos de té verde contienen elevadas cantidades de (-)-EGCG, que representa más del 50% de las catequinas totales y es, además, la que mayor actividad farmacológica presenta (24). Se han asociado al consumo de té diferentes efectos beneficiosos sobre la salud y en particular estos efectos se han atribuido a las principales catequinas del té verde: EGCG, EC, EGC y (-)-galato de epicatequina (ECG) (25,26).
Diferentes estudios han demostrado que los polifenoles, tanto como si se toma infusión de té o extracto de catequinas, presentan efectos indirectos a nivel gastrointestinal y un efecto directo sobre diferentes tejidos, ya que se han encontrado polifenoles en sangre, orina, saliva y heces tras su ingesta (27-29). Al aumentar el consumo de té, se produce un aumento en la excreción de EC y EGCG, aunque esta relación no es muy neta (28).
La administración oral de EGCG es menos eficaz que la intraperitoneal (debido a que en el tracto gastrointestinal la EGCG puede sufrir degradaciones, interacciones y a que la absorción es menos eficaz). Sin embargo, el consumo prolongado de té verde o de extractos que contengan EGCG puede imitar algunos de los efectos que aparecen en animales administrados con EGCG intraperitonealmente (1).
Es interesante señalar que al añadir leche al té, práctica muy habitual en ciertos países como el Reino Unido (20), se induce una disminución de la biodisponibilidad de los polifenoles del té que provoca una disminución de la actividad de esta infusión in vivo, sin que se afecte su capacidad antioxidante in vitro (2). Estos efectos sólo se observan cuando la cantidad de leche añadida es muy elevada (25%). Cuando se añade un 10-15% de leche, que es la cantidad que habitualmente se utiliza, no se afecta en forma relevante la biodisponibilidad de las catequinas del té ni sus efectos in vivo (30,31). Existen dos hipótesis para explicar dicha interacción. La primera de ellas es la formación de complejos resistentes a la hidrólisis gástrica entre los polifenoles del té y las proteínas de la leche, lo que impide su absorción a nivel gastrointestinal (32). La segunda hipótesis es que los polifenoles son solubles a pH ácido, al cual se encuentran en forma no ionizada y se absorben con facilidad. La leche, al producir un ligero aumento del pH gástrico, provoca una ionización de los polifenoles e impide su absorción (33).
Mecanismo de acción del té en el control de peso corporal
La obesidad es una enfermedad metabólica muy prevalerte en la sociedad occidental. La resistencia a la insulina que se produce en la mayoría de los pacientes obesos es clave promoviendo un incremento del riesgo cardiovascular debido a la producción incrementada de lipoproteínas de baja densidad (LDL) y de muy baja densidad (VLDL) (34,35). A su vez en estos pacientes es frecuente la hipertensión ligada a la hiperinsulinemia y el incremento de la trombogénesis (35). Para conseguir una disminución del peso corporal se puede actuar en términos generales de dos posibles formas, bien reduciendo la ingesta energética, bien aumentando el gasto energético (34,36,37). El gasto energético lo constituyen la actividad física, el gasto energético basal junto con la termogénesis obligatoria y la termogénesis facultativa, en respuesta a determinadas situaciones, como la ingesta de energía y la exposición al frío (38). El sistema nervioso simpático es el encargado de regular la termogénesis y la oxidación de la grasa, por eso, un posible tratamiento contra la obesidad incluiría a aquellas sustancias que actúan sobre dicho sistema o sobre su neurotransmisor, la noradrenalina (39-41). A este grupo de sustancias que tienen efectos sobre el peso corporal pertenecen algunos componentes del té (39,42,43). Las catequinas del té actúan in vitro, inhibiendo la catecol o-metiltransferasa (COMT), enzima responsable de la degradación de la noradrenalina, lo que produce un aumento del tiempo de actuación de dicho neurotransmisor sobre los receptores b 3 de los adipocitos marrones, incrementando así la termogénesis y/o la oxidación de la grasa (34,44,45). Estudios in vitro han puesto de manifiesto la capacidad de la cafeína, cuando se administra junto con adrenalina, de inhibir la fosfodiesterasa intracelular. Esta inhibición conlleva un aumento del AMPc en el adipocito, que es un mediador de la acción de las catecolaminas sobre la termogénesis (45,46). Teniendo en cuenta estos hechos, en un estudio realizado en 10 varones sanos de 24 a 26 años se comprobó que el gasto energético en 24 horas y la oxidación de la grasa aumentaban al administrar un extracto de té (90 mg de EGCG) y cafeína (50 mg) (37). Esto se debía a la acción sinérgica de la cafeína con los polifenoles del té y, en concreto, con el más abundante, la EGCG (47). Al considerar los resultados de los estudios in vitro de la termogénesis en el tejido adiposo marrón de ratas (48) y los resultados in vivo de la biodisponibilidad de las catequinas en humanos (49,50) puede afirmarse que los efectos termogénicos del extracto de té verde se deben, al menos en parte, a las interacciones entre las catequinas del té (fundamentalmente la EGCG), la cafeína y la noradrenalina (37). Siguiendo con ésta línea de investigación, al administrar inyecciones intraperitoneales de EGCG a ratas, se producía una pérdida de peso en las mismas debido a una disminución en la ingesta, hecho que no ocurría al administrar (-)–epicatequina (EC), EGC ni ECG (1,51). Esta pérdida de apetito podría deberse a un efecto en la eficacia de la oxidación de lípidos más que a un efecto directo de la EGCG (47) o bien a una acción relacionada con neuropéptidos diferentes de la leptina, ya que la EGCG produce el mismo efecto en ratas knockout que no presentan el receptor para leptina (43,51). Otros posibles mecanismos por los que el té podría contribuir a la pérdida de peso se han observado en preadipocitos 3T3-L1 de ratones. La EGCG a una concentración de 10 μmol/L, pero no la EC, EGC ni la ECG, inhibiσ la proliferaciσn de los preadipocitos en un 50% y la acumulaciσn de triacilglicerol en un 54% en estas células durante su diferenciación a adipocitos (43). Además, tanto la EGCG como la ECG en una concentración de 0,31 mmol/L, inhibieron un 50% la actividad de la acetil-CoA carboxilasa, enzima que interviene en la biosíntesis de ácidos grasos (52).
Según los resultados obtenidos en animales de experimentación se requeriría en humanos un consumo diario de bebidas de té verde equivalente a 20 g o más de té seco a 4 tazas al día de infusión, para mostrar los mismos efectos (1).
Acción del té sobre la absorción de colesterol y concentración de los lípidos y lipoproteínas plasmáticas
Diversos estudios en animales de experimentación han puesto de manifiesto que las catequinas disminuyen la absorción de colesterol y los niveles plasmáticos de este colesterol (53-59), obteniendo resultados similares en humanos (60,61). La disminución del colesterol en plasma se debe fundamentalmente al efecto de la EGCG del té (57,59,62). Para la absorción del colesterol en el yeyuno proximal es necesario, en primer lugar, que se produzca su emulsificación de los lípidos en el estómago, la hidrólisis posterior en el intestino delgado de los ésteres de colesterol por la colesterol esterasa pancreática y la posterior solubilización en micelas. Una vez en las células intestinales, el colesterol se reesterifica y se transporta a la linfa por los quilomicrones (63). De esta manera, las moléculas que influyen en la absorción de colesterol podrían actuar bien interfiriendo en la afinidad de las micelas por los enterocitos o en la afinidad del colesterol por las micelas. Estas alteraciones afectarían al metabolismo hepático del colesterol y podrían afectar a la síntesis y catabolismo de lipoproteínas (59). Estos efectos se han comprobado en estudios realizados in vitro y en animales de experimentación. Así, se ha observado que las catequinas del té verde disminuyen la absorción intestinal del colesterol al disminuir su solubilidad en las micelas (56). En concreto, al añadir EGCG aislada en concentraciones crecientes desde 109 µM hasta 436 µM a una mezcla de micelas, la concentración de colesterol en las mismas disminuía un 65% (59). Además en ese estudio también se encontró que la EGCG inducía un aumento del tamaño de las micelas (59), hecho que afecta a su afinidad por la membrana de los enterocitos y a la solubilidad del colesterol en las mismas (64).
Otros han encontrado que la incorporación de las catequinas a las bicapas de fosfolípidos disminuyen la fluidez de las mismas afectando a su estructura, siendo esta acción realizada de forma más eficaz por las catequinas esterificadas con galato que por las catequinas no sustituidas (65,66). Este hecho produce una disminución de la captación del colesterol por los enterocitos, lo que explicaría la disminución del colesterol plasmático observada en animales de experimentación. En concreto, al añadir un 1% de EGCG a la dieta de ratas, el colesterol plasmático de estos animales disminuye significativamente sin que la concentración del colesterol transportado por las lipoproteínas de alta densidad (HDL-colesterol) se vea afectada (59). Sin embargo, al administrar una dosis del 2,5% de polifenoles (constituída por una mezcla de catequinas), a ratas alimentadas con una dieta rica en colesterol, se producía un aumento del HDL-colesterol más que un descenso del colesterol total (67).
En estos estudios en los que se administraba una dieta rica en colesterol a animales de experimentación se observó además de una disminución en sus niveles séricos que las catequinas actuaban disminuyendo la absorción intestinal del mismo (53,56,68), lo que producía un aumento en heces de lípidos totales y colesterol (53) y de ácidos grasos y esteroles neutros y ácidos (68). Otros en ratas ovaridectomizadas encontraron que una dosis de 20 g de hojas de té disminuía la absorción linfática de colesterol y alteraba la absorción de ácidos grasos (58).
Con respecto a la actividad de algunos enzimas, estudios in vitro muestran que tanto la lipasa gástrica como la lipasa pancreática son drásticamente inhibidas por el té verde (69), mientras que las actividades de la 3-hidroximetilglutaril-CoA reductasa, ácido graso sintasa y colesterol 7α-hidroxilasa no se encuentran afectadas. Esto sugiere que el efecto de las catequinas se debe, tal y como se describe en los estudios ya comentados, a la disminuciσn de la absorciσn intestinal del colesterol (57,70).
Los resultados obtenidos en animales de experimentación sugieren la posibilidad de su extrapolación al ser humano, en particular en lo referente al EGCG (59). La mayoría de las investigaciones llevadas a cabo se han realizado en japoneses en los que el consumo de té es una práctica muy habitual (61). Se encontró una relación inversa entre el consumo de té y los niveles de colesterol total en suero (61,71-73), y, sólo en alguno de ellos, una disminución de los triglicéridos y un aumento de la concentración de HDL-colesterol (72,73), así como un bajo cociente de riesgo LDL-colesterol/HDL-colesterol (72). En estudios realizados hace años (71-73) sólo se incluyeron varones pero cuando más recientemente se introdujeron mujeres en la muestra, no se encontró ningún efecto del té sobre los niveles lipídicos sanguíneos (60). Estos resultados podían deberse en principio al reducido número de individuos estudiados, ya que posteriormente, en una muestra mayor en la que se incluían tanto a hombres como mujeres, sí se obtuvieron resultados positivos del consumo de té sobre los niveles de lipoproteínas (61).
En la mayoría de los estudios realizados se ha observado un efecto positivo sobre los niveles de colesterol en suero (Tablas 3 y 4), estando la disminución del 1% de este lípido asociada con una reducción del 2 al 3% en el riesgo de padecer enfermedades cardiovasculares en países occidentales (74) y del 5% en países orientales (75). Sin embargo, es necesario realizar más estudios para confirmar el efecto beneficioso del té verde sobre los niveles lipídicos sanguíneos (61), y en particular sobre aspectos más específicos tales como concentración de Lp(a), tamaño y composición de LDL y HDL, etc.
Efectos del consumo de té verde sobre los lípidos sanguíneos en humanos
| Investigador | Fecha del estudio | Muestra | Consumo de té | Resultados obtenidos |
| Kono et al, (71) | Desde1986 hasta 1988 | 1306 varones | 0-2 tazas/día = 9 tazas/día | Disminución del CT 8 mg/dL (= 9 tazas/ día) |
| Imai (72) | Desde1986 hasta 1990 | 1371 varones | = 3 tazas/día 4 -9 tazas/día =10 tazas/día | Ver resultados detallados en Tabla 4 |
| Kono et al (73) | Desde1991 hasta 1992 | 2062 varones | < 9 tazas/día = 9 tazas/día | Disminución del CT y LDL 6,2 mg/dL en ambos casos (= 9 tazas/ día) |
| Tsubono y Tsugane (60) | Desde 1989 hasta 1991 | 207 varones y 164 mujeres | <1 taza/día 1-4 tazas/día =5 tazas /día | Ningún efecto sobre el nivel de lípidos |
| Tokunaga et al (61) | Desde1995 Hasta 1996 | 8476 varones 5440 mujeres | =10 tazas/día >10 tazas/día | Disminución del CT (0,6 mg/dL con 1 taza/día y 4,16 mg/dL con >10 tazas/día). |
CT: colesterol total, LDL: lipoproteínas de baja densidad.
Modificaciones de los lípidos y lipoproteínas plasmáticas por el consumo de té
|
| < 3 tazas/día | 4-9 tazas/día | > 10tazas/día |
| Colesterol (mmol/L) | 4,85±0,05*** | 4,76±0,03 | 4,58±0,05*** |
| Triglicéridos (mmol/L) | 1,65±0,06* | 1,60±0,05 | 1,45±0,07* |
| LDL + VLDL (% del total de lipoproteínas)1 | 62,5±0,3 | 62,6±0,3 | 61,7±0,2 |
| HDL (% del total de lipoproteínas )1 | 36,4±0,3* | 36,4±0,3 | 37,4±0,4* |
1
Determinados por electroforesis en gel de agarosa***p<0,001 *p<0,05.
Adaptado de Imai (72)
Efecto antioxidante de los polifenoles (catequinas) del té verde frente a la peroxidación de LDL
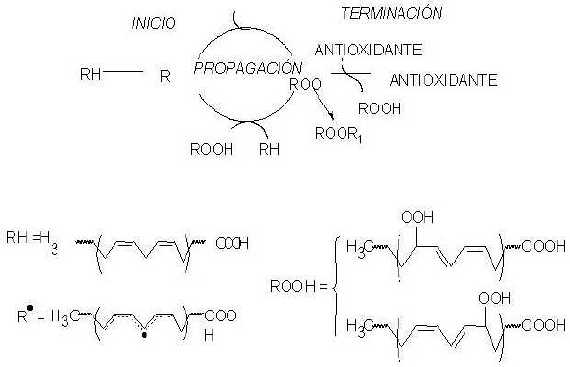
Los polifenoles presentan una fuerte actividad antioxidante en muchos sistemas lipídicos y en particular contra la oxidación de las LDL, aspecto de importancia crucial en el desarrollo de la lesión aterosclerótica (76-79). En las LDL se produce una modificación peroxidativa de sus ácidos grasos poliinsaturados (AGP) por la acción de los radicales libres (80). En este proceso intervienen iones metálicos y mecanismos oxidativos existentes en las células endoteliales, músculo liso y macrófagos (81). Se han propuesto como candidatos del origen de la oxidación de los AGP a las enzimas NADPH oxidasa, mieloperoxidasa, citocromo P450, la cadena de transporte electrónico mitocondrial, xantina oxidasa, ceruloplasmina y lipooxigenasa (82). Cuando los niveles de colesterol sérico están elevados se producen radicales superóxido en grandes cantidades (O2- ) que inactivan el NO y promueven la formación de otros radicales de oxígeno como el peroxinitrito y el radical hidroxilo (83) (Figura 2).
FIGURA 2
Esquema de la oxidación de los ácidos grasos poliinsaturados de las lipoproteínas de baja densidad
RH.- Ácido graso insaturado R.- Radical libre
ROO.- Radical peróxido ROOH.- Hidroperóxido
Adaptado de Sánchez-Muniz y Sánchez-Montero (87)
Las sustancias conteniendo radicales libres son neutralizadas por los antioxidantes endógenos (K-tocoferol, 2-carotenos, ubiquinol y otros) de las lipoproteínas. En estas condiciones las LDL comienzan a oxidarse, denominándose a este periodo "fase de latencia". Cuando se agotan los antioxidantes, los AGP son atacados por radicales libres y se forman compuestos con dobles enlaces conjugados. A continuación, se producen peróxidos lipídicos y se propagan los radicales libres destruyendo nuevas moléculas de AGP (84) (Figuras 2 y 3).
FIGURA 3
Modificación oxidativa de las lipoproteínas de baja densidad (LDL). Se esquematizan los cambios cualitativos más importantes
Los hidroperóxidos lipídicos pueden fragmentarse a aldehídos, como el malondialdehído o el 4-hidroxinonenal que, al unirse a grupos ε-aminos de la apolipoproteνna (Apo) B-100, proporcionan carga neta negativa a la LDL y aumenta su reconocimiento por los receptores barrenderos (scavenger) (85,86) (Figura 3). Además la Apo B-100 puede fragmentarse por oxidaciones no enzimáticas y algunos de los fragmentos formados pueden ser transferidos desde las LDL nativas a la LDL oxidadas, lo que produce un aumento de la carga negativa de estas partículas (88,89) (Figura 3).
Numerosas investigaciones han demostrado los efectos antioxidantes y la capacidad para neutralizar radicales libres de las catequinas (90-96). Para llevar a cabo esta última acción es fundamental la presencia de 3 grupos hidroxilos en el anillo B y del grupo galato en la posición 3 de la catequina (91,92,94).
La capacidad antioxidante del té ha sido evaluada in vitro (2,97,98) e in vivo tras la ingesta de té (2,3,97,99,100). Los estudios realizados in vitro han puesto de manifiesto la capacidad de los flavonoides para inhibir de forma dosis-dependiente la oxidación inducida por Cu2+ de las LDL aisladas del plasma (97,99,101-105). Para explicar este hecho se han propuesto diferentes mecanismos en los que intervienen las catequinas tales como (i) la quelación del Cu2+ y de otros metales iónicos, (ii) el efecto directo como antioxidante interrumpiendo la reacción de radicales libres en cadena, (iii) la aceleración del reciclaje del radical tocoferilo a tocoferol de la LDL (97,106), (iv) la inhibición de la enzima lipooxigenasa de las células endoteliales (107) y (v) la prevención de la fragmentación de la Apo B de las LDL (89,108). Para observar el efecto antioxidante de las catequinas en plasma, y no de las LDL aisladas, se necesita una menor concentración de las mismas, lo que indica que su acción antioxidante también se debe a su capacidad de donar hidrógeno (109). Este efecto antioxidante es mayor en la ECG, seguida de EGCG, EC y EGC (108,110). Además, en plasma también se ha observado un retraso de la utilización de antioxidantes endógenos liposolubles (α-tocoferol y b -caroteno), previniendo su depleción y disminuyendo la peroxidación lipídica gracias a su capacidad de atrapar a los radicales libres que inician la oxidación (91,94,106,107,111). Se ha observado también un potente efecto dosis-dependiente sobre la prolongación del tiempo de iniciación de la oxidación o fase de latencia (99,110) y una disminución de la susceptibilidad de las LDL a la oxidación mediada por macrófagos, presentando la mayor actividad la EGCG a una dosis de 400 µmol/L (99). Paradójicamente, se ha puesto de manifiesto el poder pro-oxidante de las catequinas cuando están en presencia de cobre al producirse un aumento de la división del DNA y una mayor peroxidación de AGP (112).
Los estudios anteriormente descritos se han centrado en los efectos antioxidantes de las catequinas del té verde. Sin embargo, es de interés comentar que también presentan actividad antioxidante los polímeros formados a partir de la oxidación de las catequizas, los cuales son excelentes antioxidantes en todos los sistemas lipídicos y no lipídicos, en sistemas enzimáticos y no enzimáticos, y además, no tienen actividad prooxidante (101). El mecanismo propuesto para esta capacidad antioxidante incluye el reconocimiento y quelación de radicales libres, la quelación de iones metálicos, la activación de enzimas antioxidantes y la inactivación de enzimas oxidantes (101).
En los estudios in vivo en los que se aislaron las lipoproteínas del suero (3,97,99,100) se observó que la incorporación de polifenoles a dichas lipoproteínas era muy pequeña y que además no se encontraba ningún efecto del té sobre la oxidación de las LDL (3,14,20). Sin embargo, al cultivar las LDL aisladas con células endoteliales en presencia de un extracto de té verde de diferentes concentraciones (1μg/ml, 5μg/ml y 10μg/ml) sν se observσ una inhibiciσn de la oxidación de las LDL inducida por dichas células. En concreto, la oxidación estaba totalmente inhibida al usar la concentración más elevada del extracto de té (57). También se observaron los efectos antioxidantes del té frente a la oxidación de las lipoproteínas en suero y no en un tampón, ya que en el suero las condiciones son más similares a las de la zona subendotelial arterial, que es donde se produce la formación de lipoproteínas mínimamente oxidadas (113). Solamente se encontró que la actividad antioxidante del suero aumentaba de forma significativa en algunos de ellos (2,3,67), y de forma no significativa en otros (14). Además, en un estudio hecho en ratas con enfermedad osteogénica, y por lo tanto con deficiencia de vitamina C, se midió la capacidad del té verde para modificar la oxidación de LDL y se encontró que el ácido ascórbico plasmático y el té verde prolongaban la fase de latencia un 25% y disminuían la susceptibilidad de las LDL a la oxidación por efecto sinérgico con agentes lipofílicos (vitamina E) (114). Por otro lado, en conejos hipercolesterolémicos se observó que el té verde aumentaba los niveles de vitamina E plasmáticos un 63% y disminuía el coeficiente máximo de oxidación de las LDL desde 13,4 ± 0,4 nmol/minuto a 11,2 ± 0,6 nmol/minuto en 13 semanas (13).
Aunque las evaluaciones de la oxidabilidad de las lipoproteínas in vitro pueden proveer una guía útil para valorar el potencial antioxidante del té, los efectos en humanos son muy limitados (98) (Tabla 5).
Efectos del consumo de té verde en la capacidad antioxidante del plasma
| Investigador | Lugar | Muestra | Consumo de té | Resultados obtenidos |
| Serafini et al (2) | Italia | 10 individuos sanos | 300 ml | Aumenta la capacidad antioxidante del plasma (DTRAP1= 158µmol/L) |
| Van het Hof et al (3) | Holanda | 45 individuos sanos | 900 ml | Sin efecto |
| Ishikawa et al (99) | Japón | 14 individuos sanos | 750 ml | Prolongación del "lag time" 8 minutos |
| Hodgson et al (98) | Australia | 20 individuos sanos | 1000 ml | Prolongación del "lag time" 4 minutos |
| Hodgson et al (14) | Australia | 13 individuos hipertensos e hipercolesterolémicos | 1000 ml | Sin efecto |
1
DTRAP: Variación del potencial antioxidante total del plasmaEn resumen, se puede afirmar que el mecanismo de acción de los antioxidantes del té verde en el organismo cursa con su acumulación en la pared arterial y con la disminución de la oxidación de las LDL (al aumentar el estado antioxidante de las células, mediante la quelación de iones metálicos o inhibición de la actividad de enzimas oxidantes) (13). Independientemente del mecanismo de acción, la mayoría de los estudios realizados sugieren que el consumo diario de té verde convierte a las LDL en más resistente a la oxidación, lo que conduce a una disminución del riesgo de sufrir enfermedades cardiovasculares (115).
Acción del té sobre la adhesión de monocitos al endotelio vascular
Una fase fundamental en el desarrollo de la ateroesclerosis lo constituye la adhesión de monocitos a la pared endotelial y su posterior infiltración y diferenciación a macrófagos (35). Para que los monocitos se adhieran a la pared endotelial es fundamental la presencia de sustancias tales como la molécula de adhesión a células vasculares (1VCAM-1) que es la que tiene una mayor importancia en la iniciación de la ateroesclerosis (116), la molécula de adhesión intercelular (1ICAM-1) y la molécula de adhesión de leucocitos al endotelio-E (E-selectina) (117); siendo necesario para la expresión de la molécula VCAM-1 la presencia del factor de transcripción NF-8B (118,119).
En células endoteliales de cordón umbilical humano (HUVECs), en las que se inducía la expresión de las moléculas de adhesión anteriormente citadas y posteriormente se cultivaban con concentraciones de catequinas entre 10 y 100 μM, se vio que ϊnicamente se inhibνa de forma dosis-dependiente la expresiσn de VCAM-1. Dicha inhibición se producía a nivel del RNAm y no afectaba a la activación del factor NF-8B. Por otra parte la catequina más eficaz resultó ser la EGCG, seguida de la ECG, mientras que ni la EC ni la EGC mostraron efecto significativo (120). Esto indica que sólo las catequinas que presentan el grupo galato reducen la expresión de las moléculas de adhesión (121).
Acción del té sobre la agregación plaquetaria
Las plaquetas presentan un importante papel tanto como en el mantenimiento de la hemostasia como en la formación de trombos, ya que para esto es necesario la activación y la agregación de las plaquetas (122). Por esta razón, la inhibición de la función plaquetaria representa un camino prometedor para la prevención de las trombosis (4).
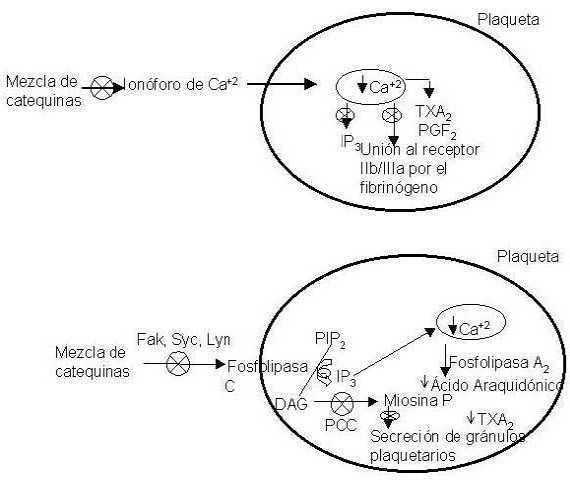
Un mecanismo fundamental para que se produzca la agregación plaquetaria es el incremento de calcio en el interior de la plaqueta. El ionóforo de calcio A23187 aumenta el flujo de calcio desde el exterior hasta el interior de la plaqueta consiguiendo aumentar la concentración de calcio intracelular. Este aumento conduce a la formación de diferentes endoperóxidos y a la fosforilación de diversas proteínas que son necesarias para que se produzca la agregación (123). Dicho ionóforo es inhibido por la GTC y la EGCG del té verde y su inhibición conduce a una disminución del Ca2+ en el interior de la plaqueta (4). Esta disminución trae como consecuencias una inhibición de la formación del inositol trifosfato (IP3), una inhibición de la unión del fibrinógeno a su receptor plaquetario IIb/IIIa (124) y posiblemente un descenso del tromboxano A2 (TXA2) y de la prostaglandina F2α (PGF2α) (4), impidiendo todo ello la agregación plaquetaria (4,124) (Figura 4a).
FIGURA 4
Posibles mecanismos de acción del las catequinas sobre la agregación plaquetaria
IP2 : Fosfoditil inositol difosfato
IP3 : Inositol trifosfato
DAG: Diacilglicerol
PCC: Proteinquinasa C

Vía de proceso inhibida
a. Esquema realizado a partir de los datos y conclusiones de Kang et al (4,124)
b. Esquema realizado a partir de los datos y conclusiones de Lill et al (17) y Deana et al (128)
Otro mecanismo proagregante consiste en la fosforilación inducida por la trombina de residuos de tiroxina de proteínas quinasas de las plaquetas (125). La activación de las proteínas quinasas FAK, Syk y Lyn conduce a la fosforilación de proteínas que son necesarias para la activación de la fosfolipasa C, que regula el aumento de calcio intracelular y la activación de la proteín quinasa C, que es necesaria a su vez para la expresión del receptor IIb/IIIa del fibrinógeno (126,127). Diferentes estudios han encontrado una inhibición de la activación de las proteínas quinasas FAK (17), Syk y Lyn (128) por la EGCG del té, lo que conduce a un efecto antiagregante de las plaquetas (17). (Figura 4b). Sin embargo otros han observado una activación de la proteína quinasa Syk, lo que produce el efecto contrario sobre las plaquetas (17).
En estudios in vivo las catequinas del té verde tienen actividad antitrombótica de manera dosis dependiente similar a la aspirina, siendo su porcentaje de protección del 40, 65, 85% a dosis de 10, 50 y 100 mg/kg respectivamente; siendo en el caso concreto de la EGCG del 45,5 y 69,1% a una dosis de 10 y 50g/kg respectivamente. De igual manera, se ha demostrado una prolongación en el tiempo de coagulación similar al de este fármaco (4). También es de interés señalar que las tres catequinas (EGCG, (+)-galato de catequina (CG), ECG) que contienen el grupo galato en la posición tres inhiben de manera importante la agregación plaquetaria; mientras que las catequinas sin este grupo (C, EC) o las catequinas con el grupo galato en posición dos, no tienen este efecto sobre las plaquetas (17).
Efectos sobre la presión arterial
No existe prácticamente información bibliográfica contrastada de los efectos de las catequinas sobre la presión arterial. En este sentido, se ha comprobado en un estudio realizado en 218 mujeres de edad avanzada (>70 años) que por cada taza de té consumida, se producía un descenso de 2,2 mmHg en la presión arterial sistólica y 0,9 mmHg en la diastólica, lo que indica que una ingesta regular y a largo plazo de té tendría efectos favorables sobre la tensión arterial (129).
Efectos del té verde y polimorfismo genético
La aplicación de la genética ha supuesto avances muy importantes a la hora de identificar y valorar la calidad de diferentes variedades de té (130). Además la respuesta a las catequinas del té es diferente en unos individuos de otros, sugiriendo que debe hablarse de individuos hipo e hiperrespondedores. Este aspecto ya ha sido comentado para el colesterol y la grasa dietética (131), y tiene su origen, muy posiblemente, en la existencia de polimorfismos genéticos (132). Al igual que ocurre con la ingesta de café y en particular de sus dos diterpenos (Cafestol y Kahweol) (133), la relación dosis-respuesta del té podría estar a su vez condicionada por variantes genéticas (I) de la Apo AIV y la proteína ligante intestinal de ácidos grasos (IFABP) que modulan la absorción de grasa y colesterol, (II) de la actividad del enzima acil-CoA-colesterol-acil-transferasa (ACAT) o (III) de mecanismos relacionados con el transporte retrógrado de colesterol debido a mutaciones en los genes que codifican entre otras a la proteína transferidora de ésteres de colesterol (CETP) y la transferasa de grupos acilos desde la lecitina al colesterol (LCAT), etc.
Muy recientemente se ha propuesto que la EGCG modifica la expresión génica mediada por H2O2, que a su vez modula la concentración de multitud de proteínas (134). También se ha señalado que los polifenoles del té ejercen unos efectos inhibitorios del desarrollo de la lesión ateroesclerótica a través de inhibir genes codificantes para PPAR-gamma, CD36, LXR-alpha, C-myc y estimular genes codificantes para LDL-R y PPAR-alpha a nivel transcripcional (135).
Futuras investigaciones
A la vista de los estudios revisados, creemos que es necesaria la realización de más investigaciones bien controladas sobre el té verde y/o sus flavonoides usando marcadores de enfermedad cardiovascular tales como la disfunción endotelial o el grado de progresión y/o regresión de la placa ateromatosa, tanto en hombres como en mujeres (136,137). Además es necesario determinar cuál de estos polifenoles, solos o en combinación, son necesarios para reducir la formación de la estría grasa en modelos animales (138).
Con respecto al papel del té sobre el control de peso corporal, es necesario usar los componentes purificados para identificar los componentes activos que le confieren al té dicha propiedad; así como, elucidar los efectos de la EGCG a largo plazo sobre el balance energético y la utilización de sustratos termogénicos en modelos animales y humanos (43). Los ensayos deben programarse a largo plazo y por tanto con ingestas crónicas.
El té verde muestra gran variedad de acciones sobre las plaquetas humanas. Muchos mecanismos pueden contribuir a los efectos beneficiosos de las catequinas en la aterosclerosis, como por ejemplo la inhibición de la función plaquetaria por parte de estas catequinas. Al haberse encontrado un efecto activador de la EGCG sobre la fosforilación de residuos de tiroxina de proteínas quinasas que produce un aumento de la agregación plaquetaria, hace que sea necesaria la realización de más estudios sobre el té verde o las catequinas aisladas antes de recomendar definitivamente su empleo en la prevención o en el tratamiento de la ateroesclerosis (17).
También se deben realizar más estudios sobre interacción con alimentos, biodisponibilidad, concentración alcanzada en los diferentes tejidos y capacidad antioxidante in vivo de las catequinas del té verde y sus metabolitos (111), así como estudios para establecer su actividad antioxidante sobre el colesterol en animales de experimentación. También deben investigarse estos efectos en las formas de catequinas sintéticas conjugadas, porque la actividad secuestrante de radicales libres de estas sustancias es diferentes dependiendo de la posición sustituida en la molécula (91,101).
En cuanto a los oxipolímeros derivados de las catequinas del té verde, se debe estudiar su estructura de forma más precisa y la relación de ésta con el mecanismo antioxidante de los mismos (139) y los riesgos potenciales del consumo de té conteniendo catequinas oxidadas.
Además es importante tener en cuenta los efectos adversos potenciales derivados del uso del té verde o de sus catequinas. Por ejemplo, los efectos sobre el sistema endocrino y sus consecuencias en mujeres embarazadas y niños (1). En este sentido, investigaciones recientes han demostrado que inyecciones intraperitoneales de EGCG producen cambios significativos en varios parámetros endocrinos. Después de haber realizado una administración de este tipo a ratas durante siete días, los niveles de testosterona disminuyeron aproximadamente un 75% en machos y los de 17 2-estradiol un 34% en hembras. Además, en los machos, el peso de los órganos sensibles a andrógenos se redujo 50-70% y en las hembras el peso de los órganos sensibles a estrógenos, aproximadamente un 50%. Por tanto, las variaciones en el peso de los órganos sexuales son catequino-dependientes, mostrando la EGCG el mayor efecto y además dichas variaciones revierten al administrar hormonas sexuales de forma exógena (51).
En cuanto a la presión arterial, que es un factor de riesgo de enfermedad cardiovascular bien establecido (36) y en cuyo desarrollo el estrés oxidativo parece jugar un papel muy importante (140), se deben realizar más estudios sobre el consumo a largo plazo de té verde ya que éste, rico en sustancias antioxidantes, podría disminuir el daño oxidativo que eleva la presión arterial (141).
Por último, la búsqueda de genes candidatos que expliquen la variabilidad de respuesta interindividual al consumo de té es un tema científico de indiscutible futuro e importancia.
CONCLUSION
Los estudios revisados sugieren que un consumo superior a 7 tazas de té verde al día (3,5 g de catequinas diarias) sería una buena elección para la prevención de enfermedades cardiovasculares, siempre que su consumo se realice en el marco de un ambiente correcto donde dieta y ejercicio sean equilibrados y correctos.
Estos resultados apoyan lo expuesto hace ya muchas centurias por el monje Esai: "El té es una medicina milagrosa para mantener la salud. El té tiene un extraordinario poder para prolongar la vida. En cualquier lugar donde una persona cultive té, le seguirá una larga vida" (8).
AGRADECIMIENTOS
Este trabajo ha sido subvencionado por el Proyecto del Plan Nacional de Investigación Científica, Desarrollo e Innovación Tecnológica referencia AGL 2001-2398-C03-03. Agradecemos al curso de Doctorado en Farmacia de la Universidad Complutense de Madrid "Nutrición y Enfermedades Cardiovasculares" por su contribución en este artículo.
REFERENCIAS
1.Liao S. The medical action of androgens and green tea epigallocatechin gallate. HKMJ 2001;7: 369-374. [ Links ]
2. Serafini M, Ghiselli A, Ferro-Luzzi A. In vivo antioxidant effect of green and green tea in man. Eur J Clin Nutr 1996;50: 28-32. [ Links ]
3. Van het Hof KH, der Boer HS, Wiseman SA, Lien N, Westrate JA, Tijburg LB. Consumption of green or black tea does not increase resistance of low-density lipoprotein to oxidative modification. Am J Clin Nutr 1997;66: 261-266. [ Links ]
4. Kang WS, Lim IH , Yuk DY. Antithrombotic activities of green tea catechins and (-)-epigallocatechin gallate. Thromb Res 1999;96: 229-237. [ Links ]
5. Valcic S, Burr J, Timmermann B , Liebler D. Antioxidant chemistry of green tea catechins. New oxidation products of (-)-epigallocatechin from their reactions with peroxyl radicals. Chem Res Toxicol 2000;13:801-810. [ Links ]
6. Leung LK, Su Y, Chen R, Zhang Z, Huang Y, Chen ZY. Theaflavins in black tea and catechins in green tea are equally effective antioxidants. J Nutr 2001; 131: 2248-2251. [ Links ]
7. Fundación Erosky, 2001. Consultado en www.consumer.es en Mayo, 2004. [ Links ]
8. Oguni I Haray. Green tea has many medicinal activities for preventing disease such as cancer, cardio-vascular diseases and diabetes. Japan: Chunichi-shinbun Nagoya, 1990. [ Links ]
9. Graham NH. Green tea composition, consumption, and polyphenol chemistry. Prev Med 1992;21: 334-350. [ Links ]
10. Devesa JA. Plantas con semillas. In: Izco J, Barreno E, Burgués M, Costa M, Devesa J, Fernández J, Gallardo T, Llinona X, Salvo E, Talaberas S, Valdes B. Botánica. McGraw-Hill: Madrid; 1997: 379-581. [ Links ]
11. Innatia. Consultado en: www.innatia.com/te/te_verde.php Mayo, 2004. [ Links ]
12. Salazarp L. Consultado en: www.nutriinfo.com.ar/pagina/info/téverde.htlm. Mayo, 2004. [ Links ]
13. Tijburg L, Wiseman S, Meijer G, Weststrate J. Effects of green tea, black tea and dietary lipophylic antioxidants on LDL oxidizability and atherosclerosis in hypercholesterolaemic rabbits. Atherosclerosis 1997;135: 37-47. [ Links ]
14. Hodgson JM, Puddey IB, Croft KD, Burke V, Mori VB, Cacceta R, Beilin L. Acute effects of ingestion of black and green tea on lipoprotein oxidation. Am J Clin Nutr 2000;71: 1103-1107. [ Links ]
15. Yamamoto T, Juneja LR, Chu DC, Kim M, editors. Chemistry and applications of green tea. New York: CRC Press, 1997. [ Links ]
16. Liang Y, Ma W, Lu J, Wu Y. Comparison of chemical compositions of Ilex latifolia Thumb and Camellia sinensis L. Food Chemistry 2001;75: 339-343. [ Links ]
17. Lill G, Voit S, Schrör K , Weber AA. Complex effects of different green tea catechins on human platelets. FEBS Letters 2003;546: 265-270. [ Links ]
18. Astill C, Birch MR, Dacombe C, Humphrey PG, Martin PT. Factors affecting the caffeine and polyphenol contents of black and green tea infusions. J Agric Food Chem 2001;49: 5340-5347. [ Links ]
19. Wang H. Determination of flavonols in green and black tea leaves and green tea infusions by high performance liquid chromatography. Food Research Int 2001;34: 223-227. [ Links ]
20. Bhagwat S, Beecher GR, Haytowitz DB, Holden JM, Dwyer J, Peterson J, Gebhardt SE, Elridge AL, Agarwal S, Balentine DA. Flavonoid composition of tea: Comparison of black and green teas. Agricultural Research Service, 2003. En: http://www.nal.usda.gov/fnic/foodcomp/Data/Other/IFT2003_TeaFlav.pdf [ Links ]
21. Chen ZY, Zhu QY, Tsang D, Huang Y. Degradation of green tea catechins in tea drinks. J Agric Food Chem 2001;49: 477-482. [ Links ]
22. Lin YL, Juan IM, Chen YL, Liang YC, Lin JK. Composition of polyphenols in fresh tea leaves and association of their oxygen radical-absorbing capacity with antiproliferative actions in fibroblast cell. J Agric Food Chem 1996;44: 1387-1394. [ Links ]
23. Lin YS, Tsai YJ, Tsay JS, Lin JK. Factors affecting the levels of tea polyphenols and caffeine in tea leaves. J Agric Chem 2003;51: 1864-1873. [ Links ]
24. Stagg GV , Millin DJ. The nutritional and therapeutic value of tea-a review. J Sci Food Agric 1975;26: 1439-1459. [ Links ]
25. Yang CS, Landau JM. Effects of tea consumption nutrition health. J Nutr 2000;130: 2409-2412. [ Links ]
26. Mukhtar H, Ahmad N. Tea polyphenols: Prevention of cancer and optimizing health. Am J Clin Nutr 2000;71: 1698S-1704S. [ Links ]
27. He YH, Kies C. Green and black tea consumption by humans: impact on polyphenol concentrations in feces, blood and urine. Plant Foods Hum Nutr 1994;46: 221-229. [ Links ]
28. Yang CS, Chen L, Lee MJ, Balentine D, Kuo MC, Schantz SP. Blood and urine levels of tea catechins after ingestion of different amounts of green tea by human volunteers. Cancer Epid Bio Prev 1998;7: 351-354. [ Links ]
29. Yang CS, Lee MJ, Chen L. Human salivary tea catechin levels and catechin esterase activities: implications in human cancer prevention studies. Cancer Epidemiol Biomarkers Prev 1999;8: 83-89. [ Links ]
30. Van het Hof KH, Kivits GAA, Westrate JA, Tijburg LBM. Bioavaility of catechins from tea: the effect of milk. Eur J Clin Nutr 1998;52: 356-359. [ Links ]
31. Hollman PCH, Gaag M, Mengelers MJB, Trijp JMP, Vries JHM, Katan MB. Absorption and disposition kinetics of the dietary antioxidant quercetin in man. Free Rad Biol Med 1996;21: 703-707. [ Links ]
32. Brown PJ , Wright WB. An investigation of the interactions between milk proteins and tea poliphenols. J Chromatog 1963;11: 5504-514. [ Links ]
33. Fingl E, Woodbury DM. General principles. In: Goodman LS, Gilman A, editors. The pharmacological basis of therapeutics. New York: Macmillan, 1970:24-25. [ Links ]
34. Bastida S, Sánchez-Muniz FJ. Nutrición y obesidad. Rev Nutr Practica, 1999, 3: 49-58. [ Links ]
35. Sánchez-Muniz FJ, Varela Gallego P, Bastida Codina S, González Lorenzo JM Enfermedad cardiovascular. Hipertensión arterial. Dislipemia. En Cuidados farmacológicos y nutricionales en el paciente de edad avanzada. Carbajal A y Varela P, editors. Tema 2. Fundación General de la Universidad Complutense 2001: 1-47. [ Links ]
36. Bastida S, Sánchez-Muniz FJ. Fitoterapia en el control del exceso de peso. En Plantas medicinales en su farmacia. Formación sobre plantas medicinales por el farmacéutico. Edufarm y Consejo General de Colegios Oficiales de Farmacéuticos, 2000: 37-46. [ Links ]
37. Dulloo A, Duret D, Rohrer D, Girardier L, Mensi N, Fathi M, Chantre P, Vandermander J. Efficacy of a green tea extract rich in catechin polyphenols and caffeine in increasing 24-h energy expenditure and fat oxidation in humans. Am J Nutr 1999;70: 1040-1045. [ Links ]
38. Bretón I. ¿Por qué nos hacemos obesos? Rev Nutr Practica 2004;6: 9-13. [ Links ]
39. Dulloo AG. Strategies to counteract readjustments towards lower metabolic rates during obesity management. Nutrition 1993;9: 366-372. [ Links ]
40. Landsberg L, Young JB. Sympathoadrenal activity and obesity: physiological rationale for the use of adrenergic thermogenic drugs. Int Obes Relat Metab Disord 1993;65: S29-S34. [ Links ]
41. Arch JRS, Wilson JB. Prospects for β3-adrenoceptor agonists in the treatment of obesity and diabetes. Int J Obes Relat Metab Disord 1996;20: 191-199. [ Links ]
42. Liao S, Liang T. Methods and compositions for inhibiting 5α-reductase activity. US patent 5, 605, 909,1997. [ Links ]
43. Kao YH, Hiipakka RA, Liao S. Modulation of obesity by a green tea catechin. Am J Clin Nutr 2000; 72: 1232-1234. [ Links ]
44. Borchardt RT, Huber JA. Catechol-o-methyltransferase: structure-activity relationship for inhibition by flavonoids. J Med Chem 1975;18: 120-122. [ Links ]
45. Palou A. Los genes de la obesidad. Formación Continuada en Nutrición y Obesidad 1998;6: 280-298. [ Links ]
46. Dulloo AG, Seydoux J, Girardier L. Potentiation of the thermogenic antiobesity effects of ephedrine by dietary methylxanthines: adenosine antagonism or phosphodiesterase inhibition? Metabolism. 1992;41:1 233-41. [ Links ]
47. Dullo A, Seydoux J, Girardier L, Chantre P, Vandermander J. Green tea and thermogenesis: interactions between catechin-polyphenols, caffeine and sympathetic activity. Int J Obes Relat Metab Disord 2000;24: 252-258. [ Links ]
48. Dulloo AG, Seydoux J, Girardier L. Tealine and thermogenesis: interactions between polyphenols, caffeine and sympathetic activity. Int J Obes Relat Metab Disord 1996;20: 71-79. [ Links ]
49. Lee MJ, Wang ZY, Li H, Chen L, Sun Y, Gobbo S, Balentine DA, Yang CS. Analysis of plasma and urinary tea polyphenols in human subjects. Cancer Epidemiol Biomarkers Prev 1995;44: 93-399. [ Links ]
50. Hollman PCH, Tijburg LBM, Yang CS. Bioavailability of flavonoids from tea. Crit Rev Food Science Nutr 1997;37: 719-738. [ Links ]
51. Kao YH, Hiipakka RA, Liao S. Modulation of endocrine systems and food intake by green tea epigallocatechin gallate. Endocrinology 2000a;141: 980-987. [ Links ]
52. Watanabe J, Kawabata J, Niki R. Isolation and identification of acetyl-CoA carboxylase inhibitors from green tea (Camellia sinensis). Biosci Biotechnol Biochem 1998;62: 532-534. [ Links ]
53. Muramatsu K, Fukuyo M, Hara Y. Effect of green tea catechins on plasma cholesterol level in cholesterol- fed rats. J Nutr Sci Vitaminol 1986;32: 613-622. [ Links ]
54. Matsuda H, Chisaka T, Kubomura Y, Yamahara J, Sawada T, Fujimura H, Kimura H. Effects of crude drugs on experimental hypercholesterolemia. Tea and its active principles. J Ethnopharmacol 1986;17: 213-224. [ Links ]
55. Ando T, Nishimura T, Matsubayashi A, Ejiri H, Inoue K, Nakayama Y, Uchiyama S, Kakuda T, Mukai I. Effects of tea catechins on cholesterol absorption with exogenously hypercholesterolemic rat (ExHC-Ta). Bull Kanagawa Dent Coll 1989;17: 21-23. [ Links ]
56. Ikeda I, Imasato Y, Sasaki E, Nakayama M, Nagao H, Takeo T, Yayabe F, Sugano M. Tea catechins decrease micellar solubility and intestinal absorption of cholesterol in rats. Biochim Biophys Acta 1992;1127: 141-146. [ Links ]
57. Yang TT, Koo MW. Chinese green tea lowers cholesterol level trough an increased in fecal lipid excretion. Life Sci 2000;66: 411-423. [ Links ]
58. Löest HB, Noh SK, Koo SI. Green tea extract inhibits the lymphatic absorption of cholesterol and a-tocopherol in ovaridectomized rats. Am Soc Nutr Sci 2002;132: 1282- 1288. [ Links ]
59. Raederstorff DG, Schlachter MF, Elste V, Weber P. Effect of EGCG on lipid absorption and plasma lipid levels in rats. J Nutr Biochem 2003;14: 326-332. [ Links ]
60. Tsubono Y, Tsugane S. Green tea intake in relation to serum lipid levels in middle-aged Japanese men and women. Ann Epidemiol 1997;7: 280-284. [ Links ]
61. Tokunaga S, White I, Frost C, Tanaka K, Kono S, Tokudome S, Akamatsu T, Moriyama T, Zakouji H. Green tea consumption and serum lipids and lipoproteins in a population of healthy workers in Japan. Ann Epidemiol 2002;12: 157-165. [ Links ]
62. Yang TT, Koo MW. Hypocholesterolemic effects of Chinese tea. Pharmacol Res 1997;35: 505-512. [ Links ]
63. Ros E. Intestinal absorption of triglyceride and cholesterol. Dietary and pharmacological inhibition to reduce cardiovascular risk. Atherosclerosis 2000;151: 357-379. [ Links ]
64. Caniparoli JP, Gains N, Zulauf M. Influence of stigmastanyl phosphorylcholine on the size, mass, and shape of taurocholate/ lecithin/ cholesterol mixed micelles. Prog Colloid Polym Sci 1992;89: 268-270. [ Links ]
65. Hashimoto T, Kumazawa S, Nanjo F, Hara Y, Nakayama T. Interaction of tea catechins with lipid bilayers investigated with liposome systems. Biosci Biotechnol Biochem 1999;63: 2252-2255. [ Links ]
66. Tsuchiya. Effects of green tea catechins on membrane fluidity. Pharmacology 1999;59: 34-44. [ Links ]
67. Yokozawa T, Nakawa T, Kitani K. Antioxidative activity of green tea polyphenol in cholesterol fed-rats. J Agric Food Chem 2002;50: 3549-3552. [ Links ]
68. Chang PT, Fong WP, Cheung YL, Huang Y, Ho WK, Chen ZY. Jasmine green tea epicatechins are hypolipedemic in hamsters (Misocricetus auratus) fed a high fat diet. J Nutr 1999;129: 1094-1101. [ Links ]
69. Juhel C, Armand M, Pafum Y, Rosier C, Vandermander J, Lairon D. Green tea extract (AR25) inhibits lipolysis of triglycerides in gastric and duodenal medium in vitro. J Nutr Biochem 2002;11: 45-51. [ Links ]
70. Chisaka T, Matsuda H, Kuboruma Y, Mochizuki M, Yamahara J, Fujimura H. The effect of crude drugs on experimental hypercolesterolemia: mode of action of (-)-epigallocatechin gallate in tea leaves. Chem Pharm Bull 1988;36: 227-233. [ Links ]
71. Kono S, Shinchi K, Ikeda N, Yanai F, Imanishi K. Green tea consumption and serum lipid profiles: a cross- sectional study in northen Kyushu, Japan. Prev Med 1992;21: 526-531. [ Links ]
72. Imai K. Cross sectional study of effects of drinking green tea on cardiovascular and liver diseases. BMJ 1995;310: 693-696. [ Links ]
73. Kono S, Shinchi K, Wakabayashi K, Honjo S, Todoroki I, Sakurai Y, Imanishi K, Nishikawa H, Ogawa S, Katsurada M. Relation of green tea consumption to serum lipids and lipoproteins in Japanese men. J Epidemiol 1996;6: 128-133. [ Links ]
74. Law MR, Wald NJ, Thompson SG. By how much and how quickly does reduction in serum cholesterol concentration lower risk of ischaemic heart disease? BMJ 1994;308: 367-372. [ Links ]
75. Chen Z, Peto R, Collins R, MacMahon S, Lu J, Li W. Serum cholesterol concentration and coronary disease in a population with low cholesterol concentrations. BMJ 1991;303: 276-282. [ Links ]
76. Steinberg DM, Parthasarathy S, Carew TE, Khoo C, Witztum J. Beyond cholesterol: modifications of low density lipoprotein that increase its atherogenecity. N Engl J Med 1989;320: 915-924. [ Links ]
77. Frankel EN, Kanner J, German JB, Parks E, Kinsella JE. Inhibition of oxidation of human low-density lipoprotein by phenolic substances in red wine. Lancet 1993;34: 454-457. [ Links ]
78. Chung KT, Wong TY, Huang YW, Lin Y. Tannis and human health: a review. Crit Rev Food Sci Nutr 1998;38: 421-464. [ Links ]
79. Kalkan Yildirim H, Delen Akcay Y, Guvenc U, Yildirim Sozmen E. Protection capacity against low-density lipoprotein oxidation and antioxidant potential of some organic and non-organic wines. Int J Food Sci Nutr 2004;55: 351-362. [ Links ]
80. Esterbauer H, Gebicki J, Puhl H, Jurgens G. The role of lipid peroxidation and antioxidants in the oxidative modification of LDL. Free Radic Biol Med 1992;13: 341-390. [ Links ]
81. Heinecke JW. Oxidants and antioxidants in the pathogenesis of atherosclerosis: implications for the oxidized low-density lipoprotein hypothesis. Atherosclerosis 1998;141: 1-15. [ Links ]
82. Young IS, McEneny J. Lipoprotein oxidation and atherosclerosis. Bio Soc Trans 2001;29: 358-362. [ Links ]
83. Ohara Y, Peterson TE, Harrison DG. Hypercholesterolemia increases endothelial superoxide anion production. J Clin Invest 1993;91: 2546-2551. [ Links ]
84. Ortega H, Carrero P, Martínez-Botas J, Gómez-Coronado D, Lasunción MA. Propiedades antioxidantes del vino y de los flavonoides. In: De Oya M, Garcés C, editors. Metabolismo lipídico: Sociedad y Colesterol. Madrid: IDEPSA, 1997:210-214. [ Links ]
85. Steinberg D. Low density lipoprotein oxidation and its pathobiological significance. J Biol Chem 1997;272: 20963-20966. [ Links ]
86. Devaraj S, Jialal I. Oxidized low density lipoprotein and atherosclerosis. Int J Lab Res 1996;26: 178-184. [ Links ]
87. Sánchez-Muniz FJ, Sánchez-Montero JM. Enzymatic methods for the study of thermally oxidized oils and fats. In: Boskou D, Elmadfa I, editors. Frying of food. USA: TechnomicPublishing Co, 1999: 105-141. [ Links ]
88. Yang M, Leake D, Rice-Evans A. Non-oxidative modification of native low-density lipoprotein by oxidized low-density lipoprotein. Biochem J 1996;316: 377-380. [ Links ]
89. Tanaka K, Iguchi H, Taketani S, Nakata R, Tokumaru S, Sugimoto T, Kojo S. Facile degradation of apolipoprotein B by radical reactions and the presence of cleaved proteins in serum. J Biochem 1999;125: 173-176. [ Links ]
90. Terao J, Piskula M, Yao Q. Protective effect of epicatechin, epicatechin gallate, and quercetin on lipid peroxidation in phospholipid bilayers. Arch Biochem Biophys 1994;308: 278-284. [ Links ]
91. Salah N, Miller NJ, Paganga G, Tijburg L, Bolwell GP, Rice C. Polyphenolic flavanols as scavengers of aqueous phase radicals and as chain-breaking antioxidants. Arch Biochem Biophys 1995;322: 339-346. [ Links ]
92. Nanjo F, Goto K, Seto R, Suzuki M, Sakai M, Hara Y. Scavenging effects of tea catechins and their derivatives on 1,1-diphenyl-2-picrylhydrazyl radical. Free Radical Biol Med 1996;21: 895-902. [ Links ]
93. Da Silva EL, Piskula M, Terao J. Enhancement of antioxidative ability of rat plasma by oral administration of (-)-epicatechin. Free Radical Biol Med 1998;24: 1209-1216. [ Links ]
94. Guo Q, Zhao B, Shen S, Hou J, Hu J, Xin W. ESR study on the structure- antioxidant relationship of tea catechins and their epimers. Biochim Biophys Acta 1999;1427: 13-23. [ Links ]
95. Kondo K, Kurihara M, Miyata N, Suzuki T, Toyoda M. Scavenging mechanism of (-) -epigallocatechin gallate and (-)-epicatechin gallate on peroxyl radicals and formation of superoxide during the inhibitory action. Free Radical Biol Med 1999;27: 855-863. [ Links ]
96. Da Silva PA, Nave JA, Pereira VA. Antioxidant protection of low density lipoprotein by procyanidins: structure/ activity relationships. Bio Pharm 2003;66: 947- 954. [ Links ]
97. McAnlis GT, McEneny J, Pearce J, Young IS. Black tea consumption does not protect low density lipoprotein from oxidative modification. Eur J Clin Nutr 1998;52: 202-206 [ Links ]
98. Hodgson JM, Mori TA, Puddey IB, Croft KD, Beilin LJ. In vitro antioxidant activity of black and green tea: effects on lipoprotein oxidation in human serum. J Sci Food Agric 1999;79: 561-566. [ Links ]
99. Ishikawa T, Suzukawa M, Ito T, Yoshida H, Ayaori M, Nishiwaki M, Yonemura A, Hara Y, Nakamura H. Effect of tea flavonoid supplementation on the susceptibility of low-density lipoprotein to oxidative modification. Am J Clin Nutr 1997;66: 261-266. [ Links ]
100.Princen HM, van Duyvenvoorde W, Buytenhek R, Blonk C, Tijburg L, Langius J, Meinders A, Pijl H. No effect of consumption of green and black tea on plasma lipid and antioxidants levels and on LDL oxidation in smokers. Arterioscler Thromb Vasc Biol 1998;18: 833-841. [ Links ]
101.Osada K, Takahashi M, Hoshima S, Nakamura M, Nakamura S, Sugano M. Tea catechins inhibit cholesterol oxidation accompanying oxidation of low density lipoprotein in vitro. Com Biochem Physio 2001;128: 153-164. [ Links ]
102.Yamaka N, Oda O, Nagao S. Green tea catechins Duch as (-)epicatechin and (-epigallocatechin acelerate Cu2+ induced low-density lipoprotein in propagation phase. FEBS Lett 1997;401: 230-234. [ Links ]
103.Yokozawa T, Dong E. Influence of green tea and its three major components upon low-density lipoprotein oxidation. Exp Toxic Pathol 1997;49: 329-335. [ Links ]
104.Miura S, Watanabe J, Sano M, Tomiya T, Osawa T, Hara T, Tomita I. Effects of various natural oxidants on the Cu2+-mediated modification of low-density lipoprotein. Biol Pharm Bull 1995;18: 1-4. [ Links ]
105.Vinson JA, Dabbagh YH, Serry MM, Jang J. Plant flavonoids, especially tea flavonoids, are powerful antioxidants using an in vitro oxidation model for heart disease. J Agric Food Chem 1995;43: 2800-2802. [ Links ]
106. Rice-Evans CA, Miller NJ, Paganga G. Structure-antioxidant activity relationship of flavonoids and phenolic acids. Free Rad Biol Med 1996;20: 933-956. [ Links ]
107. Ho CT, Chen Q, Shu H, Zhang KQ, Rosen RT. Antioxidative effect of polyphenol extract prepared from various Chinese Teas. Prev Med 1992;21: 520-525. [ Links ]
108. Hashimoto R, Yaita M, Tanaka K, Hara Y, Kojo S. Inhibition of radical reaction of apolipoprotein B-100 and α-tocopherol in human plasma by green tea catechins. J Agric Food Chem 2000;48: 6380-6383. [ Links ] 109.Brown JE, Khodr H, Hider RC, Rice-Evans CA. Structural dependence of flavonoid interactions with Cu2+ ions: implications for their antioxidant properties. Biochem J. 1998;330: 1173-1178. [ Links ] 110.Liu ZQ, Ma LP, Zhou B, Yang L, Liu ZL. Antioxidative effects of green tea polyphenols on free radical initiated and photosensitized peroxidation of human low density lipoprotein. Chem Phys Lipids 2000;106: 53-63. [ Links ] 111.Lotito SB, Fraga CG. (+)-Catechin prevents human plasma oxidation. Free Rad Biol Med 1998;24: 435-441. [ Links ] 112.Hayakawa F, Kimura T, Maeda T, Fujita M, Sohmiya H, Fujii M, Ando T. DNA cleavage reaction and linolenic acid peroxidation induced by tea catechins in the presence of cupric ion. Biochim Biophys Acta 1997;1336: 123-131. [ Links ] 113.Frei B. Cardiovascular disease and nutrient antioxidants: role of low-density lipoprotein oxidation. CRC Crit Rev Food Sci Nutr 1995;35: 83-98. [ Links ] 114.Kasaoka S, Hase K, Morita T, Kiriyama S. Green tea flavonoids inhibit the LDL oxidation in osteogenic disordered rats fed a marginal ascorbic acid in diet. J Nutr Biochem 2002;13: 96-102. [ Links ] 115.Miura J, Chiba T, Miura S, Tomita I, Umegaki K, Ikeda M, Tomita T. Green tea polyphenols (flavan 3-ols) prevent oxidative modification of low density lipoproteins: an ex vivo study in humans. J Nutr Biochem 2000;11: 216-222. [ Links ] 116.Cybulsky MI, Iiyama K, Li H et al. A major role for VCAM-1, but not ICAM-1, in early atherosclerosis. J Clin Invest 2001;107:1255-1262. [ Links ] 117.Cybulsky MI , Gimbrone MA. Endothelial expression of a mononuclear leukocyte adhesion molecule during atherosclerosis. Science 1991;251: 788-791. [ Links ] 118.Lenardo MJ, Baltimore D. NF-kappa B: a pleitropic mediator of inducible and tissue specific gene control. Cell 1989;58: 227-229. [ Links ] 119.Mauri N, Offermann MK, Swerlick R, Kunsch C, Rosen CA, Ahmad M, Alexander RW, Medford RM. Vascular cell adhesion molecule-1 (VCAM-1) gene transcription and expression are regulated through an antioxidant-sensitive mechanism in human vascular endothelial cells. J Clin Invest 1993;92: 1866-1874. [ Links ] 120.Ludwig A, Lorenz M, Grimbo N, Steinle F, Meiners S, Bartsch C, Stangl K, Baumann G, Stangl V. The tea flavonoid epigallocatechin-3-gallate reduces cytokine-induced VCAM-1 expression and monocyte adhesion to endothelial cells. Biochem Biophy Res Com 2004;316: 659-665. [ Links ] 121.Murase T, Kume N, Hase Y, Shibuya Y, Nishizawa Y, Tokimitsu I, Kita T. Gallates inhibit cytokine-induced nuclear translocation of NF-kappa B and expression of leukocyte adhesion molecules in vascular endothelial cells. Atheroscler Thromb Vasc Biol 1999;19: 1412-1420. [ Links ] 122.Di Minno G, Silver MJ. Mouse antithrombotic assay: A simple method for the evaluation of antithrombotic agents in vivo. Potentiation of antithrombotic activity by ethyl alcohol. J Pharmacol Exp Ther 1983; 225:57-60. [ Links ] 123.Walker TR, Watson SP. Synergy between Ca2+ and protein kinase C is the major factor in determining the level of secretion from human platelets. Biochem J 1993;289: 277-282. [ Links ] 124.Kang WS, Chung KH, Chung JH, Lee JY, Park JB, Zhang YH, Yoo HS, Yun YP. Antiplatelet activity of green tea catechins is mediated by inhibition of cytoplasmatic calcium increase. J Cardiovasc Pharmacol 2001;38: 875-884 [ Links ] 125.Sachinidis A, Skach RA, Seul C, Ko Y, Hescheler J, Ahn H, Fingerler J. Inhibition of the PDGF beta-receptor tyrosine phosphorylation and its downstream intracellular signal transduction pathway in rat and human vascular smooth muscle cells by different catechins. FASEB 2002;16: 893-895. [ Links ] 126.Watson S, Berlanga O, Best D, Frampton J. Update on collagen receptor interactions in platelets: is the two-state model still valid? Platelets 2000;11: 252-258. [ Links ] 127.Ozdener F, Kunapuli SP, Daniel JL. Carboxyl terminal sequence of human phospholipase Cgamma2. Platelets 2001;12: 121-123. [ Links ] 128.Deana R, Turetta L, Donella-Deana A, Dona M, Brunati AM, De Michiel L, Garbisa S. Green tea epigallocatechin-3-gallate inhibits platelet signalling pathways triggered by both proteolytic and non-proteolytic agonists. Thromb Haemost 2003; 89: 866-874. [ Links ] 129.Hodgson JM, Devine A, Puddey IB, Chan SY, Beilin LJ, Prince RL. Tea intake is inversely related to blood pressure in older women. Asia Pac J Clin Nutr 2003;12: S18. [ Links ] 130.Kaundun SS, Matsumoto S. Identification of processed Japanese green tea based on polymorphisms generated by STS-RFLP analysis. J Agric Food Chem. 2003;51: 1765-1770. [ Links ] 131.Beynen AC, Katan MB, Van Zutphen LF. Hypo- and hyperresponders: individual differences in the response of serum cholesterol concentration to changes in diet. Adv Lipid Res. 1987;22: 115-171. [ Links ] 132.Ordovas JM. The quest for cardiovascular health in the genomic era: nutrigenetics and plasma lipoproteins. Proc Nutr Soc. 2004; 63:145-152. [ Links ] 133.De Roos B. Metabolic and mechanistic facts regarding the coffe diterpenes cafestol and Kahweol. In: Vaquero P, García-Arias T, Carbajal A, Sánchez-Muníz F, editors. Bioavaility of Micronutrients and Minor Dietary Compounds. Metabolic and Technologycal Aspects. India: Research Signpost, 2003:147-160. [ Links ] 134.Vittal R, Selvanayagam ZE, Sun Y, Hong J, Liu F, Chin KV, Yang CS. Gene expression changes induced by green tea polyphenol (-)-epigallocatechin-3-gallate in human bronchial epithelial 21BES cells analyzed by DNA microarray. Mol Cancer Ther 2004;3: 1091-1099. [ Links ] 135.Kaul D, Sikand K, Shukla AR. Effect of green tea polyphenols on the genes with atherosclerotic potential. Phytother Res 2004;18: 177-179. [ Links ] 136.Sasazuki S, Kodama H, Yoshimasu K, Liu Y, Washio M, Tanaka K, Tokunaga S, Kono S, Arai H, Doi Y, Kawano T, Nakagaki O, Takada K, Koyanagi S, Hiyamuta K, Nii T, Shirai K, Ideishi M, Arakawa K, Mohri M, Takeshita A. Relation between green tea consumption and the severity of coronary atherosclerosis among Japanese men and women. Ann Epidemiol 2000;10: 401-408. [ Links ] 137.Riemersma RA, Rice-Evans CA, Tyrrell RM, Clifford MN, Lean ME. Tea flavonoids and cardiovascular health. QJM 2001;94: 277-282. [ Links ] 138.Crawford RS, Kirk EA, Rosenfeld ME, LeBoeuf RC, Chait A. Dietary antioxidants inhibit development of fatty streak lesions in the LDL receptor-deficient mouse. Arterioscler Thromb Vasc Biol 1998;18: 1506-1513. [ Links ] 139.Li M , Xie B, Evaluation of the antioxidant and pro-oxidant effects of tea catechin oxipolymers. J Agric Food Chem 2000; 48: 6362-6366. [ Links ] 140.Portaluppi F, Boari B, Manfredini R. Oxidative stress in essential hypertension. Curr Pharm Des 2004;10: 1695-1698. [ Links ] 141.Negishi H, Xu JW, Ikeda K, Njelekela M, Nara Y, Yamori Y. Black and green tea polyphenols attenuate blood pressure increases in stroke-prone spontaneously hypertensive rats. J Nutr 2004 ;134: 38-42. [ Links ]