Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Puericultura y Pediatría
versión impresa ISSN 0004-0649
Arch Venez Puer Ped vol.78 no.2 Caracas jun. 2015
La Rizotomía Selectiva Posterior: Una alternativa en el tratamiento de la espasticidad en la Disfunción Cerebral Motora
Herman Scholtz (1). Marcel Rupcich Guardia (2), Ricardo José Bravo Pérez (3)
1 Médico Cirujano, Especialista en Neurocirugía, Departamento de Neurocirugía. Centro Médico Docente La Trinidad, Caracas, Venezuela.
2 Médico Cirujano, Especialista en Cirugía Ortopédica Infantil y Neuro- Ortopedia, Departamento de Pediatría – Centro Médico Docente La Trinidad, Caracas, Venezuela. Instituto Nacional de Bioingeniería, Universidad Central de Venezuela. Caracas, Venezuela.
3 Ing. Electrónico, Magíster en Ingeniería Biomédica. Investigador Asociado, Centro de Tecnología Asistiva, Universidad Simón Bolívar, Calle Vieja Baruta, Valle de Sartenejas, Caracas, Venezuela.
Correspondencia: Dr. Marcel Rupcich G. Teléfonos. 0414-3327825 / 0212- 9496262 - 9496363 Email: rupcich@gmail.com
RESUMEN
La Rizotomía Selectiva Posterior (RSP) es un procedimiento quirúrgico que se realiza en las raíces posteriores (sensitivas) de la columna lumbosacra. Su fundamento se basa en disminuir la respuesta motora exagerada que producen los estímulos sensitivos en pacientes con espasticidad, como sucede en la Disfunción Motora de origen cerebral (DCM). En este trabajo se presenta una descripción de la técnica, indicación, selección de pacientes y aspectos pre y post operatorios.
Palabras Claves: Rizotomía, Espasticidad, Disfunción Cerebral Motora.
Selective posterior rhizotomy. An alternate treatment for spasticity in cerebral motor dysfunction
SUMMARY
Selective Dorsal Rhizotomy (SDR) is a surgical procedure performed on the posterior roots of the lumbosacral spine. It is based on the diminishment of the exaggerated motor response produced by sensitive stimuli in patients with spasticity, such as in the child with cerebral motor dysfunction (CMD). This paper presents a description of the technique, indications, patient selection and pre and post operative aspects.
Key Words: Rhizotomy, spasticity, cerebral motor dysfunction.
Recibido: 1/10/2014 Aceptado: 1/5/2015
INTRODUCCIÓN
El denominador común en la Disfunción Cerebral Motora, es la perdida del control motor selectivo (CMS), siendo la alteración primaria más frecuente la espasticidad, la cual afecta aproximadamente al 75% de los pacientes (1,2). Los autores han preferido utilizar el término Disfunción Cerebral Motora, a diferencia del término Parálisis Cerebral consagrado por el uso, ya que el primero define mejor y mas ampliamente la patología, cuyo denominador común es la pérdida del control motor selectivo, como se menciono anteriormente. La segunda voz no lo define realmente, pudiendo llegar incluso a considerarse un término peyorativo.
La espasticidad se define como un desorden motor dependiente de los reflejos tónicos de estiramiento con uno o ambos de los siguientes signos:
1.- la resistencia aumenta con el aumento de la velocidad de movimiento y varía con la dirección del movimiento articular.
2.- la resistencia al movimiento aumenta rápidamente por encima del umbral de velocidad del ángulo de la articulación (captura espástica) (1,3).
Esta definición de espasticidad interesa a ambos sistemas (motor y sensitivo), ya que el movimiento impuesto desde el exterior, velocidades diferentes y cambios de los ángulos articulares modificara la retroalimentación aferente del sistema propioceptivo (2,3); el equilibrio entre inhibición y excitación tiene influencia sobre la motoneurona alfa dando como resultado el tono normal (4,5).
Los tratamientos para la espasticidad están orientados a reducir el tono exagerado. Estos tratamientos abordan estrategias como el uso de terapia física, medicamentos y procedimientos quirúrgicos (6).
Medicamentos orales como por ejemplo: baclofen, benzodiacepinas, dantrolene sódico, los agonistas alfa-2-adrenérgicos y de aplicación local, como por ejemplo: el fenol y la toxina botulínica, son muestras de estas estrategias. Desde el punto vista quirúrgico los procedimientos más usados recientemente son los siguientes: administración de baclofen intratecal (Bomba de Baclofeno), tratamiento neuroquirúrgico de la distonía, como la rizotomía ventral del músculo distonico, estimulación epidural de la corteza motora y la rizotomía selectiva posterior, objeto de este trabajo.
La primera rizotomía selectiva posterior en Venezuela se registra en el año de 1998, en el Hospital Ortopédico Infantil, cuando se integra el primer equipo multidisciplinario bajo la dirección del Dr. Warwick Peacock, formador de los autores de la presente revisión. En el año 2004 se consolida la unidad de Neuroortopedia en el Centro Médico Docente La Trinidad (CMDLT), retomándose la aplicación de la técnica.
HISTORIA Y PATOFISIOLOGÍA
Historia
El término rizotomía deriva de la forma prefija del griego: rhidsa, raíz, y tomía, forma sufija del griego tomé, corte. La primera de estas cirugías conocida se registra en 1888, por Robert Abbe, en Nueva York, quien realizó la rizotomía posterior como tratamiento para el dolor, seccionando toda la raíz posterior. En 1908, Otfridd Foerster de Alemania, la realizó para mejorar la espasticidad delineando la indicación para la sección a la raíz posterior de L2-S2. Este autor publicó una serie de 88 de 159 pacientes en 1913. La recomienda en pacientes sin atetosis con buena fuerza y nivel cognitivo, siendo uno de los principales aportes para la definición de criterios, desarrollo y depuración de la técnica quirúrgica. En 1951 Bischof desarrolla la mielotomía que consistía en la ablación quirúrgica de las neuronas sensoriales dentro de la médula. En 1967 se revisa la técnica y se observa que producía lesión potencial del tracto piramidal y de la inervación de la vejiga. En 1967 Gros revisa el procedimiento descrito por Foerster preservando 1/5 de la raíz posterior desde L1 a S1 para conservar sensibilidad, con resultados poco funcionales. Posteriormente el proceso de selección fue cambiado de manera de agrupar las raíces de grupos musculares funcionales.
Realmente la mayor contribución en el campo teórico, selección y técnica fue aportada en primer lugar por Fasano y col (7-10), quienes reportan el uso de estímulos eléctricos para seleccionar las raíces comprometidas en los reflejos anormales, reportando buenos resultados. Posteriormente Peacock y col modifican la técnica de Fassano cambiando del conus a la cauda equina L2-L5 e identificando las raíces nerviosas para preservar la inervación sacra (11-13). Estudios más recientes reportan muy buenos resultados en DCM, enfatizando en la selección de pacientes y la terapia postoperatoria, sobre todo para efectos de marcha (14-18) sin incluir S2, dado que existen reportes de problemas del área génito-urinaria en casos donde se han incluido cortes en dicha raíz (19).
Patofisiología
La espasticidad es un desorden motor caracterizado por el aumento del tono dependiente de la velocidad de estiramiento, con exagerada resistencia a los movimientos pasivos (20), como se mencionó anteriormente.
Las raices espínales emergen de la médula espinal en cada cuerpo vertebral y consisten en una raíz anterior (ventral), principalmente responsable de la función motora y otra posterior (dorsal) responsable de la sensibilidad en sus niveles correspondientes. Estas raíces, anteriores y posteriores, también se interrelacionan por medio de las fibras aferentes y eferentes (inhibidoras o facilitadoras), procedentes de los centros superiores del sistema nervioso central (SNC).
El músculo esquelético posee receptores sensibles a la distensión que forman parte de un sistema de retroalimentación para mantener el tono muscular normal.
Las fibras sensitivas que entregan información sobre la tensión en el músculo esquelético tienen dos orígenes: las terminaciones nerviosas encapsuladas que responden a la distensión en el tendón del músculo, y las terminaciones nerviosas espirales (fibras aferentes sensitivas), sensibles a la distensión y tensión en fibras musculares especializadas contenidas en un órgano sensorial especial del músculo que se denomina huso muscular.
El huso muscular está formado por una cápsula fusiforme de tejido conjuntivo fibroso que rodea a un grupo de 8 a 15 fibras musculares delgadas. Estas fibras se conocen como fibras intrafusales. Se distinguen 2 tipos de fibras intrafusales: Fibras intrafusales grandes de generación de fuerza que componen la masa contráctil del músculo y las fibras intrafusales propiamente dichas, de los husos musculares que se encuentran dispersos en todo el vientre muscular. Cuando las fibras intrafusales se contraen, el músculo se acorta y se produce el movimiento. Estas fibras son inervadas por la motoneurona alfa procedentes del asta anterior de la médula espinal. Las fibras intrafusales están inervadas por fibras nerviosas motoras especializadas (motoneurona gamma) que ajustan la longitud de estas fibras en función del estado de distensión del músculo y que también proceden del asta anterior de la médula espinal. El estado de distensión es detectado por las terminaciones nerviosas espirales, que forman una envoltura alrededor de las fibras intrafusales y dan origen a las fibras aferentes sensitivas especiales que viajan hacia la médula espinal.
En las células del asta anterior existen dos influencias opuestas, las fibras aferentes del huso muscular que logran facilitación, y los tractos descendentes de los centros superiores que producen inhibición. Estas dos fuerzas deben estar balanceadas perfectamente para producir el tono muscular y la postura (4,5). En la Disfunción Cerebral Motora el equilibrio se pierde; el tracto motor descendente se encuentra dañado reduciéndose la inhibición, dejando el predominio a los facilitadores; de esta manera la excesiva actividad de las células de las astas anteriores producen la espasticidad. (3,4, 5, 21, 22).
Como consecuencia de este tono mantenido de forma exagerada se tienen evidencias de cambios estructurales en la célula muscular en el tiempo, causando rigidez intrínseca, tales como cambios de la viscosidad, elasticidad normal del tejido, tamaño de las sarcómeras, módulo de elasticidad del músculo etc. (23-27).
Por medio del uso de marcadores inmunohistoquímicos, se logró la identificación de la molécula de adhesión celular neural (28). Esta molécula aumenta en respuesta a la denervación y está presente en las muestras de biopsias musculares obtenidas en pacientes con DCM que no han sido sometidos a RSP antes de 6 años de edad (28). La presencia de la molécula y la atrofia muscular son más frecuentes en pacientes de edad escolar o mayores
TÉCNICA QUIRÚRGICA
Bajo anestesia general y con el paciente en decúbito prono se procede a realizar incisión por la línea media con el abordaje posterior habitual de la columna. Se realiza laminectomía desde L1 a L5 conservando el ligamento epiespinoso, interespinoso y ligamento amarillo posterior de manera de levantar la columna posterior en bloque (láminas vertebrales, apófisis espinosa y los ligamentos antes mencionados) de caudal a cefálico y fijarlo proximalmente a la piel, cuidando de realizar una muy buena hemostasia (Figura 1).
En este momento se puede constatar la profundidad de la anestesia. En pacientes que presentaban clonus previamente, si lo mantienen, es apropiado para la estimulación. La desaparición de ellos nos indicara que debe superficializarce la anestesia para el procedimiento.
Se expone la duramadre y se realiza una incisión longitudinal refiriendo ambos bordes cada centímetro aproximadamente (figura 2-a). Posteriormente se procede a identificar las raíces anteriores (ventrales) para diferenciarlas de las posteriores (dorsales) por niveles usando un electrodo en forma de gancho romo especialmente adaptado (figura 2-b).
S1 es la raíz más gruesa y típicamente es la que presenta mayor espasticidad. La estimulación eléctrica de su raíz anterior produce flexión de rodilla y flexión plantar del tobillo, mientras que la estimulación de la raíz anterior de S2 produce flexión plantar de tobillo y de los dedos del pie, y posiblemente contracción del esfínter anal. L1 puede ser identificada contando hacia arriba. La raíz anterior suele ser más oscura, pequeña y redondeada que la posterior, la cual es mayor y aplanada. La estimulación de la raíz anterior se realiza a 0.1mA a 50Hz por 500ms. El umbral de contracción es menor (unas 10 veces) en la raíz anterior (motora) que en la posterior.
Se debe tener mucho cuidado en preservar la raíz de S3 y niveles inferiores. La electromiografía (EMG) del esfínter anal externo es recomendable para identificar arcos reflejos que puedan estar relacionados con el control del esfínter.
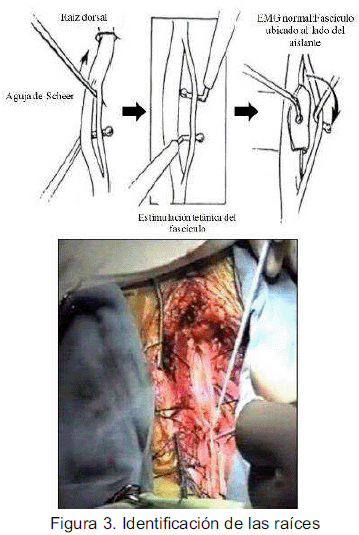
Una vez identificadas las raíces posteriores, se procede a dividirlas en sus micro-raicillas (15-20 c/u) y estimularlas desde L1 a S2 de cada lado (véase la figura 3).
La estimulación de las raíces posteriores se realiza para cada raicilla con una intensidad de 0.2 a 3mA. Se debe evitar estimulación sobre umbral. Es importante que la anestesia no esté demasiado profunda para obtener respuesta reflejas óptimas (29). De haber respuesta electromiográfica anormal a la estimulación de estas raíces, las mismas se seccionan (véase figura 4).
Aproximadamente el 25% al 40% de las raicillas son cortadas dependiendo de la respuesta al estimulo registrado. Es importante destacar que el porcentaje ideal de raicillas involucradas en el procedimiento se considera el 30% del total de la raíz; de seccionar el total de las raíces posteriores se tendrá como resultante efectos colaterales no deseados como ataxia sensorial e hipoestesia.
Respuesta EMG
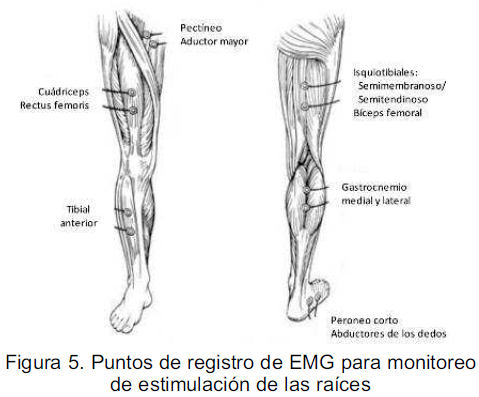
El monitoreo EMG se realiza básicamente en: aductores, cuádriceps, tibial anterior, isquiotibiales, gastrocnemius de forma bilateral, además del esfínter anal externo (figura 5). Se mantiene observación y palpación directa sobre otros músculos como los flexores de los dedos (30).
Normal
-Duración de la contracción dentro del segundo de aplicación del estimulo (figura 6, trazo superior).
-Localización: en los grupos musculares inervado por la raíz estimulada
-Patrón: de decrecimiento, cuadrado, contracción simple. Tiempo normal.
Respuesta anormal
-Duración: contracción mantenida por más del segundo de aplicado el estímulo (figura 6, trazo inferior).
-localización: se difunde más allá del grupo muscular donde se aplicó el estímulo, incluyendo niveles proximales, distales o contralaterales (figura 7-a), pudiendo incluso alcanzar al miembro contralateral (figura 7-b,c)
-Patrón: en incremento (figura 7-b), clónico, multifásico (figura 7-c).
Luego de repetirse el proceso anterior de identificación de raicillas, prueba y sección de las mismas, en los grupos musculares de interés, se procese a concluir la cirugía, cuyo cierre se ilustra en la figura 8.
Se suele inyectar 025% de bupivacaine intra canal para evitar el dolor postoperatorio así como analgesia endovenosa y relajantes musculares postoperatorio. Al paciente se le coloca un corsé lumbo sacro con el cual sale de pabellón y debe mantener durante las siguientes 12 semanas o hasta que se demuestre consolidación de las láminas.
Selección de pacientes
Tratándose la Disfunción Cerebral Motora de un desorden multifacético, es importante identificar la espasticidad como la principal causante de la discapacidad además de identificar otros factores de la DCM como otras anormalidades del tono, fuerza, alineación del esqueleto y el control motor selectivo de los miembros inferiores, que afectan la función motora del individuo, ya que la RSP reduce la espasticidad. Los problemas ortopédicos desarrollados durante el crecimiento como contracturas musculares estructuradas o deformidades óseas son mas frecuentes en pacientes que fueron intervenidos después de los 6 años por lo que deben ser corregidas posteriormente a la RSP, ya que su evolución en algunos casos se detuvo pero no revierte (31, 32).
Características Generales de la Disfunción cerebral motora:
Tono muscular anormal: espasticidad, rigidez, hipotonía, distonía (tono fluctuante).
Movimientos involuntarios: Atetosis, corea, mioclonias, etc..
Actividad refleja anormal: persistencia de reflejos primitivos (Startle, Moro), reflejo tónico-cervical asimétrico, reflejos tónico cervical simétrico, reflejo cutáneo anormal, etc.
Patrones sinérgicos: pérdida del control motor selectivo, contracciones simultáneas de agonistas y antagonistas.
Mecanismos anormales de equilibrio.
Trastornos de sensibilidad (propiocepción)
Debilidad.
Contracturas musculares y deformidades óseas secundarias.
El proceso de selección contempla:
a. Confirmar el diagnóstico.
b. Identificar la espasticidad como predominante:
resistencia dependiente de la velocidad al estirar
reflejo de estiramiento hiperactivo
clonus presentes.
disminución de rangos de movimiento.
c. Evaluar rangos de movimiento: abducción de cadera, rodilla y tobillo.
d. Evaluar la fuerza muscular subyacente y el control selectivo. El paciente debe tener suficiente fuerza subyacente a la espasticidad para soportar postura y movimientos posteriores a la reducción de la espasticidad, principalmente en músculos anti gravitatorios, como los del tronco, extensores y abductores de cadera, cuádriceps, y tríceps sural.
Exclusiones relativas:
Desordenes del movimiento resultantes de lesiones del cerebelo y ganglios de la base (rigidez, distonía, atetosis, ataxia, corea), deformidad fija de la columna, debilidad o hipotonía del tronco (pueden desarrollar detrimento de su función respiratoria).
Los reflejos primitivos y patrones sinérgicos no desaparecen despues de la Rizotomía y continúan influenciando los movimientos del paciente. La rizotomía no se recomienda en pacientes que dependen primordialmente de la espasticidad y de los reflejos primitivos para desarrollar una función.
Las metas del procedimiento deben ser consideradas y discutidas con los padres previa a la cirugía. No crear expectativas de que un paciente incapaz de deambular previa cirugía lo haga posterior a ésta. El procedimiento puede mejorar calidad y rendimiento de las funciones que se hayan desarrollado dependiendo de factores como fuerza, control motor, ausencia de contracturas, etc. La inteligencia y motivación del paciente son factores importantes en la colaboración y participación en el programa de terapia postoperatoria.
Pacientes muy comprometidos desde el punto de vista ortopédico y neurológico pueden beneficiarse de la rizotomía en función de mejorar su posicionamiento, cuidados diarios y prevenir futuras deformidades y contracturas.
Es importante destacar que contracturas musculares estructuradas, contracturas articulares, al igual que deformidades óseas y articulares, no serán corregidas por la rizotomía y ameritarán correcciones ortopédicas (6).
Un ejemplo de candidato ideal sería:
Tono predominantemente espástico (33,34).
4 a 10 años de edad, dado que no han instalado completamente alteraciones ortopédicas (34).
Mostrar buen control motor selectivo (35,36).
Buen control del tronco y anti gravitatorios (37).
Medición del costo de O2 durante la marcha (38,39).
La presencia de deformidades fijas de la columna, como por ejemplo las del plano sagital: hiperlordosis lumbares fijas y severas, roto escoliosis estructuradas, podrían ser causa de exclusión.
La satisfacción para el paciente y sus familiares depende de las metas fijadas previas a la intervención, por lo que resulta imperativo tener bien definidos y claros los objetivos. De igual importancia es tener claro que la RSP es solamente un tratamiento en el plan a largo plazo del niño.
POSTOPERATORIO Y REHABILITACIÓN
Rehabilitación
Es importantísimo que el programa de rehabilitación se desarrolle en forma regular y con personal especializado; de igual forma es importante la preparación de los padres, su formación y participación activa en la rehabilitación.
Preoperatoria
Fortalecer extensores de la columna, abdominales y músculos antigravitatorios de los miembros inferiores.
Realizar el puente, ejercicios activos en abducción de caderas, extensión de rodilla, dorsiflexión y flexión plantar del tobillo si es posible.
Las férulas antiequinas (articuladas que puedan ser bloqueadas de ser necesario), deben estar listas para el postoperatorio.
La terapia debe ser planificada en forma diaria de ser posible. Tanto los padres como el paciente deben saber que se tendrá un retraso temporal de sus funciones durante la recuperación
Siempre documentar el estado del paciente preoperatorio, en forma objetiva mediante fotos, videos, análisis de marcha, etc.
Postoperatorio inmediato:
Es importante tener un corsé tóraco-lumbar diseñado especialmente para el paciente, para proteger la columna y evitar flexiones del tórax, además de facilitar la movilización del paciente en cama y su traslado posterior.
Recomendamos iniciar la movilización precoz con movimientos pasivos y activos según tolerancia. Evitar ejercicios de estiramiento de los isquiotibiales por encima de los 30° con la rodilla extendida, durante la primera semana.
Entre el 3er y 5to día se recomienda elevar la cabeza 40° durante la mañana, y sentarse en el postmeridiano.
Pasado el 6to día se debe iniciar bipedestación, ejercicios activos enfatizando en la abducción de caderas, extensión de rodillas, y movimientos del tobillo.
Problemas postoperatorios comunes.
a. Hipersensibilidad en piernas y pies durante los primeros días o semanas que desaparecen espontáneamente. La bipedestación temprana disminuye esta complicación.
b. Espasmos de los flexores que también desaparecen espontáneamente. Se recomienda acostar de lado al paciente y evitar presión sobre la superficie de los flexores.
c. Postura en cuclillas o flexión de las extremidades inferiores: se debe a debilidad de los flexores plantares, por lo que deben fortalecerse y/o usar férulas que controlen la posición (antiequinas articulada que pueda bloquearse, férula de reacción anterior, aparatos extensores de rodilla).
d. Colapso repentino de las extremidades inferiores en flexión, las cuales pueden ser producidas por:
1.- Debilidad (flexores plantares, cuádriceps y extensores de cadera) y la incapacidad de controlar el peso del cuerpo cuando el centro de gravedad del paciente esta demasiado posterior con respecto a la rodilla.
2.- Sincronización anormal de la contracción muscular, causando reclutamiento inverso de los músculos acoplados con disminución de la co-contracción.
3.- Influencia exagerada de reflejos persistentes como respuesta flexora excesiva o pobre tono extensor.
El patrón flexor también se puede mejorar con la descarga de peso, que ayudaría a reclutar más músculos extensores de los miembros inferiores. Se recomienda fortalecer los músculos estabilizadores para mantener la bipedestación (con ejercicios excéntricos e isométricos).
CONCLUSIÓN
La RSP resulta una alternativa de tratamiento en pacientes con compromiso del haz piramidal, principalmente para mejorar la condición de vida de todo el entorno familiar (higiene, trasporte, desarrollo de contracturas musculares y/o deformidades óseas).
Se puede concluir que existe la posibilidad disminuir la transformación que sufre la fibra muscular en el tiempo con la RSP, sin embargo, esto se podrá asegurar o descartar con estudios futuros.
Finalmente, esta técnica quirúrgica, bien escogidos los candidatos, es de suma utilidad para el paciente con espasticidad como secuela de una DCM y es posible contar en Venezuela con este procedimiento, dada la experiencia acumulada, el recurso humano capacitado y especializado, y la evolución satisfactoria de los pacientes tratados desde los inicios de la aplicación de la técnica en el país.
REFERENCIAS
1.- Matthews DJ, Wilson P. Cerebral Palsy. En: G.E. Molnar, M.A. Alexander, (editores). Pediatric Rehabilitation. 3a Edición. Hanley & Belfus Philadelphia, PA 1999, pp. 193- 217. [ Links ]
2.- Sanger TD, Delgado MR, Gaebler-Spira D, Hallett M, Mink JW. Classification and definition of disorders causing hypertonia in chilhood. Pediatric 2003;111: 89-97. [ Links ]
3.- Ivanhoe CB, Reistetter TA. Spasticity: the misunderstood part of the upper motor neuron syndrome. Am J Phys Med Rehabil 2004; 83(Suppl): S3-9. [ Links ]
4.- Albright AL. Spastic Cerebral Palsy: approaches to drug treatment. CNS Drugs 1995; 4: 17-27. [ Links ]
5.- Young RR. Spasticity a Review. Neurology 1994; 44: S12-20. [ Links ]
6.- Gage J. Introduction and overview of treatment philosophy. En: R. Gage, M. Schwartz, S. Koop, T. Novacheck, (editores). The identification and treatment of gait problems in Cerebral Palsy. 2da Edición. Mac Keith Press. Londres 2009, pp. 307- 311. [ Links ]
7.- Fasano VA, Broggie G, Barolat-Romana G, Sguazzi A. Surgical treatment of spasticity in cerebral palsy. Child Brain 1978;4:289-305. [ Links ]
8.- Fasano VA, Barolat-Romana G, Zeme S, Sguazzi A. Electrophisiological assesment of spinal circuits in spasticity by direct dorsal root stimulation. Neurosurgery 1979; 4:146- 151. [ Links ]
9.- Fasano VA, Broggie G, Zeme S, Lo Russo G, Sguazzi A. Long term results of posterior functional rhizotomy. Acta Neurochir suppl (wien) 1980; 30:435-439. [ Links ]
10.- Fasano VA, Broggie G, Zeme S. Intraoperative electrical stimulation for functional posterior rhizotomy. Scand J Rehabil Med Suppl 1988; 17:149-154. [ Links ]
11.- Peacock WJ, Arens LJ, Berman B. Cerebral palsy spasticity. Selective posterior rhizotomy. Pediatr Neurosci 1987; 13:61- 66. [ Links ]
12.- Peacock WJ, Staoudt LA. Spasticity in cerebral palsy and the selective rhizotomy procedure. J Child Neurol 1990; 5:179- 185. [ Links ]
13.- Peacock WJ, Staoudt LA (1991) Functional outcomes following selective posterior rhizotomy in children with cerebral palsy. J Neurosurg 1991; 74:380-385. [ Links ]
14.- Kai M, Yongjie L, Ping Z. Long-term results of selective dorsal rhizotomy for hereditary spastic paraparesis. J Clin Neurosci 2014;1:116-120. [ Links ]
15.- Langerak NG1, Hillier SL, Verkoeijen PP, Peter JC, Fieggen AG, Vaughan CL. Level of activity and participation in adults with spastic diplegia 17-26 years after selective dorsal rhizotomy. J Rehabil Med 2011;43(4): 330-337. [ Links ]
16.- Bakir MS, Gruschke F, Taylor WR, Haberl EJ, Sharankou I. Temporal but Not Spatial Variability during Gait Is Reduced after Selective Dorsal Rhizotomy in Children with Cerebral Palsy. PLoS ONE: [2013;8(7): e69500. doi:10.1371/ journal.pone.0069500]. [Citado 12 Feb 2015] [aprox 9p] Disponible en: http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0069500 [ Links ]
17.- MacWilliams BA1, Johnson BA, Shuckra AL, D'Astous JL. Functional decline in children undergoing selective dorsal rhizotomy after age 10. Dev Med Child Neurol 2011;53(8):717- 723. [ Links ]
18.- Van Schie PE1, Schothorst M, Dallmeijer AJ, Vermeulen RJ, van Ouwerkerk WJ, Strijers RL, et al. Short- and long-term effects of selective dorsal rhizotomy on gross motor function in ambulatory children with spastic diplegia. J Neurosurg Pediatr 2011;7(5):557-562. [ Links ]
19.- Zhu GY1, Zhou MW, Huang HS, Chen YP, Wang WT, Zeng FS. Effects of highly selective dorsal rootlets rhizotomy on bladder function and penis erection in SD rats. Beijing Da Xue Xue Bao 2010;42(5):530-534. [ Links ]
20.- Lance JW. Pathophysiology of spasticity and clinical experience with baclofen. En: R.G. Feldman, R.R. Young, W.P. Koella, (editors). Spasticity: Disordered Motor Control. 1ra Edición. Year Book Medical. Chicago, IL 1980. pp 185-203. [ Links ]
21.- Davidoff RA. Antispasticity drugs: mechanism of action. Ann Neurol 1985; 17:107-116. [ Links ]
22.- Burchiel KJ, Hsu FPK. Pain and spasticity after spinal cord injury. Spine 2001; 26:S146-60. [ Links ]
23.- Olsson MC, Kruger M, Meyer LH, Ahnlund L, Granberg L, Linke WA, Larsson L. Fibre type-specific increase in passive muscle tension in spinal-cord injured subjets with spasticity. J Physiol 2006; 577: 339-352. [ Links ]
24.- Dietz V, Quintern J, Berger W. Electrophysiological studies of gait in spasticity and rigidity. Evidence that altered mechanical properties of muscle contributes to hypertonia. Brain 1981; 104: 431-439. [ Links ]
25- Dietz V, Berger W. Cerebral Palsy and muscle transformation. Dev Med Child Neurol 1995;37: 180-184. [ Links ]
26.- Huschmidt A, Mauritz KH. Chronic transformation of muscle in spasticity: a peripheral contribution to increased tone. J Neurol Neurosurg Psychiatry 1985;48: 676-685. [ Links ]
27.- Driscoll M, Blyum L. The presence of physiological stress shielding in the degenerative cycle of musculoskeletal disorders. J Bodywork & Mov Ther 2011;15(3): 335-342. [ Links ]
28.- Marbini A, Ferrari A, Cioni G, Bellanova M F, Fusco C, Gemignani F. Immunohistochemical study of muscle biopsy in children with cerebral palsy. Brain Dev 2002; 24:63-66. [ Links ]
29.- Trust JP, Dunn ME, Krach LE, Langerak NG, Novachek TF, Schwartz MH. Treatment of spasticity with selective dorsal rhizotomy. En: R. Gage, M. Schwartz, S. Koop, T. Novacheck, (editores). The identification and treatment of gait problems in Cerebral Palsy. 2da Edición. Mac Keith Press. Londres 2009, pp. 397-428. [ Links ]
30.- Fukuhara T1, Nakatsu D, Namba Y, Yamadori I. Histological evidence of intraoperative monitoring efficacy in selective dorsal rhizotomy. Childs Nerv Syst 2011;27(9):1453-1458. [ Links ]
31.- OBrien DF, Park TS, Puglisi JA, Collins DR, Leuthardt EC. Effect of selective dorsal rhizotomy on need for orthopedic surgery for spastic quadriplegic cerebral palsy: long-term outcome analysis in relation to age. J Neurosurg 2004; 101 (1 Suppl): 59–63. [ Links ]
32.- Donncha F. O'Brien, M.D., Tae Sung Park, M.D. A Review of Orthopedic Surgeries After Selective Dorsal Rhizotomy. Neurosurg Focus 2006;21(2):1-8. [ Links ]
33.- Lee KC, Carson L, Kinnin E, Patterson V (1989) The Ashworth Scale: a reliable and reproducible method of measuring spasticity. J Neurorehabil 1989; 3: 205-209. [ Links ]
34.- Nazar GB, Linden RD, Badenhausen W. The role of funtional dorsal rrhizotomy for the treatment of children with spastic cerebral palsy. J Ky Med Assoc 1990; 88: 483-487. [ Links ]
35.- Sanger TD, Delgado MR, Gaebler-Spira D, Hallett M, Mink JW. Classification and definition of disorders causing hypertonia in chilhood. Pediatric 2003;111: 89-97. [ Links ]
36.- Sanger TD, Chen D, Delgado MR, Gaebler-Spira D, Hallet M, Mink JW. Taskforce on Childhood Motor Disorder Definition and classification of negative motor sings in childhood. Pediatr 2006; 118: 2159-2167. [ Links ]
37.- Buckon CE, Thomas S, Harris GE, Piatt JH jr, Aiona MD, Sussman MD. Objetive measurement of muscle strength in children with spastic diplegia after selective dorsal rhizotomy. Arch Phys Med Rehabil 2002; 83: 454-460. [ Links ]
38.- Schwartz MH, Koop SE, Bourke JL, Baker R. A nondimensional normalization scheme for oxygen utilization data. Gait Posture 2006; 24: 14-22. [ Links ]
39.- Schwartz MH. Protocol changes can improve the reliability of net cost data. Gait Posture 2007; 26: 494-500. [ Links ]