Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Obstetricia y Ginecología de Venezuela
versión impresa ISSN 0048-7732
Rev Obstet Ginecol Venez v.71 n.4 Caracas dic. 2011
Manifestaciones dermatológicas del síndrome de ovario poliquístico
Drs. Nelson Velásquez*, Marianela Fernández**, Noramaika Briñez***
* Profesor Titular de La Universidad del Zulia, Zulia, Venezuela.
** Médico Especialista en Obstetricia y Ginecología, Profesora Agregada de La Universidad del Zulia, Zulia, Venezuela.
*** Médica Residente de Posgrado de Obstetricia y Ginecología, Hospital Chiquinquirá de Maracaibo. Zulia, Venezuela.
La piel, junto al endotelio y al tejido adiposo representan los órganos endocrinos más extensos del organismo humano. Constituye el 15 % del peso total del cuerpo; su estructura celular es heterogénea. Comprende células de rápida proliferación, como las queratinizantes epidérmicas y las del folículo piloso, glándulas sebáceas que sintetizan lípidos, células productoras de pigmentos o melanina y la dermis que se encarga de la producción de tejido fibroso y sustancias de sostén. Cada una de ellas tiene un patrón metabólico único y están dotadas de una gran actividad bioquímica.
Desde hace mucho se conoce que las hormonas gonadales juegan papel importante en el desarrollo de los caracteres sexuales secundarios por sus influencias sobre el crecimiento del pelo, la actividad de las glándulas sebáceas y el metabolismo de esteroides locales (1).
En el clásico cuadro descrito en 1935 de 7 mujeres jóvenes con oligomenorrea o amenorrea, 4 de ellas obesas, 5 hirsutas (una obesa) y una delgada con acné, todas tenían ovarios grandes y manifestaciones clínicas y bioquímicas de hiperandrogenismo. Tal asociación fue y sigue siendo conocido como síndrome de ovario poliquístico (SOP) o de Stein-Leventhal (2). Modernamente ha sido considerado como una entidad muy heterogénea porque varía en su forma de presentación clínica, bioquímica y endocrina. La apariencia ecográfica de los ovarios también es variable y se caracterizan por tener un volumen mayor de 7,5 mL; aunque el Consenso de Rotterdam estableció un volumen superior a 10 mL o la presencia de 12 o más folículos con diámetros entre 2 y 9 mm en la periferia del ovario (3).
La morfología ovárica de apariencia multiquística no es única del SOP, ha sido documentada en niñas y adolescentes, puede ser encontrada en 16 %-25 % de mujeres con ciclos menstruales regulares (4), en menopáusicas (5) y en raros casos de hipogonadismo hipogonadotrópico (6). Este tipo de eventos no se asocia a resistencia a la insulina (IR) y el tratamiento debe ser dirigido a evitar las complicaciones que a largo tiempo se asocian a la anovulación, más que a prevenir las consecuencias metabólicas que ocasiona la IR (7).
Aunque los motivos de consulta al ginecólogo o endocrinólogo de las pacientes con SOP lo constituyen los trastornos menstruales, el deseo de embarazo o el hirsutismo, el aspecto más importante del síndrome lo constituye el riesgo metabólico al cual predispone la enfermedad: hiperinsulinemia, resistencia a la insulina, riesgo de diabetes mellitus tipo 2 en edad temprana, apnea del sueño, o eventos cardiovasculares y riesgo de muerte temprana. El hirsutismo y la acantosis nigricans (AN) como expresión del hiperandrogenismo, junto a la obesidad son expresiones de IR y algunos estudios han demostrado con la escala o score de Ferriman Gallwey (8) que el hirsutismo se asocia a insulinorresistencia, aun cuando los niveles de testosterona libre no lo estén, es decir el grado de hiperandrogenemia no refleja el hirsutismo; lo que puede explicarse por las variaciones cíclicas (horaria) de los niveles plasmáticos de andrógenos y, una muestra de sangre, extraída al azar, con niveles normales o bajos de andrógenos, puede no corresponder a la magnitud de la manifestación clínica. En este sentido el estudio de Fog Svendsen y col. (7) de Dinamarca demostró que el índice de masa corporal (IMC), la hiperandrogenemia y el hirsutismo son fuertes predictores de IR cuando se evalúa por el clamp hiperinsulinémico euglicémico y que el IMC y las concentraciones libres o totales de testosterona son los más fuertes predictores de insulinorresistencia, evaluados mediante un modelo matemático que explora las características homeostáticas de un sistema metabólico para estimar el grado de sensibilidad insulínica, mejor conocido como HOMA (6).
Con respecto a la etiología, también es heterogénea; se han descrito factores genéticos que se asocian a ambientales, o alteraciones bioquímicas tipo disrregulación enzimática, neuroendocrinas, endocrino-paracrinas (hiperandrogenismo e hiperinsulinismo, factores de crecimiento y otros) (9). Como se puede observar, en la antigua narración, las pacientes cursaban con manifestaciones cutáneas como el exceso de grasa (obesidad), y una de ellas aunque delgada, presentaba acné; en las otras, la expresión del hiperandrogenismo estaba representada por el exceso de vello sexual.
El objeto de esta comunicación es hacer una revisión actualizada de las manifestaciones dermatológicas que se presentan en el cuadro descrito por Stein y Leventhal hace más de setenta años.
PIEL GRASA, SEBORREA
La unidad pilosebácea está constituida por la glándula sebácea, el folículo piloso y el músculo erector; se extiende por toda la superficie corporal, excepto la palma de las manos y las plantas de los pies. La primera produce sebo, que representa un protector para pelos y plumas en los animales y en el humano conforma un manto lipídico con detritus celulares, microorganismos y sudor que da protección y emoliencia a la piel y el olor característico que participa en la comunicación química. Los andrógenos, otras hormonas y probablemente el influjo de las fibrillas nerviosas que rodean a los acinos glandulares, así como algunas drogas estimulan su producción; probablemente el sudor, la dieta y la temperatura tengan participación, pero la influencia genética es clara, debido a la mayor o menor captación de andrógenos por la unidad pilosebácea (10). Por su parte, el folículo piloso se desarrolla entre las 8-10 semanas de gestación como un derivado de la epidermis e inicialmente se compone de una columna de células que proliferan desde la capa basal de la epidermis y protruye hacia la dermis y a medida que se alarga, encuentra un acúmulo de células mesodérmicas (papila dérmica) que las envuelve con la formación de un bulbo. Esta sólida columna epitelial se hunde para formar un canal piloso y el aparato pilosebáceo. Un pequeño músculo, el erector del pelo, se inserta oblicuamente en la papila dérmica y cumple una función de defensa; al contraerse por estímulos internos o externos provoca el vaciamiento de la glándula sebácea ocasionando lubricación de la superficie cutánea para la protección de golpes o rasgaduras. Su contracción, además, eleva el pelo produciendo lo que comúnmente se llama piel de gallina (11).
Más de la mitad del sebo de los humanos está constituido por triglicéridos y ácidos grasos libres. La glándula produce ésteres grasos, escualeno, triglicéridos, mono y diglicéridos, glicerol, colesterol y ésteres; la dermis produce triglicéridos, ácidos grasos libres y colesterol y se cree que la presencia de los ácidos grasos libres en la superficie se deba a la hidrólisis de los triglicéridos por las bacterias de la microflora folicular, la cual está colonizada por Propionibacterium (Corinebacterium) acnes (P. acnes), Propionibacterium granulosusm, Estafilococo no aureus, Micrococus, Corineformes, Microsporun furfur, Propionibacterium bacteriófago y Malasseia; mientras que en la superficie se encuentran Microaerofilicus, anaerobios facultativos y aerobios (10,12,13).
La mayoría de las glándulas sebáceas vierten su secreción en la abertura del folículo piloso, muy pocas desembocan libremente en la superficie cutánea. Son holocrinas, es decir, el sebo se produce por desintegración de células completas, las cuales se renuevan constantemente. Son abundantes después del nacimiento y van disminuyendo paulatinamente; en ambos sexos la cantidad de grasa aumenta entre 8-17 años de edad y vuelve a disminuir, en el hombre a los 40 y en las mujeres a los 25 años. La secreción de sebo es estimulada por la testosterona y sustancias relacionadas e inhibida por estrógenos y algunos retinoides (14,15).
La cantidad de grasa de la piel es generalmente escalonada en forma descendente: cuero cabelludo y frente, rostro (mejilla, nariz) región dorsal y torácica (principalmente en la parte central), axilas, cuello, pubis, abdomen, antebrazos, piernas, dorso de las manos y región maleolar. La grasa de planta de los pies y palma de las manos suele llegar por continuidad y contacto de otras regiones ya que estas zonas carecen de glándulas sebáceas. En condiciones similares de clima y región, la cantidad de grasa es sorprendentemente constante en los individuos, pero la producción es diferente en cada persona. La extensión de grasa cutánea es variable, pudiendo alcanzar hasta 3 cm/seg, según la temperatura externa (14).
La seborrea suele ser definida como un aumento patológico de las secreciones de las glándulas sebáceas de la piel, como una hiperproducción de sebo, cuya expresión clínica es variable, desde la presencia de un cutis brillante hasta la aparición de escamo-costras, untuosas amarillentas, sobre base eritematosa que se localiza en cabeza o cara, principalmente (16).
Estas manifestaciones tienen su explicación desde el punto de vista endocrinológico, ya que se conoce con bastante exactitud la acción de las hormonas androgénicas sobre las células productoras de grasa o sebocitos.
En este complejo síndrome de poliquistosis ovárica, se ha observado, sobre todo en las más jóvenes, que al interrogatorio minucioso manifiestan formas leves de expresión de la acción de los andrógenos, como lo es la piel grasosa, sobre todo en la cara; o como un singular uso de shampoo para cabello graso y seborrea (17).
Los andrógenos se producen en el organismo humano en 4 sitios principalmente: los ovarios en la mujer, los testículos en los hombres, en las glándulas suprarrenales de ambos y también como consecuencia de la conversión periférica de androstenodiona y de la dehidroepiandrosterona a través de un intermediario que es el delta-5 androstenodiol, andrógeno débil, cuyos niveles en las mujeres normales duplican a los de testosterona, y en la hirsuta lo triplican. Esta conversión periférica se produce en áreas extraesplácnicas no glandulares, de las cuales, la piel es su mejor representante (18).
La frecuencia de la piel grasosa en SOP ha sido rara vez expresada en la bibliografía médica, pero según Ablan y col. (18) es alta, representando el inicio de la acción androgénica.
ACNÉ
En un sentido amplio el acné se define como diversas afecciones del folículo sebáceo, caracterizadas por alteraciones secretorias y de la queratinización, con inflamación y subsecuente cicatrización (19). Piquero-Martín (10) lo define como una enfermedad multifactorial donde está involucrada la unidad pilosebácea y se manifiesta clínicamente por la aparición de comedones, pápulas, pústulas, nódulos, quistes y abscesos que pueden dejar como residuo cicatrices. La primera alteración microscópica es la hiperqueratosis intrafolicular, que bloquea el folículo pilosebáceo, con la formación del comedón que contiene sebo, queratina y microorganismos, particularmente el P. acnes, cuyas lipasas descomponen los triglicéridos del sebo para formar ácidos grasos libres que son irritantes de la pared folicular. La retención de las secreciones sebáceas y la dilatación del folículo, pueden dar lugar a la formación de quistes, que al romperse liberan ácidos grasos con reacción inflamatoria que curan con cicatrización.
Junto con el hirsutismo y la seborrea constituye un problema cosmético, con grados variables de severidad, relacionados a factores étnico/raciales y diferencias individuales en el metabolismo y tejidos receptores de andrógenos. Aunque mucho se ha dicho sobre factores dietéticos, no se ha podido establecer una estrecha relación entre ambas.
El acné ha sido considerado una enfermedad de la civilización occidental. Cordain y col. (20) después de observar a las comunidades de Kitavan en Nueva Guinea y de Aché en Paraguay durante 843 días continuos, no lograron observar la aparición de acné en estas poblaciones. Esta observación realza la tesis de que en su aparición influyen la genética y el medio ambiente y aunque la influencia de factores dietéticos es dudosa, el mismo grupo consideró recientemente, que ciertas dietas actúan aumentado la proliferación de los queratinocitos basales dentro del ducto pilosebáceo, causando incompleta separación del corneocito ductal de uno a otro, dañando la apoptosis y subsecuente obstrucción del conducto pilosebáceo, o que pueden aumentar la producción de andrógenos y del sebo, la colonización de los comedones por P. acne o causar inflamación dentro y en las adyacencias de los comedones (21). Ya Burkhart y col., en 2003 (22) habían llamado la atención de que la IL 1a, pudiera intervenir en la conformación del infundíbulo, así como en la respuesta inflamatoria, influyendo en la producción del factor de crecimiento vascular endotelial en las células de la papila dérmica y del queratinocito en la unidad pilosebácea.
La causa del acné en SOP está relacionada con el incremento de los andrógenos y el 60 % aproximadamente de las mujeres que los presentan normales en plasma, tienen incremento en la actividad de la 5-alfa-reductasa en la unidad pilosebácea, beneficiándose del tratamiento antiandrogénico (11).
La frecuencia de esta afección en la población general es variable; para algunos es del 75 %, considerándolo como un signo de inicio puberal normal, asociado a un aumento en la secreción de dehidroepiandrosterona o su sulfato que son producidos casi exclusivamente por las suprarrenales (23, 24). Piquero reportó (10) que un grupo de jóvenes de 11-22 años que acudió a un hospital público y a uno privado fue entre 32 % y 42 %, respectivamente.
Como acompañante en el SOP, Balen y col. (25) lo consiguen en 38 % y Frank, (26) en el mismo año, lo encontró en rango similar de 35 %.
Es muy importante notar que la obesidad empeora la hiperandrogenemia y la anovulación crónica. La prevalencia de obesidad en pacientes con SOP es mayor que en la población general, la de SOP es mayor en las que cursan con sobrepeso y obesas que en las delgadas (27); sin embargo, en la población asiática, las mujeres con SOP obesas no tienen más hirsutismo y/o acné que las no obesas con SOP, por lo que debería investigarse si los mismos hallazgos se repiten en otras latitudes; de haber similitud podría excluirse diferencias raciales el diagnóstico del SOP (28). En un análisis muy reciente de 716 mujeres con síndrome de ovario poliquístico, Huang y col. (29) encontraron que el 14,5 % eran obesas.
En 1982, Orfanos (30) introdujo el término síndrome SAHA, seborrea-acné-hirsutismoalopecia para la ocurrencia de signos cutáneos andrógenos- dependientes en las mujeres. La seborrea es la primera en aparecer, casi inmediatamente surge el acné y después el hirsutismo y la alopecia (31).
El acné vulgar ha sido clasificado según el rango de afectación, atendiendo al número y extensión de las lesiones. En el año 1990, la Academia Americana de Dermatología lo clasificó en grados de severidad. La misma Conferencia concluyó que no era posible establecer una definición estrictamente cuantitativa y se insistió en valorar otros factores adicionales como la ocupación del paciente, circunstancias psicosociales y la respuesta al tratamiento (32).
Una de las formas de medirlo es la escala de Leeds (33); pero la mayoría de los médicos lo hacen más fácilmente categorizándolo de: suave si son pocos comedones cerrados, algunas pápulas y pústulas; el moderado donde son más frecuentes las pápulas y pústulas pero con cicatrices suaves y el severo todas las formas con abscesos nodulares que han conducido a extensas áreas de cicatrizaciones, algunas de ellas pueden ser queloideas (34).
HIRSUTISMO
En las sociedades occidentales, el vello excesivo en mujeres es prácticamente inaceptable; pero lo que es excesivo es muy subjetivo y puede ser desde una pequeña porción en el labio superior a una gran barba con patrón masculino. El vello en exceso puede constituir una patología muy benigna; pero puede causar en las portadoras implicaciones psicológicas que no pueden ser despreciadas, se sienten poco femeninas y atractivas lo que hace perder su autoestima y dificulta la interacción social. Es un problema cosmético por sutiles incrementos de los andrógenos que provienen de ovarios, suprarrenales o fuentes extra esplácnicas (35).
El hirsutismo se ha tratado de definir de muchas maneras: exceso de vello, crecimiento exagerado del pelo o tan simple como mucho pelo. Ablan y col. (18) lo definen como la sustitución anormal del vello sexual femenino por pelo terminal en los mismos sitios en los cuales ocurre normalmente en el hombre después de la pubertad: labio superior, mentón, mejillas, cuello, región intermamaria, periareolar, postero-superior del tórax, supra e infraumbilical, cara interna de los muslos y región sacra; es decir, la distribución es generalmente en la línea media, donde el desarrollo de los folículos de la mujer, depende de la estimulación androgénica.
Una forma más exagerada de hiperandrogenismo es la llamada hipertecosis, tecosis, tecomatosis o luteinización difusa del estroma ovárico (36); descrita por Fraenkel en 1943, de presentación familiar, estrechamente relacionada con SOP con aumento de ambos ovarios por hiperplasia circunscrita o difusa de las células tecales, con luteinización amplia del estroma de la corteza y represión folicular. Con frecuencia presentan virilización con hirsutismo, a consecuencia de la producción aumentada de andrógenos y androstenodiona en las células tecales luteínicas (19). La histología demuestra que la hiperplasia de las células de la teca se encuentra entre los pequeños folículos atrésicos, a diferencia del SOP en los que múltiples folículos de diferentes tamaños están en la periferia del ovario y hay poco estroma luteinizado. Es considerada una variante del SOP y existen niveles bajos de la hormona estimulante del folículo (FSH) y la luteinizante (LH), debido a que los altos de andrógenos inhiben a la glándula hipofisaria.
Un aspecto diferente lo constituye la llamada hipertricosis que se define como el aumento del vello corporal, tipo lanugo de una manera generalizada en cualquier área no sexual incluyendo región periorbitaria y brazos. Es un proceso que no depende de hormonas sexuales, sino de factores étnicos y raciales, se asocia a uso de drogas y malignidades, puede presentarse en algunas mujeres con anorexia nerviosa (11).
La hipertricosis puede ser hereditaria y en algunos casos se ha transmitido un revestimiento piloso parecido a la piel de un animal; este cuadro ha sido plasmado por famosos artistas en dibujos o fotografías por ejemplo los cuadros de Charles Eisenmann del período de 1887 - 1888 donde describe un niño ruso con cara de perro o la familia peluda de Burma-Moung, madre e hijo, que corresponden a la enfermedad conocida como hipertricosis lanuginosa (37), (Figura 1).
La hipertricosis se observa en casos de uso de esteroides anabolizantes, algunos anticonceptivos y antihipertensivos, tioridacina, fenitoína, diazoxide o minoxidil. Existe una forma nevoide, solitaria o circunscrita como en las porfirias eritropoyéticas, epidermiolisis ampollar, macrogingivitis congénitas, síndrome de Pfaundler-Hurler y el de Cornelia de Lange; también se ha observado con el uso de la inmovilización prolongada con yeso e irritación traumática, en la acromegalia, hipotiroidismo, dermatomiositis, y trisomía E, entre otras (14,15).
Cinco de las 7 mujeres de la clásica descripción de 1935 eran hirsutas (70 %, aproximadamente); entre el 65 %-85 % de todas las mujeres con exceso de andrógenos son diagnosticadas con SOP o hipertecosis (38,39). Una reciente investigación lo reportó en el 72,2 % de las mujeres con SOP (29).
En la mayoría de las jóvenes el hirsutismo se debe a SOP y la anovulación crónica representa el mayor rasgo del SOP, en la cual la pituitaria está altamente sensibilizada a la hormona hipotalámica liberadora de gonadotropinas (Gn-RH), que responde con exagerada liberación pulsátil de LH, con aumento de la amplitud y frecuencia de sus pulsos. Los niveles de LH están tónicamente elevados y la mayoría de las veces existe una relación LH/FSH elevada, a favor de LH. Las altas concentraciones de LH estimulan al ovario para la producción exagerada de andrógenos (androstenodiona y testosterona) en el tejido estromal y luego convertidos en la periferia en estrona y estradiol. Parece que las elevadas concentraciones estrogénicas sensibilizan a la hipófisis a la hormona hipotalámica liberadora de gonadotrofinas (Gn- RH). Los andrógenos disminuyen la producción y concentración de la proteína que une los esteroides sexuales (SHBG) y por tanto, andrógenos y estrógenos libres se incrementan en el plasma (40).
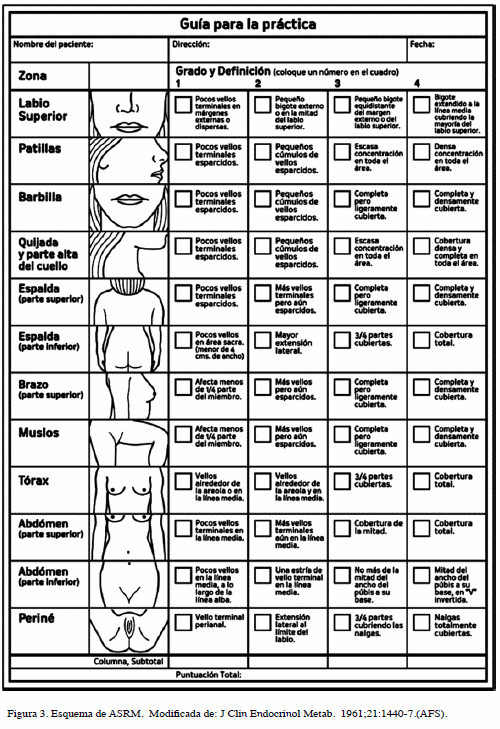
La localización y la cantidad de exceso de vello sexual se evalúan en forma clínica, generalmente con el sistema de Ferriman y Gallwey (8,38) o por variantes como la de Hatch y col. (38). Desde 1995 se ha evaluado el hirsutismo con la modificación propuesta por la Sociedad Americana de Medicina Reproductiva (ASRM) (41). En las Figuras 2 y 3 se presentan dibujos esquemático de estas modalidades.
La exactitud en la valoración del hirsutismo e hiperandrogenismo clínicos, está sujeta a errores, por la gran variabilidad inter-observadores y por la diversidad de etnias (42,43).
No hay acuerdo sobre qué tipos de pruebas deban solicitarse para el diagnóstico; pero hay que descartar patologías graves como los tumores ováricos-suprarrenales y las hiperplasias suprarrenales congénitas y adquiridas. Las imágenes obtenidas por resonancia magnética, tomografías y ecosonografía generalmente localizan las gónadas y las glándulas suprarrenales. Para fines de cribado, debe solicitarse determinación sérica de testosterona, del sulfato de la dehidroepiandrosterona (DHEAS) y 17 α hidroxiprogesterona. Las suprarrenales producen más dehidroepiandrosterona (DHEA) y su sulfato y 17 α hidroxiprogesterona. Cantidades similares de T son producidas por suprarrenales y ovarios; mientras que la androstenodiona es principalmente de origen ovárica. Los niveles de glucurónido de androstenodiol son buenos como marcador de actividad periférica y se elevan en hirsutismo idiopático. Su determinación es costosa y no es recomendada para evaluación rutinaria.
El antígeno específico prostático (PSA) es una serina proteasa, producida por la próstata y usada como marcador tumoral en cáncer prostático. Se ha detectado en mujeres y como el hiperandrogenismo es expresión del gen PSA, se puede esperar que se encuentre aumentado en las hirsutas y se ha correlacionado con los niveles de 3 alfa androstenodilglucurónido (44). En la actualidad su determinación en mujeres no tiene aplicación clínica.
Las pruebas de supresión o estimulación suprarrenal se utilizan cada vez menos en la práctica clínica; pero los niveles de cortisol plasmático en la mañana y en la tarde, así como el cortisol libre urinario de 24 horas, son de valor en el diagnóstico de hipercortisolismo ya que tiene muy pocas falsas positivas (45).
Las neoplasias ováricas generalmente producen más de 200 ng/dL de testosterona total; las suprarrenales producen menor cantidad. Altos niveles de T aumentan la SHBG hepática y la fracción libre de la T puede aumentar en 2 %-3 %. Sin embargo, su determinación es costosa y no añade información útil. Para algunos el nivel de T libre es la prueba más útil, ya que mide la excesiva producción ovárica y la inhibida producción hepática de SHBG. Cuando se le añade la determinación de DHEAS el diagnóstico de hiperandrogenismo se eleva en 14 %. Para otros la determinación aislada de T total sola tiene valor (38,46).
Desde un punto de vista práctico-endocrinológico, si hay incremento de DHEA, DHEAS y cortisol, debe pensarse en patología suprarrenal tumoral que será confirmado por imágenes.
ALOPECIA ANDROGÉNICA
La alopecia androgénica se puede definir como la regresión del pelo del cuero cabelludo, conocido generalmente como calvicie. En el varón no es considerada una enfermedad, se inicia con la aparición de entradas y es inducida por la T (Figura 4).
Se sabe que la mujer está propensa a desarrollar el tipo de patrón masculino de la pérdida del pelo de la cabeza, pero en mucho menor grado que los hombres. La participación de los andrógenos en su génesis ha quedado bien establecida desde 1951, cuando Hamilton (47) evaluó pacientes masculinos pre, peri y pospuberales a quienes se les había castrado y tratado con andrógenos y describió un patron masculino de calvicie, mientras que Ludwig, en 1977 (48) lo diferenciaba de un patrón femenino en la cual no se pierde la línea anterior del pelo, es de más rápida progresión a la calvicie total, sin embargo, hoy se conoce que ambos tipos de alopecia pueden aparecer en hombres y mujeres (49). Hamilton (50) en 1947 describió el caso de unos gemelos idénticos en el que uno de ellos fue castrado en etapa prepuberal y retuvo el pelo de su cabeza completo a los 40 años, mientras que su hermano fue quedando calvo desde la edad de 20 años. El castrado recibió testosterona inyectada y 6 meses después inició la caída del cabello como su hermano, este ejemplo claramente demuestra el potencial genético de la caída del cabello.
La pérdida del cabello en la mujer es estresante y causa morbilidad psicológica, se ha descrito una alta actividad de la 5α-reductasa en los pelos extraídos de la zona alopécica (51). El patrón masculino del pelo es frecuente en mujeres (48,52) cuando aparece en jóvenes debe pensarse en exceso de producción de andrógenos. Es común en la menopausia y está muy relacionada a la historia familiar; debe diferenciarse de la pérdida difusa del cabello que también es común en ambos sexos, pero es independiente de los andrógenos (53).
A diferencia de los andrógenos, los estrógenos prolongan la duración de la fase de anagen o de crecimiento activo del pelo de la cabeza y su exceso hace que mucho cabello entre en telogen o reposo, que en la cara y en cuero cabelludo dura tres meses aproximadamente (53). A veces se dificulta el diagnóstico de alopecia androgénica en una mujer con pérdida del pelo frontal, antecedente de alopecia en hermanos si tienen concentraciones normales de andrógenos en sangre.
Aunque se reporta como hallazgo en SOP, la frecuencia de esta condición no ha sido establecida; González (16), la considera baja, criterio que compartimos. Hay informes sobre la prevalencia de alopecia en SOP que van de 5 % a 50 % y su sola presencia o la pérdida del cabello de las mujeres pudiera ser el único signo dermatológico del SOP (54).
Cuando la pérdida del pelo es excesiva debe sospecharse de tumores ováricos o suprarrenales, benignos o malignos productores de andrógenos, de síndrome o enfermedad de Cushing en lugar del SOP.
Un estudio de 89 paciente con alopecia androgénica demostró apariencia poliquística ovárica en el 67.%, mientras que en controles normales solo fue de 27.% (55), pero las mujeres con alopecia casi siempre presentan hiperandrogenemia. En 109 mujeres premenopáusicas que consultaron por alopecia, el 36,5 % tuvieron SOP, aun cuando no presentaban hirsutismo (56). La escasa correlación que algunos reportan, entre alopecia e hiperandrogenemia bioquímica es, probablemente, porque la sensibilidad de la piel y los folículos varía entre personas (54).
En la mujer evoluciona en forma diferente al hombre, con afectación más difusa del cuero cabelludo, especialmente en las regiones centrales y sobre todo el vértex y además del desarrollo piloso normal se ven otros lanosos pequeños y respeta la región occipital y la frontal (14).
ACANTOSIS NIGRICANS, PAPILOMAS FILIFORMES O ACROCORDONES
Un grado más avanzado del espectro del SOP puede estar constituido por aquellas mujeres que presentan manifestaciones dermatológicas del tipo acantosis nigricans y papilomas filiformes (PF), llamado también acrocordones (a veces se conocen como fibromas blandos o pólipos fibroepiteliales), cuyo grado y severidad son, y se relacionan con hiperinsulinismo e IR con muchas posibilidades de cursar, además del síndrome bioquímico metabólico, con diabetes mellitus tipo 2, hipertensión arterial, accidentes cerebrovasculares, apnea del sueño y muerte súbita. Los PF se presentan con mayor frecuencia en cara anterior del tórax y cuello, generalmente son múltiples y milimétricos, aunque algunos de pocos centímetros se encuentran en región axilar en forma pendular. No es raro verlos en cara y región periorbitaria (Figura 5).
En la literatura anglosajona a veces constituyen lo que se conoce con el nombre de síndrome HAIR-AN cuyas siglas del inglés se refieren a hiperandrogenismo, insulinorresistencia y acantosis nigricans.
El síndrome HAIR AN, no es nuevo, encuadra perfectamente en lo que Achard y Thiers (57) describieron en 1921 en una mujer gorda, barbuda y con diabetes mellitus. Después de múltiples investigaciones esta asociación se ha comprobado y ahora la IR es considerada como manifestación del SOP. Dislipidemia, diabetes y enfermedad cardiovascular se relacionan con mucha frecuencia a IR (58).
La acantosis nigricans (acanto, del griego espina y nigricans, del latín, que reconvierte en negro) es un trastorno dermatológico caracterizado por un aumento de la pigmentación e hipertrofia de la piel, manifestada usualmente por obscurecimiento y endurecimiento de la piel del cuello, axila e ingle (Figura 5). Se asocia frecuentemente a carcinoma de estómago (59-61) y de hecho fue descrita en 1890 con ese mismo nombre en una mujer en la que Pollitzer (60) lo sospechó. La AN ha sido observada en raras ocasiones como una manifestación cutánea paraneoplásica de enfermedades malignas ginecológicas junto a la reticulocitosis multicéntrica, la dermatomiositis, el eritema gyratum repens y el síndrome Sweet (62). Hay tendencia a la producción de pliegues irregulares, son más prominentes en la parte posterior y lateral del cuello, en la nuca, axilas, nudillos, codo, rodillas, región submamaria, área interna de los muslos, vulva, ingle, regiones antecubitales y poplíteas (63). Aparecen primariamente en la nuca y luego progresan a axilas y otras áreas del cuerpo (64) y su presencia en los nudillos de los dedos de los diabéticos es considerado un hallazgo frecuente a veces con apariencia granular (65) (Figura 6).
Se describen tres tipos con hallazgos histológicos similares: hiperqueratosis y papilomatosis intensa con hiperpigmentación generalmente de la capa basal de las células y muy poca acantosis; una forma de genodermatosis que suele observarse en niños, benigna; otra forma tipo maligna en adultos que es la asociada con carcinomatosis abdominal y la otra, la de los obesos o seudoacantosis nigricans (59). Otros han encontrado formaciones papilomatosas extensas en la unión dermo-epidermal, hiperqueratosis con engrosamiento del estrato córneo superficial y leve incremento en los melanocitos (66). La aspereza y engrosamiento cutáneo lo ocasionan la hiperqueratosis y papilomatosis; se ha reportado la presencia de infiltrado de glucosaminoglicanos en la dermis papilar (67) y la tonalidad de la piel se debe en gran parte a un incremento del contenido de queratina en la superficie de la epidermis y hay variabilidad de acuerdo a los grupos étnicos (68).
En la piel de cara superior de los dedos, justo entre las articulaciones aparece ciertas zonas granulares muy pequeñas que algunos los catalogan como piedrecitas o piedritas, pero esta manifestación parece ser más llamativa cuando se ha manifestado la diabetes tipo 2 (65).
El tratamiento de la AN está dirigido fundamentalmente a tratar la causa, aunque se han utilizado, sustancias tópicas como blanqueadores y medicamentos por vía sistémica. Los acrocordones deben ser eliminados médica o quirúrgicamente.
EVALUACIÓN DE LAS MANIFESTACIONES CUTÁNEAS
La extensión de la grasa sobre la superficie cutánea es muy variable, puede ser de hasta 3 cm/ seg, según la temperatura ambiental. La exploración del contenido de la grasa cutánea generalmente es de forma objetiva-subjetiva por parte de la paciente y objetivo por el médico; puede medirse de manera casual, es decir la que se puede extraer de la superficie cutánea sin tratamiento previo planificado; otra forma es medir el valor residual, friccionando con un paño una determinada superficie o evaluarse el contenido de grasa de la piel en 24 h.
Los resultados de estas formas de evaluación son variables porque las grasas cutáneas son transformadas constantemente por el manto de estearasas que tiene la piel; son recomendadas pocas veces y es el juicio clínico del observador y la sugestión de la paciente lo que aporta sentido de cantidad. En ocasiones existe excesiva cantidad de grasa en la cara con la piel seca en las extremidades.
Se han utilizado equipos y métodos como el Sebumeter SM 810 y el Sebufix – Análisis (CK, Colonia), empleados en Alemania. El primero, es el dispositivo de medición de sebo en la piel, cabello y cuero cabelludo, más utilizado con éxito en dermatología y cosmetología, que permite determinar cambios leves del contenido de sebo de la piel. Se basa en la fotometría de puntos de grasa. Una cinta especial se vuelve transparente en contacto con el sebo epidérmico. La transparencia se mide mediante el envío de un haz de luz a través de la cinta que es reflejado por un espejo pequeño que está detrás. Una célula fotoeléctrica mide el nivel de transparencia. La transmisión de la luz representa el contenido en sebo de la superficie evaluada y el resultado es calculado por un microprocesador, mostrándose en la pantalla en forma de μg de sebo/cm2. Dobrev (69) utilizó el Sebufix en voluntarios de ambos sexos, midiendo la actividad de la glándulas sebáceas usando el colector de hoja de metal, y evaluado con una cámara, el Visioscope y un software (SELS), la superficie de la piel. Estos métodos muy sofisticados son poco utilizados, por lo que la bibliografía al respecto es escasa.
En caso de seborrea y piel grasa con acné suele utilizarse lociones o cremas queratolítica y antibióticos preferentemente con base alcohólicas, los mismos que se utilizan en casos graves de acné. Algunos de ellos son: peróxido benzoílo 2,5 %-10 %, una vez al día; ácido azaleico al 20%, 2 veces al día, tretinoína 0,1.%-0,25 % o isotrenoína al 0,05 % diariamente. La clindamicina al 1 %, la eritromicina 2 % con acetato de zinc al 4 % y la tetraciclina 4 % dos veces al día, son antibióticos de uso común. Múltiples cremas, geles y lociones son patrocinadas para el cutis graso, de diversos compuestos a base de surfactantes iónicos, agentes desengrasantes, glicerina, polietileno, cloruro de benzalconio, entre otros; con modalidades de uso variables y que son indicados por especialistas en cosmetología-dermatología, con resultados satisfactorios.
Para obtener una idea sobre la severidad del acné y la evolución postratamiento se ha utilizado la clasificación de Plewig modificada (70), expresándolo como leve, moderado o severo, según el número de lesiones que existan en un área pequeña de la cara o espalda; se aconseja tomar muestras para cultivo y antibiograma de gérmenes Gram positivos y negativos. Es preferible su manejo conjuntamente con dermatologo-cosmetólogo quién indicará aseo de las zonas con jabones neutros y lociones o cremas entre los que figuran el peróxido de benzoilo al 2, 5 %-10.%, queratolítico que tiene propiedad antibacteriana y no induce resistencia de las aeróbicas y la previene cuando se usa combinada con eritromicina tópica (71).
Otro agente que causa alteraciones en la composición de ácidos grasos y lípidos cutáneos utilizada es el ácido azelaico y reduce significativamente la densidad bacteriana folicular (72). Además se han utilizado diversas combinaciones de azufre-resorcinol.
Los antibióticos como tópicos-locales son útiles sobre todo en las resistentes al peróxido benzoílo, afectando el metabolismo del P. acnes. La clindamicina en loción es poco irritante; la tetraciclina es menos efectiva y produce un residuo que puede causar fluorescencia debajo de luz ultravioleta. Una mezcla de clindamicina al 1 % con peróxido de benzoílo al 5 % y un gel de clindamicina al 1 %, son algunas utilizadas en Venezuela. La eritromicina tiene eficiencia similar a la clindamicina y están disponibles en base alcohólicas para piel grasienta (34).
La tretinoína (Retin –A) sigue utilizándose hoy en forma tópica, crema, gel o soluciones, es un agente comedolítico que ablanda los comedones existentes y previene la formación de ellos. Se aplica de noche porque puede degradarse con la luz solar, se absorbe poco y no altera las concentraciones de vitamina A. Hay preparaciones incorporadas a microesponjas que promueve la localización de la droga en los folículos y permite su lenta liberación. Es eficaz la crema o el líquido de tretinoína (ácido retinoico, ácido de vitamina A) al 0,01 % - 0,025 % o el gel de isotretinoina al 0,05 % que tienen efecto comedolítico, cuya aplicación está contraindicada en el embarazo ya que los derivados de la vitamina A ácida están relacionados a daños severos en el feto (34). La respuesta usualmente es entre 6-8 semanas (73).
El adapalena se expende en Venezuela en forma de gel y crema al 0,1 % y 0,3 %, es un derivado sintético del ácido naftoico con actividad parecida a los retinoides, con efecto antiinflamatorio, es menos irritante y menos sensible a la luz solar. Recientemente se ha introducido el tazarot.
Por vía sistémica se recomienda el uso de contraceptivos orales, preferiblemente con progestágenos combinados de efectos antiandrogénicos como son el acetato de ciproterona (AC), de clormanidona y la drospirenona; los androgénicamente neutros se usan con menos frecuencia, por obtenerse menos resultados favorables. Todos actúan como inhibidores gonadotrópicos, que al disminuir la producción esteroidea ovárica, aumentan la síntesis de SHBG, disminuyen también los andrógenos y algunos pueden bloquear a sus receptores, como la clormanidona y drospirenona (74). Por supuesto que si no se desea el embarazo su uso es más que justificado, además que previene el sangrado irregular y evita hiperplasias endometriales.
Hay que tener presente que existen agentes progestacionales sintéticos como el levonorgestrel y la noretiltestosterona que poseen efectos androgenizantes en algunos animales in vivo; sin embargo, cuando se combinan con etinilestradiol (EE) presentan netos efectos antiandrogénicos (75).
Una preparación contraceptiva que contiene 30 μg de EE con 2 mg de acetato de clormanidona, también tiene efectos antiandrogénicos y ha demostrado ser eficaz en acné e hirsutismo (76,77). Igualmente los anticonceptivos que en su composición tienen drospirenona, un derivado de la 17 α-espironolactona, actúan como antagonistas de los receptores de andrógenos y con efecto antimineralocorticoide, también han probado ser útil (78,79). En Europa se ha utilizado el componente progestativo híbrido dienogest, con menos propiedades antiandrogénicas que la ciproterona (80,81).
Después de descartar lesiones tumorales benignas o no, productoras de hirsutismo y acné, y obtener diagnóstico de SOP, el endocrinólogo o ginecólogoendocrinólogo prescribirá tratamiento a base de antibióticos locales o sistémicos, principalmente tetraciclina o sus derivados, entre los que se destacan la minociclina y muy recientemente la limeciclina que es una metilciclina de tetraciclina con efecto antiinflamatorio-antilipasa. La dosis recomendada de este producto para acné es de 300 mg diario, en una o 2 tomas por 10-15 días y luego día por medio hasta 12 semanas Se pueden utilizar la eritromicina, clindamicina o metronidazol, bloqueadores solares y la isotretinoína. Algunos agregan flunarizina, que es un bloqueador selectivo de los canales de calcio y ofrece ayuda para el control de la vasodilatación y eritema del rostro.
Los antibióticos sistémicos se utilizan en grados avanzados de acné y los más útiles han sido la minociclina y la tetraciclina, pero esta debe administrarse lejos de las comidas y sin la ingestión de antiácidos. La eritromicina es menos popular e induce resistencia al P acnes y al Staphilococus epidermidis; el trimetoprin y la doxiciclina pueden ser alternativas. Deben ser utilizados por lo menos por 3 meses antes de concluir que la terapéutica ha fallado.
Los antiandrógenos más utilizados son el acetato de ciproterona y el acetato de clormanidona, componentes de algunos contraceptivos de uso oral, combinado con estrógenos. Cualquier anticonceptivo que actúe inhibiendo FSH y LH, teóricamente puede ser utilizado porque inhibe la producción endocrina de los ovarios. En Europa, America del Sur, y el Caribe se ha utilizado una mezcla de 35 μg de EE + 2 mg de AC o la que contiene 0,05 mg de EE y 2 mg de AC en forma de píldoras diariamente por 21 días en ciclos mensuales, como se usan los anticonceptivos orales (ACO), seguido de una semana libre de medicamento por varios meses, generalmente más de 6. Su uso es aconsejable adyuvante a la vitamina A ácida, y está contraindicada durante la gestación porque produce un cuadro de graves malformaciones fetales denominado síndrome tretinoico o de isotretinoína.
El AC a dosis altas de 50-100 mg iniciándose el 5 día del ciclo, durante 10 días, acompañado de estrógenos o preferiblemente de anticonceptivos combinados de EE con progestágenos antiandrogénicos (ciproterona, 2 mg + EE 35-50 μg) es ampliamente utilizado en el mundo, excepto en EE.UU, para el tratamiento de acentuadas manifestaciones de acné e hirsutismo. De esta forma se evita el sangrado irregular uterino que suele ocurrir cuando se usan agentes progestacionales, solos. Este esquema es muy conocido en Europa con el nombre de Esquema de Hammerstein, acompañado de medidas cosméticas, con resultados bastante aceptables (82,83), remisión o mejoría en más del 80 % de las mujeres, pocos efectos colaterales y su duración debe ser de por lo menos 6 meses. En ocasiones puede exacerbarse la afección en los 2 primeros ciclos y hay que expresárselo a las pacientes.
Las drogas que en su molécula tienen acetatos tienen un paso hepático para que ejerzan su actividad, deben ser utilizadas con precaución y solicitar pruebas de su funcionalismo cada 4-6 meses. El paso por hígado induce aumento de SHBG con menor cantidad de andrógenos libres circulantes, que en realidad son los que ejercen los efectos endocrinos. Por su condición progestacional, la ciproterona inhibe la secreción hipofisaria de FSH y LH con la consecuente caída de la producción ovárica de andrógenos, y además un efecto inhibidor de la producción de las glándulas suprarrenales porque tiene suave efecto glucocorticoide, inhibe la secreción de CRH y ACTH; puede actuar en la reticular suprarrenal modificando leucinas y CHR de origen local (84). Se une al receptor de dihidrotestosterona en el folículo pilosebáceo, impidiendo su acción; es además un potente inhibidor de la 5 alfa reductasa, enzima que trasforma la testosterona en dihidrotestosterona. Cuando se le añade el estrógeno aumenta la efectividad terapéutica porque suprime la secreción androgénica mediada por gonadotrofinas, además de incrementar la SHBG reduciendo la T libre disponible (85,86).
En Norteamérica recientemente se aprobó una combinación anticonceptiva que contiene EE con norgestimato, que puede utilizarse en el tratamiento del acné.
Piquero y col. (87) usaron el acetato de ciproterona en 42 pacientes con acné severo que habían utilizado otros tipos de infructuosos tratamiento, logrando curación en 23 y mejoría en 8, mientras que 2 permanecieron sin cambios. Las 6 pacientes que tenían acné en el pecho y la espalda sanaron. La seborrea curó en 22 pacientes, mejoró a 10 y una persistió sin cambios; de 14 que tenían caspa, 12 mejoraron, a una le disminuyó y la otra no presentó cambios. Fue utilizado entre 6 y 9 meses con alguna terapia local por períodos muy cortos. Obtuvieron un total de 96,9.% de mejoría o curación, con 9 pacientes que hicieron intolerancia al medicamento. En casos de tratamiento de acné e hirsutismo es preferible hablar de remisión y no curación, porque al dejar el tratamiento suelen reaparecer los síntomas cutáneos por lo que deben utilizarse por lo menos 6 meses.
La historia clínica y el examen físico permiten hacer el diagnóstico de los eventos que causan hirsutismo como los virilizantes, el SOP, endocrinopatías y uso de medicamentos androgenizantes. Si el desarrollo del hirsutismo es rápido o hay evidencias de virilización como son, clitoromegalia e incremento de masas musculares, hace sospechar la presencia de un tumor secretante, aunque en algunos casos la aparición es lenta.
La alta frecuencia del SOP, la edad de la paciente, el fenotipo, el síndrome metabólico, la acantosis, irregularidad menstruales hacia la oligo y amenorrea hace sospechar su presencia y preguntar sobre medicamentos es fundamental ya que la mayoría, con excepción del ácido valproico, no elevan el nivel de T.
El índice de Ferriman-Gallwey es suficiente para evaluar el hirsutismo y un valor de 6 o más se considera excesivo, pero en algunas poblaciones pueden ser usados otros sitios del cuerpo ya que Ferriman no toma en cuenta el cuello, patillas y nalgas/periné donde se puede localizar exceso de vello en algunas mujeres. Hassa y col. (88) consideran que se debe incluir áreas de la piel sensible a andrógenos: parte superior del labio, barba, patillas, parte superior del brazo y del tórax, parte superior e inferior del abdomen, parte superior e inferior de la espalda, muslos y nalgas/periné.
El tratamiento depende de los deseos de embarazo, si no se desea la gestación debe ser dirigido a evitar el desarrollo de nuevo pelo, remover el existente y regular el ciclo menstrual, para lo cual puede utilizarse afeitado, depiladores, ceras o electrólisis. Las medidas cosméticas son la piedra angular: el blanqueado o rasurado es suficiente para algunas. La extracción con pinzas, máquinas, ceras calientes o frías, blanqueadores, cremas de hierbas como la sanguisorba officinalis y pimpinela, también se han utilizado; algunos procedimientos de estos son irritantes y dolorosos. Una formulación tópica, utilizada como potencial droga anticancerosa y para la tripanosomiasis o enfermedad del sueño africana, el clorhidrato de eflornitina en crema al 13,9% (vaniqa) fue aprobado en EE.UU recientemente (89) con máximo efecto entre 8-24 semanas y pocos efectos colaterales, actúa inhibiendo la enzima ornitina decarboxilasa, presente en el folículo, responsable en la biosíntesis de poliaminas como la putrescina y espermidina que tienen importancia en la proliferación celular, bloqueándola en el folículo piloso, disminuye el crecimiento del pelo. Existen varios equipos de láser, así como de rayos-lámparas para la reducción o eliminación permanente del pelo.
La electrólisis amerita la colocación de electrodos en los folículos para su destrucción. Tanto el uso del láser como la electrólisis amerita personal entrenado, son caros, doloroso y repetir el procedimiento; son para áreas reducidas y pueden causar reacción local, quemaduras, despigmentación y cicatrices (90).
Cuando la severidad del acné o del hirsutismo es grande, se recomienda utilizar dosis de 100 mg de AC los primeros 10 días del ciclo acompañado de 2 mg de AC con 35 o 50 μg de EE con el fin de regularizar el ciclo menstrual y también de evitar el embarazo si se utiliza la isotretinoína que está absolutamente contraindicada durante la gestación ya que se ha reportado entre 18 %-39 % de anomalías congénitas severas e incompatibles con la vida. El uso tópico (Retin -A) es de baja absorción y no hay evidencias de daño embrionario-fetal (91).
Otros compuestos con actividad antiandrógenica son el finasteride y la flutamida; el primero se expende en Venezuela con los nombres de Propecia® de 1 mg, en tabletas de 5 mg y la segunda en tabletas de 250 mg.
El finasteride es un bloqueador de la actividad de la 5 α-reductasa inhibiendo el paso de T a DHT, que es el andrógeno activo en el folículo piloso; no se une a los receptores androgénico ni tiene efecto en la secreción de T (92). Varios estudios han demostrado su efectividad en el tratamiento del hirsutismo, con pocos efectos colaterales (93-95). Es más efectivo sobre la isoenzima 5 α-alfa-reductasa tipo 2 (hallada en piel genital femenina y próstata en los varones), que sobre el tipo 1 que se encuentra en áreas no genitales y cuero cabelludo. La dosis es de 5 mg diario por 3-12 meses y su aumento no ha demostrado mayor eficacia (96).
Un estudio comparativo entre el uso de la mezcla EE 35 μg y AC 2 mg, solo y en conjunción con 5 mg de finasteride durante un año, demostró que la asociación disminuye en más alto porcentaje el score de Ferriman-Gallwey modificado (97).
La flutamida es un compuesto no esteroideo, que disminuye la DHEA-S por inhibición de la 17 hidroxilasa, 17-20 liasa o disminuyendo el clearence de cortisol y aumentándolo en sangre para que exista un freno en ACTH, inhibiéndose la producción de andrógenos por la zona reticular de las suprarrenales (98). Su metabolito es más potente con media vida más larga, la 2 hidroxiflutamida. La flutamida, carece de efectos estrogénicos, progestativos o glucorticoide.
La espironolactona priva la unión competitiva de la T y DHT a los receptores de andrógenos, además inhibe la 5α reductasa y es un diurético ahorrador de potasio, utilizado en el tratamiento del hirsutismo y del acné (99) y con menor grado de evidencia, en la alopecia androgénica (100). La dosis diaria recomendada es de 100-200 mg/día, aunque han sido utilizadas dosis menores, 25 mg 2 veces al día, en acné con buenos resultados. Los efectos secundarios reportados son irregularidad menstrual, sensibilidad mamaria, letargo, mareos, cefaleas, hipotensión ortostática, hiperpotasemia y disminución de la libido (101,102).
Los agentes sensibilizadores de insulina poseen propiedades endocrinas que pueden mejorar las expresiones de hiperandrogenismo en el SOP; disminuyen los andrógenos, aumentan la concentración de SHBG y disminuyen las concentraciones basales o estimuladas de LH, además de los efectos benéficos en el síndrome metabólico e inducción de la ovulación (103,104). No se consideran drogas de primera línea para el tratamiento de las manifestaciones hiperandrógenicas de la piel del SOP, aun cuando hay estudios evaluando la efectividad en hirsutismo (105,106). La dosis diaria puede llegar a 25-50 mg/día; pero la tolerancia se ve limitada por los trastornos gastrointestinales secundarios y existe el riesgo de acidosis láctica en enfermas renales o hepáticas.
Las tiazolinedionas que actualmente se expenden en el mercado son la pioglitazona y la rosiglitazona que actúan como ligandos selectivos del receptor de la proliferación de los peroxisomas gamma activados o factor de transcripción nuclear PPAR gamma.
Yilmaz y col. (107) lograron comparar la utilidad de 4 mg /día de rosiglitazona con 850 mg 2 veces al día de metformina, en obesas y delgadas con SOP, lográndose mejoría del 39 % en el primer grupo y 19 % en el grupo metformina. Se reporta ganancia de peso, hepatotoxicidad y falla cardíaca congestiva asociado a estos medicamentos (79).
Las mediciones de las concentraciones de DHEA-S, metabolito principal de DHEA, es el método preferible para evaluar producción de andrógenos de las suprarrenales y tradicionalmente se utiliza como marcador suprarrenal de exceso de andrógeno ya que su producción alcanza el 97 %-99 %, es de fácil evaluación y es estable. Se ha encontrado que una proporción de pacientes con SOP tienen exagerada concentración plasmática de DHEA y DHEA-S (108,109), elevación de DHEA-S hasta del 50 % de las mujeres con SOP (55). Con base en esos hallazgos, se ha utilizado la supresión con corticosteroides en casos de hiperactividad adrenocorticotropa (persistencia de elevadas concentraciones de DHEA-S) a dosis nocturnas de 0,25 mg- 0,5 mg de dexametasona diario o interdiario, prednisona 5 mg-10 mg/día o la hidrocortisona a 15 mg diario en tratamiento de acné. Estos preparados son de elección en hiperplasia suprarrenal de expresión tardía (41). Algunos lo utilizan en las mañanas (110).
En una publicación de Carmine y Lobo de 1991 (111) se reportó modesta mejoría, de solo un 20 % con el uso de corticoides, a pesar de reducción significativa de andrógenos plasmáticos, mientras que un grupo en Chile, encontró prolongados períodos de remisión en el hiperandrogenismo funcional suprarrenal (112).
En las pacientes que no responden a la terapia convencional, pueden utilizarse los análogos de Gn- Rh de larga acción; se necesitan de 2-3 meses para observar efecto supresivo androgénico. Hay pocos estudios y casi todos lo han asociado a contraceptivos (112, 113). Se han utilizado el goserelin y el triptorelin, entre otros (114). Los efectos colaterales de oleadas de calor, sequedad vaginal y pérdida ósea que se presentan con estos fármacos pueden ser evitados con la llamada terapia ad back con estrógenos y progesterona adicionado o un contraceptivo de uso oral. Por la pérdida de calcio que producen no se recomiendan por más de 6 meses. Por sus costos elevados y el perfil de efectos secundarios no son de primera línea y se reservan para aquellos hiperandrogenismos de origen ovárico resistentes a otras terapias.
Se han utilizado combinación de corticoides, anticonceptivos, antiandrógenos y sensibilizadores de la insulina con buenos resultados por tiempos variables; pero se enfatiza en que debe ser 6-8 meses. Se recomienda electrólisis para remover los folículos androgenizados desde el momento en que la terapia hormonal ejerza sus efectos supresores. La supresión hormonal debe continuarse indefinidamente, la espironolactona puede disminuirse escalonadamente y luego suprimirse y los glucorticoides administrarse cada 2 días. Los síntomas hiperandrogénicos suelen empeorar en la posmenopausia a menos que se realice ooforectomía bilateral ya que en estas pacientes el beneficio de elevación de SHBG por estrógenos no existe y el ovario menopáusico produce cantidades elevadas de andrógenos (41).
Varias líneas de tratamiento para el hirsutismo o hiperandrogenismo en mujeres se han establecido en EE.UU. La American Society for Reproductive Medicine estableció en 1995 las guías para evaluación y tratamiento de exceso de andrógenos. En el año 2001 la Asociación Americana de Endocrinólogos Clínicos recomendó una de ellas (115). En el año 2002, el Colegio Americano de Obstetricia y Ginecología (116) estableció la suya.
El tratamiento quirúrgico del SOP como la resección en cuña de los ovarios y la reducción estromal con láser, se utiliza para inducir ovulación, pero no tiene cabida para mejorar el hirsutismo; mientras que la ovariectomía bilateral solo sería válida, si la hiperandrogenemia es únicamente de origen ovárico (41).
Para la evaluación de la alopecia androgénica en la mujer debe conocerse cómo se notó la caída, si es espontánea en la almohada en las mañanas, o cuando se lava el cabello o al peinarse o en varias de estas situaciones, si existe historia familiar y si hay rasgos de hirsutismo y virilización. Antecedentes de situaciones de estrés 6-8 meses antes, cirugías y anestesias prolongadas, traumatismos psicológicos, dietas adelgazantes, cirugías gástricas para obesidad, fiebres, exposición a ciertas drogas, embarazo reciente o anticonceptivos orales tiene significación. La malnutrición, deficiencias de hierro, diabetes, enfermedad de Hodgkin, insuficiencia hepática y renal, enfermedades malignas son causas comunes; con menos frecuencia se observa en lupus eritematoso sistémico y sífilis secundaria. El hipopituitarismo, las disfunciones tiroideas, exposición a arsénicos, bismuto, oro, bórax o thalium, se asocian a calvicie (117); igual ocurre con el uso de drogas anticancerosas y las radiaciones, aunque después de los 50 años de edad se pierde pelo de la cabeza en ambos sexos (11,117,118).
Existen medidas objetivas de la pérdida del pelo: una de ellas la que se basa en realizar tracción entre el pulgar y el índice, de esta forma se deben extraer menos de 3 cabellos; se considera anormal si se desprenden 6 o más. En las enfermedades crónicas esta prueba es normal. Otra manera de obtener la muestra por tracción es utilizando una pinza quirúrgica cubierta de goma sobre 50-70 pelos y ejerciendo fuerte tracción, luego el bulbo se observa al microscopio para ver la relación anagen/telogen junto con la medida del diámetro de la flechade encaje. El pelo en fase de anagen es oscuro con diámetro de 0,08 mm, en el telogen el bulbo es ahusado, de diámetro pequeño (0,03 mm) y apariencia amielínica. Normalmente el pelo en fase de telogen es el 10 %-15 % y cuando se extrae más del 25 % se establece el diagnóstico de efluvio, es decir, la pérdida de reposo.
El daño de la cutícula del pelo puede observarse al microscopio y esto ocurre por agentes químicos, tintes, calentamiento, desenrizado; para tomar la muestra se agarran con dedos índice y pulgar unos cabellos y los dedos de la otra mano se deslizan hacia el bulbo que permanece anclado en la piel; si el pelo resiste este movimiento y se arruga es que la cutícula está dañada (119).
Otra forma de medir la pérdida del pelo es con la técnica del enrollado; sosteniendo entre los dedos un grupo de pelos y enrollándolos se logra la impresión del diámetro de anclaje y de la sensibilidad de detectar el pelo que progresará de pelo terminal a pelo velloso; se puede observar la miniaturización del pelo del área afectada. Pueden contarse el número de los pelos perdidos en 7 días consecutivos y se analizan en forma similar a las técnicas de arrancamiento y existe la técnica de mapeo del pelo, dibujando el área de calvicie o pelo denso y observando luego el patrón de pérdida mediante fotografías (117).
Después de descartar las formas no androgénicas de la caída del cabello, la acción terapéutica debe estar dirigida a reducir la acción de los andrógenos y dependiendo de la fuente hormonal estará dirigida la acción, así, la producción ovárica se reduce con ACO antiandrogénicos solo (120) o añadiéndole espironolactona, mientras que los glucocorticoides reducirán la fuente suprarrenal, también solos o combinados con ACO (121).
El tratamiento local estará dirigido a evitar la transformación de T a DHT, es decir, inhibir la 5α reductasa. Con base en que la progesterona es el inhibidor competitivo natural de esta enzima se ha utilizado para disminuir la producción de sebo (122), pero no ha llenado las expectativas en el tratamiento local de la calvicie (117). La espironolactona y el AC aplicado localmente en la piel de la región costovertebral del hámster poseen efectos antiandrogénicos con pocos efectos sistémicos (123).
El minoxidil, comercializado en Venezuela en forma de solución para uso tópico es un potente vasodilatador que fue utilizado para el tratamiento de la hipertensión arterial refractaria, produce como efecto colateral hipertricosis probablemente aumentando la circulación alrededor del folículo, estimulándolo a entrar en fase de anagen o crecimiento, o alterando la acción o el metabolismo de los andrógenos en la raíz del pelo. Existen preparaciones en forma de spray o solución tópica que han confirmado la reversión del pelo velloso a terminal en la alopecia androgénica (124- 126). Se coloca 1 mL -2 mL, 2 veces al día, en el área afectada obteniéndose crecimiento del pelo 3-4 meses de aplicación continua; tiene reacciones generales y locales como mareos, hipotensión, taquicardia, edema e irritación local, eritema, descamación o alérgicas, por lo que no se recomienda usar más de 2 mL de la solución al día. En otros países existen formas de shampoo y de espuma para uso local (127).
En el hombre se aplica el autotrasplante de pelos y la apariencia del pelo trasplantado es similar al natural, pero en las mujeres donde la pérdida del pelo es muy difusa y las áreas de calvicies completas son raras, esta técnica es muy pocas veces indicada (128).
La evaluación de la AN y de los papilomas filiformes es mediante la observación clínica o fotográfica de las lesiones. Varias opciones terapéuticas han sido señaladas para AN; el control de la obesidad y del síndrome metabólico es la base fundamental (129). Se ha utilizado isotretrinoina local o sistémica (130,131) y rayos láser. Ha ocurrido mejoría de las lesiones dérmicas papilomatosas con el uso de metformina oral y colecalciferol (vitamina D3) local (129) cuando se mejora la IR y el peso corporal; lo mismo ha sucedido con el uso de ocreótido a largo plazo (132). Con cualquier modalidad terapéutica debe controlarse el síndrome metabólico y la obesidad para obtener evidencia de mejoría duradera de las lesiones, pero siempre hay tendencia a la reaparición (129,132).
El tratamiento de los papilomas filiformes es la desaparición de ellos mediante métodos físicos (crioterapia, electrocauterización, láser), uso de ácidos y algunas soluciones locales (ácido tricloroacético, salicílico, nitrato de plata, soluciones o geles como el glutaldehido al 5 %-10 % y la cantaridina al 0,7 %. La cantaridina es un compuesto químico venenoso extraído de la desecación de un coleóptero de color verde dorado.
La extirpación quirúrgica con bisturí o tijeras finas con hemostatasia de la base da muy buenos resultados; pero al igual que otros métodos hay tendencia a la reaparición. Tarango-Martínez en México (133) logró curación de un hombre con lesiones papilomatosas múltiples en la cara con la aplicación diaria durante 30 días de 5 fluouracilo al 5% y ácido retinoico al 0,05%.
REFERENCIAS
1. Parker F. Skin and hormones. En: Williams RH, editor. Textbook of endocrinology. 6ª. edición. Filadelfia: W.B Sauders Company; 1981.p.1080-1098. [ Links ]
2. Amenorrhea associated with bilateral polycystic ovarios. Stein IF, Leventhal ML 1935;29:181-191. [ Links ]
3. The Rotterdam ESHRE/ASRM-sponsored PCOS Consensus Working Group. Revised 2003 consensus on diagnostic criteria for policystyc ovary syndrome. Fertil Steril. 2004;81:19-25. [ Links ]
4. Bridges NA, Cooke A, Healy MJ, Hindmarch PC, Brook CG. Standarts for ovarian volumen in chilhood and puberty. Fertil Steril. 1993;60:456-460. [ Links ]
5. Birdsall MA, Farquhar CM. Polycystic ovaries in pre and postmenopausal women. Clin Endocrinol (Oxf). 1996;44:269-276. [ Links ]
6. Velásquez N, Molina-Vílchez R. Ovarios de aspecto poliquístico en pacientes con deficiencia de gonadotrofinas hipofisarias. Rev Obstet Ginecol Venez. 1997;4:265-268. [ Links ]
7. Fog Svendsen P, Madsbad S, Nilas L. The insulinresistant phenotype of polycystic ovary syndrome. Fertil Steril. 2010;94:1052-1058. [ Links ]
8. Ferriman D, Gallwey JD. Clinical assesment of body hair growth in women. J Clin Endocrinol Metab. 1961;21:1440-1447. [ Links ]
9. Angelino de Blanco MC, Febres-Ballestrini F, Molina-Vílchez R, Etiopatogenia del síndrome de ovario poliquístico. En: Bajares de Lilue M, Pizzi R, Velásquez-Maldonado E, editores. Consenso venezolano de Síndrome de Ovario Poliquístico 2007. Caracas: Editorial Ateproca; 2007.p.17-23. [ Links ]
10. Piquero Martín J. Acné. Manejo racional. 2ª edición. Santafé de Bogotá, DC. Panamericana Formas e Impresos S.A; 1995. [ Links ]
11. Speroff L, Glass RH, Kase NG. Clinical Gynecologic Endocrinology and Infertility. 6ª. Edición. Baltimore. Lippincott Williams & Wilkins, editores. Baltimore 1999. [ Links ] 12. Piquero Martín J. Patogenia, generalidades. En: Piquero Martín J, editor. Acné. Manejo racional. 2ª edición. Santafé de Bogotá, DC. Panamericana Formas e Impresos S.A; 1995.p.11-17. [ Links ]
13. Herane H M I. Microbiología de la unidad pilosebácea. En: Piquero Martín J, editor. Acné. Manejo racional. 2ª edición. Santafé de Bogotá, DC. Panamericana Formas e Impresos S.A; 1995.p.43-50. [ Links ]
14. Steigleder GK, editor. Dermatología y venereología. Barcelona: Salvat Editores S.A; 1988. [ Links ]
15. Benson RC, Pernoll ML. En: Handbook of Obstetrics & Gynecology. 9º edición. McGraw-Hill, Inc New York; 1994. [ Links ]
16. González F. Tratamiento del síndrome de ovario poliquístico. Manejo dermatológico. En: Bajares de Lilue M, Pizzi R, Velásquez-Maldonado E, editores. Consenso venezolano de Síndrome de Ovario Poliquístico 2007. Caracas: Editorial Ateproca; 2007.p.80-84. [ Links ]
17. Pardo-Palma RA. Síndrome de ovarios poliquísticos En: Terán-Dávila Y, Febres-Ballestrini F, editores. Endocrinología Ginecológica y Reproducción Humana. Caracas: Editorial Ateproca; 1995. [ Links ]
18. Ablan Candia F, Pardo-Palma RA, Terán-Dávila J, Febres-Ballestrini F. Estados hiperandrógenicos y sus manifestaciones cutáneas: hirsutismo-acné. En: Terán-Dávila Y, Febres-Ballestrini F, editores. Endocrinología Ginecológica y Reproducción Humana. Caracas: Editorial Ateproca; 1995.p.379- 412. [ Links ]
19. Diccionario Pschyrembel de ginecología y Obstetricia. Walter de Gruyter & Co. Berlín. New York; 1988. [ Links ]
20. Cordain L, Linderberg S, Hurtado M, Hill K, Eaton SB, Brand-Miller J. Acne vulgaris: A disease of Western civilizatiom. Arch Dermatol. 2002;138:1584-1590. [ Links ]
21. Cordain L. Implication for the role of diet in acne. Semin Cutan Med Surg. 2005;24:84-91. [ Links ]
22. Burkhart CN, Gottwalald L. Assesment of ethiology agents in acne pathogenesis. Skinmed. 2003:222-228. [ Links ]
23. Lucky AW, Biro FM, Huster GA, Leach AD, Morrison JA, Ratterman J. Acne vulgaris in premenarchal girls. An signo f puberty associated with risisng levels of dehydroepiandrosterone. Arch Dermatol. 1994;130:308-304. [ Links ]
24. Pardo-Palma R. Endocrinología del desarrollo gonadal y puberal. En: Terán-Dávila J, Febres- Ballestrini F, editores. Endocrinología Ginecológica y Reproducción Humana. Caracas: Editorial Ateproca; 1995.p.207-233. [ Links ]
25. Balen A, Conway G, Kaltsas G, Techatrasak K, Manning P, West V, Jacobs H. Policystic ovary syndrome: The spectrum of the disorder in 1741 patiens. Hum Reprod. 1995;10:2107-2111. [ Links ]
26. Frank S. Polycystic ovary syndrome. N Engl J Med. 1995;333:853-861. [ Links ]
27. Martínez-Bermejo E, Luque-Ramírez M, Escobar- Morreales HF. Obesity and the polycystic ovary syndrome. Minerva Endocrinol. 2007;32:129-140. [ Links ]
28. Liou Tsan-Hon, Yang Jen-Huang, Hsieh Ching-Hung, Lee Ching-Yin, Hsu Chun-Sen, Hsu Ming-I. Clinical and biochemical presentations of polycystic ovary syndrome among obese and nonobese women. Fertil Steril. 2009;92:1960-1965. [ Links ]
29. Huang A, Brennan K, Azziz R. Prevalence of hyperandrogenemia in the polycystic ovary syndrome diagnosed by National Institutes of Health 1990 criteria. Feril Steril. 2010;93:1938-1941. [ Links ]
30. Orfanos CE. Antiandrógenos en dermatología. Arch Arg Dermatol. 1982;32(Supl. I):51-55. [ Links ]
31. Camacho F. Acné en el síndrome SAHA. En: Piquero Martín J, editor. Acné. Manejo racional. 2ª edición. Santafé de Bogotá, DC. Panamericana Formas e Impresos S.A; 1995.p.19-33. [ Links ]
32. Ledo Pozueta A, F de Misa R, Pérez B. Acné: Características clínicas. En: Piquero Martín J, editor. Acné. Manejo racional. 2ª edición. Santafé de Bogotá, DC. Panamericana Formas e Impresos S.A; 1995.p.89-103. [ Links ]
33. Burke BM, Cunliffe WJ. The assessment of acne vulgaris- the Leeds technique. Br J Dermatol. 1984;111:83-92. [ Links ]
34. Healy E, Simpsom N. Acne vulgaris. BMJ. 1994;308:831-833. [ Links ]
35. Guess MK, Andrew E, Galgliardi CL, Emmi AM. Hirsutism. En : Decherney AH, Goodwin TM, Natan L, Lufer N, editores. Current diagnosis & treatment Obstetrics & Gynecology. 10 edición. Nueva York: Mc Graw Hill; 2007. pp 937-947. [ Links ]
36. Zárate A, Canales ES, MacGregor C, Castelazo-Ayala L. Endocrinología ginecológica y del embarazo. 2ª edición. México: La prensa Médica Mexicana, SA; 1982. [ Links ]
37. Artistic photographs of malformed people (Monsters of the Gilded Age) En: Kunze J, Nippert I, editores. Genetics and malformations in art. Grosse Verlag Berlin; 1986. [ Links ]
38. Hatch R, Rosenfield RL, Kim MH, Tredway D. Hirsutism: Implications etiology and management. Am J Obstet Gynecol. 1981;140:815. [ Links ]
39. Maroulis GB. Evaluation of hirsutismo and hyperandrogenemia. Fertil Steril. 1981;36:273-305. [ Links ]
40. Jean Emans S, Laufer M R, Goldestein DP. Pediatric and adolescent gynecology. 4ª edición. Filadelfia: Lipincott- Raven Pub; 1998. [ Links ]
41. The evaluation and treatment of androgen excess. Guide for practice. American Society for Reproductive Medicine. Copyright 1995. American Society for Reproductive Medicine. Birmingham, Alabama. [ Links ]
42. Wild RA, Vesely S, Beebe L, Whitsett T, Owen W. Ferriman-Gallwey self-scoring. I. Performance assesment in woman with polycystic ovary syndrome. J Clin Endocrinol Metab. 2005;90:4112-4114. [ Links ]
43. Carmina E, Koyama T, Chang L, Stanczyk FZ, Lobo RA. Does ethnicity influence the prevalence of adrenal hyperandrogenism and insulin resitance in polycystic ovary syndrome?. Am J Obstet Gynecol. 1992;167:1807-1812. [ Links ]
44. Melegos DN, Mala H, Wang C, Stanczyk F, Diamandis Ep. Prostate-specific antigen in females serum, a potencial new maker of androgen excess. J Clin Endocrinol Metab. 1997;82:777-780. [ Links ]
45. Decherney AH, Goodwin TM, Natan L, Lufer N, editores. Current diagnosis & treatment Obstetrics & Gynecology. 10 edición. Nueva York: Mc Graw Hill; 2007.p.937-947. [ Links ]
46. Powell Bl, Haddad L, Bennett A, Garani N, Sovio U, Groves CJ, et al. Analysis of multiple data sets reveals no association between the insulin gen variable Lumber tandem repeat elemet and polycystic ovary syndrome or related traits. J Clin Endocrinol Metab. 2005;90:2988-2993. [ Links ]
47. Hamilton JB. Patterned loss of hair in man: Types and incidente. Ann N Y Acd Sci. 1951;53:708-728. [ Links ]
48. Ludwig E. Classification of the types of androgenetic alopecia (common baldness) ocurring in the female sex. Br J Dermatol. 1977;97:247-254. [ Links ]
49. Barth JH. The live cycle of hair: Normal and abnormal growth patterns. En : Adshi EY, Rock JA, Rosenwaks Z, editores. Reproductive endocrinology, surgery and technology. Filadelfia: Lippincott-RavenPub; 1996.p.1486-1499. [ Links ]
50. Hamilton JB. Male hormone stimulation is prerequisit and incitan in common baldness. Am J Anat. 1947;71:451-480. [ Links ]
51. Schweikert HU, Wilson JD. Regulation of human hair growth by steroid hormones. I. Testosterone metabolismo in isolated Harris. J Clin Endocrinol Metab. 1974;38:811-819. [ Links ]
52. Kasick JM, Bergfeld WF, Steck WD, Gupta MK. Adrenal androgenic femela-pattern alopecia: Sex and hormone and the balding woman. Cleve Clin Q. 1983;50:11-122. [ Links ]
53. Rittmaster RS. Functional hyperandrogenism. En: Adshi EY, Rock JA, Rosenwaks Z, editores. Reproductive endocrinology, surgery and technology. Filadelfia: Lippincott-RavenPub; 1996. p.1401-1520. [ Links ]
54. Azziz R, Carmina E, Dewailly D, Diamanti- Kandarakis E, Escobar-Morreale HF, Futterweit W, et al. The androgen excess and PCOS Society critera for the polycystic ovary syndrome: The Complete Task Force report. Fertil Steril. 2009;91:456-488. [ Links ]
55. Cela E, Robertson C, Rush K, Kousta E, White DM, Wilson H, et al. Prevalence de polycystic ovaries in women with androgenic alopecia. Eur J Endocrinol. 2003;149:439-442. [ Links ]
56. Futterweit W, Dunaif A, Yeh HC, Kingsley P. The prevalence of hiperandrogenism in 109 consecutive female patients with difuse alopecia. J Am Acad Dermatol. 1988;19:831-836. [ Links ]
57. Achard C, Thiers J. Le virilisme pilaire et son association á l¨insuffisance glycotique (diabetes des femmes á barbe. Bull Acad Natl Méd. (Paris) 1921;86:51-56. [ Links ]
58. Dunaif A. Insulin resistance and the polycytic ovary syndrome: Mechanism and implications for pathogenesis. Endocrinol Rev. 1997;18:774-780. [ Links ]
59. Mescon H, Grots IA. Piel. En: Robins SL, editor. Patología estructural y funcional. México: Nueva Editorial Interamericana, SA; 1975.p.1324-1366. [ Links ]
60. Pollitzer S. Acanthosis nigricans: A symptom of a disorder of the abdominal sympatetic. JAMA. 1909;53:1369-1373. [ Links ]
61. Peters EJ, Stuart CA, Prince MJ. Acanthosis nigricans and obesity: Acquired and intrinsic defects in insulin action. Metabolism. 1986;35:807-813. [ Links ]
62. Levine D, Miller S, Al-Dawsari N, Barak O, Gottlie AB. Paraneoplastic dermatoses associated with gynecologic and breast malignancies. Obstet & Gynecol Survey. 2010;65:455-461. [ Links ]
63. Brown J, Winlkelmann RK. Acanthosis nigricans: A study of 90 cases. Medicine. 17:1:33-51. [ Links ]
64. Schwartz RA. Acanthosis nigricans. J Am Acad Dermatol. 1994;31:11-19. [ Links ]
65. Hollister DS, Brodell RT. Finger pebbles. A dermatologic sign of diabetes mellitus. Postgrad Med. 2000;107:209-210. [ Links ]
66. SAS User´s Gide, version 5. 1985. SAS Institute, Cary NC. [ Links ]
67. Van Haeften TW. Glucose tolerante, insulina sensitivity and the Homeostais Model Assesment Method. Diabetes Care. 1998;21(4):673-674. [ Links ]
68. Straus DS. Growth-stimulatory actions of insulina in vitro and in vivo. Endocrin Rev. 1984;5:356-369. [ Links ]
69. Dobrev H. Clinical and instrumental study of the efficacy of a new sebum control cream. J Cosmetic Dermatol. 2007;6:613-618. [ Links ]
70. Plewig G, Klilgman A. Acne. Morphogenesis and treatment. Berlin: Springer-Vertag; 1975. [ Links ]
71. Harkaway KS, McGinley KJ, Foglia AN, Lee W, Fried F, Shalit AR, et al. Antibiotic resistente pattern in coagulase-negative staphylococci after treatment with topical erythromicin, benzoilo peroxide, and combition therapy. Br Dermatol. 1992;126:586-590. [ Links ]
72. Cunliffe WJ, Holland KT. Clinical and laboratory Studies on treatment with 20 % azelaic acid cream for acne. Act Derm Venereol (Stockh). 1989;143(Suppl):31-34. [ Links ]
73. Wyatt EL, Sutter SH, Drake LA. Dermatological pharmacology. En: Hardman JG, Limbird LE, Goodman Gilman A, editores. 10ª edición. The pharmacological basis of therapeutics. Nueva York: McGraw-Hill Med Publ Div; 2001.p.1795-1818. [ Links ]
74. Azziz R, Gay F. The treatment of hyperandrogenic with oral contraceptives. Sem Reprod Endocrinol. 1989;7:246-254. [ Links ]
75. Arowojolu AO, Gallo MF, Lopez LM, Grimes DA, Garner SE. Combined oral contraceptive pills for treatment of acne. Chocrane Database Syst Rev. 2009;8:CD004425. [ Links ]
76. Schramm G, Steffens D. Evaluación de 12 meses del anticonceptivo oral Belara® que contiene ACM. Eficacia, tolerabilidad y propiedades antiandrogénicas. Contraception. 2003;67:305-312. [ Links ]
77. Zahradnik H, Golberg J, Andreas J. Eficacia y seguridad del nuevo anticonceptivo oral antiandrogénico Belara®. Contraception. 1998;57:103-109. [ Links ]
78. Sitruk-Ware R. Pharmacological profile of progestins. Maturitas. 2008;61:151-157. [ Links ]
79. Rivas AM, Vásquez LA, Arredondo MI. Diagnóstico y manejo del síndrome de ovario poliquístico: una perspectiva dermatológica. Rev Asoc Colomb Dermatol. 2010;18:78-90. [ Links ]
80. Rozenbaum H. Pharmacology of progesterone and related compounds: Dydrogesterone and norpregnane derivatives. Menopausal Review. 2001;VI:17-28. [ Links ]
81. Cabrera M, Centeno I. Tratamiento del síndrome de ovario poliquístico. Anticonceptivos orales. En: Bajares de Lilue M, Pizzi R, Velásquez-Maldonado E, editores. Consenso venezolano de Síndrome de Ovario Poliquístico 2007. Caracas: Editorial Ateproca; 2007.p.67-71. [ Links ]
82. Hammerstein J. Use of cyproterone acetate in the treatment of acne, hirsutismo and virilismo. J Steroid Biochem. 1975;6:827-831. [ Links ]
83. Hammerstein J. Possibilities and limits of endocrine therapy. Androgenization in women. En: Hammerstein J, Lachnit-Fixon U, Plewig G, editores. Excerta Medica. 1980:222-238. [ Links ]
84. Ehrhart-Bornstein M, Hinson JP, Borstein SR, Scherbaum WA, Vinson GP. Intraadrenal interactions in the regulation of adrenocortical steroidogenesis- Endocrin Rev. 1998;19:101-143. [ Links ]
85. Newmann F. Pharmacology and potencial use of cyproterone acetate. Horm Metab. 1977;59:903-908. [ Links ]
86. Schirock EA, Schirock ED. Treatment of hirsutismo. Clin Obstet Gynecol. 1991;34:852-863. [ Links ]
87. Piquero Martin J, Acosta H. Uso del acetato de ciproterona en el tratamiento del acné. Med Cut I. L. A. 1982;10:261-266. [ Links ]
88. Hassa H, Tanir HM, Yildirim A, Senses T, Eskalen M, Mutlu FS. The hirsutism scoring system should be population specific. Fertil Steril. 2005;84:778-780. [ Links ]
89. Barna Balfour JA, McClellan K. Topical eflornithine. A J Clin Dermatol. 2001;2:197-201. [ Links ]
90. Rosenfield RL. Hirsutism. N Engl J Med. 2005;353: 2578-2588. [ Links ]
91. Coustan DR, Mochizuki TK. Handbook for prescribing medications duryng pregnancy. 3ª edición. Filadelfia. Lippincott-Raven pu; 1998. [ Links ]
92. Rittmaster RS. Finasteride. New Engl J Med. 1994;330:120-125. [ Links ]
93. Castelo R, Tosi F, Perrone F, Negri C, Muggeo M, Moghetti P. Outcome of long-term treatment with the a 5 α-reductase inhibitor finasteride in idiopathic hirsutismo: Clinical and hormonal effects during a year course of therapy and 1-year follow-up. Fertil Steril. 1996;66:734-740. [ Links ]
94. Moggetti P, Castello R, Mognani CM, Tosi F, Negri C, Armanini D, et al. Clinical and hormonal effects of 5 α-reductase inhibitor finasteride in idiopathic hirsutismo . J Clin Endocrinol Metab. 1994;79:1115- 1121. [ Links ]
95. Bayram F, Müderris II, Sahin Y, Kelestimur F. Finsteride treatment for one year in 35 hirsute patiens. Exp Clin Endocrinol Diabetes. 1998;107:195-197. [ Links ]
96. Conn JJ, Jacobs HS. The clinical management of hirsutismo. Eur J Endocrinol. 1997;136:339-348. [ Links ]
97. Sahin Y, Dilber S, Kelestimur F. Comparison of Diane 35 and Diane 35 plus finasteride in treatment of hirsutismo. Fertil Steril. 2001;75:496-500. [ Links ]
98. Labrie F. Mechanism of action and pure antiandrogen properties of flutamide. Cancer. 1993;72:3816-3827. [ Links ]
99. Brown J, Farquhar C, Lee O, Toomath R, Jepson RG. Spironolactone versus placebo or in combination with steroids for hirsutis and/ or acne. Cocharne Database Syst Rev. 2009;CD000194. [ Links ]
100. Swaw JC. Low dose adjuntive spironolactone in the treatment of acne in women: A retrospective analysis of 85 consecutively treatted patiens. J Am Acad Dermatol. 2000;43:498-502. [ Links ] 101. Clark GR, Thiboutot D. Hormonal therapy for acne. Semin Cut Med Surg. 2008;27:188-196. [ Links ]
102. Thiboutot D. Acne: Hormonal concepts and therapy. Clin Dermatol. 2004;22:419-928. [ Links ]
103. Velázquez EM, Mendoza S, Hamer T, Sosa F, Glueck CJ. Metformin therapy in polycystic ovary syndrome reduces hyperinsulinemia, insulina resistance, hyperndrogenemia, and systolic blood pressure, while facilitating normal menses and pregnancy. Metabolism. 1994;43:647-654. [ Links ]
104. Velázquez Maldonado E. Tratamiento del síndrome de ovario poliquístico. Sensibilizadores de insulina. En: Bajares de Lilue M, Pizzi R, Velásquez-Maldonado E., editores. Consenso venezolano de Síndrome de Ovario Poliquístico 2007. Caracas: Editorial Ateproca; 2007.p.61-66. [ Links ]
105. Kelly CJ, Gordon D. The effect of metformin on hirsutism in polycystic ovary syndrome. Eur J Endocrinol. 2002;147:217-221. [ Links ]
106. Wasniewska M, Arrigo T, Crisafulli G, Lombardo F, Mesina MF, Salzano G, et al. Recovery of acanthosis nigricans under prolongad metformin treatment in an adolescente with normal weight. J Endocrinol Invest. 2009;32:939-940. [ Links ]
107. Yilmaz M, Biri A, Karakoc A, Törtiner F, Bingöl B, Cakir N, et al. The effects of roglitazone and metformine on insulina resistance and serum androgen levels in obese and lean patines with polycystic ovary syndrome. J Endocrinol Invest. 2005;28:1003-1008. [ Links ]
108. Azziz R, Black V, Hines GA, Fox LM, Boots LR. Adrenal androgen excess in the polycystic ovary syndrome: Sensitivity nd responsivity of the hypothalamic-pituitary- adrenal axis. J Clin Endocrinol Metab. 1998;83:2317-2323. [ Links ]
109. Azziz R, Carmina E, Dewailly D, Diamanti- Kandarakis E, Escobar-Morreale HF, Futterweit W, et al. The androgen excess and PCOS Society criteria for the polycystic ovary syndrome: The complete Task Force report. Fertil Steril. 2009;91:456-488. [ Links ]
110. Trakakis E, Loghis C, Kassanos D. Congenital adrenal hyperplasia because of 21- hydroxilase deficiency. A genetic disorder of interest to obstetricians and gynecologists. Obstet & Gynecol Survey. 2009;64:177-1898. [ Links ]
111. Carmine E, Lobo R. Peripheral androgen blockade versus glandular androgen supresion in the treatment of hirsutism. Obstet Gynecol. 1991;78:845-849. [ Links ]
112. Devoto E, Aravena L, Gaete X. Remisión prolongada del hiperandrogenismo femenino después de suspender la terapia con glucorticoides. Rev Med Chile. 1995;123:207-214. [ Links ]
113. Acien P, Mauri M, Gutierrez M. Clinical and hormonal effects of the combination gonadotrophin-releasing hormone agonista plus oral contraceptive pills containig ethinyl- oestradiol (EE) and cyproterone acetate (CPA) vs the EE-CPA pills alone on polycystic ovarian disease-related hyperandrogenism. Hum Reprod. 1997;12:423-429. [ Links ]
114. Rios C K. Uso de análogos de Gn-RH en hirsutismo. En: Cortiñas P, Karame A, Levy A. Pizzi R, editores. Análogos de Gn-RH en patología ginecológica benigna. Venezuela 2008. Imprenta Negrin Central. 2008.p.73-80. [ Links ]
115. Goodman NF, Bledsoe MB, Futterweit W. American Association of Clinical Endocrinologists medical guidelines for clinical practice for the diagnostic and treatment of hyperandrogenic disorders. Endocr Pract. 2001;7:120-134. [ Links ]
116. American College of Obstetricians and Gynecologists. ACOG practice bulletin: Clinical Management guidelines for obstetrician-gynnecologists: Nuber 41, december 2002. Obstet Gynecol. 2002;100:1389- 1402. [ Links ]
117. Herten RH. Nonscarring hair loss disorders: The basis for recognition and treatment. Postgrad Med. 1982;72:231-246.ç [ Links ]
118. Jilson OF. Alopecia. III. Diffuse hair loss (nonscarring). Cutis. 1983;31:465-469. [ Links ]
119. Reid RL, Van Vugt DA. Hair loss in the female. Obstet Gynecol Survey. 1988;43:135-141. [ Links ]
120. Aldride RD. Hair loss. Br Med J. 1984;289:985-989. [ Links ]
121. Given JR. Treatment of hirsutism with spironolactone. Fertil Steril. 1985;43:841-843. [ Links ]
122. Maroulis GB. Evaluation of hirsutism and hyperandrogenemia. Fertil Steril. 11981;36: 273-305. [ Links ]
123. Simpson NB, Bowden PE, Foster RA, Cunliffe WJ. The effect of topically aplied progesterone on sebum excretion rate. Br J Dermatol. 1979;100:687-692. [ Links ]
124. Weissmann A, Bowden J, Frank BL, Horwitz SN, Frost P. Antiandrogenic effects of topically applied spironolactone on the hamster flank organ. Arch Dermatol. 1985;121:57-62. [ Links ]
125. Wester RC, Maiback HI, Guy RH. Minoxidil stimulas cutaneus blood flow in human Baldung scalps: Pharmacodinamics measured by laser Doppler velocimetry and photopulse plethismography. J Invest Dermatol. 1984;82:515-517. [ Links ]
126. Scheinfeld N. A review of hormonal therapy for female pattern (androgenic) alopecia. Dermatol Online. 2008;14:1. [ Links ]
127. Olsen EA, Weiner MS, DeLong ER. Topical minoxidil in early male baldness. J Am Acad Dermatol. 1985;13:185-192. [ Links ]
128. Orentreich N, Durr NP. Biology of scalp hair growth. Clin Plastic Surg. 1982;9:197-205. [ Links ]
129. Hermanns- Le T, Schen A, Piérard GE. Acantosis nigricans associated with insulinoresistence: Pathophysiology and management. Am J Clinical Dermatol. 2004;5:199-203. [ Links ]
130. Katz RA. Treatment of acantosis nigricans with oral isotretinoina. Arch Dermatol. 1980;116:110-111. [ Links ]
131. Darmstadt GL, Yokel BK, Horm TD. Treatment of acantosis nigricans with tretinoin. Arch Dermatol. 1991;127:1139-1140. [ Links ]
132. Luncetta M, Di Mauro M, Le Moli R, Brerrafatos J. Long-term ocreotide treatment reduced hyperinsulinemia, excess body weight and skin lesions in severe obesity with acantosis nigricans. J Endocrinol Invest. 1996;19:699-703. [ Links ]
133. Tarango-Martínez VM, Valderrama Vargas C, Romeo Sánchez C. Tratamiento tópico de verrugas filiformes múltiples en cara con 5 fluorouracilo más ácido retinoico. Med Cutan Iber Lat Am. 2008;36:137-141. [ Links ]