Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Investigación
versión impresa ISSN 1010-2914
Revista de Investigación vol.41 no.90 Caracas abr. 2017
Síntesis de análogos de 7-cloro-N-(3-fenilsustituido)-4- aminoquinolina con posible actividad antineoplásica
Synthesis of 7-chloro-N-(3-phenylsubstituted)-4- aminoquinoline analogs with possible antineoplastic activity
Hégira Ramírez Padilla(1) Jaime Charris (2) Arthur Barazarte (1)
1 Universidad Pedagógica Experimental Libertador – Instituto Pedagógico de Caracas. hegira_01@hotmail.com arthurbarazarte@gmail.com
2 Universidad Central de Venezuela harris.jaime@gmail.com
RESUMEN
Una serie de derivados del 7-cloro-N-(3-fenilsustituido)-4-aminoquinolina fueron sintetizados y evaluados como posibles agentes antineoplásicos, midiendo los efectos citotóxicos en líneas celulares del tipo PC-3 (células tumorales de próstata humana), MCF-7 (adenocarcinoma de mama) y una línea celular no tumoral VERO (constituida por células epiteliales de riñón de mono verde africano) como control. El compuesto más activo fue 7-cloro-N-(3-hidroxifenil)-4-aminoquinolina (1), el cual posee un grupo hidroxilo; sin embargo, el mismo no logró actuar selectivamente sobre las células tumorales y normales. Los derivados fueron caracterizados a través de su punto de fusión y empleando técnicas espectroscópicas (RMN 1H 1D e IR).
Palabras clave: Quinolina; síntesis; cáncer; antineoplásicos
ABSTRACT
A series of 7-chloro-N-(3-phenylsubstituted)-4-aminoquinoline derivatives were synthesized and evaluated as possible antineoplastic agents, measuring cytotoxic effects in PC-3 cell lines (human prostate tumor cells), MCF-7 (breast adenocarcinoma) and a non-tumorigenic VERO cell line (constituted by African green monkey kidney epithelial cells) as a control. The most active compound was 7-chloro-N-(3- hidroxyphenyl)-4-aminoquinoline (1), which has a hydroxyl group; however, it failed to selectively act on tumor and normal cells. The derivatives were characterized by their melting point and employing spectroscopic techniques (1H NMR 1D and IR).
Key words: Quinoline, synthesis, cancer, antineoplastic.
Artículo recibido en junio 2016 y publicado en enero 2017
INTRODUCCIÓN
El cáncer es el nombre que se da a toda una serie de enfermedades relacionadas, en las cuales algunas células del cuerpo se dividen sin control (formando generalmente tumores sólidos) que se diseminan por todo el cuerpo (metástasis), pudiendo llegar a afectar a los órganos vitales y generar con ello la muerte del individuo (Avendaño, 2001). La proliferación descontrolada de estas células, se debe a alteraciones de sus procesos habituales, debido a factores tales como los siguientes: (a) un crecimiento celular elevado debido a la presencia de señales muy activas, un cese del anti-crecimiento debido a una disminución de la capacidad de respuesta a señales de este tipo, y a una alta capacidad de replicación; (b) sobreexpresión de proteínas que inhiben la apoptosis y cese de la expresión de proteínas que inducen a la misma; (c) alta liberación de sustancias al medio, promotoras de la vascularización tan necesaria para el abastecimiento y supervivencia de la célula, que además, le facilita la invasión a otros tejidos y órganos; y (d) desarrollo de mecanismos que permiten la evasión del sistema inmunológico. Estas alteraciones se deben a cambios en los genes que intervienen en el normal desenvolvimiento del ciclo celular: los proto-oncogenes y genes supresores de tumores (ambos encargados de controlar el crecimiento y la división celular) y los genes reparadores del ADN (encargados de arreglar ADN defectuoso). Los cambios sufridos en estos genes, pueden tener su origen en la herencia de los padres, o exposiciones a agentes del ambiente (humo de tabaco, rayos ultravioleta del sol, solventes, etc.) capaces de incidir negativamente en el proceso de duplicación del ADN, generando errores en el mismo (Hardman y otros, 1996)
Esta afección puede ocurrir, prácticamente, en cualquier tipo de células (epiteliales o escamosas) presentes en los tejidos de diferentes órganos del cuerpo. Este hecho ha dado origen al nombre que se le da a cada uno de los diferentes tipos de cánceres que hoy conocemos; de acuerdo al tipo de células donde se origina, se clasifica como: carcinoma, sarcoma, linfoma, leucemia, mieloma, melanoma, etc., y, de acuerdo al órgano donde se originó, se clasifica como cáncer de: pulmón, hígado, piel, seno, próstata, etc. (Solomón y otros, 1999)
El cáncer es una de las enfermedades que no distingue entre raza, sexo ni edad, y posee mayores índices de mortalidad a nivel mundial, ya que cada año se diagnostican más de 10 millones de casos en todo el mundo (Anand, Kunnumakara, y colaboradores, 2008). En Venezuela esta enfermedad ocupa la segunda causa de muerte, luego de las afecciones cardiovasculares; de hecho, cada año diagnostican en el país, aproximadamente 18.000 casos de esta enfermedad (Registro Central de Cáncer del Ministerio del Poder Popular para la Salud, 2009).
Los pacientes que presentan esta afección y que son tratados a tiempo (al detectar la presencia de células cancerosas y previas al desarrollo de la metástasis) manifiestan las mayores probabilidades de supervivencia. Existen varias opciones para el tratamiento del cáncer, entre las que se encuentran: cirugía, terapia hormonal, radioterapia y quimioterapia; llegando a ser más efectiva la combinación de ellas. Sin embargo, estas alternativas todavía se caracterizan por ser fuertes e invasivas y muchas veces no producen resultados favorables. (Anand y otros, 2008)
La quimioterapia refiere al uso de fármacos para destruir las células cancerosas y evitar así, la proliferación de las mismas; esta terapia ha contribuido en gran medida a disminuir la tasa de mortalidad en pacientes afectados por este tipo de enfermedad.
En la actualidad se dispone de una importante cantidad de medicamentos cuyo principio activo fue aislado de fuentes naturales (plantas y animales), o que han sido sintetizados por el hombre; sin embargo, existen dos hechos que atentan contra la utilidad de los mismos: la presencia de células cancerosas que por efecto de una mutación se vuelven resistentes a los fármacos empleados en la actualidad; o, el daño que estos medicamentos ejercen sobre las células sanas, lo que produce efectos secundarios en los pacientes y que suelen ser muy graves. Por ello, se debe dar continuidad a aquellos esfuerzos que permitan el desarrollo de medicamentos más específicos para las células tumorales y reducir de esta manera, los efectos secundarios (Flórez, 2008).
Los estudios realizados con plantas, han dado origen al descubrimiento de compuestos con una amplia actividad biológica; tal es el caso de la Quinina (la cual posee en su estructura el núcleo quinolina) utilizada como compuesto base para la síntesis de nuevos derivados aún más potentes, empleados en la quimioterapia de enfermedades tropicales, como la malaria. Algunos compuestos probados en terapias antimaláricas, también han sido ensayados frente a otros tipos de enfermedades. Cabe destacar, que estudios recientes han demostrado la capacidad de los derivados de quinolina para actuar como agentes antineoplásicos.
Ma y otros (2004) llevaron a cabo la síntesis de dos alcaloides quinazolina-quinolina: la 7-acetilaminoluotonina A y 3-3H-[(quinazolin-4- ona)]quinolina (análogo de la luotonina F). Los compuestos obtenidos, junto con cuatro alcaloides naturales, luotoninas A, B, E, F y el derivado sintético deoxoluotonin F fueron sometidos a pruebas de actividades citotóxicas en células cancerígenas in vitro P-388 (leucemia en ratón) e inhibición de la topoisomerasa II en el ADN, resultando ser activos a estos niveles.
Igualmente Mahajan, y otros (2007) realizaron la síntesis de compuestos derivados de 7-cloroquinolinil tiourea e investigaron su potencial antimalárico y como agente anticancerígeno. Los compuestos probados mostraron actividad de moderada a buena contra la malaria y una actividad moderada frente a las células tumorales HeLa (carcinoma cervical), además, presentaron buenos índices de selectividad entre el parásito y las células tumorales.
Por otro lado, Fernandes, y otros (2009), evaluaron la actividad inhibidora de la primaquina y una serie de derivados de la misma (imidazoquinas), sobre el crecimiento de líneas celulares de cáncer HT- 29 (adenocarcinoma de colon humano), Caco-2 (adenocarcinoma colon-rectal epitelial humano) y MCF-7 (cáncer de seno). La primaquina y dos de los mencionados derivados, resultaron ser significativamente activos contra la línea celular de cáncer de mama humano MCF-7.
Así mismo, Ferrer y otros (2009) realizaron la síntesis de [(7-cloroquinolin-4-il)amino]chalconas y posteriormente fueron evaluados como agentes antimaláricos y a su vez anticancerígenos. Como agentes antimaláricos se observó la acción de estos compuestos en la inhibición de la formación del grupo hemo, la cual resultó ser muy alta en cinco derivados. En el caso de su actividad anticancerígena, las pruebas se realizaron en células tumorales del tipo LNCaP, (cáncer de próstata) presentando 3 de ellos, importantes efectos citotóxicos.
Dada la capacidad que han demostrado los derivados quinolínicos como potenciales agentes quimioterapéuticos, el siguiente trabajo presenta la síntesis de análogos de 7-cloro-N-(3-fenilsustituído)-4-aminoquinolina y la determinación de su posible actividad antineoplásica a través de la evaluación de su potencial como citotóxico frente a dos líneas celulares cancerígenas: la PC-3 (células tumorales de próstata humana), MCF-7 (adenocarcinoma de mama), y además, células sanas VERO (células epiteliales de riñón de mono)
La producción de los análogos de 7-cloro-N-(3-fenilsustituído)-4- aminoquinolina, se fundamentó en una estrategia de síntesis lineal de un paso, que permitiría su obtención a partir de la reacción de sustitución nucleofílica entre 4,7-dicloroquinolina y cuatro anilinas sustituidas que presentan diferentes grupos en la posición 3, tal como se muestra en la figura 1 (Esquema de Síntesis).

MÉTODO
Diseño y Tipo de Investigación
La investigación es un proceso por el cual se intentan solventar problemáticas que afectan al ser humano; el cáncer es una enfermedad que se encuentra latente a nivel mundial, y por tanto, encontrar posibles soluciones para la misma es una forma de cooperar y ampliar lo que se conoce de la enfermedad.
En cuanto al nivel de investigación, este trabajo se enmarca de acuerdo con Arias (1997) dentro del marco de una investigación descriptiva, de diseño cuasiexperimental con un propósito aplicado para contribuir en cierta medida con la resolución del problema antes planteado.
Procedimiento Experimental para la síntesis de los análogos de 7-cloro-N-(3-fenilsustituido) -4-aminoquinolina
En un balón fondo redondo, provisto de un refrigerante y agitación magnética se colocó 1,26 x 10-3 mol de la 4,7-dicloroquinolina y la anilina sustituida, todo previamente disuelto en etanol, la mezcla se calentó a 65 ºC por 1h. Luego, se aumentó la temperatura por 2h a 75 ºC. Aproximadamente, transcurrido este tiempo se adicionó 1 gota de HCl al 37% y la mezcla se dejó agitando a 75 ºC por toda la noche; finalizado el tiempo, el sólido amarillo- verdoso formado se dejó enfriar y en agitación, por tres horas. El sólido se filtró por succión y se lavó con suficiente etanol y éter etílico.
Los puntos de fusión de los compuestos fueron determinados en un aparato Fischer-Johns y no fueron corregidos.
Los espectros de Resonancia Magnética Nuclear Protónica (1H RMN), fueron tomados en un espectrofotómetro JEOL ECLIPSE 270 (270 MHZ). Se utilizó DMSO-d6 como disolvente. El desplazamiento químico (δ) está reportado en ppm, tomando como referencia DMSO como estándar interno. La constante de acoplamiento (J) se expresó en hertz (Hz).
Los espectros de Infrarrojo fueron tomados en un espectrofotómetro Shimadzu modelo 470. Se empleó KBr para la formación de la pastilla. Las bandas de absorción son reportadas en cm-1.
Procedimiento Experimental para la determinación de la actividad biológica de los compuestos sintetizados a través del método colorimétrico XTT
En una placa de microtitulación de 96 pozos (Grado de cultivo de tejidos) que contenía 0,1 mL de medio de cultivo (RPMI) por pozo se sembraron células tumorales de próstata humana (PC-3), adenocarcinoma de mama (MCF-7), y células epiteliales de riñón de mono (VERO). Después de 24 horas de cultivo las células fueron tratadas con los compuestos a ensayar disueltos en dimetilsulfóxido (DMSO), en concentraciones que iban de 5 a 100 mg/mL durante 72 horas. La concentración final del DMSO en el medio fue inferior al 0,2 % a fin de no producir por si solo efectos citotóxicos y no interferir con la determinación colorimétrica. Al término de la incubación, se agregó el XTT (sal sódica de 2,3-bis-(2-metoxi-4-nitro- 5-sulfofenil)-2H-tetrazolio-5-carboxanilida) en cada uno de los pozos de la placa, y se incubó nuevamente por 4 horas a 37 °C. La determinación colorimétrica del formazan formado (producto naranja) se registró a 492nm (SpectraFluor Tecan) (Salamanca, Ruiz, Ticona y Giménez, 2008). Todas las concentraciones de los diferentes compuestos fueron evaluadas por triplicado. A partir de estos valores se determinó la CI50 citotóxicas (Bonilla, Mesón y Cartín, s.f.).
RESULTADOS
La síntesis de los compuestos análogos de 7-cloro-N-(3-fenilsustituido)- 4-aminoquinolina se efectuó en una etapa, a partir de una reacción de sustitución nucleofílica entre 4,7-dicloroquinolina y anilinas sustituidas, tal como se muestra en el figura 1. El mecanismo involucra una reacción de sustitución nucleofílica aromática, en la cual el nucleófilo está representado por las anilinas sustituidas (debido a que presentan el par de electrones disponibles en el nitrógeno). Estas anilinas sustituyen al cloro que se encuentra en la posición cuatro del anillo quinolínico. El mecanismo por el cual se propone que ocurre esta reacción, se muestra en el figura 2.

En esta reacción, es importante agregar una gota de ácido clorhídrico concentrado, ya que el mismo actúa como catalizador de la reacción, al formar un intermediario deficiente de electrones con el núcleo de quinolina, que puede impulsar el ataque del nucleófilo; lo cual resulta importante, debido a que las anilinas son bases débiles, por consiguiente tienen baja disponibilidad electrónica en sus átomos de nitrógeno, lo que los vuelve pobres nucleófilos. Este efecto se muestra en el figura 3. (Wade, 2004).

Los puntos de fusión y porcentajes de rendimiento obtenidos para los compuestos sintetizados, son mostrados a continuación en el cuadro 1.
Cuadro 1. Punto de fusión y Porcentaje de rendimiento de los análogos de 7-cloro-N- (3-fenilsustituido)4-aminoquinolina.
| Compuesto | -R | Punto de Fusión (ºC) obtenido | % de Rendimiento |
| 1 | -OH | 290 | 85,22 |
| 2 | -OMe | 220 | 97,54 |
| 3 | -Me | 249 | 19,54 |
| 4 | -Cl | 225 | 73,60 |
Los análogos obtenidos presentaron puntos de fusión en un rango de 225-290 ºC. Los mismos fueron obtenidos con rendimientos elevados (75%-97%), con la excepción del compuesto 7-cloro-N-(3-metilfenil)-4- aminoquinolina (3), en cuyo caso resultó ser muy bajo (19,74%). Este hecho pudo deberse, a la baja solubilidad del compuesto en el disolvente empleado (etanol), lo cual no fue evidenciado sino al final de la purificación del mismo; y que trajo como consecuencia una disminución real del reactivo en el medio de reacción. Así mismo, otro de los productos que presentó un relativamente bajo rendimiento (73,60%), fue el compuesto 7-cloro-N-(3-clorofenil)-4-aminoquinolina (4). Una posible razón por la cual este compuesto se obtuvo con este rendimiento, es el hecho de que el mismo, fue preparado con una anilina que presentaba en su estructura un átomo de cloro como sustituyente. Es sabido que los átomos más electronegativos que el carbono, disminuyen la densidad electrónica en las cadenas carbonadas que los contienen, como consecuencia de su efecto inductivo de atracción de electrones (efecto inductivo -I). Al encontrarse presente en la anilina empleada, este átomo de cloro atrajo para sí la densidad electrónica del anillo de benceno y del nitrógeno; por lo cual, el grupo amino presentó menor disponibilidad de electrones, lo que pudo reducir su carácter como nucleofílico y disminuir su reactividad en estos tipos de cambios químicos. (Wade, 2004)
Los análogos obtenidos se caracterizaron espectrofotométricamente. En tal sentido, las bandas de absorción de los espectros de Infrarrojo (IR) obtenidos para la serie de análogos, se comparó con los reportados en tablas presentes en la literatura. Los resultados experimentales y los datos presentes en las tablas de elucidación espectral, se muestran a continuación en el cuadro 2.

En general, del análisis de los espectros de Infrarrojo de los derivados obtenidos, evidencian las bandas características más representativas para cada uno de los compuestos sintetizados, en los rangos esperados. Los mismos son atribuibles, tal como destaca la literatura, a frecuencias de enlaces presentes en las diferentes moléculas. Estas son, a saber: las bandas de alargamiento del enlace N-H, para aminas secundarias y aromáticas (3450-3300 cm-1), las bandas de alargamiento del enlace C-H aromático (3080-3020 cm-1) y bandas del enlace C-C aromático (1600- 1475 cm-1). Además, el espectro de cada compuesto presentó bandas de absorción específicas y características de los grupos funcionales que tienen presentes; como son las siguientes: El 7-cloro-N-(3-hidroxifenil)- 4-aminoquinolina (1), presenta una banda ancha de alargamiento O-H (3430 cm-1); El análogo 7-cloro-N-(3-metoxifenil)-4-aminoquinolina (2), presenta una banda de alargamiento del enlace O-CH3 (1243 cm-1); El análogo 7-cloro-N-(3-metilfenil)-4-aminoquinolina (3), presenta una banda de alargamiento del enlace -CH3 (2820 cm-1); y el análogo 7-cloro-N-(3- clorofenil)-4-aminoquinolina (4), presenta una banda de alargamiento del enlace C-Cl (1088 cm-1)
Por otro lado, los compuestos obtenidos también se caracterizaron espectrofotométricamente, empleando la técnica de Espectroscopia de Resonancia Magnética Nuclear de protones (1H RMN). En tal sentido, la posición de las bandas de absorción (desplazamiento químico), los patrones de acoplamiento, y las constantes de acoplamiento presentes en los espectros, se comparó con los datos reportados en la literatura. Los resultados experimentales se muestran a continuación en el cuadro 3.

En el espectro de 1H RMN del análogo 7-cloro-N-(3-hidroxifenil)- 4-aminoquinolina (1), se observa la banda característica de la amina aromática en 11.00 ppm y en este caso en particular se observa un singlete en 9.98 ppm, originado por los protones del grupo hidroxilo (figura 4). En la zona aromática ampliada (figura 5) se presentan las señales características del anillo quinolínico, dobletes para los protones: 2 a 8.52 ppm (J=6,94 Hz), 5 a 8,79 ppm (J=9,15 Hz) y 8 a 8,13 ppm (J=9,15 Hz), y doblete de dobletes para el protón 6 a 7,87 ppm (J=9,15 Hz y J=1,98 Hz), con la diferencia de que el protón 3 no se logra observar con claridad, debido a que la señal se solapa con los protones 2´, 4´, 6´ que aparecen a campo alto en 6.85 ppm. Todo esto debido a la presencia de los grupos hidroxilo y amino quienes aportan electrones por resonancia, aumentando la densidad electrónica y el apantallamiento de los mismos. En el caso del protón 5´, vemos un triplete en 7.36 ppm, dado por la similitud en cuanto a densidad electrónica (ambiente químico) de los protones 6´ y 4´, ocasionado, como se mencionó anteriormente, por el aporte de electrones del grupo hidroxilo y la amina aromática.

Figura 4. Espectro 1H RMN del 7-cloro-N-(3-hidroxifenil)-4-aminoquinolina (1) disuelto en DMSO-d6.

El espectro de 1H RMN del análogo 7-cloro-N-(3-metoxifenil)-4- aminoquinolina (2) presentó el singlete de la amina aromática en 11.04 ppm, y el singlete de los protones pertenecientes al grupo metoxilo en 3.81 ppm (figura 6); ampliando la zona aromática (figura 7) podemos observar nuevamente las bandas características del anillo quinolínico, el doblete del protón número 3 a campo alto (6.86 ppm), acoplado con el protón número 2 que también presenta un doblete a campo más bajo (8.53 ppm), los dobletes de los protones 8 (8.15 ppm) y 5 (8.82 ppm) acoplados con el protón 6, y éste acoplado con ambos para generar un doblete de dobletes (7.88 ppm). Como muestra la figura 7, el protón 5´ generó un triplete a 7.49 ppm y los protones 2´, 4´, 6´ en el anillo de benceno, un multiplete. El triplete se encuentra bien definido, debido a que el grupo metoxilo es un buen donador de electrones por resonancia al igual que la amina, lo que hace que el protón 6´ y el 4´ sean en cuanto a densidad electrónica (ambiente químico) semejantes, permitiendo que el protón 5 se acople con ellos. Por otra parte, debido a este mismo efecto donador de electrones por resonancia del grupo metoxilo y de la amina aromática, los protones 2´, 4´, 6´ se encontraron muy apantallados y su señal se desplazó a campo alto (7.05 ppm), presentando el multiplete el solapamiento de sus señales. Sin embargo, es importante acotar, que el efecto donador de electrones del grupo metoxilo resultó ser menor al del grupo hidroxilo, por lo cual los mencionados protones 2´, 4´ y 6´ se encuentran menos apantallados y su señal se muestra a un campo más bajo, que los correspondientes protones presentes en el derivado hidroxilado (1).


En el espectro de 1H RMN del análogo 7-cloro-N-(3-metilfenil)-4- aminoquinolina (3) se ajustó al patrón de sustitución respectivo (figuras 8 y 9), mostrando un singlete ancho en 11.06 ppm, para el protón de la amina secundaria aromática; por otra parte, se pudo observar un singlete en 2.38 ppm, para los protones del metilo; además, un doblete en 6.78 ppm con una constante de acoplamiento de 6.93 Hz, asignado al protón 3; también, un doblete en 8.50 ppm, con una constante de acoplamiento de 6.93 Hz, asignado al protón 2, el cual se acopla con el protón número 3 (J= 6.93 Hz), apareciendo su señal a un campo más bajo debido a la presencia del nitrógeno, quien lo desapantalla. Así mismo, el protón número 8 mostró señal en 8.17 ppm, con una constante de acoplamiento más pequeña (J=1.85 Hz), debido a la distancia mayor existente entre los protones. Por otro lado, se pudo observar un doblete de dobletes entre 7.85 ppm, asignado al protón 6, con una constante de acoplamiento de 9.03 Hz y 1.85 Hz; así mismo, el protón 5 se muestra en 8.86 ppm, con un doblete que presenta una constante de acoplamiento de 9.03 Hz. Por último, el anillo del benceno mostró un triplete para el protón 5´, debido a la presencia del grupo metilo y la amina aromática, los cuales al dar electrones por efecto inductivo y resonancia, apantallan un poco a los protones 2´, 4´y 6´ haciendo que aparezcan a un campo más alto, y además, generó un ambiente químico algo semejante para los protones 4´ y 6´, permitiendo así, el acoplamiento con el mencionado protón 5´; observamos también un multiplete para los protones 2´, 4´ y 6´, ya que no se pudo observar el desdoblamiento de las señales, debido que las mismas se solaparon (7.26 ppm). Es importante acotar, que el efecto donador de electrones del grupo metilo es todavía menor al del grupo hidroxilo o metoxilo, por lo cual los mencionados protones 2´, 4´ y 6´ se encuentran menos apantallados y su señal se muestra a un campo más bajo, que los correspondientes protones presentes en el derivado hidroxilado (1) o metoxilado (2).170


El espectro de 1H RMN del análogo 7-cloro-N-(3-clorofenil)-4- aminoquinolina (4) (figura 10 y 11) se ajustó al patrón de sustitución respectivo, mostrando un singlete ancho en 11.32 ppm para el protón de la amina secundaria aromática; además, un doblete en 6.89 ppm, con una constante de acoplamiento de 6.93 Hz, asignado al protón 3; también un doblete en 8.57 ppm, con una constante de acoplamiento de 6.93 Hz, asignado al protón 2; el mismo se encuentra hacia campo más bajo debido a la presencia del nitrógeno en el anillo quinolínico; así mismo, la señal del protón número 8 se mostró en 8.22 ppm, con una constante de acoplamiento más pequeña (J=1.86 Mz) debido a la distancia entre él y el protón 6. Por otro lado, se pudo observar un doblete de dobletes en 7.88 ppm, asignado al protón 6, con una constante de acoplamiento de 9.15 Hz y 1.86 Hz; por otra parte la señal del protón 5 se muestra en 8.93 ppm, con un doblete que presenta una constante de acoplamiento de 9.15 Hz. Por último, en el anillo de benceno, el desdoblamiento de las señales de los protones 2´, 4´, 5´, 6´, no se pudo observar ya que las mismas se solaparon en un multiplete (7.56 ppm). Es importante resaltar que el triplete del protón 5´ que se observa en los otros espectros no logró apreciarse, ya que el átomo de cloro presente en el anillo de benceno, hizo que los protones 2´, 4´ y 6´, quedaran más desapantallados, desplazándose su señal al campo más bajo donde se encontraba la señal de protón 5´.


Para determinar la actividad biológica de los compuestos sintetizados como agentes antineoplásicos, se procedió a utilizar el método colorimétrico de XTT, el cual fue desarrollado por primera vez en 1983 por Mosmann, quien utilizó la sal de Tetrazolio 3-(4,5-dimetiltiazol-2-il)-2,5- difeniltetra-zolbromuro (MTT) para determinar la toxicidad y proliferación celular. El anillo tetrazol es roto principalmente por mitocondrias activas, y se piensa que por otras regiones extracelulares con actividad succinato-deshidrogenasa (Bonilla y otros, s.f.), las cuales pueden contribuir a la producción del formazan total, que es el compuesto naranja con el cual se realizan la medición colorimétrica.
El trabajo con MTT requiere de un posterior tratamiento con solventes orgánicos, para así lograr solubilizar el producto de reacción (Formazan), ya que el mismo es insoluble en agua. La utilización de análogos de MTT permiten obviar este paso, por lo cual en la actualidad se emplean compuestos como la sal sódica de XTT (2,3-bis-(2-metoxi- 4-nitro-5-sulfofenil)-2H-tetrazolium-5-carboxanilide), donde a diferencia del primero la forma reducida de este agente (formazan) es soluble en agua, lo que permite realizar el ensayo en un solo paso en un lector de ELISA (espectrofotómetro de rastreo de pozos múltiples) (Salamanca y otros, 2008). Es importante resaltar, que la cantidad de formazan total es proporcional al número de células vivas, por lo que al medir la concentración de formazan en los pozos donde se agreguen los compuestos a ensayar, a diferentes concentraciones, se obtendrá un gráfico que permite estimar el valor de la concentración inhibitoria 50 (CI50).
Los resultados de las pruebas biológicas efectuadas para probar la posible actividad citotóxica de los análogos de 7-cloro-N-(3-fenilsustituido)- 4-aminoquinolina, se presentan en el cuadro 4.
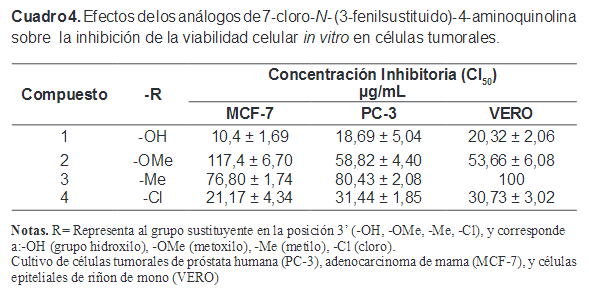
Estos resultados sugieren que el compuesto 7-cloro-N-(3-hidroxifenil)- 4-aminoquinolina (1) y 7-cloro-N-(3-clorofenil)-4-aminoquinolina (4) presentan mayor actividad citotóxica (CI50 por debajo 100 μg/mL), tanto en las células MCF-7 y como en las PC-3. Ambos análogos mostraron actividad a bajas concentraciones en células normales de riñón de mono (VERO), lo que nos indica que los compuestos no son selectivos, y actúan indistintamente en las células cancerígenas y las normales, por lo cual no puede ser utilizado como agente citotóxicos, ya que la relación riesgo-beneficio no es conveniente.
Trabajos realizados por González y otros (s.f.), indican que los derivados de Tiazolo[5,4-b]quinolina, pueden mostrar actividad antineoplásica como intercaladores. Además, que los mencionados derivados ocasionan muerte celular debido a la fragmentación del ADN y a la formación de cuerpos apoptóticos, con lo que se sugiere fuertemente que la muerte celular inducida por estos derivados es del tipo apoptótica.
La formación de complejos por intercalación es reversible, la unión y por tanto estabilidad del complejo droga-ADN, va a estar determinada por las interacciones electrostáticas que pueda formar la droga; estas interacciones, pueden ser del tipo de puente de hidrógeno, Van der Waals e hidrofóbicas. El anillo quinolínico posee anillos aromáticos planos fusionados, y con similares dimensiones al de las parejas de bases nitrogenadas en el ADN, lo que lo vuelve agente indicado para la intercalación con dicha molécula (Avendaño, 1993).
Dada la presencia del anillo de quinolina (plano) en los análogos sintetizados, se podría pensar que su actividad citotóxica, podría atribuirse a la posible habilidad que tendrían estas moléculas para intercalarse con el ADN. En el caso del análogo más activo, 7-cloro-N-(3-hidroxifenil)-4- aminoquinolina (1), la presencia del grupo hidroxilos, le permitiría formar puentes de hidrógeno con las bases nitrogenadas de ADN e intercalarse para así inhibir la replicación de la célula. En el caso del análogo 7-cloro- N-(3-clorofenil)-4-aminoquinolina (4), la presencia del grupo cloro, hace pensar que las interacciones que podría establecer con el ADN, serían más bien del tipo Van der Waals. Sin embargo, en este contexto, se necesitan estudios para elucidar el mecanismo antitumoral que presentan los mencionados compuestos.
Los otros compuestos sintetizados y ensayados presentaron valores de CI50 muy altos, por lo que no pueden utilizarse como agentes anticancerígenos, ya que las dosis a administrar tendrían que ser elevadas, lo que los haría demasiado tóxicos para el organismo.
CONCLUSIONES
En la investigación realizada se logró sintetizar los análogos de 7-cloro- N-(3-fenilsustituido)-4-aminoquinolina a partir de 4,7-dicloroquinolina y anilinas sustituidas mediante una reacción de sustitución nucleofílica aromática, activada por un protón que actuó como catalizador de la reacción al activar al anillo quinolínico.
Los análogos de 7-cloro-N-(3-fenilsustituido)-4-aminoquinolina obtenidos fueron caracterizados a través de las técnicas espectroscópicas (IR y RMN ¹H de 1D), registrando las señales esperadas para los mismos.
Se logró determinar la actividad biológica de los análogos de 7-cloro- N-(3-fenilsustituido)-4-aminoquinolina a través de pruebas en líneas celulares de próstata humana (PC-3), adenocarcinoma de mama humana (MCF-7) y células epiteliales de riñón de mono (VERO). El compuesto 7-cloro-N-(3-hidroxifenil)-4-aminoquinolina (1), evidenció mayor actividad, y el compuesto 7-cloro-N-(3-clorofenil)-4-aminoquinolina (4) le siguió, Ahora, si bien es cierto que estas sustancias presentaron actividad en las células cancerígenas, estos no son selectivos y por lo tanto, resultarían tóxicos para el organismo.
REFERENCIAS
1. Anand, P., Kunnumakara, A., Sundaram, C., Harikumar, K., Tharakan, S., Lai, O., Sung, B., (2008). Canceris a Preventable Disease that Requires Major Life style Changes. PharmaceuticalResearch, 25(9), 2097-2116 [ Links ]
2. Arias, F.G. (1997). El proyecto de Investigación. Guía para su elaboración. 2da edición. Caracas: Episteme [ Links ]
3. Avendaño, C. (1993). Introducción a la Química Farmacéutica. España: McGraw-Hill
4. Bonilla, J.A., Mesón, M.G. y Cartin, W. (s.f.). Modificación de un método colorimétricoque usa XTT, para la determinación de linfoproliferación.19-25
5. Fernandes, I., Vale, N., De Freitas, V., Moreira, R., Mateus, N., Gomes, P. (2009). Anti-tumoral activity of imidazoquines, a new class of antimalarials derived from primaquine. Bioorganic & Medicinal Chemistry Letters (19) 6914–6917,
6. Ferrer, R., Lobo, G., Gamboa, N., Rodriguez, J., Abramjuk, C., Jung, K., Lein, M., Charris, J.E. (2009), SciPharm.; 77, 725-741
7. Florez, J. (2008). Farmacología Humana [Libro en línea]. Tercera Edición. Disponible: http://www.scribd.com/doc/19477461/Farmacologia-Humana-J-Florez-3ra-Ed . [Consulta, 2016, Noviembre 13]
8. González, I., Cerbón, M.A., Lira, R.A., Solano, J.D., Loza, M.A. y Olvera, V.S. (s.f.). Muerte celular en la línea de leucemia mielogénica crónica K-562 inducida por el compuesto D3CLP, un nuevo derivado de tiazolo [5,4-b]quinolina. 2do Congreso Nacional de Química médica.
9. Hardman, J.G., Limbird, L.E., Molinoff, P.B., Ruddon, R.W. y Goodman Gilman, A. (1996). Las Bases Farmacológicas de la Terapéutica. Novena Edición. México: McGraw- Hill Interamericana177
10. Ma, Z., Hano, Y., Nomura, T. y Chen, Y. (2004). Novel quinazoline-quinoline alkaloids with cytotoxic and DNA topoisomerasa II inhibitory activities. Bioorganic & Medicinal Chemistry Letters (14) 1193–1196
11. Mahajan, A., Yeh, S., Nell, M., van Rensburgc, C. E. J. y Chibalea, K. (2007) Synthesis of new 7-chloroquinolinyl thioureas and their biological investigation as potential antimalarial and anticancer agents. Bioorganic & Medicinal Chemistry Letters (17) 5683–5685
12. Pretsch,E., Clerc, T., Seibl, J. y Simon, W. (1980). Tablas de elucidación estructural de compuestos orgánicos por métodos espectroscópicos. España: Alhambra
13. Registro Central de Cáncer del Ministerio del Poder Popular para la Salud (2009). Frecuencia del Cáncer en Venezuela [Documento en línea]. Disponible: http://www.fundacionbadan.org/30temaspdf/fasc-nro2.pdf . [Consulta: 2009, Noviembre 10]
14. Salamanca, E., Ruiz, G., Ticona, J.C., Giménez, A. (2008). Método colorimétrico XTT: como evaluación de alto rendimiento de sustancias con actividad leishmanicida. BIOFARBO (16), 21-27
15. Solomón, E.P., Berg, L.R. y Martin, D.W. (1999). Biología. Quinta Edición. México: McGraw-Hill Interamericana.
16. Wade, L.G. (2004). Química Orgánica. 5ta Edición. España: Pearson Prentice Hall













