Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Agronomía Tropical
versión impresa ISSN 0002-192X
Agronomía Trop. v.60 n.4 Maracay oct. 2010
CAPACIDAD DE FIJACIÓN DE NITRÓGENO ATMOSFÉRICO DE CEPAS NATIVAS DE AGROECOSISTEMAS VENEZOLANOS1
Marisol López *, Rafael Martínez Viera **, Mariluz Brossard Fabré *** y Marcia Toro ****
1Trabajo financiado por el INIA, proyecto 7-281-150-341en el marco del Convenio de Cooperación Técnica Cuba-Venezuela.
*Investigadora. Instituto Nacional de Investigaciones Agrícolas. Centro Nacional de Investigaciones INIA-CENIAP-Maracay.
**Investigador. Instituto de Investigaciones Fundamentales en Agricultura Tropical Alejandro de Humboldt (INIFAT)-Cuba.
***Investigadora. IS-Cuba, Convenio de Cooperación Técnica Cuba-Venezuela.
****Profesora. Universidad Central de Venezuela. Facultad de Ciencias. Caracas. Venezuela. Correo electrónico: mlopez@inia.gob.ve; mtoro@ciens.ucv.ve
RESUMEN
La baja eficiencia de fertilizantes nitrogenados de origen industrial, así como los altos costos energéticos y ambientales hacen necesario generar tecnologías de menor impacto como los biofertilizantes a base de bacterias fijadoras de nitrógeno atmosférico para sustituir parcial o totalmente las fuentes industriales. La población de microorganismos nativos y su capacidad de fijación de nitrógeno (CFN) fue estimada a través de pruebas de agitación-fermentación de los bioproductos durante 72 h en el laboratorio. Simultáneamente las cepas se inocularon en los medios de cultivo Ashby y DIMARGON®-M y se agitaron diariamente por 6 h durante 15 d. El diseño experimental fue al azar con tres repeticiones. Se evaluaron nueve cepas fijadoras de nitrógeno atmosférico de vida libre (FNVL), divididas en dos grupos. El grupo 1 con cuatro cepas: FNGMBar; FNMGSRt4f; FNMGSRt2f; FNMGSRt1f, aisladas de tratamientos evaluados en campo con principios agroecológicos. El grupo 2 con cinco cepas: 9, 12, 17, T5 y B1 pertenecen al Cepario Nacional INIA-CENIAP. El nitrógeno (N) producido por cada cepa y su equivalente en kg ha-1 fue significativamente (P<0,05) diferente entre tratamientos evaluados. Todas las cepas fueron preseleccionadas por su CFN y por mantener altas poblaciones, 1010 y 1013 UFC ml-1 en medio Ashby y DIMARGON®-M, respectivamente, garantizando alta concentración y bajas dosis de aplicación. El grupo 1 puede aportar al suelo entre 46 y 50 y el grupo 2 entre 39 y
Palabras Clave: cepas nativas; fijación de nitrógeno; bacterias de vida libre; agroecosistemas.
CAPACITY ATMOSPHERIC NITROGEN FIXATION OF NATIVE STRAINS OF VENEZUELAN ECOSYSTEMS1
SUMMARY
The low eficiency of industrial nitrogen fertilizers, as well as the high energetic and environmental costs make necessarily generate low impact technologies like biofertilizers based on atmospheric nitrogen fixing bacteria to substitute partially or totally the industrial sources. The population of native microorganisms and its capacity of nitrogen fixation (CFN) were estimated using agitation-fermentation tests by bioproduct agitation during 72 h in the laboratory. Simultaneously strains were inoculated in the culture medium Ashby and Dimargon®-M and shaking daily by six hours for 15 d. A randomized design with three repetitions was used. Nine strains atmospheric nitrogen fixing free life bacteria (FNVL), were assessed, divided into two groups. Group 1 with four strains: FNGMBar; FNMGSRt4f; FNMGSRt2f; FNMGSRt1f, isolated from treatments evaluated in Þ eld with agroecological principles. And the group 2 with five strains: 9, 12, 17, T5 and B1 belong to the National Strain Collection of INIA-CENIAP. The nitrogen (N) produced by each strain and its equivalent in kg ha-1 was signiÞ cantly (P<0.05) different between treatments evaluated. All strains were pre-selected by its CFN and by maintain high populations, 1010 and 1013 CFU ml-
Key Words: native strains; nitrogen fixation; free-living bacteria; agroecosystems.
RECIBIDO: abril 20, 2010 ACEPTADO: junio 20, 2011 INTRODUCCIÓN
En este sentido, Dyson (1996) estimó las necesidades de fertilizantes nitrogenados para cubrir la demanda de N para el año 2020, en 160 millones de toneladas solo para la producción de cereales. Estas estimaciones permitieron predecir el impacto que estos fertilizantes pudieran seguir ocasionando sobre los recursos naturales y el ser humano, si no se toman medidas preventivas. Los 77.000 Mg de fertilizante nitrogenado que se aplican en el mundo, requieren anualmente 100.000 Mg de combustible, equivalente al 1,4% de todo el combustible consumido (McCown et al., 1988; Böckman, 1997) se espera que cada año sea mayor lo cual hace que ese ritmo de consumo sea insostenible.
En el país, particularmente el Ministerio del Poder Popular para
El aumento interanual promedio de estos fertilizantes para dicho período se calculó en un 19% (11% fórmula + 8% urea), según el MPPAT, 2009, razón por la cual, es necesario auspiciar su uso eficiente y racional, además de la incorporación de otras fuentes locales orgánicas y biológicas. Haciendo uso de los biofertilizantes, el consumo energético y la contaminación ambiental, pueden ser significativamente reducidos a través de procesos biológicos que contribuyen exitosamente en cubrir las necesidades de nitrógeno (N) de los cultivos (Peoples y Craswell,1992), tanto por bacterias rizosféricas del género Rhizobium (España et al., 2006) que viven en simbiosis con plantas leguminosas, como por bacterias que habitan en la rizósfera en forma asociativa; ambos tipos de microorganismos están presentes en los agroecosistemas tropicales, y pueden ser activados al manejar los sistemas de producción con bajos insumos y principios agroecológicos (López, 2010).
En Venezuela se le dio rango jurídico a la agricultura sustentable y al desarrollo rural integral (CRBV, 1999) y recientemente se aprobó
Entre los biofertilizantes asimbióticos se encuentran los producidos a base de bacterias con capacidad para fijar N atmosférico en forma asimbiótica, denominadas fijadoras de nitrógeno de vida libre (FNVL), estas bacterias pudieran contribuir significativamente a suministrar N a los cultivos y sustituir parcialmente la aplicación de fertilizantes nitrogenados de origen industrial, lo cual constituye una alternativa viable para proveer el N en cultivos de interés socio productivo (como los cereales), altamente exigente en este elemento, entre otros. El objetivo de este trabajo fue evaluar la capacidad de fijación biológica de nitrógeno (FBN) de las cepas FNVL nativas, aisladas de diferentes condiciones agroecológicas del país, avanzando en el proceso de evaluación y selección de cepas efectivas.
MATERIALES Y MÉTODOS
Se realizaron pruebas sencillas con las cepas en el laboratorio, permitiendo estimar su capacidad de fijación de nitrógeno (CFN) atmosférico haciendo una primera preselección antes de ser caracterizadas e ingresadas al Cepario Nacional, con miras a ser utilizadas como insumo biológico o materia prima en la preparación de biofertilizantes, para lo cual deberán someterse a pruebas más rigurosas de laboratorio, invernadero y campo.
Cepas evaluadas: nueve cepas fueron utilizadas en las pruebas de efectividad de fijación de N atmosférico, las cuales se dividieron en dos grupos: Grupo 1: integrado por cuatro cepas: FNGMBar; FNMGSRt4f; FNMGSRt2f; FNMGSRt1f, aisladas de lotes experimentales a nivel de campo, donde existen registros y conocimiento de la historia de uso de un sistema de producción sorgo-frijol, que se evalúa en suelos ácidos de muy baja fertilidad natural, manejados con principios agroecológicos durante 10 años, ubicados en el estado Guárico, provenientes de las siguientes parcelas experimentales:
Barbecho (FNMGBar), manteniendo la vegetación nativa del sitio experimental , lo cual representa un testigo absoluto de las condiciones agroecológicas naturales del paisaje de mesas disectadas y suelos de sabanas.
Sin residuos (FNMGSR) fueron aisladas de las parcelas , en las que se extraen los restos de cosecha y no se aplican abonos orgánicos, simulando la práctica que realiza el agricultor al dejar el suelo desprotegido después de cosechar e ingresar el ganado a pastorear los restos de cosecha. Las tres parcelas SR donde se aislaron las cepas FNMGSRt4f; FNMGSRt2f y FNMGSRt1f, recibieron fertilización inorgánica con base a N, P, K. Los subíndices t4 y t2 se refieren a la fuente de P: fosfato diamónico (FDA) y roca fosfórica, respectivamente, y t1 el testigo sin aplicación de P. Todas provienen de suelos de reacción ácida, con un pH que osciló entre 4,7 y 5,3.
Grupo 2: pertenecen a la colecta del Cepario Nacional que está en proceso de evaluación y caracterización taxonómica y molecular. Está compuesto por cinco cepas FNVL provenientes de diferentes agrosistemas del país y bajo distintos tipos de uso de la tierra (TUT), registradas con los códigos: 9, 12,17, T5 y B1, provenientes de los estados Portuguesa, Zulia, Delta Amacuro, Anzoátegui y Mérida, respectivamente. Todas, asociadas a la rizósfera de cultivos, desconociéndose con precisión la historia de manejo en los últimos años de los sitios muestreados.
Aislamientos: se realizaron siguiendo los procedimientos y métodos propuestos por Martínez et al. (2006). A partir de una muestra de suelo compuesta de aproximadamente
Procedimientos para evaluar la efectividad de fijación de nitrógeno atmosférico
Simultáneamente, se colocó 10 ml de medio de cultivo Ashby (libre de N) y 10 ml del medio Dimargon®-M en tubos de ensayo. Cada tubo se inoculó con dos ansas del cultivo de la cepa correspondiente . Se realizaron tres repeticiones por cada cepa, obteniéndose tres tubos por cepa y por medio de cultivo. Todos los tubos se dejaron durante 15 d en condiciones de laboratorio. A diario se agitó cada tubo a 160 r.p.m durante 6 h para estimular el crecimiento bacteriano, determinándose la población de microorganismos y la cantidad de N por el método de Kjeldahl (1983). Igualmente, se obtuvo por el método de conteo viable por dilución seriada el tamaño de la población de cada una de las bacterias.
Estimación de aportes de nitrógeno por hectárea: Los resultados obtenidos se utilizaron para hacer el cálculo de la estimación teórica de N que pudieran fijar estas bacterias en condiciones de campo, para ello se consideró como peso promedio de
El peso varía entre tipos de suelos, dependiendo de la profundidad y
Criterios establecidos: se consideró una población de bacterias fijadoras de 108 células/g, valor de referencia mínimo que deben tener los biofertilizantes para considerarlos de calidad y establecer dosis bajas de aplicación en campo (Leaungvutiviroj et al., 2010), esta población de bacterias FNVL expresada en UFC ml-1 se contrastó con la población obtenida después de 15 d de incubación y agitación diaria señalada en los procedi mientos para evaluar la efectividad.
Para conocer la probabilidad de que las bacterias evaluadas sean seleccionadas para la producción de biofertilizantes, debían crecer y mantener altas poblaciones en un medio de cultivo comercial. En este caso, se utilizó el medio Dimargon® modificado (Dibut y Martínez-Viera, 2001). Se realizaron fermentaciones con agitaciones a 160 r.p.m de los bioproductos durante 72 h en frascos con 500 ml del medio modificado e inoculados con 50 ml de la bacteria correspondiente. Las cepas aisladas y multiplicadas en frascos de Erlenmeyer se agitaron durante 72 h. Simultáneamente, se realizó igual procedimiento utilizando el medio de cultivo Ashby, recomendado en la literatura para aislar y mantener bacterias FNVL del género Azotobacter. Las poblaciones de bacterias que se desarrollaron fueron determinadas por recuento directo en cámara de Neubauer y por el método de dilución en placas de Petri.
RESULTADOS Y DISCUSIÓN
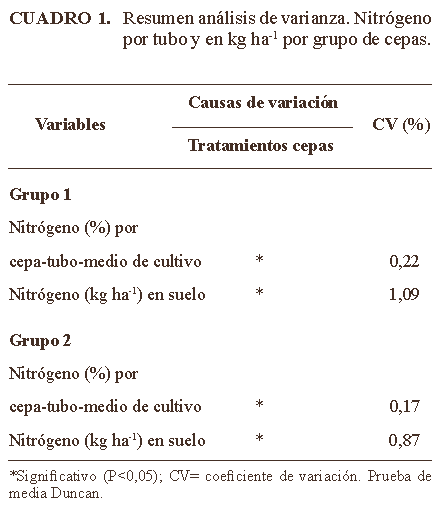
Grupo 1: Crecimiento bacteriano: las cepas de bacterias FNVL presentaron poblaciones promedio de 1010 y de 1013 UFC ml-1 en medio Ashby y Dimargon® modificado, respectivamente. Se observaron diferencias estadísticas significativas (P<0,05) entre cepas dentro de un mismo medio de cultivo. Las mayores poblaciones con diferencias estadísticas significativas (P<0,01) fueron obtenidas con las bacterias aisladas de la parcela con FNMGBar. Las poblaciones fueron de 1012 UFC ml-1, 100 veces superiores a las que se obtuvieron con los medios utilizados en la fabricación industrial (Martínez-Cruz et al., 1993; Dobbelaere et al., 2001).
Estimación de cantidad de nitrógeno fijado por cepa
El N producido por cepa/tubo en los medios de cultivo correspondiente y la estimación de
Las cepas: FNMGBar, FNMGSRt4f, FNMGSRt2f, pudieran aportar al suelo entre 46 y
Estos son suelos que fueron manejados con principios agroecológicos, sin aplicaciones de cal agrícola. Los resultados reflejan el alto potencial que presenta este grupo de cepas para ser utilizadas como posibles insumos biológicos en la preparación de biofertilizantes; bioinsumos que pueden contribuir a incrementar la capacidad productiva de suelos ácidos al ser aplicados como inoculantes o al activarse su población con prácticas agroecológicas y bajos insumos. Esta tecnología permitiría para el caso de cultivos como cereales , frutales y hortalizas, reducir las dosis de fertilizantes nitrogenados de origen industrial hasta en 50% para el caso de la cepa FNMGBar , considerando requerimientos de
Grupo 2: Crecimiento bacteriano: todas las cepas bacterianas asociativas FVLN, mantuvieron poblaciones de 1010 UFC ml-1 en medio de Ashby y de 1013 UFC ml-1 en Dimargon® modificado. Condición que le confiere posibilidades para ser utilizadas como insumos biológicos para producir biofertilizantes bacterianos, al igual que el primer grupo. La contribución del N de las cepas 12, 9, T5, B1 y 17 osciló entre 39 y
Sin embargo, pudieran aportar alrededor de
Las cepas serán ingresadas al Cepario Nacional del INIA-CENIAP e identificadas taxonómica y molecular mente a medida que los resultados reflejen mayor potencial para ser utilizadas como biofertilizantes. Los resultados obtenidos, muestran que el medio Dimargon® modificado, posee las condiciones para mantener altas poblaciones de las cepas evaluadas, por lo que podrá ser utilizado como medio de cultivo en la producción de biofertilizantes con estos microorganismos bacterianos, en la fabricación artesanal, semindustrial e industrial de los bioproductos (particularmente, los basados en bacterias FNVL como el Azotobater). Las cepas preseleccionadas (Grupo 1) fueron evaluadas en pruebas de bioestimulación en experimentos de invernadero (datos no mostrados) estimulando la longitud radical y del tallo de un cultivar de tomate (híbrido Río Grande). La cepa FNMGBar estuvo entre las evaluadas por López et al. (2008) en dos suelos contrastantes venezolanos, donde se probó el efecto de biofertilizantes bacterianos sobre el crecimiento de un cultivar de maíz (cv. INIA-SQ-1).
Entre los bioproductos se utilizó uno preparado con la cepa FNMGBar identificada como Azotobacter sp. En dicha investigación se encontraron resultados que muestran el potencial de la cepa FNMGBar para bioestimular el crecimiento vegetal y fijar N atmosférico de forma asociativa, lográndose un mejor comportamiento en el suelo de mayor disponibilidad de P.
CONCLUSIONES
- Los medios de cultivo evaluados presentaron condiciones óptimas para aumentar el número de unidades formadoras de colonias por mililitro (UFC ml-1) para producir biofertilizantes de calidad.
- El método de incubación y fermentación con agitaciones por períodos cortos, permitió estimar la capacidad de cepas de vida libre para fijar nitrógeno, criterio preliminar para preseleccionar los microorganismos con potencial para ser utilizados como biofertilizantes.
- Las cepas nativas FNVL aisladas de agroecosistemas venezolanos presentan potencial para aportar de
- Las cepas preseleccionadas deben ser evaluadas a través de otros métodos y procedimientos más precisos para determinar su capacidad real de fijación de N, así como, seleccionar las más efectivas y compatibles para un cultivo y suelo determinado antes de utilizarse como biofertilizantes.
BIBLIOGRAFÍA
1. Böckman, O. 1997. Non biological nitrogen fixation. In: Biological Nitrogen Fixation. The Global Challenge and Future Needs. Roma, 24-26 pp. [ Links ]
2. Constitución de
3. Day, J. H. and J. Dobereiner. 1976. Physiological aspects of N2-fixation by Spirillum from Digitaria roots. Soil. Biol. Biochem. 8: 45-50. [ Links ]
4. Dibut, B. y R. Martínez-Viera. 2001. DIMARGON-M, medio de cultivo para la fabricación industrial de biofertilizantes y bioestimuladores microbianos. Cultivos Tropicales, 36: 45-52. [ Links ]
5. Dobbelaere, S., A. Croonenborghs and A. This. 2001. Azospirillum. Australian Journal Plant Physiology, 28: 871-879. [ Links ]
6. Dyson, T. 1996. Population and Foods. Global Trends and Future Prospects. Global Environmental Pro gramme Rutledge. 45 pp. [ Links ]
7. España, M., E. Cabrera and M. López. 2006. Study of nitrogen fixation by tropical legumes in acid soil from Venezuelan savannas using 15N. Interciencia. 31: 197-201. [ Links ]
8. Galloway, J. N. 1998. The global nitrogen cycle: changes and consequences. Environmental Pollution, 102 ( S1): 15-24. [ Links ]
9. Galloway, J. N., J. D. Aber, J. W. Erisman, S. P. Seitzinger, R. W. Howarth, E. B. Cowling and B. J. Cosby. 2003. The Nitrogen Cascade. BioScience, 53 ( 4): 341-356. [ Links ]
10. Kjeldahl, J.
11. Leaungvutiviroj, C., P. Ruangphisarn and P. Hansanimitkul. 2010. Development of a new biofertilizer with a high capacity for N2 fixation, phosphate and potassium solubilization and auxin production. Biosciencie Biotechnology and Biochemistry, 74 ( 5): 1.098-1.101. [ Links ]
12. Ley de Salud Agrícola Integral. 2008. Decreto N° 6129 con Rango, Valor y Fuerza de Ley de Salud Agrícola Integral. Gaceta Oficial 5890 extraordinaria de
13. López, M., R. Martínez-Viera, M. Brossard, A. Bolívar, N. Alfonzo, A. Alba y H. Pereira. 2008. Efecto de biofertilizantes bacterianos sobre el crecimiento de un cultivar de maíz en dos suelos contrastantes venezolanos. Agronomía Trop. 58 ( 4): 391-401. [ Links ]
14. López, M., B. Rodríguez y A. Bolívar. 2009. Estrategias del Estado venezolano para consolidar el uso de biofertilizantes en la agricultura. Simposio sobre biofertilizantes, riesgos y ventajas. XVIII. Congreso Venezolano de
15. López, M. 2010. Manejo agroecológico del sistema sorgo-frijol, efecto sobre la fertilidad del suelo y microorganismos con potencial para biofertilizar agroecosistemas venezolanos. Tesis de doctorado en Ciencia del Suelo. Postgrado en Ciencias del Suelo. Maracay, Ven. Universidad Central de Venezuela. Facultad de Agronomía. 211p. [ Links ]
16. Martínez-Cruz, A., T. Bach, A. Delgado y V. Martínez. 1993. Fosforina, un nuevo biopreparado para
17. Martínez-Viera, R., M. López, M. Brossard, G. Tejeda, H. Pereira, C. Parra, J. Rodríguez y A. Alba. 2006. Procedimientos para el estudio y fabricación de Biofertilizantes Bacterianos. Maracay. Venezuela. Instituto Nacional de Investigaciones Agrícolas. 88 p. (Serie B No 11). [ Links ]
18. McCown, R. L., A. L. Cogle, A. P. Ockwell and T. G. Reeves. 1988. Nitrogen supply to cereals in legume ley systems under pressure. In: Advances in Nitrogen Cycling in Agricultural Ecosystems. C. A. B. International, Wallingford. Ed. J. R. Wilson. 292-314 pp. [ Links ]
19. Organización de Naciones Unidas para
20. Peoples, M. B and E. T. Craswell. 1992. Biological nitrogen fixation: Investments, expectations and contributions to agriculture. Plan and Soil, 141: 13-39. [ Links ]
21. Thompson, L. M. y F. R. Troeh. 1982. Los suelos y su fertilidad. Barcelona España. Editorial Reverté, S. A. 387 p. [ Links ]