Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Agronomía Tropical
versión impresa ISSN 0002-192X
Agronomía Trop. vol.63 no.3-4 Maracay dic. 2013
Composición microbiológica e inocuidad de lixiviados de pseudotallos y láminas foliares de plátano 'Hartón' en el estado Yaracuy
Microbiological composition and safety of pseudostems and leaf blades leachates of 'Harton' plantain in Yaracuy state
Giomar Blanco1*, Blas Linares1*, Julitt Hernández1, Anna Maselli2, Amalia Rincón2, Rogelio Ortega1, Elena Medina1, Livia Hernández1 y Juan Morillo1
1 Instituto Nacional de Investigaciones Agrícolas (INIA) estado Yaracuy. 2 Centro Nacional de Investigaciones Agropecuarias (INIA-CENIAP). Venezuela.
*Correo electrónico: gblanco@inia.gob.ve, gioma@hotmail.com
Resumen
Los lixiviados de plátano (Musa AAB) tienen efecto sobre la disminución en la incidencia de enfermedades como sigatoka negra (Mycosphaerella fijiensis), moko (Ralstonia solanacearum), fusariosis (Fusarium oxysporium), y recientemente, sobre el crecimiento de las plantas. Sin embargo, es necesario realizar estudios que permitan conocer los microorganismos que intervienen en el proceso de obtención de estos lixiviados a los fines de entender su mecanismo de acción y mejorar la eficiencia de producción. El objetivo de esta investigación fue determinar la composición microbiológica e inocuidad de lixiviados de plátano en el estado Yaracuy. Para ello, pseudotallos (PS) y láminas foliares (LH), provenientes de dos localidades con diferente manejo agronómico, fueron colocados en recipientes plásticos para su descomposición bajo un diseño experimental completamente aleatorizado, arreglo factorial 2x2 (tipo de lixiviados y localidad) y tres repeticiones. Semanalmente, se aislaron e identificaron los microorganismos que actuaron en el proceso y se midió el volumen de extracto producido y la temperatura dentro del recipiente. Se identificaron bacterias del género Bacillus como los microorganismos que intervienen en la descomposición de la materia fresca para la obtención de los lixiviados de PS y LH; determinándose que el volumen de extracto producido resultó un buen indicador del final del proceso, logrado en un tiempo aproximado de 90 días. Además, se descartó la presencia de microorganismos patogénicos para plantas, seres humanos y animales. Se recomienda identificar, purificar y liofilizar las bacterias encontradas en esta investigación para ser utilizadas como aceleradores del proceso de descomposición de residuos de plátano.
Palabras clave: Bacillus, descomposición, inocuidad, mecanismo de acción, Musa AAB.
Abstract
The extracts of plantain (Musa AAB) have effect on reduction of major diseases such as black sigatoka (Mycosphaerella fijiensis), Moko (Ralstonia solanacearum) and Fusarium oxysporium, and more recently on crop growth. However, studies are needed to know microorganisms involved in the process in order to understand their mechanism of action and improve production efficiency. The objective of this research was to determine the microbiological composition and plantain extract innocuity in state of Yaracuy. Pseudostem and leaf blades from two locations with different management were placed in plastic containers for decomposition under a 2x2 factorial arrangement (extract type and location) completely randomized design with three replications. Weekly, were isolated and identified microorganisms active in the process, the volume of extract produced and the temperature inside the container was measured. Bacillus bacteria active in the decomposition of the fresh material for obtaining extracts of leaf blades and pseudostems, determining the volume of extract produced is a good indicator of the end of the process, which was 90 days. There was an absence of pathogenic microorganisms to plants, humans and animals. It is recommended to isolate and freeze dry bacteria found in this study to be used as accelerators of decomposition of waste plantain.
Key words: Bacillus, decomposition, innocuity, mechanism of action, Musa AAB.
Recibido: 18/10/13 Aprobado: 05/11/14 Publicado: 11/07/16
Introducción
Los lixiviados de musáceas comestibles (plátano y banano) son extractos vegetales obtenidos por descomposición de restos de cosecha (Larco, 2004; Arenas et al., 2005) en un proceso semejante a la lixiviación que ocurre en los ecosistemas. Cumple con los principios del método de obtención de extractos donde se utiliza un solvente (en este caso el agua) para la extracción de uno o varios solutos (Ammatanda, 1999). Los lixiviados han demostrado ser eficientes en el control de enfermedades asociadas al cultivo y como promotores del crecimiento de las plantas.
En el caso de la sigatoka negra (Mycosphaerella fijiensis Morelet), una de las enfermedades de mayor importancia en estos cultivos, se evidenció que con lixiviados de raquis a una concentración del 90% existe una mayor reducción en el número y tamaño de colonias del hongo; así como la inhibición del 100% de la esporulación y germinación de conidios. Destacando, que a medida que se aumentó la concentración del lixiviado fue menor el desarrollo de M. fijiensis (Mogollón y Castaño, 2010).
Garcés (2010) compara la calidad y efecto de lixiviados producidos a partir de raquis de banano (Musa AAA) y plátano (Musa AAB), mediante transformación aeróbica y anaeróbica en condiciones de invernadero, y encontraron que los obtenidos mediante fermentaciones anaeróbicas y aplicados vía radical en concentraciones de 70 y 100% presentan los más altos índices de inhibición sobre el hongo y los mejores resultados como biofertilizantes.
En condiciones de invernadero, Álvarez et al (2010) reportan que el uso de lixiviado a la dosis de 10% retrasa considerablemente el progreso de la sigatoka negra.
Con respecto al moko, otra enfermedad de importancia en el cultivo causada por el agente bacteriano Ralstonia solanacearum Smith, se ha logrado una reducción de 31,6% en las poblaciones de esta bacteria en suelo inoculado, cuando son tratados con lixiviados de raquis de plátano (Arenas et al., 2005).
En el caso de Fusarium oxysporium causante del Mal de Panamá, se determina que la aplicación del lixiviado con el 50% de agua evaporada (50% de concentración) disminuye significativamente el crecimiento micelial y la tasa de crecimiento, así como la esporulación y por consiguiente la germinación del hongo; comportándose de manera similar a productos comerciales e inhibe completamente el desarrollo de F. oxysporum (Osorio et al., 2012).
Por otra parte, estos extractos vegetales poseen un efecto favorable sobre el crecimiento de plantas. Blanco et al. (2011) reportan que el uso de lixiviados de plátano al 10% incrementa la altura, número de hojas, así como, la longitud total y el peso fresco y seco de las raíces en más de un 50% de las plantas de plátano en condiciones de vivero.
De igual forma, Garcés (2010) indica que el uso de lixiviados de banano y plátano obtenidos mediante fermentaciones anaeróbicas, influyen positivamente sobre la altura de las plantas de banano Williams (Musa AAA) y su contenido de clorofila. Además, Russo et al. (1995) demuestran que el extracto húmico de raquis de banano al 1% promueve significativamente el crecimiento de raíces, área foliar y biomasa de hojas y pseudotallo (PS) de plántulas de banano en condiciones de vivero. De ahí, la importancia de estudiar la composición de los extractos vegetales que determinan su efectividad en el control de enfermedades y en la promoción del crecimiento, con el fin de mejorar su producción.
Contrariamente del avance en su caracterización química (Blanco et al., 2011; Ortiz, 2009; Garcés, 2010), poco se ha reportado sobre los microorganismos naturales que intervienen en el proceso, que posiblemente formen parte de la composición final del producto. Asimismo, es necesario conocer si el producto generado es inocuo a los fines de proteger al aplicador.
En tal sentido, el objetivo de esta investigación fue determinar la composición microbiológica y la inocuidad de lixiviados provenientes de PS y láminas foliares (LH) de plátano provenientes de dos zonas productoras del estado Yaracuy.
Materiales y métodos
La investigación se llevó a cabo en el Laboratorio Integral Agropecuario del Instituto Nacional de Investigaciones Agrícolas (INIA), ubicado en el km 3, sector La Ermita, vía Aeropuerto, municipio Cocorote, estado Yaracuy, coordenadas 10°1729" latitud norte, 68°459,6" longitud oeste, a una altitud de 254 m.s.n.m.
Este proceso se desarrolló con el fin de prever las diferencias en el contenido de los microorganismos presentes, debido a las discrepancias en el manejo agronómico de las plantaciones. Donde se obtuvo el material vegetal se utilizó PS y LH de plátano Hartón Gigante (Musa AAB) provenientes de dos localidades del estado Yaracuy, que difieren en el manejo del cultivo:
Localidad 1: Asentamiento Campesino Macagua-Jurimiquire, parroquia Farriar, municipio Veroes, coordenadas 10°25'4" latitud norte y 68°37'46,61" longitud oeste, con manejo agronómico deficiente caracterizado por la poca o nula fertilización del cultivo y deshoje fitosanitario poco frecuente.
Localidad 2: Sector San Javier, parroquia San Javier, municipio San Felipe, coordenadas 10°22'18" latitud norte y 68°39'58" longitud oeste, con un manejo agronómico adecuado, basado en una fertilización al análisis de suelo y prácticas de deshoje fitosanitario.
Los lixiviados vegetales se obtuvieron por descomposición aeróbica de restos de cosecha de plátano, tales como PS y LH, los cuales fueron repicados y colocados en recipientes plásticos con tapa de 40 litros de capacidad a los que se les adaptó una plumilla o llave para la toma de muestra del extracto (Linares, 2009).
En el fondo de cada recipiente, se colocó 10 kg de grava de río, tapando, previamente, el orificio de la plumilla con malla plástica para evitar su obstrucción. La cantidad de material fresco colocado en los recipientes fue de 10 kg en el caso de PS y 5,5 kg para LH, establecida por la máxima capacidad de recepción de los mismos. Se le agregó un litro de agua para garantizar la humedad necesaria para el inicio del proceso de descomposición.
Los recipientes fueron tapados para prevenir la entrada de contaminantes y colocados bajo sombra a temperatura ambiente promedio de 36 ºC. El diseño experimental utilizado fue completamente aleatorizado con arreglo factorial 2x2, correspondientes a dos niveles de los factores: tipo de lixiviados (PS y LH) y localidad (localidad 1 y localidad 2), con tres repeticiones, lo que generó las siguientes combinaciones: 1) PS-localidad 1; 2) PS-localidad 2; 3) LH-localidad 1; 4) LH-localidad 2.
Este ensayo fue repetido en el tiempo para evaluar la constancia en la respuesta de las variables a estudiar, lo que determinó dos ciclos de producción.
Semanalmente se recirculó el líquido producido, lo que permitió el aireamiento del sistema, además de mantener húmeda la superficie del material en descomposición. Durante cada recirculación se midió el volumen del extracto producido para detectar el momento en el cual dicha variable se hacía constante, considerado como el final del proceso de descomposición.
El registro diario de la temperatura alcanzada dentro de los recipientes durante todo el proceso, se realizó entre las 8:30 am y 1:00 pm.
Se tomaron muestras de los lixiviados en intervalo de 3 días para determinar los microorganismos presentes en el proceso de descomposición, las cuales fueron analizadas en los Laboratorios de Fitopatología del Laboratorio Integral Agropecuario del INIA Yaracuy y el Laboratorio de Bacteriología de la Unidad de Protección Vegetal del INIA CENIAP, estado Aragua.
Para el aislamiento de microorganismos se realizó, inicialmente, el cultivo en medio PDA para descartar la presencia de hongos y luego se realizaron diluciones seriadas en agar nutritivo para bacterias.
Las cápsulas se incubaron a temperatura del laboratorio (25 °C) y se realizaron observaciones diarias durante 72 horas, periodo después del cual se repicaron las colonias presentes en agar nutritivo para la obtención del cultivo puro. Posteriormente, fueron caracterizadas las colonias obtenidas e identificadas las bacterias. En esta última, se efectuaron las pruebas de KOH 3%, la tinción de Gram, además de la tinción negativa de Rojo Congo para observar las preparaciones mediante el microscopio de luz con lente de inmersión.
Para identificar los microorganismos se utilizaron las claves de clasificación convencionales para hongos y bacterias (Ainsworth et al., 1973; Barnet y Hunter, 1972) para identificar. Finalmente, se determinó la carga microbiana de cada lixiviados (Bacteriology Commitee of American Phytopathological Society, 1989), expresándose en Unidades Formadoras de Colonias por ml (UFC/ml).
Los análisis para determinar la inocuidad de los extractos evaluados, se realizó en el Laboratorio comercial SEDICOMVET, C.A. (Rif J-30590770-6; NIT 0054330707), ubicado en Maracay, estado Aragua, donde fueron evaluados los niveles de Salmonella en 25 ml de muestra y el método de análisis FONDONORMA 1291-04; en coniformes totales y Escherichia coli, siguiendo el método establecido por COVENIN 3276-97.
Se utilizó el Programa InfoStat® para análisis de los datos obtenidos, realizando la prueba de normalidad de Wilk y Shapiro, modificada para la variable volumen, a la que posteriormente, se le efectuó la prueba de varianza en los casos donde se detectó desigualdades entre los tratamientos y, de diferencias de medias de Tukey.
Resultados y discusión
Microorganismos presentes en el proceso de descomposición para la obtención de lixiviados de plátano
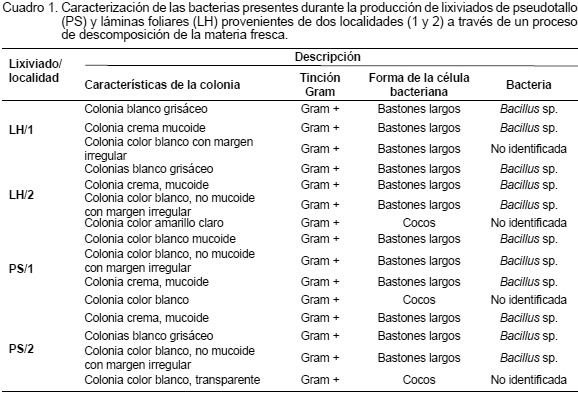
En el Cuadro 1 se presentan los análisis microbiológicos realizados para identificar los agentes responsables del proceso de descomposición durante la obtención de los extractos vegetales evaluados y se determinó la presencia de bacterias tipo Gram+, del género Bacillus y algunas bacterias con forma de cocos saprofíticos. No se detectó la presencia de hongos.
Bacillus sp. estuvo presente en los lixiviados evaluados, independientemente del tipo de material vegetal utilizado (PS y LH) y de la localidad de procedencia. Este hallazgo es muy importante debido a que la literatura señala las propiedades de bacterias del género Bacillus, tales como Bacillus subtilis, siendo promotoras del crecimiento en algunas especies vegetales (Idriss et al., 2002; Robles y Barea, 2004; Corrales et al., 2011; Gómez-Luna et al., 2012), lo que pudiera ayudar a interpretar el efecto de estos extractos sobre el crecimiento de vitroplantas de plátano.
También se ha señalado que las bacterias de este género ejercen una acción específica mediante la producción de metabolitos secundarios y resistencia a estrés biótico y abiótico, facilitando la toma de nutrientes del suelo (Calvo y Zúñiga, 2010).
Por su parte, Glick (2012) señala cuáles bacterias de este género producen fitorreguladores del crecimiento como citocininas y giberelinas. Asimismo, Hernández-Castillo et al. (2008) reporta que aplicaciones de cepas bacterianas del género Bacillus en papa, se tradujo en un aumento del peso fresco de follaje y tallos, así como en un incremento del 117% en el rendimiento.
En cuanto a las temperaturas generadas dentro de los recipientes, se encontró que hubo poca variación entre las alcanzadas por la descomposición de PS y LH. Sin embargo, las mayores temperaturas se registraron a la 1:00 pm (Figura 1) superando en algunos momentos la temperatura ambiente (36 °C en promedio), lo que pudiera estar asociado a la actividad de los microorganismos que actuaron en el proceso de descomposición.
En general, las temperaturas dentro de los recipientes oscilaron entre 28 y 40 °C; aunque algunos autores como Larco (2004) reportan que las bacterias del género Bacillus actúan en la fase termófila (entre 50 y 65 °C). Durante el proceso de compostaje, se pudo demostrar que las bacterias identificadas, en su mayoría de este mismo género, pueden actuar dentro de este rango de temperaturas.
Estos resultados son soportados por estudios realizados por Calvo y Zúniga (2010) quienes señalan que las bacterias del género Bacillus tienen una alta capacidad de adaptarse a diferentes condiciones, por lo que pueden incluso, crecer a temperaturas de 10 y 20 °C.
Por su parte, Hernández-Orona et al. (2011) señala actividad de estas bacterias entre 40 y 60 °C, mientras que Hernández-Castillo et al. (2008) reporta temperaturas de incubación para Bacillus spp. de 24 °C, lo que corrobora la alta capacidad de adaptación de las mismas.
Por otra parte, la carga microbiana determinada en este estudio para los extractos evaluados (Cuadro 2) está por encima de 1x106 UFC/ml reportado por Hernández-Castillo et al. (2008), como la dosis de aplicación necesaria para que estas bacterias ejerzan su efecto, por lo que se puede señalar que en los lixiviados se encuentran suficientes cantidades de Bacillus para producir una posible respuesta en la planta.
Volumen de lixiviado producido
La Figura 2, representa el volumen de lixiviados de PS y de LH provenientes de las dos localidades de plantaciones con manejo agronómico deficiente y manejo agronómico adecuado, respectivamente, obtenidos durante dos ciclos de producción.
Se observa que el volumen de producción de dichos extractos aumentó en el tiempo hasta alcanzar un máximo en aproximadamente 90 días a partir del cual se mantiene estable como es el caso del ciclo 2 o comienza a disminuir ligeramente, como en el ciclo 1. También, se pudo notar una mayor pendiente inicial observada en la línea que representa a los lixiviados provenientes de PS comparada con los de LH, lo que indica que el proceso de descomposición cuando se utiliza este tipo de material vegetal, es más acelerado que cuando se utilizan LH.
Los lixiviados evaluados presentaron diferencias en el volumen de obtención de los mismos, siendo en los PS donde hubo una mayor producción (Figura 2). Estas diferencias pueden ser atribuidas al contenido de agua en los tejidos, el cual es mayor en el caso de PS comparado con LH. Henao et al. (2002) reportan para el vástago de banano (Musa AAA) una humedad de aproximadamente 81,0%. Este contenido de agua es liberado una vez que actúan las enzimas celulolíticas en el proceso de descomposición (Hernández-Orona et al., 2011), contribuyendo así a un mayor volumen de extracto producido.
Por otra parte, para el segundo ciclo de producción, se detectaron diferencias entre el volumen del lixiviados proveniente de PS de la localidad 1, con respecto al de la localidad 2, siendo menor en esta última. Lo que se presume está relacionado más que al manejo, al hecho de que durante ese ciclo el material proveniente de la localidad 2 tenía 2 días de cosechado, por lo que pudo ocurrir pérdida de agua, evidenciado más en PS que en LH, debido a que esta últimas presentan una capa de cutícula más gruesa y cerosa que la protege por más tiempo de la desecación.
Sin embargo, en ambos ciclos evaluados, se observó que el volumen producido de los extractos comienza a estabilizarse alrededor de los 90 días (Figura 2), y este comportamiento se mantuvo independientemente de la localidad, por lo que se considera que el volumen producido es un buen indicador del final del proceso de descomposición.
Por lo antes mencionado, estos lixiviados vegetales tuvieron un ciclo de producción de 90 días aproximadamente (Figura 2), que difiere de Garcés (2010) quien reporta que obtuvo lixiviados provenientes de raquis de plátano cada 7 días.
Esta diferencia radica en que para fines de este trabajo no se utilizaron microorganismos eficientes que aceleraran el proceso de descomposición de estos materiales, tal como lo hizo Garcés (2010), ya que era necesario conocer el potencial de estos materiales vegetales (PS y LH) para ser utilizados en la obtención de extractos en condiciones naturales.
No obstante, la identificación de las bacterias responsables del proceso realizada en esta investigación, abre la oportunidad a nuevos estudios que evalúen la posibilidad de multiplicar dicha bacteria y utilizarla como microorganismo eficiente que acelere el proceso de obtención de estos lixiviados.
En cuanto a la inocuidad de los lixiviados, los resultados demuestran la ausencia de Salmonella coliformes y E. coli en los PS y LH de plátano (Cuadro 3), lo que es de suma importancia dado a que las organizaciones internacionales de salud exigen, como requisito indispensable de control para la utilización de estos productos, que estos microorganismos deben estar a muy bajas poblaciones o ausentes para considerar al producto inocuo (Larco, 2004).
Los resultados confirman que estos lixiviados se encuentran libres de microorganismos patogénicos que puedan perjudicar a la planta o a los seres humanos u otros animales.
CONCLUSIONES
Las bacterias del género Bacillus son los microorganismos que intervienen en el proceso de descomposición de PS y LH para la obtención de lixiviados en las condiciones planteadas en esta investigación, independientemente del lugar de donde provenga el material vegetal inicial.
Este proceso permite la obtención de lixiviados vegetales inocuos para las plantas, los seres humanos y los animales.
Se recomienda continuar los estudios para aislar, identificar, purificar y liofilizar estas bacterias y evaluar la posibilidad de su uso como microorganismos eficientes que permitan acelerar el proceso y acortar el ciclo de obtención de los lixiviados, para así aumentar la eficiencia de producción de los mismos.
AGRADECIMIENTO
A la Escuela Socialista de Agricultura Tropical (ESAT) del INIA y al Fondo Nacional de Ciencia, Tecnología e Innovación (FONACIT) por el financiamiento de esta investigación. A los señores Sabino Morales, Walter Williams y a los productores de plátano José Garranchán y Moisés Piñero por la ayuda prestada en la realización de este trabajo.
LITERATURA CITADA
1. Ainsworth G.C., F.K. Sparrow and A. Sussman. 1973. The fungi. An advanced treatise. A taxonomic review with keys: Ascomycetes and Fungi Imperfecti. Academic Press: New York, San Francisco, London. 620 p. [ Links ]
2. Álvarez E., J. Cortés y G. Ceballos. 2010. Alternativas para el manejo de la sigatoca negra en plátano Dominico Hartón (AAB), mediante el uso de lixiviado y productos biológicos. Boletín MUSALAC 1(2):3-5. [ Links ]
3. Ammatanda M. 1999. Extraction of ricin from castor. Thesis in Master of Science in Chemical Engineering. Faculty of Texas Tech University. 69 p. [ Links ]
4. Arenas A., D. López, E. Álvarez, G. Llanos y J. Loke. 2005. Efecto de prácticas ecológicas sobre la población de Ralstonia solanacearum Smith, causante de moko de plátano. Fitopatología Colombiana 28(2):76-80. [ Links ]
5. Bacteriology Committee of American Phytopathological Society. 1989. Laboratory Guide for identification of plant pathogenic bacteria. Ed. Schaad, N. W. Georgia, EE. UU. Department of Plant Pathology, University of Georgia. 69 p. [ Links ]
6. Barnett H.L. and B.B. Hunter. 1972. Illustrated genera of imperfect fungi. Third Edition. Burgess Publishing Company Minneapolis, Minnessota. 241 p. [ Links ]
7. Blanco G., B. Linares y R. Guédez. 2011. Efecto de lixiviados provenientes de restos de cosecha de plátano sobre el crecimiento de vitroplantas de Plátano Hartón. In: Memorias de III Encuentro Nacional de la Red de Biotecnología Agroalimentaria de Venezuela. Maracay, del 05 al 09 de diciembre de 2011. [ Links ]
8. Calvo P. y D. Zúñiga. 2010. Caracterización fisiológica de cepas de Bacillus spp. Aisladas de la rizósfera de papa (Solanum tuberosum). Ecología Aplicada 9(1):31-39. [ Links ]
9. Corrales L.C., L.C. Sánchez, J. Cuervo, D. Bautista, L. González y M. Guevara. 2011. Evaluación del efecto biocontrolador de Bacillus spp., frente a Fusarium spp., bajo condiciones de invernadero en Rosmarinus officinalis L. NOVA Publicación Científica en Ciencias Biomédicas. 8(13):63-75. ISSN:1794-2470. [ Links ]
10. Garcés H. H.M. 2010. Comparación de la calidad y efectos de lixiviados obtenidos a partir de caquis de banano (Musa acuminata) y plátano (Musa balbisiana) mediante transformación aeróbica y anaeróbica en condiciones de invernadero. Trabajo de Grado para la obtención del título de Ingeniero Agropecuario, Escuela Politécnica del Litoral, Facultad de Ingeniería en Mecánica y Ciencias de la Producción. Guayaquil, Ecuador. 133 p. [ Links ]
11. Glick B.R. 2012. Plant Growth promoting bateria: Mechanisms and applications. Review Article. Scientifica volumen 2012, artículo ID963401, 15 p. Disponible en línea: http://dx.doi.org/10.6064/2012/963401 [Sep. 22, 2012]. [ Links ]
12. Gómez-Luna B.E., A. Hernández-Morales, C.H. Herrera, B.E. Méndez, G. Arroyo-Figueroa, L. Vargas-Rodríguez y V. Olalde-Portugal. 2012. Aislamiento de bacterias promotoras del crecimiento de la rizósfera de plantas de guayaba (Psidium guajava). Ra Ximhai 8(3):97-102. [ Links ]
13. Henao A., M. León y J.A. Ospina. 2002. Evaluación de microorganismos aceleradores del proceso de descomposición en banano de rechazo. In: Memorias XV Reunión Acorbat realizada en Cartagena de Indias, Colombia, 27 de octubre al 02 de noviembre de 2002 Medellín (Col): Asociación de Bananeros de Colombia AUGURA. pp. 323-330. [ Links ]
14. Hernández-Castillo F.D., R.H. Lira-Saldivar, L. Cruz-Chávez, G. Gallegos-Morales, M.E. Galindo-Cepeda, E. Padrón-Corral y M. Hernández-Suárez. 2008. Potencial antifúngico de cepas de Bacillus spp. y extracto de Larrea tridentata contra Rhizoctonia solani en el cultivo de la papa (Solanum tuberosum L.). Revista Internacional de Botánica Experimental ΦYTON 77:241-252. [ Links ]
15. Hernández-Orona V.L., Y. Garza-García, B. Gutiérrez-Rodríguez y J.G. Gaona-Lozano. 2011. Adecuación de parámetros microbiológicos de Bacillus sp. para la obtención de enzimas celulolíticas de ambientes extremos. In: Memorias XIV Congreso Nacional de Biotecnología y Bioingeniería. 19 a 20 de Junio, Queretaro, Qro. México. [ Links ]
16. Idriss E.E., O. Makarewicz, A. Farouk, K. Rosner, R. Greiner, H. Bochow, T. Richter and R. Borriss. 2002. Extracellular phytase activity of Bacillus amyloliquefaciens FZB45 contributes to its plant-growth-promoting effect. Microbiology 148:2.097-2.109. [ Links ]
17. Larco R. E.S. 2004. Desarrollo y evaluación de lixiviados de compost y lombricompost para el manejo de sigatoka negra (Mycosphaerella fijiensis Morelet), en plátano. Tesis de grado para optar por el título de Magíster Scientiae. Escuela de Posgraduados, Programa de Educación para el Desarrollo y la Conservación del Centro Agronómico Tropical de Investigación y Enseñanza (CATIE), Costa Rica. 77 p. [ Links ]
18. Linares B. 2009. Informe de seguimiento técnico anual del proyecto Fortalecimiento de cadenas de valor de plátano: Innovaciones tecnológicas para reducir agroquímicos, caso Venezuela. FONTAGRO-INIA Yaracuy, Venezuela. 10 p. [ Links ]
19. Mogollón O. M.A. y J. Castaño Z. 2010. Evaluación in vitro de lixiviados del raquis de plátano sobre Paracercospora fijiensis (Morelet) Deighton. Agron. 18(2):17-23. [ Links ]
20. Ortiz M. 2009. Evaluación de la actividad de los lixiviados de raquis de banano (Musa AAA), plátano (Musa AAB) y banano Orito (Musa AA) sobre el agente causal de la sigatoca negra (Mycosphaerella fijiensis Morelet) en condiciones in vitro. Trabajo de grado de Ingeniera Agropecuaria. Escuela Politécnica del Litoral. Facultad de Ingeniería en Mecánica y Ciencias de la Producción. Guayaquil, Ecuador. 110 p. [ Links ]
21. Osorio G. L.A., J. Castaño Z. y L.B. Gutiérrez R. 2012. Eficacia in vitro de lixiviados de plátano sobre Fusarium oxysporum Schlecht, causante de la pudrición de raíces de arveja (Pisum sativum Linneo). Agron. 20(1):17-25. [ Links ]
22. Robles C. y J.M. Barea. 2004. Respuesta de la planta y del suelo a la inoculación con Glomus intraradices y rizobacterias en maíz en cultivo intensivo. Terra Latinoamericana 22(1):59-69. [ Links ]
23. Russo R., J. Lugo, O. Arreola y O. Arango. 1995. Efecto de un bioestimulante húmico extraído del raquis de banano (pinzote) sobre el crecimiento de plántulas de banano (Musa AAB subgrupo Cavendish clon Gran enano). Agronomía Mesoamericana 6:130-133. [ Links ]