Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Latinoamericanos de Nutrición
versión impresa ISSN 0004-0622versión On-line ISSN 2309-5806
ALAN v.52 n.2 supl.2 Caracas jun. 2002
Purificación y caracterización de proteasas de Pseudomonas fluorescens y sus efectos sobre las proteínas de la leche
Marcia Costa L., M. Francisca Gómez S., Luz H. Molina C., Ricardo Simpson R. y Alejandro Romero M.
Instituto de Ciencia y Tecnología de los Alimentos, ICYTAL. Universidad Austral de Chile, Valdivia-Chile, Universidad Técnica Federico Santa María, Valparaíso- Chile
RESUMEN.
El aumento de los niveles de contaminación de la leche cruda por bacterias psicrotróficas, durante el período en que ésta permanece refrigerada previo a su tratamiento en la planta, puede traducirse en la producción de enzimas termorresistentes responsables del deterioro de productos lácteos industrializados del tipo larga vida. Pseudomonas fluorescens, es la especie bacteriana psicrotrófica que con mayor frecuencia se encuentra en las leches del sur de Chile. En el presente trabajo se purificaron los extractos enzimáticos de proteasas obtenidos de cultivos a 6ºC de Pseudomonas fluorescens RV10 en leches crudas recién ordeñadas. Se encontró que la proteasa corresponde a una proteína de masa molecular 49,5 kD, que presenta termorresistencia y que ataca rápidamente a la k-caseína y luego a la ъ-caseína. Del trabajo es posible concluir que el almacenamiento de la leche a 6ºC es riesgoso cuando va a ser destinada a productos del tipo larga vida, debido a la pérdida de calidad por la acción de proteasas de bacterias psicrotróficas.
Palabras clave: Psicrotróficas, proteasas termorresistentes, Pseudomonas fluorescens, leche cruda.
SUMMARY.
Purification and characterization of proteases from Pseudomonas fluorescens and their effects on milk proteins. The increase in the levels of psichrotrofic bacteria in the raw milk during the refrigeration period, could lead to the production of heat-resistant enzymes responsible for the deterioration of long-life industrial dairy products. Pseudomonas fluorescens is the psychrotrophic bacteria most commonly found in milk in Southern Chile. In the present work the enzymatic proteinases extract of cultures of Pseudomonas fluorescens RV10 at 6ºC in raw milk just milked were purified. It was found that the proteasa corresponds to a protein with a molecular mass of 49.5 kD, that presents heat resistance and rapidly attacks the k-casein continuing with the ъ-casein. It is possible to conclude that storage of the milk for long-life products at 6ºC is risky, as it causes the loss of quality for the proteasas of psychrotophic bacteria.
Key words: Psichrotrophe, thermoresistant proteases, Pseudomonas fluorescens, raw milk.
Recibido: 11-04-2001 Aceptado: 28-01-2002
INTRODUCCION
Es frecuente la contaminación de la leche cruda por bacterias psicrotróficas durante el período en que la leche se encuentra almacenada en los estanques prediales refrigerados, el transporte a la planta lechera en camiones cisterna y el almacenamiento en la industria. Si la contaminación es alta, puede traducirse en la producción de proteasas y lipasas termorresistentes, principales responsables del deterioro de productos lácteos industrializados, especialmente leches UHT (Ultra High Temperature) y otros del tipo larga vida (1- 5).
En Chile los estanques prediales, el transporte y los estanques silos operan a temperaturas reales entre 4ºC y 6ºC. Dentro de las cepas bacterianas encontradas en leches refrigeradas en la Xª Región, es importante por su alta frecuencia Pseudomonas fluorescens (6). En nuestro laboratorio se ha aislado la cepa RV10 con la cual se efectuaron estudios de crecimiento bacteriano y producción de enzimas termorresistentes en leches crudas recién ordeñadas almacenadas a 4ºC (7).
Las proteínas de la leche principalmente están compuestas por caseínas (8), las que son degradadas por acción de las enzimas termorresistentes producidas por microorganismos psicrotróficos provocando la proteólisis de la leche, lo que lleva a la coagulación, gelificación y la formación de sabores amargos en el producto terminado (9). Las caseínas se clasifican de acuerdo a su secuencia aminoacídica en as1-, as2-, ъ- y k-caseína. Las distintas caseínas son muy susceptibles a la hidrólisis debido a que presentan una estructura no helicoidal al azar. Casi todas las caseínas de la leche fresca recién secretada están contenidas en partículas agregadas denominadas micelas. El modelo más aceptado para la conformación de las micelas de caseína presenta numerosas subunidades compuestas de (-caseína en la mayor parte de la superficie, y as1-, as2- y ъ-caseínas comprimidas al interior de las micelas. Cuando la leche es almacenada a bajas temperaturas, la ?-caseína se disocia de las micelas y la cantidad de caseína soluble puede alcanzar hasta un 30%. Se ha sugerido entonces, que la refrigeración podría hacer a las fracciones de caseínas más susceptibles a la proteólisis (10).
Fairbairn y Law (1), han postulado un mecanismo que describe como ocurriría la proteólisis en la leche producida por enzimas de microorganismos psicrotróficos. Generalmente, las proteasas bacterianas de Pseudomonas fluorescens, atacarían a la k-caseína para producir para-k-caseína, esto produciría la desestabilización de las micelas de caseína, y por lo tanto, una severa hidrólisis de la k-caseína que traería como consecuencia la coagulación de la leche, su gelificación y desarrollo de sabores a sucio y amargo.
Los siguientes objetivos de esta investigación fueron purificar y caracterizar extractos enzimáticos obtenidos de cultivos en leche cruda a 6ºC y determinar la fracción de proteínas de la leche sobre las cuales actuarían estas proteasas bacterianas.
MATERIALES Y METODOS
Cultivos
Los cultivos de Pseudomonas fluorescens RV10 se efectuaron en un fermentador modular (Gallenkamp) de 1 L, con control automático de pH y temperatura (6ºC) sin aireación y con mínima agitación, en 500 mL de leche recién ordeñada de vacas sanas pertenecientes al fundo Vista Alegre de la Universidad Austral de Chile. Las leches fueron inoculadas con un cultivo previo de Pseudomonas fluorescens RV10 en caldo cerebro corazón de forma tal de obtener una concentración inicial de 4 a 6 x103 ufc/mL. Se tomaron muestras cada 2 horas durante 100 horas y se determinó cada vez el recuento total en placa Agar Plate Count de acuerdo con Houghtby y col. (11) y la actividad proteásica mediante el método de Linden y col. (12), que fue modificado en el presente trabajo como sigue: 3 mL de leche se mezclan con 1 mL de una solución de leucyl-p-nitroanilida 6mM (Sigma Chemical Co.) en 20 mM buffer bis-tris propano (Sigma Chemical Co.) e incubados a 37ºC por 2 h, al término del cual se toman 2 mL de la mezcla y se mezclan con 4 ml de etanol absoluto (Merck). Luego de dejar reposar unos minutos la mezcla es centrifugada a 14.700g por 20 min a 4ºC. El sobrenandante es extraído cuidadosamente y se lee su absorbancia a 405 nm. Se construye una curva de calibración estándar de p-nitroanilina (Sigma Chemical Co.) en el rango de 0-200 µmoles/L. La actividad proteásica se expresa como µM de p-nitroanilina (pNA) liberados en 2 h a 37ºC.
Purificación de proteasas
El procedimiento seguido para extraer las enzimas de la muestra de leche con Pseudomonas fluorescens se presenta en la Figura 1 y está basado en los prococolos de Extercate y Shamsuzzaman y McKellar (13,14). A cada una de las fracciones obtenidas en cada etapa se les determinó la actividad proteásica y concentración de proteínas, esta última mediante el ensayo mejorado de cobre alcalino (15).
FIGURA 1
Esquema del proceso llevado a cabo para el fraccionamiento subcelular
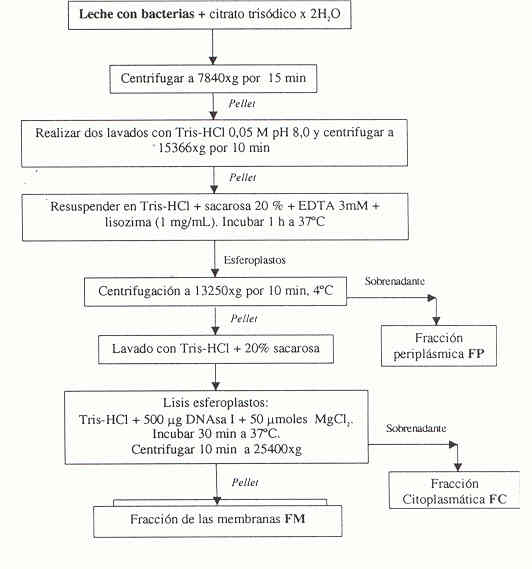
Para la purificación de las proteasas de Pseudomonas fluorescens se realizó una cromatografía en gel, utilizando una resina Sephadex G-75, para ello se empacaron aproximadamente 10 g de resina en una columna de 150,9 cm3 (Pharmacia). La resina fue equilibrada por 72 horas en buffer fosfato 50 mM, pH 7,2. Se eluyó a presión normal, con un flujo de 57 mL/h y para recoger las distintas fracciones se utilizó un colector de fracciones automático (Gilson). Para la calibración de la columna se utilizaron estándares de peso molecular conocido para columnas de filtración en gel de origen Sigma Chemical Co.: aprotinina (6,5 Kd), citocromo C (12,4 Kd), anhidrasa carbónica (29 Kd) y albúmina de suero bovino (66 Kd).
A todas las fracciones eludías se les determinó la absorbancia a 280 nm para verificar presencia de proteínas y a aquellas que la contenían se les determinó actividad proteásica conforme el protocolo detallado anteriormente.
Se utilizó Blue Dextran (2x106 Kd) (Sigma Chemical Co.) para obtener los valores de operación de la columna, se introdujeron los estándares, se recolectaron las fracciones, eluídas al mismo flujo utilizado para el Blue Dextran y se construyó la curva estándar que permitió determinar que el volumen de elución de la enzima correspondía a una proteína ubicada entre, anhidrasa carbónica y albúmina desuero bovino.
Caracterización parcial de las proteasas
Ensayos de termorresistencia
Se efectuaron ensayos de termorresistencia (100ºC y 130ºC, 120 s) a leche cruda inoculada con Pseudomonas fluorescens y a la fracción enzimática purificada por cromatografia de filtración gel y se determinó la actividad enzimática residual.
Determinación del peso molecular
Para la estimación del tamaño molecular se realizó una electroforesis del extracto enzimático obtenido por cromatografía en gel, utilizando geles de poliacrilamida en presencia de dodecil sulfato de sodio (SDS-PAGE). Para esto, se utilizó una solución de acrilamida-bisacrilamida al 15%-0,4%. Se utilizó un sistema continuo, es decir la muestra de proteína fue colocada directamente sobre el gel separador. Para el gel separador se utilizó como tampón tris-HCl pH 8,8 y como tampón de corrida tris-glicina pH 8,3 (16,17).
Se adicionaron 20 µL de estándar y 50 µL de muestra de enzima en cada carril. La curva de calibración fue realizada con proteínas estándares de peso molecular conocido grado electroforético de origen Sigma Chemical Co.: albúmina de leche bovina (66 Kd), a-caseína (40% de b-caseína), k-caseína (19 Kd), b -lactoglobulina (18,4 Kd). Las corridas se realizaron a temperatura de refrigeración y con una intensidad de 25 mA.
Una vez finalizada la corrida se fijaron las bandas con: metanol: ácido acético (50:10), y se tiñeron durante 1 h con azul de Coomasie R 200, en metanol:ácido acético:H20 (50:10:40) y se destiñó el gel solución de desteñido metanol:ácido acético:H20 (30:7:63), (16,17).
Electroforesis en geles de poliacrilamida (SDS-PAGE) de las proteínas de la leche. Proteólisis causada por enzimas de Pseudomonas fluorescens
Mediante la electroforesis en geles de poliacrilamida (SDS-PAGE), es posible separar las distintas caseínas que forman parte de las proteínas de la leche y a través de los distintos patrones electroforéticos constatar en qué extensión y cuáles de estas proteínas han sido degradas por acción de una enzima proteolítica, en este caso de Pseudomonas fluorescens.
Para realizar esta experiencia se incubaron muestras de leche cruda inoculada con P. fluorescens por intervalos de 1, 2, 3 y 6 días a 4ºC, con la finalidad de verificar las diferencias en los patrones electroforéticos.
El ensayo se realizó tomando un volumen de 10 mL de leche al que se le adicionaron lentamente 5 mL de TCA (ácido tricloroacético) al 24%, bajo agitación constante. Después de permanecer en reposo durante 90 minutos a temperatura ambiente (25ºC), el precipitado de caseína y proteínas del suero fue removido por filtración en papel filtro Whatman Nº5, (18). Posteriormente el precipitado fue lavado y resuspendido en buffer gel al volumen inicial.
Luego se realizó la electroforesis en gel de poliacrilamida (PAGE) bajo las mismas condiciones aplicadas en la determinación de la masa molecular.
RESULTADOS
Cultivos
El resultado de los cultivos efectuados a 6ºC se presenta en la Figura 2 donde es posible observar el crecimiento de Pseudomonas fluorescens y la producción de proteasas, mostrando un acelerado aumento de actividad luego de las 72 h.
FIGURA 2
Curvas de crecimiento de Pseudomonas fluorescens y actividad proteásica a 6ºC
Purificación de las proteasas bacterianas
En la Tabla 1 se muestran los valores de actividad enzimática y concentración de proteínas obtenidos para el fraccionamiento subcelular realizado para purificar parcialmente las proteasas bacterianas. Estos resultados obtenidos muestran que la fracción en la cual se encuentra mayoritariamente la actividad proteásica corresponde a la fracción periplásmica (FP), lo que estaría indicando que la proteasa estaría unida a alguna zona de la membrana de la célula bacteriana.
Cromatografía de filtración en gel
En el Figura 3, se presenta el perfil de elución del extracto enzimático, encontrándose mayor actividad proteásica luego del fraccionamiento subcelular. Se pueden observar claramente dos picos, y solamente el primer pico, la fracción 13, representaría a la proteasa aislada de Pseudomonas fluorescens.
TABLA 1
Resultados del fraccionamiento subcelular realizado para purificar parcialmente las proteasas de Pseudomonas fluorescens
| Fracción | Actividad proteásica ( m M p-NA/2 h) | Concentración de proteínas ( m g/mL) |
| Leche con bacterias (cultivo de 6 ºC) Pellet, 1ª centrifugación Esferoplastos Pellet esferoplastos Fracción de las membranas, FM Fracción citoplásmática, FC Fracción periplásmica, FP | 416,5 402,2 231,2 43,0 0,0 31,5 119,0 | --- --- --- --- 86,9 375,3 244,1 |
FIGURA 3
Cromatografía en Sephadex G-75, en buffer fosfato pH 7,2 del extracto enzimático purificado de un cultivo realizado a 6ºC en leche cruda entera
Caracterización de las proteasas purificadas por cromatografía en gel
La Figura 4 presenta el resultado de la electroforesis donde se puede apreciar que la masa molecular de la proteasa purificada mediante cromatografía en gel es de 49,5 Kd.
En cuanto a la resistencia de las enzimas proteolíticas al calor, en la Figura 5 se presentan las curvas de inactivación térmica para la enzima de Pseudomonas fluorescens en leche cruda entera y en el extracto enzimático purificado por cromatografía de filtración molecular. Se observa que para los tratamientos a diferentes temperaturas la enzima retiene en un menor porcentaje la actividad proteásica a la temperatura más elevada (130ºC), en este caso un 4,9% de actividad residual a los 120 s y para el extracto purificado de 2,4% a los 120 s.
FIGURA 4
Determinación del peso molecular de extrato enzimático obtenido por cromatografía en gel

FIGURA 5
Curvas de inactivación térmica de leche cruda con Pseudomonas fluorescens (100ºC y 130ºC) y del extrato enzimático purificado por cromatografia de filtración en gel (130ºC)

Proteólisis por enzimas de Pseudomonas fluorescens
En la Figura 6 se puede observar una fotografía del gel de la electroforesis donde se puede apreciar una considerable hidrólisis de las caseínas de la leche, no así de las proteínas del suero (b -lactoglobulina y a -lactalbúmina). En el carril Nº 2, se ubica la leche cruda no inoculada (T0) y en los carriles Nº 3, 4, 5 y 6 las muestras de leche cruda inoculada con bacterias psicrotróficas e incubadas por 1, 2, 3 y 6 días, respectivamente a 4ºC. En la primera muestra se aprecia que la banda correspondiente a la k-caseína desaparece casi por completo. Así también, podemos observar una disminución de la banda que corresponde a la b -caseína. La acción sobre la a -caseína no es detectable a simple vista. En las restantes muestras se aprecia también la desaparición de la banda de k -caseína, pero aparece otra banda que correspondería a la para-k -caseína, incrementando su intensidad a medida que aumenta el tiempo de incubación. De igual forma se encontraron otras bandas que corresponderían a polipéptidos producto de la hidrólisis de la ß-caseína, dada la disminución de la intensidad de dicha banda.
FIGURA 6
SDS-PAGE de muestras de leche cruda inoculadas con Pseudomonas fluorescens e incubadas por diferentes tiempos a 4ºC. En el car il Nº 2, se ubica la leche cruda no incubada y en los carriles Nº 3,4,5 y 6 las muestras de leche cruda incubadas por 1,2,3 y 6 días, respectivamente. En el carril Nº 1 se ubica el estándar
DISCUSION Y CONCLUSIONES
El crecimiento de Pseudomonas fluorescens y la producción de proteasas fue evidenciado en el cultivo en leche llevado a cabo a 6ºC, las curvas que presentan ambos comportamientos indican que a partir de las 72 h y cuando la concentración celular alcanza niveles de 107 ufc/mL se produce un incremento notable en la actividad proteásica, lográndose al final del cultivo niveles de actividad sobre 90 µM pNA/2h, al efectuar la purificación del extracto enzimático. Siguiendo el protocolo de Extercate (13) se encontró que la proteasa se encuentra asociada a la membrana bacteriana y presenta marcada termorresistencia.
La característica más particular de las bacterias psicrotróficas presentes en la leche cruda es su capacidad de producir enzimas degradativas, sobre las cuales los tratamientos de pasteurización y de ultra alta temperatura (UHT) tienen pocos efectos en su inactivación. Pseudomonas fluorescens, es predominante en la flora de la leche refrigerada y es enzimáticamente activa, reteniendo una actividad residual entre un 14% y un 51% (19).
Se ha descrito que proteasas de 13 especies de Pseudomonas psicrotróficas retuvieron entre el 55% y el 65% de su actividad luego de un tratamiento a 77ºC por 17 segundos, y alrededor del 20 al 40% de la actividad fue detectada luego de un tratamiento a 140ºC por 5 segundos (20).
Estos estudios confirman los resultados obtenidos en el presente trabajo, donde el valor D (tiempo necesario para reducir la actividad en un 90%) de la proteasa de leche cruda a 100ºC es cercano a los 2 minutos, no así para la misma fuente de proteasa a 130ºC, donde D es aproximadamente de 30 segundos. En el caso del extracto enzimático tratado a 130ºC, D es de 15 segundos aproximadamente, indicando así la mayor termoestabilidad que estas proteasas presentan en la leche. Lo anteriormente señalado coincide con un estudio realizado por Barach y col. (21), donde se comprobó que la termoestabilidad de la proteasa de Pseudomonas spp. MC60 a 149ºC en leche y en buffer suplementado con Ca2+, fue mayor que en buffer sin Ca2+ o en agua. Esto indicaría, además, que la estabilidad de las proteasas estaría dada por el Ca2+ y no por las proteínas de la leche (22).
En este estudio se determinó que la proteasa purificada tiene un peso molecular de 49,5 Kd aproximadamente, lo que fue determinado por electroforesis en geles de poliacrilamida (SDS-PAGE).
La proteasa purificada además presenta una alta actividad del tipo aminopeptidasa, y que estaría asociada a la célula bacteriana ya que durante el fraccionamiento subcelular se encontró que la actividad estaba principalmente asociada a la fracción periplásmica. Estos resultados coinciden con los obtenidos por Shamsuzzaman y McKellar (10), quienes estudiaron dos cepas de Pseudomonas fluorescens, la 240 y 32A, que mostraron actividad asociada a la célula y que fue demostrado por el fraccionamiento subcelular; dos peptidasas fueron purificadas de la cepa 32A, una de ellas hidrolizaba específicamente N-a -benzoil-DL-arginina-4-nitroanilida que fue denominada como endopeptidasa, y la otra hidrolizaba L-lisina- y L-leucina-4-nitroanilida y fue denominada como aminopeptidasa.
En cuanto a la proteólisis provocada por esta enzima sobre las distintas fracciones proteicas de la leche (proteínas del suero o caseínas), se observa que la proteasa causa una extensa degradación, afectando principalmente a la k -caseína, hecho que es corroborado por la presencia de una banda que correspondería a la para-k -caseína. Además de la k -caseína, la a -caseína también es degradada rápidamente, ya que se aprecia una disminución en la intensidad de esta banda en el gel, mientras que sobre la a-caseína no se aprecia un efecto degradativo significativo.
Por otro lado, sobre la fracción de las proteínas del suero (a -lactoalbúmina, b-lactoglobulina) no se observa degradación.
Las proteínas del suero serían más resistentes a la proteólisis por estas enzimas proteolíticas, seguramente atribuíble a que poseen una estructura terciaria más compacta, lo cual las protegería de la acción de la enzima. Esto no ocurriría en el caso de proteínas parcialmente desnaturalizadas o proteínas con estructuras más abiertas, como es el caso de las caseínas, que son más sensibles al ataque enzimático.
Estos resultados concuerdan con los obtenidos por Grieve y Kitchen (23), donde se estudió la proteólisis causada en la leche por la presencia de leucocitos y por las proteasas naturales y de origen bacteriano. Los perfiles de degradación para el caso de las enzimas bacterianas mostraron que la k -caseína fue atacada prontamente, como lo indicó la rápida aparición de la banda de para-k -caseína, y que la b -caseína fue hidrolizada mucho más rápidamente que la a s1-caseína, además de la aparición de ocho fragmentos de hidrólisis, provenientes principalmente de la degradación de la fracción de la b -caseína.
De este estudio se puede concluir en general, que el almacenamiento de la leche a 6ºC es riesgoso cuando va a ser destinada a productos del tipo larga vida, debido a la pérdida de calidad por la acción de proteasas de bacterias psicrotróficas. Particularmente se pudo observar que:
- Cultivos realizados con leche cruda a 6ºC con Pseudomonas fluorescens muestran una considerable producción de enzimas con elevada actividad proteásica a partir de las 72 horas de incubación y cuando el recuento bacteriano alcanza los 107 ufc/mL.
- La termoestabilidad de la enzima encontrada es mayor en la leche cruda que en buffer si se comparan los resultados obtenidos a 130ºC.
- La proteasa purificada presenta una actividad del tipo aminopeptidasa ya que hidroliza en forma extensa al sustrato sintético L-leucil-4-nitroanilida.
- Esta enzima estaría probablemente asociada a la envoltura de la célula bacteriana, según los resultados obtenidos del fraccionamiento subcelular.
- Se determinó mediante electroforesis en geles de poliacrilamida (SDS-PAGE), que la enzima tiene un peso molecular de 49,5 Kd.
- Los resultados obtenidos por SDS-PAGE para la proteólisis causada por la proteasa purificada, indican que el efecto degradativo afectaría en forma casi inmediata a la k -caseína, para luego atacar a la fracción que corresponde a la b-caseína y menos visible para el caso de la a-caseína. Efectos degradativos no fueron observados sobre la fracción del suero.
Esta investigación fue financiada por el Proyecto FONDECYT 1951116.
REFERENCIAS
1. Fairbairn D.J y Law BA. Proteinases of psychrotrophic bacteria: their production, properties, effects and control. J Dairy Res. 1986; 53: 139- 177. [ Links ]
2. Shah NP. Psychrotrophs in milk: a review. Milchwiss. 1994; 49 ( 8): 432-437. [ Links ]
3. Kohlmann KL, Nielsen SS and Steenson LR. Production of proteases by psychrotrophic microorganism. J Dairy Sci. 1991; 74 ( 10): 3275-3283. [ Links ]
4. Mottar J. Heat resistant enzymes in UHT milk and their influence on sensoric changes during uncooled storage. Milchwiss. 1981; 36 ( 2): 87-91. [ Links ]
5. Celestino EL, M Iyer and H Roginski. The effects of refrigerated storage on the quality of raw milk. Aust. J Dairy Technol. 1996; 51: 59-63. [ Links ]
6. Levicán J. Caracterización de la flora psicrotrófica y sus proteasas en la leche cruda refrigerada. Tesis. Escuela de Bioquímica, Facultad de Ciencias, Universidad Austral de Chile, Valdivia, Chile. 1992. p. 132. [ Links ]
7. Costa M, Herrera VM, Romero A y Carrasco E. Purificación y caracterización de proteasas y lipasas producidas pos Pseudomonas fluorescens en leche a 4ºC. Alimentos, Chile. 1997; 22 ( 1-2): 73-82. [ Links ]
8. Alais, C. Ciencia de la leche. Principios de técnica lechera. 1985. 2ª Ed. Barcelona, Reverte. [ Links ]
9. Law BA, Andrews AT and Sharpe ME. Gelation of ultra-high-temperature-sterilized milk by proteases from a strain of Pseudomonas fluorescens isolated from raw milk. J Dairy Res. 1977; 44: 145-148. [ Links ]
10. Cromie S. Psychrotrophics and their enzyme residues in cheese milk. Aust. J. Dairy Technol. 1992; 47: 96-100. [ Links ]
11. Houghtby GA, LJ Maturin and EK Koenig, (Messer, J.W., Tech. Comm.). Chapter 6. Microbiological Counts Methods. In: Standard Methods of Dairy Products, 16th Edition. Robert T. Marshall, Editor. American Public Health Association. 1992; 213-244. [ Links ]
12. Linden G, Humbert G, Desnouveaux R et J Picard. Aplications de la dissolution complete du lait à la détermination de quelque activités enzymatiques. Le Lait. 1982; 62 ( 615-616): 209-219. [ Links ]
13. Exterkate FA. Location of peptidases outside and inside the membrane of Streptococcus cremoris. Appl. Environ. Microbiol. 1984; 7 ( 1): 177-183. [ Links ]
14. Shamsuzzaman K and McKellar R. Peptidases from two strains of Pseudomonas fluorescens: partial purification, properties and action on milk. J Dairy Res. 1987; 54: 283-293. [ Links ]
15. Stoscheck CM. Section II. General Methods for Handling Proteins and Enzymes. 6. Quantitation of Protein. En: Methods in Enzymology, Volume 182: Guide to Protein Purification Purification. Deutscher, M.P., Ed., Academic Press Inc., London. 1990. [ Links ]
16. Laemmli UK. Cleavage of structural proteins during assembly of the head of bacteriophage T4. Nature. 1970; 224: 680. [ Links ]
17. Hill SHA and Gasson M J. A qualitative screening procedure for the detection of casein hydrolysis by bacteria, using sodium dodecyl sulphate polyacrylamide gel electrophoresis. J Dairy Res. 1986; 53: 625-629. [ Links ]
18. Urbán G, Pérez N., Vega y León S, Fresón C y M Pinto. Separación por electroforesis (PAGE-SDS) del caseinomacropéptido liberado por quimosina sobre la k-caseína. Efecto de la proteólisis por bacterias psicrótrofas. Agro Sur, Chile. 1998; 26 ( 2): 110-120. [ Links ]
19. Muir D. The shelf-life of dairy products: 3. Factor influencing intermediate and long life dairy products. J Soc. Dairy Tech. 1996; 49 ( 3): 67-72. [ Links ]
20. Griffiths MW. Effect of temperature and milk fat on extracellular enzyme synthesis by psychrotrophic bacteria during growth in milk. Milchwiss. 1989; 44 ( 9): 539-542. [ Links ]
21. Barach JT, Adams DM and Speck ML. Stabilization of a psychrotrophic Pseudomonas protease by calcium against thermal inactivation in milk at ultra high temperature. App. and Environ. Micr. 1976a; 31 ( 6): 875-879. [ Links ]
22. Barach JT, Adams DM and Speck ML. Low temperature inactivation in milk of heat-resistant proteases from psychrotropic bacteria. J. Dairy Sci. 1976b; 59 ( 3): 391-395. [ Links ]
23. Grieve PA and Kitchen BJ. Proteolysis in milk: the significance of proteinases originating from milk leucocytes and comparison of the action of leucocyte, bacterial and natural milk proteinases on casein. J. Dairy Res. 1985; 32: 101-112. [ Links ]

















