Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Latinoamericanos de Nutrición
versión impresa ISSN 0004-0622versión On-line ISSN 2309-5806
ALAN v.56 n.1 Caracas mar. 2006
Retención de Tiamina como Función de las Condiciones de Proceso Térmico en Salmón en Conserva
Quitral, V., Romero, N., Ávila, L., Marín, M.E., Nuñez, H. y Simpson, R.
Departamento de Ciencia de los Alimentos y Tecnología Química; Facultad de Ciencias Químicas y Farmacéuticas; Universidad de Chile. Departamento de Procesos Químicos, Biotecnológicos, y Ambientales; Universidad Técnica Federico Santa María
Correspondencia: Universidad de Chile; Vicuña Mackenna 20; P.O. Box 110570; Santiago, Chile. Tel: 56-02-6781635, Fax: 2227900. E-mail:vquitral@uchile.cl Universidad Técnica Federico Santa María, P.O. Box 110-V; Valparaíso, Chile. Tel: 56-32-654302, Fax: 56-32-654478, E-mail: ricardo.simpson@usm.cl
Resumen
Se estudió el efecto de distintos tratamientos de esterilización sobre la calidad nutricional expresada como retención de tiamina y sobre la pérdida de color en conservas de salmón (Salmo salar). En la materia prima y en las conservas se determinó el contenido de tiamina mediante HPLC y la variación de color mediante colorímetro triestímulo Hunter. Las conservas se elaboraron en envase salmonero y se esterilizaron hasta alcanzar el valor Fo = 6 min. El valor nutricional representado por la tiamina se vio afectado por las altas temperaturas y por el tiempo de exposición al calor. La mayor retención de tiamina fue de 19,2% y se obtuvo en las conservas que se procesaron a 114°C por 89 min. El color de las conservas de salmón varió significativamente respecto a la materia prima, se produjo pérdida de coloración roja y mayor claridad de la carne.
Palabras claves: Conservas, tiamina, color, Hunter, Fo, salmón.
Thiamine retention as a function of thermal processing conditions: canned salmon
Summary
The present work studied the effect of different treatments at high temperatures on the nutritional properties of thiamine retention and color measurement experimentally. Canned salmon (Salmo salar) was processed under different temperatures and time conditions (110°C for 135 minutes; 114°C for 89 minutes; 118°C for 69 minutes and 121°C for 62 minutes). Thiamine was determined by HPLC before and after the process. Color changes, due to processing conditions, were also measured utilizing a Hunter colorimeter. The canning was prepared in 300 x 407 cans and sterilized until Fo value reached 6 min. The nutritional value or index represented by the B1 vitamin or thiamine was affected by high temperature and time exposition. The lowest loss of thiamine of 19.2% was obtained in the canned salmon sterilized at 114°C for 89 minutes. The color in canned salmon was different from the raw material, with a severe loss of red color and a greater clarity of the meat.
Key words: Canned, canning, thiamine, color, Hunter, Fo, salmon
Recibido: 10-06-2005 Aceptado: 20-01-2006
Introducción
Los alimentos marinos son conocidos por su alto contenido en importantes constituyentes para la nutrición en la dieta humana. Los pescados aportan proteínas, vitaminas del complejo B, minerales esenciales. Las especies de alto contenido graso como el salmón, contienen ácidos grasos omega 3 que son esenciales para el desarrollo normal de los niños, y disminuyen el riesgo de enfermedades del corazón en adultos (1).
En Chile, la especie Salmón es la más pujante y con mayores perspectivas en el rubro de exportaciones, siendo sus principales mercados Japón con un 47% y Estados Unidos con un 36%, donde el 44% de estas exportaciones corresponde a Salmón Atlántico (2).
Desde los inicios de la conservería una de sus principales preocupaciones ha sido la determinación de los tiempos de proceso adecuados para asegurar la estabilidad de las conservas. La aplicación de calor sobre los alimentos no solamente reduce substancialmente su carga microbiana, sino que también actúa sobre el resto de sus propiedades (3).
La esterilización comercial requiere de un tratamiento térmico severo para destruir células vegetativas y esporas de bacterias termoresistentes y se controla mediante el valor esterilizante "F", el cual se evalúa mediante análisis microbiológico de esterilidad comercial. Con el fin de calcular el tratamiento térmico necesario para su conservación, aquella porción que se calienta con mayor lentitud es la más conflictiva, de aquí que se deban determinar los cambios de temperatura de esa porción que generalmente está próxima al centro del contenido del recipiente cuando se trata de alimentos que se calientan por conducción (3)(4)(5)
La esterilización por el calor produce reacciones intermoleculares que pueden comprometer la biodisponibilidad o modificar la estructura química de los nutrientes de los alimentos además de inactivación de enzimas. Como consecuencia del tratamiento térmico disminuye el contenido de muchos nutrientes, lo mismo que el número de microorganismos viables (3)(4)(6)(7)(8). Aunque el efecto negativo del proceso térmico no puede evitarse, éste si puede minimizarse. Después de la identificación del propósito del proceso, es posible optimizar las condiciones del mismo (9). Actualmente, el principal objetivo de cualquier optimización son las condiciones del procesamiento térmico para maximizar la calidad nutricional y/o sensorial del producto. La calidad nutricional, tal como el contenido vitamínico, es importante en algunos productos específicos y para sectores de público bien entendido, sin embargo, la percepción del consumidor común va dirigida a los atributos sensoriales tales como textura, color y sabor (10).
La intensidad de degradación de las vitaminas depende de la especie de pescado y de su contenido en grasa, así como de los parámetros de esterilización aplicados (7). La vitamina B1 o tiamina, se destruye con relativa facilidad con el calor en medios no ácidos por lo cual ha sido motivo de estudios desde el punto de vista de la cinética de deterioro. Debido a su termolabilidad, esta vitamina se ha considerado como un índice de destrucción de nutrientes en procesos térmicos (11).
Existen varios autores que han propuesto la determinación de tiamina por HPLC (12-15), todos se basan en el mismo principio básico, con modificaciones en la extracción, purificación y condiciones cromatografícas. Valls y cols. (14) sugiere un método de detección por HPLC con detector de fluorescencia, ya que reduce el rango de interferentes, aumentando la reproducibilidad y sensibilidad. Para la determinación se debe convertir la tiamina a tiocromo ya que este compuesto posee las propiedades fluorescentes.
Estabilidad de los nutrientes frente al calor
En los alimentos, la mayoría de los microorganismos, vitaminas, enzimas y factores de calidad presentan una cinética de destrucción de orden uno con respecto al tiempo:
dN/dt = -KTN
reordenando los términos e integrando la ecuación:
∫dN/N = -KT∫dt
Ln(N/N0) = -KTt
donde KT es la constante cinética de muerte a una temperatura T. Si se expresa la ecuación en log10 , se tiene:
10x = ez
donde x representa el logaritmo en base 10 y z el logaritmo neperiano. Si se toma el logaritmo decimal a ambos lados, se tiene:
xlog10 10 = zlog10 e
x = z(0,434)
z = 2.303x
la expresión anterior se sustituye en la ecuación resultante de la integración y se tiene:
2,303 log10 N - 2,303 log10 N0 = -KTt
finalmente, la ecuación puede expresarse como:
log10 N = -(KT/2,303) t + log10 N0
si se representa la ecuación en un eje cartesiano, la pendiente será:
(log10 N1 - log10 N2)/ ∆t
si se reduce un solo ciclo logarítmico, el tiempo ∆t se conoce como DT ; es decir, el tiempo necesario, a una temperatura T, que se requiere para reducir en un 90% o en un ciclo logarítmico la población de microorganismos en estudio. Por lo tanto la ecuación quedaría:
log10 N = -(1/DT) t +log10 N0
la letalidad que se aplica en el proceso se despeja de la ecuación anterior y finalmente se obtiene la ecuación:
t = DT (log10 N0 - log10 N)
donde t es el tiempo a una temperatura letal, N0 y N son número de bacterias o índice de calidad en el tiempo 0 y tiempo t respectivamente, y D es el tiempo requerido a temperatura T para destruir el 90% de las esporas o células vegetativas o índice de calidad (3)(10)(16)(17).
El valor Fo, corresponde al tiempo en minutos -a la temperatura de 250ºF y valor de z = 18- requeridos para alcanzar el criterio de esterilización previamente establecido (18). La razón de letalidad (Fo) esta definida como:
Fo = ∫ 10(T-To)/z dt
donde T es la temperatura en el punto de interés, To es la temperatura de referencia y z corresponde a los grados de temperatura requeridos para atravesar un ciclo logarítmico en la curva de tiempo de muerte térmica (TDT) (3)(5).
El valor de F determinado para cualquier proceso depende del valor z aplicado en el cálculo. El valor z empleado es aquel, que caracteriza la curva de destrucción térmica del organismo en el proceso. La curva TDT refleja los tiempos de muerte térmica de las bacterias a diferentes temperaturas letales. El valor z empleado en los cálculos de proceso proporciona información de la resistencia relativa de microorganismos a diferentes temperaturas letales (18).
Cambios en las propiedades organolépticas
La esterilización por el calor también produce cambios en la textura y otras características organolépticas de los alimentos (aspecto, color, olor). Así, el calor modifica la capacidad de la carne de reflejar y dispersar la luz (7).
El método de colorimetría triestímulo de Hunter es el más usado en el campo de los alimentos, donde se define un espacio cartesiano en el que L* corresponde a la claridad (luminosidad), a y b a la cromaticidad. Concretamente a* (rojos-verdes) y b* (amarillos-azul) (19). El color de los filetes de salmón Atlántico ha sido medidos por Skjervold y cols. (20) donde fueron calculados Hºab (tinte) y C* (cromaticidad) como:
Hºab = arctan (b*/a*)
![]()
Los rangos de Hºab son de un rojo total (Hºab =0) a amarillo total (Hºab = 90), y el color más intenso corresponde a un valor de C* alto (20).
El objetivo del presente estudio es evaluar el efecto de distintos tratamientos térmicos (procesos de letalidad equivalente) sobre el valor nutritivo expresado en pérdida de tiamina y color en conservas de carne de salmón.
Materiales y Métodos
Materia Prima
Se utilizó la especie de la familia salmonídea Salmón Atlántico (Salmo salar), proveniente de la Región de Los Lagos (X Región) ubicada en el sur de Chile. Se trabajó con 10 kg de la especie al estado congelado. El pescado se recibió eviscerado y fileteado. En estas condiciones el peso promedio individual fue de 1,3 -1,5 kg con un tamaño promedio de 40 - 60 cm.
Muestreo
Para cada tratamiento térmico, el contenido de tres envases se homogeneizó y se extrajeron muestras en duplicado para determinación de tiamina por HPLC y análisis de color por Hunter. Diez envases se destinaron para análisis microbiológico.
Elaboración de las conservas
Los filetes de salmón se prepararon para la elaboración de conservas envasándolos en tarros de hojalata con barniz interior epoxifenólico, de formato salmonero 76 x 113 mm, los que se llenaron con 320 g de carne desmenuzada de salmón sin medio de empaque para asegurar una transferencia de calor por conducción. No se produjo adhesión de la carne en la pared interna de la hojalata ya que se encontraba desmenuzada.
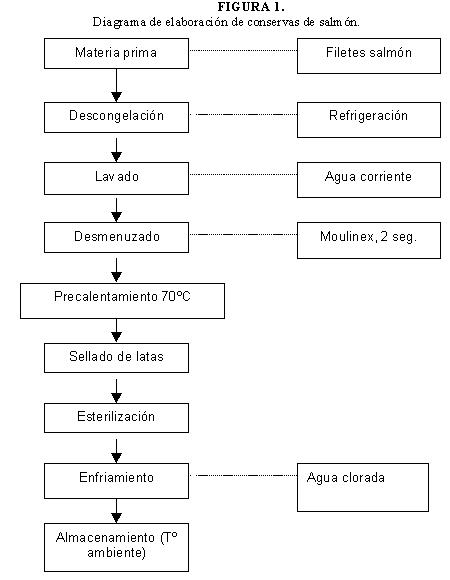
Se aplicaron 4 tratamientos térmicos diferentes en cuanto a temperatura y tiempo de proceso térmico, alcanzando en todos ellos el valor esterilizante Fo = 6 min, valor esterilizante recomendado para obtener un moderado a alto grado de seguridad (21) para inhibir microorganismos patógenos y alteradores. En la Tabla 1 se presentan los tratamientos térmicos aplicados. Las conservas se elaboraron de acuerdo al diagrama presentado en la Figura 1.
Mediante termopares Ecklund se realizó un seguimiento de la temperatura en el punto de calentamiento más frío de las conservas cada un minuto. El procedimiento de esterilización se realizó en un autoclave vertical, hasta alcanzar el valor de Fo = 6 min.
Métodos de Análisis
Determinación de Humedad.: Por desecación a 105°C hasta peso constante (22)
Determinación del Contenido de Materia Grasa.: según el método Bligh and Dyer (23)
Determinación de Proteínas: Por método Kjeldhal (22)
Determinación de Cenizas: Por calcinación en mufla a 550°C (22).
Determinación de Tiamina por HPLC
Equipamiento
Se usó un Cromatógrafo líquido de alta resolución (HPLC) equipado con bomba L-6200A. Merck-Hitachi (Merck, Darmstadt, Germany), inyector Rheodyne 7725i con loop de 20 µl, detector de fluorescencia F-1050 longitud de onda de excitación 360 nm y emisión 430 nm e integrador D-2500 ambos Merck- Hitachi. Columna µbonda pak C18 3.9 x 150 mm, 5 µm (Waters, Milford, M.A.), fase móvil metanol: agua (35:65), flujo 0,95 ml/min.
Preparación de las muestras
La tiamina fue extraída por el método modificado de Valls y cols. (14). Se tomó 10 g de muestra homogeneizada y se llevó a matraces erlenmeyer de 250 ml. Se agregó 60 ml de HCl 0,1N, con agitación. Las muestras se autoclavaron a 120ºC por 30 min (22), luego se enfriaron a temperatura ambiente y se ajustó el pH a 4,0-4,5 con acetato de sodio 2.5 M. Se agregó 10 ml de solución enzimática de diastasa (10% p/v) recientemente preparada, las muestras se incubaron a 37ºC por 4 h (24). Al precipitado de proteínas, se agregó 2 ml de ácido tricloroacetico 50% (p/v) y se calentó a 90ºC por 15 min. Los matraces se enfriaron a temperatura ambiente y se llevaron a 100 ml con agua MilliQ. Se filtró por papel Wattmann Nº2 y los filtrados se refrigeraron para ser utilizados al día siguiente.
Para oxidar la tiamina al derivado fluorescente, tiocromo, se agregó a 10 ml del extracto filtrado del día anterior 5ml de ferricianuro de potasio al 1% en 15% NaOH (22). Se agitó por 90 segundos y se dejó reposar por 1 min, se agregó 1 ml de H3PO4 concentrado para minimizar la formación de tiamina bisulfito (25). El extracto oxidado se pasó a través de una columna Sep-Pak C18 (Waters, Milford, M.A.) activada previamente con 3 ml de metanol y 2 ml de agua. Las sustancias interferentes se removieron con 3 ml de solución 5% metanol/ 95% buffer fosfato 5mM a pH 7.0. La tiamina se eluyó con 3 ml de metanol y se llevó a un volumen final de 5 ml con metanol, se filtró con filtro Millipore (0,22μm) y se inyectaron 20 µl de la solución al HPLC.
La cuantificación se realizó con una curva de calibración con solución estándar de tiamina (Merck Darmstadt, Germany) en un rango de concentración de 0,025 - 0,2 µl/ml.
Para el test de recuperación se adicionó cantidades conocidas de estándar de tiamina a la materia prima salmón crudo y se trabajó de igual forma que las muestras.
Esterilidad comercial
De acuerdo al Reglamento Sanitario de los Alimentos (26) sobre el control de esterilidad comercial para conservas, a partir de conservas tratadas térmicamente, se incubaron 5 unidades a 35ºC por 10 días y 5 unidades a 55ºC por 5 días. Se sembraron las muestras por el método de ensayo de mésofilos y termófilos aerobios y anaerobios de la FDA - BAM (27), utilizando como medios Caldo dextrosa púrpura de bromocresol (DPB) y Caldo hígado triturado. Se incubaron 3 unidades durante 14 días a 35ºC (mésofilos) y 3 unidades durante 7 días a 55 ºC (termófilos). La incubación se realizó en cámara de flujo laminar u otro ambiente de contaminación controlada. Luego de la incubación se observó el desarrollo de microorganismo por presencia de turbidez y cambio de color de los caldos.
Determinación de color
Para determinar el color se utilizó un colorímetro triestímulo Hunter Lab. Las muestras de salmón se colocaron en la cubeta de vidrio de aproximadamente 3 cm de diámetro. La cubeta de vidrio se colocó debajo del ojo del colorímetro y se realizó la lectura utilizando el sistema de color oponente de Hunter donde L* mide las tonalidades de blanco [100] hasta negro [0&], a* las tonalidades de rojo [+] hasta verde [-] y b* las de amarillo [+] hasta azul [-] (20). Donde para salmón Atlántico los rangos de Hºab igual a 0 fueron para el rojo total y el valor de 90 para el amarillo total, mayor valor de C* indica mayor intensidad de color (28).
Los resultados se analizaron por análisis de varianza con el Programa Stats Graphics 2.0 plus.
Discusión
La Figura 2 presenta la letalidad medida cada un minuto en las conservas de salmón elaboradas a diferentes temperaturas y tiempos de proceso, y se observa que a medida que la temperatura de proceso térmico (Tr) es mayor, la curva es más alta y aguda, como se visualiza en la curva de Tr = 121°C, mientras que al disminuir la temperatura de proceso térmico la curva se presenta más baja y aplanada.
La Figura 3 presenta la letalidad acumulada alcanzada por las cuatro conservas elaboradas, se observa que todas las conservas alcanzaron el valor esterilizante Fo = 6 min, y las conservas tratadas con temperaturas de proceso más altas lo lograron en menor tiempo.
La Tabla 2 presenta la composición proximal para la carne de salmón Atlántico. Al igual que otras especies marinas presenta alto contenido proteico y su clasificación según contenido lipídico corresponde a un pez semigraso de acuerdo a Jacquot (29).
Dentro de los organismos patógenos y más resistente a las temperaturas está el Clostridiun botulinum, un microorganismo anaeróbico mesófilo esporulado, su toxina puede llegar a ser letal para el ser humano (17). El Reglamento Sanitario de los Alimentos (26) establece para conservas la esterilidad comercial que asegura la destrucción de formas viables de microorganismos patógenos y de otros microorganismos capaces de alterar el producto, especificando como número máximo de unidades de muestras contaminadas cero para que el alimento sea aceptable.
El análisis microbiológico realizado en las muestras para comprobar la esterilidad comercial indicó que no hubo desarrollo de microorganismos aerobios y anaerobios mesófilos y termófilos viables, como se presenta en la Tabla 3.
Para lograr una extracción satisfactoria de la vitamina B1, fue necesario disgregar en HCl y luego calentar las muestras. Esto garantizó la hidrólisis de los complejos vitamina-proteína ya que en forma natural las vitaminas se encuentran en muy pequeña cantidad en forma libre (30).
La Tabla 4 presenta el contenido de tiamina en la materia prima y en las conservas elaboradas a distintas temperaturas y tiempos de proceso, así como su porcentaje de retención. A pesar de la presente perdida de tiamina por efecto del calor con respecto a la carne fresca (diferencias significativas a nivel del 0,05), se puede observar en la Tabla 4 que el comportamiento del porcentaje de retención de tiamina es menor a medida que aumenta la temperatura excepto en la conserva de 110ºC. Las pérdidas de tiamina durante el proceso de enlatado pueden ser elevadas, en la industria pueden variar significativamente entre 20 a 70% para conservas de carne y pescado (11). Aubourg (31) describe una pérdida de vitamina B1 o tiamina en conservas de albacora, para una esterilización a 121ºC por 95 min de alrededor de 94,2% (retención equivalente a 6%) y a 115ºC por 120 min de alrededor de 95,2% (retención equivalente a 5%).
La molécula de tiamina se compone de un anillo pirimidínico y otro tiazólico unidos por un puente metileno Figura 4 (32). La pérdida de actividad biológica resulta de una degradación térmica que ha sido estudiada extensivamente (7)(33), al respecto, se han propuesto dos mecanismos de reacción para explicar la degradación térmica de tiamina:
- Uno que involucra la ruptura del enlace metilénico dejando una mitad pirimidínica y otra tiazólica.
- Otro que considera la apertura del anillo tiazol con la producción de sulfuro de hidrógeno (34).
Otros factores, que afectan la degradación de la tiamina está relacionada con componentes propios del alimento como forma de combinación de la vitamina (libre o ligada), complejos metálicos, pH, carbohidratos y enzimas presentes en bajas concentraciones (tiaminasas), proteínas y aminoácidos, estos últimos en condiciones alcalinas degradan la tiamina desulfurándola (35)(36). Briozzo y cols. (37) determinaron experimentalmente que la retención de tiamina aumentaba en conservas de carne de cerdo y de hígado de vacuno al acidificar el medio.
El análisis de varianza indicó que sólo hubo diferencias significativas a nivel de 0,05 entre los tratamiento a 110ºC y 114ºC, y los tratamiento a 110ºC y 118ºC. Para los tratamientos de 114ºC, 118ºC y 121ºC, no hubo diferencias significativas en la pérdida de tiamina. El mayor porcentaje de retención de tiamina se produjo en las conservas procesadas a 114°C y 89 minutos. Texeira y cols. (38) indicaron que al aumentar la temperatura de proceso térmico y disminuir los tiempos no se obtienen los resultados más óptimos en cuanto a retención de nutrientes, lo que se comprueba experimentalmente en este estudio.
Para el parámetro L* en las conservas tratadas a diferentes temperaturas de esterilización no se observaron diferencias significativas a nivel de 0,05, pero sí se presentaron diferencias con respecto a la materia prima. En la Tabla 5 se presentan los datos de los parámetros de color en la materia prima y en las conservas tratadas a diferentes temperaturas. El valor del parámetro luminosidad (L*) nos informa que las muestras sometidas a esterilización son mucho más blancas, con valores más cercanos a 100. La muestra que presenta mayor luminosidad es la muestra procesada a 114°C, mientras que la muestra menos afectada es la muestra que corresponde a las conservas procesadas a 110°C, como se observa en la Figura 5.
Para el parámetro a* no se encontraron diferencias a nivel de significación de 0,05 entre las conservas, pero si hubo diferencias entre éstas con respecto a la muestra sin tratamiento. En el salmón sin tratamiento el valor de a* correspondió a su coloración típica. Este parámetro experimentó una disminución importante en las muestras esterilizadas, presentando pérdida de coloración roja por efecto de la temperatura, siendo la menor pérdida en las conservas tratadas a 110ºC. Para el parámetro b* se encontró diferencias significativas a nivel de un 5% entre los tratamientos térmicos a 110ºC y 121ºC, Figura 6.
Los valores de Hºab y C* obtenidos en las conservas tratadas a diferentes temperaturas de esterilización no presentaron diferencias significativas a nivel de un 5%. El valor Hºab en las conservas presentó valores superiores al de la materia prima, este parámetro dio cuenta de una mayor tonalidad amarilla, valores más cercanos a 90 (28). A pesar de no existir diferencias significativas en los parámetros más importantes en las conservas tratadas a distintas temperaturas de proceso que son Hºab , L*, a* y C*, el proceso que presentó mejor comportamiento o que experimentó menor pérdida de coloración fue el de 110ºC, mientras que el proceso que mostró menor pérdida de tiamina fue el de 114ºC.
Bibliografía
1. INTA. Bondades nutricionales del pescado. publicación periódica en línea. URL: http://www.inta.cl/Consumidor/tripticos/Pescado/index.asp?offset=1.htm.
2. Chile.com. Aumentan Exportaciones de Trucha y Salmón. publicación periódica en línea. URL: http://www.chile.com/tpl/articulo/detalle/ver.tpl?cod_articulo=55187.
3. Casp A. y Abril J. Tecnología de Alimentos. Procesos de conservación de Alimentos. España. Mundi-Prensa; 1999. [ Links ]
4. Rees J.A.G. y Bettison J. Procesado térmico y envasado de los alimentos. Editorial Acribia, S.A. Zaragoza. España; 1994. [ Links ]
5. Hersom A.C. y E. D. Hulland. Conservas alimenticias. Procesado térmico y microbiología. Editorial Acribia, S.A. Zargoza. España; 1995. [ Links ]
6. Fennema O. En: Richardson T. y FinleyJ. W., editors. Chemical changes in Food during Processing. AVI Publishing Company. Inc. U.S.A.; 1985. [ Links ]
7. Ojea Gonzalo. Cambios en la calidad de los alimentos marinos durante la esterilización por el calor. Industria Conservera 1999; 7 ( 26): 38-42. [ Links ]
8. Quitral V., Abugoch L., Vinagre J., Larraín M. "Efecto de tratamientos térmicos sobre el contenido de lisina disponible en carne de jaiba mora (Homalaspis plana)". Archivos Latinoamericanos de Nutrición. 2001; 51 ( 4): 382 - 385.
9. Manvell C. Minimal processing of food. Food Science and Technology Today. 1997; 11 ( 2): 107.
10. Villota R. and Hawkes B. Kinetics of nutrients and organoleptics changes in foods during processing. In: Physical and Chemical Properties of Food. Eds. American Society of Agricultural Engineering. Michigan; 1986.
11. Banga J., Alonso A.A., Gallardo J. M. and Pérez-Martín R. Kinetics of thermal degradation of thiamine and surface colour in canned tuna.. Z Lebersm Unters Forsch 1993;( 196): 7-12.
12. Hägg Margareta. Effect of various commercially available enzymes in the liquid chromatographic determination with external standardization of thiamine and riboflavin in foods. J. AOAC International, 1994; 77 ( 3): 681-686.
13. Barna É. and Dworschák Ernó. Determination of thiamine (vitamin B1) and riboflavin (vitamin B2) in meat and liver by high-performance liquid chromatography. J. Chromatography A 1994; (668): 359-363.
14. Valls F., Martín A. Checa, Miguel A. Fernández-Muñio, and M. Teresa Sancho. Determination of Thiamin in Cooked Sausages. J. Agric. Food Chem 1999; (47): 170-173.
15. Esteve María-José, Farré Rosaura, Frívola Ana and Cantabella José. Simultaneous determination of thiamin and riboflavin in mushrooms by liquid chromatography. J. Agric. Food Chem., 2001; (49): 1450-1454.
16. Durante T., Dou J. and Mazza J. Selection of variable retort temperature processes for canned salmon. J. Food Process Engineering, 1997; (20): 65-76.
17. Holdsworth S.D. Thermal processing of packaged foods. New York, Blackie Academic & Professional, 2000; 71, 79 -80.
18. Stumbo C. R. Thermobacteriology in food processing. 2nd Edition, Academic Press., Estados Unidos; 1973.
19. Universidad de Chile. Facultas de Ciencias Agrarias y Forestales. El color en alimentos. Medidas Instrumentales; 1989.
20. Skjervold P.O., Beneze Anna M., Fjaera Svein O., Vegusdal Anne, Vorre Aase and Einen Olai. Effects of pre-, in-, or post-rigor filleting of live chilled Atlantic salmon. Aquaculture, 2001; (194): 315-326.
21. Stumbo C. R., Purohit K.S. and Ramakrishnan T.V. Termal process lethality guide for low-acid foods in metal containers. J. Food Sci 1975; 40: 1316-1323.
22. AOAC. Official Methods of Analysis of the AOAC. 16th Edition; 1996.
23. Bligh, E.G and Dyer W.J., Lipid extraction from fish muscle, Can J Biochemistry Physiology 1959; (37): 911-913.
24. Fernández T., Gonzáles Miguel y Travieso L. Determinación de vitaminas del Complejo B en Arthrospira maxima por cromatografía líquida de alta resolución, Ars. Pharmaceutica 2001; (42): 171-183. [ Links ]
25. Ryan M., Ingle J. Fluorometric reaction rate method for the determination of thiamin. Anal. Chem 1980; (52): 2177-2184.
26. Ministerio de Salud. Reglamento Sanitario de los Alimentos, D.S. Nº977, Ediciones Publiley; 2000. [ Links ]
27. FDA-BAN. FDA- Bacteriological Analitycal Manual, 21 E1; 1992 [ Links ]
28. Wyszecki G., Stiles W.S., Colour Science. Wiley, New York; 1967.
29. Contreras E. Bioquímica de Pescados e Invertebrados. CECTA- USACH. Santiago, Chile. 2002 [ Links ]
30. Cárdenas F. T., González San Miguel H. y Travieso L. Determinación de vitaminas del complejo B en Arthrospira maxima por cromatografía líquida de alta resolución. Ars Pharmaceutica, 2001; 42 ( 3-4): 171-183.
31. Aubourg S.P. Review: Loss of quality during the manufacture of canned fish products. Food Sci. Tech. Int. 2001; 7 ( 3): 199-215, 2001.
32. Enciclopedia Médica en Español. publicación periódica en línea . URL: http://www.nlm.nih.gov/medlineplus/spanish/ency/article/002401.htm
33. Farrer K.T.H. The thermal destruction of vitamin B1 in foods. Advances in Food Research, 1955; (6): 257- 1955.
34. Mulley E.A., Stumbo C.R. and Hunting W.M. Thiamine: a chemical index of the sterilization efficacy of thermal processing. J. Food Sci., 1975; (40): 993-996.
35. Dwivedi B. K. and Arnold R. G. Chemistry of thiamine degradation in food products and model systems: A review. J. Agr. Food Chem 1973; 21 ( 1): 54-60.
36. Dwivedi B. K., Arnold R. G. and Libbey L.M. Chemistry of thiamine degradation. Identification of minor volatile components from thermally degraded thiamine. J. Food Sci 1973; 37: 689.
37. Briozzo J., Basualdo R.N., Carrera P.A., Alzamora S.M. y Chirife J. Improvement of Thiamin retention in canned low-acid foods through pH adjustment . J. Food Sci. 1987; 52 ( 3): 827-829.
38. Texeira A.A., Dixon J.R., Zahradnik J.W. and Zinsmeister G.E. Computer optimization of nutrient retention in the thermal processing of conduction-heated foods. Food Technology 1969; 23 ( 845): 137-142. [ Links ]
 Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons
Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons