Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Latinoamericanos de Nutrición
versión impresa ISSN 0004-0622versión On-line ISSN 2309-5806
ALAN v.56 n.4 Caracas dic. 2006
Interferón-gamma e interleucina-10 sérica en niños anémicos con deficiencia de vitamina A
Jorymar Y. Leal, Haydée V. Castejón (), Tania Romero, Pablo Ortega, Gisela Gómez, Daysi Amaya y Jesús Estévez.
Instituto de Investigaciones Biológicas. Facultad de Medicina. Universidad del Zulia. Maracaibo-Venezuela
RESUMEN.
Estudios realizados en humanos y animales han mostrado que la baja ingesta de vitamina A puede provocar anemia, sin embargo, aún no se conocen los mecanismos etiopatogénicos involucrados en tal proceso, lo cual puede ser debido a las complejas interacciones de los micronutrientes entre sí y con el sistema inmune. El objetivo del presente estudio fue analizar las concentraciones séricas del Interferón gamma (IFN- ã) y la Interleucina 10 (IL-10) en niños anémicos y no anémicos según el estado nutricional de la vitamina A. Para ello, se estudiaron 53 niños eutróficos (45-77 meses; F=29, M=24), procedentes de Maracaibo-Venezuela, en quienes se evaluó: la presencia de anemia mediante el análisis de la concentración de hemoglobina, según los criterios de la OMS (Hb<110g/L <60 meses, Hb<115g/L >60 meses); y el estado de la vitamina A por la técnica de Citología de Impresión Conjuntival (CIC), considerando la prueba de CIC Normal=suficiencia de vitamina A y CIC Anormal=DVA. Asimismo, fueron determinadas las concentraciones séricas de las citocinas (IFN-gamma e IL-10) en pg/mL con el método de ELISA. Los datos fueron analizados con el programa estadístico SAS/STAT, los grupos fueron comparadas aplicando ANOVA (p<0,05). En nuestros resultados la prevalencia de anemia observada fue de 75,50%; DVA 50,94% y de Anemia+DVA 35,86%. Los niños anémicos con DVA mostraron valores séricos significativamente más bajos de IFN- ã e IL-10 que el resto de los grupos. Esta alteración de los complejos mecanismos regulatorios del sistema inmunitario pudiera ser un elemento responsable de los trastornos en la formación de los eritrocitos.
Palabras clave: Anemia-deficiencia de vitamina A, IFN-ã- Interleucina 10.
Serum levels of interferon-gamma and interleukine- 10 in anemic children with vitamin A deficiency.
SUMMARY.
Studies done with human and animals have shown that the diminished vitamin A intake can produce anemia, but the ethiopathogenic mechanism hasnt been known due to the few studies about the complex interactions between micronutrients deficiencies, immune system and cytokine productions. The objective of the present study was to analyze the serum concentration of IFN- ã and IL-10 in anemic and non anemic children according to vitamin A nutritional status. A descriptive study of 53 euthrophic children, without infectious diseases (45-77 month old; 29 girls, 24 boys), living in a slum in Maracaibo-Venezuela. Anemia was evaluated by means of blood hemoglobin concentration analysis, standard WHO criteria for anemia were Hb<110g/L in <60 month old children; Hb<115g/L in >60 month old children. Vitamin A status was assessed by Conjunctival Impression Cytology (CIC) technique, which determines Normal CIC=Control or Abnormal CIC=VAD. The serum concentration of IFN- ã and IL-10 (pg/mL; X±DE), was determined by the ELISA method. Statistical significance of differences was tested by ANOVA (p<0.05). Prevalence of anemia was 75.50%; VAD 50.94% and anemia+VAD 35.86%. The anemic children with VAD showed significant serum values of IFN-ã e IL-10 lower than in other groups. This alteration of the complex immunoregulatory mechanism could be responsible for dysfunction eritrhoid cell formation.
Key words: Anemia- Vitamin A deficiency – Interferon gamma- Interleukin 10- Pre-school children.
Recibido: 09-05-2006 Aceptado: 19-09-2006
INTRODUCCION
La anemia y la deficiencia de vitamina A (DVA) son dos importantes problemas de salud pública en los países en desarrollo (1-2). La anemia por deficiencia de hierro es el desorden nutricional de mayor prevalencia en el mundo, especialmente en los países de América Latina (3, 4). La OMS estima que 1.300 millones de personas están anémicas, de las cuales de 500 a 600 millones tienen deficiencia de hierro (4). En Venezuela, la prevalencia de anemia se ha ido incrementando desde finales de la década de los años 70, a pesar de la fortificación con hierro de las harinas de maíz y trigo desde 1993 (5-7). La deficiencia leve y moderada de hierro, aún sin anemia, se ha asociado con trastornos del desarrollo psicomotor, alteraciones moleculares y celulares de la respuesta inmunitaria e incremento la morbilidad debida a infecciones (8).
Con respecto a la DVA, en los países de América Latina, no es frecuente la forma clínica severa de esta vitamina (9). Sin embargo, la forma subclínica es capaz de provocar trastornos de la integridad de las barreras epiteliales, del sistema inmune y contribuir en el incremento de la morbilidad debida a enfermedades infecciosas, incluso antes de que ocurra daño manifiesto en el sistema visual (9,10). En Venezuela, la prevalencia de DVA es variable, se han reportado cifras que van desde 0,5% hasta 60%, dependiendo de la condición socioeconómica, el grupo etáreo, la región geográfica y el método de detección de la vitamina A (7,11-17). En el Estado Zulia, Amaya-Castellanos y col. (15) en el año 2001, y Castejón y col., (16) en el año 2004, aplicando la técnica de Cromatografía Líquida de Alta Resolución (HPLC) para la determinación de retinol sérico, han reportado una prevalencia de 22,20% y 21,78%, respectivamente; mientras que por la técnica de Citología de impresión conjuntival (CIC) Castejón y col., en el año 2001 (17) reportaron en niños de condición socioeconómica marginal una prevalencia de DVA de 35,46%.
Diversos estudios en humanos y animales han demostrado que la baja ingesta de vitamina A en la dieta puede provocar anemia (18-20) y que la suplementación con vitamina A mejora el metabolismo del hierro (21,22). Si bien, no se conocen en forma cierta los mecanismos etiopatogénicos de la anemia por DVA, estudios epidemiológicos han mostrado que existe asociación significativa entre los niveles séricos de retinol y los indicadores bioquímicos del estado del hierro (18-23). Además, la vitamina A parece involucrarse en el desarrollo y diferenciación de las células progenitoras de los eritrocitos (23) y en la inmunidad contra enfermedades infecciosas (24).
La vitamina A y el hierro pueden regular la secreción de citocinas, mediadores solubles producidos por células linfoides y no linfoides, capaces de modular el sistema inmunitario (25,26). La vitamina A actúa sobre receptores nucleares específicos afectando la trascripción de los genes de las citocinas (25). Aunque poco se conoce sobre los efectos de la anemia por deficiencia de hierro sobre la producción de citocinas, diversos estudios han demostrado que el hierro está involucrado en la regulación segundos mensajeros relacionados con la producción de citocinas (26). Sin embargo, son escasas las investigaciones que analizan las complejas interacciones de estos micronutrientes entre sí y con el sistema inmune, por lo que aún no se ha llegado a conclusiones integradoras de las condiciones anemia, DVA e Inmunidad. Asimismo, no existen reportes en humanos que señalen la relación del IFN-ã y la IL- 10 con la coexistencia de anemia y deficiencia de vitamina A. De allí que, el objetivo de la presente investigación fue evaluar el comportamiento del IFN- ã y la IL-10 sérico en niños anémicos y no anémicos según el estado nutricional de la vitamina A.
Sujetos y metodos
Sujetos
Se evalúo por antropometría, análisis clínico y determinación sérica de la proteína C reactiva una población preescolar de un Centro de Educación situado en el Noroeste de Maracaibo-Venezuela, en una zona ubicada en los estratos IV y V de pobreza crítica y extrema, estimada por el Método de Graffar, adaptado para Venezuela por Méndez Castellano y Méndez (27). Se seleccionó una muestra que cumplió con los criterios de inclusión: edad entre 3 y 6 años, ambos sexos, eutróficos y sin patología aguda, crónica, o proceso inflamatorio activo. Luego se tomó una sub-muestra de 53 niños en forma aleatoria, la cual luego fue clasificada en cuatro grupos, de acuerdo con los valores de hemoglobina (no anémicos y anémicos) y del estado nutricional de la vitamina A (normales o deficientes de vitamina A). GRUPO 1: Sin anemia,con suficiencia de vitamina A (n=5). GRUPO 2: Sin anemia, con deficiencia de vitamina A (n=8). GRUPO 3: Anémicos, con suficiencia de vitamina A (n=21). GRUPO 4: Anémicos con deficiencia de vitamina A (n=19).
El presente estudio transversal cumplió con lo dispuesto en la Declaración de Helsinki por lo que fue aprobado por el Consejo Técnico del Instituto de Investigaciones Biológicas de la Facultad de Medicina de la Universidad del Zulia. Los padres o representantes legales de los niños dieron su consentimiento verbal y escrito para la inclusión del niño en el proyecto de investigación.
Evaluación nutricional – antropométrica
Para la evaluación nutricional antropométrica, se establecieron las variables Peso, Talla y Edad, y la combinación de éstas. Se aplicó el puntaje Z para el análisis de los indicadores Peso//Edad (P//E), Talla//Edad (T//E) y Peso//Talla (P//T), utilizando el programa estadístico Epi-Info, versión 6.04 (Centers for Diseases Control and Prevention, Atlanta, Georgia, U.S.A. OMS, 1994), tomando como base el patrón de referencia internacional del Centro Nacional de Estadística en Salud de USA (NCHS/OMS), válido para estudios en Latinoamérica. Valores de Puntaje Z entre +2 y =-2 Desviaciones Estándar (DE) fueron considerados indicativos de nutrición adecuada (eutróficos) y valores <-2 DE indicativos de desnutrición (28).
Toma de la muestra
Los niños eutróficos incluidos en el estudio fueron evaluados mediante interrogatorio y examen físico, además se les tomó una muestra de sangre (5 mL), por punción venosa antecubital, en ayunas, entre las 8:00-9:00 am, la cual fue vertida en dos tubos: uno con anticoagulante (EDTA), destinada a estudios hematológicos, y otro sin anticoagulante, los cuales fueron trasladados en un medio refrigerado al Laboratorio de Investigación en Malnutrición Infantil. La muestra contenida en el tubo sin anticoagulante fue sometida a centrifugación a 3000 rpm durante 10 minutos, con el objeto de obtener el suero, el cual se repartió en dos alícuotas en tubos "Eppendorf".
Análisis de la proteína C reactiva
Se tomó una alícuota para el análisis semicuantitativo de la Proteína C Reactiva (Wiener Lab), con el objeto de incluir en el estudio los niños eutróficos libres de infección al exa- men físico y con Proteína C reactiva negativa. El resto de las alícuotas fueron conservadas a -70 ºC hasta su estudio. Las muestras hemolizadas fueron descartadas.
Análisis hematológico
Para evaluar la condición de anemia en la población infantil estudiada, la sangre colocada en los tubos con EDTA fue analizada con un contador hematológico automatizado Sysmex K-800, y se tomaron los valores de Hemoglobina (Hb) establecidos por la OMS/UNICEF/UNU para definir anemia en poblaciones ubicadas a nivel del mar, se tomó como puntos de corte en niños menores de 60 meses valores de Hb <110 g/L y en los mayores o igual a 60 meses, cifras de Hb <115 g/ L para definir la anemia (29).
Evaluación del estado nutricional de la vitamina A
Para evaluar el estado nutricional de la vitamina A, se aplicó la técnica de Citología de Impresión Conjuntival (CIC), de acuerdo al Manual de Instrucciones del International Center for Epidemiologic and Preventive Ophthalmology (ICEPO) (30). Se consideró que un resultado de CIC normal era indicativo de un adecuado estado nutricional de vitamina A; mientras que una CIC anormal era indicativa de deficiencia de vitamina A.
Determinación de las concentraciones séricas de las citocinas Th1 (IFN-ã) y Th2 (IL-10)
Para la determinación de citocinas, las alícuotas de suero conservadas a -70ºC, fueron transportadas y analizadas en el Laboratorio Regional de Referencia Virológica del Instituto de Investigaciones Clínicas de la Facultad de Medicina de la Universidad del Zulia, donde se aplicó el método de Inmunoanálisis Enzimático (ELISA) de doble anticuerpo (BioSource Europe SA).
Análisis estadístico
Con el fin de estimar la relación del sexo o la edad con las variables estudiadas, los datos se agruparon por sexo y edad. Los valores obtenidos de las variables hematológicas y las concentraciones de IFN-ã e IL-10 (pg/mL), fueron expresados como Media ± Desviación Estándar (X±DE). Para comparar los resultados las variables cuantitativas del estudio (hemoglobina, citocinas) se aplicó la prueba t para muestras independientes. Para comparar las medias de los cuatro grupos estudiados se aplicó el Análisis de la Varianza (ANOVA) de dos vías. En caso de significancia estadística, la prueba fue seguida del Test de Tukey, para determinar diferencia entre las varianzas de los promedios entre los grupos. Se consideró el 95% de confiabilidad estadística con una p<0,05. El procesamiento de los datos se realizó con el programa de Sistema de Análisis Estadístico (SAS) (SAS Institute, Cary, NC).
Resultados
Indicadores Antropométricos, hematológicos y estado nutricional de la vitamina A
Se seleccionó una sub-muestra de 53 niños eutróficos (F=29, M=24), edad comprendida entre 45-77 meses (X±DE: 65,21±7,83 meses). En el presente estudio la prevalencia de anemia fue de 75,50% (n=40) y de CIC anormal, indicativa de DVA fue de 50,94% (n=27). La prevalencia de DVA detectada en los niños no anémicos fue de 61,53% superior a la encontrada en los niños anémicos (47,50%). No se observaron diferencias significativas de los valores de hemoglobina y las concentraciones séricas de las citocinas entre los niños con suficiencia o deficiencia de vitamina A. Igualmente, no se evidenciaron relaciones significativas con el sexo ni la edad en los grupos estudiados. Sin embargo, prevalencia de la coexistencia de anemia y DVA fue mayor en los niños del sexo masculino (52,60%) y en los mayores de 60 meses (84,20%); sin embargo, estas diferencias no fueron estadísticamente significativas. Nótese en la Tabla 1, que los valores promedio de Hb y Hematocrito (Hcto), como es de esperar, fueron significativamente menores en los niños anémicos en comparación con los no anémicos, independientemente de la condición de la vitamina A. Con respecto al análisis del puntaje Z de los indicadores antropométricos no se observaron diferencias significativas entre los grupos estudiados.

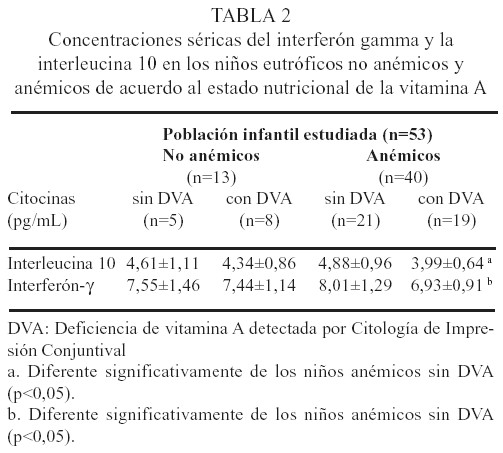
Citocinas séricas
Nótese en la Tabla 2 que el grupo de niños anémicos con DVA mostraron valores séricos significativamente menores de IFN-ã e IL-10 (p<0,05) al compararlo con el grupo de niños anémicos sin DVA. El grupo de niños anémicos sin DVA mostró valores más altos de IFN-ã aunque no significativos en comparación con los niños no anémicos con y sin DVA.
Discusion
Indicadores antropométricos, hematológicos y estado nutricional de la vitamina A En la presente investigación la prevalencia de anemia en los niños estudiados (75,50%) fue superior a las reportadas en niños de diferentes grupos etáreos en años recientes en Venezuela por Castejón y col., 2004 (38,11%) (16); en Latinoamérica por Morasso y col., 2003 (66,4%) (31), Cunningham y col., 2001 (26,3%) (32). Este resultado, revela la existencia de un serio problema de salud pública debido a la falta de estrategias efectivas y sostenidas para la prevencióny el control de la anemia y la deficiencia de hierro que puede afectar a gran parte de la población infantil causando daños irreversibles en su desarrollo psicomotor y cognitivo, trastornos en el crecimiento pondoestatural y en el funcionamiento de los sistemas endocrino, gastrointestinal e inmunitario (8)
En el grupo de niños estudiados se detectó por CIC una prevalencia de DVA subclínica de 50,90%, que supera la señalada por la OMS para definirla como un problema de salud pública (33). La citología de impresión conjuntival, es una metodología que detecta los cambios histológicos del epitelio conjuntival antes del desarrollo de los primeros signos clínicos evidentes de DVA como la ceguera nocturna y la xeroftalmia, lo cual determina su importancia como método diagnóstico que permite decidir sobre las medidas terapéuticas pertinentes antes del desarrollo de las formas clínicas severas (34). Investigaciones realizadas en poblaciones infantiles de nuestro país fundamentadas en la técnica de CIC, muestran una prevalencia de DVA subclínica que varía entre 9% y 35,4% (14,17). Otros reportes, basados en la determinación sérica de retinol por HPLC, han mostrado que la prevalencia de DVA varía desde 0,5% hasta 60% en las diferentes regiones de Venezuela (7,11-16,35).
La prevalencia de anemia asociada con DVA observada en este estudio fue de 35,86%, superior a la señalada recientemente por Castejón y col. de 7,92% (16). Diversos reportes epidemiológicos han planteado potenciales mecanismos biológicos a través de los cuales la DVA podría causar anemia (23), y algunas de estas investigaciones han mostrado que la deficiencia de hierro y vitamina A por separado afectan el estado funcional del sistema inmunitario (36,37).
Ante estos graves problemas de salud pública, se considera necesaria la educación nutricional y para la salud, tanto en los hogares como en las comunidades, con el objeto de diseñar y ejecutar programas que incluyan la intervención nutricional con múltiples micronutrientes. Estas medidas, deben ejercerse en forma sostenida y extenderse a toda la población infantil, adolescentes y las madres embarazadas, las cuales al ser bienconducidas y ampliadas minimizarían la prevalencia y por ende las consecuencias clínico-patológicas.
Anemia y citocinas
El grupo de niños anémicos sin DVA estudiado mostró concentraciones séricas de IFN-ã e IL-10 mayores pero no significativas al compararlo con los grupos no anémicos con y sin DVA. Al respecto, Beard, (8) señaló que el hierro está involucrado en la regulación de la producción de citocinas. Por su parte, Janson y col. (26), han reportado en estudios "in vitro" una alta producción de IFN-ã en niños con deficiencia crónica de hierro. Feelders y col. (38), demostraron que altas concentraciones de IFN-ã se relacionan con un incremento en los niveles de ferritina y de los depósitos de hierro, y con una disminución del hierro sérico. Tilg y col., 2002 (39) revelaron que niveles elevados de IL-10 son capaces de inhibir la secreción de IFN-ã, y en consecuencia disminuir los valores de la ferritina y los depósitos de hierro, e incrementar la disponibilidad del hierro sérico necesario para la eritropoyesis; por lo que, el IFN-ã y la IL-10 parecen ejercer efectos inmunoreguladores en la homeostasis del metabolismo del hierro, situación que pudiera comprobarse o descartarse en próximas investigaciones.
Deficiencia de vitamina A y citocinas
Aunque los estudios acerca de DVA-citocinas son controversiales tanto en animales (40,41) como en humanos (42,43), los mismos han señalado que la DVA afecta la inmunidad celular en relación a la función y cantidad de leucocitos y linfocitos circulantes, lo cual altera la secreción de citocinas. Al comparar el grupo de niños con DVA y sin DVA analizados en el presente estudio, no mostraron diferencias significativas entre las concentraciones séricas de las citocinas evaluadas. Estos resultados son contrarios a los demostrados en otros estudios realizados en animales (40,41) y en humanos (42,43), en los que la DVA determina un fuerte imbalance regulatorio de células TCD4+, con síntesis excesiva de citocinas fenotipo Th1 e insuficiente secreción por el fenotipo de células Th2.
Anemia, DVA y citocinas
En nuestro estudio, la coexistencia de anemia y DVA afectó significativamente los niveles séricos de ambas citocinas, puesto que el grupo de niños anémicos con DVA mostró valores séricos significativamente más bajos de IFN-ã (6,93±0,91 pg/ mL) e IL-10 (3,99±0,64 pg/mL) (p<0,05) que los niños anémicos sin DVA (IFN-ã: 8,01±1,29 pg/mL. IL-10: 4,88±0,96 pg/mL), no así la condición de anemia y DVA por separado. El IFN-ã es una citocina que induce la muerte de las células progenitoras hematopoyeticas a través del incremento de la apoptosis (muerte celular programada). La sobreproducción de IFN-ã, en animales, se ha asociado con la patogénesis de la Anemia de Fanconi (44) y en humanos con la patogénesis de la Anemia Aplásica (45). Por otro lado, la IL-10 es capaz de incrementar la formación de colonias eritroides de manera dosis dependiente, y limitar la producción de IFN-ã en pacientes con anemia aplásica severa (45). Aunque no se dispone de otros estudios que evalúen las concentraciones séricas de IFN-ã e IL-10 en niños con DVA y anemia nutricional, nuestro hallazgo sugiere la presencia de complejos mecanismos inmunoregulatorios cuyo objeto probable sea garantizar la formación de los eritrocitos ante situaciones adversas.
En la presente investigación, el porcentaje de determinación indica que un 66,90% de los cambios observados en el IFN-ã son explicables por las variaciones de la IL-10 o viceversa, quedando un 33,10% de variación atribuible a otros factores involucrados, tales como la participación de otras citocinas y la posible deficiencia de otros micronutrientes como: vitaminas B6, B12, ácido fólico, vitamina E, niacina, zinc y selenio cuyas carencias repercuten en la inmunidad celular y que pueden producir alteraciones en los procesos inmunológicos (42). Por ello, es importante ampliar el estudio debido a la cantidad de factores intrínsecos y extrínsecos involucrados en la afectación del sistema inmunitario en los casos de coexistencia de DVA y anemia.
Agradecimiento
Este trabajo fue financiado por el Consejo de Desarrollo Científico y Humanístico (CONDES) de la Universidad del Zulia. Nuestro reconocimiento al personal del Laboratorio Regional de Referencia Virológica del Instituto de Investigaciones Clínicas de la Facultad de Medicina de La Universidad del Zulia, en especial al MgSc Ricardo Atencio, por su valiosa colaboración; a la Lic. María I. Rodríguez, coordinadora del Laboratorio Clínico del Hospital de Especialidades Pediátricas de Maracaibo por su contribución.
REFERENCIAS
1. Nestel P, Melara A, Rosado J, Mora JO. Vitamin A deficiency and anemia among children 12-71 months old in Honduras. Pan American of Public Health 1999; 6: 34-43. [ Links ]
2. Albalak R, Ramakrishnan V, Stein AD, Van der Haar F, Haber MJ, Schroeder D, et al. Co-occurrence of nutrition problems in Honduran children. J Nutr 2000; 130: 2271-2273. [ Links ]
3. Stoltzfus RJ. Defining iron-deficiency anemia in public health terms: a time for reflection. J Nutr 2001; 131: 565S-567S. [ Links ]
4. Solano L, Meertens L, Peña E, Argüello F. Deficiencia de micronutrientes. Situación actual. An Venez Nutr 1998; 11: 48-54. [ Links ]
5. Layrisse M, Chávez JF, Méndez-Castellano H, Bosh V, Tropper E, Bastardo B, et al. Early response to the impact of iron fortification in the Venezuela population. Am J Clin Nutr 1996; 64: 903-907. [ Links ]
6. Diez-Ewald M, Torres-Guerra E, Layrisse M, Leets I, Vizcaíno G, Arteaga-Vizcaíno M. Prevalence of anemia, iron, folic acid and vitamin B12 deficiency in two Bari indian communities from western Venezuela. Invest Clin 1997; 38: 191-201. [ Links ]
7. Landaeta-Jiménez M. Alimentación y Nutrición en la Venezuela de 2000. An Venez Nutr 2000; 13: 143-150. [ Links ]
8. Beard JL. Iron biology in immune function, muscle metabolism and neuronal functioning. J Nutr 2001; 131:569S-580S. [ Links ]
9. Mora JO, Gueri M, Mora OL. Vitamin A deficiency in Latin America and the Caribbean: An overview. Pan Am J Public Health 1998; 4:178-185. [ Links ]
10. Sommer A, Katz J, Tamrvrotj J. Increased risk of respiratory disease and diarrhea in children with pre-existing mild vitamin A deficiency. Am J Clin Nutr 1984; 40: 1090-1095. [ Links ]
11. Yépez C, Ludovic I, Naranjo R, Solano-Rodríguez L. Niveles séricos de vitamina A, C y E en una población pre-escolar del Municipio Los Guayos. Estado Carabobo. Arch Latinoamer Nutr 1994; 44: 42S-43S [ Links ]
12. Montilva M, Nieto R, Ferrer MO, Pérez M, Durán L, Mendoza MA. Vitamina A en niños menores de 7 años de comunidades suburbanas. Barquisimeto-Venezuela. An Venez Nutr 2001; 14. ISSN 0798-0752. [ Links ]
13. de Abreu J, Santos C, Borno S, Montilla M, Arenas O, Dini E. Deficiencia de vitamina A en niños desnutridos moderados de una población urbano-marginal de Caracas. An Venez Nutr 2002; 15: 76-86. [ Links ]
14. Páez-Valery MC, Solano LR, del Real S. Indicadores de riesgo para la deficiencia de vitamina A en menores de 15 años de una comunidad marginal de Valencia, Venezuela. Arch Latinoamer Nutr 2002; 52: 12-19. [ Links ]
15. Amaya-Castellanos D, Viloria-Castejón H, Ortega P, Gómez G, Urrieta JR, Lobo P, Estévez J. Deficiencia de vitamina A y estado nutricional antropométrico en niños marginales urbanos y rurales en el Estado Zulia, Venezuela. Invest Clin 2002; 43: 89-105. [ Links ]
16. Castejón HV, Ortega P, Amaya D, Gómez G, Leal J, Castejón OJ. Co-existence of anemia, vitamin A deficiency and growth retardation among children 24-84 months old in Maracaibo, Venezuela. Nutr Neurosc 2004; 7: 113-119. [ Links ]
17. Castejón HV, Ortega P, Díaz M, Amaya D, Gómez G, Ramos M, et al. Prevalencia de deficiencia subclínica de vitamina A y desnutrición infantil en niños marginales de Maracaibo-Venezuela. Arch Latinoamer Nutr 2001; 51: 25-32. [ Links ]
18. Mohanram M, Kulkarni KA, Reddy B. Hematological studies in vitamin A deficient children. International J Vitaminol Res 1977; 47: 389-393. [ Links ]
19. Hodges RE, Sauberlich HE, Canham JE, Wallace DL, Rucker RB, Mejía LA, Mohanram M. Hematopoietic studies in vitamin A deficiency. Am J Clin Nutr 1978; 31: 876-885. [ Links ]
20. Bloem MW, Wedel M, Egger RJ, Speek AJ, Schrijver J, Saowakontha S, et al. Iron metabolism and vitamin A deficiency in children in Northeast Thailand. Am J Clin Nutr 1989; 50; 332-338. [ Links ]
21. Bloem MW, Wedel M, van Agtmaal EJ, Speek AJ, Saowakontha S, Schreurs W. Vitamin A intervention: short-term effects of a single, oral, massive dose on iron metabolism. Am J Clin Nutr 1990; 51: 76-79. [ Links ]
22. Mejía LA, Chew F. Hematological effect of supplementing anemic children with vitamin A alone and in combination with iron. Am J Clin Nutr 1988; 48: 595-600. [ Links ]
23. Semba RD, Bloem MW, The anemia of vitamin A deficiency: epidemiology and pathogenesis. Eur J Clin Nutr 2002; 56: 271- 281. [ Links ]
24. Thurnham DI, McCabe GP, Northrop-Clewes CA, Nestel P. Effects of subclinical infection on plasma retinol concentrations and assessment of prevalence of vitamin A deficiency: meta-analysis. Lancet 2003; 362: 2052-2058. [ Links ]
25. Harada H, Miki R, Masushige S, Kato S. Gene expression of retinoic acid receptors, retinoid –X receptors, and cellular retinol- binding protein I in bone its regulation by vitamin A. Endocrinology 1995; 136: 5329-5335. [ Links ]
26. Janson J, Archibald LK, Nwanyanwu OC, Bell M, Jensen RJ, Gunter E, et al. The effects of iron deficiency on lymphocyte cytokine production and activation: preservation of hepatic iron but not at all cost. Clin Exp Immunol 2001; 126: 466-473. [ Links ]
27. Méndez-Castellano H, de Méndez MC. Estratificación social y Biología humana. Método Graffar modificado. Arch Venez Puer Pediatr 1986; 49: 93-104. [ Links ]
28. Waterlow JC "Evaluación del Estado Nutricional en la Comunidad" en Malnutrición proteico energética OPS. 1996; Publicación N° 555: 260-280. [ Links ]
29. Nestel P. Adjusting Hemoglobin values in Program Surveys. [Citado 31 de marzo de 2005]. World wide web: <http:// inacg.ilsi.org/publications/index.cfm?pubentiyid=17. [ Links ]
30. Wittpenn J, West K, Keenum D, Farazdaghi M, Humpherey J, Howard G, et al. Training Manual Assessment of vitamin A status by impression cytology. ICEPO, Dana Center for Preventive Ophthalmology 1988;1-25. [ Links ]
31. Morasso MC, Molero J, Vinocur P, Acosta L, Paccussi N., Raselli S, et al. Deficiencias de hierro y de vitamina A y prevalencia de anemia en niños y niñas de 6 a 24 meses de edad en Chaco, Argentina. Arch Latinoamer Nutr 2003; 53: 21-27. [ Links ]
32. Cunningham L, Blanco A, Rodríguez S, Ascencio M. Prevalencia de anemia, deficiencia de hierro y folatos en niños menores de siete años. Costa Rica, 1996. Arch Latinoamer Nutr 2001; 51: 37-43. [ Links ]
33. De Pee S, Dary O. Biochemical indicators of vitamin A deficiency: serum retinol binding protein. J Nutr 2002; 32: 2895S-2901S. [ Links ]
34. Kjolhede CL, Gadomski AM, Wittpenn J, Bulux J, Rosas AR, Solomons NW, et al. Conjunctival impression cytology: feasibility of a field trial to detect subclinical vitamin A deficiency. Am J Clin Nutr 1989; 49: 490-494. [ Links ]
35. Zabala MT. Prevalencia del déficit de vitamina A en niños yniñas entre 6 y 59 meses de edad. Ministerio de Salud y Desarrollo Social-Venezuela. Caracas 2003; 1: 1-33. [ Links ]
36. Soyano A, Gómez M. Participación del hierro en la inmunidad y su relación con las infecciones. Arch Latinoamer Nutr 1999; 49: 40S-46S. [ Links ]
37. Stephensen CB. Vitamin A, infection, and immune function. Annu Rev Nutr 2001; 21:167-192. [ Links ]
38. Feelders, Vreugdenhil F, Eggermont, Kuiper-Kramer, van Eijk, Swaak. Regulation of iron metabolism in the acute-phase response: interferon-ã and tumour necrosis factor á and decrease in circulating transferring receptors in cancer patients. Eur J Clin Invest 1998; 28: 520-527. [ Links ]
39. Tilg H, Ulmer H, Kaser A, Weiss G. Role of IL-10 for induction of anemia during inflammation. J Immunol, 2002; 169: 2204-2209. [ Links ]
40. Carman JA, Smith SM, Hayes CE. Characterization of a helper T lymphocyte defect in vitamin A-deficient mice. J Immunol 1989; 142: 388-393. [ Links ]
41. Bowman TA, Goonewardene MI, Pasatiempo AMG, Ross AC, Taylor CE. Vitamin A deficiency decreases natural killer cell activity and Interferon production in rats. J Nutr 1990; 120: 1264-1273. [ Links ]
42. Wieringa FT, Dijkhuizen MA, West CE, van der Ven-Jongekrijg J, Muhilal, van der Meer JWM. Reduced production of immunoregulatory cytokines in vitamin A-and zinc-deficient Indonesian infants. Eur J Clin Nutr 2004; 58:1498-1504. [ Links ]
43. Leal J, Castejón HV, Romero T, Ortega P, Gómez G, Amaya D, et al. Valores séricos de citocinas en niños con desordenes por deficiencia de vitamina A. Invest Clín 2004; 45: 193-294 [ Links ]
44. Dufour C, Corcione A, Svahn J, Haupt R, Poggi V, Nandor- Békassy A, et al. TNF-á and IFN-ã are over expressed in the bone marrow of Fanconi anemia patients and TNF-á suppresses erythropoiesis in vitro. Blood 2003; 102: 2053-2059. [ Links ]
45. Asano Y, Shibata S, Kobayashi S, Okamura S, Niho Y. Effect of interleukin 10 on the hematopoietic progenitor cells from patients with Aplastic anemia. Stem Cells 1999; 17: 147-151. [ Links ]
Nota
Financiado por: CONDES-LUZ














