Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Puericultura y Pediatría
versión impresa ISSN 0004-0649
Arch Venez Puer Ped v.70 n.2 Caracas jun. 2007
Correlación entre bilirrubina serica y bilirrubinometría transcutánea en neonatos estratificados por edad gestacional
Jaime A. Furzán (*); Mercedes Expósito (**); Consuelo Luchón (***)
(*) Pediatra Neonatólogo. Jefe de Servicio de Neonatología. Hospital Universitario Dr. Alfredo Van Grieken. Profesor Titular de Pediatría. Universidad Nacional Francisco de Miranda. Correspondencia: Servicio de Neonatología. Hospital Universitario Dr. Alfredo Van Grieken. Calle El Tenis. Coro. Edo. Falcón. Venezuela. Tlf. 0268-2513294 – 02682516433. Ext. 138-139 Cel:0416-0680399 Fax 0268-2532744. e-mail: jfurzan@hotmail.com
(**) Pediatra Neonatóloga. Especialista I Servicio de Neonatología. Hospital Universitario Dr. Alfredo Van Grieken. Venezuela.
(***) Pediatra Neonatóloga. Especialista I Servicio de Neonatología. Hospital Universitario Dr. Alfredo Van Grieken. Venezuela.
RESUMEN:
Introducción: La ictericia neonatal es un dilema diagnóstico y terapéutico muy común. Las decisiones basadas en mediciones seriadas de bilirrubina sérica se asocian con dolor en el niño, tiempo de espera y ansiedad por los resultados. La bilirrubinometría transcutánea puede ser una alternativa confiable si se demuestra su validez para poblaciones e instituciones particulares.
Objetivos: Establecer el grado de correlación entre bilirrubina sérica total (BST) y bilirrubina transcutánea (BTC) en neonatos estratificados por edad gestacional.
Métodos: Estudio de diseño transversal. Cien recién nacidos ictéricos, 50 de término y 50 pretérmino, fueron analizados. A cada niño se le realizó una medición simultánea de BST y BTC. Luego se calcularon los coeficientes de variación de las medias, las diferencias de las medidas, la sensibilidad y el valor predictivo positivo de la BTC, los coeficientes de correlación, la ecuación de la línea de regresión, y la equivalencia de ambas mediciones para predecir el riesgo de hiperbilirrubinemia.
Resultados: El coeficiente de variación de las medias fue similar para ambas mediciones (BST: 3,09%; BTC: 3,24%). Las mediciones de BST y BTC fueron diferentes en 95 niños, e iguales en 5 de ellos. En los 95 neonatos con lecturas divergentes, la BTC subestimó la BST en 59 y la sobreestimó en 36, con una diferencia promedio de 1,39 mg/dl (DE 0,58 mg/dl). La sensibilidad de la BTC para identificar una BST >12 mg/dl fue 87%, con un valor predictivo positivo de 94%. El coeficiente de correlación de toda la muestra fue 0,88; en los neonatos de término fue 0,92 y en los pretérmino fue 0,84. El 82% de los neonatos fueron correctamente clasificados por la BTC en los percentiles de riesgo para hiperbilirrubinemia significativa.
Conclusiones: La precisión de las medidas de BST y BTC es similar en nuestra institución. Aunque hay una correlación aceptable entre ambos métodos de valoración, independientemente de la edad gestacional, la técnica de la BTC tiende a subestimar los valores de BST cuando éstos exceden la cifra de 12 mg/dl. La medición de BTC puede predecir la posibilidad de hiperbilirrubinemia significativa en la mayoría de los neonatos, por lo que su uso prudente antes del egreso hospitalario puede reducir este riesgo y a la vez prevenir procedimientos innecesarios.
Palabras clave: Neonato, ictericia, bilirrubinometría transcutánea.
SUMMARY:
Background: Newborn jaundice with its potential for producing brain damage remains a continuing problem for pediatricians. Therapeutic decisions based on serial measurements of serum bilirubin (TSB) are time-consuming and associated with stress for the child, parents and practitioners. Transcutaneous bilirubinometry (TCB) may be an alternative method if its reliability is proven for a particular institution and population.
Objective: to establish the degree of correlation between TSB and TCB in newborn infants classified by gestational age.
Methods: cross-sectional study. 100 jaundiced infants, stratified into two groups of 50 preterm and 50 full-term newborns, were analyzed by simultaneous samples of TSB and TCB. Statistical analysis included estimates of differences between the two measurements, coefficients of variation of means, correlation coefficients, sensitivity and positive predictive value of TCB, and accuracy of TCB to predict significant hyperbilirubinemia
Results: the coefficient of variation of means was similar for both methods (TSB: 3.09%; TCB: 3.24%). Measurements of TSB and TCB were different in 95 infants and equivalent in 5. TCB underestimated TSB in 59 measurements and overestimated it in 36 of them, with a mean difference of 1.39 mg/dl (SD 0.58 mg/dl). Sensitivity of TCB to identify a TSB >12 mg/dl was 87%, with a positive predictive value of 94%. The global correlation coefficient was 0.88 (term infants: 0.92; preterm infants: 0.84). 82% of the infants were correctly classified by the TCB within the percentiles of risk for significant hyperbilirubinemia.
Conclusions: precision of measurements of TSB and TCB is similar in our institution. Despite a good correlation between the two methods, regardless the gestational age, TCB tends to underestimate TSB when bilirubin values go beyond 12 mg/dl. The TCB technique can accurately predict the risk of extreme hyperbilirubinemia, so it can be cautiously used prior to discharge to reduce this risk and to avoid unnecessary interventions.
Key words: newborn, jaundice, transcutaneous bilirubinometry.
InTRODUCCIÓn:
La ictericia en el recién nacido constituye uno de los problemas clínicos más comunes para el pediatra en cuanto a decisiones terapéuticas, debido al potencial neurotóxico de la bilirrubina, único de este grupo de edad. Todos los neonatos sanos desarrollan hiperbilirrubinemia no conjugada durante la primera semana de vida, y más de 50% de ellos desarrollan ictericia clínicamente visible durante este período. Este evento fisiológico, confrontado con la toxicidad eventual de la bilirrubina para el cerebro neonatal, representa un reto constante para el médico, que siempre debe diferenciar la ictericia fisiológica de la ictericia potencialmente dañina. Aunque la mayoría de los neonatos ictéricos tienen un curso benigno, el recién nacido con ictericia extensa debe ser identificado, cuidadosamente seguido, y si es necesario, tratado apropiadamente (1,2,3).
La hiperbilirrubinemia severa continúa siendo observada en neonatos de término y cerca del término, con una morbilidad significativa (4,5). Esta situación está condicionada por eventos inadvertidos que incrementan la bilirrubina por encima de los valores considerados como fisiológicos, y eventualmente, podría estar asociada con mayor riesgo de encefalopatía.
Los factores predisponentes hacia una mayor severidad de la hiperbilirrubinemia incluyen bajo peso al nacer, hemólisis no diagnosticada, retardo de la expulsión de meconio e interferencia con la alimentación exclusiva al seno. La política del egreso precoz antes de las 48 horas del nacimiento es un elemento de riesgo adicional debido a que el pico de bilirrubina ocurre a los tres o cuatro días de vida, cuando el niño está en casa, no supervisado por personal médico (2,6). De hecho, la ictericia es la primera causa de readmisión luego del alta precoz neonatal, y el kernícterus ha sido descrito en algunos de estos neonatos (7,8). Por esta razón, la identificación precoz del riesgo de desarrollar hiperbilirrubinemia severa es un objetivo obligatorio en el trabajo clínico diario. Los intentos dirigidos hacia este propósito incluyen la documentación de factores de riesgo clínicos y epidemiológicos (9,10), el desarrollo de pautas prácticas por la Academia Americana de Pediatría (11), y la estimación del riesgo por mediciones de bilirrubina sérica total (BST) antes del egreso hospitalario, clasificadas por percentiles dentro de un nomograma ideado por Buthani (12). Las recomendaciones anteriores implicarían que a todos los neonatos se les mida la BST previamente a su egreso, y que el niño sea supervisado 48 horas después de su alta, una pauta que es difícil de cumplir en instituciones públicas de salud por la alta densidad de nacimientos.
En la práctica clínica convencional, una vez hecho el diagnóstico visual de la ictericia, la medición inicial de la BST fundamenta las primeras resoluciones en cuanto al tratamiento. Este método de evaluación tiene algunas desventajas como son el dolor en el niño, la ansiedad del médico y de los padres por el tiempo de espera del resultado, y la falta de relación temporal entre la extracción y el reporte definitivo que puede dificultar su interpretación (13). Otro inconveniente radica en la gran variabilidad de las mediciones de laboratorio para la BST, lo que resulta en una falta de precisión de esta medida (14,15).
Un sistema alternativo para la valoración del niño ictérico es la medición de la bilirrubina transcutánea (BTC), método derivado de la necesidad de disponer de instrumentos indoloros y de lectura inmediata, para decisiones terapéuticas rápidas (16). Sus ventajas son múltiples. Es un procedimiento no doloroso y de resultado rápido, lo que favorecería su uso colectivo en la prevención de hiperbilirrubinemia significativa y encefalopatía por bilirrubina. Aún más, la BTC no mide la bilirrubina circulante, sino más bien la cantidad del pigmento que se ha movido desde el suero hasta el tejido. Si esto representa la cantidad de bilirrubina que está disponible para desplazarse hacia el tejido neuronal, este método podría ofrecer una mejor información que aquélla provista por la medición de BST en lo que concierne al riesgo de impregnación neurológica (13).
Aunque hay estudios que establecen una adecuada correlación entre BST y BTC (17-20), algunos otros han reportado una inconsistencia de ambas medidas a medida que la BST aumenta (21). Existen aún controversias sobre la influencia de factores como la edad gestacional (22), el color y el grosor de la piel (23-26), y la fototerapia (27). Algunos autores han sugerido que la validez del empleo de la BTC debe ser verificada en cada institución, pues puede haber circunstancias locales adicionales que pueden influir sobre su aplicación (28).
La medición de BTC ha sido incluso propuesta como un método equivalente a la BST antes del egreso institucional del recién nacido para estimar el riesgo de hiperbilirrubinemia y reducir las tasas de readmisión por ictericia (29,30).
Aunque los métodos de medición de la BTC han sido empleados en todo el mundo desde hace más de una década, no hay estudios publicados en nuestro país sobre la conveniencia de este método como alternativa de vigilancia del niño ictérico. En el Servicio de Neonatología del Hospital Universitario Dr. Alfredo Van Grieken se evalúan cada mes aproximadamente 120 neonatos ictéricos provenientes del área de alojamiento conjunto. Este hospital maneja un régimen de alta precoz, y 80% de los neonatos egresan antes de 48 horas, con el consiguiente riesgo de hiperbilirrubinemia severa. En el servicio, se emplea rutinariamente el nomograma de Buthani (12) para la predicción de este tipo de complicación.
En adición a lo anterior, en los neonatos críticamente enfermos bajo cuidados intensivos, la determinación de la bilirrubina es un procedimiento frecuente dado el mayor riesgo de daño cerebral en esta población. La alta incidencia de egreso precoz e ictericia clínica hace perentoria la aplicación de un método de medición de bilirrubina que sea rápido, confiable, indoloro y que pueda emplearse en grandes masas de población. El sistema Bilicheck (SpectRx, Respironics, Norcross, GA) utilizado en este estudio es un instrumento de nueva generación de lectura de BTC que emplea datos de refracción analizados a múltiples longitudes de onda, características que teóricamente le permiten una medición más confiable de la bilirrubina, independiente del color de la piel y de la edad gestacional. (19,20)
El objetivo de este estudio fue establecer la correlación entre la BST medida por el analizador del laboratorio y la BTC medida por el Bilicheck en neonatos estratificados por edad gestacional, a fin de evaluar la validez de la prueba en nuestra población, obtener una ecuación para la predicción de la BST a partir de la BTC, medir la sensibilidad y el valor predictivo positivo del método, y estimar si la BTC es equivalente a la BST para la predicción de hiperbilirrubinemia significativa.
MÉTODOS
Se realizó un estudio observacional analítico de diseño transversal, aprobado por el Comité de Bioética del Área de Posgrado de la Universidad Nacional Experimental Francisco de Miranda, y con el consentimiento informado de los padres. La población analizada estuvo conformada por neonatos atendidos en el Servicio de Neonatología del Hospital Universitario Alfredo Van Grieken, desde octubre 2005 a enero 2006. Esta institución es un hospital público nivel IV, afiliado a dicha universidad; maneja 5000 nacimientos por año y dispone de áreas de alojamiento continuo, cuidados especiales e intensivos, y consulta de seguimiento inmediato.
Los criterios de inclusión fueron neonatos con ictericia, edad posnatal menor de una semana y edad gestacional entre 29 y 42 semanas, a quienes se les practicó determinación de BST por indicación clínica como parte de sus cuidados. Los criterios de exclusión fueron los neonatos ictéricos en los que no fue factible la medición simultánea de BST y BTC, y el edema o trauma en la zona frontal de medición de la BTC.
En la hipótesis alternativa de la investigación se propuso una alta correlación entre BST y BTC, independientemente de la edad gestacional. Se trató de una hipótesis alternativa de dos colas, por la posibilidad de que la BTC subestimara o sobrestimara la BST.
Dado que la medida final a analizar fue una variable continua, el coeficiente de correlación, el tamaño óptimo de la muestra se estimó con base en las consideraciones siguientes: coeficiente de correlación más pequeño que se propuso detectar a través del estudio: 0,35; error alfa: 0,05; error beta: 0,05; poder estadístico de la prueba, 0,95 (31). Así, el tamaño predeterminado de la muestra estuvo conformado por 100 neonatos. Esta muestra fue luego estratificada en dos grupos según su edad gestacional, 50 recién nacidos de término (RNT) y 50 recién nacidos pretérmino (RNPT). La muestra fue no probabilística y se recolectó por reclutamiento consecutivo de cada paciente que cumplió los criterios de elegibilidad, hasta alcanzar el número ya establecido de niños.
Una vez admitido al estudio, a cada recién nacido se le realizó una medición simultánea de BST y BTC. Todas las muestras iniciales de BST fueron obtenidas por indicación clínica. Las medidas de BST total fueron realizadas en un autoanalizador de química marca Spectra II (Vitalab), a través de un método colorimétrico (Laboratorios Wiener), empleando suero obtenido de una muestra sanguínea por punción periférica. La valoración de BTC se hizo con el instrumento Bilicheck System (SpectRx - Respironics, Norcross, GA) El equipo Bilicheck es una innovación dentro de los sistemas de medición de BTC, debido a que analiza la intensidad de la luz reflejada a más de 100 longitudes de onda, y así contrarresta la interferencia de elementos cutáneos como melanina, hemoglobina y grosor de la piel.
Cada resultado de BTC se obtuvo haciendo cinco mediciones en distintos puntos de la frente del neonato, por un solo observador (ME), que desconocía los resultados de la medida de BST. La medición de BTC se efectuó dentro de los 30 minutos siguientes a la extracción de la muestra para BST. En los pacientes que recibían fototerapia para el momento de la medición, el procedimiento se hizo en el área de la frente protegida de la luz por el accesorio BiliEclipse recomendado por los fabricantes de Bilicheck.
La exactitud de las mediciones realizadas en el estudio estuvo determinada por la estandarización de los equipos de medición, el entrenamiento del operador del equipo y la repetición de las medidas. La confiabilidad fue definida por la calibración de los instrumentos y la medición ciega de la bilirrubina sérica en el laboratorio.
Para el análisis estadístico se utilizó el programa SPSS. Las variables continuas son presentadas como media y una desviación estándar. Las variables dicotómicas se reportan como distribuciones de frecuencia. Para la estimación de la precisión de las medidas de BST y BTC se midió el coeficiente de variación de las medias, obtenido por cinco mediciones repetidas de 10 muestras de BST y BTC. Se calcularon las diferencias de medición entre ambos métodos, y la sensibilidad y el valor predictivo positivo de la BTC, en general y para tres puntos de corte de la BST (<9, 9-12 y >12 mg/dl). Estos puntos de corte fueron escogidos porque definen algunos valores comúnmente empleados para decisiones terapéuticas.
El análisis inferencial consistió en la estimación del coeficiente de correlación de Pearson y el cálculo de la ecuación de la línea de regresión, con un intervalo de confianza de 95% y un valor alfa de 5%. En el análisis de regresión lineal, la BST se tomó como variable dependiente (y) y la BTC (x) como variable independiente. Una vez obtenida la ecuación de regresión, se aplicó este cálculo para estimar la predicción de la BST a partir del valor de la BTC.
Finalmente, se estimó la equivalencia de la BST y la BTC en el nomograma de predicción de Buthani para hiperbilirrubinemia significativa (12), sólo para los recién nacidos de término (>37 semanas) y cerca del término (35-37 semanas) elegidos para el estudio, tal como ha sido indicado por su autor. Para ello, se consideró que había una adecuada paridad entre los métodos cuando las mediciones se ubicaron en los mismos percentiles de riesgo del nomograma.
RESULTADOS
En el cuadro 1 se muestran las características demográficas de la población total de recién nacidos. La media de BST fue 11,50 mg/dl (intervalo 5,4 a 24,2 mg/dl) y la de BTC fue 10,68 mg/dl (intervalo 3 a 26,2 mg/dl) en los RNT, mientras que en los RNPT tales valores fueron 10,35 mg/dl (intervalo 5,2 a 19,8 mg/dl) y 10,27 mg/dl (intervalo 3 a 18,4 mg/dl), respectivamente (Cuadro 2). De las 100 determinaciones simultáneas de BST y BTC, 75 eran las primeras medidas en pacientes con un diagnóstico inicial de ictericia clínica. De los 100 niños analizados, 41 mostraron valores de BST mayores de 12 mg/dl, 27 presentaron esta medida entre 9-12 mg/dl, y en 32 la cifra fue menor de 9 mg/dl. Sólo siete niños tenían una BST >15 mg/dl para el momento de su inclusión. Un total de 20 pacientes, siete RNT y 13 RNPT, estaban recibiendo fototerapia cuando se determinaron las medidas simultáneas del estudio. En el grupo total de niños, el coeficiente de variación de las medias, una estimación de la precisión de las mediciones de la bilirrubina, fue 3,09% para la BST y 3,24% para la BTC.
En el cuadro 2 se presentan estos coeficientes de variación diferenciados para los dos grupos. Las mediciones simultáneas de BST y BTC fueron diferentes en 95 niños, y exactamente iguales en cinco de ellos. Las cinco mediciones idénticas ocurrieron en el subgrupo con BST >12 mg/dl. La media de las diferencias fue 1,39+0,58 mg/dl, y su intervalo estuvo entre 0,10 y 3,30 mg/dl. Veintinueve (30,5%) de estos 95 neonatos tuvieron una dife-rencia igual o mayor de 2 mg/dl entre ambas mediciones, mientras que en 66 (69,4%) la diferencia fue menor de 2 mg/dl.
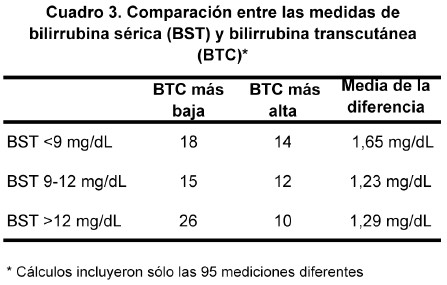
En el cuadro 3 se muestran estas diferencias estratificadas por los tres puntos de corte de BST. En los 95 neonatos con lecturas dispares, la BTC subestimó la BST en 59 y la sobreestimó en 36; sin embargo, a medida que la BST sobrepasó el valor de 12 mg/dl, la BTC exhibió valores inferiores a la BST con una mayor frecuencia que para los otros puntos de corte.
Así, de los 41 niños con BST >12 mg/dl, 26 tuvieron una lectura de BTC menor que la BST (Cuadro 3). De los siete neonatos con BST >15 mg/dl, cinco fueron correctamente identificados por el Bilicheck. El promedio de las diferencias en el punto de corte de BST >12 mg/dl fue 1,29 (intervalo 0,10-3,30 mg/dl). Este último valor extremo de diferencia lo manifestó un neonato pretérmino de 31 semanas.
En general, la sensibilidad y el valor predictivo positivo (VPP) global de la BTC para todos los valores de BST fue 88% y 87%, respectivamente. En el cuadro 4 aparecen la sensibilidad y el VPP de la BTC para los tres puntos de corte de BST. La sensibilidad del Bilicheck para detectar una BST >12 mg/dl fue 87%, con un VPP de 94%.
El coeficiente de correlación global de la población fue 0,88 (figura 1). Al discriminar ambos grupos, los resultados de la regresión lineal simple mostraron un coeficiente de correlación de 0,92 para los RNT (figura 2) y de 0,84 para los RNPT (figura 3). En las tres figuras aparece la ecuación de regresión para el cálculo de la BST a partir de la BTC. Para toda la población, esta ecuación de predicción de BST fue: y = 2,170 + 0,834 (x), donde y es el valor de BST y x es el valor de BTC. En las figuras 2 y 3 se muestran las ecuaciones correspondientes a cada uno de los dos grupos (RNT: y = 2,485 + 0,840 (x); RNPT: y = 2,081 + 0,805 (x)).
En el cuadro 5 se muestran los resultados de la aplicación hipotética de un modelo predictivo basado en la ecuación de regresión para la estimación de la BST a partir de la BTC, con un intervalo de confianza de 95%. Para la comparación de la equivalencia de la BTC con la BST en lo que se refiere a la predicción de hiperbilirrubinemia significativa en el nomograma de Buthani, se analizaron sólo los neonatos mayores de 35 semanas. De los 82 neonatos mayores de esta edad gestacional, 67 (81,7%) fueron correctamente clasificados y 15 (18,3%) fueron erróneamente catalogados por el Bilicheck. Doce de estos niños mal categorizados tenían una edad postnatal menor de 36 horas.
DISCUSIÓN
La reducción de la estadía hospitalaria del neonato luego de su nacimiento y la advertencia de que aún ocurren casos de kernícterus han dirigido la atención hacia la importancia de identificar y monitorear al recién nacido ictérico (1-3,8).
Como la mayoría de los neonatos son egresados antes de las 48 horas de vida, el pico de los valores de bilirrubina casi siempre aparece después de este egreso; esto hace perentoria la necesidad de vigilancia para prevenir la hiperbilirrubinemia severa (7,8,32,33). Dado que la estimación visual de la ictericia no es absolutamente confiable, este control depende de mediciones de bilirrubina sérica inevitablemente asociadas a dolor en el niño y preocupación e inconveniencia para los familiares y el médico. En este sentido, un método de estimación de la bilirrubina que sea no invasivo, confiable y rápido sería de enorme beneficio. Cualquier método alternativo a la medición de BST debe además tener una alta sensibilidad y un alto valor predictivo positivo o, en otros términos, generar un mínimo de falsos negativos, de manera que ningún neonato con posibilidad de daño por altos valores de bilirrubina pueda tener el riesgo de no ser apropiadamente identificado (34).
El sistema de medición bilicheck usado en este estudio ha sido investigado ampliamente como equipo de monitoreo de bilirrubina (18,19,20). En la mayoría de estos reportes se ha encontrado una adecuada correlación entre BST y BTC, pero tal correlación no es totalmente lineal, especialmente cuando hay valores altos de BST (21,35).
En la población neonatal analizada en esta investigación parece existir una precisión y una correlación aceptables entre los valores de BTC medidos por el Bilicheck y los valores de BST calculados en el laboratorio, independientemente de la edad gestacional. Tal correlación debe ser interpretada con algunas precauciones antes de ser aplicada en la práctica clínica diaria.
En casi todos los estudios, incluido el presente, la valoración de la validez de los bilirrubinómetros transcutáneos se ve limitada por la escasa precisión del patrón de referencia con el que se deben contrastar, el cual es la determinación de la BST por el laboratorio (14,15). Es común que esta medición tenga un alto error aleatorio, especialmente para valores elevados de BST. En realidad, el control de calidad de las medidas de BST se determina por análisis de cromatografía líquida de alta calidad (HPLC), y no por análisis de bilirrubina en laboratorios comunes de hospitales. Esto hace que la prueba de oro con la que se contrasta la medida de BTC sea imprecisa y se pueda distorsionar la valoración de cualquier medición comparada con este método. A pesar de esta observación, en el presente estudio se trató de evaluar tal error aleatorio de las medidas calculando su precisión mediante los coeficientes de variación. Estos coeficientes fueron bajos, por lo que se puede inferir que dentro de nuestra institución las mediciones de BST y BTC tienen una precisión y una variabilidad similares.
Los altos coeficientes de correlación entre BST y BTC descritos en esta investigación son similares a los reportados en otras poblaciones, tanto para neonatos maduros (18-20) como prematuros (22,36). Sin embargo, el presente estudio demuestra las inconveniencias de usar la correlación como la única medida de concordancia, pues a pesar de que existe una alta correlación, aún puede existir un margen de error entre los dos métodos (37).
Un extenso estudio en una población hispana de Dallas reportó una tendencia del Bilicheck a subestimar la BST, particularmente a niveles muy altos de bilirrubina (21). Este hallazgo es similar al de nuestra población, en la que 21 de los 41 neonatos con BST >12 mg/dl mostraron una BTC más baja que este valor, aunque con una diferencia promedio de 1,29 mg/dl. En este grupo de riesgo, la sensibilidad del Bilicheck fue 87%, lo que indica que aproximadamente 13% de los neonatos con BST >12 mg/dl pueden no ser exactamente identificados por el Bilicheck. Sin embargo, el valor predictivo positivo para este punto de corte de 12 mg/dl fue 94%. Esto implica que en nuestra población, un neonato con una BTC > 12 mg/dl tiene una posibilidad de 94% de tener una BST igual o mayor de ese nivel.
Una evaluación que escapa de los datos del presente estudio es el coeficiente de correlación particular de los neonatos con BST >12 mg/dl, ya que no se estratificaron los pacientes por valores de BST para el cálculo de los coeficientes. De hecho, un reporte previo ha comprobado que los coeficientes de correlación entre BST y BTC se reducen de forma significativa en los grupos con bilirrubinas más altas (35).
Otra observación confirmada por esta investigación, y que es concordante con datos ya publicados es la validez de la BTC en niños pretérmino (22,36) y bajo fototerapia (27,38), probado que la medición se haga en un área de la piel sin edema ni escoriaciones y, en el caso de la fototerapia, protegida de la luz. Esto permite que la BTC también sea útil para el seguimiento de la bilirrubina en neonatos que reciben fototerapia, ya que la buena correlación no fue alterada por esta modalidad de tratamiento.
Una interrogante aclarada en este estudio es si la medición de BTC puede ser efectivamente empleada como una técnica segura y equivalente a la BST para estimar el riesgo de hiperbilirubinemia severa antes del egreso del recién nacido, como ha sido recomendado en estudios pre-vios (29,30,39,40,41). Corzo et. analizaron la utilidad de la BTC como método de vigilancia de hiperbilirrubinemia en 100 neonatos de bajo riesgo, y describieron una seguridad aceptable de esta herramienta diagnóstica para decidir el alta precoz (39). Buthani et. evaluaron el Bilicheck en una población multirracial de 490 recién nacidos de término y prematuros tardíos, y reportaron la confiabilidad y reproducibilidad de la medición de BTC previa al egreso, con la advertencia de la escasez de datos sobre la eficacia segura del método en neonatos con BST >15 mg/dl (30). En nuestro estudio, 81,7% de los recién nacidos mayores de 35 semanas fueron correctamente ubicados por el bilirrubinómetro transcutáneo en los percentiles de riesgo reportados por Buthani (12), pero este hallazgo debe analizarse con algunas reflexiones.
En el nomograma de Buthani, los valores de BST >7 mg/dl a las 24 horas y >11 mg/dl a las 48 horas definen el percentil 75 (zona de riesgo intermedio alto; riesgo de hiperbilirrubinemia significativa 1:8). En la población que se analizó, 69% de los neonatos exhibieron una discrepancia entre BST y BTC menor de + 2 mg/dl. La magnitud de esta diferencia puede ser relevante a las 24 horas, puesto que en el nomograma el percentil 50 de la BST es 5 mg/dl, y el percentil 95 es 8 mg/dl. Así, pequeñas diferencias entre BST y BTC antes de las 24 horas podrían colocar al niño en categorías de riesgo muy distintas. Esto es mucho menos probable que ocurra más allá de las 24-36 horas, cuando la diferencia entre los percentiles 50 y 95 se incrementa. Así, aunque en nuestro estudio la mayoría de los neonatos fueron correctamente clasificados en el nomograma, es destacable que de los 15 niños erróneamente categorizados por el Bilicheck, 12 estaban en ese período precoz, por lo que este dato debe interpretarse con cautela. En la Unidad de Alojamiento Conjunto de nuestra institución, a todo niño <24 horas con BTC >5 mg/dl o >48 horas con BTC >9 mg/dl se le realiza de inmediato una BST, y con base en ésta se decide su curso.
La aplicación de la ecuación de regresión mostró valores de predicción de la BST, con intervalos de confianza medianamente aceptables. El uso prudente de la ecuación con sus rangos de valores probables podría reducir la frecuencia de extracciones innecesarias de BST (39).
En conclusión, a pesar de que existe buena correlación entre los dos métodos de medición, y una sensibilidad y un valor predictivo positivo aceptables de la BTC para los valores usuales de intervención terapéutica, el margen variable de error no permite recomendar la BTC como el único fundamento al momento de tomar la decisión crítica de si un neonato ictérico debe recibir tratamiento con fototerapia o exanguinotransfusión. Las indicaciones para implementar estas terapias deben basarse en la confirmación del valor de bilirrubina a través de una medida de BST, en especial cuando la BTC muestra valores >12 mg/dl, en el reconocimiento de factores que predisponen a aumentos excesivos de la bilirrubinemia y en la realización de pruebas seriadas que definan la producción y metabolismo de la bilirrubina en cada niño en particular. Finalmente, la medición de BTC puede predecir la posibilidad de hiperbilirrubinemia significativa en la mayoría de los neonatos de término y cercanos al término, por lo que su uso prudente antes del egreso puede reducir este riesgo y a la vez prevenir intervenciones innecesarias.
REFERENCIAS
1. Subcommittee on Neonatal Hyperbilirubinemia. Neonatal jaundice and kernicterus. American Academy of Pediatrics. Pediatrics 2001; 108(3):763-765. [ Links ]
2. Maisels MJ, Newman TB. Jaundice in full term and near-term babies who leave the hospital within 36 hours. The pediatricians nemesis. Clin Perinatol 1998; 25:295-302. [ Links ]
3. Dixon KT. Newborn jaundice and kernicterus. Greater awareness and action needed. Adv Nurse Pract 2004; 12(1):43-63. [ Links ]
4. Buthani VK, Johnson LH, Maisels MJ. Kernicterus: epidemiological strategies for its prevention through system-based approaches. J Perinatol 2004; 24:650-662. [ Links ]
5. Stevenson DK, Fanaroff A, Maisels J, Young BW, Wong RJ, Vreman HJ et al. Prediction of hyperbilirubinemia in term and near-term newborn infants. Pediatrics 2001; 108(1):31-39. [ Links ]
6. Brown AK, Johnson L. Loss of concern about jaundice and the reemergence of kernicterus in full term infants in the era of managed care. In: Fanaroff AA, Klaus MH, editors. The Yearbook of Neonatal and Perinatal Medicine. Philadelphia: Mosby Yearbook 1996;p. xvii-xviii. [ Links ]
7. Seidman DS, Stevenson DK, Ergaz Z, Gale R. Hospital readmission due to neonatal hyperbilirubinemia. Pediatrics 1995; 96(4):727-729. [ Links ]
8. Maisels MJ, Newman TB. Kernicterus in otherwise healthy, breast-fed term newborns. Pediatrics 1995; 96(4):730-733. [ Links ]
9. Newman TB, Xiong B, Gonzales VM, Escobar GJ. Prediction and prevention of extreme neonatal hyperbilirubinemia in a mature health organization. Arch Pediatr Adolesc Med 2000; 154(11):1140-1147. [ Links ]
10. Johnson L, Brown AK, Buthani VK. System-based approach to management of neonatal jaundice and prevention of kernicterus. J Pediatr 2002; 104(4):488-494. [ Links ]
11. American Academy of Pediatrics Subcommittee on Neonatal Hyperbilirubinemia. Management of hyperbilirubinemia in the newborn infant 35 or more weeks of gestation. Pediatrics 2004; 114(1):297-316. [ Links ]
12. Buthani VK, Johnson L, Sivieri EM. Predictive ability of a predischarge hour-specific bilirubin for subsequent significant hyperbilirubinemia in healthy term and near-term newborns. Pediatrics 1999; 103(1):6-14. [ Links ]
13. Knudsen A. Prediction and non-invasive assessment of neonatal jaundice in the term healthy newborn infant. Acta Paediatr 1996; 85:393-397. [ Links ]
14. Schreiner RL, Glick MR. Interlaboratory bilirubin variability. Pediatrics 1982; 69(3): 277-281. [ Links ]
15. Vreman HJ, Verter J, Oh W. Interlaboratory variability of bilirubin measurements. Clin Chem 1996; 42:869-973. [ Links ]
16. Maisels MJ. Historical perspectives: transcutaneous bilirubinometry. Neoreviews 2006; 7:e217-e225. [ Links ]
17. Maisels MJ, Ostrea Jr EM, Touch SE, Clune SE, Cepeda E, Kring E et al. Evaluation of a new transcutaneous bilirubinometer. Pediatrics 2004; 113(6):1628-1635. [ Links ]
18. Robertson A, Kazmierczak S, Vos P. Improved transcutaneous bilirubinometry: comparison of SpectRx Bilicheck and Minolta jaundice meter JM-102 for estimating total serum bilirubin in a normal newborn population. J Perinatol 2002; 22(1):12-14. [ Links ]
19. Ebbesen F, Rasmussen LM, Wimberley PD. A new transcutaneous bilirubinometer, Bilicheck, used in the neonatal intensive care unit and the maternity ward. Acta Paediatr 2002; 91(2):203-211. [ Links ]
20. Wong CM, van Dijk PJE, Laing IA. A comparison of transcutaneous bilirubinometer: Spectrx Bilicheck versus Minolta Airshields. Arch Dis Child Fetal Neonatal Ed 2002; 87(2):F137-F140. [ Links ]
21. Engle WD, Jackson GL, Sendelbach D, Manning D, Frawley WH. Assessment of a transcutaneous device in the evaluation of neonatal hyperbilirubinemia in a primarily hispanic population. Pediatrics 2002; 110(1):61-67. [ Links ]
22. Willems WA. Transcutaneous bilirubinometry with the Bilicheck in very premature newborns. J Matern Fetal Neonatal Med 2004; 16(4):209-214. [ Links ]
23. Slusher TM, Angyo F, Bode-Thomas F, Akor F, Pasm SD, Adetunji DW et al. Transcutaneous bilirubin measurements and serum total bilirubin levels in indigenous african infants. Pediatrics 2004; 113(6):1636-1641. [ Links ]
24. Kumar A, Faridi MM, Singh N, Ahmad SH. Transcutaneous bilirubinometry in the management of bilirubinemia in term neonates. Indian J Med Res 1994; 99:227-230. [ Links ]
25. Tan KL, Chia HP, Koh BC. Transcutaneous bilirubinometry in chinese, malay and indian infants. Acta Paediatr Scand 1996; 85(8):986-990. [ Links ]
26. Amit Y, Jabbour S, Arad ID. Effect of skinfold thickness on transcutaneous bilirubin measurements. Biol Neonate 1993; 63(4):209-214. [ Links ]
27. Tan KL, Dong F. Transcutaneous bilirubinometry during and after phototherapy. Acta Paediatr 2003; 92(3):327-331. [ Links ]
28. Sankaran K. Transcutaneous bilirubinometry in neonates. Paediatr Child Health 2006; 11(1):75-76. [ Links ]
29. Briscoe L, Clark S, Yoxall C. Can transcutaneous bilirubinometry reduce the need for blood tests in jaundiced full term babies? Arch Dis Child Fetal Neonatal Ed 2002; 86:F190- F192. [ Links ]
30. Buthani VK, Gourley GR, Adler S, Kreamer B, Dalin C, Johnson LH. Noninvasive measurement of total serum bilirubin in a multiracial predischarge newborn population to assess the risk of severe hyperbilirubinemia. Pediatrics 2000 106(2):pe17. [ Links ]
31. Hulley SB, Cummings SR, Browner S, Grady D, Hearst N, Newman TB. Designing Clinical Research. 2nd. Ed. Philadelphia. Lippincott Williams & Williams. 2001;p. 89. [ Links ]
32. Maisels MJ, Kring E. Length of stay, jaundice and hospital readmission. Pediatrics 1998; 101(6):995-998. [ Links ]
33. Edmonson MB, Stoddard JJ, Owens LM. Hospital readmission with feeding-related problems after early postpartum discharge of normal newborns. JAMA 1997; 278(4):299-303. [ Links ]
34. Schumacher RE. Transcutaneous bilirubinometry and diagnostic tests: The right job for the tool. Pediatrics 2002; 110(2):407-408. [ Links ]
35. Ochoa Sangrador C, Marugán I, Tesoro González R, García Rivera MT, Hernández Calvo MT. Evaluación de un instrumento de medición de la bilirrubina transcutánea. An Esp Pediatr 2000; 52:561-569. [ Links ]
36. Nanjundaswamy S. Transcutaneous bilirubinometry in preterm infants receiving phototherapy. Am J Perinatol 2005; 22(3):127-131. [ Links ]
37. Bland JM, Altman DG. Statistical methods for assessing agreement between two methods of clinical measurement. Lancet 1986; 1(8476):307-310. [ Links ]
38. Buthani VK, Jonson LH, Gourley g. Measuring bilirubin through the skin? Pediatrics 2003; 111(4):919-920. [ Links ]
39. Corzo Pineda JA, Jurado Hernández VH, Tejera Orozco JL, Martínez González M. Bilirubinometría transcutánea y egreso hospitalario temprano en neonatos de bajo riesgo con ictericia. Ginecol Obstetr Mex 2001; 69:194-199. [ Links ]
40. Thayyil S, Marriott L. Can transcutaneous bilirubinometry reduce the need for serum bilirubin estimations in term and near term infants? Arch Dis Child 2005; 90(12):1311-1312. [ Links ]
41. Petersen JR, Okorodudu AO, Mohammad AA, Fernando A, Shattuck KE. Association of transcutaneous bilirubin testing in hospital with decreased readmission rate for hyperbilirubinemia. Clin Chem 2005; 51(3):540-544. [ Links ]