Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Puericultura y Pediatría
versión impresa ISSN 0004-0649
Arch Venez Puer Ped v.71 n.1 Caracas mar. 2008
Calidad microbiológica de la leche humana procesada en el Banco de Leche Materna. Hospital Ruiz y Páez. Ciudad Bolívar.
Zandra Duran (*), Armando Guevara (**), Carmen Rodríguez (***), Lierry Carreño Carmona (****), Viayra Lourdes Rosas Alcoba. (*****)
(*) Pediatra. Coordinadora del Banco de Leche Materna. Hospital Universitario Ruiz y Páez. Venezuela.
(**) Microbiologo Clinico. Jefe de la Unidad de Infectología y Microbiología Médica del Hospital Universitario Ruiz y Páez. Venezuela.
(***) Lic. en Bioanálisis Maestria en Ciencia de los Alimentos. Profesor Agregado de Bioquímica. UDO. Venezuela.
(****) Médico Residente. I.V.S.S Hector Noel Joubert. Venezuela.
(*****) Lic. en Bioanálisis. Hospital Universitario Ruiz y Páez. Barrio Ajuro. calle Columbo Silva, Edif. Celina, apto 8 – B, Ciudad Bolívar. Teléfono habitación (0285) 6311063, Cel. (0416) 485.7139. Fax: (0285) 632.7398. Venezuela. email: viayra@hotmail.com
RESUMEN:
Los Bancos de Leche Humana son centros especializados que garantizan un producto bacteriológicamente seguro a los niños que la reciben.
Objetivo: Evaluar la calidad microbiológica de la leche humana procesada en el Banco de Leche del Hospital Ruiz y Páez, Ciudad Bolívar.
Método: Se recolectaron 30 muestras de leche obtenidas por extracción mecánica, durante el período agosto-noviembre del año 2004, se analizaron microbiológicamente antes y después de su pasteurización. Los parámetros investigados fueron recuento de Bacterias Aerobias Mesófilas, Coliformes Totales, Coliformes Fecales, Escherichia coli, y Estafilococos coagulasa positivos
Resultados: La leche humana sin pasteurizar mostró una carga microbiana total con un máximo de 105 UFC/ml, representado por el recuento de aerobios mesófilos. En cuanto al recuento de estafilococos, en 76,7% (23 muestras) creció hasta 10 UFC/ml y Staphylococcus aureus, en 16,7% (5 muestras) se presentó en el orden de 10 UFC/ml. Con relación a los Coliformes Totales, sus recuentos fueron menor o igual 102 NMP/ml, Coliformes Fecales menor a 10 NMP/ml, no se encontró Escherichia coli. Luego de efectuar el proceso de pasteurización, se determinó la ausencia de microorganismos en todas las muestras analizadas.
Conclusión: La leche humana distribuida a los niños de este hospital se encuentra dentro de los estándares microbiológicos demostrando ser apropiadas las condiciones bajo las cuales se pasteuriza la leche humana en el Banco de leche del Hospital Ruiz y Páez.
Palabras Clave: Bancos de leche humana, Pasteurización, Leche materna, Calidad microbiológica.
SUMMARY:
The Human Milk Banks are specialized centers that guarantee a bacteriologicaly safe product for those children who receive it.
Objective: To evaluate the microbiological quality of processed human milk at the Milk Bank of the Hospital Ruiz y Páez, of Ciudad Bolivar.
Method: 30 milk samples were collected by mechanical extraction, during the period of August-November 2004. The samples were microbiologically analyzed before and after its pasteurization. The investigated parameters were counts of Aerobic Bacteria Mesophyla, Total Coliforms, Fecal Coliforms, Escherichia coli, and positive coagulase Staphylococci.
Results: Human milk prior pasteurization showed a total microbial load with a maximum of 10º UFC/ml, which was represented by the count of mesophile aerobes. The count of Staphylococci, reached 10 UFC/ml in 76,7 % (23 samples), Staphylococcus aureus was present up to10 UFC/ml in 16,7% (5 samples). In relation with the total Coliforms, their counts were under or equal to 10 NMP/ml and fecal Coliforms under 10 NMP/ml. Escherichia coli was not found. After pasteurization, all samples were free from any type of microorganism.
Conclusion: The human milk distributed to children of this hospital, is within microbiological standards, indicating that the conditions under which human milk is pasteurized at the Milk Bank of the Hospital Ruiz and Páez are appropriate.
Key words: Human milk banks, Pasteurization, Maternal milk, Microbiological Quality.
INTRODUCCIÓN:
Es un hecho aceptado universalmente que la leche humana debe constituir el único alimento que el niño reciba durante los primeros seis meses de vida postnatal ya que ella es la mejor y más importante fuente nutritiva en esta edad, garantizándole el pleno desarrollo y crecimiento (1-3). Existen situaciones especiales en las cuales la lactancia materna está contraindicada, por ejemplo, cuando la madre está gravemente enferma, en tratamiento con quimioterapia o cuando necesita realizarse estudios con sustancias radiactivas (2).
Con el fin de que los niños prematuros, con patologías graves o impedidos de recibir lactancia materna directa de sus madres puedan ejercer este derecho, fueron creados los Bancos de Leche Humana, que son centros especializados, responsables de la promoción, protección y apoyo de la lactancia materna; en los cuales se extrae, almacena, conserva, procesa y distribuye la leche humana garantizándole a los niños que la reciben un producto bacteriológicamente seguro y con una calidad nutricional óptima, acorde a sus necesidades y requerimientos (4).
La experiencia con el almacenamiento de leche humana en bancos se extiende a más de medio siglo. En Latinoamérica, varios países entre ellos Argentina, Brasil, Costa Rica, Colombia y Venezuela, establecieron Bancos de Leche Humana en los últimos 25 años.
En Venezuela, se han establecido Bancos de Leche Humana tomando como modelo la experiencia que tiene Brasil al respecto. En 1985, Brasil contaba con diez unidades de servicio y en una década pasó a tener más de cien Bancos de Leche Humana, con reconocimiento internacional de The Human Milk Bank Association of North America (5).
A través de un programa de cooperación técnica establecido entre el Ministerio de la Salud Brasilero y el gobierno Venezolano, siete Bancos de Leche ya fueron implantados en Venezuela, así como programas de cooperación se han establecido con la Universidad Central de Venezuela, para transferencia de tecnología en el ámbito de actuación de los Bancos de Leche Humana (5). En nuestro país, el primer Banco de Leche Humana se fundó en Caracas, en el año 1986, ubicado en el Hospital Universitario de Caracas y los otros seis están en los estados Apure, Bolívar, Guárico y Sucre, en hospitales que cuentan con servicios de Obstetricia, Pediatría y Neonatología.
La leche humana procesada en estos centros recolectores debe conservar sus cualidades biológicas y de defensa para el niño recién nacido, así como su calidad bacteriológica (6). Esta, como todo alimento, es un cultivo para el desarrollo de microorganismos, que mientras se encuentra dentro de la madre es un líquido estéril, libre de contaminación microbiana, pero como todo fluido corporal tiende a contaminarse una vez fuera, producto de su manipulación y tratamiento posterior. No obstante, se deben observar técnicas higiénicas apropiadas para la recolección y procesamiento, de esta manera se evita la contaminación por microorganismos, preservando los beneficios inmunológicos y nutricionales (2).
La flora microbiana que debe investigarse tendrá que incluir, por lo tanto, aerobios mesófilos, flora indicadora de contaminación fecal y Staphylococcus aureus. Las bacterias aerobias mesófilas constituyen un grupo de microorganismos que crecen en placa de agar a 30 - 37 °C, estando su temperatura óptima de crecimiento entre 30 y 45° C. Todas las bacterias patógenas conocidas vehiculadas por los alimentos son mesófilas (7).
Dentro de los organismos de interés sanitario se encuentra el género Enterobacteriaceae que incluye a los coliformes totales, fecales y Escherichia coli. La utilización del grupo completo de las Enterobacteriaceae como indicador fue sugerida desde 1952 y su presencia en número significativo indica una anomalía o fallo en la calidad microbiológica del alimento y, consiguientemente, un riesgo para el consumidor (8).
Se ha comprobado que la determinación de Enterobacteriaceae supone una protección suficiente para el consumidor, mientras que las pruebas para coliformes o coliaerogenes, grupo menos numeroso que las Enterobacteriaceae, no son buenas indicadoras de la calidad microbiológica, cuando se determinan en forma aislada (7). Un microorganismo de riesgo para la salud, cuya presencia en alimentos indica generalmente una acción directa o indirecta de contaminación fecal, falta de higiene en el manejo del alimento y un almacenamiento inadecuado es Escherichia coli; un bacilo corto Gram negativo, catalasa positivo, oxidasa negativo y anaerobio facultativo (7).
También puede ser utilizado como indicador, en este caso de manipulación, el Staphyloccocus aureus; se presenta en forma de cocos Gram positivos, catalasa positivos y muestra un metabolismo de anaerobio facultativo. Produce una gama especialmente amplia de sustancias (agresinas y exotoxinas) siendo las enterotoxinas las responsables de intoxicaciones alimentarias (7).
Este microorganismo es un patógeno oportunista, su presencia en los alimentos es un índice del grado de contacto humano o con alimentos naturales no tratados de origen animal dentro de la fábrica de alimentos, y se interpreta. Por lo general, como indicativo de contaminación a partir de la piel, la boca y las fosas nasales de los manipuladores de alimentos; si bien el material, el equipo sucio y las materias primas de origen animal pueden ser asimismo la fuente de contaminación. Cuando se encuentra un gran número de estafilococos en un alimento, ello significa, por lo general, que las prácticas de limpieza y desinfección y el control de la temperatura no han sido, en algún lugar, adecuados (8).
Trombino et al. estudiaron los efectos de los procesos de higienización sobre la calidad microbiológica de la leche humana extraída en el Banco de Leche Humana del Hospital Universitario de Caracas, y encontraron una relación directa entre las condiciones de procesamiento y los microorganismos presentes en la leche humana (9).
La pasteurización es un tratamiento aplicado a la leche, que produce inactivación térmica del 100% de bacterias patógenas y el 90% de la flora saprófitas, esto se obtiene a través del binomio temperatura/tiempo, 62,5 ºC por 30 minutos (6).
Los microorganismos patógenos que puedan crecer y reproducirse en el seno de la leche son sensibles al tratamiento térmico; cada constituyente de la leche tiene un diferente grado de sensibilidad a la temperatura; por ejemplo, las enzimas en forma libre y las proteínas del suero son mucho más lábiles al calor que las caseínas y estas a su vez que los lípidos y los carbohidratos (8).
La pasteurización se combina con el congelamiento como método alterno para inactivar contaminantes en la leche y probablemente sea la temperatura el más importante de los factores ambientales que afectan la viabilidad y el desarrollo microbiano. La leche sin pasteurizar y almacenada a -18 ºC se puede mantener de dos a tres meses; y pasteurizada, de seis meses hasta un año a la misma temperatura (4).
Luego de todas estas consideraciones surge la necesidad de garantizar una leche humana sin riesgos a todos aquellos lactantes que por diferentes motivos no pueden ser amaman- 6 tados por sus madres, y para que el Banco de Leche pueda brindar un producto en óptimas condiciones nutricionales e higiénicas es necesario hacer estudios de caracterización bajo las condiciones actuales de funcionamiento.
METODOS:
El estudio realizado tuvo un diseño de investigación descriptivo-comparativo, cuasi-experimental, ex post-facto, en el cual se evaluó la calidad microbiológica de la leche humana procesada en el Banco de Leche. Hospital Ruiz y Páez.
La población estuvo conformada por todas las muestras de leche madura, congeladas y pasteurizadas durante los meses agosto-noviembre del año 2004, cada una tuvo un volumen de 8 ml provenientes de un pool de varias madres donadoras que completaron un volumen de 350 ml, cantidad necesaria para pasteurizar.
Criterios de inclusión:
1. Madres sanas en periodo de lactancia.
2. Edades comprendidas entre 17 a 35 años.
3. Embarazo controlado.
4. Seronegativos para el Virus de Inmunodeficiencia Humana.
5. V.D.R.L. no reactivo.
6. No haber recibido tratamiento antibiótico durante las 48 horas previas a la donación.
7. Voluntarias a donar el excedente de leche en el BLH del Complejo Hospitalario Ruiz y Páez.
METODOLOGÍA:
Al llegar la madre donadora al BLH se llenaron los datos en una ficha personal y luego pasaron a la sala de higienización donde se le indicó:
Retiro de blusa, sostén y prendas (cadenas, sortijas, relojes, pulseras, zarcillos.)
Colocación de bata estéril con abertura hacia adelante, gorro y tapaboca. Lavado de manos con agua y jabón líquido.
Lavado de mamas con agua.
Secado con gasa estéril.
Una vez realizada la higiene, la madre fue conducida al área de extracción, donde asistida por el personal del servicio se le indicó, sentarse cómodamente con la espalda relajada e inclinada un poco hacia adelante, se procedió a realizarle en las mamas un masaje suave en forma circular para facilitar la eyección de la leche descartando las primeras gotas y posteriormente, se le colocaron en ambas mamas las copas de la bomba eléctrica extractora, marca Medela, durante 15 minutos aproximadamente.
Una vez obtenida la muestra en el BLH se trasladó al área de procesamiento ubicada en el mismo servicio y se procedió a su almacenamiento en congelación a -18 °C por un lapso de 72 horas.
Transcurrido este tiempo se descongeló en el refrigerador a 5 ºC, luego se sacó a temperatura ambiente, y en un área estéril bajo campo de llama se procedió a trasvasar la leche humana madura a envases de vidrio estériles con capacidad de 350 ml realizando un pool; luego se tomó con pipeta estéril 8 ml del pool de la leche humana (muestra nº 1), y se llevó a un balón estéril con tapón de algodón. Inmediatamente, se trasladó la muestra al Servicio de Microbiología del mismo hospital para preparar las diluciones de trabajo realizándose los respectivos análisis microbiológicos.
La leche humana restante se pasteurizó en el área de pasteurizado del BLH, para lo cual, se introdujeron 5 envases conteniendo muestras de leche humana, más un envase testigo en el pasteurizador marca Gemmy Industrial Corp. durante 30 minutos a una temperatura de 62,5 ºC. Transcurrido este tiempo se sumergieron estos frascos en un envase contentivo de agua a 0 ºC hasta alcanzar 5 ºC, con el fin de obtener el efecto del choque frío e inmediatamente después se tomó la muestra nº 2 con la misma metodología y bajo las mismas condiciones aplicadas a la muestra anterior.
Preparación de las diluciones (10)
a) Recuento de Bacterias Aerobias Mesófilas (11)
b) Recuento de Coliformes Totales (12)
c) Determinación de Coliformes Fecales (13)
d) Determinación de Escherichia coli (12)
e) Recuento de estafilococos coagulasa positivos (Staphylococcus aureus) (13)
El análisis estadístico fue presentado tomando en cuenta métodos de la estadística descriptiva a través de la aplicación de tablas de distribución de frecuencias absolutas y porcentuales.
RESULTADOS:
En la leche humana almacenada y sin pasteurizar, se obtuvo desarrollo de microorganismos aerobios mesófilos en el 100% de ellas (30 muestras); encontrándose en el 40% de los casos (12 muestras), una carga microbiana entre 103-104 UFC/ml. Solo 13,3% (4 muestras) alcanzaron contajes hasta 105 UFC/ml, las demás muestras presentaron contajes entre 10 -103 UFC/ml (Cuadro 1).
Con relación a los estafilococos, se observó que 76,7% de los casos (23 muestras) estaban presentes en concentraciones menores o iguales a 10 UFC/ml, seguido por 16,7% (5 muestras) con contajes entre 10 - 102 UFC/ml. No se observaron recuentos de estafilococos por encima de 104 UFC/ml, Staphyloccocus aureus se presentó en el orden de menor o igual a 10 UFC/ml en 16,7% (5 muestras) (Cuadro 1).
En lo que respecta al contaje de otros microorganismos se encontró que 43,3% (13 muestras) presentaron concentraciones entre 10 - 102 UFC/ml, seguido de 36,7% (11 muestras) con recuentos iguales o inferiores a 10 UFC/ml. El recuento de este grupo de microorganismos no sobrepasó de En cuanto a microorganismos de origen fecal se encontró que en coliformes totales, 80% (24 muestras) presentaron recuentos inferiores a 10 NMP/ml y 20% (6 muestras) alcanzaron rangos entre 10 - 102 NMP/ml. No se encontraron muestras de leche humana con contajes de coliformes totales superiores a 102 NMP/ml (Cuadro 2).
En los coliformes fecales, el 100% (30 muestras) estuvo en el orden de la primera dilución decimal, es decir, sus recuentos no sobrepasaron las 10 NMP/ml. No se detectó la presencia de Escherichia coli en ninguna de las muestras analizadas (Cuadro 2).
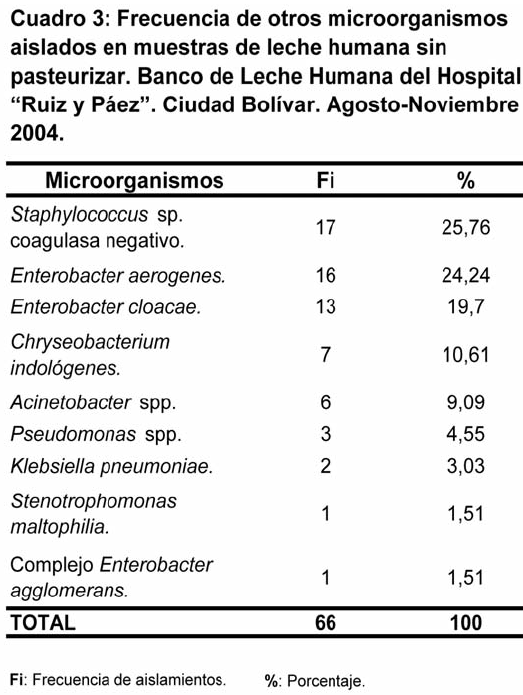
En el Cuadro 3 se observa que el germen con mayor frecuencia fue Staphylococcus sp. coagulasa negativo con 25,76% (17 aislamientos), seguido por el género Enterobacter con 24,24% (16 aislamientos) y 19,70% (13 aislamientos) para Enterobacter aerogenes y Enterobacter cloacae respectivamente.
Entre los microorganismos con menor frecuencia se encontraron Stenotrophomonas maltophilia (01 aislamiento) y Complejo Enterobacter agglomerans (01 aislamiento), ambos con un porcentaje de 1,51%. También fueron identificadas bacterias como Chryseobacterium indologenes, Acinetobacter spp., Pseudomonas spp. y Klebsiella pneumoniae (Cuadro 3).
Luego de la pasteurización no se observó crecimiento de microorganismos en la leche en el 100% de los casos (30 muestras).
DISCUSIÓN:
Desde la primera mitad de este siglo existe evidencia de almacenamiento de leche humana en Bancos de Leche de diversas regiones del mundo, en estos lugares se recolectan grandes cantidades de leche humana ordeñada para ser suministrada a todos aquellos niños recién nacidos que por diversas razones no pueden ser amamantados por sus madres y debido a la vulnerabilidad de la salud de estos, se requiere del empleo de técnicas adecuadas de recolección, procesamiento y control de calidad, garantizándoles que reciben un producto bacteriológicamente seguro y con calidad nutricional óptima acorde a sus necesidades y requerimientos. Este dilema ha inducido a una serie de investigadores a someter las muestras de leche a diferentes procesos y a estudiar su flora bacteriana (2,14,15).
En el presente estudio se encontró que la leche humana sin pasteurizar mostró una carga microbiana total con un máximo de 105 UFC/ml, representado por el recuento de aerobios mesófilos. Este resultado coincide con Sosa y Barnes (16), Moreno et al. (17) y Assis et al. (18), quienes encontraron recuentos menores de 105 UFC/ml en muestras de leche sin pasteurizar. Sin embargo, se han encontrado otros superiores, tal es el caso de Almeida (15), quien obtuvo un contaje en el rango de 102 -107 UFC/ml y Trombino et al. (9) con valores iguales o inferiores a 106 UFC/ml; estos hallazgos contrastan con los criterios microbiológicos, que afirman que para obtener una leche de calidad óptima, ésta debe tener menos de 2,5 x 103 UFC/ml y para una calidad aceptable 2,5 x 103 – 104 UFC/ml de aerobios mesófilos (19).
En Venezuela no existe una norma que estandarice los recuentos microbiológicos en leche humana, sin embargo, en países del Reino Unido se establece que antes de la pasteurización no debe existir crecimiento bacteriano superior a 105 UFC/ml (20). De igual manera, según La Asociación Norteamericana de Bancos de Leche Humana, la leche recolectada no debe tener bacterias patógenas, o no más de 104 UFC/ml (9).
Basado en estos criterios, otros investigadores como Tyson et al. (21), afirman que un contaje mayor a 105 UFC/ml se debe considerar no apta para el consumo; esto es constatado en el trabajo realizado por Williansom, citado por Guevara et al. (14), quien señala que la leche se puede utilizar sin pasteurizar cuando su conteo bacterial está por debajo de 106 UFC/ml.
Es de destacar que no existe uniformidad de criterios en cuanto a los valores que pueden ser considerados como satisfactorios en la leche humana sin procesar (9), sin embargo, según los estándares internacionales anteriormente citados, los resultados obtenidos en esta investigación se encuentran dentro de los criterios microbiológicos.
Con relación al recuento de estafilococos, esta investigación reveló que 76,7% (23 muestras) de contaminación por este microorganismo fue de una dilución decimal o menos, es decir 10 UFC/ml, lo cual coincide con los resultados de Trombino et al. (9) y Pontes et al. (22) quienes reportan iguales recuentos en 67,6% (23 muestras) y 44,4% (12 muestras) respectivamente. Es posible encontrar muestras de leche humana con mayor contaminación por estafilococos, contajes de hasta103 UFC/ml, tal es el caso de Almeida (15) que los reportó en un 72,2% (14 muestras).
La presencia de estafilococos puede ser interpretada de manera general, como un indicador de contaminación a partir de piel y fosas nasales, en virtud de la manipulación inadecuada del producto (14,15). La mayor preocupación en cuanto a estafilococos, incide sobre la ocurrencia de Staphylococcus aureus, productor de toxinas termorresistentes (8,15,23), el cual fue aislado en la presente investigación en el orden de 10 UFC/ml en 16,6% (5 muestras) con relación al total de estafilococos.
En lo que respecta a Staphylococcus aureus, Guevara et al. (14) y Ponte et al. (22), señalan recuentos bajos, similares a los de esta investigación en 0,4% y 3,4% respectivamente; mientras que Assis et al. (18) reportan 105 UFC/ml en 32% de sus muestras.
En países del Reino Unido, las normas de recolección son muy estrictas y establecen controles microbiológicos previos al proceso de pasteurización según los cuales la presencia de bacterias patógenas o no, conduce al rechazo de la muestras (20). Esto coincide con los criterios microbiológicos de los Lactarios en Colombia, que expresan que S. aureus debe ser negativo en la leche humana ordeñada que va a ser consumida (19).
Definitivamente, la presencia de estafilococos está directamente relacionada con las condiciones sanitarias tanto del personal que labora en el área como de utensilios y equipamiento, en especial de las bombas extractoras de leche. Kuerten y Goulart (23) en un trabajo realizado en Bancos de Leche aislaron S. aureus de manos y orofaringe 9 del personal del servicio, esto permite inferir en cuanto a posibles condiciones insatisfactorias de higiene. Estos autores reportaron el aislamiento no solo de S. aureus sino también Pseudomonas aeruginosa, Escherichia coli y Streptococcus b-hemolíticus (15, 24-26).
En relación a los Coliformes Totales, en el presente estudio alcanzaron un crecimiento bacteriano menor o igual a 102 NMP/ml, y de Coliformes Fecales menor a 10 NMP/ml, lo que difiere del resultado de Assis et al. (18) que obtuvo un contaje de coliformes totales de 103 NMP/ml. Ambos hallazgos difieren de criterios microbiológicos que afirman que en la leche humana no debe haber coliformes (19).
La presencia de microorganismos del grupo coliforme, indica la posibilidad de una contaminación de origen fecal (15), lo que ratifica Kuerten y Goulart (23) cuando demostraron mediante inspección sanitaria que la contaminación de la leche con coliformes provenía en 49,5% de las condiciones higiénicas del servicio de Banco de Leche.
Con relación a Escherichia coli, no se determinó su presencia en ninguna de las muestras procesadas; a diferencia de Kuerten y Goulart (23); Trombino et al. (9) y Guevara et al. (14) quienes lo aislaron en sus trabajos. Su presencia en los alimentos indica contaminación de las muestras con materia fecal, deficiencia de higiene en el manejo de los alimentos y almacenamiento inadecuado de los mismos (7). Los resultados de esta investigación sugieren que la aplicación de medidas higiénicas por parte del personal de Banco de Leche del hospital Ruiz y Páez es adecuada.
En este estudio se encontraron otros microorganismos y se observó que Staphylococcus sp. coagulasa negativo obtuvo mayor frecuencia de aislamiento (17 aislamientos), resultado que coincide con otros autores, quienes aislaron específicamente, Staphylococcus epidermidis en las muestras de leche humana (9, 14, 15, 17, 23, 27-31). En segundo lugar se encontró Enterobacter aerogenes (16 aislamientos), microorganismo también aislado por Guevara et al. (14); además se evidenció la presencia de Enterobacter cloacae (13 aislamientos) hallazgo que coincide con el trabajo realizado por Trombino et al. (9).
En esta investigación se observó, crecimiento de Chryseobacterium indologenes (7 aislamientos), Acinetobacter spp. (6 aislamientos). Además, se aisló Pseudomonas spp. (3 aislamientos), hallazgo que coincide con la investigación realizada por Myron et al. (24); Guevara et al. (14) y Sosa y Barnes (16).
También se evidenció la presencia de Klebsiella pneumoniae (2 aislamientos), germen que igualmente fue encontrado en los trabajos realizados por Guevara et al. (14), Sosa y Barnes (16) y Olowe et al. (27); mientras que el Complejo Enterobacter agglomerans y Stenotrophomona maltophilia, se aislaron una vez cada uno. Guevara et al. (14), señala haber encontrado más de un microorganismo en el 71% de las muestras, resultado que difiere del presente estudio donde se obtuvo un porcentaje del 95,78% de muestras con más de un microorganismo.
La presencia de todos estos microorganismos en la leche humana sin pasteurizar pudiera deberse a que la mayoría de ellos son agentes causantes de infecciones nosocomiales, son patógenos oportunistas que colonizan el ambiente hospitalario y según el boletín sobre etiología y resistencia bacteriana, enero-agosto del 2002 del Hospital Ruiz y Páez, todos estos microorganismos forman parte de la flora hospitalaria del mismo (32).
Algunos autores refieren que al aplicar métodos higiénico- sanitarios apropiados se puede reducir en gran número la contaminación de la leche humana ordeñada, con relación a mesófilos y estafilococos, así como eliminar los microorganismos pertenecientes a los grupos coliformes; mejorando la calidad microbiológica de la leche (14, 15, 33).
El mantenimiento de la leche humana en refrigeración por más de 48 horas contribuye a evitar el riesgo de crecimiento bacteriano (14, 15, 17). De igual modo, el descartar los primeros ml. de leche en el momento de su extracción puede reducir sustancialmente el contaje bacteriológico, tal como se hizo en este trabajo, ya que la permanencia en los ductos colectores puede contaminarla con bacterias de la piel de la madre e incluso de la boca del niño (14, 15, 33).
Con los procesos de congelación y pasteurización, la leche humana pierde parte de su valor biológico, sin embargo, no llevar a cabo estos procedimientos la exponen a una contaminación bacteriana que al ser ingerida por el neonato puede actuar como una fuente potencial de agentes patógenos (14, 33, 34).
Myron et al. (24), señalan que la leche humana se debe pasteurizar si el contaje bacterial es mayor de 105UFC/ml; por otra parte, la Food and Drug Administration, citada por Trombino et al. (9) y el Center of Diseases Control and Prevention recomiendan usar leche con tratamiento térmico ya que la pasteurización produce inactivación térmica del 100% de las bacterias patógenas (6).
Luego de efectuar el proceso de pasteurización a 62,5 ºC por 30 minutos, se determinó la ausencia de microorganismos en todas las muestras analizadas. Este resultado coincide con Knoop et al. (34), donde el patrón porcentual de muestras estériles luego de la pasteurización fue de 100%. Sin embargo, otros autores han reportado la presencia de microorganismos luego de la pasteurización en las mismas condiciones; Assis et al. (18) presentó valores de 102 UFC/ml para el contaje de aerobios mesófilos; Trombino et al. (9), obtuvo recuentos inferiores a 10 UFC/ml para aerobios mesófilos, S. aureus y contajes menores a 10 UFC/ml para coliformes. Almeida, (15), obtuvo una reducción de 55,8% en la población de mesófilos, y observó la inactivación completa de los estafilococos.
El resultado de esta investigación se encuentra dentro de los estándares microbiológicos de Bancos de Leche del Reino Unido los cuales señalan que debe existir ausencia total de microorganismos en la leche humana luego de su pasteurización (20) y estos resultados demuestran que las condiciones bajo las cuales se pasteuriza la leche son apropiadas.
El proceso de pasteurización es el mecanismo más efectivo para la completa eliminación de microorganismos en la leche humana (2, 4, 6, 8) y su inclusión dentro del proceso, permite obtener productos seguros y de calidad comparable a los de otros bancos a nivel mundial.
CONCLUSIÓN:
1. La carga microbiana total de la leche humana luego de su almacenamiento, antes de pasteurizar, alcanzó un máximo de 105 UFC/ml; lo cual justifica su pasteurización.
2. Luego de la pasteurización, en el 100% de las muestras se evidenció la ausencia de microorganismos indicadores en la leche humana.
3. El proceso de pasteurización sobre la carga microbiana de la leche humana fue 100% eficaz.
REFERENCIAS:
1. Bueno O, Lázaro A. 1999. Lactancia Materna en: Bueno M, Sarría A. y Pérez J. Nutrición en Pediatría. Edit. Ergón. Madrid. Cap. XIII: 125 -145. [ Links ]
2. Neira L. M. 1999. Lactancia para la mujer contemporánea en: Rojas C. y Guerrero L. Nutrición clínica y gastroenterología pediátrica. Edit. Méd. Panam. Bogotá. 7ma ed. Cap. IV: 50 - 67. [ Links ]
3. UNICEF. 2001. Progreso desde la cumbre mundial a favor de la infancia. (En línea). Disponible: www.unicef.org/spanish. (Enero, 2004). [ Links ]
4. American Academy of Pediatrics. commitee on Nutrición. 1997. Breast Feedinf and the use of Human Milk. Pediatrics; 100: 235-239. [ Links ]
5. Guerra J. 2003. Bancos de leite humana. (En línea). Disponible: www.redeblh.fiocruz.br (Febrero 2004). [ Links ]
6. Víquez A. 2002. Situación de la Lactancia Materna en la transmisión de VIH en América Latina. (En línea). Disponible: www.sidalacorg.mx/spanish/publicaciones/lactancia/víquez.pdf (Febrero, 2004). [ Links ]
7. International Commission on Microbiological Specifications for Foods (ICMSF). 2000. Microorganismos de los alimentos 1. Su significado y método de enumeración. Edit. Acribia. España. 2da ed. p.p. 431. [ Links ]
8. International Commission on Microbiological Specifications for Foods (ICMSF). 1998. Ecología microbiana de los alimentos: Factores que afectan a la supervivencia de los microorganismos en los alimentos. Edit. Acribia. España. Vol. 1. p.p. 332. [ Links ]
9. Trombino V, Hernández M, De Selgrad M. Efectos de los procesos de higienización sobre la calidad microbiológica de la leche humana extraída en el Banco de Leche del Hospital Universitario de Caracas. Rev Inst Nac Hig Rafael Rangel 2003; 34(1):10 - 16. [ Links ]
10. Norma Venezolana COVENIN 1126-89. Alimentos. Identificación y preparación de muestras para análisis microbiológicos. [ Links ]
11. Norma Venezolana COVENIN 0902-87. Alimentos. Métodos para recuentos de colonias de bacterias aerobias en placas de Petri. (2da revisión). [ Links ]
12. Norma Venezolana COVENIN 1104-96. Alimentos. Determinación de número más probable (NMP) de Coliformes fecales y E. coli. [ Links ]
13. Norma Venezolana COVENIN 1292-89. Alimentos. Aislamiento y recuento de Staphylococcus aureus. [ Links ]
14. Guevara J, Moya C. y Valerio J. Prevalencia de flora bacteriana en leche materna y su tolerancia en neonatos. Rev. Méd. Hosp. Nac. Niños. Costa Rica. 1979;14(2): 107 -114. [ Links ]
15. Almeida, J. A. G. 1986. Qualidade do leite humano colectado e procesado em bancos de leite. Tesis do grado. Departamento do microbiología. Universidade Federal de Viscosa. Brasil. p.p. 68 (Multígrafo). [ Links ]
16. Sosa R. and Barness L. Bacterial growth in refrigerate human milk. Am. J. Dis. Child. 1987; 141(1): 111 – 112. [ Links ]
17. Moreno R, Cerebro S. y Beltrán Z. Crecimiento bacteriano de la leche humana según tipo de almacenamiento. Rev. Mex. Pediatr. 1994; 61(1): 4 - 6. [ Links ]
18. Assis A, Gomes M., Pereira T, Santos M. Perfil microbiológico do leite materno do Banco da Maternidade Evangelina Rosa, Teresina (Piauí). Bol. Centro. Pesqui. Process. 2001; 19(1):75 -74. [ Links ]
19. Baquero A, Torres M. y Mendez H. 1998. Lactarios amigos de la mujer y la infancia. Edit. Trazo Ltda. Bogotá. 1ª ed. pp 48. [ Links ]
20. United Kingdom Association for Milk Banking (UKAMB). 2003, september. Guidelines for the establishment and operation of human milk bank in the UK. (en linea). Disponible: http://www.ukamb.org (Marzo, 2005). [ Links ]
21. Tyson J, Edwards W, Rosenfeld A, and Beer A. Collection methods and contamination of bank milk. Arch. Dis. Child. 1982; 57: 396 - 398. [ Links ]
22. Pontes M, Ivasaki Y, Oliveira Y. Avaliaçäo das codiçöes higiênico sanitárias do leite humano pasteurizado distribuído pelo banco de leite de um hospital público do Distrito Federal. Hig. Aliment. 2003; 7(107):43 – 49. [ Links ]
23. Kuerten R. and Goulart R. Diagnosis of hygienic-sanitary and microbiological conditions of hospital human milk banks. Rev. Saúde Pública. 1997; 31(2):131 -139. [ Links ]
24. Myron L, Lewiston N, Asquith M. and Sunshine P. Comparison of bacterial contamination with two methods of human milk collection. J. Pediat. 1978; 92(2):236 -237. [ Links ]
25. Knoop U, Schutt-Gerowitt H and Matheis G. Bacterial contamination of pump-collected breast milk. Monatsschr Kinderheilkd. 1985(b); 133(8):537 – 541. [ Links ]
26. Barrie, H. Human milk banks. The Lancet. 1982; 30: 284. [ Links ]
27. Olowe S, Ahmed I, Lawal S. and Ransome-Kuti S. Bacteriological quality of raw human milk: Effect of storage in a refrigerator. Ann Trop Pediatrics; 1987; 7(4): 233 -237. [ Links ]
28. Deodhar L. and Joshi S. Microbiological study of breast milk with special referente to its storage in milk bank. J. Postgrad. Med. 1991; 37(1):14 -16. [ Links ]
29. Mohandes A, Schatz V, Keiser J. and Jackson B. Bacterial contaminants of collected and frozen human milk used in an intensive care nursery. Am. J. Infect. Control. 1993; 21(5): 226 -230. [ Links ]
30. Thompson N, Pickler R, Munro C. and Shotwell J. Contamination in expressed breast milk following breast cleansing. J. Hum. Lact. 1997; 13(2):127 - 130. [ Links ]
31. Kembi A. and Otufowora A. Effect of Storage Temperature on Microbial Quality of Infant Milk. J. Tropic. Pediat. 1998; 44:54 -55. [ Links ]
32. Sandoval M, Salomón M, Abud J, Bisignano F, Canónicco M, Cuba M. Boletín sobre Etiología y Resistencia Bacteriana. 2003. Enero-Agosto 2002. [ Links ]
33. Carroll L, Osmam M. and Davies D. Does discarding the first few millilitres of breast milk improve the bacteriological quality of bank breast milk?. Arch. Dis. Child. 1980; 55(11): 898 - 899. [ Links ]
34. Knoop U, Schutt-Gerowitt H and Matheis G. Bacterial growth in breast milk under various storage conditions. Monatsschr Kinderheilkd. 1985(a); 133(7): 483 – 486. [ Links ]