Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Puericultura y Pediatría
versión impresa ISSN 0004-0649
Arch Venez Puer Ped v.71 n.2 Caracas jun. 2008
Citocinas TH2 (IL 4 e IL10) en el niño desnutrido. Universidad del Zulia, Maracaibo - Venezuela.
Montserrat Vicente Villarroel (*), Alis Amesty Valbuena (**), Nayda Pereira (***), Doris García (****), José Luís Castillo (*****), José Rafael Nuñez González (******)
(*) Profesora Titular Jubilada, Cátedra de Puericultura y Pediatría, Facultad de Medicina, Universidad del Zulia (LUZ), Venezuela. e-mail: mvicente30@hotmail.com
(**) Profesora Titular Jubilada, Cátedra de Microbiología e Inmunología, Escuela de Medicina, Facultad de Medicina. LUZ. Venezuela.
(***) Profesora Titular, Cátedra de Inmunología, Escuela de Bioanálisis, Facultad de Medicina, LUZ. Venezuela.
(****) Profesora Titular, Escuela de Nutrición y Dietética, Facultad de Medicina, LUZ. Venezuela.
(*****) Profesor Asociado, Cátedra de Microbiología e Inmunología, Facultad de Medicina, LUZ. Venezuela.
(******) Profesor Asociado, Cátedra de Inmunología, Escuela de Medicina, Facultad de Medicina, LUZ. Venezuela.
RESUMEN:
Objetivo: Determinar las concentraciones sèricas de citocinas Th2 (IL4 e IL10), en niños desnutridos y eutróficos sin infección, en edades comprendidas entre 6 meses y 6 años.
Método: Se seleccionaron 89 niños; 64 niños con algún grado de desnutrición (leve, moderada y grave) y 25 niños eutróficos. Las citocinas se midieron en sangre periférica utilizando el método de ELISA doble sandwich. Para el análisis estadístico se utilizo el test de ANOVA con post test de Tukey.
Resultados: Se presentan como media + DE. La IL4 mostró en el grupo de desnutridos, niveles más elevados: leves (0.46±0.04 pg/ml), moderados (0.48±0.10pg/ml) y graves (0.55±0.006pg/ml), presentando cada grupo diferencias significativas p<0.001 en relación con el grupo control (0.37±0.004 pg/ml). También hubo diferencias significativas entre los grupos de desnutridos leves y moderados con los graves p<0.001. La IL10 mostró diferencias significativas entre los desnutridos moderados (9.91±3.17 pg/ml) y graves (10.88±5.13 pg/ml) con el grupo control (6.53± 2.59pg/ml) p<0.01.
Conclusión: Los valores elevados de IL4 e IL10 en el niño desnutrido son consecuencia de un daño en la capacidad de activación de las células inmunitarias en los mismos, sumándose el grado de infestación parasitaria con helmintos que presentan, que condiciona la elevación de IL4.
Palabras claves: Desnutrición, citocinas Th2, citocina IL4, citocina IL10.
SUMMARY:
Objective: To determine the cytokine serum measurements Th2 (IL4 and IL10), in malnourished children and eutrophic without infection, in ages understood between 6 months and 6 years.
Method: 89 children were selected; 64 children with some grade of malnourishment (mild, moderate and severe) and 25 eutrophic children. The cytokines was measured in outlying blood using ELISA'S double sandwich method. For the statistical analysis we use the test of ANOVA with post test of Tukey.
Results: They are presented like Mean + SD. The IL4 showed in the group of malnourished, higher levels: mild (0.46±0.04 pg/ml), moderate (0.48±0.10pg/ml) and severe (0.55±0.006pg/ml), presenting each group significant differences (p <0.001) in relation with the control group (0.37±0.004 pg/ml). There were also significant differences among the groups of mild malnourished and moderate with the severe ones p <0.001. The IL10 showed significant differences among the moderate malnourished (9.91±3.17 pg/ml) and the severe (10.88±5.13 pg/ml) with the control group (6.53± 2.59pg/ml) (p <0.01).
Conclusion: The high values of IL4 and IL10 in the malnourished children are consequence of damage in the capacity of activation of the immune cells in the same ones, being added the grade of parasitic infection with worms that present that conditions the rise of IL4.
Key words: Malnourished, Cytokines Th2, IL 4, IL 10.
INTRODUCCIÓN:
La desnutrición proteico calórica representa un problema común en los países en vías de desarrollo como consecuencia de las condiciones económicas y sociales, lo cual constituye un indicador sensible del nivel de desarrollo de un país. El efecto negativo que la desnutrición tiene sobre el individuo dependerá de la duración y la gravedad del déficit nutricional, siendo los niños menores de un año los más comprometidos por su tasa de crecimiento rápido y por su vulnerabilidad a los procesos infecciosos (1,2, 3,).
Ha sido demostrado que en la desnutrición existe un desbalance que afecta profundamente la función inmunitaria debido a alteraciones en los componentes de la inmunidad celular, humoral e inmunidad innata, observándose un mayor compromiso de la inmunidad celular, lo que se traduce en una disminución importante de las subpoblaciones de linfocitos CD3 y CD4 (4,5,6,7,8,9,10).
Los linfocitos T son los responsables de la inmunidad celular y según sus marcadores de membrana se conocen como linfocitos CD3, CD4 y CD8 (5,6). Los linfocitos CD4 o colaboradores están clasificados en dos subgrupos Th1 y Th2, los cuales una vez activados comienzan a producir un número de proteínas conocidas como citocinas o interleucinas (IL), que difieren si son producidas por la células Th1 o Th2. Los linfocitos Th1 regulan la respuesta inmune celular y está basada fundamentalmente en la síntesis de IL2, de Interferón Gamma (IFy) y del Factor de Necrosis Tumoral (TNF); mientras que los linfocitos Th2 se encargan de coordinar la respuesta de tipo humoral basada en la síntesis de IL4, IL5 e IL10 entre otras; produciéndose en ambos casos la proliferación y diferenciación de los linfocitos T y B respectivamente. (11,12).
Las citocinas, como moléculas efectoras de la respuesta inmunitaria permiten la comunicación entre diferentes clases de células y transmiten mensajes para iniciar o suprimir diferentes funciones, siendo algunas de éstas el crecimiento y la diferenciación celular, las reacciones inflamatorias y la modulación de la respuesta del sistema inmunitario (13, 14,15).
De acuerdo a sus funciones las citocinas han sido categorizadas en aquellas producidas por macrófagos y células mononucleares. Existe otro grupo de citocinas producidas por los linfocitos T las cuales regulan la inmunidad adquirida o adaptativa mediante la activación del crecimiento y diferenciación de diversas poblaciones linfocitarias, por lo que desempeñan un papel importante en la fase de activación de la respuesta inmunitaria dependiente de células T. Entre estas citocinas se encuentran la IL2, IL4, e IL10. (15, 16, 17,18)
La IL4 es una molécula pleiotròpica y proinflamatoria, producida por los linfocitos T colaboradores (Th2), pero también la producen las células cebadas, los mastocitos y los basófilos; promueve la multiplicación de los linfocitos B en reposo y actúa sobre ella en forma autocrina sobre su crecimiento. En los mastocitos induce la síntesis y liberación del fragmento del receptor (CD23) para el Fc de la IgE. Los anticuerpos IgE intervienen en la defensa mediada por los eosinòfilos frente a la infección por helmintos, siendo esta su principal función en la respuesta del huésped. La IgE también es el principal mediador de las reacciones de hipersensibilidad inmediata (alérgica) y la producción de IL4 es importante para el desarrollo de las alergias, de allí que la IL4 es una citocina que se produce en gran cantidad en pacientes alérgicos y parasitados. Es la citocina más importante que regula la producción de anticuerpos IgE y el desarrollo de células Th2 a partir de las células T colaboradoras, CD4 vírgenes. La IL4 es la citocina característica de las subpoblaciones de Th2 y actúa como citocina inductora y efectora de estas células. (18,19, 20,21)
Por su parte la IL10 es también una citocina proinflamatoria producida por los linfocitos B y los linfocitos Th2 así como también por los macrófagos activados; tiene actividad biológica como inmunoestimulante e inmunosupresora; esto último porque puede inhibir la producción de IL2, el TNF y el INF y producidos por los linfocitos Th1. La mayoría de sus efectos son inmunosupresores por lo que es conocida también como factor inhibidor de la síntesis de citocinas. La IL10 inhibe los macrófagos activados y por lo tanto interviene en el control homeostático de las reacciones de la inmunidad innata y de la inmunidad celular, por lo que es un excelente ejemplo de un regulador de retroalimentación negativa. (3,16, 18,22)
Por su capacidad de inhibir la producción y liberación de citocinas inflamatorias por los fagocitos estimulados por endotoxinas, la IL10 es capaz de proteger contra los efectos del shock endotóxico producido por los lipopolisacàridos. Por esta razón se ha considerado que su actividad antiinflamatoria debe ser muy importante en la defensa del organismo contra la sepsis, la artritis reumatoidea y otras enfermedades caracterizadas por reacciones inflamatorias intensas. (3, 18,23)
Debido a la interacción de las citocinas con numerosas células del sistema inmune y a que las mismas regulan diversos procesos biológicos, se requiere para el desarrollo de esta respuesta tan compleja de la integridad del huésped, integridad que se ve comprometida en la desnutrición proteico energética. (2, 3,24). La íntima relación entre el estado nutricional y el sistema inmunitario ha sido tópico de estudio para muchos investigadores en las últimas décadas, lo cual ha llevado a un incremento en el conocimiento de la asociación entre nutrición, función inmunitaria y respuesta del huésped. (2-5) Diversos trabajos han sido realizados sobre las citocinas en el niño desnutrido, entre ellas IL1, IL6 y TNF. ( 25,26 ) No obstante no existen datos mayormente reportados en relación con las citocinas IL4 e IL10 en estos pacientes, lo que motivo el interés para la presente investigación, planteándose como objetivo principal la determinación de los niveles de citocinas IL4 e IL10 en niños con desnutrición leve, moderada y grave.
METODOS:
Grupos de Estudio
Se estudiaron prospectivamente 89 niños provenientes de la Unidad de Recuperación Nutricional del Hospital General de Cabimas y de diferentes hogares de cuidado diario de la ciudad de Maracaibo, Estado Zulia Venezuela, en edades comprendidas entre 6 meses y 6 años de edad, de sexo masculino y femenino, durante el periodo comprendido entre enero 2004 y diciembre de 2006 y pertenecientes a familias de bajos ingresos (estratos IV y V), según método de Graffar modificado. (27)
El estado nutricional se evaluó en forma integral interrelacionándose los indicadores antropométricos, clínicos, nutricional y bioquímicos. La evaluación antropométrica se realizó utilizando las variables: peso, talla y edad, las cuales al ser relacionadas entre sí permitieron la elaboración de los indicadores corporales (P/E, T/E, P/T) que fueron llevados a las gráficas de referencia del Instituto Nacional de Nutrición (INN) de acuerdo a los valores de la Organización Mundial de la salud (OMS). (28)
Se consideró como eutrófico cuando el punto de referencia de la curva respectiva se encontró entre los percentiles 10 y 90. El déficit nutricional se determinó utilizando el indicador peso-edad en menores de 2 años y peso-talla en los mayores de 2 años. Se estableció desnutrición leve cuando se encontró el parámetro usado entre < percentil 3 hasta -3 DE (Desviación estandar), desnutrición moderada < - 3 DE hasta - 4 DE y desnutrición grave < -4 DE, considerados en las tablas correspondientes (28), lo cual permitió distribuir al grupo de desnutridos en:
Desnutrido leve: n=22
Desnutrido moderado: n=22
Desnutrido grave: n=20
Grupo control (Niños Eutróficos) n=25
Para la evaluación clínica se consideró el examen físico considerando los signos clínicos presentes en la desnutrición, tales como: disminución del panículo adiposo, cambios en el cabello, dermatosis, palidez cutáneo mucosa, edema, hepatomegalia, entre otros signos. Todos los desnutridos graves fueron clasificados como marasmáticos.
Dentro de los indicadores de Laboratorio se hizo la determinación de: proteínas totales, albúmina, glicemia y creatinina. Los resultados obtenidos fueron relacionados con el resto de los indicadores nutricionales ya que valores aislados de estas pruebas no indican la presencia de desnutrición ni el grado de déficit nutricional. Con la finalidad de excluir los niños con procesos infecciosos se realizaron: hematología completa, reactantes de fase aguda (Proteína C reactiva) y uroanálisis. Igualmente se investigó la presencia de parásitos por concentrado de heces, debido a la relación entre helmintiasis y niveles de IL 4.
Recolección de las Muestras para determinación de citocinas.
Para la obtención de las muestras de sangre se contó con el consentimiento de los padres y con la autorización previa de las autoridades correspondientes. Se extrajo de cada niño en estudio, una muestra de sangre de 5 mL, la cual fue colocada en tubo de polipropileno sin anticoagulante, separando luego el suero por centrifugación y colocando alícuotas de 0,5 mL en viales de igual material (polipropileno), guardados a -70º C hasta el momento de ser procesadas.
Determinación de IL4 e IL10
Se realizó mediante la técnica de ELISA tipo sándwich de los Laboratorios R & D SYSTEM (USA) y siguiendo las especificaciones de la casa comercial. Los valores obtenidos fueron reportados en picogramo/mililitros (pg/ml.)
Análisis Estadístico.
Para el análisis estadístico los valores obtenidos se expresaron en valores absolutos, rangos o como media ± desviación estándar (M ± DS). Para la comparación entre las medias de los grupos de estudio (incluyendo los controles) se utilizó el test de ANOVA en una dirección con post test de Tukey y la prueba de x2 según fuera necesario para establecer la significancia estadística, para lo cual, se tomo el 95% como índice de confiabilidad con una p > 0,05.
RESULTADOS:
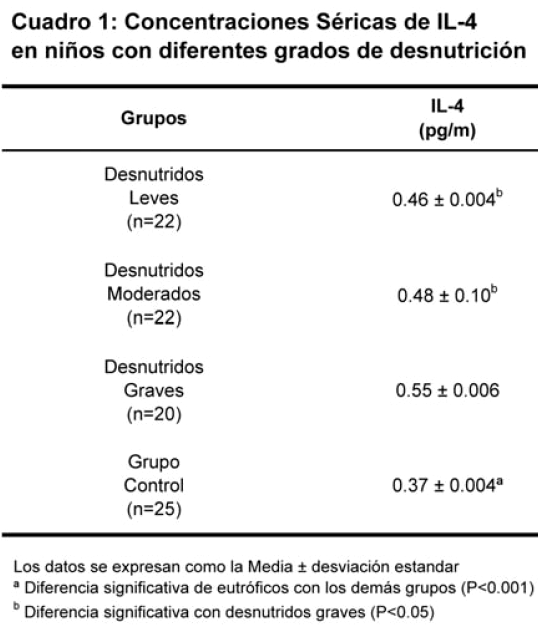
Los resultados de la concentración sérica de IL4 aparecen en el Cuadro Nº 1.
Se observa que los valores de esta citocina en los grupos de desnutridos: Leves (0,46 ± 0,04 pg/ml), moderados (0,48 ± 0,10 pg/ml) y graves (0,55 ± 0,006 pg/ml) presentaron con respecto al grupo control (0,37 ± 0,004 pg/ml) p<0.001 diferencias estadísticamente significativas p<0.001, observándose igualmente que entre los desnutridos hubo dife-rencias significativas entre los grupos de leves y moderados con los graves, con una p<0.001
En relación a la IL10 puede apreciarse en el Cuadro Nº 2, que sus niveles en el grupo de desnutridos moderados (9,91 ± 3,17 pg/ml) y los desnutridos graves (10,88 ± 5,13 pg/ml) sólo mostró diferencias significativas p<0.01, con los niños eutróficos (6,53 ± 2,59 pg/ml).
Si observamos la presencia de infestación por helmintos, se verifica en el Cuadro No 3, que la misma resultó más frecuente en los grupos de desnutridos (p<0,01)
DISCUSION:
La desnutrición infantil es un problema complejo que compromete básicamente todos los órganos y sistemas especialmente el sistema inmunitario.
Desde hace más de tres décadas los inmunólogos han estudiado los aspectos relacionados con la inmunidad humoral, celular y la inmunidad innata (2-7) y más recientemente las proteínas que intervienen en la respuesta inmunitaria y que son conocidas como interleucinas, tales como la IL1, la IL2, la IL4, TNF, la IL6 y la IL10, entre otras (17,24).
De las citocinas anteriormente mencionadas, ha sido demostrado que algunas de ellas como la IL1, la IL6 y el TNF sufren cambios en su concentración en el niño con desnutrición (24); de la IL2 se conocen algunos resultados (24), sin embargo poco se conoce sobre el comportamiento de la IL10 y de la IL4 en el niño desnutrido.
En la presente investigación donde se estudiaron las concentraciones de las citocinas IL4 e IL10 en el niño con desnutrición leve, moderada y grave se encontró que para la IL4 hubo un incremento de la misma en los tres grupos de desnutridos con diferencias significativas entre el grupo de desnutridos leves y moderados con los desnutridos graves.
La IL4 es una citocina que regula la producción de la inmunoglobulina E (IgE), esta inmunoglobulina se encuentra asociada con los procesos alérgicos y como mecanismo de inmunidad contra los parásitos (29-31).Algunos investigadores (32,33) han estudiado la respuesta de IL4 e IgE contra el áscaris lumbricoides en el niño desnutrido. Hagel y col. (33), reportaron en un grupo de desnutridos venezolanos parasitados, viviendo en condiciones de pobreza, que tanto la IL4 como la IgE se encontraron elevadas, resultados que según los autores sugieren una estimulación policlonal para la síntesis de IgE; posteriormente estos mismos autores (34) en un interesante trabajo realizado en niños parasitados de estos mismos estratos sociales encontraron valores elevados de IgE, contrastando con un bajo nivel de IgE específica contra áscaris lumbricoides y contra otros alergenos, pero el hallazgo mas relevante fue que después del tratamiento antihelmíntico, los valores de IgE antiáscaris en el grupo de desnutridos no sufrió ninguna modificación a diferencia del grupo de niños controles que si lo hicieron, hecho que incrementa la susceptibilidad del desnutrido a la infestación por estos parásitos.
En nuevas investigaciones Hagel (34) reporta que estos hallazgos son el resultado de una respuesta defectuosa de la célula T en el desnutrido como consecuencia de un desbalance en las subpoblaciones de linfocitos T (CD3 y CD4) y en la respuesta de las células T de memoria, debido a una maduración defectuosa de estas células T y en consecuencia una respuesta disminuida en la producción de IgE contra el parásito. Estudios más recientes confirman las múltiples anormalidades de la respuesta inmunitaria con incremento de IL4 y en las subpoblaciones de linfocitos en los niños desnutridos (24).
Los resultados de las investigaciones anteriormente señaladas soportan nuestros hallazgos en lo que respecta a la IL4, al encontrar un incremento estadísticamente significativo de esta citocina en los desnutridos con relación al grupo control, este incremento resultó estar en relación directa con el grado de déficit nutricional, hecho que parece estar condicionado además con el grado de infestación parasitaria que presentaron los niños desnutridos ya que el mayor número de niños parasitados fue encontrado en los desnutridos.
En relación con la IL10, esta poderosa interleucina tiene importantes efectos inmunoreguladores para muchas células, siendo su principal acción biológica la limitación y terminación de una respuesta inflamatoria. En la presente investigación se encontró que los desnutridos moderados y graves mostraron incremento de su valor, con diferencias significativas en relación con los desnutridos leves así como con los niños eutróficos que sirvieron de grupo control. Rodríguez y col. (24) han demostrado muy recientemente, valores elevados de IL10 en los desnutridos graves conjuntamente con valores elevados de IL4, señalándose que estos resultados son consecuencia de un daño en la capacidad de activación de las células inmunitarias.
En estudios experimentales realizados en ratones se ha demostrado que existe un incremento de IL10 en animales con déficit de vitamina A (35). Es conocido que el desnutrido tiene déficit de vitamina A y de otros micronutrientes como el cinc (Zn), sin embargo los resultados reportados por algunos investigadores en relación con esta vitamina e IL 10 son divergentes (36,37); con respecto al Zn no se han encontrado variaciones de esta interleucina en individuos deficientes en este metal (38, 39,40).
Los hallazgos de la presente investigación resultan interesantes no solo en lo que respecta a la IL4 sino especialmente en lo relacionado con la IL10, surgiendo la interrogante del por qué esta citocina se eleva con diferencias significativas en desnutridos moderados y graves. Es probable que exista en el desnutrido un descontrol en algunos de los factores reguladores de la repuesta inmune, entre ellos los linfocitos TCD4+CD25+ conocidos como linfocitos reguladoras (Tr), estas células tienen un perfil peculiar de producción de citocinas especialmente una producción elevada de IL10, pero no de IL4 ni de IL2, por lo que puede asumirse que el desnutrido, presenta un incremento en la subpoblación de linfocitos reguladores. (8, 13, 41,42).
Por otra parte la gran mayoría de bacterias gram positivas y gram negativas inducen directamente la producción de IL10 por los monocitos macrófagos y otras células dendríticas. El papel biológico esencial de la IL10 parece ser el de regulador homeostático del sistema inmunitario, en base a esto, la infección y colonización crónica o continuada por diversos microorganismos conducen a una mayor producción de IL10, esto sugiere que otro mecanismo que mantiene la elevación de IL10 en el desnutrido sean las infecciones repetidas que se observan frecuentemente en ellos, especialmente en el desnutrido moderado y grave (43).
Los resultados de la presente investigación refuerza lo reportado por otros investigadores, al encontrar elevaciones significativas de las interleucinas IL4 e IL10 en el niño desnutrido, elevaciones que guardan relación con el grado de déficit nutricional y cuya significado para la IL10 debe ser dilucidado a fin de conocer los efectos que pueden producirse al no poderse suprimir una respuesta inflamatoria por su elevación sostenida.
Finalmente a pesar de que las investigaciones realizadas en el desnutrido son numerosas, la desnutrición continúa siendo un modelo complicado por la deficiencia de múltiples nutrientes. Por otra parte, la comprensión de la dinámica de regulación del sistema inmunitario en el desnutrido, y muy especialmente lo relacionado con las citocinas, es aún un campo por explorar.
AGRADECIMIENTO:
Al FONACIT por su apoyo financiero en la realización de este trabajo, mediante su Programa de Financiamiento para Proyectos de Investigación.
REFERENCIAS:
1. Schofield C, Ashworth A. ¿Por qué siguen siendo tan altas las tasas de mortalidad por malnutrición grave?. Rev Panan Salud Publica/Pan Am Health. 1997; 1(4):295-300. [ Links ]
2. Keusch G. The History of Nutrition: Malnutrition, Infection and Immunity. J Nutr. 2003; 133: 336S-340S. [ Links ]
3. Chandra RK. Nutritional regulation of immunity and risk of illness. Indian J Pediatr. 1989; 56(5): 607-611. [ Links ]
4. Chandra RK. Nutrition and the immune system: an introduction. Am J Clin Nutr. 1997; 66 (2): 460S-463S. [ Links ]
5. Bhaskaram P. Micronutrient malnutrition, infection and immunity: an overview. Nutr Rev. 2002; 60 (5Pt 2): S40-5. [ Links ]
6. Amati L, Cirimele D, Pugliese V, Covelli V, Resta F, Jirillo E. 2003, Nutrition and immunity: laboratory and clinical aspects. Curr Pharm Des. 2003; 9 (24): 1924-1931. [ Links ]
7. Chandra RK. Nutrition and the immune system from birth to old age. 2002: 56 (3): S73-6. [ Links ]
8. Marcos A, Nova E, Montero A. Changes in the immune system are conditioned by nutrition. Eur J Clin Nutr. 2003; 57 (1): S66-9. [ Links ]
9. Lofty O, Saleh W. el-Barbari M, 1998, A study of some changes of cell-mediated immunity in protein energy malnutrition. J Egypt Soc Parasitol. 1998; 28 (2): 413-28. [ Links ]
10. Amesty de Valbuena A, Vicente de Villarroel M, Granados A, Rivero M, Diaz S, Salas D. Aspectos inmunitarios del desnutrido infectado. Arch Venez Puer Ped. 1997; 60 (3):99-106. [ Links ]
11. Mosmann T, Sad S. The expanding universe of T-Cell subsets: Th1 Th2 and more. Immunol Today. 1996; 17:138-146. [ Links ]
12. Muñoz C, Schlesinger L, Cavaillon J. 1995, Interaction between cytokines, nutrition and infection. Nutrition Research. 1995; 15 (12): 1815-1844. [ Links ]
13. Borish L, Denver C. Updates on cells and cytokines. J Allergy Clin Immunol. 1998; 101 (3): 293-297. [ Links ]
14. Amesty-Valbuena A, Castillo J, Vicente-Villarroel M, Núñez- González J, Marcano H, Colmenares Y, Atencio R, Rivero M, Cayama N. Citocinas proinflamatorias y proteína C reactiva en niños desnutridos graves infectados y en un grupo control. Arch Venez Puer Ped. 2002; 65 (3): 91-99. [ Links ]
15. Asselin S, Breban M, Fradelizi D. 1997, Action of citokines IL-12 and IL-4 on T helper cells: Cellular immunity or humoral immunity?. Presse Med, 1997; 26 (6): 278-283. [ Links ]
16. Bergen C, Smit W, Sluijters D, Rijnbeek M, Willemze R. Interleukin-10, Interleukin-12 and tumor necrosis factoralpha influence the proliferation of human CD8+ and CD4+ T-Cell clones. Ann Hematol, 1996; 72 (4): 245-252. [ Links ]
17. Amesty-Valbuena A, Pereira N, García D, Vicente-Villarroel M, Núñez-González J , Cayama N, Villadiego N. Niveles séricos de citocinas proinflamatorias en niños con diferentes grados de desnutrición. Bol Med Hosp Infant Mex. 2002; 60:14-21. [ Links ]
18. Abbas A, Lichtman A, Pober Jordan. Inmunologia Celular y molecular. 4ta. Edición. Madrid (España): McGraw-Hill- Interamericana: 2002; p243-279. [ Links ]
19. Regueiro J, López C, González S, Martínez E. Inmunología Biología y Patología del Sistema Inmune. Mensajería Inmunológica: Las Citocinas y sus Receptores, 3ª. edición. Madrid (España): Editorial Panamericana. 2002; p111-120. [ Links ]
20. Gemmell E, Seymour G. Cytokines and T cell switching. Crit Rev Oral Biol Med, 1994; 5 (3-4): 249-79. [ Links ]
21. Kasakura S. A role for T-helper type 1 and tipe 2 cytokines in the pathogenesis human diseases. Rinsho Byori, 1998; 46 (9): 915-21. [ Links ]
22. Dulger H, Arik M, Sekeroglu M, Tarakcioglu M, Noyan T, Cesur Y. et al. Pro-inflammatory cytokines in Turkish children with protein-energy malnutrition. Mediators inflamm. 2002; 11(6):363-5. [ Links ]
23. Pelletier L, Bellon B, Druet P. Cytokines and immune response. Rev Prat. 1993; 43(5): 536-46. [ Links ]
24. Rodriguez L, Gonzalez C, Flores L, Jimenez-Zamudio L, Graniel J y Ortíz R. Assessment by flow cytometry of cytokine production in malnourished children. Clin Diagn Lab Immunol. 2005; 12(4): 502-7. [ Links ]
25. Doherty J, Goldlin M, Remick D, Griffin G. Production of interleukin6 and tumor necrosis factor- alpha in vitro is reduced in whole blood of severely malnourished childrens. Clin Sc. 1994; 86:347-51. [ Links ]
26. Grimble R. Nutrition and cytokine action. Nutr Res Rev. 1990;3:93-210. [ Links ]
27. Méndez-Castellano H. Estratificación Social: Método de Graffar modificado para Venezuela. Arch Venez Puer Pediatr, 1986; 49: 93-104. [ Links ]
28. Espinoza I. Guía Práctica para la evaluación antropométrica del crecimiento, maduración y estado nutricional del niño y del adolescente. Arch Venez Puer Ped, 2004; 67(1): S5-S54. [ Links ]
29. Geiger ., Massara C, Bethony J, Soboslay T, Carvalho O, Correa C. Cellular responses and cytokines profiles in Ascaris lumbricoides and Trichuris trichiura infected patients. Parasite Immunol. 2002; 24 (11-12): 499-509. [ Links ]
30. Cooper P, Chico M., Sandoval C, Espinel I, Guevara A, Kennedy M. et al. Human infection with Ascaris lumbricoides Is Associated with a Polarized Cytokine Response. The Journal of Infectious Diseases. 2000;182:1207-1213. [ Links ]
31. Hagel I., Lynch N., Pérez M., Di Prisco M., López R., Rojas E. 1993, Modulation of the allergic reactivity of slum children by helminthic infection. Parasite Immunol. 1993; 15 (6): 311-5. [ Links ]
32. Hagel I, Lynch N, Pérez M, Di Prisco M, Lopez R, Rojas E. 1995, Nutritional status and the IgE response against Ascaris lumbricoides in children from a tropical slum. Trans R Soc Trop Med Hyg. 1995; 89 (5): 562-5. [ Links ]
33. Hagel I, Lynch N, Pèrez M, Di Prisco M, Lòpez R, Rojas E. 1993, Relationship between the degree of poverty and the IgE response to Ascaris infection in slum children. Trans R Soc Trop Med Hyg. 1993; 87 (1): 16-8. [ Links ]
34. Hagel I, Lynch N, Puccio F, Rodríguez O, Luzondo R, Rodríguez P. Defective regulation of the protective IgE response against intestinal helminth Ascaris lumbricoides in malnourished children. J Trop Pediatr. 2003; 49 (3): 136-42. [ Links ]
35. Stephensen C, Jiang X, Freytag T. Vitamin A deficiency increase the in vivo development of IL-10 – positive Th2 cells and decreases development of Th1 cells in mice. J Nutr. 2004; 134(10): 2660-6. [ Links ]
36. Amaya-Castellanos D, Viloria-Castejón H, Ortega P, Gómez G, Urrieta J, Lobo P. et al. Deficiencia de vitamina A y estado nutricional antropométrico en niños marginales urbanos y rurales en el Estado Zulia, Venezuela. Invest Clin. 2002; 43(2): 89-105. [ Links ]
37. Leal Y, Castejón H, Romero T, Ortega P. Valores séricos de citocinas en niños con desórdenes por deficiencia de vitamina A. Invest Clin. 2004; 45 (3): 243-256. [ Links ]
38. Beck F, Prasad A, Kaplan J, Fitzgerald J, Brewer G. Changes in cytokine production and T cells subpopulations in experimentally induced zinc – deficient humans. Am J Physiol. 1997; 272 (6 Pt 1): E1002-07. [ Links ]
39. Scott M, Koski K. Zinc Deficiency Impairs Immune Responses against Parasitic Nematode Infections at Intestinal and Systemic Sites. J. Nutr. 2000; 130: 1412S-1420S. [ Links ]
40. Sebnem-Kilic S, Yapici-Kezer E, Ozarda-Ilcol Y, Yakut T, Aydin and Hakki-Ulus I. Journal of clinical immunology. 2005; 25(3):275-280. [ Links ]
41. Papiernik M. Natural CD4+ CD25+ regulatory T cells. Their role in the control of superantigen responses. Immunol Rev. 2001; 182: 180-189. [ Links ]
42. Shevach E. Certified professionals: CD4+ CD25+ suppressor T cells. J Exp Med. 2001; 193: F41-F46. [ Links ]
43. Raqib R, Lindberg A, Wretlind B, Bardhan P, Andersson B, Andersson J. Persistence of local cytokine production in shigellosis in acute and convalescent stages. Inf Immun. 1995; 63:289-296. [ Links ]