Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Puericultura y Pediatría
versión impresa ISSN 0004-0649
Arch Venez Puer Ped v.72 n.4 Caracas dic. 2009
Lactantes menores alimentados con fórmula de soya. Evaluación de hormonas tiroideas
Arelis Conde* Lani Cárdenas**, Ammary Carreño**, Egimer Caruso**, Maria Beatriz Bocaranda**, Harold Guevara***, Sobeida Barbella****
(*) Puericultor. Profesor Instructor de la Universidad de Carabobo. Unidad de Investigación en Gastroenterología y Nutrición Pediátrica Universidad de Carabobo. Venezuela
(**) Estudiantes de sexto año de Medicina Universidad de Carabobo. Venezuela
(***) Médico Ocupacional, Profesor Asociado en el Departamento de Salud Pública de la Universidad de Carabobo, Investigador PPI. Venezuela
(****) Pediatra Nutrólogo. Profesor Titular de la Universidad de Carabobo. Unidad de Investigación en Gastroenterología y Nutrición Pediátrica Universidad de Carabobo. Investigador PPI
Autor corresponsal: Dra. Arelis Conde. Teléfono: 0241-8248371 / 01466442050 Correo electrónico: arelis_conde@hotmail.com - areliscondeb@yahoo.es
RESUMEN
Introducción y objetivo: La alimentación a base de soya, se ha relacionado con alteración de la función tiroidea, debido a la presencia de fitoestrógenos en su composición. Es por ello, que el presente estudio tiene como objetivo determinar la función tiroidea en lactantes menores de 6 meses alimentados con fórmula infantil a base de soya.
Materiales y Métodos: Es un estudio descriptivo, transversal. Se evaluaron 28 lactantes que recibieron fórmula infantil de soya, como única alimentación. Variables utilizadas: edad, sexo, Graffar-Méndez Castellano, motivo de indicación de la fórmula, dilución, onzas diarias ingeridas, determinación de T3-libre y T4- libre y TSH sérico. Para el análisis estadístico se aplicó t de Student para un nivel de significación estadística de p < 0,05.
Resultados: Los valores séricos de T3 y T4 libres se mantuvieron dentro de rangos normales. 7% de la muestra mostró valores elevados de TSH, no siendo estadísticamente significativo.
Conclusión: No existió relación estadística entre el consumo de fórmula de soya y función tiroidea. Sin embargo, en la muestra estudiada dos de los pacientes presentaron aumento de los niveles de TSH, por lo que no se puede descartar la posibilidad de una asociación dado lo limitado de la muestra.
Palabras clave: Soya, isoflavonas, función tiroidea, fórmula infantil.
SUMMARY
Introduction and objective: Feeding with soy has been related to alteration of thyroid function. The objective of this study was to determine thyroid functionalism in babies under 6 months of age fed with infantile soy based formula.
Methods: Descriptive, cross-sectional, non experimental study. Twenty eight babies who received exclusively infantile soy based formula were evaluated. Variables studied were: age, gender, socio-economical level, reason for the prescription of soy formula, dilution, daily ounces, determination of free T3, T4 and TSH. For the statistic analysis, Students t test was applied for a statistical significance level of p< 0.05.
Results: Serum free T3 and T4 were within normal ranges. 7% of the sample showed elevated levels of TSH, with no statistic significance.
Conclusion: there was no statistical relationship between consumption of soy formula and thyroid function. However, two patients had increased levels of TSH and therefore, the possibility of an association cannot be ruled out given the small size of the sample.
Key words: Soy, isoflavonoids, thyroid function, infantile formula.
INTRODUCCIÓN
La lactancia materna proporciona el alimento ideal durante los primeros seis meses de vida del niño, ya que le aporta todos los nutrientes, anticuerpos, hormonas y antioxidantes que necesita para sobrevivir. Protege a los niños frente a la diarrea y las infecciones respiratorias y estimula su sistema inmunitario(1). En el mercado se dispone de una gran variedad de fórmulas infantiles, cuya indicación dependerá de diversas circunstancias, atribuibles a la madre o al lactante; éste puede presentar condiciones, tales como la intolerancia a la lactosa, en cuyo caso está indicado el uso de fórmulas infantiles a base de proteína de soya (FIBS). En los años setenta fueron agregados varios nutrientes complemen tarios como metionina, yodo, carnitina, taurina, colina e inositol(2,3).
En 1990, el Comité de Nutrición de la Sociedad Europea de Gastroenterología y Nutrición Pediátrica (CNSEGNP) se pronuncia respecto a las FIBS, siendo restrictivo y limitando su uso a casos de reacciones adversas a la proteína de leche de vaca, hijos de padres vegetarianos y en caso de necesitar una dieta exenta de lactosa y/o galactosa(4); sin embargo, un estudio realizado en el 2005 evidenció que las madres juegan un papel aún mayor que el personal médico en cuanto a la prescripción de FIBS(5).
A partir de la publicación en 1933 del primer estudio en animales, existe una larga serie de investigaciones sobre el posible efecto bociógeno de la soya. Y hacia 1960 había va-rios casos de bocio en infantes asociados con el uso de la fórmula de soya(6); esto se debe a la presencia de una serie de componentes bioactivos de origen vegetal, que pueden ser importantes para la salud, conocidos como fitoestrógenos, los cuales son compuestos químicos no esteroideos que se encuentran en los vegetales, pero son similares a los estrógenos humanos, y con acción similar (efecto estrogénico) u opuesta (efecto antiestrogénico) a éstos.
En un principio estas fórmulas contenían harina de soya, una proteína de baja digestibilidad y reducido contenido pro-teico total, por lo que fue sustituido por proteína aislada de soya.
Si bien pueden identificarse varias formas de fitoestrógenos (isoflavonas, lignanos, cumestanos, entre otras), las más activas y relevantes para el consumo humano son las isoflavonas, que se encuentran en la soya, y que tiene un efecto bociogénico(7). Los efectos biológicos potenciales en los lactantes debido a las isoflavonas de la soya han sido claramente identificados e incluye cambios en las funciones de las glándulas sexuales, el sistema nervioso central, la tiroides y los patrones de comportamiento(8).
Los niveles séricos de isoflavonas en niños que toman FIBS son aproximadamente 5 veces más altos que en los que consumen suplementos de soya(9).
Diversos documentos de los años 60 reportan que los lactantes sanos alimentados con fórmula de soya desarrollaron hipotiroidismo, aunque las causas no fueron identificadas en ese momento(10-12).
En el año 2002 en Arkansas, Estados Unidos, Doerge y Sheehan(13), evaluaron los posibles efectos bociogénicos y estrogénicos de las isoflavonas en ratas expuestas a dietas con altos niveles de isoflavonas (in vivo); los niveles en las glándulas tiroides de las ratas eran suficientes para producir in vitro inactivación de la peroxidasa tiroidea (TPO) humana y de ratas, más otros parámetros de funcionalidad tiroidea como los niveles séricos de T3, T4 y TSH no se encontraron alterados. El hecho de no encontrar hipotiroidismo causado por la genisteína en las ratas a pesar de la extensa inactivación de la TPO, indica que hay otros factores de riesgo necesarios para producir hipotiroidismo; en particular, la deficiencia de yodo es necesaria para que la soya tenga efectos anti tiroideos in vivo; conclusión a la que también llegaron Messina y Redmond en el año 2006 en su revisión bibliográfica(14).
Para el 2003, en el Departamento de Medicina de la Universidad de Stanford, investigaron la función tiroidea en 38 mujeres posmenopáusicas, entre 64 y 83 años, que no recibieran terapia hormonal pero sí un suministro diario de 90 mg de isoflavonas, comparando con un grupo control que recibió un placebo, lo cual permitió concluir que las isoflavonas no tenían ningún efecto adverso sobre la función tiroidea(15).
En el 2004, Conrad y col(16) quisieron comprobar que en lactantes con hipotiroidismo congénito, el hecho de ser alimentados con FIBS ocasionaría un aumento prolongado de TSH; para ello estudiaron a 78 pacientes durante su primer año de vida, de los cuales sólo 8 se encontraban consumiendo FIBS, y encontraron que éstos tenían un incremento prolongado de TSH en comparación con el grupo control, por lo que necesitan una monitorización constante del perfil tiroideo y dosis mayores de levotiroxina para alcanzar va-lores normales en las pruebas de hormonas tiroideas.
En Canadá, Xiao y col., realizaron un estudio cuyo objetivo fue examinar el efecto de la proteína aislada de soya y las isoflavonas en los receptores de hormona tiroidea hepáticos en ratas, y encontraron que esta proteína no repercutió en los niveles totales de hormonas tiroideas, mas si lo hicieron los suplementos de isoflavonas a altas dosis, especialmente los niveles de T4 aumentaron en ratas hembras(17).
Asimismo, un mes después, White y col(18), publicaron un estudio en el que administraron a un grupo de gatos sanos una dieta a base de soya por tres meses y compararon los niveles de hormonas tiroideas con un grupo control (exento de soya); encontraron que hubo un aumento de los niveles de T4 libre, mientras que T3 permaneció sin alteraciones.
En el año 2006, Milerova y col(19) del Instituto de Endocrinología de la República Checa, realizaron un estudio en 268 niños sin problemas tiroideos, para evaluar sus niveles de hormonas tiroideas, autoanticuerpos antitiroideos, junto con las concentraciones de genisteína y daidzeína en sangre, buscando deficiencia de yodo. Investigaron si la presencia de ambos tipos de isoflavona en sangre podría influir en la función tiroidea en una población donde el consumo de soya no es común. Los resultados indicaron que hubo una asociación significativa entre la genisteína con los autoanticuerpos de la tiroglobulina y una correlación muy leve entre los niveles de genisteína y los de las demás hormonas tiroideas. Concluyeron que existe una modesta asociación entre los niveles de fitoestrógenos y los parámetros tiroideos evaluados, además que una pequeña variación en la cantidad de fitoestrógenos puede afectar la función tiroidea, cuando la ingesta de yodo no es adecuada.
Por los resultados arrojados en las diferentes investigaciones, se genera un debate con respecto a la seguridad del uso de FIBS, ya que en la actualidad no existen estudios concluyentes, como lo expresan Song y col(20). A pesar de no llegar a un consenso, aún existe una cantidad significativa de lactantes que toman estas fórmulas; las estadísticas a nivel mundial reflejan que su consumo es de alrededor del 1% de los lactantes; y en Estados Unidos se manejan cifras de alrededor de 25% de lactantes que las consumen(21). En América Latina, específicamente Venezuela, no se tienen estadísticas sobre el consumo de FIBS en lactantes.
Actualmente no se manejan cifras de hipotiroidismo en lactantes menores a nivel nacional, así como tampoco de su posible relación con la ingesta de FIBS, puesto que no existen estudios con resultados concluyentes que relacionen las dos variables, por lo que se planteó determinar el funciona-lismo tiroideo en lactantes menores de 6 meses, alimentados exclusivamente, con fórmula infantil a base de soya.
MÉTODOS
Se realizó un estudio descriptivo, transversal. La muestra quedó integrada por 28 niños y niñas menores de 6 meses, que consumieron de forma exclusiva fórmula infantil a base de soya, por un periodo mínimo de dos meses, quienes acu-dieron a la consulta pediátrica de la Ciudad Hospitalaria Dr. Enrique Tejera entre febrero y julio de 2008, cuyas madres estuvieron de acuerdo con participar en el estudio(22).
Criterios de inclusión: menores de 6 meses de edad, uno u otro sexo, eutróficos pertenecientes a cualquier es trato social, consumo de FIBS durante mínimo dos meses, con pruebas tiroideas al nacer dentro de límites normales (prueba talón al nacer).
Criterios de exclusión: hipotiroidismo congénito, patologías crónicas, retraso psicomotor, o inicio de alimentación diferente a FIBS.
La estratificación social de las familias se realizó por el método de Graffar- Méndez Castellano(23).
Para seleccionar a los pacientes eutróficos se realizó eva- luación antropométrica por un personal debidamente entrenado y estandarizado; incluyó las siguientes variables e indicadores:
Variables: peso (Kg.), talla (cm.) utilizando el infantómetro. La circunferencia media del brazo se midió con cinta métrica, no extensible.
Indicadores: peso para la edad (P-E), peso para la talla (P-T), talla para la edad (T-E), circunferencia braquial izquierda para la edad (CBI-E), perímetro cefálico para la edad (PC-E).
Los valores de referencia utilizados para P-E, P-T, T-E, fueron las Gráficas de Fundacredesa: Proyecto Venezuela 1993 y para la CBI-E se utilizaron las gráficas del Estudio Transversal de Caracas. El diagnóstico nutricional se realizó de acuerdo con el criterio de combinación de indicadores(24). Los valores límite fueron los percentiles 10 y 90 para peso-edad, peso-talla, PC-edad y circunferencia braquial izquierda-edad y los percentiles 3 y 97 de talla/edad.
La información en cuanto a tipo de alimentación, motivo de indicación de la FIBS, número de teteros, onzas ingeridas por día, dilución de la fórmula, considerándose correcta al 13,5% se realizó a través de la aplicación de un instrumento de recolección de datos, mediante un interrogatorio perso-nalizado con el representante del paciente.
Para la determinación de hormonas tiroideas, T3 y T4 libres y TSH, se tomaron muestras de sangre a través de venopunción, obteniendo la cantidad de 4 ml por cada paciente, las cuales fueron transportadas al Centro de Análisis Especiales Dr. Jacobo Domínguez Rochil, donde posterior a centrifugación se almacenaron a una temperatura entre 2 y 8°C, hasta ser procesadas en un Analizador de Inmunoensayo tipo ELECYS 1010∕2010 ROCHE MODULAR ANALYTICS E 170, mediante el método de inmunoensayo de electroquimioluminiscencia (ECLIA). Se conside-raron valores normales de referencia a los aportados por el laboratorio, de acuerdo a la técnica empleada (ROCHE) para menores de 6 meses, T3 libre 1,5 – 6,4 pg/mL, T4 libre: 0,93 – 1,71 ng/dL, y TSH: 0,27 – 4,2 /µU mL(25).
Se le aplicaron técnicas de análisis estadístico descriptivo univariado y bivariado, con el programa Statistix 8,0 para Windows, previa confirmación del ajuste de las variables numéricas a la distribución normal con la prueba de Kolmogorov-Smirnov. Se realizó la prueba t de Student con el fin de comparar los promedios de TSH, T3-libre y T4-libre de los integrantes de la muestra, con los valores de referencia en niños menores de 6 meses, utilizando un nivel de significación de 95% (p < 0,05).
RESULTADOS
En el Cuadro 1 se muestra la distribución de acuerdo al sexo, edad y estrato social, de los pacientes evaluados (n=28), se observó una distribución similar entre géneros; la edad promedio fue de 4,21 meses, con una desviación estándar de 0,99 meses. Con respecto a la distribución Graffar-Méndez Castellano, se evidenció que predominaron los estratos sociales III y IV (85,7%).
En el Cuadro 2 se muestran los motivos de indicación de FIBS, donde 96,4% fue por indicación médica (atopia e intolerancia a la lactosa); sólo un paciente (3,6%) se debió a recomendación familiar. En cuanto a la dilución, se observó que 92,9% de los lactantes estudiados fue correcta y estadísticamente mayor que los que no la recibieron en la forma adecuada (7,1%), siendo Z = 6,15 y p = 0,000.
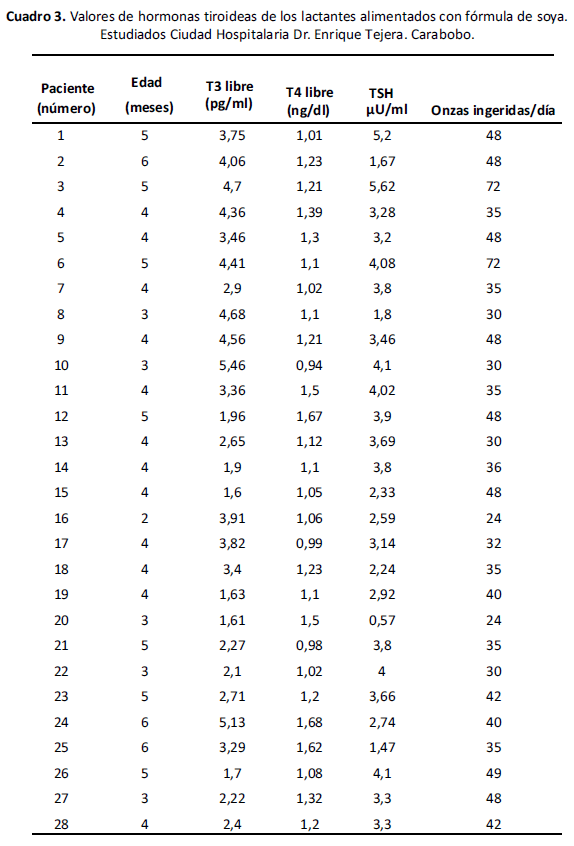
En el Cuadro 3 se presentan los valores de hormonas tiroideas y onzas diarias ingeridas, encontrada en cada uno de los lactantes estudiados, apreciándose niveles normales para T3 y T4 en todos los casos. La TSH se encontró por encima de su valor normal (4,2 µU/ml), en 2 pacientes. En cuanto a la cantidad de onzas de FIBS ingeridas diariamente, se observa que a mayor edad existe una mayor ingesta.
Los valores promedio de T3 y T4 libres y TSH de los lactantes estudiados se compararon con el límite pertinente de los valores de referencia en cada caso. Las medias de los niveles en sangre de T3 y T4 libre fueron significativamente mayores que el límite inferior de los valores de referencia respectivos (Cuadro 4).
Se estimaron los límites de confianza para la incidencia de valores de TSH por encima de 4,2 µU/ml, en 95%. El valor resultante fue de 0,0% para el nivel inferior y el superior de 9,5%, aportando así una estimación entre los valores en estudio.
En el Cuadro 5, al observar los resultados de la TSH, dos de los pacientes presentaron aumento de los niveles por encima de los valores esperados para su edad (7%); no siendo este hallazgo estadísticamente significativo.
Se obtuvo que los coeficientes de correlación de las hormonas T3 y T4 libres resultaron ser muy bajos y sin significación estadística (p > 0,05). Sin embargo, al considerar la TSH, el cociente resultó ser de orden medio (r = 0,474), significativo (p < 0,011), indicando que existió una relación entre los valores de TSH y el número diario de onzas ingeridas: a mayor cantidad de onzas ingeridas mayor fueron los niveles de TSH en el grupo estudiado (Cuadro 6).
Dado que la ingesta diaria de la fórmula de soya en onzas ingeridas estuvo en relación directa con la edad en meses de los pacientes, se calculó el coeficiente de correlación parcial, manteniendo constante la influencia de la edad, para evitar el efecto oculto que puede tener esta variable en la relación li-neal con las otras variables a correlacionar. Las hormonas T3 y T4 libre, presentaron coeficientes de correlación negativos, sin significación estadística (p> 0,05), en el caso de la hormona TSH el coeficiente presentó significación estadística (p< 0,011) y ligeramente mayor (r = 0,482), lo que implica que al controlar la edad, la relación entre la TSH y las onzas ingeridas fue de mayor fortaleza.
DISCUSIÓN
La principal causa del suministro de FIBS en los niños evaluados fue por prescripción médica, específicamente por presencia de atopias e intolerancia a la lactosa, por lo tanto la utilización de la FIBS es adecuada en este grupo de estudio. Así mismo, se observó que la dilución empleada para la preparación de la fórmula es la correcta, esto puede deberse al hecho de que las mismas fueron indicadas por el médico.
En cuanto al funcionalismo tiroideo de los lactantes alimentados con FIBS, se encontró que éste fue normal al compararlo con los valores de referencia de T3 y T4 libres, pero en el caso de los niveles de TSH, se encontró elevación de los mismos en los lactantes con mayor ingesta en onzas de FIBS, por lo que hay que considerar lo expresado por investigadores como Fitzpatrick y Dipp, en un documento informativo de la Comisión de Alimentos del Reino Unido, donde plantean su preocupación por la salud de los lactantes que consumen FIBS, ya que en su revisión encuentran modelos animales que demuestran efectos generadores de bocio y hasta efectos carcinogénicos de productos de soya. Incluso, reportes sobre los efectos generadores de bocio por el consumo de soya en niños(26). Otros investigadores como Dillingham y col(27), Messina y col(14), no encontraron una influencia significativa entre la proteína aislada de soya y los niveles de hormonas tiroideas en adultos.
Por otra parte, La Food and Drug Administration (FDA) ha avalado que las fórmulas de aislado de proteína de soya son efectivas y seguras para ser usadas como única fuente alimentaria en los casos específicos(2).
La soya ha merecido una variada gama de atributos y comentarios tanto a favor como en contra, particularmente durante la infancia, por su importancia en el crecimiento y desarrollo.
Debido a la escasa e inconsistente data humana existente y a la evidencia substancial in vitro de la influencia hormo-nal de la soya, y por los resultados obtenidos en este estudio, se recomienda: insistir en la importancia del seguimiento y control del perfil tiroideo en los lactantes alimentados con FIBS. Realizar un estudio con mayor número de muestra controlando otros factores. Igualmente, determinar el valor mínimo de consumo de fitoestrógeno que sería seguro, para no provocar alteraciones en los valores de hormonas tiroideas en los niños que consuman fórmula de soya.
REFERENCIAS
1. Saadeh R. Estrategia mundial: la lactancia materna, fundamental para la supervivencia infantil. Comunicado de prensa conjunto UNICEF/OMS. 2004. Disponible: http://www.who.int/mediacentre/news/releases/2004/pr19/es/. [Consultado el 11 enero de 2008]. [ Links ]
2. American Academy of Pediatrics. Committe on Nutrition. Soy protein-based formulas: recommendations for use in infant feeding. Pediatrics 1998; 101:148-153. [ Links ]
3. Henley EC, Kuster JM. Protein quality evaluation by protein digestibility-corrected amino acid scoring. Food Technol 1994; 48:74-77. [ Links ]
4. Agostini C, Axelsson I, Goulet O, Koletzko B, Michaelsen KF, Tamas D,et al. Soy protein infant formulae and follow-on formulae: a commentary by the ESPGAN Committee on Nutrition. J Pediatr Gastroenterol Nutr 2006; 42(4):352-361. [ Links ]
5. Berger-Achituv S, Shohat T, Romano-Zelekha O, Ophir E, Rachmani S, Malovizky D, Garty BZ. Widespread use of soy-based formula without clinical indications. J Pediatr Gastroenterol Nutr 2005; 41: 660-666. [ Links ]
6. Messina M. Perspectiva del rol de los alimentos de soja en una nutrición saludable. En: E. Ridner (editor). Soja, propiedades nutricionales y su impacto en la salud. Grupo QSA; Buenos Aires 2006, pp. 76-89. [ Links ]
7. Setchell KD, Zimmer-Nechemias L, Cai J, Heubi JE. Exposure of infants to phyto-oestrogens from soy-based infant formula. Lancet 1997; 350:23-27. [ Links ]
8. Thomas B, Clarkson M, Hughes A, Hughes CL. Estrogenic soybean isoflavones and chronic disease. Risks and benefits. Trends in Endocrinol Metab 1995; 6:11-16. [ Links ]
9. Shepard TH. Soybean goiter. New Eng J Med 1960; 262:1099-1103. [ Links ]
10. Ripp JA. Soybean induced goiter. Am J Dis Child 1961; 102:136-139. [ Links ]
11. Pinchera A, Macgillivray M, Crawford JD, Freeman AG. Thyroid refractoriness in an athyreotic cretin fed soybean formula. New Eng J Med 1965; 273:83-87. [ Links ]
12. Álvarez P, San Isidro J, Cordido F. Hipotiroidismo Subclínico. Guìas Clìnicas. España 2004; 2(29):1- 3. [ Links ]
13. Doerge DR, Sheehan DN. Goitrogenic and Estrogenic activity of soy Isoflavones. Environm Health Perspect 2002;110(Suppl. 3):349-353. [ Links ]
14. Messina M, Redmond G. Effects of soy protein and soybean isoflavones on thyroid function in healthy adults and hypothyroid patients: a review of the relevant literature. Thyroid 2006; 16(3):249-258. [ Links ]
15. Bruce B, Messina M, Spiller GA. Isoflavone supplements do not affect thyroid function in iodine-replete postmenopausal women. J Med Food 2003; 6(4):309-316. [ Links ]
16. Conrad SC, Chiu H, Silverman BL. Soy formula complicates management of congenital hypothyroidism. Arch Dis Child 2004; 89:37-40. [ Links ]
17. Xiao CW, L'Abbé MR, Gilani GS, Cooke GM, Curran IH, Papademetriou SA. Dietary soy protein isolate and isoflavones modulate hepatic thyroid hormone receptors in rats. J Nutr 2004; 134:7439. [ Links ]
18. White HL, Freeman LM, Mahony O, Graham PA, Hao Q, Court MH. Effect of dietary soy on serum thyroid hormone concentrations in healthy adult cats. Am J Vet Res 2004; 65(5):586-591. [ Links ]
19. Milerova J, Cerovska J, Zamrazil V, Bilek R, Lapcik O, Hampl R. Actual levels of oy phytoestrogens in children correlate with thyroid laboratory parameters. Clin Chem Lab Med 2006; 44:171-174. [ Links ]
20. Song WO, Chun OK, Hwang I, Shin HS, Kim BG, Kim KS, et al. Soy isoflavones as safe functional ingredients. Med Food 2007; 10: 571-580. [ Links ]
21. Bhatia J, Greer F. American Academy of Pediatrics: Committee on Nutrition. Use of soy protein-based formulas in infant feeding. Pediatrics 2008; 121:1062-1068. [ Links ]
22. Declaración de Helsinki de la Asociación Médica Mundial. Principios éticos para las investigaciones médicas en seres humanos. 52dª Asamblea General Edimburgo Oct. 2000. Disponible: http://www.wma.net/s/policy/pdf/17c.pdf [Consultado 16 dic 2007]. [ Links ]
23. Méndez Castellano H, Méndez MC. Sociedad y Estratificación. Método Graffar Méndez Castellano. Editorial Fundacredesa. Caracas 1994, 206p. [ Links ]
24. Henríquez G, Hernández Y, Correa C. Evaluación nutricional antropométrica. En: M. López- Blanco, M. Landaeta-Jiménez (Eds). Manual de Crecimiento y Desarrollo. Laboratorio Serono-Fundacredesa- Sociedad Venezolana de Puericultura y Pediatría. Editorial Técnica Salesiana. Caracas 1991, pp. 16-23. [ Links ]
25. Muñoz M, Suarez L. Manual práctico de nutrición en pediatría. Sociedad de Pediatría Madrid y Castilla- La Mancha. Madrid 2000, pp. 210-211. [ Links ]
26. Dibb S, Fitzpatrick M. Fórmulas infantiles a base de soja: hay motivos para preocuparse. Documento Informativo de la Comisión de Alimentos del Reino Unido. Abril 1999. Disponible: http://www.soyonlineservice.co.nz/epanol/formulas_infantiles.html. [Consultado: 20 noviembre 2007]. [ Links ]
27. Dillingham BL, McVeigh BL, Lampe JW, Duncan AM. Soy protein isolates of varied isoflavone content do not influence serum thyroid hormones in healthy young men. Thyroid 2007; 17:131-137. [ Links ]