Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Puericultura y Pediatría
versión impresa ISSN 0004-0649
Arch Venez Puer Ped v.73 n.4 Caracas dic. 2010
TRATAMIENTO ANTIMICROBIANO
Amando Martín Peña (1), Lisbeth Aurenty (2), Ángela Troncone Azocar(1), José Vicente Franco Soto(3)
(1) Pediatra Infectológo. Hospital Universitario de Caracas. Venezuela. e-mail: amando.martin@gmail.com
(2) Pediatra Infectológo. Hospital J.M. de los Ríos. Hospital de Niños de Caracas. Venezuela.
(3) Pediatra Infectológo. Hospital General de San Cristóbal (Edo. Táchira). Venezuela.
Autor corresponsal: Dr. Amando Martín Peña. Hospital Universitario de Caracas. Sección de Pediatria Médica Infecciosa. Los Chaguaramos. 2do. piso. Universidad Central de Venezuela. Venezuela. Telf. 6067322.
RESUMEN
Las Meningitis Bacterianas Agudas (MBA) siguen constituyendo un capítulo de extraordinario interés dentro de los procesos infecciosos. El conocimiento de la epidemiología local es fundamental. La terapia específica con antibióticos debe ser aplicada en forma precoz, con drogas bactericidas de buena concentración en líquido cefalorraquídeo. El conocimiento de la resistencia de los gérmenes causales de las MBA es capital para el logro de un tratamiento eficaz, buscando la menor morbi-mortalidad posible. Cada paciente debe individualizarse en función de la edad, factores asociados y evolución del caso.
Palabras clave: meningitis, antibióticos, resistencia bacteriana, niños.
SUMMARY
Acute bacterial meningitis (ABM) remains a chapter of extraordinary interest in infectious processes. Knowledge of local epidemiology is essential. Specific therapy with the use of antibiotics must be used early, using antibacterial drugs with good concentration in cerebrospinal fluid. Knowledge of the resistance of the causative organisms of the MBA is valuable in achieving an effective treatment, seeking the lowest possible morbidity and mortality. Each patient should be individualized for each patient age, associated factors and its evolution. Treatment should be individualized for each patient age, associated factors and clinical course.
Key Words: meningitis, antibiotics, bacterial resistance, children.
INTRODUCCIÓN
Las Meningitis Bacterianas Agudas (MBA) siguen constituyendo un capítulo de extraordinario interés dentro de los procesos infecciosos. Aunque se dispone de un arsenal terapéutico antibiótico sumamente amplio y eficaz, y a pesar del gran interés en los estudios de resistencia bacteriana, sumado al conocimiento ampliado de la farmacodinamia y farmacocinética de las drogas utilizadas, todavía la morbiletalidad por infecciones del Sistema Nervioso Central (SNC) sigue siendo elevada. Venezuela no escapa de esta realidad, puesto que hay programas de vacunación masiva, pero aún son incompletos. El tratamiento con antibióticos en pacientes con MBA debe considerar una serie de principios generales (1): - Se debe iniciar en forma precoz por sospecha clínica- previa realización de punción lumbar para estudios cito-químicos y cultivos. - El agente antimicrobiano debe ser bactericida, con adecuados niveles de concentración en Líquido Céfalo-Raquídeo (LCR). - La vía de administración debe ser endovenosa. - La duración del tratamiento será de acuerdo a pautas establecidas por epidemiología, edad, etiología y complicaciones. En este sentido, en este capítulo se desarrollarán los siguientes aspectos: - Farmacocinética y farmacodinamia de los antibióticos para considerar la selección conveniente. - Resistencia bacteriana actual. - Esquemas de tratamiento antibiótico en MBA. - Antibioticoterapia en situaciones especiales. - Conclusiones.
FARMACOCINÉTICA Y FARMACODINAMIA DE LOS ANTIBIÓTICOS EN EL SNC.
La elección de una terapia empírica debe basarse en la actividad contra los gérmenes más probables, de acuerdo a la data epidemiológica, la edad del paciente, el estado inmunológico y otros factores predisponentes (1-3).
Las características descritas a continuación determinan la eficacia del antibiótico (3): Penetración en el LCR
La penetración de los antibióticos a través de la barrera hemato-encefálica hacia el LCR es el primer determinante de la capacidad de la droga para tratar una meningitis, teniendo claro que las características del LCR son diferentes a las de otros espacios corporales (4).
Todos los betalactámicos penetran pobremente hacia el LCR si la barrera hemato-encefálica no está alterada. La capacidad del antibiótico para penetrar hacia el LCR se incrementa por la inflamación de las meninges. Así, cualquier proceso o medicamento que disminuya la inflamación meníngea afecta la penetración antimicrobiana, por ejemplo, el uso de dexametasona (2,5).
Algunas condiciones pueden influenciar la penetración y concentración de un antibiótico en el LCR:
1. Drogas de bajo peso molecular y estructuras químicas simples penetran mejor (2-4).
2. Antibióticos con alto grado de ionización lo penetran pobremente (3-6).
3. La penetración en el LCR mejora si los antibióticos tienen alta solubilidad lipídica, tal como se observa con fluoroquinolonas, cloramfenicol, rifampicina y sulfonamidas (4-6).
4. Un alto grado de unión a proteínas en suero restringe la entrada al LCR, ya que la cantidad de droga libre, más que la cantidad total, es lo importante para la penetración (5,6).
5. Existe un sistema de transporte activo en los plexos coroideos y capilares cerebrales que puede alterar la penetración de las penicilinas y cefalosporinas desde el LCR hacia el plasma (5-7).
En el Cuadro 1 se presentan datos sobre la penetración de los agentes antimicrobianos en el LCR. Es importante enfatizar que la selección del antibiótico no debe basarse únicamente en elementos de concentración, ya que existen otros factores que influyen en el porcentaje de penetración, tales como enfermedades subyacentes, la dosis de la droga administrada, la frecuencia de la administración y el tiempo de adquisición de la muestra (3-6).
Actividad de los antibióticos en LCR purulento Un factor relevante es conocer la eficacia del antibiótico en LCR purulento, la cual puede ser afectada por varios factores:
1. Durante la meningitis el pH del LCR se acidifica, lo cual puede causar inhibición del efecto bactericida (5-7).
2. La concentración proteica en el LCR purulento altera la eficacia, ya que la fracción de droga libre es la que genera la actividad bactericida (6-8).
3. El crecimiento bacteriano disminuye en el LCR purulento. Esta situación puede reducir el efecto de los beta-lactámicos (7-9).
4. Después de la penetración en el LCR, algunos antibióticos pueden ser metabolizados a compuestos menos activos (7-9).
5. La actividad bactericida puede ser modificada por el llamado efecto inóculo; cuando el inóculo cambia de 105 a 107 unidades formadores de colonia la Concentración Inhibitoria Mínima (CIM) de un antibiótico se incrementa dramáticamente (7-10).
Actividad bactericida
Un factor importante concierne a la necesidad de que el antibiótico tenga efectos bactericidas, ya que la meningitis se produce en un área de limitada capacidad inmunogénica. La muerte bacteriana ocurre rápido cuando la concentración del antibiótico supera 10 a 20 veces la Concentración Bactericida Mínima (CBM). Para lograr este objetivo es necesario conocer los aspectos farmacodinámicos de los antibióticos y, por ejemplo, saber que la eficacia de los betalactámicos depende del tiempo que dure sobre la CBM, contrario a los aminoglucósidos, cuya eficacia depende de los niveles sobre la CBM (5,6). En terapia antimicrobiana se prefiere
el uso de antibióticos con actividad bactericida que aquellos con actividad bacteriostática, aunque depende del germen; por ejemplo, el comportamiento de cloranfenicol contra Streptococcus pneumoniae y Haemophilus influenzae tipo b es bactericida, aunque su comportamiento general sea de droga bacteriostática (6-8,10).

RESISTENCIA BACTERIANA ACTUAL
La resistencia bacteriana se mantiene en aumento y se caracteriza por la capacidad parcial o total de los microorganismos de no ser afectados por los antibióticos, generado principalmente por el uso indiscriminado e irracional de éstos y no sólo por la evolución propia de las bacterias para defenderse de la terapia antibiótica (6,8).
Las infecciones causadas por bacterias multirresistentes son responsables de una gran morbilidad y mortalidad. Asimismo, causan un mayor costo debido a mayor estancia hospitalaria y complicaciones (10,11). En muchos casos se requiere un enfoque multidisciplinario que incluye cuidados intensivos para el tratamiento de estas infecciones.
En Venezuela no existe un programa de vigilancia activa continua para gérmenes productores de MBA, sin embargo, se cuenta con sistemas regulares en red de hospitales, como el Programa Venezolano de Vigilancia de la Resistencia Bacteriana a los Antimicrobianos (PROVENRA) que, a pesar de las limitaciones, ofrece datos importantes sobre la resistencia de gérmenes productores de MBA. En los datos de PROVENRA se pueden observar las diferencias en los patrones de resistencia según los nuevos cortes de CIM para gérmenes de origen meníngeo y/o enfermedad no invasiva por neumococo. Para 2007, este programa reportó una susceptibilidad global para neumococo de 65,31% en 103 cepas procesadas; para H. influenzae tipo b (Hib) se reportó una susceptibilidad a ampicilina de 83,3%. En este programa no se dispone de datos para Neisseria meningitidis (12). El sistema de registro de cepas bacterianas denominado SIREVA II (Sistema de Redes de Vigilancia) de la Organización Panamericana de Salud, realizado en Venezuela por el Instituto Nacional de Higiene Rafael Rangel, ha permitido conocer más de los gérmenes importantes en MAB como son Streptococcus pneumoniae (neumococo), Hib y N. meningitidis (12,13).
En SIREVA II se describe la resistencia total del neumococo a penicilina, la cual ha ido ascendiendo desde 2000 hasta 2008, con rangos actuales de 15% a 30% en 676 cepas aisladas en menores de 5 años de edad. Se observan niveles de alta resistencia (CIM > 2,0 mcg/ml) de S. pneumoniae en LCR, los cuales están en 5-6%. Para 2009, las cepas aisladas en LCR presentaron una susceptibilidad a penicilina de 87% (12,13). Los serotipos más aislados en enfermedad invasiva por neumococo hasta 2008 son: 14, 5, 6B, 1, 19A, 5, 23F y 18C.
Específicamente en meningitis purulenta por S. pneumoniae son: 14, 6B, 5, 18C,1, 23F, 19F, 7, 19A, predominando los serotipos 14, 6B, 23F y 19A, los cuales están relacionados con altos porcentajes de resistencia. SIREVA II ha reportado un 0,5% de resistencia por S. pneumoniae a cefalosporinas de tercera generación hasta el año 2007, sin discriminar cepas aisladas o no en LCR. Para 2008, en cepas aisladas causantes de meningitis se reportó sensibilidad intermedia de 3,8% (CIM ≈ 0,5-1mcg/ml). Hasta 2009 no se habían reportado cepas de neumococo aisladas en LCR con alta resistencia (2,0 mcg/mL) a cefalosporinas de tercera generación (12,13). La resistencia del neumococo no está claramente relacionada a un incremento de la mortalidad, pero sí es una causa muy importante de falla clínica (12).
En Hib, PROVENRA y SIREVA II han descrito que para 2006 el número de cepas había disminuido en 40%, en comparación con los años 1999-2005; el porcentaje de resistencia a ampicilina fue 8,7%. Estos datos sugieren menor incidencia de MBA por este germen (12-14).
La MBA por N. meningitidis ha tenido una interesante evolución. Los serogrupos aislados desde 1999 hasta 2008 han variado en sus frecuencias. Se ha observado que el serogrupo B ha aumentado hasta ocupar el 40%de los casos, el serogrupo C se mantiene en 34% y, el serogrupo Y se observa 26% casos. Hay que hacer notar que en los últimos cinco años llama la atención la aparición del serogrupo Y, el predominio del serogrupo B, manteniéndose el serogrupo C en segundo lugar (12-14). En Venezuela, desde 1994 se describen las cepas de meningococo (Instituto de Higiene Rafael Rangel) con sensibilidad disminuida a penicilina, en especial por el serogrupo B. En 1998, se estableció 20% como nivel de resistencia a penicilina (resistencia intermedia) y ha oscilado con pocas variaciones en los datos obtenidos hasta 2008 (12-14).
Recientemente se han identificado infecciones polimicrobianas y de multiresistencia a los antibióticos, por lo cual se están desarrollando nuevos antimicrobianos. El médico debe ser consciente de esto y considerar las tendencias locales de sensibilidad a los antibióticos y de los patógenos más frecuentes al momento de indicar antibioticoterapia para MBA (9-11).

ESQUEMAS DE TRATAMIENTO EN MBA
En los últimos años, se han presentado modificaciones en el tratamiento de la MBA que motivan a tomar nuevas conductas. Esto puede atribuirse a las siguientes situaciones:
El advenimiento de antibióticos con capacidad para lograr esterilización más rápida y con menos reacciones adversas.
El cambio en los patrones de susceptibilidad de las bacterias causantes de MBA.
La vacunación sistemática contra Hib, lo cual ha disminuido considerablemente la incidencia de meningitis causada por este germen.
Los cambios en la epidemiología de la infección por neumococo y por meningococo, debido al advenimiento de las vacunas conjugadas (15,16).
a.- Antibioticoterapia empírica inicial
El tratamiento empírico inicial de la MBA debe basarse en los probables agentes etiológicos, de acuerdo al grupo etario (17,18) (Cuadro 2). Debe considerarse:
Ausencia de inmunizaciones contra Hib o neumococo.
Edad menor a 6 meses, asistencia a guarderías, exposición al tabaco, ausencia de lactancia materna y tratamiento con betalactámicos en las 3 semanas previas al diagnóstico, ya que está asociado a infecciones por neumococo resistente a la penicilina (19-21).
El bajo peso al nacer es factor de riesgo para meningitis por Pseudomonas (22,23).
b.- Antibioticoterapia específica
Una vez conocido el agente etiológico, a través del reporte de cultivo y antibiograma, deben hacerse los cambios en el tratamiento, orientados a utilizar los antibióticos más específicos, de bajo costo y con menor frecuencia de reacciones adversas (20) (Cuadro 3).
c.- La duración del tratamiento varía con el grupo etario y el agente etiológico.
El esquema terapéutico para abordar meningitis neonatales, por lo general, es no menor a 21 días. Sin embargo, en neonatos con aislamiento de Streptococcus agalactiae (ß hemo-lítico grupo B) y L. monocytogenes puede ser de 14 días. Debe realizarse punción lumbar control luego de 10 días; si es estéril, se mantiene el tratamiento por un mínimo de 2 semanas.(14,15,21,24-27).
En caso de meningitis no complicada y dependiendo del germen aislado, se recomienda lo siguiente:
S. pneumoniae: 10 a 14 días
Hib: 7 a 10 días
N. meningitidis: 5 a 7 días
L. monocytogenes: 14 a 21 días
Bacilos gram negativos: 3 semanas ó mínimo 2 semanas después de un cultivo estéril.
Hay casos particulares en los cuales se establece la duración del tratamiento, dependiendo del estado febril. Un 12- 14% de los casos pueden presentar fiebre de 4 a 5 días, aunque se haya comenzado el tratamiento con antibióticos, y en un 16% se puede observar fiebre secundaria o recurrente, después de un período afebril (23,28).
En estos casos deben evaluarse: tratamientos inadecuados, desarrollo de infecciones nosocomiales, infecciones virales secundariamente adquiridas, complicaciones supurativas, complicaciones neuroquirúrgicas (colección subdural, con frecuencia). En estas situaciones, es necesario evaluar a cada niño en forma individualizada y realizar estudios que incluyan análisis del LCR e imagenología (23,28,29).
d.-Vía de Administración
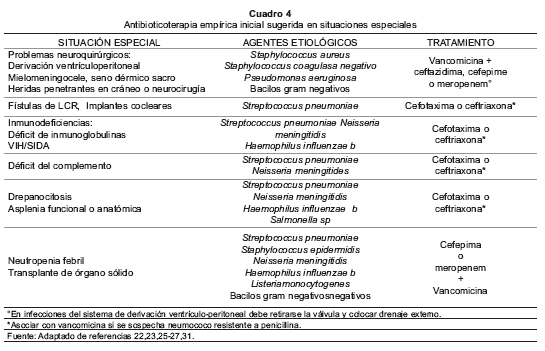
El tratamiento de la MBA siempre debe ser endovenoso. No se recomienda la terapia secuencial parenteral-oral, excepto con el uso de rifampicina en las situaciones señaladas en los Cuadros 3 y 4 (16,21,23,28,30).
![]()


REFERENCIAS
1. Valery FV, Veitía J, Leisse P, Herrera M, Lavado D, Santiago RJ, et al. Tratamiento Específico de la Meningitis Bacteriana. Arch Venez Puer Ped 2003;66(Supl 3):28-39. [ Links ]
2. Cabellos C, Fernandez V, Gudiol F. Tratamiento de las Infecciones del Sistema Nervioso Central. En: L. Drobnic (editor). Tratamiento Antimicrobiano. 3ra. edicion. Ergon. Barcelona, España 2002, pp. 605-615.
3. Honda H, Warren DK. Central nervous system infections: meningitis and brain abscess. Infect Clin NA en vez de Clin North Am 2009; 23(3):609-623. [ Links ]
4. Chowdhury MH, Tunkel AR. Antibacterial agents in infections of the central nervous system. Infect Clin NA en vez de Clin North Am 2000; 14(2):391-408. [ Links ]
5. Miranda J, Tunkel AR. Strategies and new developments in the management of bacterial meningitis. Infect Clin NA en vez de Clin North Am 2009; 23(4):925-943. [ Links ]
6. Sinner SW, Tunkel AR. Antimicrobial agents in the treatment of bacterial meningitis. Infect Clin NA en vez de Clin North Am 2004;18(3):581-602. [ Links ]
7. Fitch MT, Abrahamian FM, Moran GJ, Talan DA. Emergency department management of meningitis and encephalitis. Infect Clin NA en vez de Clin North Am 2008; 22(1):33-52. [ Links ]
8. Mace SE. Acute bacterial meningitis. Emerg Med Clin NA en vez de Clin North Am 2008;26(2):281-317. [ Links ]
9. Harrison LH. Epidemiological profile of meningococcal disease in the United States. Clin Infec Dis 2010;50 Suppl 2:S37- S44. [ Links ]
10. Clinical and Laboratory Standards Institute (CLSI): Performance Standards for Antimicrobial Susceptibility Testing; Twentieth Informational Supplement. Washington. Disponible en: http://emedicine.medscape.com/article/225811-overview
11. Lynch JP, Zhanel GG. Streptococcus pneumoniae: does antimicrobial resistance matter? Semin Respir Crit Care Med 2009; 30(2):210-238. [ Links ]
12. Programa Venezolano de Vigilancia de la Resistencia Bacteriana a los Antimicrobianos. [sitio en internet]. Disponible en: http://provenra.org/whonetvenezuela/reportes.asp [Consultado: 7 de octubre de 2010].
13. Reunión regional de SIREVA II. 2009. [sitio en internet]. Disponible en: http://new.paho.org/bra/index2php?option=com_docmantask=doc_viewgid=440Itemid=614 [Consultado: 22 de julio de 2010].
14. Spadola E, Fernández S, Payares DJ, Tarazona BD, Gabastou JM, Waard JH, et al. Revista del Instituto Nacional de Higiene Rafael Rangel 2009; 40(2):36-43. [ Links ]
15. Sáez-Llorens X, McCracken G Jr. Bacterial meningitis in children. Lancet 2003; 361: 2139-2148. [ Links ]
16. Kim KS. Acute bacterial meningitis in infants and children. Lancet Infect Dis 2010;10(1):32-42. [ Links ]
17. Peltola H, Roine I. Improving the outcomes in children with bacterial meningitis. Curr Opin Infect Dis 2009;22(3):250- 255. [ Links ]
18. Brouwer MC, Tunkel AR, van de Beek D. Epidemiology, diagnosis, and antimicrobial treatment of acute bacterial meningitis. Clin Microbiol Rev 2010 ;23(3):467-492. [ Links ]
19. Chávez-Bueno S, McCracken GH Jr. Bacterial meningitis in children. Pediatr Clin NA en vez de Clin North Am 2005; 52(3):795-810. [ Links ]
20. Raymund R, Michael R K. Meningitis. Updated: Jun 9, 2010. Disponible en: http://emedicine.medscape.com/article/232915 . [Consultado: 03-09-2010]
21. Buckingham SC, McCullers JA, Luján-Zilbermann J, Knapp KM, Orman KL, English BK. Pneumococcal meningitis in children: relationship of antibiotic resistance to clinical characteristics and outcomes. Pediatr Infect Dis J 2001; 20(9):837-843. [ Links ]
22. Estripeaut D, Sáez-Llorens X. Perinatal bacterial diseases. In: R.D. Feigin, J.D.Cherry, G.J. Demmler-Harrison, S.L. Kaplan. Textbook of Pediatric Infectious Diseases. 6th ed. Saunders. Philadelphia 2009; pp. 979-981.
23. Tunkel AR, Hartman BJ, Kaplan SL, Kaufman BA, Roos KL, Scheld WM, et al. Practice guidelines for the management of bacterial meningitis. Clin Infect Dis 2004; 39(9):1267-1284. [ Links ]
24. Valery F, López MG, Siciliano L, Martín A, Castillo O. Manual de Antibióticos en Pediatría. Sociedad Venezolana de Puericultura y Pediatría. Editorial Médica Panamericana. Caracas 2007, pp. 56-57.
25. American Academy of Pediatrics. Haemophilus influenzae Infections. In: L.K. Pickering (editor). Red Book. Report of the Committee on Infectious Diseases. 28th ed. Elk Grove Village, IL 2009, pp.314-321.
26. American Academy of Pediatrics. Pneumococcal infections. In: L.K. Pickering (editor). Red Book. Report of the Committee on Infectious Diseases. 28th ed. Elk Grove Village, IL 2009, pp. 524-535.
27. American Academy of Pediatrics. Meningococcal infections. In: L.K. Pickering (editor). Red Book. Report of the Committee on Infectious Diseases. 28th ed. Elk Grove Village, IL 2009, pp. 455-463.
28. Bortolussi R, Mailman T. Listeriosis. In: R.D. Feigin, J.D.Cherry, G.J. Demmler-Harrison, S.L. Kaplan. Textbook of Pediatric Infectious Diseases. 6th ed. Saunders. Philadelphia 2009; pp.1420-1422.
29. Neurologic Syndrome. Purulent Meningitis. In: R. Fisher, T.H. Boyce (editors). Moffet´s Pediatric Infectious Diseases. A Problem-Oriented Approach. 4th ed. Lippincott Williams&Wilkins. Philadelphia 2005, pp. 243-264.
30. Tan TQ. Antibiotic resistant infections due to Streptococcus pneumoniae: impact on therapeutic options and clinical outcome. Curr Opin Infect Dis 2003;16 (3):271-277. [ Links ]
31. Tunkel AR, Sheld WM. Treatment of Bacterial Meningitis. Curr Infect Dis Rep 2002; 4(1):7-16. [ Links ]














