Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Puericultura y Pediatría
versión impresa ISSN 0004-0649
Arch Venez Puer Ped v.74 n.1 Caracas mar. 2011
Manejo intrahospitalario. Infección urinaria en el recién nacido
Michelle López Luzardo (1), Belén Arteaga (1), Pedro Macuarisma (2), María José Castro (3), Huníades Urbina-Medina (1)
(1) Hospital de Niños JM de los Ríos. Caracas, Venezuela
(2) Hospital Universitario Antonio Patricio de Alcalá. Cumaná, Edo Sucre, Venezuela
(3) Hospital Miguel Carreño. Caracas, Venezuela
Autor corresponsal: Michelle López Luzardo Servicio de Nefrología. Hospital de Niños JM de los Ríos Caracas. Venezuela Correo electrónico: michellelopez@cantv.net
Consenso de Infecciones Urinarias. Octubre 2010
RESUMEN
La decisión de hospitalizar o no un niño con Infección Urinaria (IU) no debe sustentarse de forma exclusiva en el diagnóstico de pielonefritis aguda, ya que estudios recientes han mostrado que en los pacientes con buen estado general y, sin antecedentes de uropatía importante, el tratamiento ambulatorio con antibióticos por vía oral es eficaz y seguro. Por ello, la decisión de ingreso se debe basar fundamentalmente en la valoración de la situación clínica del paciente y el riesgo estimado de complicaciones generales. En esta revisión se evalúa la eficacia y seguridad de los antibióticos que se utilizan para tratar pielonefritis aguda en niños que requieren ser hospitalizados, se especifican los agentes antibióticos óptimos, así como la vía de administración y la duración del tratamiento adecuadas para este grupo de pacientes. Asimismo, se revisan los aspectos particulares de la IU en el neonato, debido a las características especiales del sistema inmune en este grupo de edad.
Palabras clave: infección urinaria, criterios de hospitalización, tratamiento intravenoso, neonato.
SUMMARY
The decision to hospitalize a child with urinary tract infection should not rely exclusively on the diagnosis of acute pyelonephritis, for recent studies have demonstrated that ambulatory treatment with oral antibiotics is safe and efficient in patients with good general status and no history of urological abnormalities. For this reason, the decision to admit the patient should be based on the assessment of clinical conditions and the estimated risk of general complications. This review evaluates the efficiency and safety of antibiotics employed in children with acute pyelonephritis who require hospitalization, specifies the appropriate antibiotics, as well as the route and length of the treatment. Particular aspects of urinary tract infection in the newborn due to the special characteristics of the immune system at this age are also reviewed.
Key words: urinary tract infection, hospitalization criteria, intravenous antibiotics, newborn.
CRITERIOS DE HOSPITALIZACIÓN
Se acepta de manera generalizada, que los niños con diagnóstico comprobado de IU deben recibir tratamiento antibiótico precozmente, con el fin de prevenir el desarrollo de cicatrices renales secundarias a una posible Pielonefritis Aguda (PNA). A fin de asegurar un tratamiento oportuno y eficaz, es importante conocer cuáles son los aspectos que conducen a la hospitalización de estos pacientes.
La efectividad demostrada del tratamiento oral con cefixima, comparable con la administración intravenosa de cefotaxima, modificó los criterios de hospitalización para niños con IU (1). El pediatra debe tomar en cuenta dos aspectos importantes para decidir hospitalizar o no a su paciente:
- Ingresar a un niño injustificadamente significa, además del impacto psicológico que supone separarlo de su ambiente familiar, aumentar innecesariamente el riesgo de contraer otra infección, alterar la vida de la familia y aumentar los costos.
- Tratar de forma inadecuada a un niño con PNA significa aumentar el riesgo de que se produzcan cicatrices renales o que se desarrolle una urosepsis (2).
Hay pocas publicaciones que estudien la efectividad o rentabilidad del ingreso de niños con IU. Los protocolos de diagnóstico y tratamiento en infección del tracto urinario recientemente publicados por la Asociación Española de Pediatría analizan tres aspectos que pueden aportar información para decidir sobre la hospitalización de niños con IU (3):
Indicadores clínicos analíticos de PNA con mayor riesgo de desarrollar cicatrices renales y otras complicaciones.
A pesar de que los estudios disponibles no son concluyentes (4-6), los datos apuntan a que la Procalcitonina (PCT) mejora los indicadores de validez de la Proteína C reactiva (PCR), fundamentalmente su especificidad. Una PCT por encima del punto de corte (habitualmente 0,5 ng/ml) aumentaría la probabilidad de PNA hasta un 82,8%, mientras que una PCT por debajo de esa cifra la bajaría hasta el 20%.
Si la PCR se encuentra por encima del punto de corte (habitualmente 20 mg/l, aumentaría la probabilidad de PNA hasta el 58,7%, mientras que una PCR por debajo de esa cifra la bajaría hasta el 16,7%. Una posible ventaja de la PCT como indicador de PNA es la precocidad con la que se elevan sus concentraciones plasmáticas, aunque se requieren más estudios sobre la capacidad de la PCT para predecir el desarrollo de cicatrices renales (7).
Se han estudiado múltiples variables de laboratorio como indicadores de PNA. En plasma: la Velocidad de Sedimentación Globular (VSG), N-acetil-β-glucosaminidasa (NAG), NAG/creatinina y complejo alfa 1 antitripsina-elastasa polimorfonuclear. En orina se han estudiado la relación α 1-microglobulina/creatinina, la osmolaridad y el análisis microbiológico del sedimento urinario (8-10).
Estos estudios no permiten extraer conclusiones claras debido a que el tamaño de algunos ensayos era muy pequeño, los indicadores estudiados son muy diversos y, las metodologías y los distintos puntos de corte para valores positivos fueron muy diferentes. En general, el rendimiento diagnóstico de los distintos parámetros es pobre.
Efectividad del tratamiento antibiótico oral comparado con el endovenoso, cuando el paciente es enviado a su domicilio. Este punto será tratado en la sección correspondiente al tratamiento antibiótico intrahospitalario.
Recomendaciones de práctica clínica
En base a las guías de práctica clínica disponibles, los principales criterios de hospitalización son los siguientes (2,3,11-14):
- Edad (neonatos y lactantes menores de 3 meses)
- Alteración del estado general (decaimiento o disminución de la respuesta a estímulos, palidez, piel moteada, entre otros).
- Vómitos
- Deshidratación
- Inadecuada respuesta al tratamiento antibiótico previo
- Dificultad para un seguimiento adecuado
- Antecedentes de malformaciones importantes de las vías urinarias (especialmente obstructivas), Reflujo Vésico Ureteral (RVU) de alto grado, alteración de la función renal, inmunodeficiencias.
- Condición social de riesgo - IU en adolescentes embarazadas
No existen publicaciones que valoren de forma específica los criterios de ingreso hospitalario en los niños con IU. La mayoría de los estudios tienen como objetivo identificar parámetros clínicos y de laboratorio que sean útiles para el diagnóstico de PNA y, en consecuencia, para identificar los pacientes con mayor riesgo de desarrollar cicatrices renales. Sin embargo, hasta ahora ninguno de estos parámetros ha mostrado la suficiente sensibilidad y especificidad como para sustentar un diagnóstico inequívoco. Todos los autores coinciden en que el único método capaz de evaluar de forma adecuada el desarrollo de cicatrices renales es la gammagrafía DMSA, pero es poco viable en la fase aguda de la infección, por su elevado costo y escasa disponibilidad en la mayoría de los centros hospitalarios.
La orientación actual en la práctica clínica es hacia un manejo cada vez menos hospitalario de la IU, ya que los niños mayores de 3 meses con buen estado general y sin antecedentes de uropatía, pueden ser tratados con antibióticos vía oral en su domicilio, sin que se incremente el riesgo de lesiones renales.
A pesar de que estos hallazgos requieren su confirmación con más estudios antes de generalizar su uso, el impacto en la práctica clínica ha sido importante. En este sentido, se recomienda la hospitalización para tratamiento intravenoso, basada en criterios más relacionados con el riesgo de complicaciones generales que con el diagnóstico de PNA (2,3).
Manejo durante la hospitalización
Los objetivos durante la hospitalización de un niño con IU son: mejorar el estado general, restituir el estado de hidratación y administrar el tratamiento antibiótico adecuado por vía intravenosa. Adicionalmente, una vez que las condiciones generales del paciente lo permitan, podrían practicarse los estudios imagenológicos que estuviesen indicados de acuerdo a la edad y al sexo del niño. De estos estudios, sólo la Gammagrafía renal con DMSA es el estudio de elección para identificar lesiones renales de PNA y lesiones crónicas o cicatrices corticales. De hecho, la mayoría de los trabajos que evalúan otros indicadores de lesión renal utilizan la Gammagrafía DMSA como patrón estándar de referencia (7,9,10).
Los distintos tipos de estudios por imágenes y sus indicaciones serán considerados en otro capítulo de este consenso.
Criterios para el egreso
Se recomienda el egreso cuando se recupere el estado general del paciente, luego de transcurridas al menos 24 horas sin fiebre y cuando esté asegurada una buena tolerancia oral (2,3). Indicaciones en el momento del alta.
- Insistir en la importancia de una buena adhesión al tratamiento, de un seguimiento adecuado y de mantener la profilaxis antibiótica en caso de estar indicada.
- Reforzar los hábitos de hidratación adecuada, evitar la retención de orina y el estreñimiento.
- Corregir la técnica de aseo perineal.
- Consultar precozmente ante fiebre sin foco aparente, en especial en los 6 meses posteriores al episodio de IU.
- En el caso de una PNA, se debe practicar urocultivo de control a las 72 horas de iniciado el tratamiento antibiótico.
ANTIBIÓTICOS EN EL MANEJO INTRAHOSPITALARIO DE INFECCIÓN URINARIA
El tratamiento precoz de la IU, especialmente durante las primeras 24 horas desde el inicio de síntomas, reduce la probabilidad de lesión renal durante la fase aguda, pero no está probado que previene la formación de cicatrices (15,16).
La elección de antibióticos depende del microorganismo causal y su patrón de susceptibilidad, de la edad y severidad de la infección del paciente. La hospitalización es necesaria si el paciente tiene urosepsis o se considera probable bacteriemia basada en la evaluación clínica y de laboratorio (17).
Los objetivos de esta revisión son evaluar la eficacia y seguridad de los antibióticos que se utilizan para tratar PNA en niños, determinar los agentes antibióticos óptimos, así como la vía de administración y la duración del tratamiento adecuadas para este grupo de pacientes.
Pielonefritis aguda-IU febril
Se recomienda que un niño con IU febril sea tratado empíricamente con antibióticos después de obtener una muestra apropiada para cultivo. El resultado del cultivo y la susceptibilidad bacteriana pueden indicar posteriormente la necesidad de un cambio de antibiótico (15).
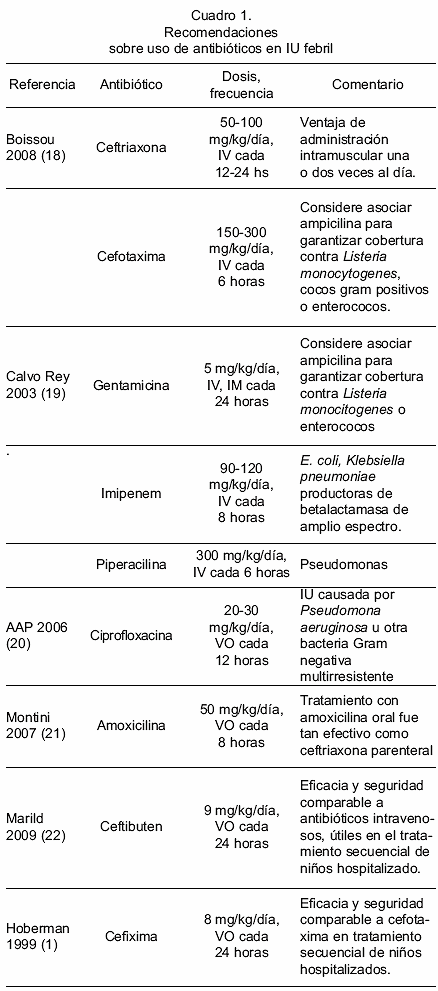
En niños hospitalizados, se recomienda tratar inicialmente la PNA con cefalosporina de tercera generación o aminoglicósidos vía intravenosa, durante 3-5 días o al menos 72 horas luego de la desaparición de la fiebre, seguida de tratamiento vía oral, según el resultado del antibiograma, hasta completar 7-14 días (17).
Tratamiento oral vs. tratamiento secuencial (IV/VO)
Al comparar terapia oral (cefixima, amoxicilina/clavulánico y ceftibuten) con tratamiento intravenoso (cefotaxima o ceftriaxona) seguido de tratamiento oral, se ha reportado lo siguiente (1,22,23):
- Cefixima oral es un tratamiento eficaz y seguro para niños con IU febril
a. La orina era estéril a las 24 horas del inicio del tratamiento; se encontró bacteriemia en 3,4% de los niños tratados vía oral y 5,3% de los niños tratados vía intravenosa; la duración de la fiebre fue de 48,4 horas en los niños tratados por vía oral y de 46,5 horas en los niños tratados por vía intravenosa. No hubo diferencia significativa entre ambos grupos en cuanto a la tasa de recurrencia de bacteriuria o de IU sintomática durante los 6 meses siguientes.
b. El número de niños con daño del parénquima renal, expresado como proporción del número total de pacientes con diagnóstico de PNA o como proporción de pacientes con cambios en el gammagrama con DMSA, no difirió significativamente entre los dos grupos.
c. Aproximadamente 40% de los patógenos urinarios fueron resistentes a ampicilina/amoxicilina.
Por lo tanto, los antibióticos orales, cuidadosamente seleccionados para cubrir los patógenos locales, son tan seguros y efectivos como los antibióticos intravenosos en niños con PNA. La tasa de E. coli no susceptible a ampicilina o trimetoprim sulfametoxazol se ubica entre 40-60% (24,25).
Tratamiento secuencial (IV/VO) versus tratamiento parenteral (IV 7-14 días)
Las guías de práctica clínica y las revisiones sistemáticas consistentemente han apoyado 7 a 14 días de tratamiento con antibiótico para niños con IU (17,26).
Un ensayo controlado (18) y un estudio de cohorte (27) demostraron los siguientes hallazgos:
- Ocho días de tratamiento intravenoso con ceftriaxona no reduce el riesgo de daño renal persistente cuando se le compara con 3 días de tratamiento intravenoso (18).
- La incidencia de daño renal persistente se correlaciona significativamente con el incremento del diámetro renal longitudinal en el ultrasonido inicial y con la presencia y grado de reflujo (18).
- La severidad de la enfermedad y la presencia de anomalías urogenitales, pero no la edad o la duración del tratamiento con antibióticos intravenosos, estuvieron asociadas con riesgo de falla terapéutica, definida como reingreso en un lapso de 30 días (27).
Estos datos apoyan las recomendaciones y guías publicadas para el tratamiento de IU en niños con PNA, las cuales sugieren antibióticos parenterales como tratamiento inicial, seguidos de tratamiento oral hasta completar 14 días.
Dosis diferentes de aminoglicósidos
Entre la administración de dosis única diaria y tres dosis diarias de aminoglicósidos, no se han observado diferencias en la persistencia de bacteriuria, el tiempo hasta la resolución de la fiebre, recurrencia de IU ni disfunción renal o auditiva (19,28). Si se elige el tratamiento intravenoso, la dosis única diaria de aminoglicósidos es segura y efectiva.
Implicaciones para la práctica
Se han identificado las siguientes implicaciones para la práctica clínica en el tratamiento de niños con PNA:
a. La dosis única diaria de aminoglicósidos intravenosa tiene eficacia y seguridad equivalente al tratamiento con 2 o 3 dosis diarias.
b. No hay diferencias significativas de eficacia entre el tratamiento secuencial y el tratamiento antibiótico IV durante 7 a 10 días.
c. No hay diferencias significativas de eficacia entre el tratamiento oral (cefixima, ceftibuten o amoxicilina/ácido clavulánico durante 10 a 14 días) y el tratamiento secuencial. Los niños con PNA y RVU de grado alto parecen beneficiarse del tratamiento parenteral inicial sobre tratamiento oral.
Control de la eficacia de la antibioterapia.
La eficacia terapéutica habitualmente se establece por la desaparición de la fiebre en las primeras 48-72 horas y por la negatividad del cultivo de orina a las 72 horas de iniciado el tratamiento antimicrobiano. Si la respuesta clínica no se produce, debe practicarse urocultivo y revisar otras circunstancias asociadas al fracaso terapéutico (uropatía obstructiva, resistencia bacteriana).
Ocurre falla terapéutica en 1,6% de los niños que reciben antibióticos intravenosos de corta duración y en 2,2% de los niños que reciben tratamiento de larga duración. La falla terapéutica en niños hospitalizados por IU es infrecuente y no está asociada con la duración del tratamiento intravenoso (27).
La posibilidad de diagnosticar la localización de IU en la fase aguda es un aspecto importante de su tratamiento: las IU altas (PNA) tienen más riesgo de complicaciones y pueden necesitar estudios y seguimientos más prolongados que las IU bajas.
INFECCIÓN URINARIA EN RECIÉN NACIDOS
En recién nacidos, las infecciones urinarias son poco frecuentes, están asociadas a bacteriemia y deben ser evaluados para el descarte de infección sistémica y anomalías funcionales y/o anatómicas del tracto urinario. Se reporta una asociación con sepsis de 6-30% (14, 29,30). Las IU en el período neonatal suelen ser de origen hematógeno y la incidencia de bacteriemia en esta etapa es de 30% (14, 30,31). En recién nacidos a término, la incidencia de IU diagnosticadas por punción suprapúbica es de 0,1 a 1%, mientras que en neonatos prematuros y de muy bajo peso puede alcanzar 2-25% (14, 30,31). Es más frecuente en bebés no circuncidados que en aquéllos circuncidados (32). En la edad neonatal es más frecuente en varones, con una relación de 5 a 1 con respecto a las hembras, y disminuye progresivamente hasta que a los 6 meses de vida se ve más frecuentemente en hembras que en varones (14,30,33).
Entre los factores de riesgo están: la prematuridad, bajo peso al nacer, sexo masculino, infecciones asociadas (sepsis, meningitis, osteomielitis, neumonía, onfalitis, etc.), el uso de antibióticos de amplio espectro, asfixia perinatal, ventilación mecánica, nutrición parenteral, uso de catéteres intravasculares y permanencia prolongada en unidades de cuidados intensivos; igualmente, es frecuente la presencia de malformaciones renales y del tracto urinario, especialmente las malformaciones obstructivas. La combinación de catéter intravascular y nutrición parenteral total tiene la más alta relación con IU en el período neonatal (33).
Las defensas naturales del tracto urinario incluyen las propiedades antibacterianas de la orina y la mucosa del tracto urinario, que presenta además mecanismos de antiadherencia. Igualmente, influyen el efecto mecánico del flujo urinario y la presencia de células fagocíticas e inmunoglobulinas. Estos últimos factores pueden ser defectuosos en neonatos (34). En presencia de más de un factor de riesgo, la posibilidad de ocurrencia de IU en recién nacidos puede ascender hasta 11 veces (33).
Las manifestaciones clínicas en neonatos son inespecíficas: fiebre, irritabilidad, inactividad, inapetencia, vómitos, ictericia, ausencia de ganancia de peso, palidez, mala perfusión de piel y dolor abdominal; suelen aparecer después de 72 horas de vida. Las infecciones urinarias en neonatos son más frecuentes entre la segunda y tercera semanas de vida. Un grupo importante de neonatos pueden presentarse en forma asintomática (35).
En vista de que las manifestaciones clínicas son inespecíficas, el diagnóstico certero se realiza a través del urocultivo, preferiblemente por punción suprapúbica, dado el alto grado de contaminación de las muestras obtenidas por cateterismo vesical o recolección externa. El urocultivo realizado por punción suprapúbica tiene una sensibilidad del 95%, con una especificidad de 99% y debe repetirse a las 24-48 horas de iniciado el tratamiento (30).
Las infecciones urinarias en la edad neonatal pueden generar consecuencias a largo plazo por lesión renal que conduzca a hipertensión arterial, infecciones recurrentes e insuficiencia renal (14,30,31,33).
Los gérmenes comúnmente involucrados son los Gram negativos, E. coli, Klebsiella sp, Enterobacter sp, muchas veces resistentes a ampicilina y aminoglicósidos y la Cándida sp (14, 30, 31, 34,35). Si la madre no recibió antibióticos en el último mes, los gérmenes son generalmente sensibles a ampicilina-gentamicina. Si, como sucede con mayor frecuencia, la madre recibió tratamiento profiláctico durante el mes anterior, por haberse detectado Streptococcus agalactiae en el flujo vaginal, es posible que en la flora entérica y vaginal se hayan seleccionado cepas de E. coli que conllevan plásmidos productores de betalactamasas de espectro ampliado, por lo cual sería probable la resistencia a la ampicilina. La asociación con gentamicina soluciona este problema, porque es improbable la resistencia a este aminoglucósido. Si la madre recibe en los días previos al parto cefalosporinas de tercera generación, en especial ceftriaxona, existe el riesgo de que en el canal de parto se seleccionen cepas productoras de betalactamasa. En este caso el antibiótico indicado es la amikacina. El esquema con amikacina-cefotaxima provoca mayor selección, por lo que se recomienda la asociación de piperacilina-tazobactam + amikacina.
Más frecuente es la infección del neonato que permanece internado y adquiere infecciones intrahospitalarias, generalmente multirresistentes y adquiridas en unidades de cuidados intensivos. En este caso predominan Klebsiella pneumoniae, E. coli, Proteus mirabilis, productores de betalactamasa, Pseudomona A. y Acinetobacter (36). Debe utilizarse el antibiograma y controlar sus resultados con urocultivos y hemocultivos seriados.
Tres aspectos adicionales relacionados con las IU en neonatos que merecen un comentario son los siguientes:
1.- Papel protector de la lactancia materna: la lactancia materna ha sido propuesta como una forma para suplementar el sistema inmune inmaduro del neonato mediante el paso de IgA materna y lactoferrina, así como también mediante el efecto anti-adhesivo de los oligosacáridos (37-39). Estudios clínicos nacionales e internacionales han demostrado el efecto protector de la lactancia materna sobre la IU durante los 7 primeros meses de vida (40,41).
2.- Circuncisión: desde la década de los años 80, diversos estudios han mostrado una mayor frecuencia de IU en lactantes no circuncidados. Se ha demostrado una alta concentración de uropatógenos en el prepucio, los cuales tendrían la potencialidad de ascender al tracto urinario y ocasionar IU (42,43). Durante los primeros 6 meses de vida, los niños no circuncidados muestran bacteriuria en una frecuencia 10-12 veces mayor que en niños circuncidados (42,43).
Aunque los datos disponibles hasta los actuales momentos asocian beneficios de índole médica y económica con las circuncisión del recién nacido (42), los estudios previos han sido cuestionados por un potencial sesgo en la selección de los pacientes (44). Como resultado de esto, actualmente se acepta que no existe suficiente evidencia científica para recomendar la circuncisión neonatal de rutina. (45)
3.- Conducta ante el diagnóstico de hidronefrosis antenatal: Luego de una extensa revisión de datos y de las guías recientes de la Asociación Americana de Urología, se recomienda la realización de Uretrocistografía Miccional (UCM) en niños con grados importantes de hidronefrosis (Grados 3- 4), hidrouréter o vejiga anormal por ultrasonido o en quienes desarrollen una IU durante la observación.
También se propone la opción de un manejo observacional sin descartar RVU, con tratamiento precoz de cualquier IU para niños con hidronefrosis grado 1-2, dada la ausencia de pruebas científicas para el valor de identificar y tratar el RVU. También se considera como opción válida la de realizar una UCM en estos pacientes para descartar RVU (46).
REFERENCIAS:
1. Hoberman A, Wald ER, Hickey RW, Baskin M, Charron M, Majd M, et al. Oral versus initial intravenous therapy for urinary tract infections in young febrile children. Pediatrics. 1999;104:79-86 [ Links ]
2. San José González Ma, Méndez Fernández P. Infección urinaria en la infancia, nuevas guías, nuevos modos. Bol Pediatr 2009; 49:227-243. [en línea] [fecha de acceso 11 de noviembre de 2010] URL Disponible en: www.sccalp.org/documents/0000/.../BolPediatr2009_49_227-243.pdf [ Links ]
3. Molina Cabañero J, Ochoa Sangrador C. Criterios de ingreso hospitalario en las infecciones urinarias. An Pediatr (Barc). 2007;67:469-77. [ Links ]
4. Whiting P, Westwood M, Bojke L, Palmer S, Richardson G, Cooper J, et al. Clinical effectiveness and cost-effectiveness of tests for the diagnosis and investigation of urinary tract infection in children: A systematic review and economic model. Health Technol Assess. 2006;10:1-172. [ Links ]
5. Pecile P, Miorin E, Romanello C, Falleti E, Valent F, Giacomuzzi F, et al. Procalcitonin: A marker of severity of acute pyelonephritis among children. Pediatrics. 2004;114:e249-54. [ Links ]
6. Gervaix A, Galetto-Lacour A, Gueron T, Vadas L, Zamora S, Suter S, et al. Usefulness of procalcitonin and C-reactive protein rapid tests for the management of children with urinary tract infection. Pediatr Infect Dis J. 2001;20:507-11. [ Links ]
7. Prat C, Domínguez J, Rodrigo C, Giménez M, Azuara M, Jiménez O, et al. Elevated serum procalcitonin values correlate with renal scarring in children with urinary tract infection. Pediatr Infect Dis J. 2003;22:438-42. [ Links ]
8. Fretzayas A, Moustaki M, Gourgiotis D, Bossios A, Koukoutsakis P, Stavrinadis C. Polymorphonuclear elastase as a diagnostic marker of acute pyelonephritis in children. Pediatrics. 2000;105:E28. [ Links ]
9. Capa Kaya G, Taskiran Y, Bak M, Aydin A, Toksavul O, Uslu Y, et al. Urinary N-acetyl-betaglucosaminidase in children with upper urinary tract infection, in relation to Tc-99m DMSA scintigraphy. Eur J Nucl Med. 2001;28:1156. [ Links ]
10. Garin EH, Olavarría F, Araya C, Broussain M, Barrera C, Young L. Diagnostic significance of clinical and laboratory findings to localize site of urinary infection. Pediatr Nephrol. 2007;22:1002-6. [ Links ]
11. Clark CJ, Kennedy WA 2nd, Shortliffe LD. Urinary tract infection: when to worry. Urol Clin North Am. 2010;37(2):229-41. [ Links ]
12. Salas P, Alvarez E, Saieh C. Pautas de diagnóstico y Tratamiento en Infección Urinaria en niños. Documento de la Rama de Nefrología de la Sociedad Chilena de Nefrología. Rev Chil Pediatr. 2003;74(3):311-314. [ Links ]
13. Cavagnaro F. Infección urinaria en la infancia. Rev Chil Infectol. 2005;22(2):161-168. [ Links ]
14. Málaga Guerrero S. Evidencias científicas en la Infección Urinaria. An Pediatr (Barc). 2007;67:431-4. [ Links ]
15. UTI Guideline Team, Cincinnati Children's Hospital Medical Center: Evidence-based care guideline for medical management of first urinary tract infection in children 12 years of age or less. Guideline 7. Noviembre, 2006. [Sitio en internet]. Disponible en http://www.cincinnatichildrens.org/assets/0/78/1067/2709/2777/2793/9199/c2dda8f2-f122-4cc4-9385 Consultado: 12 de noviembre de 2010. [ Links ]
16. Doganis D, Siafas K, Mavrikou M, Issaris G, Martirosova A, Perperidis G. Does Early Treatment of Urinary Tract Infection Prevent Renal Damage? Pediatrics. 2007;120:e922-e928. [ Links ]
17. American Academy of Pediatrics, Committee on Quality Improvement, Subcommittee on Urinary Tract Infection. Practice parameter: the diagnosis, treatment, and evaluation of the initial urinary tract infection in febrile infants and young children. Pediatrics. 1999;103(4):843-852. [ Links ]
18. Bouissou F, Munzer C, Decramer S, Roussel B, Novo R, Morin D, et al. Prospective, randomized trial comparing short and long intravenous antibiotic treatment of acute pyelonephritis in children: Dimercaptosuccinic Acid scintigraphic evaluation at 9 months. Pediatrics. 2008;121(3):e553-e560. [ Links ]
19. Calvo Rey C, García Díaz B, Nebreda Pérez V, García ML, Maderuelo Sánchez AI, Cilleruelo Pascual ML, et al. Once-daily gentamicin dosing versus thrice-daily dosing in infants with acute pyelonephritis. An Pediatr (Barc). 2003;58(3):228-31. [ Links ]
20. American Academy of Pediatrics. Committee on Infectious Diseases. The Use of Systemic Fluoroquinolones Pediatrics. 2006;118;1287-1292. [ Links ]
21. Montini G, Toffolo A, Zucchetta P, DallAmico R, Gobber D, Calderan A, et al. Antibiotic treatment for pyelonephritis in children: multicentre randomized controlled non-inferiority trial. BMJ. 2007;335(7616):386. [ Links ]
22. Mårild S, Jodal U, Sandberg T. Ceftibuten versus trimethoprim- sulfamethoxazole for oral treatment of febrile urinary tract infection in children. Pediatr Nephrol. 2009;24:521-526. [ Links ]
23. Neuhaus TJ, Berger C, Buechner K, Parvex P, Bischoff G, Goetschel P, et al. Randomised trial of oral versus sequential intravenous/oral cephalosporins in children with pyelonephritis. Eur J Pediatr. 2008;167(9):1037-47. [ Links ]
24. Stelling J, Travers K, Jones R, Turner P, O'Brien T, Levy S. Integrating Escherichia coli antimicrobial susceptibility data from multiple surveillance programs. Emerg Infect Dis. [en línea] 2005 [fecha de acceso 12 de noviembre de 2010];11:873-882. URL Disponible en: http://www.cdc.gov/ncidod/EID/vol11no06/04-1160.htm [ Links ]
25. Prelog M, Schiefecker D, Fille M, Wurzner R, Brunner A, Zimmerhackl LB. Febrile urinary tract infection in children: ampicillin and trimethoprim insufficient as empirical monotherapy. Pediatr Nephrol. 2008; 23:597-602. [ Links ]
26. Mori R, Lakhanpaul M, Verrier-Jones K. Diagnosis and management of urinary tract infection in children: summary of NICE guidance. BMJ. [en línea] 2007 [fecha de acceso 11 de noviembre de 2010]; 25;335(7616):395-7. URL Disponible en: http://www.bmj.com/content/335/7616/395.full.pdf+html [ Links ]
27. Brady P, Conway P, Goudie A. Length of intravenous antibiotic therapy and treatment failure in infants with UTI. Pediatrics. 2010;126:196-203. [ Links ]
28. Hodson EM, Willis NS, Craig JC. Antibióticos para la pielonefritis aguda en niños (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, 2008 Número 4. Oxford: Update Software Ltd. [Sitio en internet]. Disponible en: http://www.update-software.com. Consultado: 12 de noviembre de 2010 [ Links ]
29. Baraff L. Management of infants and young children with fever without source. Pediatr Ann. 2008;37(10):673-9. [ Links ]
30. Islas Domínguez LP, Cardiel Marmolejo LE, Estrada Torres MR, Gavidia López LG. Frecuencia de infección de las vías urinarias en recién nacidos con septicemia neonatal. Rev Mex Pediatr. 2001;68(2):66-68. [ Links ]
31. Fernández Díaz M, Solís Sánchez G, Málaga Guerrero S, Fernández Fernández EM, Menéndez Arias C, Fernández Menéndez JM, et al. Comparación temporal y bacteriológica de la infección urinaria neonatal. An Pediatr (Barc). 2008;69:526-32. [ Links ]
32. Singh-Grewal D, Macdessi J, Craig J. Circumcision for the prevention of urinary tract infection in boys: a systematic review of randomized trials and observational studies. Arch Dis Child. 2005;90:853-8. [ Links ]
33. Falcao MC, Rodrigues Leone C, DAndrea RAP, Berardi R, Ono NA, Costa Vaz FA. Urinary tract infections in full-term newborn infants: risk factor analysis. Rev Hosp Clin Fac Med Sao Paulo. 2000;55(1):9-16. [ Links ]
34. Velázquez Acosta P, Shimabuku Azato R, Delgado Bocanegra C, Zarpa Larrauri R, Arribasplata Garfias G, Fernández Borjas S, et al. Infección urinaria en el recién nacido: etiología y susceptibilidad microbiana. Rev Per Pediatr. 2004; 18-21. [ Links ]
35. Pashapour N, Nikibahksh AA, Golmohammadlou S. Urinary tract infection in term neonates with prolonged jaundice. Urol J. 2007;4(2):91-4. [ Links ]
36. Exeni R, Grimoldi I. Infección urinaria. Arch Latin Nefr Ped. 2010;10(2):75-88. [ Links ]
37. Hanson LA, Korotkova M, Haversen L. Breast-feeding, a complex support system for the offspring. Pediatr Int. 2002;44(4):347-52. [ Links ]
38. Marild S, Hansson S, Jodal U. Protective effect of breastfeeding against urinary tract infection. Acta Paediatr. 2004;93(2):164-8. [ Links ]
39. Haversen L, Ohlsson BG, Hahn-Zoric M. Lactoferrin downregulates the LPS-induced cytokine production in monocytic cells via NF-kappa B. Cell Immunol. 2002;220(2):83-95. [ Links ]
40. Orta-Sibu N, Zibaoui P, Sanchez J, Salcedo M, Repetto V, Guevara H, et al. Study of breastfeeding and not complicated urinary tract infection in children in Valencia, Venezuela. Pediatr Nephrol. 2002;9:21. [ Links ]
41. Hanson LA. Protective effect of breast feeding against urinary tract infection. Acta Paediatr. 2004;93(2):154-6. [ Links ]
42. Schoen EJ, Colby CJ, Ray GT. Newborn circumcision decreases incidence and costs of urinary tract infections during the first year of life. Pediatrics. 2000;105(4 Pt 1):789-93. [ Links ]
43. Wiswell TE. The prepuce, urinary tract infections, and the consequences. Pediatrics. 2000;105(4 Pt 1):860-2. [ Links ]
44. Van Howe RS. Effect of confounding in the association between circumcision status and urinary tract infection. J Infect. 2005;51(1):59-68. [ Links ]
45. American Academy of Pediatrics Task Force on Circumcision. Circumcision policy statement. Pediatrics. 1999;103(3):686- 93. [ Links ]
46. Skoog S, Peters C, Arant B, Copp H, Elder J, Hudson G, et al. Pediatric Vesicoureteral Reflux Guidelines Panel Summary Report: Clinical Practice Guidelines for Screening Siblings of Children With Vesicoureteral Reflux and Neonates/Infants With Prenatal Hydronephrosis. J Urology. 2010;184:1145- 1151. [ Links ]














