Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Puericultura y Pediatría
versión impresa ISSN 0004-0649
Arch Venez Puer Ped vol.76 no.2 Caracas jun. 2013
Los esteroides inhalados y su impacto en el crecimiento
Ivonne Pimentel de Medina (1), María Eugenia García (2), Carlos Albarran (3), Jhonatan Malka Rais (4), Arnaldo Capriles Hulett (5)
1 Alergólogo Pediatra , Ex director del Servicio de Alergología/ Inmunología Hospital de Niños JM de Los Ríos, Caracas, Venezuela.
2 Neumonologo Pediatra, CMDLT, Caracas. Venezuela
3 Pediatra. Clínica Adventista, Barquisimeto, Edo Lara, Venezuela
4 Fellow Alergología/Inmunología, National Jewish Hospital, Denver, Colorado, USA.
5 Alergologo Pediatra, Centro Médico de Caracas, Programa de Medicina Comunitaria CMDLT, Hospital San Juan de Dios, Caracas, Venezuela
Autor corresponsal: Arnaldo Capriles Hulett. Correo electrónico: arnaldocapriles@gmail.com
RESUMEN
Los esteroides inhalados son la base del tratamiento del asma bronquial en niños. El crecimiento infantil es el parámetro más sensible a los efectos adversos de los esteroides. Esta revisión concentra la más reciente información en relación a esta modalidad terapéutica. Sólo se consideraron estudios de al menos un año de duración vs placebo y con mediciones estadiométricas periódicas: La Beclometasona a 400/mcg/día administrada tanto por vía nasal como oral, mostro una diferencia de talla de 1-1,5 cm vs controles. Budesonida (polvo seco), 400mcg/día administrada durante 4-6 años mostró una diferencia similar a la encontrada con beclometasona, persistiendo hasta los 21 años de edad (efecto más evidente en el sexo femenino). Fluticasona CFC en preescolares, a dosis de 100 mcgs BID y dos años de tratamiento (aerochamber), mostro idénticos resultados a los anteriores. No se detectó recuperación del crecimiento en niños menores de 2 años o de peso menor a 15 kg, al año de descontinuarse el tratamiento. Mometasona en polvo seco a 200 mcg/día vs placebo y por un año,en niños escolares,mostró similar diferencia a lo mencionado anteriormente para los otros esteroides Ciclesonida HFA,a 40 mcg y 160 mcg/día por un año, no mostró impacto alguno sobre el crecimiento vs placebo. La adherencia fué un elemento crucial en estos análisis. Los pediatras deberían considerar esta información en un contexto adecuado, intentando mantener las dosis en el mínimo indispensable para un adecuado control del asma bronquial.
Palabras claves: crecimiento, niños, esteroides inhalados, asma, adherencia
Inhaled corticosteroids and their effect om growth
SUMMARY
Steroids are the antinflamatory treatment for asthma in children. Growth has been shown to be the most sensitive parameter to detect steroids' adverse effects. Recent information in relation to inhaled steroids and growth in children is reviewed; only year-long studies vs placebo, employing stadiometric measurements were considered, as follows:1. Beclomethasone , 400 mcg / day, when administered either orally or nasally impacts growth with a height difference vs placebo of 1-1,5 cm at the end of a year-long treatment .2. Budesonide dry powder ,400 mcg / day, during a 4-6 years treatment in school age children has shown the same height difference vs placebo as that for Beclomethasone; such difference persists until 21 years of age (more evident in females ).3. Fluticasone CFC, 100 mcg BID in preschool children over a 2-year treatment administered via aerochamber has shown the same difference as reported for other steroids above. No catch up growth was detected in patients under 2 years of age and weighting less than 15 kg after 1 year of withholding treatment.4. Momethasone dry - powder at 200 mcg / day has shown the same height difference as above.5. Ciclesonide HFA at doses of 40 mcg and 160 mcg / day over a year-long study has shown no impact on growth. Adherence was a crucial issue in this review; pediatricians should analyze this information in a proper context, aiming to the lowest dose possible for appropriate asthma control.
Key words: children, asthma, growth, inhaled steroids,adherence
Recibido: 10-04-13 Aceptado: 10-06-13
INTRODUCCIÓN
Los corticoides son de uso frecuente en pediatría y su farmacología de conocimiento obligado. Es pertinente, en esta revisión, discutir algunos aspectos de los esteroides que estimamos de particular interés para los pediátras, sobre todo para aquellos involucrados en el manejo diario de problemas alérgicos. Los corticoides sintéticos por vía oral (1) han sido utilizados durante más de medio siglo en el tratamiento del asma bronquial aguda así como en la terapéutica crónica o de mantenimiento (control); actualmente, han sido reemplazados por los esteroides inhalados en las estrategias de control excepto en aquellos casos menos frecuentes, cuya severidad así lo amerite. Siendo la inflamación el substrato tanto del asma bronquial como de la rinitis alérgica, los esteroides resultan muy eficaces por su más amplio efecto antiinflamatorio.
La presente revisión se concentra en los llamados esteroides inhalados (EI), una forma de administración muy frecuente y bastante efectiva para el control del asma bronquial y de la rinitis alérgica. Los EI han formado parte de las armas terapéuticas contra el asma durante algo más de 30 años y no existe droga alguna, hasta nuestros días (1,2), capaz de superarlos en su eficacia.
Para el caso del asma tenemos que los EI:
1. Disminuyen significativamente el número de exacerbaciones y las visitas a salas de emergencia o ambulatorios por asma aguda (1,2) y tienen influencia determinante en la disminución del uso de medicación de rescate (empleo de Beta 2 de acción corta). No obstante, la evolución natural de la enfermedad asmática no es afectada por el uso de los EI(2); al cesar su acción antiinflamatoria, reaparece la sintomatología.
2. Impactan significativa y favorablemente la mortalidad por asma, lo cual se ha demostrado en estudios fármaco-epidemiológicos canadienses desarrollados por autores como Suissa (3).
3. Mejoran la calidad de vida del paciente asmático y de sus familiares (1,2).
4. Mejoran significativamente los parámetros objetivos de función pulmonar, tales como el VEF 1 (volumen espiratorio forzado en 1 segundo), muy utilizado en estudios clínicos debido a requerimientos de la Federal Drug Administration de Estados Unidos de Norteamérica (FDA) (1,2).
Para el caso de la rinitis alérgica, la administración de los EI por vía nasal mejora aspectos clínicos tales como la rinorrea, los estornudos, el prurito nasal y muy especialmente un síntoma cardinal y determinante en la calidad de vida: la congestión u obstrucción crónica (hasta ahora, ninguna otra medicación de uso rutinario mejora tan significativamente este aspecto en particular). Es importante recordar que, hoy en día, la vía aérea es considerada como una sola, que comienza en las fosas nasales y se prolonga hasta los alvéolos pulmonares (4).
Un breve repaso histórico sobre los esteroides en general y, en particular, los de uso oral resulta pertinente a los fines de una mejor comprensión del tema. Los esteroides orales, administrados en dosis muy pequeñas, pero de manera continua y diaria, pueden afectar el crecimiento en niños (5). Es conocido que 2 a 3 mg/m2/día de prednisona, o su equivalente, son suficientes para afectar la velocidad de crecimiento (5). Se estima que un niño preescolar de contextura promedio es poseedor de una superficie corporal muy cercana a 1 m2, lo cual se corresponde con unos 20 a 25 kg aproximadamente. Aún cuando la relación dosis de prednisona/kg de peso sea pequeña, tanto como 0.1 mg – 0.2 mg / Kg / día, esta puede llegar a afectar el crecimiento (5). De tal evidencia clínica se deriva que el crecimiento es quizás el parámetro más sensible a la acción de los esteroides.
Por otro lado, los esquemas de tratamiento por vía oral, pero administrados en días alternos (con esteroides de acción corta y/o mediana), tanto para el asma bronquial como para otras patologías con substrato inflamatorio - por ejemplo: artritis reumatoidea - surgen de una lógica terapéutica. En días alternos, los complejos sistemas de retroalimentación de la hormona de crecimiento (HGH) o aquellos involucrados en la secreción del cortisol, dejan de ser sometidos en forma constante y diaria al influjo externo de los esteroides. Es conocido que los efectos antiinflamatorios buscados se mantienen durante unas 48 horas, mientras los correspondientes al equilibrio metabólico solo permanecen durante las primeras 24 horas de uso del fármaco. Con el tratamiento a días alternos se minimizan los efectos deletéreos y se conserva la esperada efectividad terapéutica antiinflamatoria. Ya los pioneros trabajos de Harter y col. en 1963 daban cuenta de esto (6). El rechazo por parte de los pediatras al uso de preparaciones de depósito proviene de lo antes mencionado; es decir, evitar una exposición constante y prolongada al esteroide.
El desarrollo de moléculas administradas por vía oral y poseedoras de un mejor índice terapéutico, esto es, de máximo efecto beneficioso y/o ausencia o mínima presencia de efectos deletéreos, nos conduce al concepto de los llamados esteroides blandos o soft steroids. Se busca con artificios químicos y/o moleculares privilegiar los efectos antiinflamatorios sobre aquellos que afectan las estructuras óseas y/u oculares, así como aspectos muy importantes del metabolismo. No contamos todavía, lamentablemente, con moléculas poseedoras de estas características descritas para ser utilizadas en la práctica clínica diaria.
Resulta ahora fácil entender que, si los EI actuasen aisladamente sobre el órgano de choque involucrado (sea el pulmón o la nariz), se podrían obviar los efectos no deseables a todo el organismo (toda vez que las dosis se reducen unas 10 veces: de unos cuantos miligramos a unos cuantos microgramos). Esta premisa fue la guía en el desarrollo de los EI durante los últimos años. El objetivo de esta revisión es la de poner a disposición del clínico elementos que le permitan analizar la validez actual de esta premisa, valorando aspectos generales y particulares de farmacología así como elementos clínicos relacionados con la adherencia, para cada uno de los esteroides inhalados existentes en el país.
Aspectos farmacológicos de las distintas moléculas de esteroides inhalados disponibles Los EI son moléculas sintéticas de una disímil estructura química fraguada alrededor de un núcleo pentano-perhidrofenantreno; a pesar de poseer individualmente una farmacocinética (FC) y una farmacodinamia (FD) muy específicas, tienen como denominador común un impacto similar y favorable sobre el asma bronquial y la rinitis alérgica (7,8), algo que desde un comienzo deseamos dejar muy en claro. La farmacocinética (FC) implica movimientos o cambios, un metabolismo o una descomposición sufrida por la droga en el organismo, como la maneja, como la elimina, etc.: en esencia, los efectos biológicos sobre la droga. Por otro lado, la farmacodinamia (FD) se refiere básicamente a los efectos o acciones que la droga ejerce sobre el paciente (9).
Las distintas moléculas existentes de EI en nuestro país (10) son las siguientes:
a) Beclometasona
b) Budesonida
c) Fluticasona
d) Mometasona
e) Ciclesonida
De estas, la más antigua es la beclometasona. Las formulaciones iniciales de muchos de estos EI para uso bronquial, Inhaladores de Dosis Medidas (IDM), aparecieron en forma de suspensiones con propelentes gaseosos tipo Clorofluorocarbonados (CFC), evolucionando en el tiempo hacia el polvo seco (dry powder) y posteriormente a soluciones con propelentes tipo Hidrofluroalcanos (HFA). Estos últimos resultan más amigables con la capa de ozono y poseen algunas otras características tales como un menor tamaño de la molécula y, por ende, una mejor deposición en la vía aérea pequeña (menor de 2 micras), lo cual los hace muy atractivos en la clínica diaria (1,7,8).
El siguiente diagrama (figura 1) ilustra los pasos que sufre el EI en humanos, al ser administrado en la vía área, tanto superior como inferior. Esto depende tanto de la FC como de la FD de estas drogas (7). En dicha figura se puede apreciar que una porción significativa de lo que se inhala, sea por vía nasal o bronquial, termina en el tracto digestivo y es absorbida al sistema porta con la consiguiente inactivación hepática. La budesonida, la triamcinolona y la flunisolida (estos dos últimos no se encuentran en el país para uso en asma), sufren un primer paso hepático de inactivación incompleto, es decir en proporción menor al 100%. Los de aparición más reciente (1,7,8) como la fluticasona, la mometasona y la ciclesonida poseen un metabolismo de primer paso hepático completo (100%). Este es un primer aspecto que se debe destacar.
Los receptores de glucocorticoides a nivel de todo el organismo, son idénticos a los que se encuentran en las vías aéreas; por tanto, aquellas cantidades absorbidas y que acceden a la circulación sistémica por escapar a la inactivación en el hígado (primer paso hepático), pueden ocasionar efectos sistémicos. Además de las características de una FC y FD propias, las dosis empleadas y la duración de su administración (1,7,8) son elementos a considerar en este sentido. Debemos hacer hincapié que existe en el ser humano una susceptibilidad muy particular (quizás determinada genéticamente) a los efectos sistémicos de todos los corticoides y por supuesto también a los EI. Algunos pacientes pueden ser más afectados con el uso de la misma molécula, en las mismas dosis y duración de la administración.
La tabla 1 muestra, de acuerdo a GINA ( Global Initiative for Asthma, 2012), las dosis pediátricas recomendadas como bajas, medianas o altas de los EI empleados para el tratamiento del asma bronquial (1). Podemos apreciar una nueva molécula, la ciclesonida, con las dosis en mcg comparativamente más bajas. Hacemos énfasis en el efecto beneficioso similar de todas estas moléculas en el tratamiento de las distintas patologías respiratorias. La beclometasona es el comparador en equipotencia, debido a que es la más antigua. Esta tabla, además, nos abre el camino hacia varios interrogantes.
¿Las diferencias en la estructura química entre estas moléculas, que además generan a su vez diferentes atributos de FC y FD, podrían tener una expresión adicional en la clínica? ¿Existe acaso algún parámetro clínico que permita evidenciar estas diferencias? ¿El crecimiento, siendo el parámetro más sensible a los efectos de los esteroides, podría ser el ejemplo clínico modelo? ¿Existen diferencias entre estas moléculas y su relación respecto al crecimiento en asmáticos?
Al examinar este punto cabe deslindar si el asma, sobre todo si es severa, puede ejercer algún impacto sobre el crecimiento; es decir, si el efecto adverso sobre el crecimiento se debe a la misma enfermedad o a la terapéutica empleada. Es aceptado que los pacientes asmáticos crecen de igual manera a los controles y alcanzan su edad predictiva como adultos con base en las tallas parentales (1,11); la variabilidad clínica en la severidad del asma permite que esto sea así. Algunos estiman, sin embargo, que los asmáticos se comportan como aquellos niños con talla baja constitucional, es decir, con un retardo en el crecimiento que se empareja con su potencial al alcanzar la talla de adulto (11). Por tanto, el efecto intrínseco del asma sobre el crecimiento no será un elemento a considerar en este análisis (1). Se acepta también que aquellas mediciones del crecimiento por periodos de tiempo estimados como cortos, es decir, meses a menos de un año, no constituyen reflejo fidedigno de lo que puede sucederle al crecimiento si estas drogas (EI) se administran durante espacios de tiempo más prolongado (1,7,8). Cualquier análisis debe dirigirse a estudios de un año de duración o más y, en todo caso, realizados con el empleo de técnicas o mediciones estadiométricas (1 8). Recientemente, y buscando soluciones a la necesidad de estudios prolongados y costosos para la obtención de información fidedigna respecto a crecimiento y el uso de EI, ha aparecido la knemometría como una alternativa interesante (12).
Adherencia como aspecto fundamental
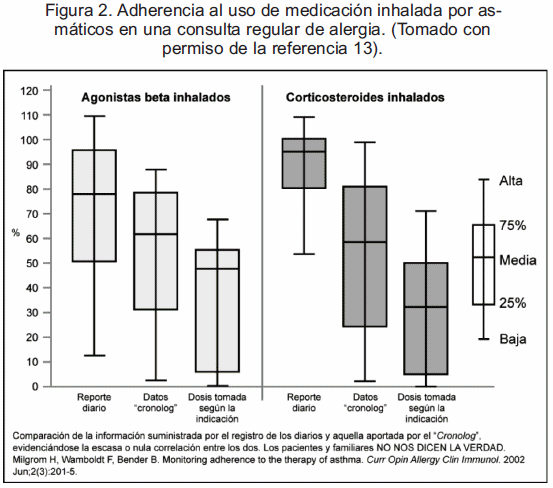
Aparece en este escenario y como de capital importancia un elemento clínico conocido como la adherencia, es decir, si los pacientes cumplen o no (vía oral o inhalada) con el tratamiento que les fue prescrito. La adecuada interpretación del impacto, beneficioso o no, de una terapéutica en una población requiere de esta consideración. El apego o cumplimiento con la medicación prescrita es algo que se debe tener muy presente. Datos como los aportados por el profesor Henry Milgrom (13) en pacientes asmáticos habituales de una consulta de alergia, son muy reveladores. Resultó muy pertinente que a pacientes asmáticos y sus familiares no se les advirtiera de su participación en un estudio clínico, evitando sesgar resultados y permitiendo que estos fueran fiel reflejo de lo que sucede en el día a día de un paciente con asma (13). Se colocó un chip electrónico en los inhaladores para registrar el día y la hora de la administración de las medicaciones y, simultáneamente se llevó a cabo un registro diario de la misma información (por medio de los familiares), el cual se cotejó en las visitas regulares con los datos aportados por el chip electrónico. Se registró la información tanto para el uso de B2 agonistas como el de EI. Los pacientes se sometieron a las visitas rutinarias usuales durante tres meses. La figura 2 nos muestra el bajo cumplimiento en el uso de los esteroides inhalados: sólo un tercio de los pacientes los empleó de la manera indicada. Muchos trabajos corroboran estos hallazgos, siendo uno de los tópicos más actuales en el asma bronquial (13-16).
Sin ningún tipo de ambages afirmamos que, una cosa es lo que los pacientes reportan y otra, la realidad del cumplimiento de los tratamientos. Para el análisis de estudios clínicos en donde se hace uso prolongado de medicación inhalada, el factor adherencia es crucial. Aquellos donde no se controla de manera ciega, pueden inducir fácilmente a una apreciación errónea de los resultados (13-16).
Aspectos particulares a cada esteroide inhalado
Desde mediados de los años 1990 (17) comenzaron a aparecer varios estudios con buena metodología que demostraban un impacto sobre el crecimiento con el uso de la beclometasona en niños asmáticos. La administración de una dosis de 400 mcg/día (dosis media de acuerdo con el GINA 2012) vs. placebo, por un periodo de administración de un año permitió detectar una diferencia promedio en la talla final de 1 a 1,5 centímetros, aproximadamente. Los estudios de mayor significado clínico son aquellos cuya duración mínima es de un año. La beclometasona tiene un incompleto metabolismo de primer paso (figura 1) y por tanto un porcentaje de droga activa puede acceder a la circulación sistémica; no debemos olvidar que un tiempo de administración prolongado( y una dosis dada) es un factor adicional que se debe tener en cuenta.
A igual dosis y tiempo de administración (18), la beclometasona por vía intranasal (figura 3) impacta de igual manera el crecimiento; sin embargo, no ocurre así con la fluticasona y la mometasona (19,20) hasta por un año de administración (200 mcg/día); la budesonida intranasal (21) en dosis de 100 mcg/día/año tampoco posee efecto sobre crecimiento. Es ampliamente conocida la comorbilidad existente entre rinitis alérgica y asma (1,4). Resulta frecuente el uso concomitante de EI para la vía aérea superior en pacientes asmáticos, haciéndose necesario sumar las cantidades administradas tanto por vía nasal como bronquial, para no superar las dosis recomendadas por GINA. Preferimos enfrentar posibles efectos adversos como es el del crecimiento, a la alternativa de un paciente asmático pobremente controlado y con necesidad de asistir recurrentemente a salas de emergencia por repetidas exacerbaciones. Además, es de esperar que en estos casos, les sean administrados esteroides por otras vías (oral, IV, IM) no solo durante las visitas de urgencia sino también al alta, ignorándose por cuánto tiempo. Este es un segundo aspecto que se debe destacar.
Para el caso de la beclometasona nos hacemos las siguiente preguntas:
1. ¿Qué significado clínico podría tener el impacto demostrado sobre el crecimiento a lo largo de un año? La literatura médica al respecto es muy ambigua, notándose en todo caso el deseo de no alarmar a la comunidad médica (1) y al público en general. Desprestigiar la mejor arma actualmente a nuestra disposición (EI) para el control del asma, no pareciera ser una estrategia deseable. No obstante, estos datos sobre beclometasona nos informan de su absorción, pudiendo tener efecto sistémico e impacto sobre el crecimiento. Cada quien podrá llegar a su propia interpretación o derivar alguna o ninguna importancia clínica de este hecho. En todo caso, nos habla de la necesidad de un control clínico más estricto por parte del médico, empleando mediciones estadiométricas regulares (cada tres meses) y vigilancia sobre otros importantes aspectos clínicos que permitan, en última instancia, disminuir la beclometasona a la menor y más efectiva dosis posible; esto debe ser un desiderátum clínico. Hábitos de tabaquismo en el entorno, control alérgico del medio ambiente, sinusitis o reflujo gastroesofágico, son algunos de estos aspectos clínicos de importancia. Esta molécula es la más económica, y pilar fundamental de muchos programas públicos exitosos para el control del asma en Latinoamérica y en nuestro país (22,23). El estudio TREXA (24) corrobora estos aspectos sobre la beclometasona y crecimiento.
2. ¿Los EI más recientes están exentos de este efecto sobre el crecimiento? En relación a los nuevos EI, nos detendremos a mencionar seis estudios publicados que merecen nuestra atención, por ser prolongados (de un año o más de duración), aleatorios, controlados con placebo y basados en mediciones estadiométricas: dos respecto al uso de budesonida, dos acerca de fluticasona, uno que hace referencia a mometasona y otro sobre ciclesonida.
Respecto a la budesonida citaremos el prestigioso estudio CAMP (2) y el excelente trabajo de Jónasson y cols (25, 26), y acoplaremos sus resultados. La adherencia al tratamiento en ambos estudios fue controlada de una manera clínica (empleo de diarios para el registro de síntomas, interrogatorio al paciente y/o familiares, verificación de las dosis inhaladas en el dispositivo, etc.). No se hizo monitoreo con el Cronolog o chip electrónico u otras técnicas ciegas al paciente. El estudio CAMP, entre otros, dejó entrever que la budesonida (polvo seco) en dosis de 200 mcg/BID, durante 4 a 6 años produce una disminución significativa promedio de 1 a 1,5 cm al cabo de un año en comparación al placebo. Se ha especulado que es un efecto clínico transitorio que no tiene mayor relevancia clínica (2).
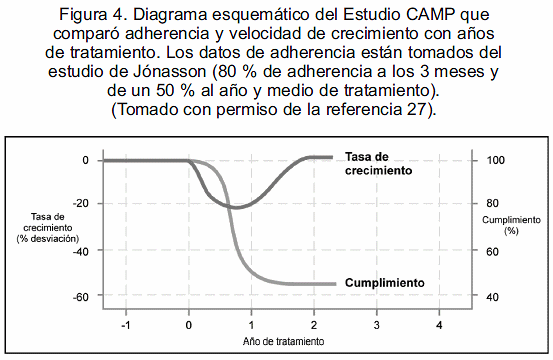
Al comparar el estudio CAMP (2) con los estudios de Jónasson (25, 26), los cuales utilizan similar esquema terapéutico (200 mcg budesonida en polvo seco, BID) y un control clínico de la adherencia por espacio de un año y medio (80% de adherencia a los tres meses y de un 50% al año y medio), se puede concluir que la disminución en la velocidad de crecimiento está directamente relacionada a una alta adherencia y su normalización posterior a la falta de apego a la medicación (25,26) (figura 4).
Es decir, si una droga no se usa, o se utiliza de una manera intermitente, o si su empleo disminuye con el paso del tiempo, no estaremos en capacidad de apreciar su verdadero impacto sobre el crecimiento (27). En la práctica clínica diaria y apoyados en el sentido común, la mayoría de los pacientes que dicen usar los EI de manera crónica, están mintiendo (figura 2). Sin embargo, el estudio de Agertoft y Pedersen (28) en pacientes asmáticos pediátricos, en el cual se utilizaron dosis de budesonida de 200 mcg BID por un promedio de nueve años y con adherencia reportada entre el 50 y 90%, no evidenció impacto sobre talla final predictiva parental vs los controles. Esta adherencia no fue controlada por métodos ciegos y el mínimo sentido común nos revela que tomar consistentemente una medicación BID durante nueve años, no es algo que hace todo el mundo, o quizás únicamente los escandinavos. Aun más interesante y, a nuestro entender, de un mayor peso clínico, es el reporte reciente del seguimiento del mismo estudio CAMP (29). Los pacientes al ser reevaluados en la edad adulta mostraron que esa diferencia de 1 a 1,5 cm detectada en el primer año, se mantenía en la talla final en la edad adulta vs los controles. Algo pareciera suceder en edades tempranas de la vida con este esteroide, a las dosis mencionadas y por este tiempo de administración. La recuperación esperada del crecimiento no ocurre. No existen estudios con seguimientos tan estrictos y tan largos para los otros esteroides.
Lo anterior nos permite puntualizar que no existe evidencia sobre el uso de este EI (y los otros mencionados), que haya demostrado impacto sobre el crecimiento al ser administrado durante espacios más cortos de tiempo (menos de un año). Deseamos evitar la aversión entre la comunidad médica y el público en general al uso de estas medicaciones (EI). Consideramos, no obstante el conocimiento de estos aspectos, que los EI deben ser utilizados cuando lo amerite. Su objetivo es el control del asma y tratar que esto ocurra con la menor dosis posible y en el menor tiempo de administración (1). Quizás este sería un tercer aspecto para destacar en niños, que no ignoramos es controversial.
Con relación a fluticasona, existen también evidencias contradictorias. En dosis de 100 mcg BID, dosis baja de acuerdo con el GINA (tabla 1), el estudio inicial de Bisgaard (30) en lactantes (figura 5) revela que con estas dosis empleadas vs una cromona y por un año de tratamiento, no hubo efecto alguno sobre el crecimiento. Se utilizó un Babyhaler®, espaciador de alto volumen para la administración del esteroide.
Sin embargo, el estudio PEAK en asmáticos preescolares con API+ (asthma predictive index) en las mismas dosis vs placebo (31) y durante dos años consecutivos, con empleo de Aerochamber ® Pediátrico (Trudeau Medical) y con un 75% de adherencia controlada con chip electrónico, sí demostró una diferencia de crecimiento de 1 cm frente a los controles (figura 6). No podemos especular sobre el significado clínico de estos hallazgos, pero sí al menos decir que la medicación es absorbida posiblemente por vía pulmonar, toda vez que las mismas dosis de fluticasona por vía intranasal, no impactan el crecimiento (se hace un bypass inicial de la vía metabólica hepática) (figura 6).
A estos pacientes se les hizo, además, un seguimiento más prolongado de hasta dos años después de haber terminado la fase activa (32). Aquellos pacientes menores de 15 kg y de 2 años de edad, no mostraron una recuperación del crecimiento, a diferencia de aquellos con mayor peso y edad. Los autores sugieren no sobrepasar la dosis de 10 mcg/kg/día de fluticasona con el fin de evitar aspectos relacionados con el crecimiento, aunque hacen esta recomendación de manera empírica. Se especula también que el dispositivo espaciador comercial empleado, Aerochamber ® (Trudeau Medical), pudiera dar lugar a una mayor deposición pulmonar y a una mayor absorción.
En relación a Mometasona, un estudio de reciente publicación (Tabla 2) nos informa que una dosis de 200 mcg/día (polvo seco) administrado en la mañana vs placebo en pacientes asmáticos prepúberes y por espacio de un año, tuvo un impacto sobre el crecimiento que alcanzó un nivel de significancia de p < 0,02 en comparación con los controles (33). De aquí que la dosis aprobada por la FDA para el uso de mometasona en niños sea de un máximo de 100 mcg / día (34).
Así, podemos ver que todos los EI mencionados hasta con otros corticoides inhalados ahora y disponibles en el mercado venezolano pueden absorberse y causar impacto sobre la velocidad de crecimiento y la talla final (durante un año de tratamiento) vs placebo. Para esto se necesita de una cierta magnitud de adherencia, de una dosis particular y de un tiempo de administración de un año.
Mencionaremos para finalizar, y con relación a ciclesonida, un estudio de reciente publicación, el cual aporta datos muy interesantes (35). Pacientes asmáticos leves a moderados (n = 661), de ambos sexos, prepúberes y en edades comprendidas entre los 5 y los 9 años de edad, divididos en 3 grupos, fueron aleatoriamente asignados a recibir durante un año ciclesonida (HFA) 40 mcg, ciclesonida 160 mcg y placebo una vez al día. Se realizaron mediciones estadiométricas (Harpenden ®) regulares y frecuentes, controlándose en cada visita la adherencia (por medio de registro en diarios) y de manera inadvertida y ciega a los pacientes, a través de una balanza ultrasensible (peso del canister), lo cual verificó un 80% de apego o cumplimiento a la medicación. Al cabo de un año no hubo diferencia entre las dos dosis prescritas y el placebo, desde el punto de vista de la talla final o de la velocidad de crecimiento (figura 7).
La explicación a estas diferencias entre ciclesonida y los otros EI se encuentra en sus características FD y FC (7,8) (Tabla 3). Si tenemos una pro droga que se activa en el pulmón, los efectos tópicos bucales serán mínimos o inexistentes; si la cantidad de droga que se absorbe tiene altísima adherencia a las proteínas plasmáticas (albúmina), no habrá droga libre capaz de unirse a receptores periféricos y si la vida media es muy corta se refuerza lo anterior. Además, la alta penetración y su elevado tiempo de residencia pulmonar le permite ser muy efectiva en su impacto a la pequeña vía aérea (por su masa aspirable promedio) y su posibilidad de administración una sola vez al día facilitaría el citado factor de adherencia (35,36). Luce como un esteroide tan efectivo como los existentes en el control del asma (37-42) con unos perfiles de seguridad muy significativos. Información obtenida por knemometría (43) permite saber que aún a dosis de 320 mcg/día (160 mcg/BID) no impacta el crecimiento en los niños.
En conclusión, los esteroides inhalados desempeñan un papel fundamental en el tratamiento del asma bronquial; todos son igualmente efectivos y al considerarlos para tratamientos prolongados deben ser tomados en cuenta algunos aspectos de los mencionados en este artículo. Creemos que esta información puede serle útil a los pediatras que utilizan EI en su práctica clínica diaria.
AGRADECIMIENTOS
Este artículo está dedicado, de forma póstuma y en justo reconocimiento, a quien en vida fuera insigne pediatra y excelente alergóloga. Fue además formadora de generaciones de especialistas en alergia e inmunología en Venezuela merced a su dilatada carrera académica en el Servicio de Alergología del Hospital JM de los Ríos, en Caracas. La Dra. Pimentel de Medina, además, fue Jefe de Servicio durante muchos años y fuente de inspiración para numerosísimos colegas pediatras durante sus pasantías por ese Servicio. Insigne colaboradora de la especialidad, fue Presidente de la Sociedad Venezolana de Alergia, Asma e Inmunología, alcanzando logros muy destacados; su actuación en el plano asistencial en pro del niño afectado con enfermedades inmunológicas, tales como el SIDA entre otras, fue destacadísima y muy valorada por pacientes y colegas. No es sin pesar que sus amigos y colegas han sentido hondamente su desaparición. Deseamos dejar constancia de nuestra admiración y amistad con tan excelente ser humano. A Carolina Medina y Álvaro Medina, cuyo aporte fue fundamental para la publicación de este articulo.
REFERENCIAS
1. Global Strategy for Asthma Management and Prevention,Global Initiative for Asthma (GINA) 2012. Disponible en: http://www.ginasthma.org (fecha de consulta marzo 13,2013). [ Links ]
2. Strunk RC; Childhood Asthma Management Program Research Group. Childhood Asthma Management Program: lessons learned. J Allergy Clin Immunol. 2007;119(1):36-42. [ Links ]
3. Suissa S, Ernst P. Inhaled corticosteroids: impact on asthma morbidity and mortality. J Allergy Clin Immunol. 2001;107(6):937-944. [ Links ]
4. Bousquet J, Schunemann HJ, Samolinski B, Demoly P, Baena-Cagnani CE, Bachert C, et al. A World Health Organization Collaborating Center for Asthma and Rhinitis. World Health Organization Collaborating Center for Asthma and Rhinitis. Allergic Rhinitis and its Impact on Asthma (ARIA): achievements in 10 years and future needs. J Allergy Clin Immunol. 2012;130(5):1049-1062. [ Links ]
5. Kerrebijn KF, de Kroon JP. Effect on height of corticosteroid therapy in asthmatic children. Arch Dis Child. 1968;43(231):556-561. [ Links ]
6. Harter JG, Reddy WJ, Thorn GW. Studies on an intermittent corticosteroid dosage regimen. N Engl J Med. 1963;269:591- 596. [ Links ]
7. Hübner M, Hochhaus G, Derendorf H. Comparative pharmacology, bioavailability, pharmacokinetics, and pharmacodynamics of inhaled glucocorticosteroids. Immunol Allergy Clin North Am. 2005;25(3):469-488. [ Links ]
8. Allen DB, Bielory L, Derendorf H, Dluhy R, Colice GL, Szefler SJ. Inhaled corticosteroids: past lessons and future issues. J Allergy Clin Immunol. 2003;112(3 Suppl):S1-40. [ Links ]
9. Katzung B, Bourne H, Von Zastrow M, Holford N, Correia MA, Berkowitz B. Basic principles in Pharmacology. En: Katzung B, Masters S, Trevor A (Editores) Basic and Clinical Pharmacology. 11a edición. LANGE Basic Science Mc Graw Hill. USA. 2009. pp: 1-76. [ Links ]
10 . Spilva de Leher A, Muktans Spilva Y, Navarrete Muktans R. Guia Spilva de las Especialidades Farmaceuticas. 52a Edición. Global Ediciones SA,Caracas 2011-2012,1084 p. [ Links ]
11. Doull IJ. The effect of asthma and its treatment on growth. Arch Dis Child. 2004;89(1):60-63. [ Links ]
12. Wolthers OD. Methodology and implications of knemometry in growth assessment of inhaled glucocorticoids. Pediatr Allergy Immunol. 2010;21(1 Pt 2):e190-198. [ Links ]
13. Milgrom H, Wamboldt F, Bender B. Monitoring adherence to the therapy of asthma. Curr Opin Allergy Clin Immunol. 2002;2(3):201-205. [ Links ]
14. Van Gent R, de Meer G, Rovers MM, Kimpen JL, van der Ent CK, van Essen LE. Adherence to follow-up recommendations in asthma. Arch Dis Child. 2008;93(3):236-238. [ Links ]
15. Apter A, Bender B, Rand C. Adherence. En: Middleton's Allergy, Principles and Practice, Adkinson NF,Busse W,Boehner R,Lemanske R,Holgate S,Simons F (editores). 7a edición, Mosby-Elsiever,China 2009. pp 1473-1483. [ Links ]
16. Krishnan JA, Bender BG, Wamboldt FS, Szefler SJ, Adkinsone NF Jr, Zeiger RS, et al. Adherence Ancillary Study Group. Adherence to inhaled corticosteroids: an ancillary study of the Childhood Asthma Management Program clinical trial. J Allergy Clin Immunol. 2012;129(1):112-118. [ Links ]
17. Sharek PJ, Bergman DA. The effect of inhaled steroids on the linear growth of children with asthma: a meta-analysis. Pediatrics. 2000;106(1):E8. [ Links ]
18. Skoner DP, Rachelefsky GS, Meltzer EO, Chervinsky P, Morris RM, Seltzer JM, et al. Detection of growth suppression in children during treatment with intranasal beclomethasone dipropionate. Pediatrics. 2000;105(2):E23. [ Links ]
19. Allen DB, Meltzer EO, Lemanske RF Jr, Philpot EE, Faris MA, Kral KM, et al. No growth suppression in children treated with the maximum recommended dose of fluticasone propionate aqueous nasal spray for one year. Allergy Asthma Proc. 2002;23(6):407-413. [ Links ]
20. Schenkel EJ, Skoner DP, Bronsky EA, Miller SD, Pearlman DS, Rooklin A, et al. Absence of growth retardation in children with perennial allergic rhinitis after one year of treatment with mometasone furoate aqueous nasal spray. Pediatrics. 2000;105(2):E22. [ Links ]
21. Murphy K, Uryniak T, Simpson B, O'Dowd L. Growth velocity in children with perennial allergic rhinitis treated with budesonide aqueous nasal spray. Ann Allergy Asthma Immunol. 2006;96(5):723-730. [ Links ]
22. Lasmar L, Fontes MJ, Mohallen MT, Fonseca AC, Camargos P. Wheezy child program: the experience of the Bello Horizonte pediatric asthma management program. World Allergy Organ J. 2009;2(12):289-295. [ Links ]
23. Isturiz G, Guilarte A, Méndez R, España M. Norma Oficial Venezolana del Programa Nacional Integrado de Control del Asma, Revisión 1998. Publicación del MSAS, División de Tuberculosis y Enfermedades Pulmonares, patrocinado por el Programa de las Naciones Unidas para el Desarrollo. [ Links ]
24. Martinez FD, Chinchilli VM, Morgan WJ, Boehmer SJ, Lemanske RF Jr, Mauger DT, et al. Use of Beclomethasone dipropionate as rescue treatment for children with mild persistent asthma (TREXA): a randomised, double-blind, placebocontrolled trial. Lancet. 2011;377(9766):650-657. [ Links ]
25. Jónasson G, Carlsen KH, Mowinckel P. Asthma drug adherence in a long term clinical trial. Arch Dis Child. 2000;83(4):330-333. [ Links ]
26. Jónasson G, Carlsen KH, Sødal A, Jonasson C, Mowinckel P. Patient compliance in a clinical trial with inhaled budesonide in children with mild asthma. Eur Respir J. 1999;14(1):150- 154. [ Links ]
27. Wolthers OD, Allen DB. Inhaled corticosteroids, growth, and compliance. N Engl J Med. 2002;347(15):1210-1211. [ Links ]
28. Agertoft L, Pedersen S. Effect of long-term treatment with inhaled budesonide on adult height in children with asthma. N Engl J Med. 2000;343(15):1064-1069. [ Links ]
29. Kelly HW, Sternberg AL, Lescher R, Fuhlbrigge AL, Williams P, Zeiger RS, et al. CAMP Research Group. Effect of inhaled glucocorticoids in childhood on adult height. N Engl J Med. 2012;367(10):904-912. [ Links ]
30. Bisgaard H, Allen D, Milanowski J, Kalev I, Willits L, Davies P. Twelve-month safety and efficacy of inhaled fluticasone propionate in children aged 1 to 3 years with recurrent wheezing. Pediatrics. 2004;113(2):e87-94. [ Links ]
31. Guilbert TW, Morgan WJ, Zeiger RS, Mauger DT, Boehmer SJ, Szefler SJ, et al. Long-term inhaled corticosteroids in preschool children at high risk for asthma. N Engl J Med. 2006;354(19):1985-1997. [ Links ]
32. Guilbert TW, Mauger DT, Allen DB, Zeiger RS, Lemanske RF, Szefler SJ,et al. Childhood Asthma Research and Education Network of the National Heart, Lung, and Blood Institute. Growth of preschool children at high risk for asthma 2 years after discontinuation of fluticasone. J Allergy Clin Immunol. 2011;128(5):956-963.e1-7. [ Links ]
33. Skoner DP, Meltzer EO, Milgrom H, Stryszak P, Teper A, Staudinger H. Effects of inhaled mometasone furoate on growth velocity and adrenal function: a placebo-controlled trial in children 4-9 years old with mild persistent asthma. J Asthma. 2011;48(8):848-859. [ Links ]
34. Skoner DP, Murphy K,Lemanske R . Once daily dosing of 100 mcg of mometasone furoate has no effect on growth velocity in chidren with asthma. Ann Allergy Asthma Immunol 2009;102: pA 53. [ Links ]
35. Skoner DP,Maspero J,Banerji D; Ciclesonide Pediatric Growth Study Group. Assesment of the long -term safety of inhaled ciclesonide on growth in children with asthma. Pediatrics.2008; 12(1) e 1-14. [ Links ]
36. Abdullah AK, Khan S. Evidence-based selection of inhaled corticosteroid for treatment of chronic asthma. J Asthma. 2007;44(1):1-12. [ Links ]
37. Von Berg A, Engelstätter R, Minic P, Sréckovic M, Garcia MLG, Latoś T, et al. Comparison of the efficacy and safety of ciclesonide 160 mcg once daily vs Budesonide 400 mcg once daily in children with asthma .Pediatrics Allergy Immunol. 2007;18:391–400. [ Links ]
38. Pedersen S, Engelstätter R, Weber H-J, Hirsch S, Barkai L, Emeryk A, et al. Efficacy and safety of ciclesonide once daily and fluticasone propionate twice daily in children with asthma .Pulm Pharmacol Ther 2009;22:214–220. [ Links ]
39. Pedersen S, Garcia ML, Manjra AI, Theron I, Engelstätter R. A comparative study of inhaled Ciclesonide 160 mcg / day and fluticasone propionate 176 mcg/day in children with asthma. Pediatrics Pulmonol. 2006;41:954–961. [ Links ]
40. Pedersen S, Potter P, Dachev S, Bosheva M, Kaczmarek J, Springer E, et al . Efficacy and safety of three ciclesonide doses vs placebo in children with asthma : the RAINBOW study.Respir Med 2010;104:1618–1628. [ Links ]
41. Gelfand EW, Georgitis JW, Noonan M, Ruff ME. Once daily ciclesonide in children: efficacy and safety in asthma. J Pediatr 2006;148(3):377–383. [ Links ]
42. Rohatagi S,Derendorf H,Zech K,Nave R,Banerji D. PK/PD of inhaled corticosteroids: the risk / benefit of inhaled ciclesonide (abstract 598). J Allergy Clin Immunol. 2003;11: S 380. [ Links ]
43. Agertoft L, Pedersen S. Lower-leg growth rates in children with asthma during treatment with ciclesonide and fluticasone propionate. Pediatr Allergy Immunol. 2010;21:e199-205. [ Links ]