Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Puericultura y Pediatría
versión impresa ISSN 0004-0649
Arch Venez Puer Ped vol.76 no.3 Caracas set. 2013
Manejo nutricional del prematuro
María J. Castro (1), Gina Totta (2), Florangel García (3), Juan Marcano (4), José Luis Ferrero (5)
(1) Pediatra Neonatóloga. Adjunto y Profesora Postgrado de Neonatología Hospital Miguel Pérez Carreño. Profesora del Postgrado de Pediatría Hospital Miguel Pérez Carreño. Caracas, Venezuela.
(2) Pediatra Neonatóloga Adjunto de Neonatología del Hospital Manuel Noriega Trigo IVSS Zulia. Coordinadora de Postgrado de Neonatología del HMNT-IVSS Maracaibo-Venezuela
(3) Pediatra Neonatóloga. Adjunto Servicio de Neonatología Hospital Central Universitario Antonio María Pineda. Profesora Asistente Pregrado y Postgrado de Pediatría Universidad Centroccidental Lisandro Alvarado. Coordinadora Residencia Asistencial Programada en Neonatología HCUAMP. Barquisimeto, Venezuela
(4) Pediatra. Ex Director del Curso de Postgrado de Pediatría y Puericultura y del Postgrado de Neonatologia. Hospital Miguel Pérez Carreño. Vicepresidente de la SVPP. Caracas, Venezuela.
(5) Pediatra Intensivista. Hospital Clinico de Maracaibo. Clinica y Hospitalizacion Falcón, Venezuela.
Autor corresponsal: Dra. María José Castro Teléfonos: (0412) 214-62-56 Correo electrónico: chefacastro@gmail.com
RESUMEN:
La nutrición del recién nacido prematuro o de bajo peso constituye un desafío para el pediatra y el neonatólogo desde el nacimiento y hasta bien avanzada la infancia. Uno de los mayores retos es mantener una ganancia de peso similar al crecimiento fetal hasta que el neonato alcance las 40 semanas de edad postconcepcional, y luego lograr un crecimiento que garantice eventualmente, una talla acorde a la edad cronológica, adecuada mineralización ósea y un óptimo neurodesarrollo. Todas estas metas se pueden alcanzar con el inicio precoz de la alimentación enteral, incluso nutrición trófica, en aquellos neonatos difíciles de alimentar y sin contraindicación de la vía oral; así como con el empleo de leche humana, la suplementación y/o fortificación cuando los requerimientos sean mayores y/o la ganancia de peso sea insuficiente, y el adecuado seguimiento de las variables antropométricas y bioquímicas que evidencian un crecimiento saludable.
Palabras clave: Recién Nacido. Recién Nacido Prematuro. Recién Nacido de Bajo Peso, Alimentación, Nutrición.
Nutritional manaement of preterm newborn
SUMMARY
The nutrition of the premature or low birth weight newborn is a challenge for the pediatrician and neonatologist from birth and up to advanced childhood. One of the biggest challenges is to keep a weight gain similar to fetal growth until the neonate achieves 40 weeks of postconcepcional age, and subsequently achieve a growth rate that guarantees, eventually, the goal of a length according to chronological age, proper bone mineralization and an optimal neurodevelopment. All these goals can be reached with the early commencement of enteral feeding, even with trophic nutrition in those hard-to-feed infants without contraindication to eat; the use of human milk, supplementation or fortification when the requirements are higher, and/or weight gain is too low and with the appropriate follow-up of the anthropometric and biochemical measurements that evidence a healthy growth.
Key words: Newborn. Premature newborn, Low birth weight newborn, Feeding, Nutrition.
INTRODUCCIÓN
Definición de Términos
La Organización Mundial de la Salud (OMS) clasifica a los prematuros de la siguiente forma (1):
Recién Nacido Prematuro: nacido antes de completar las 37 semanas de edad gestacional o antes de los 259 días desde el primer día de la última menstruación de la madre.
Recién Nacido Prematuro Moderado: nacido entre las 32 semanas y antes de las 37 semanas de gestación. En este grupo se distingue como Recién Nacido Prematuro Tardío al nacido desde las 34 semanas y antes de las 37 semanas de gestación.
Recién Nacido Muy Prematuro: nacido entre las 28 semanas y antes de las 32 semanas de gestación.
Recién Nacido Prematuro Extremo: nacido antes de las 28 semanas de gestación.
Igualmente, la OMS clasifica a los recién nacidos de acuerdo a su peso de la siguiente forma (2):
Recién Nacido de Bajo Peso: nacido con un peso menor a 2.500 g
Recién Nacido de Muy Bajo Peso: nacido con peso menor a 1.500 g
Recién Nacido de Extremo Bajo Peso: Nnacido con peso menor a 1000 g
Recién Nacido Pequeño para Edad Gestational: peso al nacer menor al percentil 10
Por otra, parte durante la evaluación de un recién nacido prematuro se utilizan diferentes definiciones de edad (3):
Edad Gestacional: tiempo transcurrido entre el nacimiento y el primer día de la última menstruación de la madre. Se define en semanas.
Edad Cronológica: tiempo transcurrido desde el nacimiento. Se define en días, meses o años.
Edad Corregida: Edad cronológica reducida por el número de semanas en que nació el niño antes de las 40 semanas de gestación. Se calcula de la siguiente manera: Edad cronológica - (40 semanas - Edad gestacional)
Prevalencia e incidencia de niños prematuros en Venezuela Según cifras de la Organización Mundial de la Salud (OMS), en Venezuela la tasa de nacimientos prematuros para el año 2010 fue de 8,1 por cada 1.000 nacidos vivos (1).
En el más reciente anuario de natalidad publicado por el Ministerio del Poder Popular para la Salud, correspondiente al año 2005, se reportan 45.647 nacimientos con peso menor a 2.500 g, lo cual representa 9,53% de los nacimientos de ese año y una tasa de 95,31 neonatos con menos de 2.500 g por 1.000 nacidos vivos (4).
Requerimientos nutricionales del recién nacido prematuro Los requerimientos hídricos del recién nacido prematuro son (5):
Peso < 750 g:
Día 1-2: 100-200 mL/kg/d
Después del día 3: 150-200 mL/kg/d
Peso entre 750 y 1.000 g:
Día 1-2: 80-150 mL/kg/d
Después del día 3: 100-150 mL/kg/d
Peso mayor de 1.000 g:
Día 1-2: 60-100 mL/kg/d
Después del día 3: 100-150 mL/kg/d
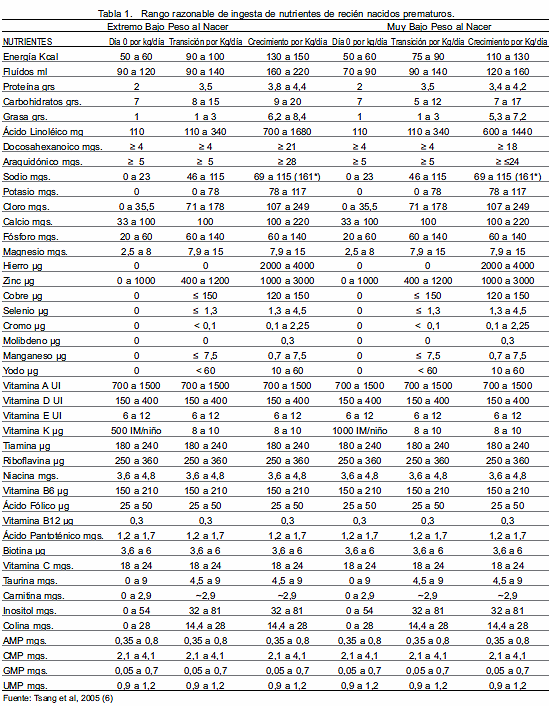
El rango razonable de ingesta de nutrientes de recién nacidos prematuros de muy bajo peso y extremo bajo peso se describen en la Tabla 1(6).
Alimentación intrahospitalaria enteral
La vida intrauterina es una etapa crítica del desarrollo donde el déficit nutricional lleva a una adaptación fetal en la que ocurrren cambios metabólicos, endocrinos y genéticos programados, que repercuten en edades avanzadas de la vida del individuo. Se ha vinculado el bajo peso al nacer con mayor frecuencia de hipertensión arterial en la adolescencia y la adultez, enfermedad coronaria, resistencia a la insulina, diabetes, hiperlipidemia y obesidad (7).
En los recién nacidos prematuros se recomienda iniciar la nutrición parenteral y enteral en los primeros 5 días de vida para evitar complicaciones futuras, así como la nutrición intraluminal para la integridad funcional y estructural del tracto gastrointestinal, la estimulación de lactasa y la mejor absorción de nutrientes. El aporte enteral mantiene la masa del intestino delgado y promueve la actividad de disacaridasas. La alimentación en los primeros 5 días de vida condiciona la adaptación endocrina y los patrones de motilidad, proporciona nutrientes luminales y beneficia la función inmune (8). La motilidad intestinal es el factor determinante de la posibilidad de alimentar a un recién nacido de muy bajo peso. En estos pacientes una opción es la estimulación enteral trófica (9). Las evidencias reportan que una alimentación enteral temprana, junto con la administración de esteroides antenatales y la leche humana, favorecen la disminución en la permeabilidad intestinal o capacidad de moléculas pequeñas de penetrar la mucosa gastrointestinal e inducir sensibilización en el infante (10).
La nutrición enteral favorece la integridad funcional y estructural del aparato gastrointestinal, mejora la actividad hormonal, el desarrollo de la mucosa intestinal, la actividad de la lactasa, la absorción de alimentos, la maduración motora y la mineralización ósea (11,12).
En recién nacidos de bajo peso sin contraindicación de la vía oral, pero que no pueden recibir alimentos en forma regular, las evidencias indican el beneficio de la estimulación enteral mínima o trófica, preferiblemente con leche humana o, en su defecto, fórmula para prematuros. El inicio debe ser lo antes posible luego del nacimiento, si las condiciones clínicas del recién nacido lo permiten (11-14).
Las contraindicaciones para la alimentación por vía enteral son: enterocolitis necrotizante, falta de indemnidad del tracto gastrointestinal y situaciones de hipoxia e inestabilidad hemodinámica. No hay contraindicaciones para la estimulación enteral trófica en presencia de soporte ventilatorio y/o cardiovascular, persistencia de conducto arterioso y catéteres umbilicales, siempre y cuando el niño se encuentre libre de shock o cualquier otra condición que comprometa la perfusión gastrointestinal (2, 13,14).
Se recomienda comenzar con estimulación enteral trófica (10-20 mL/kg/d) entre las primeras horas de vida o a más tardar, en los primeros 3 días con leche humana siempre que sea posible. Mantener este aporte enteral mínimo por 4 a 7 días antes de comenzar el incremento progresivo de los volúmenes de aporte enteral (2, 14,15).
Se recomiendan los incrementos de la estimulación enteral trófica de la siguiente forma (2, 14, 15):
Neonatos más enfermos y/o peso menor de 1.000 g: 10 a 15 mL/kg/d
Neonatos más estables y/o mayores de 1.000 g y más estables 15 a 30 mL/kg/d
Si bien se sugiere precaución, es importante el aumento consistente del alimento siempre que sea tolerado, incrementando el volumen deseado una vez por día para alcanzar más eficientemente el volumen de alimentación enteral completa. (2, 14, 15)
Se considera que el niño alcanza la nutrición enteral completa cuando tolera 120 mL/kg/d y/o cuando el niño recibe todo el aporte calórico que requiere por vía enteral (14).
El objetivo de la nutrición enteral es ofrecer los nutrientes y calorías necesarias para un óptimo desarrollo y crecimiento del prematuro que asemeje el crecimiento intrauterino. Por lo tanto, es suficiente una nutrición que permita un aumento de peso de al menos 15 g/kg/d, con un aporte de nutrientes que satisfaga las necesidades recomendadas (14).
La alimentación intermitente ofrece más ventajas sobre el desarrollo y la maduración intestinal; sin embargo, cuando se administra por bolo rápido ejerce efectos adversos sobre la respuesta motora duodenal. Se ha evidenciado mejor ganancia de peso en recién nacidos prematuros alimentados en forma continua (14).
La evidencia sugiere que es más beneficiosa la alimentación enteral en forma intermitente lenta (infusión en un periodo de 1 a 2 horas cada tres horas), sobre todo en recién nacidos muy inmaduros y/o con dificultad para progresar en la alimentación. Debe suministrarse a través de un sonda orogástrica. Se recomienda evitar la vía transpilórica para los recién nacidos prematuros y/o enfermos que requieren alimentación enteral por sonda; solo está indicada en reflujo gastroesofágico severo (2, 14,15).
Se recomienda utilizar sondas de silicona o poliuretano, que son de larga duración, o sondas de polivinilo que son de menor permanencia, según disponibilidad. En relación a su permanencia y mantenimiento se sugiere seguir las indicaciones del fabricante (14,15). Se recomienda iniciar con el fortificador de leche humana sólo cuando el bebe esté tolerando 100 mL/kg/d, para alcanzar 24 kcal/oz (80 kcal/100 ml). En caso de no poder utilizarse leche humana fortificada deben indicarse fórmulas para prematuro y así cubrir sus necesidades nutricionales (14,15).
Alimentación posterior al alta hospitalaria
La mayoría de los prematuros, especialmente los de extremo bajo peso al nacer, están por debajo del percentil 10 para peso, talla y circunferencia cefálica al egreso (16). Los recién nacidos pretérmino, menores de 31 semanas hospitalizados, tienen un déficit acumulativo de energía y proteínas de 406 kcal/kg y 14 g/kg, respectivamente a la semana de vida y de 813 kcal/kg y 23 g/kg a las 6 semanas posnatal (17).
A continuación se presentan los diversos tipos de crecimientos posibles y su pronóstico relativo en el tiempo.
Mientras menor edad gestacional y peso al nacer tenga el niño, menor será la velocidad de crecimiento extrauterino (16-19).
Al momento del egreso el prematuro puede ser clasificado en 4 patrones diferentes (18):
1. Crecimiento apropiado: niño con peso apropiado, tanto al nacer como al egreso, para la edad posconcepcional.
2. Restricción posnatal del crecimiento: niñoss nacidos con peso adecuado a la edad gestacional, pero con peso al egreso por debajo de la tabla de referencia de crecimiento.
3. Retardo de Crecimiento Intra Uterino (RCIU): niños nacidos con bajo peso para la edad gestacional y con un peso al egreso todavía por debajo de la tabla de referencia de crecimiento.
4. Crecimiento compensatorio posnatal temprano: niños nacidos con bajo peso para la edad gestacional, pero con un peso al egreso adecuado a su edad posconcepcional.
Usualmente, los niños con patrón 1 mantienen un crecimiento normal, pero alrededor del 80% de los neonatos con patrones 2, 3 y 4 muestran recuperación del peso para la edad cronológica hacia los 2-3 años (18).
Si no hay crecimiento compensatorio en etapas tempranas de la vida, la posibilidad de que ocurra después es limitada. Este periodo crítico pareciera ser límite al primer año de vida para la circunferencia cefálica y los primeros 3 años para la talla final (18).
Un mejor neurodesarrollo se ha observado en prematuros con peso al nacer adecuado para edad gestacional que mantienen velocidad de crecimiento favorable, y en los prematuros de bajo peso al nacer que presentan crecimiento compensatorio precoz (18)
La mineralización ósea, a diferencia del peso, generalmente mejora en los primeros meses de vida. Entre los 6-12 meses de edad se adquieren valores similares a los bebés a término, cuando reciben alimentación adecuada y suficiente (18). También se ha observado un descenso de zinc plasmático, necesario para crecimiento y desarrollo cerebral, en RNPT alimentados con fórmula de 20 cal/oz, lo cual puede ser prevenido con la administración de fórmulas para prematuros o suplementación de zinc hasta los 2 a 6 meses de edad (16).
La aparición de enfermedades cardiovasculares, hipertensión arterial, resistencia a la insulina y obesidad en adultos con antecedente de peso bajo al nacer es una de las condiciones que preocupan hoy día. Esto se define como Programación Metabólica, según la cual las influencias adversas tempranas en el desarrollo, y particularmente durante la vida intrauterina, pueden resultar en cambios permanentes en la estructura, fisiología y metabolismo, lo que se agrava en condiciones de crecimiento compensatorio acelerado. Se sugiere una monitorización continua del crecimiento para adaptar el plan de nutrición a las necesidades individuales del prematuro sin sub o sobrealimentarlo. La velocidad de ganancia de peso que tenga el niño en esta etapa puede determinar su condición de salud tanto a corto, como a largo plazo (18-21).
Propuesta de alimentación de los niños prematuros al egreso
Las recomendaciones nutricionales se basan en estudios realizados en prematuros estables con pocas complicaciones y tienen como meta proveer la cantidad de nutrientes necesarias para lograr una aproximación al crecimiento intrauterino (18).
Para alcanzar un crecimiento similar al fetal deben recibir un aporte proteico de aproximadamente 2,8 - 4 g/kg/d y un aporte calórico de 110-120 kcal/kg/d (6,22).
Los niños que reciben fórmulas enriquecidas para prematuros post-egreso muestran mayor ganancia en longitud y circunferencia cefálica que aquellos que reciben fórmulas infantiles para niños a término o leche humana exclusiva. Las fórmulas de transición o enriquecidas (post-egreso) tienen mayor contenido de proteína para promover el crecimiento compensatorio y un modesto aumento energético para permitir una mejor utilización de la proteína, con respecto a las fórmulas convencionales o a término; también tienen mayor contenido de calcio y fósforo para obtener una adecuada mineralización ósea, contenido adicional de zinc, elementos traza y vitaminas que favorecen la tasa de crecimiento (17). Esta diferencia se mantiene más allá de los 9 meses, incluso a los 18 meses, y ésta es mayor en hembras que en los varones (18).
La leche humana es el alimento óptimo para el prematuro debido a sus conocidos beneficios, sin embargo, se sabe que el contenido de ciertos nutrientes de la leche humana no suplementada, especialmente los minerales, es insuficiente. Los prematuros que, al egresar reciben lactancia humana no suplementada en forma exclusiva, crecen más lentamente y tienen menor masa ósea que los que reciben fórmula enriquecida o leche humana fortificada (17).
Alimentación al egreso de los prematuros con adecuado peso para la edad posconcepcional
Lactancia humana exclusiva en lo posible y, si hay imposibilidad de hacerlo, deben recibir leche humana de donante o fórmula de inicio para niños a término enriquecida con Ácidos Grasos de Cadena Larga (LCPUFA -siglas en inglés). Estos niños deben recibir adicionalmente hierro y multivitaminas (2, 18).
Alimentación al egreso de los prematuros con peso bajo para la edad posconcepcional y/o con riesgo de falla de crecimiento Leche humana suplementada mediante fortificadores o fórmulas enriquecidas posegreso con LCPUFA que ofrezcan 22 cal/oz (2, 18). La madre debe amamantar al niño a libre demanda y ofrecer 2-3 tomas al día de leche humana fortificada o de fórmula enriquecida. Esta conducta se modificará de acuerdo al patrón de crecimiento del niño (2, 20).
El uso de multivitaminas no está indicado cuando el niño es alimentado exclusivamente con fórmula enriquecida o cuando alcanzan más de 3 kg de peso (23).
La transición alimentaria debe realizarse de la siguiente forma (19,23):
Los prematuros con peso posnatal menor de 1.800 g deben recibir leche humana fortificada o fórmula que aporte 24 kcal/oz.
La transición a leche humana fortificada o fórmulas de 22 kcal/oz se debe realizar cuando alcance 1.800 g, los parámetros de crecimiento estén en el percentil 25 o más y la ganancia de peso sea de 15-40 g/d
La transición a leche humana exclusiva o fórmula de 20 kcal/onza se hará hacia los 4-6 meses de edad corregida si todos los parámetros de crecimiento están en o por encima del percentil 25.
Los niños en riesgo debe recibir alimentación suplementada (leche humana fortificada o fórmula enriquecida) hasta los 6-9 meses de edad corregida, siempre que mantenga patrón de crecimiento por encima del percentil 25 y biomarcadores de laboratorio normales (18,24,25).
Seguimiento nutricional del prematuro al egresar
Antes del egreso del niño, se debe haber establecido un patrón de ganancia de peso con la alternativa de nutrición decidida para el egreso, no debe tener problemas cardio-respiratorios que comprometan su alimentación y, además, sus padres deben demostrar habilidad para alimentarlo (25,26).
El niño debe ser evaluado clínicamente y establecer medidas antropométricas (peso, talla y circunferencia cefálica) antes del egreso, a la semana del mismo y, si no presenta comportamiento adverso, al cumplir el mes. Los niños con patrón de crecimiento inadecuado, alimentación inconsistente o pruebas de laboratorio anormales deben tener un seguimiento más estrecho (25-27).
Lo ideal para el seguimiento de los parámetros de crecimiento es el uso de curvas de crecimiento posnatal. Las curvas de crecimiento posnatal se desarrollaron en base a datos de crecimiento posnatal en prematuros sin complicaciones y reflejan la pérdida de peso que normalmente ocurre en la primera semana de vida. La curva de Fenton es la más usada ya que refleja esta pérdida de peso fisiológica, lo cual no ocurre en las curvas de crecimiento intrauterino que se usaban como referencia en el pasado. Se recomienda utilizar estas curvas hasta las 50 semanas de edad posconcepcional (28,29)
Para fines prácticos, también se puede evaluar el crecimiento esperado para prematuros tal como se señala en la Tabla 2 (30):
Durante el seguimiento deben realizarse pruebas de laboratorio en los períodos de tiempo planteados a continuación:
A la semana de egreso.
Al mes de egreso para los recién nacidos de peso al nacer <1800 g, crecimiento inadecuado o con pruebas de laboratorio anormales.
Al realizar la transición a lactancia humana exclusiva o fórmula de término.
Las pruebas de laboratorio recomendadas para seguimiento nutricional son (14, 31):
Hemoglobina (Valor de Referencia (VR) > 10,5 g/dL)
Hematocrito (VR > 33 %)
Ferritina sérica (VR > 12 microg/L)
Hierro sérico (VR > 50 microg ⁄dL),
Volumen Corpuscular Medio (VR >70 fL)
Fosfatasa alcalina (VR-: 82-500 mg/dL). Es un marcador de síntesis ósea, su valor es elevado en periodos de crecimiento esquelético. Valores mayores de 500 mg/dL en prematuros son indicativos de riesgo de osteopenia.
Calcio sérico (VR: 9,0-11,0 mg/dL) Calcio
Fósforo sérico (VR: 4-8 mg/dL en Edad Gestacional - EG- <40 semanas y 4-6,5 mg/dL en EG >40 semanas). Valor inferior a 4,5 mg/dL sugiere osteopenia.
Proteínas Totales en suero: (VR: 4,2 y 7,6 g/dL)
Albúmina (VR: 3,6 a 5,4 g/dL).
Nitrógeno Ureico Sanguíneo (BUN -siglas en inglés- VR: 6 a 18 mg/dL). Permite la estimación de la utilización de proteínas de la dieta.
Estrategias para la prevención de deficiencia de micronutrientes
Hierro: es un elemento esencial para el crecimiento y desarrollo normal de los órganos, pero es potencialmente tóxico por su efecto oxidante. Los prematuros son muy vulnerables a este efecto, ya que sus defensas antioxidantes son inmaduras. Por lo tanto, hay que estar atentos a cualquier signo de infección, inflamación y/o lesión resultantes de una sobrecarga de hierro. En los prematuros y niños de bajo peso, los efectos del déficit de hierro incluyen: crecimiento inadecuado, trastornos gastrointestinales, disfunción tiroidea, alteración de la inmunidad, afectación del neurodesarrollo e inestabilidad térmica. La anemia es un signo tardío que sugiere depleción del hierro almacenado (33,34). El exceso de hierro está asociado con anemia hemolítica, cuando hay déficit de Vitamina E, así como con displasia broncopulmonar y retinopatía de la prematuridad (32,34,35).
El contenido de hierro de la leche humana es de aproximadamente 0,5 mg/L con una muy buena biodisponibilidad y es suficiente para los requerimientos de los recién nacidos a término durante 4-6 meses de edad, sin embargo no resulta suficiente para la eritropoyesis de los RNPT, por lo que es necesaria su suplementación (33-36).
Desde las dos semanas y hasta los 6 a 12 meses, se recomiendan las siguientes dosis de hierro suplementario (2,14,33):
Niños recibiendo leche humana: 2-4 mg/kg/d
Niños recibiendo fórmula: 1,0 mg/kg/d
Niños que reciben Eritropoyetina Recombinante
Humana: 6,0 mg/kg/d
Zinc: las manifestaciones clínicas de las deficiencias de zinc son: anorexia, detención del crecimiento, dermatitis, glositis, alteraciones de las uñas, diarreas e incremento de la susceptibilidad a infecciones (6).
Los requerimientos fisiológicos de zinc resultan del cálculo necesario para la retención y lo que requiere para reemplazar las pérdidas endógenas y son de 1000 a 3000 μg/kg/día (6).
Sin embargo no se recomienda suplementación con zinc en aquellos neonatos que se alimentan bien y tienen adecuado crecimiento (2).
Yodo: el efecto deletéreo de las deficiencias de yodo materno es especialmente crítico para la maduración tisular fetal y el cerebro es particularmente sensible. Cuando hay baja reserva de yodo materno los recién nacidos pueden tener niveles bajos de T3 y T4 y tienen alta prevalencia de hipotiroidismo, lo cual puede perjudicar su neurodesarrollo. Los niños prematuros necesitarían un mínimo de 30 μg/kg/d, los niños a término 15 μg/kg/d (37,38).
Vitamina A: juega un papel crucial en la fisiología de la visión, la integridad de las mucosas y del sistema inmune y en la morfogénesis durante el desarrollo embrionario. Su deficiencia puede aumentar el riesgo de displasia bronco pulmonar, ya que la vitamina A juega un papel importante en la diferenciación celular y el proceso de maduración (39).
La hipervitamosis A puede tener un efecto tóxico que se puede manifestar por síntomas de aumento de la presión intracraneal, resequedad de las mucosas, dolores osteomusculares, hepatomegalia y se presenta cuando los valores en plasma exceden los 100 μg/kg/cal. No se recomienda la suplementación con vitamina A en neonatos que están creciendo bien (2, 39). Dosis recomendadas: 700-1500 UI/kg/ (39).
Calcio y fósforo: la leche humana es insuficiente en los aportes de calcio y fósforo (38 mg/100 ml de Ca y 22 mg/100 ml de P), por lo que estos minerales debe ser suplementados con fortificadores de leche materna en prematuros extremos. (40-42).
Los RNPT corren un riesgo significativo de desarrollar patología ósea asociada a un bajo contenido mineral óseo, denominada enfermedad metabólica ósea del prematuro, osteopenia de prematuridad o raquitismo neonatal. Esto es particularmente importante en pretérminos con peso menor de 1.500 g, en quienes es imperativo el despistaje (40-42).
Cuando el egreso hospitalario ocurre antes de las 38 semanas de edad posconcepcional, el aporte mineral y proteico puede ser insuficiente para esa etapa, por lo que debe fortificarse la leche o adicionar calcio y fósforo durante un período de 4 a 6 semanas, retirando la fortificación cuando la fosfatasa alcalina comienza a descender y el paciente se amamanta sin dificultad, con buen crecimiento semanal en todos los parámetros (40,43).
En neonatos de muy bajo peso que reciben leche humana, se recomienda suplementar con calcio a una dosis de 120- 140 mg/kg/d y Fósforo a 60-90 mg/kg/d, durante los primeros meses de vida (2).
Vitamina D: su déficit está asociado con raquitismo en niños, por falta de una adecuada absorción del calcio y consecuentemente una mineralización y crecimiento de hueso y cartílago insuficientes (14, 44-47).
La concentración de vitamina D en la leche humana es baja (20 a 60 UI/L), por lo que los recién nacidos amamantados que no reciben adicionalmente vitamina D podrían agotar sus reservas dentro de las 8 semanas después del nacimiento, lo que sugiere la necesidad de suplementarla. La exposición al sol en la gama recomendada para los lactantes sin exponer al niño al riesgo asociado a los rayos ultravioleta, no es suficiente para mantener niveles de vitamina D. Asimismo, todavía no se ha definido con certeza la cantidad de tiempo que el niño debe ser expuesto a la luz solar, ya que una sobreexposición puede causar lesiones e inclusive predisponer a cáncer de la piel (14, 44-48).
Se recomienda una ingesta diaria mínima de 400 UI (10 mg/dL) de vitamina D para todos los niños empezando tan pronto como se haya establecido la vía oral y hasta los 6 meses de edad (2).
Ácidos grasos poliinsaturados de cadena larga (LCPUFA): estos ácidos grasos están relacionados con el crecimiento celular, en especial, del cerebro y la retina. El neonato prematuro no es capaz de sintetizar los LCPUFA con la velocidad suficiente para cubrir sus requerimientos, a partir de ácidos grasos esenciales, por lo que tienen que ser administrados en la dieta (49-51).
Se recomienda la leche humana exclusiva. Es importante mencionar que las madres deben consumir pescado o en su defecto, suplementos de ácidos grasos polinsaturados. En el caso de que el uso de leche humana no sea posible, se utilizarán fórmulas infantiles enriquecidas con estos ácidos grasos (51-54).
REFERENCIAS
1. Organización Mundial de la Salud. Nacido Demasiado Pronto: Informe de Acción Global sobre Nacimientos Prematuros. Ginebra 2010. Disponible en: http://www.who.int/pmnch/media/news/2012/2010_pretermbirthsper100births_es.pdf. Fecha de acceso: 22 de abril de 2013. [ Links ]
2. World Health Organization. Optimal feeding of low birth weight infants in low and middle income countries. WHO Press. Geneva, Switzerland 2011; 51 p. [ Links ]
3. Engle WA. American Academy of Pediatrics Committee on Fetus and Newborn. Age Terminology during the Perinatal Period. Pediatrics 2004;114:1362 [ Links ]
4. Ministerio del Poder Popular para la Salud. Dirección General de Epidemiología. Dirección de Información y Estadística en Salud. Boletín Informativo de Natalidad 2005 Disponible en: http://www.mpps.gob.ve/index.php?option=com_phocadownload & view=category & download=613:anuarioano2005 & id=12:anuarios-de-natalidad & Itemid=915 Fecha de consulta: 22 de abril de 2013. [ Links ]
5. Bhatia J. Fluid and electrolyte management in the very low birth weight neonate. J Perinatol 2006; 26 Suppl 1:S19-S21. [ Links ]
6. Tsang, RC, Uauy R, Koletzko, B, Zlotkin, SH. In: E. Jones E, C. King. Nutrition of the preterm infant. Scientific Basis and Practical Guidelines. Digital Educational Publishing, Inc. Second Edition. Cincinnatti, OH 2005, 203 p. [ Links ]
7. Neu J, Hauser N, Douglas-Escobar M. Postnatal nutrition and adult heath programming. Semin Fetal Neonatal Med 2007; 12(1):78-86. [ Links ]
8. Okada Y, Klein N, van Saene HK, Pierro A. Small volumes of enteral feedings normalise immune function in infants receiving parenteral nutrition. J Pediatr Surg 1998; 33(1):16-19. [ Links ]
9. McClure RJ, Newell SJ. Randomized controlled trial of clinical outcome following trophic feeding. Arch Dis Child Fetal Neonatal Ed 2000; 82(1):F29-F33. [ Links ]
10. Shulman RJ, Schanler RJ, Lau C, Heitkemper M, Ou CN, Smith EO. Early feeding, antenatal glucocorticoids, and human milk decrease intestinal permeability in preterm infants. Pediatr Res 1998; 44(4):519-523. [ Links ]
11. Johnson LR. The trophic action of gastrointestinal hormones. Gastroenterology 1976; 70(2):278-288. [ Links ]
12. Weiler HA, Fitzpatrick-Wong SC, Schellenberg JM, Fair DE, McCloy UR, Veitch RR, et al. Minimal enteral feeding within 3 days of birth in prematurely born infants with birth weight < or = 1200 g improves bone mass by term age. Am J Clin Nutr 2006; 83(1):155-162. [ Links ]
13. Crissinger KD, Granger DN. Mucosal injury induced by ischemia and reperfusion in the piglet intestine: influences of age and feeding. Gastroenterology 1989 ;97(4):920-926. [ Links ]
14. Rogido M, Golombek SG, Baquero HD, Borbonet D, Goldsmit G, Lemus L, et al. Tercer Consenso Clínico SIBEN: Nutrición del recién nacido enfermo 2009. Disponible en: http://www.ascon.org.co/images/Documentos/Con_Siben_version_final.pdf Fecha de acceso: 22 de abril de 2013. [ Links ]
15. Adamkin DH. Enteral feeding guidelines practicum. In: D.H. Adamkin (editor). Nutritional Strategies for the Very Low Birthweight Infant. Cambridge University Press. Cambridge, UK 2009, 89-100 pp. [ Links ]
16. Fewtrell MS. Growth and nutrition after discharge. Semin Neonatol 2003; 8(2):169-176. [ Links ]
17. Ehrenkranz RA, Younes N, Lemons JA, Fanaroff AA, Donovan EF, Wright LL, et al. Longitudinal growth of hospitalized very low birth weight infants. Pediatrics 1999; 104(2 Pt 1):280-289. [ Links ]
18. Aggett PJ, Agostoni C, Axelsson I, De Curtis M, Goulet O, Hernell O, et al. Feeding Preterm Infants After Hospital Discharge. J Pediatr Gastroenterol Nutr 2006; 42(5):596-603. [ Links ]
19. Bhatia J. Post-Discharge Nutrition of Preterm Infants. J Perinatol 2005; 25 Suppl 2:S15-S16. [ Links ]
20. Adamkin DH. Postdischarge nutritional therapy. J Perinatol 2006; 26: S27-S30. [ Links ]
21. Barker DJ. Fetal origins of cardiovascular disease. Ann Med 1999; 31; (Supp.l 1):3-6. [ Links ]
22. Kashyap S, Schulze KF, Forsyth M, Zucker C, Dell RB, Ramakrishnan R. Growth, nutrient retention, and metabolic response in low birth weight infants fed varying intakes of protein and energy. J Pediatr 1988; 113(4):713-721. [ Links ]
23. Gartner LM, Greer FR. Prevention of rickets and vitamin D deficiency: new guidelines for vitamin D intake. Pediatrics 2003;111(4):908-910. [ Links ]
24. American Academy of Pediatrics, Committee on Nutrition: Nutritional needs of the preterm infant. In: R.E. Kleinman (editor). Pediatric Nutrition Handbook. 6th edition Chapel Hill, IL 2009:86-92. [ Links ]
25. Dusick AM, Poindexter BB, Ehrenkranz RA, Lemons JA. Growth failure in the preterm infant: can we catch-up? Semin Perinatol 2003;27:302-310. [ Links ]
26. Hospital discharge of the high-risk neonate: proposed guidelines. American Academy of Pediatrics. Committee on Fetus and Newborn. Pediatrics 1998; 102(2 Pt 1):411-417. [ Links ]
27. Hall RT. Nutritional follow-up of the breastfeeding premature infant after hospital discharge. Pediatr Clin NA 2001; 48: 453- 460. [ Links ]
28. Fenton TR. A new growth chart for preterm babies: Babson and Benda's chart updated with recent data and a new format. BMC Pediatr 2003; 16(3):13. [ Links ]
29. Fenton TR, Kim JH. A systematic review and meta-analysis to revise the Fenton growth chart for preterm infants. BMC Pediatrics 2013; 13(59) doi:10.1186/1471-2431-13-59. [ Links ]
30. Schanler RJ. Nutrition of premature babies post-discharge. Ann Nestlé 2005;63:57-65. [ Links ]
31. Schiza V, Giapros V, Pantou 1K, Theocharis P, Challa A, Andronikou S. Serum transferrin receptor, ferritin, and reticulocyte maturity indices during the first year of life in large preterm infants. European J Haematol 2007; 79: 439-446. [ Links ]
32. Rao SC, Tompkins J. Growth curves for preterm infants. Early Hum Dev 2007; 83(10):643-651. [ Links ]
33. Rao R, Georgieff MK. Iron Therapy for Preterm Infants. Clin Perinatol 2009; 36(1):27-42. [ Links ]
34. Carlson SJ, Ziegler EE. Nutrient intakes and growth of very low birth weight infants. J Perinatol 1998; 18(4):252-258. [ Links ]
35. Dani C, Reali MF, Bertini G, Martelli E, Pezzati M, Rubaltelli FF. The role of blood transfusions and iron intakes on retinopathy on premature. Early Hum Dev 2001; 62(1):57-63. [ Links ]
36. Friel JK, Andrews WL, Aziz K, Kwa PG, Lepage G, L'Abbe MR. A randomized trial of two levels of iron supplementation and development outcome in low birth weight infants. J Pediatr 2001; 139(2):254-260. [ Links ]
37. Rogahn J, Ryan S, Wells J, Fraser B, Squire C, Wild N, et al. Randomized trial of iodine intake and thyroid status in preterm infants. Arch Dis Child Fetal Neonatal Ed 2000;83(2):F86-F90. [ Links ]
38. Ares Segura S, Morreale de Escobar G, Quero Jiménez J. Necesidades de yodo en la época perinatal. XVIII Congreso Español de Medicina Perinatal. Disponible en: http://www.seneonatal.es/Portals/0/42-48ponencias.pdf. Fecha de consulta: 22 de abril de 2013. [ Links ]
39. Tyson JE, Wright LL, Oh W, Kennedy KA, Mele L, Ehrenkranz RA, et al. Vitamin A supplementation for extremely low-birth weight infants. National Institute of Child Health and Human Development Neonatal Research Network. N Engl J Med 1999; 340(25):1962-1968. [ Links ]
40. Kuschel CA, Harding JE. Leche materna con suplementos de Calcio y Fósforo para recién nacidos prematuros. (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus 2008 (4). Oxford: Update Software Ltd. Disponible en: http://www.update-software.com. (Traducida de The Cochrane Library, 2008 Issue 3. Chichester, UK: John Wiley & Sons, Ltd). Fecha de consulta: 22 de abril de 2013. [ Links ]
41. Rigo J, Mohamed MW, De Curtis M. Disorders of Calcium, Phosphorus, and Magnesium Metabolism. In: R. Martin, A. Fanaroff, M. Walsh. Neonatal-Perinatal Medicine. Diseases of the fetus and infant. 9th Ed. Mosby. St. Louis, MO 2011, 1523-1556 pp. [ Links ]
42. Vachharajani AJ, Mathur AM, Rao R. Metabolic Bone Disease of Prematurity. Neoreviews 2009; 10:e402-e411. [ Links ]
43. Harrison CM, Johnson K, McKechnie E. Osteopenia of prematurity: a national survey and review of practice. Acta Paediatr 2008; 97(4):407-413. [ Links ]
44. Misra M, Pacaud D, Petryk A, Collett-Solberg PF, Kappy M. Vitamin D Deficiency in Children and Its Management: Review of Current Knowledge and Recommendations. Pediatrics 2008;122(2):398-417. [ Links ]
45. Greer FR. Vitamin D deficiency-it's more than rickets. J Pediatr 2003; 143(4):422-423. [ Links ]
46. Winzenberg T, Jones G. Vitamin D and Bone Health in Childhood and Adolescence. Calcif Tissue Int 2013; 92(2):140-50. [ Links ]
47. Haussler MR, Whitfield GK, Kaneko I, Haussler CA, Hsieh D, Hsieh JC, et al. Molecular Mechanisms of Vitamin D Action. Calcif Tissue Int 2013; 92(2):77-98. [ Links ]
48. Shah MD, Shah SR. Nutrient Deficiencies in the Premature Infant. Pediatr Clin NA 2009; 56(5):1069-1083. [ Links ]
49. Guxens M, Mendez MA, Moltó-Puigmartí C, Julvez J, García-Esteban R, Forns J, et al. Breastfeeding, Long-Chain Polyunsaturated Fatty Acids. Pediatric. 2011; 128(4):e880- e889. [ Links ]
50. Schack-Nielsen L, Michaelsen K. Advances in Our Understanding of the Biology of Human Milk and Its Effects on the Offspring. J Nutr 2007; 137(2):503S-510S. [ Links ]
51. Makrides M, Gibson RA, McPhee AJ, Collins CT, Davis PG, Doyle LW, et al. Neurodevelopmental Outcomes of Preterm Infants Fed High-Dose Docosahexaenoic Acid: A Randomized Controlled Trial. JAMA 2009; 301(2):175-182. [ Links ]
52. Fewtrell M, Morley R, Abbott R, Singhal A, Kennedy K, Cockburn F, et al. Randomized, double-blind trial of longchain polyunsaturated fatty acid supplementation with fish oil and borage oil in preterm infants. J Pediatr 2004; 144(4):471- 479. [ Links ]
53. Smithers LG, Gibson RA, McPhee A, Makrides M. Higher dose of docosahexaenoic acid in the neonatal period improves visual acuity of preterm infants: results of a randomized controlled trial. Am J Clin Nutr 2008; 88(4):1049-1056. [ Links ]
54. Simmer K, Patole S. Longchain polyunsaturated fatty acid supplementation in preterm infants. Cochrane Database Syst Rev 2004;(1):CD000375. [ Links ]