Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Gen
versión impresa ISSN 0016-3503
Gen vol.60 no.3 Caracas set. 2006
Determinación del Helicobacter pylori en la placa dental por el test de la ureasa en pacientes dispépticos
Dres. *Parlapianno Donatella, * Villasmil Luis, *Casanova Gerardo. **Milano Mellise, *** Vázquez Libia, ***De Sousa Lilibeth, * Aguilera Elio, *Albarracín Zaida, * Caraballo Agustín, * Cammarata Francesco, *Velazco José, *Lantén Dinoira, * Gemmato Anna.
Departamento de Microbiología. Facultad de Medicina y Farmacia. Universidad de los Andes, Mérida. Venezuela.
*Servicio de Gastroenterología, **Servicio de Anatomía patológica. ***
Para cualquier información o separata contactar a la: Dra. Donatella Parlapianno, Servicio de Gastroenterología Facultad de Medicina y Farmacia. Universidad de los Andes, Mérida. Venezuela. E-mail: dparlapiano@cantv.net
RESUMEN
En la Unidad de Gastroenterología del Hospital Universitario de los Andes (I.A.H.U.L.A.) se realiza un estudio epidemiológico, observacional, descriptivo, transversal con grupo de comparación para determinar la presencia del Helicobacter pylori (H. Pylori) en la placa dental por medio del test de la ureasa comparado con el cultivo del microorganismo, desde marzo hasta mayo del 2004. Resultados: se evalúan 147 pacientes que acuden voluntariamente al estudio, los cuáles 97(66%) presentan dispepsia (Casos) y 50(34%) sin dispepsia (Grupo de comparación), catalogándose en Grupo 1 y Grupo 2 respectivamente. El test de la ureasa en antro gástrico es positivo en 50(51,1%) pacientes del grupo 1 y 29(58%) pacientes del grupo 2. El test de la ureasa en la placa dental resulta positivo en el 99.3% (n=146) de los pacientes estudiados. Se compara el test de la ureasa en la placa dental con el cultivo de la misma, se encuentra que 146(99%) pacientes son test de la ureasa positivo, pero no hay aislamiento del H. pylori en la placa dental en ningún paciente. En cuanto a la correlación entre el test de la ureasa en la placa dental y el cultivo del H. pylori en antro gástrico se encuentra que en 74(50,3%) pacientes se aísla el microorganismo y resultan positivos para el test de la ureasa en la placa dental; De los 72(49%) pacientes que no se aísla el microorganismo en el antro gástrico resultan positivos para el test de la ureasa en la placa dental. No hay correlación estadísticamente significativa entre las pruebas. Conclusión: El test de la ureasa no es un método diagnóstico especifico para determinar la presencia del H. pylori en la placa dental.
Palabras claves: Helicobacter pylori, Placa dental, Test de la ureasa, Cultivo.
SUMMARY
In the Gastroenterology Unit of the University Hospital of the Andes (I.A.H.U.L.A.) an epidemiologic, observational, descriptive, crosssectional study was made with a control group to determine the presence of Helicobacter pylori (H. Pylori) in the dental plate by means of the ureasa test compared with the culture of the microorganism, from March to May of the year 2004. Results: 147 patients are evaluated who show voluntarily to the study, 97 (66%) have dyspepsia and 50 (34%) do not (control group), catalogued as Group 1 and Group 2 respectively. The ureasa test in the gastric antrum is positive in 50 (51.1%) patient of group 1 and 29 (58%) patients from group 2. The ureasa test in the dental plate is positive in 99, 3% (n=146) of the studied patients. The ureasa test in the dental plate is compared to the culture, we found that 146 (99%) patients show positive to the ureasa test, but H. pylori can not be isolated in the dental plate of any of the patients. As to the correlation between the test of ureasa in the dental plate and the culture of H. pylori in the gastric antrum there were 74 (50.3%) patients in whom the microorganism was isolated and are positive for the ureasa test in the dental plate. Of the 72 (49%) patients from whom the microorganism was not isolated from the gastric antrum show positive for the ureasa test in the dental plate. There is no statistical significant correlation between the tests. Conclusion: The ureasa test is not a specific diagnosis method to determine the presence of H. pylori in the dental plate.
Key words: Helicobacter pylori, Dental plate, Ureasa test, Culture.
Fecha de Recepción Sep. 2005- Fecha de Revisión Abr. 2006- Fecha de Aprobación. Jun. 2006
De acuerdo a los estudios realizados a nivel mundial se ha identificado la placa dental como un segundo reservorio del Helicobacter pylori (H.pylori) y el primer reservorio extragástrico, lo cual conlleva a una alta sospecha de que éste sea el medio de transmisión oro-oral y muy probablemente de la reinfección en los pacientes que se les ha erradicado la bacteria. Sin embargo estas consideraciones son desconocidas en nuestro medio. Los estados andinos son conocidos por la alta incidencia de la infección por esta bacteria. Planteamos determinar la presencia del H.pylori en la placa dental para demostrar su presencia, por un método sencillo y de bajo costo como lo es el test de la ureasa, y corroborar ésta positividad en los pacientes dispépticos y asintomáticos con el cultivo del mismo y su correlación con la infección en la mucosa gástrica. En la Unidad de Gastroenterología del (I.A.H.U.L.A), se lleva a cabo un estudio tipo epidemiológico, observacional, descriptivo, transversal, con grupo de comparación con el fin de demostrar el H. pylori en la placa dental por medio del test de la ureasa y el cultivo.
MATERIALES Y MÉTODOS
Se incluyen 100 pacientes con dispepsia en forma consecutiva procedente de la ciudad de Mérida y sus áreas de influencia, que acuden a la consulta externa, y 50 pacientes sin dispepsia. Son 44 hombres y 103 mujeres cuyas edades están comprendidas entre los 15 y 85 años de edad, que no hubiesen recibido, inhibidores de la bomba de protones, antibióticos tales como: amoxicilina, metronidazol, claritromicina, furazolidona, tetraciclina; en un periodo de 4 semanas antes del inicio del estudio; así como antagonistas de los receptores de histamina, neutralizantes y citoprotectores dos semanas antes. Los datos se registran en un formato de recolección donde se incluye la identificación personal, procedencia, hábitos psicobiológicos (consumo de alcohol, tabaco, consumo de vegetales crudos), control odontológico, caries dental, hábitos higiénicos dentales. Se utiliza un equipo de video endoscopia digestiva marca Olympus® modelo CV-100 con gastroscopio tipo GIF-130, 3 pinzas para biopsias gástrica tipo Multibite Microinvase® la desinfección se realiza con Glutaraldehido al 2 % (Cidex®).
El test de la ureasa es proporcionado por el Departamento de Microbiología de la Facultad de Medicina de la Universidad de Los Andes (U.L.A.). Mérida-Venezuela.
La biopsia se conserva en formaldehído al 10%. La coloración utilizada para cada muestra es Hematoxilina-Eosina (H&E) y Giemsa modificado. Se utiliza medio de cultivo agar Belo Horizonte® para la muestra de la placa dental y la biopsia gástrica. Se toman 3 muestras de la placa dental a nivel gingival de los molares (sexto y séptimo superiores e inferiores) mediante raspado de la superficie dentaria con cureta de Gracey®, la cual se esparce sobre el test de la ureasa, medio de Chrisistensen , que consiste en un gel casero que contiene urea y un marcador de pH (rojo fenol), la fuerte actividad de la ureasa de H. pylori produce un cambio de color amarillo a rosado fucsia; las dos muestras restantes se introducen en Vacuntainer® individuales estériles con 1cc de solución fisiológica para transportar de forma inmediata al Laboratorio de Microbiología de la Universidad de los Andes y colocar en medio de cultivo para siembra en dos medios: "Agar Belo Horizonte® diferencial: BHI suplementado con 10% de sangre de caballo, suplemento nutritivo (Isovitalex), e indicador 2,3 difenil tetrazolium.
"Agar Belo Horizonte® selectivo diferencial: BHI suplementado con 10% de sangre de caballo, indicador 2,3 difenil tetrazolium y suplemento antibiótico ( Skirrow ®)
Posteriormente, se introducen en jarras de anaerobiosis con sistemas generadores CO2 (Gaspack ® o Campygen Oxoid ®) y se llevaron a la estufa a una temperatura de 37°C durante 5- 7 días. Las colonias sospechosas (pequeñas, de color dorado debido al indicador del medio) fueron identificadas como H. pylori por pruebas de ureasa, oxidasa, catalasa y coloración de Gram modificado para evaluar la morfología.
Para control del estudio microbiológico se obtuvo una cepa de referencia del Instituto de Colección de Microorganismos de Venezuela.
Posteriormente, previa anestesia local con Cifarcaina al 2% y sedación conciente con Midazolam se realiza gastroscopia a cada paciente, el diagnóstico de infección por H. pylori se establece obteniendo 3 muestras de la mucosa gástrica antral y fundica, cada vez que se toma el número de muestras para las biopsias, la pinza en uso, se limpia y desinfecta con Glutaraldehido al 2% por espacio de cinco minutos con la intención de eliminar la posibilidad de contaminación de las mismas, una vez concluida la gastroscopia, el endoscopio se limpia y desinfecta de acuerdo con las recomendaciones internacionales para la desinfección de equipos endoscópicos. Una muestra de la biopsia se utiliza para el test de la ureasa, ésta misma posteriormente, se introduce en un reservorio con Formaldehído al 10% para ser transportada al laboratorio de Anatomía patológica. Las dos muestras restantes tanto de antro como de fundus se introducen en tubos estériles de Eppendorff® de 0,5 ml, respectivamente con 0,2 ml de Sol. 0,9 % para ser transportados de forma inmediata al Laboratorio de Microbiología y ser procesados para el cultivo del microorganismo.
Cada uno de los contenedores de las muestras se identifica con un código específico para cada paciente y tipo de muestra, el patólogo examinador de la muestra de mucosa gástrica no conoce de los resultados del test de la ureasa previamente tomada. Las biopsias se colorean con H&E y Giemsa modificado. Con la coloración de Giemsa modificado se determina la presencia del H. pylori y de acuerdo a la densidad del mismo, en la muestra se clasifica en: ausente, escaso, moderado y abundante con respecto a la cantidad de bacilos espiralados. Los hallazgos histológicos observados por H&E son clasificados de acuerdo al sistema internacional de Sydney.
Cultivo microbiológico de la muestra de la placa dental:
Parte de la muestra de la placa dental se siembra pura y la otra parte de la muestra se le realiza un pre -tratamiento con 10 ?l de HCL (0.06 N) y 5 ?l de Urea (0.008 M) por 5 minutos a 37º C, para la eliminación de la flora habitual de cavidad oral.
Se inoculan las muestras de biopsias gástricas en los medios descritos, en igual condiciones de incubación. Las variables categóricas se expresan como porcentajes y se comparan mediante Chi cuadrado (c2) o test de Fisher además de coeficiente Gamma, tau-b de Kendall, tau-c de Kendall, Spearmam, Mante-Haenzel y Kappa. El nivel de significancia elegido fue de p< 0.05. Se utilizó el programa estadístico SPSS versión 10.0.
RESULTADOS
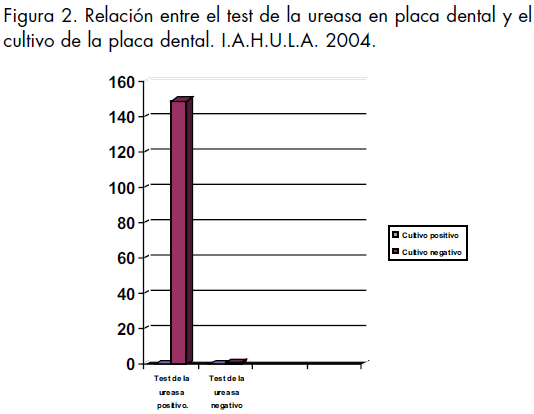
El test de la ureasa para H. pylori en la placa dental resulta positivo en el 99.3% (n=149) de los pacientes estudiados. Dado estos resultados el análisis de la relación entre la colonización de la placa dental por H. pylori según el test de la ureasa con otras variables no es procedente desde el punto de vista estadístico en esta muestra de pacientes, la cual se caracteriza porque prácticamente todos son test de la ureasa positivos para H. pylori en la placa dental. (Figura 1) En la relación entre el test de la ureasa en la placa dental y el cultivo de la misma, se encuentra que 149(99%) pacientes son test de la ureasa positivo y no hay crecimiento del H. pylori en la placa dental en ningún paciente. Por lo cual no hay significancia estadística entre las pruebas. (Figura 2)
En la correlación entre la presencia del H. pylori en la mucosa gástrica por el Gram y el test de la ureasa en la placa dental, encontramos que 78 (53,1%) pacientes se reporta la presencia del microorganismo y son positivos para el test de la ureasa en la placa dental; 68(46,3%) pacientes no se observa el microorganismo por el Gram pero se reportan positivos en el test de la ureasa en la placa dental. No hay correlación estadísticamente significativa para las pruebas diagnósticas. (Tabla 1).
En la correlación entre el test de la ureasa en la placa dental y el cultivo del H. pylori en antro gástrico se encuentra que 74(50,3%) pacientes presentan crecimiento del microorganismo y positividad para el test de la ureasa en la placa dental; 1(1,2%) paciente hay crecimiento del microorganismo en el antro gástrico, sin embargo es el único paciente que no resulta positivo para el test de la ureasa en la placa dental.
De los 72(49%) pacientes que no hubo crecimiento del microorganismo de igual manera resultaron positivos para el test de la ureasa en placa dental.
No hay correlación estadísticamente significativa entre las pruebas. (Tabla 2).
En la correlación entre el test de la ureasa en la placa dental y en el antro gástrico, se encuentra que son positivos para ambas muestras 74(50,3%) pacientes y 72 (49%) positivo en placa dental pero negativos en antro gástrico. Solo 1(1,7%) paciente resulta positivo para antro y negativo en la placa dental. No hay correlación estadísticamente significativa para ambas muestra. (Tabla 3).
En la correlación entre la presencia del microorganismo por medio del cultivo tanto en antro como en fundus gástrico, encontramos que hay crecimiento del H. pylori en 53 pacientes tanto en el antro como en el fundus, 22 pacientes son negativos para el antro pero positivos para el fundus; 11 pacientes son negativos para el fundus pero positivos para el antro y 61 pacientes son negativos en ambas porciones del estómago.
Hay correlación estadísticamente significativa para la prueba en ambas porciones del estómago. (Tabla 4).
DISCUSIÓN
La presencia de H. pylori en la cavidad oral ha sido demostrada en numerosos estudios empleando técnicas de Reacción en Cadena de Polimerasa (PCR). Recientes estudios realizados por Berroterán y cols. en una población venezolana, detectaron la presencia de H. pylori en placa dental en un 37,5 % (usando PCR) y Umeda y cols. utilizando la misma técnica encontrando éste microorganismo en un 35%. Varios estudios recuperaron el H.pylori de cavidad oral mediante cultivo.
El aislamiento microbiológico de muestras de biopsia gástrica constituye la regla de oro para la identificación de H. pylori. Aunque la bacteria es catalogada como de carácter fastidioso algunos autores manifiestan métodos sencillos para aislarla e identificarla fácilmente promoviendo que se incorpore el cultivo en la rutina bacteriológica.
Numerosos investigadores han planteado el problema de aislamiento mediante cultivo de muestras procedentes de cavidad oral, debido a que esta puede poseer una baja cantidad de H. pylori los cuales no pueden ser detectados por el sobre crecimiento de abundantes poblaciones de microorganismos competitivos contaminantes.
También se ha atribuido como dificultad para el cultivo la existencia de H. pylori en forma cocoide la cual se especula sea una forma de resistencia capaz de soportar las condiciones adversas que encuentra en el medio ambiente y reversible a la forma espiral en el momento en que se vuelven a dar las condiciones óptimas.
Numerosos intentos de cultivar la forma cocoide han fracasado, lo que han llevado a denominar a esta como "forma viable pero no cultivable de H. pylori, aunque en otros estudios por el contrario, estas formas son viables y fácilmente cultivables.
Young y cols. Relacionaron la presencia del H. pylori por PCR, cultivo, y microscopía electrónica encontrando formas cocoides en la placa dental en su mayoría, lo cual fue difícil cultivarlos pero fueron observados rápidamente por microscopía electrónica.
Kim cols. evaluaron por PCR, test de la ureasa, cultivo, Gram, la presencia de H. pylori en la placa dental y en la mucosa gástrica, encontrando solo 2(6,9%) pacientes con positividad.
Siddig y cols. Realizaron un estudio descriptivo, en 52 pacientes con síntomas dispépticos, comparando la presencia del H. pylori en la placa dental y la mucosa gástrica, encontrando que el 80,76% presentaban positividad para el H. pylori por el test de la ureasa y 69,53% para la placa dental, concluyendo que la mayoría de los pacientes posiblemente tienen colonización de la placa dental, sin embargo no realizaron métodos diagnósticos comparativos para el test de la ureasa en placa dental. En nuestro estudio se realizó la misma comparación encontrando similares resultados, pero a diferencia del anterior, el nuestro comparó la positividad del test de la ureasa en placa dental con el cultivo de la misma, no encontrando positividad en ninguna de las muestras cultivadas.
Esto nos llevo a pensar que pudiese haber un error en el procedimiento del cultivo, ya que se ha descrito la gran dificultad que existe para obtener el crecimiento de la bacteria, por lo cuál se llevo a cabo con la colonización del microorganismo ya aislado y preservado en el laboratorio de Microbiología de la Facultad de Farmacia, en una muestra aleatoria de la placa dental logrando el crecimiento del mismo. Por lo tanto podemos suponer ante estos resultados que las formas cocoides que son imposibles de cultivar sean las que colonizan nuestra población o que realmente no se encuentra en nuestro medio.
Se debería realizar un nuevo estudio a futuro, comparando el cultivo de la placa dental con el PCR ya que es el Gold Standard para determinar su presencia en esta àrea.
CONCLUSIÓN
El test de la ureasa no es un método diagnóstico de primera línea para determinar la colonización en la placa dental del H. pylori. Deben realizarse estudios por PCR o microscopía electrónica para determinar la presencia del H. pylori en la placa dental.
REFERENCIAS
1. Desai HG, Gill HH, Shankararan K, Metha PR, Prabhu SR. A dental plaque: A permanent reservorio Helicobacter pylori?. Scand J Gastroenterol 1991;26:1205-1208. [ Links ]
2. Pytko-Polonczyk J, Konturek E, Bielanski W, Kaszmarczyk-Stachowska A. Oral cavity as permanent reservoir of Helicobacter pylori and potential source of reinfection. J Physiol Pharmacol 1996; 47:121-129. [ Links ]
3. Thomas MD, Jiang C, Chi DS, Li CH, Ferguson DA. The role of the oral cavity in Helicobacter pylori infection. Am J Gastroenterol 1997; 92:2148-2154. [ Links ]
4. Bracho S. Estudio Comparativo con técnicas de aislamiento, identificación, preservación de H. pylori provenientes de biopsias gástricas. Trabajo de Grado. Facultad de Farmacia. Universidad de Los Andes.1995. [ Links ]
5. Gemmato A. Relación entre infección por Helicobacter pylori y las lesiones preneoplasicas gástricas en pacientes de la Unidad de Gastroenterología del IAHULA. Trabajo de Grado. Unidad de Gastroenterología. Facultad de Medicina. Universidad de Los Andes. 2002. [ Links ]
6. Velazco JG. Estudio comparativo de cuatro inhibidores de bomba y dos antibióticos para la erradicación del Helicobacter pylori. Trabajo de Grado. Unidad de Gastroenterología. Facultad de Medicina. Universidad de Los Andes. 2003 [ Links ]
7. Villasmil LM. Niveles de selenio en sangre y en tejido gástrico de pacientes relacionados con la presencia o ausencia de Helicobacter pylori Trabajo de Ascenso para escalafón de Asociado. Universidad de los Andes.2003. [ Links ]
8. Kullavanijaya P., Thong D., Nunthapisud P., Suwangool P., Chulalongkorn. An Análisis of Eigh Different Methods for the Diagnosis of Helicobacter pylori Infection in Thailand. Helicobacter 2003; 8 (4):487-90. [ Links ]
9. Skirrrow, M.B. Microbiología del Género Helicobacter. En: Lopez- Brea (Ed). Helicobacter pylori: Microbiología, Clínica y Tratamiento.1995 ( pp 23-31) Madrid España: Mosby /Doyma Libros. [ Links ]
10. Guidelines for clinical application. Infection Control During Gastrointestinal Endoscopy. ASGE 1999; 49(6): 836-840. [ Links ]
11. Michael F. Dixon, MD. Internacional Workshop on the Histopathology of Gastritis. AJSP 1996;20:1161-1181. [ Links ]
12. Song Q., Zirnstein G.W., Swaminathan B., Gold B.D. Pretreatment with Urea-Hydrochloric Acid Enhances the Isolation of Helicobacter pylori from Contaminated Specimens. J. Clinic. Microbiol. 2001;39: 1967-1968. [ Links ]
13. Glupczynnski, Y. Diagnóstico Microbiológico de la Infección por Helicobacter pylori. En: Lopez- Brea, (Ed) Helicobacter pylori: Microbiología, Clínica y Tratamiento.1995; ( pp 54-72) Madrid España: Mosby /Doyma Libros. [ Links ]
14. Marascuilo, L. A. y Serlin, R. C. Statistical methods for the social and behavioral Sciences.1998 New York: W. H. Freeman and Company. [ Links ]
15. Bickley J, Owen RJ, Fraser AG, Pounder RE. Evaluation of the polymerase chain reaction for detecting the urease C gene of Helicobacter pylori in gastric biopsy samples and dental plaque. J Med Microbiol 1993; 39: 338-344. [ Links ]
16. Berroteran A, Perrone M, Correnti M, Cavazza M, Tombazzi C, Goncalvez R, Lecuna V. Detection of Helicobacter pylori DNA in the oral cavity and gastroduodenal system of a Venezuelan population. J. Med Microbiol 2002; 51: 764-770. [ Links ]
17. Umeda M., Kobashi H., Takeuchi Y., Hayashi J., Morotome-Hayashi Y., Yano K., Aoki A., Ohkusha T., Ishikawa I. High prevalence of Helicobacter pylori detected by PCR in the oral cavities of periodontitis patients. J. Periodontol. 2003; 74 (1): 129-34. [ Links ]
18. Campuzano FS., Ramírez I., Arguello E., Herrera M. Aislamiento de Helicobacter pylori en placa dental. Trib. Med. 1996; 93 (4):169-79. [ Links ]
19. Mattana CM, Vega AE, Flores G, De Domenicon AG, De Centorbi OV. Isolation of Helicobacter pylori from dental plaque. Rev Argent Microbiol. 1998; 30:93-5. [ Links ]
20. Glupczynnski, Y. Diagnóstico Microbiológico de la Infección por Helicobacter pylori. En: Lopez- Brea, (Ed) Helicobacter pylori: Microbiología, Clínica y Tratamiento.1995; ( pp 54-72) Madrid España: Mosby /Doyma Libros. [ Links ]
21. Henández-Chavarria, Rivera, P. Experiencias en el cultivo de bacterias microaerofílicas. 2001. Disponible en : www.ucr.ac.cr/~gacetapc/Helicobacter-cultivo.htm [ Links ]
22. Al-Hawaji Ballam L D., Mendall MA., Asante M., Morris M, Strachan D P, Whincup P H. and Cook D G. Western blotting is useful in the salivary diagnosis of Helicobacter pylori infection. J Clin Pathol. 2003; 53: 314-317. [ Links ]
23. Nasrolahei M, Maleki I, Emadian O. Helicobacter pylori colonization in dental plaque and gastric infection. Rom J Gastroenterol. 2003;12(4):293-6. [ Links ]
24. Buh Bode G., Mauch F and Malfertheiner P. The coccoid forms of Helicobacter pylori. Criteria for their viability. Epidemiol. Infect. 1993; 111: 483-490. [ Links ]
25. Garcia, J.A. Formas cocoides de Helicobacter pylori: Formas de muerte o Resistencia.2001. Disponible en: www.Helicobacterspain.com. [ Links ]
26. Young V, Wong B. H. pylori eradication: does it prevent gastric cancer?. Gastroenterology and Hepatology, 2003; 18(Supl 1): A5-A6. [ Links ]
27. Kim N., LimS., Lee K., You J., Kim J., Lee N., Jung HC., Somg IS., Kim CY. Helicobacter pylori in dental plaque and Saliva. Korean J. Intern Med. 2000; 15 (3): 187-94. [ Links ]
28. Siddigh V, Trikha B, Vaiphei K. Helicobacter pylori: evidence for spouse-to-spouse transmission. J Gastroenterol Hepatol. 1999; 14:519-22. [ Links ]