Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Gen
versión impresa ISSN 0016-3503
Gen vol.60 no.3 Caracas set. 2006
Tumor estromal gastrointestinal del intestino delgado con expresión negativa del marcador oncogénico KIT (CD117). A propósito de un caso
Dres. Aparcero Miguel*, Delgado Maria Gabriela**, Galvis Elymir***, Bethelmy Alejandro***, Quijada Oswaldo***, Vargas Pedro****, Essenfeld Harold*****, Scholz Jannete*****.
* Jefe de la Unidad de Gastroenterología del Hospital Central Dr Miguel Pérez Carreño, IVSS. Caracas, Venezuela.
** Gastroenterólogo egresado del Post Grado de Gastroenterología del Hospital Central Dr. Miguel Pérez Carreño, IVSS.
*** Residentes de Postgrado de Gastroenterología del Hospital Central Dr. Miguel Pérez Carreño, IVSS.
**** Médico Cirujano. Policlínica Metropolitana.
***** Anatomía Patológica. Policlínica Metropolitana.
Hospital Miguel Pérez Carreño, IVSS y Policlínica Metropolitana. Caracas
Para cualquier información o separata contactar a la: Dr. Miguel Aparcero. Servicio de Gastroenterología, Hospital Pérez Carreño. E-mail: aparcero@cantv.net
RESUMEN
Los tumores estromales del tracto gastrointestinal (GIST), aunque infrecuentes, son tumores mesenquimatosos importantes de origen mesodérmico. Macroscópicamente se presentan como una masa intramural submucosal, siendo los mas comunes dentro de los tumores mesenquimatosos. La forma maligna, típicamente agresiva y resistente al tratamiento, es afortunadamente rara. Un importante avance ha sido la caracterización del marcador oncogénico KIT y su relación a la patogénesis del Tumor Estromal Gastrointestinal. Sin embargo, recientes investigaciones han demostrado la génesis de los GIST que son KIT negativos. Por lo tanto, la positividad del marcador oncogénico KIT, si bien es altamente sensible, no es requerimiento indispensable para el diagnóstico de GIST. Presentamos nuestra paciente con un GIST del intestino delgado y negatividad al c-KIT(CD 117).
Palabras claves: Tumores mesenquimatosos, tumor estromal gastrointestinal (GIST), tumor submucoso gastrointestinal.
SUMMARY
Gastrointestinal stromal tumors (GIST) are uncommon but important mesenchymal tumors of the Gastrointestinal Tract, defined as being of mesodermal origin. Macroscopically they present as intramural submucosal masses, being the most common mesenchymal tumors to arise from the gastrointestinal tract. The malignant form, typically aggressive and resistant to treatment, in fortunately rare. An important development has been the characterization of the oncogene marker KIT, and its relation to the pathogenesis of GIST. However recent research has shed light on the genesis of GIST that is KIT negative. KIT is highly sensitive for GIST (though not 100%) but is not a marker of malignancy or essential requirement to the diagnosis of GIST. We show a patient with a GIST of the small intestine, KIT- negative.
Key words: Mesenchymal tumors, stromal tumors of the gastrointestinal tract (GIST), submucosal tumors of the gastrointestinal tract.
Fecha de Recepción Sep. 2005- Fecha de Revisión Abr. 2006- Fecha de Aprobación. Jun.
INTRODUCCIÓN
El Tumor Estromal Gastrointestinal (GIST) se ha establecido como una entidad clínica bien definida. Si bien son los tumores mesenquimatosos y tumores no-epiteliales del tracto gastrointestinal (TGI) más comunes, solamente constituyen el 1-3% de todos los tumores gastrointestinales.1
Se piensa que los GIST se originan de la transformación neoplásica de las células intersticiales de Cajal, células intestinales marcapasos, quienes expresan KIT en su estado normal.2 Probablemente, el tumor estromal se desarrolla como resultado de la mutación del c-KIT en las células intersticiales de Cajal.3
El estómago es el sitio más frecuente, 70%; en el intestino delgado 10-20% y el resto en esófago, colon , recto y apéndice.4
Suelen presentarse con signos de Tumor Submucoso en el TGI, usualmente con la mucosa que la recubre, conservada y contínua; aunque pudiera estar umbilicada y ulcerada. Si bien son generalmente asintomáticos, pudieran presentarse con dolor, distensión abdominal, hemorragia digestiva y ocasionalmente obstrucción.3
En 1998,se demostró que la mayoría de los GIST, expresaban un receptor tirosina-kinasa, KIT, también llamado CD 117. Este receptor trans-menbrana es responsable en la mediación de una variedad de funciones de crecimiento celular. El receptor KIT expresado en GIST es anormal en su función, con actividad tirosina-kinasa, resultando en proliferación celular no regulada.3
El diagnóstico de GIST se ha venido basando en los hallazgos morfológicos y en la demostración inmunohistoquímica de la expresión de la proteína KIT(CD117). Sin embargo, algunos tumores 4%, tienen características clinicopatológicas y hallazgos histológicos típicos de GIST, pero sin expresión de KIT, es decir son KIT-negativos.4
Recientes avances han ocurrido en la génesis de los GIST que son KIT-negativos. Heinrich y colaboradores demostraron que en pacientes con GIST maligno, 1/3 de los tumores KIT-negativos, eran positivos al así llamado alfa PDGFR (alfa receptor factor de crecimiento de plaquetas activadas), otro receptor tirosina-kinasa con actividad similar al KIT. Así se deduce que la positividad al KIT, no es requerimiento indispensable para el diagnóstico de KIT.3, 5
Análisis mutacional de genes c-kit y PDGFRA deberían ser requeridos para el diagnóstico definitivo de GIST. Los GIST con mutación del gen PDGFRA algunas veces son KIT-negativo.6
Presentamos nuestra paciente con las características clinicopatológicas e histológicas de un GIST del intestino delgado y expresión negativa del marcador oncogénico c-kit(CD117) negativo.
CASO CLÍNICO
Se trata de paciente femenina de 64 años de edad, con clínica desde el 2000 de anemia microcitica-hipocromica y melena; recibiendo tratamiento con hierro y ácido fólico. Permanece asintomática hasta el 23 de noviembre del 2003 cuando presenta melena de tres días de evolución, concomitante lipotimia y epigastralgia decidiéndose su ingreso.
Antecedentes personales:
2000: Presenta anemia microcítica-hipocrómica y melena. Es evaluada por gastroenterólogo quien realiza los siguientes estudios:
"Endoscopia Digestiva superior (EDS): Hernia Hiatal, gastritis.
"Ecosonograma abdominal (USA): normal
"Recibe tratamiento con hierro y ácido fólico, presentando mejoría de la anemia y manteniéndose asintomática.
2002: La paciente presenta un síncope, evidenciándose anemia microcítica-hipocrómica y sangre oculta en heces positiva
"Colonoscopia: enfermedad divertícular del sigmoides
"USA: normal.
"HTA desde 2001 en tratamiento con losartán potásico.
Quirúrgicos:
Colecistectomía por litiasis vesicular sin complicaciones
Histerectomía mas ooforosalpingectomía
Antecedentes familiares:
Padre fallecido por cáncer gástrico
Hábitos psicobiologicos
Niega tabáquicos, alérgicos y alcohólicos.
Examen fisico
TA 140/70
Palidez cutáneo mucosa.
Cardiopulmonar: normal.
Abdomen: blando, deprimible, no doloroso, no visceromegalias.
Tacto rectal: no se evidencia melena.
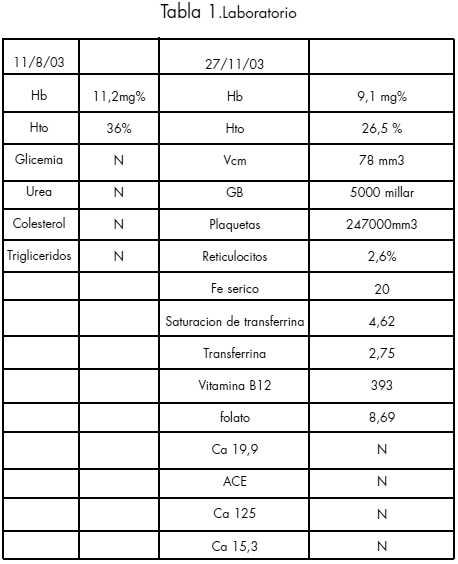
VALORES NORMALES DE LABORATORIO
Hb 12 a 14 mg%.Hto 37 a 47%VCM 81 a 99mm3.GB 5,0 a 9,5millar.Neu 55 a 65%. Linf 25 a 45%. Plaquetas 130 a 400 mil mm3.Reticulocitos 0,5 a 1,5 %.
" EDS: en noviembre 2003:gastritis erosiva
Biopsia: gastritis crónica severa con atrofia focal. HP positivo.
No atipias.
o USA: normal. Colecistectomizada.
" TAC abdomino - pélvica
Mayo 2004: Divertículos en sigmoides. Resto Normal
EVOLUCIÓN
Se le indica tratamiento con hierro y ácido fólico permaneciendo asintomática y con cifras de Hb normal hasta el 7 junio del 2004, cuando presenta clínica caracterizada por tres evacuaciones tipo melena, concomitante debilidad generalizada y dolor abdominal difuso por lo cual es hospitalizada.
● EDS 11/06/04
NORMAL
● COLONOSCOPIA 11/06/04
Diverticulos en sigmoides
DIAGNOSTICO DEFINITIVO
Hemorragia digestiva oculta: tumor submucoso del ángulo duodenoyeyunal, por lo que es llevada a cirugía.
COMENTARIOS
Los tumores estromales gastrointestinales son definidos como tumores mesenquimatosos del TGI, que se caracterizan por expresar una proteína protoncogen llamada CD 117, detectada por inmunohistoquímica.7 La mutación genómica de un gen simple kit, encontrado en el cromosoma 4, es la responsable de la activación de la tirosina-kinasa que promueve el desarrollo sin control del tumor e inhibe el proceso de apoptosis celular.1 Sin embargo un 4% de estos tumores no expresan KIT,1 siendo denominados tumores mesenquimales indiferenciados o de fenotipo nulo ("nullphenotypes").4
Los GIST si bien son raros, son los tumores mesenquimales mas comunes del TGI, y representan 1 a 3 % de todos los tumores malignos gastrointestinales. Muestran un linaje de diferenciación similar a las células intestinales de Cajal, que como sabemos son las células marcapasos de la peristalsis gastrointestinal.7
Usualmente afectan pacientes en edad media y ancianos con una media de edad entre 50 y 60 años. Son infrecuentes antes de los 40 años y excepcional en niños.7 Nuestro caso ocurre en mujer de 64 años de edad. Actualmente se considera la afectación igual en ambos sexos en pacientes con tumores c-KIT positivo; pero se mantiene el predominio en hombres en los KIT negativos.
Su localización más frecuentemente es en el estómago (60-70%) y en menor frecuencia se encuentran en el intestino delgado (30%), recto, colón y esófago (10%).1,7 Existen tumores similares extragastrointestinal que pueden originarse del mesenterio, omento y retroperitóneo. En nuestra paciente, la localización fue el intestino delgado, a nivel del ángulo de Treitz (Figura 1).
La presentación clínica es vaga y depende del tamaño y la localización del tumor. Usualmente asintomáticas.3 Los síntomas más comunes son el dolor abdominal y la distensión, seguido por el sangrado GI con anemia de origen oculto ó indeterminado. Los tumores duodenales pueden cursar con ictericia obstructiva y pueden ser confundido por tumores de la cabeza del páncreas.1 En nuestra paciente la historia clínica fue de sangramiento leve crónico recurrente con exploraciones iniciales digestivas de rutina que fallaron en la detección del origen del sangramiento.
Macroscópicamente son masas con características de lesiones submucosas, blandas o firmes, circunscritas, no encapsuladas, sin/con umbilicación o ulceración central. Su superficie es lisa con una cubierta de fibra o tejido suave. Su tamaño suele encontrarse entre 3 y 10cm. Las grandes lesiones muestran degeneración quística o necrosis central. Es común la ulceración de la mucosa que los cubre, como se observa en la foto de la enteroscopia de nuestra paciente (Figura 2).

El patrón histológico predominante, visto en aproximadamente un 80% de los tumores, es el de células en huso. Cerca de un 20 a 30% están compuestos predominantemente por células epiteliales poligonales con abundante citoplasma eosinófilo o claro. Menos del 10% son tumores mixtos. En el caso de los c-KIT negativo más de un 50% presentan un fenotipo epitelioide.7
Se debe investigar las propiedades inmunohistoquímicas del tumor para lograr su diagnóstico. Los GIST son en su mayoría positivos al CD 117, antígeno c-kit. El tumor leimiogénico es positivo al alfa-antígeno de músculo liso (alfa-SMA). El tumor glial es positivo a la proteína S-100 y el tumor fibroso es vimentina positivo.1 En nuestro caso, todas ellas resultaron negativas.
La ecoendoscopia juega un papel crucial en el diagnóstico de este tipo de lesiones,ya que permite diferenciar la capa de origen y sus características, y además permite la toma de biopsia por aguja fina para la realización de inmunohistoquímica .3
El diagnóstico de GIST se basa en sus características morfológicas y la demostración inmunohistoquímica de la expresión de la proteína tirosina-kinasa KIT(CD 117) y de la proteína CD 34. Los casos KIT negativos deberían someterse a detección de PDGFRA (receptor factor de crecimiento de plaquetas activadas), el cual es otro receptor con actividad tirosina-kinasa similar al KIT,y da positivo en 1/3 de los pacientes con KIT-negativo. A pesar de ello, todavía existe un 2/3 de KIT-negativos, también PDGFRA-negativos, lo cual sugiere que hay otros mecanismos por ser dilucidados en el futuro.3
La sobre-expresión del KIT en las células tumorales resulta de la activación del receptor tirosina-kinasa. La activación del KIT conduce a una señal intracelular que causa un incremento en la proliferación celular y mejora la sobrevida celular, llevando así a la formación del tumor.8
Una estrategia terapéutica actualmente disponible es el agente farmacológico SCI-571, mesilato de imatinib (Glivec, Novartis), el cual es un inhibidor selectivo de la tirosina-kinasa, logrando regresión del tumor en más del 50% en las series iniciales de pacientes con GIST tratados desde 2001. Su indicación es en casos avanzados, inoperables, metastásicos, recurrentes .9 La cirugía permanece la terapia de elección para los casos resecables.
Los GIST expresan en un 60 a 70% otro marcador denominado CD 34, que es una proteína transmembrana, y que puede ayudar al diagnóstico.3 Los tumores gástricos lo expresan en más de un 80% no así los de intestino delgado, en los que se observa en menos del 50% de los casos.
Determinar la malignidad de estos tumores suele ser un proceso complejo. Factores que pueden pronosticar transformación maligna son: tamaño mayor de 4cm, más de 5 figuras mitóticas en un aumento de 50 campos de alto poder y presencia de áreas ulceradas, necróticas o quísticas. En 2001, un consenso del National Institute of Health, USA, desarrolló pautas de clasificación histológica del GIST. Fue admitido que los términos "benigno y maligno" no caracterizan a plenitud el comportamiento clínico de los GIST. Se estableció una clasificación en cuanto al riesgo de comportamiento maligno, tomando criterio de contaje mitótico y tamaño. La escala va desde GIST de Muy Bajo Riesgo: menor de 2cm y menos de 5 mitosis/50 HPF(Campo de alto poder), Bajo Riesgo: 2-5cm y menos de 5 mitosis/50HPF, Riesgo Intermedio:menos de 5cm y 6-10 mitosis/50 HPF ó 5-10cm y menos de 5 mitosis/50 HPF. Alto Riesgo: menos de 5cm con mas de 5 mitosis/50 HPF, mayor de 10cm sin relación al número de mitosis ó mas de 10 mitosis/50 HPF sin relación al tamaño.3 Nuestra paciente fue clasificada como GIST de Bajo Riesgo.(Fig 4 y 5 )

Pueden diseminarse al hígado y a la cavidad abdominal. Son raras las metástasis a hueso, pulmón y ganglios linfaticos. En tejido celular subcutáneo de la pared abdominal pueden verse metástasis. Los GIST del intestino delgado tienden a comportarse mas agresivamente que los del estómago.7 La TAC y RMN se utilizan para determinar la extensión de la enfermedad.
El tratamiento curativo es el quirúrgico, con resección completa y márgenes libres. La linfadenectomia es innecesaria, ya que es muy raro la metástasis a ganglios linfáticos regionales. El Imatinib (Glivec,Novartis) es la droga de elección en pacientes con metastasis, GIST inoperable o recaidas.7
Nuestra paciente ha seguido una evolución satisfactoria, con buena calidad de vida, asintomática,con ultimo control en julio del 2005, luego de su Tratamiento Quirúrgico en Julio 2004, con excisión completa de la lesión.
REFERENCIAS BIBLIOGRAFÍCAS
1. Sandrasegaran K, et al. Gastrointestinal stromal tumors: clinical,radiologic and pathologic features. AJR 2005; 184:803. [ Links ]
2. D´Amato G, et al. Update on the biology and therapy of gastrointestinal stromal tumors. Cancer Control 2005; 12:44-56. [ Links ]
3. Nickl N. Gastrointestinal stromal tumors: new progress,new questions. Current opinion in Gastroenterology, 2004; 20:482-487. [ Links ]
4. Medeiros F, et al. Kit negative gastrointestinal stromal tumors: Proof of concept and therapeutic implications. Am J Surg Pathol 2004; 28:889-894. [ Links ]
5. Heinrich MC, et al. PDGFRA activating mutations in gastrointestinal stromal tumors. Science 2003; 299:708-710. [ Links ]
6. Hirota S. Review of pathophysiology on GIST: the role of inmunohistochemical staining and ckit mutational analysis. 6th International Gastric Cancer Congress. Yokohama Japan. Current status of the management of GIST. 2005 May 6, Symposium S9-2:4. [ Links ]
7. Chandu de Silva MV. Gastrointestinal stromal tumors(GIST). Orphanet encyclopedia 2005; Feb:1-6. [ Links ]
8. Xiu YS, et al. Gastrointestinal tumors: update. Arkh Patol 2004; 66:36-40. [ Links ]
9. De Mestier P. Treatment of gastrointestinal stromal tumors with Imatinib Mesylate: a major breakthrough in the understanding of tumor specific molecular characteristics. World J Surg 2005; Feb 10. [ Links ]
















