Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Gen
versión impresa ISSN 0016-3503versión On-line ISSN 2477-975X
Gen v.61 n.3 Caracas sep. 2007
Relación del factor de crecimiento insulina tipo I y la malnutrición en pacientes adultos con enfermedad hepática crónica compensada
Dres. Romero Gisela*, Camarillo Nathaly**, Anderson Hazle**, Bravo Alfonso**, Lizarzábal Maribel **.
*Servicio de Gastroenterología HUM. Venezuela. dragiselaromero@cantv.net
**Escuela de Nutrición y Dietética Facultad de Medicina LUZ. Venezuela.
RESUMEN
Los pacientes con hepatopatía crónica presentan malnutrición en grados variables. Uno de los factores implicados en la malnutrición es la deficiencia del factor de crecimiento insulina tipo I. Objetivo: determinar la relación del factor de crecimiento insulina I y la mal nutrición en pacientes con enfermedad hepática crónica compensada. Materiales y métodos: grupo A, formado por 31 pacientes con enfermedad hepática crónica Child Pugh A y grupo B, 16 controles sanos. A los pacientes se les realizó historia clínica, laboratorio, evaluación antropométrica y se determinó el FCI-1 por técnica de inmunoensayo enzimático. Se aplicó T student con el programa computarizado SPSS y un valor de p < 0,05 fue estadísticamente significativo. Resultados: grupo A: 31 pacientes con enfermedad hepática crónica alcohólica y no alcohólica edad entre 40 y 66 años; grupo B: control 16 sujetos en edades entre 30 y 62 años. En el grupo A se encontró un 41,94% de pacientes normales, 38,71% con sobrepeso, 12,9% con obesidad tipo 1 y 6,45% con déficit. En el grupo B todos los controles eran nutricionalmente sanos. El FCI-1 en el grupo A fue de 47+22ng/ml y en controles 79+33 ng/ml p < 0,05. Conclusión: los niveles sericos de F CI-1 son estadísticamente menores (p < 0,05) en pacientes con enfermedad hepática crónica compensada que en controles sanos, y parecen relacionarse con el grado de malnutrición.
Palabras clave: enfermedad hepática crónica, malnutrición, factor de crecimiento insulina tipo I.
SUMMARY
Patients with chronic liver disease have malnutrition in variable degrees. One of the factors implied in malnutrition is the deficiency of insulin growth factor type 1. Objective: to determine the relationship of insulin-like growth factor 1 and malnutrition in patients with compensated chronic liver disease. Materials and methods: group A: 31 patients with chronic liver disease Child Pugh A and group B: 16 healthy controls. The patients were submitted to a clinical history, laboratory, anthropometric evaluation and IGF-1 was determined by enzymatic immunoassay technique. T student was applied with the SPSS online program and a value of p < 0.05 was considered statistically significant. Results: group A: 31 patients with chronic liver disease, alcoholic and non alcoholic, ages between 40 and 66 years, group B: control 16 healthy individuals, with ages between 30 and 62 years. In group A 41.94% of patients were normal, 38.71% with overweight, 12.9% with obesity type 1 and 6.45% with deficit. In group B all the controls were healthy, nutritionally. IGF- 1 in group A was 47 + 22ng/ml and in controls 79 + 33ng/ml p < 0.05. Conclusion: The serum levels of IFG-1 are statistically lower (p< 0.05) in patients with compensated chronic liver disease than in healthy controls and they seem to be related with the malnutrition degree.
Keys words: Chronic liver disease, malnutrition, insulin growth factor -1.
Recibido Sep. 2006 Revisado Mar. 2007 Aceptado Jun. 2007
INTRODUCCIÓN
La cirrosis hepática constituyó la 12 causa de muerte en los Estados Unidos durante el año 2000(1,2); provocando más de 25.000 muertes. Se trata de un estado irreversible caracterizado por formación de nódulos y contracción del órgano (hígado de tamaño pequeño)(3). Las causas más frecuentes de cirrosis hepática son la hepatitis viral B y C crónicas y el alcoholismo, sin embargo, otras causas como trastornos congénitos, metabólicos, inflamatorios, inmunológicos, cardiovasculares y enfermedad hepática toxica, la pueden provocar(4).
La enfermedad hepática en su estadio final cursa con una serie de complicaciones tales como hipertensión portal, ascitis, encefalopatía, trastornos de síntesis y deterioro de la capacidad metabólica; estas dos últimas, son conducentes a malnutrición en grados variables(3). Se trata de una patología que conduce a una alta morbilidad y mortalidad. En nuestro medio, específicamente en la consulta de Clínica de Hígado del Hospital Universitario de Maracaibo, el 80% de los pacientes que consultan, presentan enfermedad crónica del hígado (predominantemente de etiología alcohólica) y el 60% de éstos muestran estado de descompensación, consultan por ascitis, infección del líquido ascitico, sangrado por várices esofagogástricas, encefalopatía y malnutrición proteico-calórica(3).
Es bien conocido que el paciente con hepatopatia crónica presenta malnutrición( 5). Factores tales como una inadecuada ingesta de nutrientes debido a anorexia, disgeusia, saciedad temprana, nauseas, vómito, uso de fármacos, restricciones alimentarías, alteraciones del proceso digestivo y de absorción, así como las dietas hospitalarias poco apetitosas, conllevan a serios problemas nutricionales en este grupo de pacientes(6).
Se ha demostrado que los pacientes zulianos con hepatopatía crónica de etiología alcohólica y no alcohólica, presentan malnutrición en un 70% y 90% respectivamente; entre el 66% y 70% de los sujetos estudiados presentaron sobrepeso y obesidad, y el 30%, aproximadamente, se encontró desnutrido(7). Loquercio y colaboradores, encontraron en pacientes con enfermedad hepática crónica malnutrición en un 50%-60%(7). La malnutrición varía de severidad en pacientes con cirrosis hepática y produce un impacto profundo y negativo sobre el pronóstico, influenciando la sobrevida a corto y largo plazo de estos pacientes(7). Los cirróticos malnutridos tienen una producción de energía muy baja, con una gran dependencia de oxidación de las grasas endógenas. El desgaste muscular se debe a un fallo en la síntesis proteica por parte del músculo, con una disminución del proceso de regresión proteica de todo el cuerpo(8).
Unos de los factores que pretende estar implicado en la malnutrición de los pacientes con enfermedad hepática crónica es el factor de crecimiento insulínico tipo 1 (insulin-like growth factor-1 --> IGF-1), que es un polipéptido de 70 aminoácidos cuyo peso molecular es de 7650 daltons, que forma parte de un grupo de factores de crecimiento parecidos a la insulina presentes en el cuerpo humano. La molécula presenta aproximadamente un 50 % de similitud en la secuencia de aminoácidos con la proinsulina, y tiene un número de funciones biológicas similares a las de la insulina. Aunque el péptido presenta una elevada dependencia de la hormona de crecimiento (GH), un número cada vez mayor de estudios informan de una secreción independiente de la GH(9,10).
El FCI-1 está implicado en mantener los niveles de glucosa en sangre, mejora marcadamente el balance nitrogenado y causa una conservación substancial del potasio urinario, logrado un balance nitrogenado positivo; su síntesis esta disminuída en caso de enfermedad hepática crónica o cirrosis hepática, lo cual pudiera contribuir a la severidad y progresión de la malnutrición de este tipo de pacientes. Trabajos de investigación sugieren que bajos niveles circulantes de este factor, pueden tener un papel en la patogénesis de la perdida muscular, que caracteriza la enfermedad hepática avanzada(9,10).
Debido a los diferentes problemas de tipo económicos, sociales, políticos, culturales y en educación que se presentan en nuestro país actualmente, se ha observado un incremento de enfermedad hepática crónica, de etiología alcohólica y por hepatitis viral B y C, cuya complicación más frecuente es la cirrosis hepática, la cual disminuye el funcionalismo hepático. Por lo tanto, se hizo necesaria la realización de este estudio, para conocer la relación del FCI-1 y datos antropométricos en este grupo de pacientes con hepatopatia crónica, ya que es importante hacer una intervención nutricional optima y adecuada debido a varias razones:
1.- La enfermedad hepática crónica es una entidad frecuente en nuestro medio que afecta predominantemente al sexo masculino en la etapa útil de su vida, entre los 45 y 55 años de edad.
2.- Se trata de una patología que conduce a una alta morbilidad y mortalidad, por lo que descubrir factores o condiciones que puedan interrumpir o prolongar el curso de la enfermedad es de gran significado clínico y epidemiológico.
3.-El factor de crecimiento Insulina tipo I es una proteína de síntesis hepática, implicada en procesos anabólicos del organismo tales como glucogénesis, crecimiento osteomuscular, captación de aminoácidos por las células órgano-blanco, entre muchas otras.
4.- Demostrar alguna relación entre niveles del FCI-I y la malnutrición en pacientes con enfermedad hepática crónica permitiría, según una línea de investigación, contribuir en el conocimiento de las bases moleculares y fisiopatología de la malnutrición en este tipo de patología del hígado, y porque no, más adelante aportar soluciones concretas para su prevención o control satisfactorio para la población.
Además de lo anteriormente descrito, la determinación de la evaluación antropométrica de estos sujetos permitiría tener un indicador de las reservas proteicas y calóricas del individuo(7,11-14). Las mediciones de talla, peso, y grosor del pliegue cutáneo reflejan el estado nutricional presente. La variable índice de masa corporal (IMC) presenta como ventaja con relación al peso, que sus variaciones no son afectadas por la talla, ya que son índices relativamente independientes de esta variable. El IMC explica las diferencias en la composición corporal, al definir el nivel adiposo con base en la relación entre el peso y la talla.
Dado que en Venezuela es muy poca la data publicada sobre la evaluación del estado nutricional en hepatopatias y no se tiene información sobre la misma en pacientes con cirrosis hepática, este estudio tuvo como objetivo determinar la relación del factor de crecimiento insulina tipo I y la malnutrición en pacientes adultos con esta patología.
MATERIALES Y MÉTODOS
Tipo de Investigación
Esta investigación fue prospectiva, de corte transversal de tipo correlacional, donde se evaluó la relación del factor de crecimiento insulina tipo I y la malnutrición en pacientes adultos con enfermedad hepática crónica que acudieron al Servicio de Gastroenterología del Servicio Autónomo Hospital Universitario de Maracaibo (G.S.A.H.U.M); la misma fue utilizada para proporcionar indicios de la relación que podría existir entre dos o más conceptos, categorías o variables, o de que manera uno o más datos podarían predecir un resultado especifico(15).
Población y muestra de estudio La población de estudio estuvo conformada por 31 pacientes con enfermedad hepática crónica, de etiología alcohólica y no alcohólica, la cual se seleccionó por muestreo intencional (12 pacientes de sexo femenino y 19 pacientes de sexo masculino), con enfermedad hepática crónica, con edades comprendidas entre los 18 y 71 años de edad. Se evaluaron, con propósitos comparativos, 16 individuos sanos (7 del sexo femenino y 9 del sexo masculino), en un rango de edad similares. Todos los individuos dieron su consentimiento para participar en el estudio luego de haber recibido una explicación completa del protocolo.
Criterios de inclusión
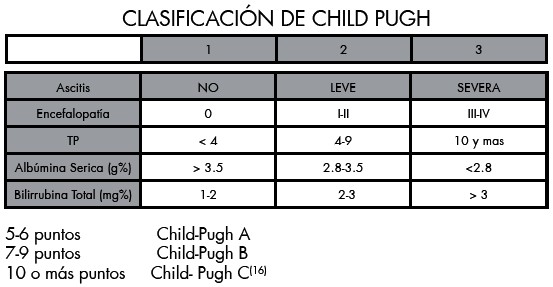
Se incluyeron aquellos pacientes con diagnostico de enfermedad hepática crónica por cualquier etiología, de acuerdo a criterios clínicos, bioquímicos, encontró en Child Pugh A.
Criterios de exclusión
Se excluyeron todos aquellos pacientes con enfermedad hepática crónica que habían recibido terapia nutricional, por lo menos en los últimos tres meses antes de ser incluidos en este estudio. Igualmente se excluyeron los pacientes con ascitis, edema, Child Pugh B y C, así como también pacientes con otras enfermedades no controladas, en crisis, pacientes con diarrea crónica, con VIH, cáncer, síndromes linfoproliferativo o enfermedades progresivas debilitantes.
Técnica de recolección de datos
La técnica de recolección de datos que se utilizó para la realización de la presente investigación fue la observación directa e indirecta, la cual se le aplico a 100 pacientes con enfermedad hepática crónica que acudieron a la consulta de Gastroenterología del Hospital Universitario de Maracaibo en el período entre enero y junio de 2005.
El instrumento utilizado para la recolección de la información fue el cuestionario o formulario, que permitió obtener una serie de datos que facilitaron la medición del comportamiento de las variables del estudio. La información contenida en el mencionado formulario fue tomada o recogida por el investigador del estudio. El mismo fue diseñado con preguntas cerradas, éstas fueron fáciles de codificar y preparar para su análisis. Así mismo, estas preguntas necesitaron un menor esfuerzo por parte de los consultados(15).
Aplicación de formulario
Luego de seleccionar a los sujetos que formaron parte de la muestra, se les aplicó el formulario establecido de acuerdo a los objetivos del estudio, que incluyó la información de interés como: identificación del paciente, antecedentes personales y familiares, datos sobre el examen físico, antropométricos, de laboratorio, ecograma abdominal, y datos sobre el tratamiento que recibió el paciente.
Selección de los pacientes: a la población evaluada se le aplicó los siguientes criterios de selección, que permitieron reducir la muestra a 31 sujetos:
Historia clínica
Los pacientes fueron evaluados clínicamente mediante la realización de la historia clínica y una base de datos, con la determinación del Child-Pugh.
Esta clasificación, combina criterios clínicos y de laboratorio para establecer el grado de reserva funcional hepática en pacientes con cirrosis. Esta clasificación es la que se sigue utilizando e nivel internacional para conocer la severidad del trastorno hepático. Dicha clasificación permitió seleccionar a los pacientes con menor severidad (CHILD - PUGH A).
Ecografía
Como criterio diagnóstico de enfermedad hepática, se les solicitó a todos los pacientes y controles, ultrasonido abdominal convencional para conocer las características del parénquima hepático, tamaño, diámetros de vena porta y vena esplénica y descartar presencia de lesión ocupante de espacio (LOE).
Examen de laboratorio
Para confirmar el diagnóstico clínico de enfermedad hepática crónica, a los pacientes seleccionados se les determinó hematológia completa, tiempo de protombina, proteínas totales, albúmina, AST, ALT, bilirrubina total y fraccionada, creatinina y glicemia.
Procedimiento
Se tomaron 15 cc de sangre venosa; 10 cc se procesaron en el laboratorio del Hospital Universitario de Maracaibo para determinar hematológica completa, tiempo de protombina (TP), proteínas totales, albúmina, AST, ALT, bilirrubina total y fraccionada, creatinina y glicemia. Los otros 5 cc se utilizaron para la determinación del factor de crecimiento insulina tipo I por l método Elisa, el cual se procesó en el Laboratorio de Investigación y Desarrollo de Nutrición y Dietética (LIDN) de la Facultad de Medicina.
Método para determinar el factor de crecimiento insulina tipo I Por técnicas de inmunoensayo, la cuantificación del FCI-1 fue de 3,5 horas en fase sólida, diseñado por Elisa para medir los cultivos celulares de FCII, niveles sericos y plasmáticos. Este inmunoensayo quantikina de FCI-1, contiene FCI-1 humano recombinante expresado por Echericha Coli y ha demostrado que hay una cuantificación exacta del factor recombinante. En los resultados obtenidos al usar el FCI-1 humano natural, se forma una línea curva o mejor dicho una curva lineal, que fue paralela a las curvas estándar obtenidas al usar los estándares de Kit-quantikina; estos resultados indicaron que el kit de FCI-1 quantikina pudo ser utilizado para determinar valores relativos para la expresión natural del FCI-(17).
Principio del ensayo
El ensayo, o esta prueba, implicó un sándwich cuantitativo de técnica de inmunoensayo enzimático. Un anticuerpo monoclonal específico para el FCI-I fue precubierto sobre un microplate, los estándares y muestras pretratadas fueron pipeteadas hacia las paredes y algún FCI-I presente se unió por anticuerpos inmovilizados después de lavado, las sustancias que no se unieron fueron lavadas. Se añadió a las paredes un anticuerpo policlonal de unión enzimático específico para el FCI-I y seguidamente se lavó para remover reactivos enzimáticos de anticuerpos no unidos. Se añadió a las paredes una solución bisustrato y se desarrolló un color en proporción a la cantidad de FCI-I unido en el paso inicial. El desarrollo del color se detuvo y la intensidad del mismo fue medida(18).
Procedimiento del ensayo
Los conjugados debieron permanecer de 2 a 8À C hasta el uso. Se sugirió mantener los reactivos y muestra a temperatura ambiente antes del uso. Así mismo, se recomendó que las muestras estándar y controles sean probados en duplicado.
1. Se prepararon todos los reactivos estándares de trabajos y muestras, éstos fueron dirigidos a las secciones previas.
2. Se removió el exceso del microplate del plato, retornando esto al pusch que contiene el paquete de disecante.
3. Se añadieron 150 ul del diluyente RD1-53 a cada pared.µ
4. Se añadieron 50 ul de estándar control o muestra por pared, se cubrió con cinta adhesiva, se incubó por 2 horas, de 2 a 8°C.
5. Se aspiró bien y se lavó. Se repitió el procedimiento 3 veces para un total de cuatro lavadas; se lavó con un búfer de lavado de 400 ul, una pipeta de multicanal, un dispensador de muchos folios o autolavado, se removió completamente el líquido de cada paso, ya que ésto es esencial para un buen procedimiento. Después del último lavado, se removió algún remanente o búfer de lavado o washbufer para aspirar o decantar, se vertió la placa para que quedara limpia y luego se limpió con papel higiénico.
6. Se añadieron 200 ul de FCI-I frío conjugado para cada pared, se cubrió con un nuevo adhesivo, luego se incubó por una hora a una temperatura de 2 a 8 °C.
7. Se repitió la aspiración y lavado hasta el paso N° 5.
8. Se añadieron 200 ul de solución de sustrato, se incubó por 30 minutos a temperatura ambiente y se protegió de la luz.
9. Se añadieron 50 ul de la solución para detener el proceso. El color de la pared cambió de azul a amarillo, si el color de pared hubiese sido gris o el cambio de color no hubiese parecido uniforme es porque el procedimiento no fue correcto.
10. Se determinó la densidad óptica de cada pared luego de 30 minutos al usar un set microplate de 450 manómetros. La longitud de onda fue disponible, lo cual permitió el uso del set 540 manómetros y 570 manómetros(17).
Cálculo de los resultados
El promedio de lectura duplicado para cada estándar, control y muestra estaba a nivel de un promedio de densidad óptica estándar cero, la densidad óptica para los estándares, versus la concentración de los estándares y manejo de la mejor curva. Los datos pudieron ser linearizados al usar un papel de logaritmo, barra logaritmo y pudo ser aplicado análisis de regresión para la transformación logarítmica, con el fin de determinar las concentraciones de FCI-I en cada muestra. Primero se halló el valor a absorbancia sobre el eje Y y estándar. Una línea horizontal para la curva estándar, en el punto de intersección se extendió una línea vertical al eje de las X y se leyeron las concentraciones correspondientes del factor. Las muestras séricas plasmáticas fueron pretratadas. La concentración leída para la curva estándar fue multiplicada por un factor de dilución igual a 100(18).
Evaluación antropométrica Para la evaluación antropométrica las medidas fueron las siguientes: peso, talla, perímetro del brazo, pliegue del tricep. Se tomaron las medidas a todos los sujetos del grupo de estudio y al grupo control (sin patología hepática).
Ningún paciente seleccionado presentaba ascitis o edema al momento de ingresar al estudio. Las mediciones antropométricas fueron realizadas por una persona previamente entrenada y estandarizada en antropometría.
A los pacientes seleccionados como muestra (grupo A) y al grupo control (grupo B), se les realizó la evaluación antropométrica, para ello se les tomó el peso, la talla, la circunferencia del brazo y el pliegue del triceps. El peso se tomó con una balanza de uso clínico de 0 a 140 Kg de capacidad (Healthometer), debidamente calibrada antes de practicar la medición en el individuo, quien fue pesado con la mínima cantidad de ropa posible.
El sujeto se coloco de pie en la parte media de la base de la balanza, en posición estable y sin apoyo; la lectura se efectuó con una precisión de 100 gramos.
La talla se midió con el tallímetro ubicado en la parte posterior de la balanza, colocando al individuo descalzo, de pie, con la espalda, glúteos, cabeza y talones pegados a la barra vertical del instrumento, los brazos colocados en forma relajada a los lados del cuerpo, con las palmas de las manos hacia dentro, el medidor se puso en contacto con la cabeza del sujeto, la barra deslizable y sobre esta una pesa de 1 Kg; se colocó la cabeza del sujeto en el plano de Frankfurt y se aplicó una ligera tracción hacia arriba sobre las mastoides y se le indicó al sujeto que inspirara y aspirara, al momento en que se efectuó la lectura(19-21).
El índice de masa corporal se determinó con la ecuación de Quetelet = (peso en kg / talla2 en m), utilizando como criterio las tablas de referencia desarrolladas con base en las encuestas nacionales de salud y nutrición de los Estados Unidos y adoptadas por la OMS para uso internacional(23-28), los cuales se basan en los siguientes puntos de corte: déficit severo(<16), déficit moderado (17,4 -16), déficit leve (17,5-18,4), normal (18,5 - 24,9), sobrepeso (25-29,9), obesidad I (30-34,9), obesidad II ( 35- 39,9 ) y obesidad III (> 40)(22).
Para la toma de la circunferencia media del brazo, se marcó el punto de medición, colocando el miembro superior del individuo flexionado, el antebrazo sobre el brazo en un ángulo de 90 grados. Se localizó el acromion y el olécranon, se marcaron estos puntos, y con la cinta métrica se identificó, en la línea posterior del brazo, el punto medio entre los dos puntos anatómicos de referencia. Sobre éste se hizo un marco con un lápiz dérmico. Se colocó al individuo con los brazos relajados a los lados del cuerpo pasando la cinta alrededor del brazo a nivel de la marca del punto medio antes descrito, cuidando de no apretar y que la cinta no se separe del brazo.
Para la toma del pliegue tricipital, la marca del punto donde se efectuó la medida es la misma que se definió para la circunferencia media del brazo. El individuo permaneció de pie con los brazos relajados a los lados del cuerpo, con las palmas de las manos hacia atrás. Se tomo un pliegue vertical, en la línea media posterior, a una distancia de 1 cm por encima de la marca del punto medio del brazo. Con ambas mediciones se calculó la CMB, el cual es un indicador importante del nivel deficitario de proteínas somáticas, dicho cálculo se realizó según la siguiente formula:
CMB = CB (cm) - 3.14 x Ptr (mm)(20-21, 23-27).
En cuanto al área grasa (AG), se utilizó la siguiente formula para su cálculo:
AG = PT (CMB) dividido entre 2, restándole 3,14 (Ptr)-, dividido entre 4(27). El área muscular (AM), se calculó a través de la siguiente formula:
AM=(CMB-(3,14 x Ptr ) )- dividido entre 12,5664 15. Los puntos de cortes correspondieron a los siguientes: reserva calórica o proteica normal, cuando el valor observado se encontró entre el percentil 90 y el 10. Reserva calórica o proteica baja, cuando fue menor que el percentil 10 y mayor que el percentil
5. Reserva calórica o proteica muy baja, cuando el valor fue menor que el percentil 5 y reserva calórica alta, cuando el valor fue mayor que el percentil 90(28).
Análisis estadístico
Los resultados obtenidos fueron expresados en valores absolutos, cifras porcentuales o como el promedio + desviación estándar, cuando fue aplicable.
Para establecer diferencias entre los promedios de las variables estudiadas en los grupos de pacientes con enfermedad hepática crónica y el grupo control, se utilizo la prueba "t" de Student a través del programa computarizado SPSS (versión 10.0 para Windows), considerando un valor de p<0,05 como estadísticamente significativo. Los niveles séricos del factor de crecimiento insulina tipo I fueron relacionados con los valores del estado nutricional, determinados con la evaluación antropométrica, empleando el coeficiente de correlación de Pearson (r).
RESULTADOS
El presente estudio estuvo conformado por 31 pacientes con enfermedad hepática crónica de etiología alcohólica y no alcohólica con edades comprendidas entre 40 y 66 años de edad y el grupo control estuvo conformado por 16 pacientes con edades entre 30 y 62 años de edad (tabla 1).
En esta tabla, se presentan las características antropométricas de los sujetos estudiados. No se encontraron diferencias significativas entre ambos grupos con respecto a la edad, el peso y la talla; a diferencia de la circunferencia del brazo, el pliegue del tricep, el índice de masa corporal y circunferencia muscular del brazo, donde sí se hallaron diferencias significativas (p<0,05).
En la tabla 2 se muestra la distribución del diagnóstico nutricional antropométrico en pacientes con enfermedad hepática crónica y controles, donde se observa que se encontraron 13 pacientes con enfermedad hepática crónica en estado nutricional normal (41,94 %), 12 pacientes con sobrepeso (38,71%), 4 pacientes con obesidad tipo I (12,90%), 2 pacientes en déficit (6,45%); los 16 individuos sanos o controles, presentaron estado nutricional normal (100%).
La Tabla 3 presenta los niveles séricos del factor de crecimiento insulina tipo I (IGF-I) en los pacientes con hepatopatía y controles, donde se encontraron significativamente disminuidos los niveles séricos del FCI-I en los pacientes con hepatopatía (47 + 22 ng/ml), en comparación con los controles (79 + 33 ng/ml) (p<0.05).
La Tabla 4 presenta los niveles séricos del factor de crecimiento insulina tipo I (FCI-I) distribuidos según el diagnostico nutricional antropométrico. Los resultados demostraron variaciones en los niveles de FCI-I en ambos grupos, lo cual se debe a diferencias entre los diagnósticos nutricionales antropométricos (p<0,05). Sin embargo, se encontró que los niveles del FCI-I se hallaron significativamente disminuidos en los pacientes con hepatopatía y sobrepeso (41 + 17 ng/ml) en comparación con los controles normales (79 +33 ng/ml) (p<0.05). No se encontraron diferencias significativas dentro del grupo de pacientes con hepatopatía para los niveles del IGF-I en relación al diagnostico nutricional antropométrico. Los pacientes con estado nutricional normal presentaron niveles séricos del factor en (55 + 28 ng/ml), con sobrepeso (41 + 17 ng/ml), obesidad tipo I (45 + 14 ng/ml) y los pacientes con déficit presentaron el nivel sérico del FCI-I en (31+ 3 ng/ml).
a,b,c,d Valores con letras iguales son estadísticamente significativos según la prueba de Tukey (p<0,05).
DISCUSIÓN
La cirrosis hepática puede servir de ejemplo de enfermedad compleja, tanto en su etiología como en su espectro de manifestaciones, en la que la elección de un mecanismo patogénico concreto y relevante sobre el cual actuar permite generar un tratamiento útil. En este sentido, los resultados obtenidos en el presente trabajo evidenciaron que los pacientes con hepatopatia crónica con Child Pugh A, presentaron algún grado de malnutrición y descenso significativo del FCI-1. El hígado es una glándula de secreción interna y el principal productor del IGF-1. Esta hormona tiene unas potentes acciones anabolizantes y despliega una variedad de efectos biológicos en el organismo(28).
Con relación a las características de los pacientes y controles, no hubo diferencias estadísticamente significativas en cuanto a la edad, peso, talla; sin embargo, hubo diferencias significativas en datos antropométricos tales como: CB, PTr, IMC y CMB. Con una P<0,05. El IMC y la CMB fueron superiores en pacientes con respecto a los controles sanos, mientras que el pliegue tricipital fue menor en los pacientes con hepatopatia crónica. Resultados similares confirman que estos pacientes presentaron en un 90% malnutrición, entre el 60% y 70% presentan sobrepeso y obesidad efectivamente y un 30% estaban desnutridos(7). Lolly y colaboradores han demostrado que el porcentaje de malnutrición en pacientes con enfermedad hepática crónica, descompensados es alta(29).En nuestra investigación se encontró que el 51,61% de los sujetos con hepatopatía crónica presentaron malnutrición por exceso y el 6,45% presentaron malnutrición por déficit.
Los niveles séricos del factor de crecimiento-1 semejante a la insulina (IGF-I), son estadísticamente menores: < P 0,05 en pacientes con enfermedad hepática crónica compensados, Child Pugh A 47 + 22 vs 79 + 33 de los controles, dando como resultado diferencia significativa entre ambos grupos. Este hallazgo ha sido demostrado previamente por otros autores, quienes encontraron que los pacientes cirróticos compensados y descompensados presentaban disminución de la proteína 3 que se liga al IGF-1, el complejo ternario de 150 K-Da o subunidad ácido labil (ALS), así como el IGF-1, y que los niveles de complejo ternario se correlacionaron negativamente con la clasificación del Child Pugh(28).
Así mismo, en este trabajo se observó que los pacientes se encontraban con buena reserva funcional hepática a juzgar por el Child Pugh A, sin embargo, presentaban muy bajos niveles de IGF-1. Cuando se realizó la correlación de IGF-1 con el diagnóstico nutricional antropométrico, se destacó el hecho de que la condición de ser portador de enfermedad hepática crónica es suficiente para disminuir dicho factor. Aun encontrándose el paciente en estado nutricional normal, según los datos antropométricos, el IGF-1 se encontraba disminuido y se observó que mientras mayor es el grado de malnutrición (desnutrición, sobrepeso y obesidad tipo I), los niveles séricos de IGF-1 son menores, hallazgo éste que no había sido demostrado por otros autores.
Dado que el 51,6 % de los sujetos presentaron sobrepeso y obesidad, es importante considerar que las actividades tipo insulina de la IGF-1 son: transporte intracelular de glucosa, formación de glucógeno a nivel de las fibras musculares esqueléticas, captación de glucosa y producción de ácido láctico en fibras cardíacas; actividades mitogénicas en cultivos de tejidos, lipogénesis, disminución de ácidos grasos esterificados en suero, reducción en forma prolongada de la glucemia, funciones que se verían afectados por la disminución del IGF-1. Por otra parte, es importante considerar que la principal acción de la somatomedina (STH) es promover el crecimiento somático. Sobre los huesos largos provoca el crecimiento longitudinal actuando sobre el cartílago de crecimiento siendo su acción sobre éste dual.
Por una parte, la STH inicia la replicación de los condrocitos, los cuales, en su proceso madurativo, segregan IGF-I y al mismo tiempo desarrollan los receptores para este factor de crecimiento. El crecimiento óseo es, por tanto, una acción desencadenada por la STH, pero luego conducido por el binomio STH más IGF-1. En los tejidos periféricos, gran parte de las acciones de la STH son mediadas por el IGF-I, y este factor de crecimiento, que es producido por el hígado tras el estímulo de la STH, circula en el plasma unido a diferentes tipos de proteínas transportadoras o IGF-BP. En el tejido muscular la STH promueve la incorporación de aminoácidos y la síntesis proteica, siendo por tanto anabólica y trófica sobre este tejido (28).
Recientemente, tras la disponibilidad en cantidades ilimitadas de STH por bioingeniería, se ha comunicado que esta hormona tiene propiedades de nuevo tipo con relevancia clínica. En concreto, promueve la regeneración tisular en quemados o traumatizados, incrementa la eficacia del sistema inmunitario y tiene acciones tróficas sobre las gónadas. Dado que los sujetos estudiados en esta investigación presentaron niveles bajos de IGF-1, ello podría implicar un gran riesgo para presentar en el futuro la osteoporosis observada en esta enfermedad, asimismo podría explicarse la depleción de masa muscular observada en estos pacientes en etapas avanzadas.
Finalmente, los niveles del factor de crecimiento similar a la insulina (IGF 1) también se encuentran disminuidos por el envejecimiento, tomando en cuenta que gran parte de la población estudiada en esta investigación era mayor de 50 años, se ha sugerido como una causa de pérdida de masa muscular propia del envejecimiento, lo cual, asociado a la hepatopatía, implicaría una mayor depleción(28).
CONCLUSIONES
1. La evaluación antropométrica determinó que no existen diferencias significativas en cuanto al peso y la talla, entre los pacientes y los controles, y determino diferencias significativas en cuanto a la circunferencia muscular del brazo (CMB) y el índice de masa corporal (IMC), entre ambos grupos.
2. Los niveles séricos del factor de crecimiento insulina tipo I (FCI-I) se encontraron en mayor concentración en los controles que en los pacientes con enfermedad hepática crónica.
3. La cronicidad de la enfermedad hepática parece determinar la disminución del IGF-1.
4. Mientras mayor es el grado de malnutrición por déficit o por exceso en pacientes con enfermedad hepática crónica, menores son los niveles del IGF-1.
5. Los pacientes con enfermedad hepática crónica con Child Pug A, presentan disminución de los niveles séricos de IGF-1.
6. El IGF-1 pudiera ser un indicador temprano de malnutrición en pacientes con enfermedad hepática crónica compensada, lo que pudiera sugerir una intervención nutricional oportuna y adecuada que permita interrumpir la historia natural de la enfermedad hepática.
RECOMENDACIONES
1.- Para futuras investigaciones es recomendable, crear estándares donde el factor de crecimiento tipo I (FCI-I) sea utilizado como preventivo de la malnutrición.
2.- Utilizar niveles séricos del FCI-I como indicador de estado nutricional.
3.-Para investigaciones futuras se recomienda determinar el factor de crecimiento insulina tipo I (FCI-I), en pacientes con enfermedad hepática crónica descompensados
REFERENCIAS BIBLIOGRÁFICAS
1.- Rawen R, Zetternan, Foutch Gregory, et al. Alcohol liver disease: Annua Post Graduate Course. American College of Gastroenterology 1997; 383-396. [ Links ]
2.- Anderson, P. The risk of alcohol addiction: PubMed. National Library of Medicine 1993; 88(11): 1493-1508. [ Links ]
3.- Bien Th, Miller W.R, Tonigan J.S. Brief intervections for alcohol problems: A reviea. addiction. 1993; 88: 315-336. [ Links ]
4.- National Institute on alcohol abuse and alcoholism. Special focus issue: Alcoholismo aprenda la realidad. Alcohol health and research world 1997; NÀ 97: 4153-S. [ Links ]
5.- Arthur J. Mc Cullough. Alcoholic Liver Diseases. Chapter 10, SCHIFFÊS Diseases of the liver. Eighth Edition. Volumen two. Lippincott Willians Wikins, 1999; Pág. 941- 971. [ Links ]
6.- Voet D, Voet J. Biochemistry. Wiley & Son Inc. New York, 1990; 737-750. [ Links ]
7.- Loguercio C, Sava E, Marmo R, Del Vecchio Blanco C, Coltorti M. Malnutrition in cirrhotic patients: anthropometric measurements as a method of assessing nutritional status. Br J Clin Pract 1990; 44 (3): 98-101. [ Links ]
8.- Sherlock Sheila, Dooley James. Enfermedades del Hígado y Vías Biliares. Novena edición. Marban. 357, 360-363, 366,408. [ Links ]
9.- Carolin A, Boundy, Louis E, Underwood David R, Clemmons, Hans-Peter Guler, Mark A, Bach, And Monica Skarulis. Clinical Uses of insulin-like Growth Factor I. Annals of Internal Medicine 1994; 120 ( 7): 593-601. [ Links ]
10.- Siciliano M, et al. Insulin-Like Growth factor-I (IGF-I) and handgrjo in liver cirrhosis hepatology 1999; 30(4): 2. [ Links ]
11.- Venegas Tresierra L.F, Holguin Marin R, Yoza Yoshidaira M, Mormontoy Lauret W, Jara Cubas T, Polo Ramirez C, Vega Caico I. Evaluation and nutritional therapy in cirrhotic patients of the "Edgardo Rebagliati Martins" hospital: Perú. Rev Gastroenterol 2002; 22 (1): 13-8. [Disponible: http://www.socgastro.org.pe/biblioteca/revista/vol22n1/trabajos/trabajos_1.asp] [ Links ]
12.- Nutritional status in cirrhosis. Italian Multicentre Cooperative Project on nutrition in Liver Cirrhosis. J Hepatol 1994 Sep; 21(3): 317-25. [ Links ]
13.- Loguercio C, Sava E, Sicolo P, Castellano I, Narciso O. Nutritional status and survival of patients with liver cirrosis: anthropometric evaluation. Minerva Gastroenterol Dietol 1996; 42 (2): 57-60. [ Links ]
14.- Madden A.M, Morgan M.A. Comparison of skinfold anthropometry and bioelectrical impedance analysis for measuring percentage body fat in patients with cirrhosis. J Hepatol 1994; 21 (5):878- 83. [ Links ]
15.- Sampieri Hernández R; Collado Fernández C; Baptista Lucio P. Metodología de la Investigación. 3ra. edición. 121-122,396. [ Links ]
16.- Handerson J. Michael. Surgical Management of Portal Hypertension. Chapter 12. SCHIFFÊS diseases of the liver. Eighth Edition. Vol. one. Lippincott Willians Wikins 1999; 444-458. [ Links ]
17.- R&D Systems. A guide for the use of antibodies in ELIZA development. Pág. 4. [Disponible: www.RnDSystems.com] [ Links ]
18.- R&D System. Quantiquine. Human IGF-I Immunoassay. [ Links ]
19.- Kathleen L; Mahan; Escott-Stump S. Nutrición y Dietoterapia de Krause. Décima edición. Mc Graw Hill Interamericana. 386, 400, 404,754. [ Links ]
20.- Hernández Y. Manual para simplificar la Evaluación Antropométrica en Adulto. 1995; 1-10. [ Links ]
21.- Frisancho A.R. Gráficos y Tablas para la Evaluación Nutricional: Parámetros de Referencia. New norms of upper fat and muscle areas for assessment of nutritional status. Ann J Clin Nutr 1981; 34: 2504-2445. [ Links ]
22.- Organización Mundial de la Salud - O.M.S. 1998. [ Links ]
23.- Ball MM, Carlin C, Robuck J. Nutrition assessment. Nutrition in Diet therapy, 1:3, C.V; Mosby Company, 1988. [ Links ]
24.- Baker JP, Detcky AS, Wilson DE, Wolman SL, Stewart S, White-well RN, Langer B, Jeejeebhoy KN. A comparison of the predictive value of nutritional assessment techniques. Human Nutrition: Clinical Nutrition 1982; 36C: 223:241. [ Links ]
25.- Barrocas A, Webb GL, Webb WB et al. Nutritional considerations in the critically ill. South Med J 1982; 75(7):848. [ Links ]
26.- Blackbun GL, Harvey KB. Nutritional assessment as a routine in clinical medicine, Posgrad. Med. 1982; 71(5):46. [ Links ]
27.- Chistensen Ks, Gstundtner KM. Hospital-wide screening improves basis for nutrition intervention. J Ame Diet Assoc 1985; 85 (6): 704. [ Links ]
28.- Lone Harild Ottesen, Flemming Bendtsen, Allan Flyvbjerg. The insulin-like growth factor binding protein 3 ternary complex is reduce in cirrhosis. Department of Hepatology V and Center for Clinical. 2001; 21(5):350. [ Links ]
29.- Lolly R, Marchesini G, Bianchi G, Fabbri A, Bugianesi E, Zoli M, Pisi E. Antropometric assess of the nutricional status of patients with liver cirrhosis in an Italian population. Ital J Gastroentrol 1992Oct; 24(8):429-35. [ Links ]



















