Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Gen
versión impresa ISSN 0016-3503versión On-line ISSN 2477-975X
Gen v.65 n.1 Caracas ene. 2011
CLASIFICACIÓN DE LOS PÓLIPOS DE
Dra. Nilda Bastos
Gastroenterólogo Clínica Las Ciencias. Sistemas Integrales de Salud (SISCA) y Servicio Diagnóstico de Atención Primaria (Servidiap).
RESUMEN
El sistema Imagen de Banda Angosta (IBA) es un nuevo desarrollo tecnológico, con filtro óptico anterior a la lámpara de xenón, emite dos rangos de longitud de onda que son azul de 415nm y verde 540nm que son dos rangos con picos de captación por la hemoglobina. Objetivo: Evaluar la utilidad predictiva, del sistema de imágenes de banda angosta para el diagnóstico de lesiones polipoideas (neoplásicas o no neoplásicas) en la mucosa del colon y/o recto, durante el estudio colonoscópico. Materiales y Métodos: Se realiza un estudio prospectivo, descriptivo y comparativo, con los pacientes evaluados en el Servicio de Gastroenterología del Hospital Oncológico Padre Machado, desde Marzo a Noviembre del 2007. Se realiza un muestreo intencional no probabilístico. Fueron analizados 39 pólipos colorectales, se observaron con aumento y sistema IBA, se anotó la morfología de los vasos y el patrón críptico, luego fueron resecados y analizados histológicamente, estimando la capacidad de este sistema para clasificar las lesiones polipoideas. Resultados: Los datos obtenidos del patrón críptico con IBA aumento e histología fue de un 100% para los tipos I y II y un 92% para los tipos IIIL, IV y VN. Este sistema demostró buenos resultados para identificar los detalles morfológicos que se correlaciona bien con la histología de los pólipos para clasificar los pólipos colorectales y diferenciar lesiones neoplásicas y no neoplásicas. Conclusión: El sistema IBA es una herramienta óptica de grandes proyecciones en nuestros estudios endoscópicos, tanto diagnósticos como terapéuticos, el cual provee imágenes con características adicionales a las de la endoscopia convencional y la cromoendoscopia.
SUMMARY
The Narrow Band Image system (NBI) is a new technological development, with previus optic filter to the lamp of xenon, emits two wave length ranks that are blue of 415nm and green 540nm that are two ranks with peaks of colleting by the hemoglobin. Objetive: To evaluate the utility predictive, of the narrow band images system for the diagnosis of wounds polypoid (neoplasics or not neoplasics) in the mucous membrane of the colon and/or straight, during the colonoscopic study. Material and Methods: A comparative, descriptive, and prospective study is carried out, with the patients evaluated in the Gastroenterology Service of the
INTRODUCCIÓN
La evidencia clínica sostiene que cerca del 95% de los cánceres colorectales, surgen de adenomas que se desarrollan y crecen muy lentamente durante muchos años por la secuencia adenoma-carcinoma. La interrupción de esta secuencia por la detección y posterior extracción de lesiones neoplásicas colorectales, incluyendo adenomas y cáncer precoz, reduce la incidencia del cáncer colorectal, por lo que la resección de los pólipos es un buen método de prevención secundaria de esta patología, ya que los canceres colorectales constituyen la segunda causa de muerte por cáncer en los Estados Unidos, (contabilizando casi 60.000 muertes por año). En Japón; es la cuarta causa de muerte en hombres; y la quinta causa en mujeres(1, 2); y en Venezuela es la cuarta causa de cáncer en hombres (tasa cruda (TCR) de 7,60 por 100.000 varones) y la tercera causa de cáncer en mujeres (TCR de 8,33 por 100.000 mujeres) (2004)(3).
La colonoscopia cumple un pilar fundamental en la pesquisa y resección de pólipos. Constituye el método más importante para la prevención del cáncer colorectal. La polipectomía en-doscopica es considerada el procedimiento de elección para el diagnóstico y tratamiento de los pólipos colorectales, ocupan-do los adenomas un 70% a 80% de todos los pólipos colorec-tales, por lo que su incidencia puede reducirse hasta en un 90% con este método(4).
Durante la colonoscopia se ha reportado que del 10% al 30% de los pólipos son lesiones no neoplásicas, por lo que no necesitan ser resecadas; la distinción de dichas lesiones durante la exploración (en neoplásicas y no neoplásicas) puede aumentar la eficacia del tratamiento al reducir el tiempo y costo de polipectomías innecesarias, asociado a riesgos de perforación y sangrado, estimada en un 0,4 - 0,7% de los casos, una complicación que se estima nada despreciable. Además, la existencia de adenomas pequeños o planos, con alto grado de displasia, incrementa la importancia de detección y extracción de estas pequeñas lesiones(5).
El sistema de Imágenes de Banda Angosta (IBA), es una de las más recientes técnicas de video-endoscopia electrónica, que hace más nítida la imagen endoscópica, a la que se ha denominado tinción electrónica, ya que aumenta la visibilidad de los microvasos y otras estructuras de la superficie de la mucosa. Se comenzó a desarrollar en 1999 y el primer reporte de su eficacia para el uso en el tracto gastrointestinal, fue publicado en el año 2001(6). Fue creada por Olympus Medical Systems, y desarrollada en el National Cáncer Center en Japón por los Drs. Gono K. y Sano Y. en el año 2001, con un procesador CV240 y una fuente de iluminación CLV-U40, con la finalidad de mejorar la exactitud del diagnóstico a través de un procesamiento de imagen y tecnología digital. Inicialmente en el desarrollo de esta técnica de NBI, el primer prototipo poseía tres bandas o filtros del color rojo, verde y azul (RGB) de iluminación secuencial 415-30nm, 445-30nm, y 500-30nm por la facilidad de integrar 3 coladores de NBI con el filtro giratorio de RGB del sistema secuencial, el actual NBI disponible se reduce a dos bandas la iluminación de tejido del color azul (415 nm) y el verde, (540 nm) espectro del haz de luz; dando como resultado diferentes niveles de imagen de la mucosa, que solo penetra la capa superficial del colon. La luz con estos determinados valores de longitud de onda azul y verde son específicamente absorbidas por la hemoglobina. El haz azul presenta poca penetración en los tejidos limitado a la mucosa y por ser un pico de luz absorbido por la hemoglobina los capilares de la mucosa superficial se muestran en marrón. El haz de luz verde penetrante más profundamente y corresponde a un máximo pico de absorción de hemoglobina secundario y por ende los vasos mas profundos de la submucosa son visible se observan de color sepia(6, 7, 14, 15,16). Además, puede ser combinado con magnificación o aumento endoscópico, para caracterizar la superficie de los capilares finos y los diferentes tipos de epitelio de la mucosa del tracto gastrointestinal, permitiéndonos así identificar neoplasias. La utilidad clínica del IBA es la observación de detalles endoscópicos que nos orienta hacia el diagnóstico de carcinomas; como por ejemplo, lesiones elevadas, haciendo el diagnóstico diferencial entre lesiones neoplásicas y no neoplásicas, con imagen en tiempo real durante la colonoscopia, sin necesidad de tinciones, por ser un sistema de magnificación y evaluación cromoendoscópica virtual o tinción electrónica(6,7).
La angiogénesis es fundamental para la transición de lesiones premalignas a un estado hiperproliferativo para la malignización. Por lo tanto el diagnóstico basado en la angiogénesis o cambios en la morfología vascular puede ser ideal para la detección precoz o el diagnóstico de neoplasias(17), por lo que, los cambios morfológicos de los microvasos han sido reconocidos como un nuevo pilar en el diagnóstico del cáncer.
Se reconocen cambios progresivos en la morfología de los capilares: dilatación, tortuosidad y cambios en el calibre de los vasos. Estas alteraciones revelan además etapas evolutivas del avance de las lesiones neoplásicas al correlacionarse con la angiogénesis y probablemente con cambios genéticos subyacentes. (Figura 1)(14)
El sistema de IBA, puede potencialmente reducir los riesgos, costos y tiempo al no hacer polipectomías innecesarias a lesiones no neoplásicas. Este sistema es usualmente combi-nado con endoscopio de magnificación y alta resolución(11,13).
La magnifición colonoscopica es una técnica que hace posible la observación detallada de la mucosa colónica y las criptas, con sus alteraciones, aumentando la imagen hasta 100x con alta resolución, para mejorar la visualización de un epitelio normal o anormal para así, predecir el diagnóstico(18). Los endoscopios de magnificación utilizan un sistema de interposición de microlentes, (similar a los lentes de un microscopio), produciendo un aumento de la señal luminosa captada por la unidad electrónica. Existen varios modelos e incluyen un mecanismo de enfoque en el mando del endoscopio que permiten una visión estándar o con magnificación. Estos aparatos permiten la visión endoscópica convencional, y de hecho es en este modo en el que se realiza la exploración, cuando se detecta una lesión sospechosa, es cuando posterior al uso de IBA o cromoendoscopia, se aplica la magnificación, a través de movimientos mecánicos de lentes, que son controlados por palancas, pedales electrónicos o discos sobre los mandos del colonoscopio(5) generalmente accionando un mando en los controles del endoscopio(13). Para predecir el diagnóstico histológico de pólipos colónicos, mediante la observación de las aperturas de las criptas colónicas según la clasificación de Kudo; distinguir lesiones neoplásicas y no neoplásicas; evaluar la profundidad de invasión de un carcinoma colorectal precoz y detectar pequeños residuos de tumor después de la resección mucosal endoscópica. Adicionalmente, recientes estudios han analizado el papel de la alta magnificación endoscópica (HMC) para valorar la actividad y detectar neoplasias en colitis ulcerativa(16). Además se ha dirigido la aplicación a identificar criptas aberrantes, el cual se cree que son precursores de adenomas y cáncer.
La alta resolución endoscópica involucra un aumento de ampliación hasta de 1.5 X, un incremento de píxel por ejemplo ≥400.000 versus 100.000 o 200.000 para los primeros videoendoscopicos y una cámara electrónica de mayor velocidad.
Varios investigadores han combinado la magnificación colonoscopica y el sistema de IBA para diferenciar los tipos de pólipos, así Kudo et. Al, clasificaron la diferencia morfológica de los pólipos en cinco patrones crípticos.
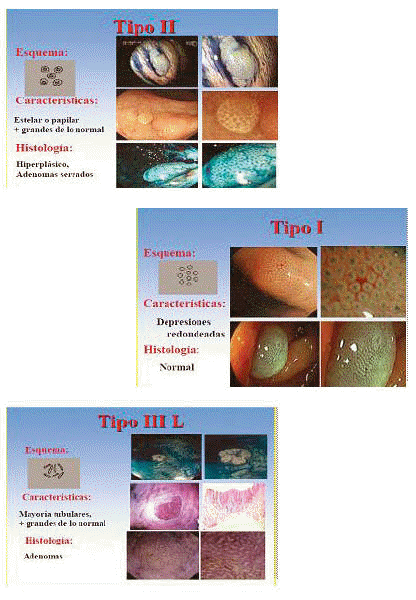
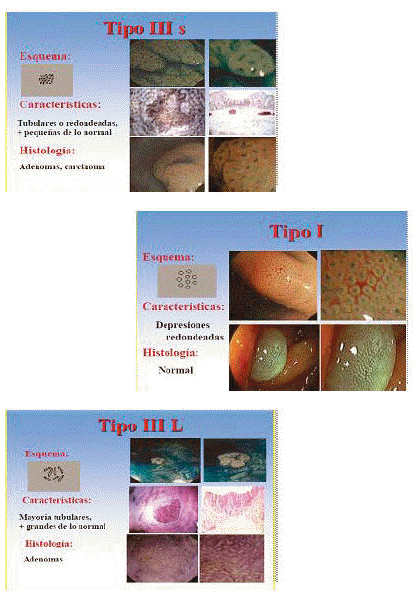
La clasificación de Kudo basado en los modelos de criptas colónicas, clasifica a los pólipos y los diferencia en neoplásicos y no neoplásicos, según la morfología de las criptas y el tamaño del orificio, empleando el sistema de IBA o cromoendoscopia con magnificación en:
I. Patrón de cripta normal, con glándulas no ramificadas y con orificios circulares dispuestos a intervalos regulares, cuya medida es de 0,07±0,02μm.
II. Criptas en forma de cruz o estrella, ordenada en forma circular, morfológicamente similar a la mucosa normal. Este patrón corresponde a las criptas de Lieberkun, más grandes que las normales, típicas de lesiones hiperplásicas, con una medida de 0,09±0,02μm.
IIIL. Criptas alargadas, más grandes que las normales, circulares, con surcos, presentes en adenomas, que miden 0,22±0,09μm.
IIIS. Criptas pequeñas, dispuestas de manera compacta, típicas de lesiones deprimidas, suelen asociarse a displasia severa o carcinoma in situ. Miden 0,03±0,01μm.
IV. Combinan glándulas neoplásicas ramificadas con criptas tortuosas, largas, frecuentes en lesiones con componente velloso. 0,93± 0, 32μm
V. Glándulas desestructuradas, desorganizadas, rodeadas de tejido adenomatoso e inflamatorio que sugieren invasión(16).
El significado clínico del diagnóstico de patrón críptico de las lesiones en el colón y recto, es realizar el diagnóstico diferencial entre lesiones neoplásicas y no neoplásicas, diagnosticar el grado de la displasia de un tumor, la profundidad de invasión de carcinomas precoces, precisar persistencia de lesión residual, después de una resección endoscópica, estimar el grado de inflamación histológica en colitis ulcerativa y el diagnóstico de displasia/colitis asociado a carcinomas en colitis ulcerativa(20).
En algunos centros terciarios de Japón, el diagnóstico por los patrones crípticos es rutinario durante la colonoscopia. Figura (2)(15).
Bases de la arquitectura microvascular de lesiones colorectales:
Mucosa colonica normal: La red capilar de la mucosa, está configurada en forma de patrón críptico en la glándula de la mucosa, conformada por arteriolas y capilares subepiteliales que drenan por venas que se unen y forman las venas submucosas. El diámetro de los vasos es de 8.6 ± 1.8 μm a 12.4 ± 1.9 μm (rango de 6.4-20.9 μm). Esta red capilar se observa a lo largo de todo el intestino grueso, desde el ciego hasta el recto(17).
Pólipos hiperplásicos: Aunque tenemos conocimiento, sobre el significado de la angiogénesis tumoral y la base molecular de la formación de los vasos sanguíneos en los carcinomas del colon y recto, no existe información para los pólipos hiperplásicos. Es conocido que, el espesor del microvaso intratumoral, es mayor que en los pólipos hiperplásicos, y así mismo, mayor que en la mucosa normal, pero el diámetro del vaso en los pólipos hiperplásicos no es relevante en comparación con la mucosa normal(17).
Adenomas: En los adenomas pequeños, menores de 3mm de diámetro, la organización microvascular es similar al colón normal. La red capilar es proporcionada por las arteriolas y los capilares de la submucosa que drenan en las vénulas, únicamente en el revestimiento luminal. La red de los capilares en la superficie tumoral está conservada. La mayor diferencia con la mucosa normal, se basa en un alargamiento de los capilares y vénulas y un moderado incremento del diámetro microvascular, cuya medida es de 13.1 ± 3,3μm.
Los adenomas mayores de 3mm de diámetro, proveen una elongación de los microvasos. La estructura microvascular de los adenomas, tienen una organización similar al de los vasos normales, pero es adaptado a la configuración del adenoma(17).
Carcinomas: La microvasculatura de los carcinomas colónicos está caracterizada por una desorganización estructural y un marcado aumento de la densidad. Sin embargo, frecuentemente la proliferación de los vasos dentro de los tumores, resulta del incremento del número y espesor de los microvasos entre las células tumorales y una desorganización de la estructura vascular. El diámetro del vaso es reportado en 18.3 ± 0.1μm a 19.8 ± 7.6 μm (rango: 2.2 - 84.5 μm)(17) (Figura 3).
Sistema de imágenes de banda angosta (IBA).
Nuevo prototipo:
A la red capilar de la mucosa configurada con patrón de criptas alrededor de las glándulas de la mucosa se le llama red capilar (meshed capillary) y se clasifican, usando el colo-noscopio de IBA con magnificación identificando tres tipos de patrón capilar (capillary pattern) (PC): tipo I, II y III, describiéndose a continuación.
Mucosa colónica normal (PC: tipo I): Durante la realización de una colonoscopia, usando el sistema de imágen de banda angosta (IBA) sin magnificación, las vasos y capilares gruesos y los capilares finos toman coloración marrón. La red vascular de la mucosa es visualizada con un detalle más fino con el colonoscopio IBA en comparación al estándar. Sin embargo, la observación magnificada, de la red capilar de la mucosa, esta configurada por un patrón críptico invisible o discreta-mente visible, porque la resolución endoscópica no es lo sufi-cientemente alta para visualizar esta trama vascular(17).
Pólipos Hiperplásicos (PC: tipo I): La mayoría de los pólipos hiperplásicos pueden ser vistos como ligeras lesiones mar-rones sin neovasculatura en el colonoscopio de IBA. Los patrones crípticos tipo II de Kudo pueden ser vistos con la observación magnificada usando IBA sin medios de tinción. En muchos casos la red de capilares es invisible o ligeramente visible con el empleo de colonoscopio estándar, ya que la resolución endoscópica no es lo suficientemente alta para visu-alizar la red vascular. En ocasiones, los patrones vasculares son reconocidos en algunos pólipos hiperplásicos, de gran tamaño con cambios adenomatosos dentados(17).
Adenomas (PC: tipo II): Los adenomas, incluyendo los tipos planos y con depresiones pueden ser vistos como lesiones neovasculares, de color marrón oscuro, y son fácilmente de-tectados cuando se utiliza el colonoscopio IBA sin magnificación(5). El patrón críptico tipo III o IV de los patrones de Kudo, indicado por la aparición de las redes vasculares, pueden ser observados por la magnificación utilizando IBA, sin emplear medios de tinción. Los vasos, son claramente visibles porque los capilares están alterados y anormalmente más largos(17).
Carcinomas (CP: tipo III): La arquitectura microvascular de un carcinoma colónico esta caracterizada por una des-organización de la estructura un incremento en el espesor de los microvasos. La red de vasos capilares, son claramente visibles y muestran un tamaño irregularmente grueso, con ramificaciones irregulares. Cuando una lesión muestra un tipo III, identificado con una colonoscopia IBA, se recomienda efectuar cromoendoscopia(17). (Figura 4)
Por lo anteriormente mencionado, debido a la innovación tecnológica de este equipo en nuestro hospital, con pocas referencias reportadas que demuestren la utilidad de este sistema en la clasificación de los pólipos del colon y recto, el presente trabajo tiene como objetivo evaluar la sensibilidad de este sistema para establecer el diagnostico diferencial de estas le-siones y justificarlo.
En Venezuela para el 2007 no se han hecho publicaciones de resultados de este sistema, por su reciente aparición y poca existencia de estos equipos en diferentes instituciones, tanto publicas como privadas.
PACIENTES Y MÉTODOS
Se realiza un estudio prospectivo, descriptivo y comparativo, con los pacientes evaluados en el Servicio de Gastroenterología del Hospital Oncológico Padre Machado, desde Marzo a Noviembre del 2007. Se realiza un muestreo intencional no probabilístico. En este estudio se cuenta con dos grupos de muestra, en el grupo A, se evalúa la apariencia macroscópica de los pólipos encontrados en el colon y/o recto y el grupo B corresponde al hallazgo histológico de los mismos.
La muestra será de tipo intencional, no probabilística y consistirá en un total de 30 pacientes, de los cuales serán evaluados los pólipos por su aspecto macroscópico (grupo A) comparándose con los hallazgos histológicos (grupo B). Se incluyen en este estudio todos los pacientes de ambos sexos, mayores de 15 años, que tengan indicación colonoscópica, por pesquisa, rectorragía, seguimiento, cambio del hábito intestinal, mucorrea o cáncer de cuello uterino y serán excluidos de este protocolo aquellos pacientes con hemorragia digestiva inferior u obstruidos; quien durante el procedimiento convencional, se detecten como hallazgo casual, lesiones elevadas en la mucosa colón y/o recto. Se realiza
aumento 1,5X, para examinar la arquitectura microvascular y luego empleando el sistema IBA, se diagnóstica el patrón críptico, según la clasificación de Kudo y Tsuruta, son reseca-dos para el análisis histológico. Se calculó la media y desviación estándar de las variables continuas y en el caso de las nominales sus frecuencias y porcentaje.
Las correlaciones de los hallazgos de la evaluación de la morfología de las lesiones polipoideas endoscopicamente, respecto al estudio anatomopatológico, se hará usando la prueba Kappa de concordancia.
RESULTADOS
En el servicio de gastroenterología del Hospital Oncológico Padre Machado, desde febrero hasta noviembre del 2007 fueron analizados 30 pacientes con un total de 39 pólipos colorectales, con el sistema de imagen de banda angosta más alta resolución endoscópica, comparado con el estudio anato-mopatológico. Este estudio analiza el sistema IBA con su habilidad para clasificar los pólipos colorectales y diferenciar en lesiones neoplasias y no neoplásicas.
Todas las lesiones fueron evaluadas con un videoendoscopio magnificador Olympus modelo CF-H180.
Once pacientes fueron hombres y 19 fueron mujeres. La edad promedio fue de 55 años. (Rango de
Un total de 39 lesiones colorectales de 30 pacientes fueron incluidos en este estudio. Veinticuatro personas tuvieron un solo pólipo, 6 tenían dos o más pólipos. (Gráfico 1)
Del total de los 39 pólipos, 29 pólipos fueron adenomas (20 tubulares, 1 tubulovellosos y 1 velloso, 4 adenomas incipi-entes, 1 aserrado y 2 criptas aberrantes). Uno fue un pólipo hiperplásico, 1 fue un ca in situ y 8 hiperplasias polipoide, el cual es un hallazgo de Anatomía Patológica indicando mu-cosa normal (Cuadro 2).
El promedio del tamaño de los pólipos fueron los que median entre
El tratamiento endoscopico fue realizado, en las 39 lesiones de los 30 pacientes de la siguiente manera: 22 polipectomía con pinza (56%), 13 con asa fría (33%), 3 con más electrocauterio (8%) y 1 laparotomía (2,6%). No hubo complicaciones. (Gráfico 4).
EL sistema de IBA identifico, 7 patrones crípticos del tipo I, 4 patrones crípticos del tipo II, 26 fueron del tipo IIIL, 1 del tipo IV y 1 fue del tipo V. (Cuadro 3).
Usando los datos de revisión de anatomía patológica, para la clasificación de los pólipos colorectales, el total de sensibilidad para el sistema IBA en la clasificación de los pólipos fue de un 92% (36/39) de precisión, 86% (27/30) de los pólipos, fueron clasificados en lesiones neoplásicas y un 100% (9/9) fueron sospechosas de lesiones no neoplásicas. Para la red vascular, evaluada con aumento tuvo un 85% de precisión, un 83% (23/29) de los pólipos fueron clasificados en lesiones neoplásicas y un 100% (9/9) fueron diagnosticadas como lesiones no neoplásicas. La única lesión polipoidea, que el sistema IBA con aumento interpretó como adenoma, la biopsia reportó un adenoma tubular con focos de cáncer in situ (displasia de alto grado). Igualmente hubo una lesión cuyo IBA con aumento fue reportado como un carcinoma, la biopsia resultó un adenoma velloso, sin embargo la pieza operatoria posterior a resección quirúrgica confirmó un adenocarcinoma. (Cuadro 4)
Cuando se compara la confirmación histológica con el sistema IBA y aumento para los pólipos no neoplásico (hiperplásicos e hiperplasia polipoide) el hallazgo tuvo una sensibilidad de un 100% y fue capaz de determinar que el pólipo era adenoma (incluyendo: tubular, túbulo-vellosos, velloso, insipiente, aserrado y cripta aberrante) en un 93% de los casos. El total de diagnostico de precisión (número de pólipos correctamente identificados como adenomas, pólipos hiperplásicos y cáncer in situ) fue de 95% (37/39). (Cuadro 5)
Estos resultados sugieren que la evaluación de las lesiones colónicas con el sistema IBA y magnificación provee imágenes adicionales que el empleo de la endoscopia convencional, para diferenciar entre lesiones neoplásicas de las no neoplásicas. De las 39 lesiones examinadas, 74% (29/39) fueron neoplásicas, 1 lesión que fue interpretada endoscópicamente como no neoplásicas fue diagnosticada histológicamente como adenoma.
DISCUSION Y CONCLUSIONES
Este estudio de investigación, estimo la clasificación de los pólipos colónicos de la mucosa del colon y recto, con correlación de los hallazgos de la evaluación morfológica de las lesiones polipoideas con el sistema de imagen de banda angosta, utilizando la clasificación de Kudo y Tsuruta, comparándose a los hallazgos anatomopatológicos; a través de la prueba de Kappa de concordancia. Como el valor de significación estuvo por debajo de 0,05 (p < 0,05) se podría inferir que el patrón de Kudo se correlaciona bien con los diagnósticos reportados por la anatomía patológica.
Con respecto a la lesión de tipo VN, (ca in situ) fue difícil detectar el patrón críptico irregular, quizás por la influencia de la preservación del orificio del patrón (pit) del adenoma velloso. Al igual que en la lesión que fue interpretada como un carcinoma por IBA y aumento cuya biopsia reporto un adenoma velloso, al hecho de que la biopsia fue tomada en la zona donde se preservaba el componente adenomatoso y no donde se hallaba la displasia de alto grado, sin embargo la pieza operatoria si confirmó un adenocarcinoma; cabe destacar que aunque al observar un pólipo la indicación es realizar polipectomía, en este caso la conducta era la biopsia diagnóstica, ya que la lesión era muy sugestiva de un carcinoma y por ende la conducta fue quirúrgica.
En el tracto gastrointestinal inferior, el sistema IBA acentúa el patrón de criptas glandulares, la variabilidad de su geometría, las características topográficas de la superficie, los tonos marrones- verdosos que reflejan la hemoglobina que sugiere variaciones en la densidad de los capilares, que asociado a la magnificación o aumento, permite imágenes de gran calidad que nos pueden revelar el diagnóstico de benignidad o malignidad con mayor exactitud que la colonoscopia convencional, obteniendo datos de detalles morfológicos que se correlacionan cerca con el análisis histopatológico, al mejorar la visualización de la superficie de la mucosa y su patrón vascular.
Tanaka y colaboradores estimo la habilidad del diagnostico de los patrones crípticos, donde comparo el sistema IBA sin cromoendoscopia con la histopatológica. El hallazgo fue 100% (9/9) para el tipo I y II; 93% (27/29) para el tipo IIIL, 100% (1/1) para el tipo VN(9). En otro estudio volvió a demostrar buenos resultados para el Dx de lesiones neoplásicas con NBI magnifi cación, especialmente para patrón críptico regular:100% tipo II (9/9), 100% tipo IIIL (56/56), 100% tipo IV (3/3), 80% tipo V1 ((12/15), 57% tipo VN(20). La detección de adenomas es importante ya que para todos es bien conocida la relación con el cáncer colorectal. Los investigadores generalmente aceptan que el cáncer colorectal se origina principalmente de los adenomas, (por la secuencia adenoma - carcinoma), por lo que estos adenomas al ser removidos pueden probablemente reducir el riesgo de desarrollar cáncer colorectal. Las evidencias que existen en la literatura y nuestra propia experiencia permiten establecer que la nueva tecnología del IBA, es una herramienta óptica de grandes proyecciones en nuestros estudios endoscopios, tanto diagnósticos como terapéuticos, ya que provee imágenes con características adicionales a las de la endoscopia convencional y la cromoendoscopia. Los datos aportados por esta técnica, reflejan que el sistema IBA es útil en el diagnóstico diferencial entre lesiones superficiales benignas y malignas, permitiendo la polipectomía dirigida, sin la necesidad del uso de colorantes, ya que idealmente, la indicación de polipectomía puede ser limitado a pólipos adenomatosos, por su potencial de desarrollar un carcinoma colorectal invasivo y por lo tanto, es importante diferenciar entre pólipos neoplásicos y no neoplásicos, por lo que este método puede ser de ayuda para evitar polipectomias innecesarias con sus complicaciones y costos inherentes, aumentando así la eficacia del tratamiento al reducir tiempo y costos. Este avance tecnológico, aunque es poco desarrollado, parece ser prometedor; es efectivo y fácil de usar para el diagnóstico de lesiones colorectales neoplásicas y no neoplásicas, sin usar cromoendoscopia, teniendo varias ventajas sobre esta:
1. Elimina la necesidad de agentes líquidos de contraste, con lo que no requiere tiempo y trabajo para hacer tinciones.
2. Distribución irregular del tinte.
3. Permite cambiar inmediatamente, hacia atrás o hacia delante entre la imagen del colonoscopio estándar y la imagen del sistema IBA.
Además, con el sistema IBA se puede visualizar focos de criptas aberrantes, que es el cambio detectable mas temprano en la progresión a neoplasia. Finalmente, IBA con aumento o magnificación, demostró tener buenos resultados para el patrón críptico de las lesiones coloretales, especialmente para lesiones con patrones crípticos regulares en el diagnóstico de neoplasias colorectales. Para evaluar la viabilidad y eficacia del uso del sistema IBA son requeridos más estudios para lesiones colorectales y otras lesiones del tracto gastrointestinal. En el futuro cercano, nosotros esperamos que el uso del sistema IBA pueda hacerse estándar para la pesquisa y vigilancia colonoscopica, por ser un método muy fácil de usar sin necesidad de cromoendoscopia, ya que puede ser útil para diferenciar pólipos hiperplásicos y adenomas.
REFERENCIAS BIBLIOGRÁFICAS
1. Bond, JH. Clinical evidence for the adenoma-carcinoma sequence, and the management of patients with clorectal adenomas, Semin Gastrointest Dis, 2000; 11; 176-84.
2. Lux; Stabenow-Lohbauer U. Cancer prevention with the endoscope. Search not only for polyps!, Fortschr Med, 2002; 144; 29-33. [ Links ]
3. Ministerio de Sanidad y desarrollo Social (MSDS) Registro Central de cáncer en Venezuela 2001. [ Links ]
4. Wehrmann K; Fruhmorgen P. Removing adenomas colon carcinoma Risk up to 90%. Effective cancer prevention with the endoscope, Fortschr, Med 2000; Feb 24; 148 ( 8): 26-9. [ Links ]
5. Su Ming-Yao; Hsu Chen-Ming; Ho Yu-Pi; Chen Pang-Chi; Lin Chun-Jung et al. Comparative Study of Convencional Colonoscopy, Chromoendoscopy, and Narror-Band Imaging Systems in Differential Diagnosis of Neoplastic and Nonneoplastic Colonic Polyps, A. J. Gastroent, 2006; 101; 2711-2716. [ Links ]
6. Sano Yasushi; Muto Manabu; Tajiri H; Ohtsu Atsushi; Yoshida Shigeaki. Optical/Digital chromoendoscopy during colonoscopy using Narrow-Bang Imaging System, Digestive Endoscopy, 2005; 17; 43-48. [ Links ]
7. Kuznetsov K; Lambert R; Rey JF. Narrow-band imaging: potencial and limitaciones, Endoscopy, 2006; 38 ( 1); 76-81. [ Links ]
8. Feldman Mark; Friedman Lawrence; Sleisenger Marvin. Enfermedades Gastrointestinales y Hepáticas, Pólipos colónicos y síndromes de poliposis, 2004; 2; 2324-2365. [ Links ]
9. Kahn A, Shrier I, Gordon PH. The changed histologic paradigm of colorectal polyps. Surg Endosc 2002; 16: 436-440. [ Links ]
10. Colina Francisco; Ibarrola Carolina. Protocolo e información sistematizada para los estudios histopatológicos relacionados con el carcinoma colorrectal, Revista española de Patología, 2004; Vol 37, Nº1. [ Links ]
11. Dekker Evelien; Fockens Paul. New Imaging Techniques at Colonoscopy: Tissue Spectroscopy and Narrow Band Imaging, Gastrointestinal Endoscopy, Clinics of North America, 2005; 15; 703-714. [ Links ]
12. Eisen Glemar, Kim Cristopher, fleischer David, Kozarek Richard, Carr Locke David. High-resolution chromoendoscopy for classifying colonic polyps: a multicenter study, Gastroentest Endosc, 2002; 55: 687-94. [ Links ]
13. Seth A. Gross; Wallace, Michael. Hold On Picasso, Narrow Band Imaging Is Here, A. J Gastroent, 2006; 101; 2717-2718. [ Links ]
14. Sanchez Nancy; Mazza Varinia; Ayala Suzanne; Saenz Roque. Imágenes de banda angosta (IBA): Nuevo aporte al diagnostico endoscopico. Gastr Latinoam, 2007; Vol 18, Nº1: 25-33. [ Links ]
15. Huang Qiyang, Fukami Norio, Kashida Hiroshi, Takeuchi Tskasa, Kogure Etsuko. Interobserver and intra-observer consistency in the endoscopic assessment of colonic pit patterns, Gastroentest Endosc, 2004; 60: 520-6. [ Links ]
16. Rezende, Livia; Parra-Blanco, Adolfo. Utilidad de la cromoendoscopia como método auxiliar de la colonoscopia, Gastroenterología Latinoamérica, 2005; 16 ( 3); 192-204. [ Links ]
17. Sano Yasuchi; Takairo H; Kuang I Fu; Katagiri Atsuchi; Muto Manabu. Magnifying observation of microvascular architecture of colorectal lesions using a Narrow-Bang Imaging system, Digestive Endoscopy, 2006; 18; 44-51. [ Links ]
18. Beck, David. Advance in Gastrointestinal Endoscopic Techniques, Surgical Clinics of North America, 2006; 86; 849-865. [ Links ]
19. Tanaka Shinji; PhD; Kaltenbach Tonya; Chayama Kazuaki; Soetikno Roy. High-magnification colonoscopy (with videos), Gastrointestinal Endoscopy, 2006; 64 ( 4); 604-613. [ Links ]
20. Tanaja S; Oka Shiro; Hirata Mayuko, Yoshida Shigeto; Kaneko Iwao; et al. Pit pattern diagnosis for colorectal neoplasia using Narrow Band Imaging Magnification, Digestive Endoscopi, 2006; 18; 52-56. [ Links ]
21. Kudo Shinei, Tamura satoru, Nakajami Takashi, Yamano Hiroo, Lusaka Hisashi, et al. Diagnosis of colorectal tumorous lesions by magnifying endoscopy, Gastroentest Endosc, 1996; 44: 8-14. [ Links ]
Para cualquier información o separata contactar a la:
Dra. Nilda Bastos. Sistemas integrales de Salud (SISCA) y Servicio diagnóstico de atención primaria (Servidiap), Caracas, Venezuela. Correo: nilda.bastos@gmail.com . Fecha de Recepción: Sep. 2010. Fecha de Revisión: Oct. 2010. Fecha de Aprobación: Nov. 2010.