Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Gen
versión impresa ISSN 0016-3503versión On-line ISSN 2477-975X
Gen v.66 n.3 Caracas sep. 2012
Enfermedad Inflamatoria Intestinal: Rectocolitis Úlcerosa Idiopática y Enfermedad de Crohn
Marianela Añez,1 Mildred Fuenmayor,2 Gisela Romero3
1 Gastroenterólogo Adjunta al servicio de Gastroenterología del Hospital Universitario de Maracaibo y Profesora Titular de la Facultad de Medicina de la Universidad del Zulia, Zulia, Venezuela
2 Gastroenterólogo Adjunta al Servicio de Gastroenterología del Hospital Universitario de Maracaibo, Zulia, Venezuela.
3 Gastroenterólogo, Profesor Titular de la Universidad del Zulia, Maracaibo, Zulia, Venezuela
Resumen
Objetivo General
Este artículo proporciona una revisión de la Enfermedad inflamatoria Intestinal, su fisiopatología, manifestaciones intestinales y extraintestinales, evaluación de la actividad de la enfermedad , complicaciones comunes, diagnóstico y los principios generales que guían el manejo y tratamiento de los pacientes.
Introducción
La Enfermedad Inflamatoria Intestinal (EII) comprende un grupo de trastornos inflamatorios intestinales crónicos de etiología desconocida, que incluye a la Rectocolitis Úlcerosa Idiopática (RCUI) y la Enfermedad de Crohn (EC) como las dos enfermedades más importantes de este grupo. Ambas se caracterizan por la apari
ción de una inflamación aguda recurrente, que afecta en grado y extensión variables las capas y segmentos del intestino, con diversas manifestaciones clínicas tanto digestivas como extra digestivas que, con frecuencia, siguen un curso recidivante. La RCUI afecta al recto y colon y se caracteriza por un proceso inflamatorio continuo de predominio mucoso. La EC es un proceso inflamatorio transmural y discontinuo que puede afectar de forma segmentaria a todo el tubo digestivo, desde la boca hasta el ano.1,2, 3,4Palabras Clave: Enfermedad inflamatoria intestinal, Rectocolitis Ulcerosa Idiopática y Enfermedad de Crohn, Tratamiento.
Introduction
Inflammatory Bowel Disease (IBD) comprises a group of chronic intestinal inflammatory disorders of unknown etiology, which includes Ulcerative Colitis Idiopathic (UC) and Crohn's disease (CD) as the two most important diseases of this group. Both are characterized by the appearance of recurrent acute inflammation, which affects the degree and extent variables layers and segments of the intestine, with various clinical manifestations both digestive and extra digestive often follow a relapsing course. UC affects the rectum and colon and is characterized by a continuous inflammatory process predominantly mucosal. The CD is a transmural inflammation and discontinuous segmental can affect the entire digestive tract from mouth to anus.
Key words
: Inflammatory Bowel Disease, Ulcerative Colitis Idiopathic, Crohns disease, Treatment.Epidemiología
La EII puede presentarse a cualquier edad es comúnmente diagnosticada en la adolescencia tardía y la adultez temprana. No existen diferencias importantes en la prevalencia entre los hombres y las mujeres. La incidencia y la prevalencia de EII varían notablemente, las mayores tasas de incidencia y prevalencia se han reportado en el norte de Europa, el Reino Unido y América del Norte. Sin embargo, se ha informado creciente incidencia y prevalencia en otras zonas del mundo, como el sur y el centro de Europa, Asia, África y América Latina.3,5,6,7
En América del Norte, para el año 2011 las tasas de incidencia para la RCUI era de 8 a 14 casos por 100.000 habitantes/año, mientras que para la EC es de 6-15 casos por 100.000 habitantes/año. La prevalencia varía 120-200 casos por cada 100.000 habitantes para RCUI y de 50-200 casos por cada 100.000 habitantes para la EC. Un estudio realizado en Latinoamérica en el año 2009 (Brasil) reporto una incidencia de 4,48 casos por 100.000 habitantes/año para RCUI y 3,50 por 100.000 habitantes/año, para EC y una prevalencia de 22,61, casos por cada 100.000 habitantes para RCUI y de 14,81 casos por cada 100.000 habitantes para la EC.8,9
Etiopatogenia
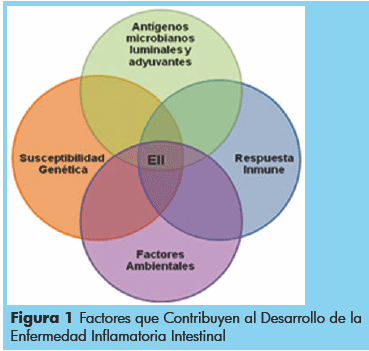
La etiología de la enfermedad es desconocida, aunque la teoría más extendida indica que la EII obedece a un mecanismo etiopatogénico multifactorial en el que intervienen factores genéticos, infecciosos, inmunitarios, ambientales y psicológicos. Los nuevos conocimientos sobre la patogenia de esta enfermedad indican que se desarrolla una respuesta inmune muy agresiva ante un subconjunto de bacterias entéricas en huéspedes susceptibles genéticamente, y los factores ambientales precipitan el comienzo o la reactivación de la enfermedad. Esta compleja teoría consta de cuatro componentes separados que deben interactuar de múltiples formas para que la enfermedad pueda volverse clínicamente evidente (Figura 1).1,10
EII: Enfermedad Inflamatoria intestinal. Fuente:13
Factores Genéticos
Los estudios epidemiológicos demuestran que la familia y los factores genéticos juegan un papel importante en la susceptibilidad a la EII. La enfermedad es, sin embargo, genéticamente compleja y no puede ser explicada por un modelo de gen único. Es probable que la enfermedad esté determinada por varios factores, incluyendo la interacción entre las variantes alélicas en una serie de lugares, así como otras influencias genéticas y ambientales. En consecuencia, la presencia de un gen mutado no garantiza que la EII se desarrolle, ni predice quién la va a desarrollar, lo que subraya la importancia de los co-factores en la iniciación de la enfermedad. Los genes involucrados son: el CARD15, antes conocido como NOD2, los genes SLC22A4 y SLC22A5, el gen DLG5, el gen MDR1, y los Receptores Activados por Proliferadores de Peroxisomas (PPARG).1,3,11,12
Respuesta Inmune
Los pacientes con EII activan la respuesta inmune innata (neu
trófilos y macrófagos), la adquirida (células T y B), con pérdida de la tolerancia y agresiva respuesta de células T frente a bacterias comensales del lumen intestinal. La producción de citocinas proinflamatorias y quimiocinas aumenta en la EII, así como también la expresión de moléculas de adhesión, coestimuladoras y numerosas moléculas relevantes en la patogénesis de la EII (Interleucina-1β (IL-1β, el Factor de Necrosis Tumoral α (TNF-α), la Interleucina-6 (IL-6) y la Interleucina-8 (IL-8).1,3,11,12Desencadenantes Ambientales
Los estudios han implicado a varios factores ambientales en la patogénesis de la EII. Estos factores incluyen el tabaquismo, el uso de antibióticos y de medicamentos antiinflamatorios no esteroideos (AINES), el estrés y la infección. Desafortunadamente, los mecanismos por los cuales estos factores inician la aparición de la enfermedad o reactivan la EII aún no se comprenden bien. Se cree que estos factores desencadenantes alteran la integridad de la barrera mucosa, la respuesta inmune, o el microambiente luminal, cada uno de los cuales tiene un impacto en la susceptibilidad a la inflamación.
3,5,13Disbiosis
La función defectuosa de la barrera mucosa o de la integridad de la misma puede conducir a una mayor captación de antígenos luminales y/o de adyuvantes que alteran el sistema inmunológico de la mucosa. Por otra parte, un defecto en la reparación del epitelio podría potenciar los daños causados por los factores ambientales. El efecto neto de cualquier vía es la estimulación constante de respuestas inmunológicas innatas y adquiridas de la mucosa por los adyuvantes luminales y los antígenos, respectivamente. Una alteración del equilibrio de las especies de microbios beneficiosos frente a los agresivos podría llevar a un entorno proinflamatorio luminal que impulsa la inflamación intestinal crónica en un hospedero susceptible.1,3,13,14
Características Clínicas
La EII es una enfermedad identifica por un curso crónico que alterna períodos de actividad con períodos de remisión. Du rante las recidivas, la severidad de los síntomas varía de leve hasta severos, y durante las remisiones muchos de ellos pueden desaparecer o disminuir. En general, los síntomas dependen del segmento del tracto intestinal comprometido.14
La RCUI presenta una inflamación difusa y continua de la mucosa limitada al colon, con una extensión proximal desde el recto simétrica, circunferencial y variable entre pacientes y en el curso de la enfermedad. La extensión determina la presentación clínica, tratamiento, curso y pronóstico. Los síntomas en la RCUI son generalmente graduales e intermitentes, resultando cada vez más persistentes y severos. El síntoma cardinal es la diarrea con sangre y/o moco o la rectorragia. Los síntomas asociados son dolor abdominal tipo cólico, malestar general, pujo o tenesmo. El índice de actividad clínica de Truelove - Witts permite determinar la severidad de la RCUI (Cuadro 1).4,14,15
A diferencia de la RCUI, la EC puede afectar cualquier parte del tracto gastrointestinal desde la boca hasta el ano de una manera discontinua y transmural. Las áreas que se comprometen con mayor frecuencia son el ciego e íleon terminal. Los síntomas de la EC son más heterogéneos, pero por lo general incluyen dolor abdominal, diarrea y pérdida de peso. Los síntomas sistémicos como malestar general, anorexia, o fiebre son más frecuentes en la EC que en la RCUI. Por ser la EC una patología transmural, la pared intestinal se encuentra engrosada con compromiso de la mucosa, submucosa, muscular propia, serosa y grasa mesentérica. Este compromiso transmural explica los diferentes fenotipos de los pacientes (inflamatorios, estenosantes y penetrante, cada uno con manifestaciones clínicas diferentes (Cuadro 2). El curso clínico de la EC también se caracteriza por exacerbaciones y remisiones, pero tiende a producir mayor discapacidad que la RCUI. De manera similar a la RCUI en la EC se utiliza el índice de actividad CDAI (Crohn Disease Activity Index) para estimar la actividad de la enfermedad (Cuadro 3). Tanto la RCUI como la EC se asocian con un mayor riesgo de carcinoma de colon.4, 14,15
Manifestaciones Extraintestinales
Aunque la EII afecta sobre todo al tracto gastrointestinal, debe considerarse como un trastorno sistémico, ya que con frecuencia aparecen síntomas extraintestinales que no siempre coinciden con la actividad de la enfermedad intestinal. Algunas complicaciones pueden presentarse aún antes de hacerse el diagnóstico de EII y otras manifestaciones tienen un curso independiente de la enfermedad intestinal pero, en general, las manifestaciones extraintestinales siguen el curso de la enfermedad de base. Las principales manifestaciones son:14,20,21,22
Manifestaciones del Aparato Locomotor: Es la manifestación extraintestinal más frecuentemente asociada a la EII. La afección de las articulaciones se puede mostrar como artralgias y artritis; las artralgias son más frecuentes que la artritis; afecta generalmente a grandes articulaciones en forma asimétrica. La artritis se presenta como: artritis periférica, sacroileítis o espondilitis anquilosante, y puede preceder, ser sincrónica o comenzar después del diagnóstico de la EII. La osteopenia y la osteoporosis son comúnmente encontradas en la EII.14,20,21,23
Manifestaciones Oculares: Pueden afectar a todos los compartimientos anatómicos del ojo y se observan en menos del 10% de los casos, con predominio en la EC y las más frecuentes, son: Epiescleritis, Escleritis y Uveítis.14,20,22
Manifestaciones Dermatológicas: Suponen aproximadamente la tercera parte de las manifestaciones extraintestinales, las que afectan a la piel, son: Eritema nodoso, Pioderma gangrenoso, Síndrome de Sweet, Rosácea y Psoriasis. Las que afectan a la región oral, son: la estomatitis aftosa, la nodularidad mucosa (empedrado) y la pioestomatitis vegetante.20,21,22
Manifestaciones Hepatobiliares:
El 40% de los pacientes con EC y hasta un 27% de los que tienen RCUI presentan aumento de las transaminasas, bilirrubina y fosfatasa alcalina. La colangitis esclerosante primaria (CEP) tiene una frecuencia relativamente baja en la EII, con un ligero predominio en la RCUI. Entre el 70 y el 80% de los pacientes con CEP, padecen también EII. Realizar el diagnóstico de CEP es muy importante para los pacientes, ya que se asocia con un riesgo mayor de hepatocelular y, en los casos de RCUI, cáncer colorrectal. Otras manifestaciones incluyen: la cirrosis biliar primaria, la enfermedad hepática grasa no alcohólica, la litiasis vesicular y la hepatitis autoinmune.14,20,21
Complicaciones
Numerosas complicaciones han sido descritas en el curso de la EII. Las más frecuentes se presentan a continuación: Hemorragia digestiva: en la RCUI, el sangrado es general-mente profuso, mientras que en la EC el sangrado es menos común. Perforación intestinal y abscesos intraabdominales, son más frecuentes en la EC.14,24,25
Estenosis y obstrucción: La estenosis es una disminución de lumen intestinal producto del proceso inflamatorio en la mucosa, y se puede forma por inflamación y edema agudo o por fibrosis crónica. Debe presumirse que las estenosis colónicas son malignas, hasta probar lo contrario.14,24,25
Abscesos, Fístulas y patología perianal: Las fistulas se define como comunicación anormal entre la luz del intestino y la superficie corporal, o entre el intestino y otro órgano interno y estas pueden ser simples o complejas. Los abscesos intrabdominales corresponden a perforaciones cubiertas al adherirse la serosa inflamada a la serosa normal, constituyen complicaciones indicativas y distintivas de la EC.14,15,25
Megacolon tóxico
: Es una complicación que amenaza la vida. Es más común en la RCUI que en la EC. Se caracteriza por la dilatación del colon y requiere tratamiento médico agresivo, debiéndose recurrir a la intervención quirúrgica urgente si no hay respuesta en las primeras 24 horas.14,24,25
Neoplasia maligna: Después de 8 años del diagnóstico de RCUI se ha descrito un aumento significativo en el riesgo de desarrollar cáncer de colon. En la EC existe un riesgo similar cuando hay compromiso de un área importante del colon. En la EC también se observa un aumento del riesgo Adenocarcinoma del intestino delgado.14,24,25
Diagnóstico
Para establecer el diagnóstico de la EII y distinguir entre EC y RCUI se necesita de la presencia de un cuadro clínico sugerente apoyado en una combinación de hallazgos clínicos (anamnesis y examen físico completo), exámenes de laboratorio (incluyendo análisis de sangre y análisis de heces), procedimientos endoscópicos e histológicos. Los estudios radiológicos son, habitualmente, de menor valor; no obstante, ayudan a excluir otras causas y confirmar el diagnóstico. La evaluación directa de la mucosa y su histología puede definir la distribución, gravedad y activi
dad de la enfermedad. En los pacientes con EII establecida, la endoscopia, ayudará a evaluar la respuesta al tratamiento, con lo que se determina el curso de la terapia médica y quirúrgica. Por otra parte, la endoscopia tiene un papel terapéutico en la EII en la dilatación de estenosis y manejo de la hemorragia. En los pacientes con enfermedad de larga data, la endoscopia juega un papel integral en la vigilancia de la displasia y del cáncer colorrectal.4,14,15,26La endoscopia permite la visualización directa de la mucosa y la obtención de tejido para su estudio histológico, Los hallazgos histológicos (
Cuadro 4) adecuadamente interpretada, son de gran apoyo; sin embargo, en la práctica clínica, no son definitivos. Durante la evaluación inicial, las biopsias múltiples es lo recomendado, modalidades tales como imágenes de banda estrecha (NBI) se puede utilizar para mejorar el rendimiento en la toma de de biopsias de la mucosa.4,14,15,26El diagnóstico de la RCUI, deberá realizarse sobre la base de una sospecha clínica adecuada, aunado a los hallazgos en la colonoscopia y la histología. La colonoscopia es considerada el principal método diagnostico, los cambios inflamatorios endoscópicamente observados suelen comenzar por encima de la unión anorrectal y se extienden proximalmente en forma continua, los primeros cambios en la RCUI son el eritema, la congestión vascular y el aspecto granular fino de la mucosa. Como la inflamación se vuelve más grave la mucosa puede ser friable y sangra con facilidad, se forman ulceras, y puede ocurrir sangrado espontáneo. La inflamación crónica puede resultar en atrofia de la mucosa con pérdida de los pliegues haustrales, estrechamiento de la luz y desarrollar pseudopólipos, que pueden tener formas diversas, así como puentes mucosos. La colonoscopia permitirá no solo efectuar el diagnostico sino evaluar la extensión del compromiso de la mucosa, de tal manera que el compromiso aislado de la mucosa rectal corresponderá a una proctitis, el compromiso desde el recto hasta el ángulo esplénico una colitis izquierda, el compromiso más allá del ángulo esplénico (colitis extensa), y si abarca todo el colon (pancolitis).4,14,15,26
El diagnóstico de la EC depende de la demostración de inflamación segmentaria y asimétrica de la mucosa (se observa entre aéreas comprometidas mucosa de aspecto normal), puede afectar a cualquier segmento de la boca hasta el ano. La colonoscopia en pacientes con sospecha de EC debe ser en lo posible completa e incluir la evaluación de la mucosa del ileon terminal. Las características endoscópicas de la EC son las úlceras aftosas, úlceras serpiginosas discretas, úlceras longitudinales, mucosa con aspecto de empedrado, estenosis y fístulas. En etapas tempranas de la EC se observan con frecuencia pequeñas ulceraciones aftosas. A medida que la enfermedad progresa, estas úlceras pueden confluir en úlceras grandes estrelladas. Ulceraciones aisladas en la válvula ileocecal o en el íleon terminal se ven comúnmente en la EC. La esofagogastroduodenoscopia inicial en adultos no es necesaria, salvo que exista clínica sugestiva de afectación del tracto digestivo superior. Tras la realización de una colonoscopia con ileoscopia, y de una endoscopia digestiva alta, si procede, puede realizarse un estudio con cápsula endoscópica o enteroscopia en aquellos pacientes en los que se sospeche una afectación de intestino delgado.4,14,15,26
Las pruebas diagnósticas a seleccionar varían, de acuerdo a las manifestaciones, hallazgos físicos y complicaciones. El papel actual de las exploraciones radiológicas en el diagnóstico inicial de la RCUI y la EC es limitado. Sin embargo, en pacientes con limitaciones para realizar procedimientos endoscópicos y en el seguimiento de los pacientes para el control de la actividad de la enfermedad, la progresión y la respuesta a las intervenciones terapéuticas los estudios radiológicos pueden ser fundamentales.4,14,15,26
Biomarcadores Fecales y Serológicos en la Eii
Los marcadores biológicos podrían tener un papel en casi todos los puntos en el tratamiento de la enfermedad. Cuando los pacientes presentan síntomas sugestivos de la EII, la combinación de materia fecal y marcadores serológicos podría ser utilizados para identificar pacientes que deben someterse a pruebas invasivas y para ayudar a distinguir la EC de la RCUI.29,30,31
Biomarcadores Serológicos
Existe cada vez más evidencia sobre la asociación de los marcadores serológicos con formas específicas, comportamiento y fenotipo de la EII. Estos marcadores serológicos pueden actuar como indicadores pronósticos de gravedad y comportamiento de EII. Los anticuerpos anti-Saccharomyces cerevisiae (ASCA) y los anticitoplasma del neutrófilo de patron perinuclear (p-ANCA) permiten una mejor distinción entre la EC y la RCUI, el fenotipo ASCA+/pANCA- es característico de EC, mientras el ASCA-/ pANCA+ de RCUI.29,30,31,32
Calprotectina Fecal y Lactoferrina
Marcadores fecales tales como calprotectina y lactoferrina, se han estudiado por su capacidad para identificar pacientes con EII, evaluar la actividad de la enfermedad, y predecir recaída. La calprotectina y lactoferrina pueden ser utilizado para evaluar curación de la mucosa, sin necesidad de pruebas invasivas.29, 30,31
Otros Marcadores
La proteína C-reactiva y la velocidad de sedimentación se utilizan para evaluar los procesos inflamatorios y predecir el curso de la progresión de la EII. La medida de los niveles de metabolitos de drogas y anticuerpos contra los agentes terapéuticos permite determinar por qué los pacientes no responden a la terapia y para identificar estrategias alternativas de tratamiento.3
Tratamientos Terapias Convencionales:
Agentes 5-ASA: Mesalamina, Sulfasalazina.
Corticosteroides: Prednisona bidesonida.
Inmunoduladores: Mercaptopurina, metotrexato, Ciclosporina
Biologicos: Infliximab, Adaliummab, Certolizumab, Natalizumab.
Paradigma actual sobre la estrategia ascendente (step-up) de tratamiento
Los esteroides son eficaces para inducir la remisión.
La recaída cuando se quitan los esteroides es alta, y con frecuencia requiere de inmunosupresión.
En la mayoría de los pacientes no se logra la cicatrización de la mucosa.
PASOS PROPUESTOS PARA UN ENFOQUE DE TRATAMIENTO SEGÚN OBJETIVOS EN LA EC Y RCUI
Optimizar rápidamente la terapia convencional, Introducir la terapia con anti-TNF a tiempo para los pacientes adecuados.1,2
Sostener la eficacia a largo plazo.
Monitoreo regular y objetivo de pacientes para mantener un
"control estricto".Aminosalicilatos Indicación: Rcui:
Indicación de la remisión y mantenimiento en CU.
EC:
Introducción de la remisión, a dosis más altas y en brotes más leves.
Mantenimiento de la remisión en formas ileales e ileocolicas.
Prevención de la recidiva postquirúrgica en algunos subgrupos de enfermos.
Efectos secundarios: Intolerancia, Diarrea, dolor de cabeza, Nauseas, Rash, Trombocitopenia, Nefrotoxicidad (nefritis interstrcial o síndrome nefrotico), Rara e idiosincrática.
Corticosteroides (cs): Indicación: RCUI: Inducción de la remisión. No son eficaces en el mantenimiento de la RCUI
EC: Inducción de la remisión. No son eficaces en el tratamiento de la enfermedad perianal o de enfermedad fistulosa, ni en el mantenimiento de la EC. Efectos secundarios: Suspresión adrenal, HTA, Diabetes corticoidea, osteoporosis, fracturas patológicas, necrosis avascular, cataratas, acné, estrías cutáneas, insomnio, obesidad, retención de líquidos, brotes psicóticos, alteraciones emocionales.
Recomendaciones para el uso de CS en la EC:
Los corticosteroides sistemáticos son mejor utilizados para EC activa grave de cualquier ubicación, no se apoya su uso en la EC perianal aislada, se prefiere la budesonida a los corticosteroides sistémicos para la enfermedad ileocecal moderadamente activa, pero no se encuentra disponible en cualquier lugar, en países en los que la budesonida no está disponible se recomienda la inducción precoz de IM (y/o terapia con anti.TNF) por sus efectos economizadores de corticosteroides, la duración inicial del tratamiento con corticostiroides sistémicos en dosis completas depende de la respuesta del paciente, no hay evidencia clara de continuar con la dosis completa por más de 1-3 semanas influya en las tasas de remisión, los pacientes que no responde dentro de las 2-4 semanas deben ser evaluados con mayor profundidad, y deben considerarse otras opciones terapéuticas.
Dosis óptimas inicial de CS en la EC:
Corticosteroides sistemáticos orales: Esta varía desde 40 60mg/día/ a 1mg/kg/día. En la hidrocortisona intravenosa, la dosis es de 300-400mg/dia.
La dosis de budesonida es de 9mg/día.
La reducción de los corticosteroides se inicia dentro de la se
mana de comenzada la terapia y después de no más de 3-4 semanas y se debe bajar 5mg por semana, llevándola a cero en un periodo de 8 semanas, el tratamiento no debería exceder las 12 semanas. Los corticosteroides no son eficaces como terapia de manu
tención. Estos medicamentos aumentan el riesgo de infecciones oportunistas graves y la mortalidad, tanto independientemente como en combinación con los agentes anti-TNF e IM. Para evadir los efectos secundarios se debe evitar su uso prolon
gado o repetitivo y cambiar los pacientes adecuados a terapias con IM y/o anti-TNF, La cirugía es una opción apropiada para algunos pacientes que presentan una dependencia de los corticosteroides y debería ser considerada. Se debe prevenir la osteoporosis asociando calcio y vitamina D
en todos los pacientes, hay grupos que recomiendan tratamiento con difosfonatos como profilaxis primaria.Terapias Convencionales: Inmunomoduladores (IM):
AZATIOPRINA/6MCP
:Dosis:
Azatoprina: 2-2.5 mg/kg de peso/día.
6-mercaptopurina: 1-1.5 mg/kg de peso/día.
Indicación:
RCUI: Corticodependecia, corticorrefractariedad, mantenimiento de la remisión.
EC: Corticodependencia, corticorrefractariedad, mantenimiento de la remisión prevención de la recurrencia postquirúrgica, tratamiento de la enfermedad perianal y de la enfermedad fistulosa.
Efectos secundarios: Intolerancia digestiva, aumento del VCM, neutropenia, aplasia medular, pancreatis aguda, hepatitis colestatica, no está de mostrado un aumento de linfomas u otras tumoraciones, es SEGURO durante el embarazo.
Controles: Monitorizar la TPMT al principio del tratamiento para descartar a pacientes homocigotos, hemograma, amilasa y enzimas hepáticas cada 4 meses para valorar toxicidad, el efecto comienza entre 3-6 meses de comenzar su administración, cuidado con las infecciones oportunistas, son efectos inmuno-suprimidos.
METOTREXATE:
Dosis: Iniciar con 25 mg sc semanales durante 4 semanas y luego 15 mg s.c. semanales.
Indicación:
RCUI: no hay estudios que demuestren eficacia.
EC: inducción de la remisión en corticodependiente o corticorrefractario, tratamiento de mantenimiento en pacientes intolerantes a azatioprina, no se ha demostrado eficacia en la enfermedad perianal o fistulosa.
Efectos secundarios: Leucopenia, fibrosis hepática, debe interrumpirse si las transasminasas alcanzan el doble de la normalidad, neumonitis por hipersensibilidad, nauseas, vómitos, y diarrea, que puedes ser disminuidos mediante administración de acido fólico, teratogenicidad.
Monitoreo:
Análogos de purina: Riesgos de mielosupresión, hemogramas completos: todas las semanas durante 4 semanas, después se aumenta el intervalo.
Metotrexato: Comparable a la vigilancia con tiopurinas, neumonía por hipersensibilidad y ¿Riesgos de fibrosis hepática en EII?
Resumen y Conclusiones
SI: Identificar pacientes con pronostico desalentador, intervenir
con tratamiento precoz con IM, revaluar al paciente en momentos determinados:
- prednisona 2-4 semanas
- azatioprina 10-12 semanas
Convertir la remisión libre de esteroides en un objetivo, tratar más allá de los síntomas: biomarcadores, cicatrizacion de la mucosa.
Optimizar las dosis de IM temprano.
NO: Usar rondas prolongadas o repetitivas de CS, subestimar la toxicidad por CS, prolongar el uso de azatioprina a dosis estándar si no se logra la remisión total.
Agentes biológicos para el manejo de la enfermedad
Objetivo de tratamiento hoy: detener la progresión de la enfermedad mediante el control total de la enfermedad
: 
Cicatrización de la Mucosa como un Objetivo de Tratamiento:
SONIC: La terapia temprana basada en agentes anti-TNF estuvo asociada con la remisión libre de esteroides y la cicatrización total de la mucosa.1
ESTUDIO "STEP-UP, TOP-DOWN": Las tasas de remisión clínica fueron similares pero la tasa de cicatrización de la mucosa fue mayor con la estrategia descendente (top-down) (terapia precoz con anti-TNF) que con la estrategia ascendente (step-up),2 la cicatrización de la mucosa fue una fuerte variable predictiva de la remisión libre de esteroides.2
STORI: La cicatrización de la mucosa predijo la manutención de la remisión clínica cuando se suspendió la terapìa anti-TNF3
EXTEND: El uso precoz de anti. TNF estuvo asociado con una tasa más alta de cicatrización de la mucosa que la relatividad al uso tardio.4
USO ACTUAL DE AGENTES ANTI-TNF
Pacientes con EC que no responden o son intolerantes a los IM, que no responden o son intolerantes a los esteroides y necesitan rescate precoz, pacientes con EC fistulizante agresiva, algunas manifestaciones extraintestinales de la EC, ¿Puente para la inmunosupresión?, ¿EC precoz agresiva?, Colitis aguda grave.
ANTES DE INICIAR LA TERAPIA CON ANTI-TNF
Historia clínica y examen físico detallados para determinar cualquier contradicción.
Historial de vacunas
Exámenes de laboratorio (hemograma completo, perfil hepático, ESR, PCR, calprotecnia fecal)
Determinar serología VIH, VVZ, (VHC) y BHV.
Prueba de detección de TBC según los lineamientos del país (Prueba de la tuberculina, Radiografía de tórax y Evaluación epidemiológica).
Tomografía computada (TC)/enterografía (sospecha de absceso o fibroestenosis)/RM
CONTRAINDICACIONES PARA LA TERAPIA CON ANTI-TNF
Absolutas:
* Sepsis/infección activa conocida
* Insuficiencia cardiaca congestiva clase III o IV
* Cáncer actual, enfermedad desmielinizante.
Relativas: Síntomas obstructivos (¿Fibroestenosis, inflamación?
* Cáncer previo
* Hipersensibilidad a anticuerpos monoclonales
LA EC PRECOZ COMO OBJETIVO
FASE PRE-CLÍNICA
: Inflamación sub-clínica (respuesta inmune y lesiones histológicas). EC PRECOZ
: Inflamación (evidencia clínica, biológica, endoscopia y radiológica de la actividad de la enfermedad). Sin fistulas, abscesos o estenosis. EC TARDÍA
: Daño intestinal (fistulas, abscesos, estenosis), deterioro de la función Gl, cáncer colorrectal.LA TERAPIA ACTUAL CON AGENTES ANTI-TNF DEBE OPTIMIZARSE
El objetivo de tratamiento es la remisión profunda (Cicatrización de la mucosa y remisión clínica).
Tratamiento temprano en el curso de la enfermedad
Usar terapia combinada
Considerar dosis flexibles
Evitar el cambio precoz.
INTERVENCIÓN PRECOZ EN LA EC
Declaración 5F de la ECCO: En la actualidad, los pacientes que tienen características clínicas que sugieren un pronóstico desfavorable parecen ser más adecuados para la introducción precoz de tiopurinas, metotrexato y/o terapia anti-TNF.
VARIABLES PREDICTIVAS DE RESULTADOS DESFAVORABLES EN LA EC
Tabaquismo, edad joven al diagnostico2
Enfermedad perianal, edad al diagnostico 40 años4
Edad menor de 40 años, enfermedad obstructiva o fistulas, enfermedad perianal, fiebre, pérdida de peso>5kg, recuento plaquetario alto.
PACIENTES DE ALTO RIESGO QUE DEBERÍAN SER CONSIDERADOS PARA TRATAMIENTO PRECOZ CON TERAPIA COMBINADA:
Fístula compleja
Ulceración profunda en la endoscopia
Edad joven
Resistencia/dependencia de esteroides
Anatomía de alto riesgo (enfermedad del intestino anterior enfermedad extensiva, enfermedad perianal.)
Actividad grave de la enfermedad (pérdida de peso, Hgb, albumina baja).
¿QUE AGENTE ANTI-TNF DEBE USAR?
La elección puede depender de: La preferencia del paciente, la respuesta clínica (luminal/fistulas), el mantenimiento de la remisión estable a largo plazo.
Declaración 51 de la ECCO: "Todas las terapias con agentes anti-TNF disponibles en la actualidad parecen tener una eficacia y perfiles de eventos adversos similares, por eso, la elección depende de la disponibilidad, la vía de administración, la preferencia del paciente, el costo, los lineamientos nacionales"
1 [EL5, RG D].QUE EXPLICARLE A LOS PACIENTES SOBRE LOS AGENTES ANTI-TNF
Activos para la induccion y la manutencion.
Debe esperarse un efecto rapido
Pocos efectos secundarios inmediatos.
Infuciones contra inyecciones
Beneficio de la terapia combinada
Profilaxis de infecciones
No usar vacunas vivas
Necesidad de vigilancia clínica mejorada
Riezgo persibido de linfoma (¿terapia combinada?)
Perdida de efecto.
Duración del tratamiento.
RECOMENDACIONES DE LAS SOCIEDADES: DURACIÓN DE LA TERAPIA DE MANUTENCIÓN CON ANTI-TNF
EUROPEAN CCROHN´S AND ORGANISATION: "No pueden darse recomendaciones sobre la duración del tratamiento con MTX o anti-TNF, aunque puede considerarse el uso prolongado de esta drogas de ser necesario".
BRIST SOCIETY OF GASTROENTEROLOGY
: "NICE recomienda que la terapia de manutención con anti-TNF continúe durante 12 meses o hasta que el tratamiento falle". AMERICAN COLLEGE OF GASTROENTEROLOGY
: "La recomendación utiliza leguaje fuerte respecto del beneficio de continuar con la terapia anti-TNF La calidad de la evidencia fue alta". CANADIAN ASSOCIATION OF GASTROENTEROLOGY: "Para el paciente que respondió favorablemente a las 52 semanas de terapia, el beneficio de continuarla parece superar los riesgos."
Conclusiones
Se ha redefinido los objetivos de tratamiento, tratar únicamente los síntomas deja a los pacientes en riesgo de desarrollar una enfermedad progresiva
Emplear estrategias para identificar pacientes precozmente en el tratamiento con biólogos le ofrece a los pacientes la mejor oportunidad de mejorar los resultados clínicos a largo plazo.
Debe considerarse una terapia combinada precoz para los pacientes de alto riesgo.
Se ha demostrado que adalimumab induce y mantiene la re
misión clínica.Los estudios a largo plazo han demostrado que estos efectos son sostenibles y llevan a resultados mejorados, entre ellos menos hospitalizaciones y cirugías y una calidad de vida mejorada.
Referencias Bibliográficas
1. Balfour Sartor R. Mechanisms of Disease: pathogenesis of Crohns disease and ulcerative colitis. Nature Clinical Practice Gastroenterology & Hepatology. 2006;3(7):390-404. [ Links ]
2. Baumgart Daniel, Baumgart C. The Diagnosis and Treatment of Crohns Disease and Ulcerative Colitis. Deutsches Ärzteblatt International. 2009;106(8):123-33. [ Links ]
3. Hanauer Stephen B. Inflammatory Bowel Disease: Epidemiology, Pathogenesis, and Therapeutic Opportunities. Inflamm Bowel Dis. 2006;12(1):3-9. [ Links ]
4. Quera P. Rodrigo, Palma C. Renato. Enfermedades Inflamatorias Intestinales: Colitis Ulcerosa y Enfermedad de Crohn. Revista Médica Clínica las Condes 2008;19(4):331-341. [ Links ]
5. Loftus Edward V. Clinical Epidemiology of Inflammatory Bowel Disease: Incidence, Prevalence, and Environmental Influences.
Gastroenterology. 2004;126(6):1504-1517. [ Links ]6. Langan Robert C, Gotsch Patricia B, Krafczyk Michael A, David Skillinge D. Ulcerative Colitis: Diagnosis and Treatment. American Family Physicians.2007;76(9):1323-1330. [ Links ]
7. Marshall John K. Are There Epidemiological Differences Bet
ween Crohns Disease and Ulcerative Colitis?. Inflamm Bowel Dis. 2008;14(2). [ Links ]8. Cosnes J, Gowe C, Seksik P y Cortot A. Epidemiology and Na
tural History of Inflammatory Bowel Diseases. Gastroenterology. 2011;140(6):1785-1794. [ Links ]9. Victoria C, Sassaki L y Nunes H. Incidence and Prevalence Ra
tes of Inflammatory Bowel Diseases, in Midwestern of São Paulo State, Brazil. Arq Gastroenterol. 2009;46(1):20-25. [ Links ]10. López Blanco B, Moreno Jiménez B, Devesa Múgica M y
Rodríguez Muñoz A. Relación entre variables sociodemográficas y clínicas y calidad de vida relacionada con la salud en pacientes con Enfermedad Inflamatoria Intestinal. Rev Esp Enferm Dig; 2005;97(12):887-898. [ Links ]11. Podolsky Daniel K. Inflammatory Bowel Disease. N
Engl J Med 2002;347(6):417-429. [ Links ]12. Strober Warren, Fuss Ivan, Mannon Peter. The fundamental
basis of inflammatory bowel disease. The Journal of Clinical Investigation. 2007;117(3):514-521. [ Links ]13. Vidal Ángela, Gómez Gil Esther, Sans Miquel, Portella María J, Salamero Manel, Pique Josep M, Panès Julián. Health
related Quality of Life in Inflammatory Bowel Disease Patients: The Role of Psychopathology and Personality. Inflamm Bowel Dis. 2008;14(7):977-983. [ Links ]14. Bernstein Charles N, Fried Michael, Krabshuis JH, Cohen Henry, Eliakim R, Fedail Suleiman, Gearry Richard, Goh KL, Ha-mid Saheed, Ghafor Khan Aamir, LeMair AW, Malfertheiner P, Ouyang Qin, Rey JF, Ajit Sood, Steinwurz Flavio, Thomsen Ole,
Thomson Alan, Watermeyer Gillian. Enfermedad inflamatoria intestinal: una perspectiva global. Guías Mundiales de la Organización Mundial de Gastroenterología. 2009;1-27. [ Links ]15. Chan Grace, Fefferman David S, Farrell Richard J. Endoscopic Assessment of Inflammatory Bowel Disease: Colonoscopy / Esophagogastroduodenoscopy. Gastrointestinal Endoscopy Clinics of North America. 2012;22(2):271-290. [ Links ] 16. Baumgart Daniel C, Sandborn William J. Inflammatory bowel disease: clinical aspects and established and evolving therapies. Lancet. 2007;369:1641-57. [ Links ] 17. Head Kathleen A, Jurenka Julie S. Inflammatory Bowel Disease Part I: Ulcerative Colitis – Pathophysiology and Conventional and Alternative Treatment Options. Altern Med Rev. 2003;8(3):247-283. [ Links ] 18. Siu-Moguel Ana Guadalupe, García-Guerrero Víctor Antonio, Corral-Medina Adalberto, Espino-Cortés Héctor, Uc-Contreras Javier, Valdés-Lías Rosario, Guzmán-Zárate Mario Ángel. Correlación clínica-endoscópica-histológica de colitis ulcerosa en el Hospital General de México. Endoscopia. 2006;18(4):317-322. [ Links ] 19. Baños Fabián Julian. Tratamiento médico para Enfermedad In 20. Cabré Gelada Eduard. Manifestaciones y Complicaciones Extraintestinales de la Enfermedad Inflamatoria Intestinal. Barcelona. España. Temis Médical, S.L. 2007;1-51. [ Links ] 21. Danese Silvio, Semeraro Stefano, Papa Alfredo, Roberto Italia, Scaldaferri Franco, Fedeli Giuseppe, Gasbarrini Giovanni, 22. Nikolaus Susanna, Schreiber Stefan. Diagnostics of Inflammatory Bowel Disease. Gastroenterology. 2007;133:1670-1689. [ Links ] 23. Fernández Castro M., Muñoz Carreño P, Silva Fernández 24. Sleisenger M, Feldman M, Friedman L. Enfermedades Gastrointestinales y Hepáticas; Fisiopatología, diagnóstico y tratamiento. 7ma Edición. Tomo 2. Buenos Aires, Argentina: Editorial Médica Panamericana; 2004; 2139-2206. [ Links ] 25. Anderson Simon HC, Davies Gareth, Dalton Harry R. Key To 26. Carter MJ, Lobo AJ, Travis SPL. Guidelines for the management 27. Vásquez Iglesias José Luis, Alonso Aguirre Pedro A. Vásquez Pérez Laura, Vásquez José Carlos. Endoscopia Digestiva Diagnostica y Terapéutica. Madrid, España. Editorial Médica Panamericana: 2008;591-615. [ Links ] 28. Kumar Vinay, Abul Abbas, Fausto Nelson. Patología Estructural y Funcional. 7ma Edición. Madrid, España: Editorial Elsevier; 2007., 849-855. [ Links ] 29. Inflammatory Bowel Disease Diagnosis and Therapeutics. Second Edition. New York, USA: Editorial Springer Science+Business Media; 2011., 177-194. [ Links ] 30. (otico libro) Clinical Dilemmas in Inflammatory Bowel Disease. Massachusetts, USA. Editorial: Blackwell Publishing, Inc. 2006;5-8. [ Links ] 31. James D Lewis. The Utility of Biomarkers in the Diagnosis 32. Tamboli Cyrus P., Doman David B., Patel Amar. Current and future role of biomarkers in Crohns disease risk assessment and treatment. Clinical and Experimental Gastroenterology. 2011;4:127-140. [ Links ] 33. Esser D. et al. J Crohns Colitis. 2011;5:165-166. [ Links ] 34. Rutgeerts PJ. Aliment Pharmacol Ther. 2001;15:1515-1525. [ Links ] 35. Colombel JF, et al. J Crohns Colitis 2011;5:S41-PO69 at ECCO. [ Links ] 36. Homik J, et al. Calcium and vitamin D for corticosteroid-induced osteoporosis. The Cochrane Library, Issue1,2001. [ Links ] 37. Otley, et al. Cochrane Database Syst Rev. Oct 2005;19;(4):CD000296. [ Links ] 38. Ferrante M, et al. J Crohns Colitis 2012;6:116-131. [ Links ] 39. Ghosh S.J Cronhns Colitis. 2012;6(Supla 2):S243-S249. [ Links ] 40. Present DH, Korelitz Bl. N Engl J Med. 1980;302:981-987. [ Links ] 41. Khan N, et al. Inflamm Bowel Dis. 2012;18:359-367. [ Links ] 42. Adapted from Feagan B, et al. Inflamm Bowel Dis, 43. Colombel JF, et al. N Engl J Med. 2010;362:1383-1395. [ Links ] 44. Louis E, et al. Gastroenterology 2011;in press. [ Links ] 45. Cottone M and Criscuoli V. Clin Exp Gastroebterol. 2011;4:227-238. [ Links ] 46. Dignass A, et al. J Crohns Colitis. 2010;4:28-62; Melmed 47. Infliximab-Summary of Product Characteristics, July 2011; 48. Adapted from Peyrin-Biroulet L, et al. Gut. 2010;59:141-147. [ Links ] 49. Panaccione R and Ghosh S. Ther Adv. Gastroenterol, 2010;3:179-189. [ Links ] 50. Ghosh S. J Cronhns Colitis. 2012;6(Supla 2):S243-S249; Panaccione R., et al. J Ghosh S. J Cronhns Colitis.2012;6:S235-S242. [ Links ] 51. Dignass A, et al. J Crohns Colitis. 2010;4:28-62. [ Links ] 52. 1. Munkholm PL, et al. Gastroenterol. 1993;105:1716-1723; 2. Fran cgimont D, et al. Eur J Gastroenrol Hepatol. 1998;10:821825;3. Lichtenstein. [ Links ] 53. Schreiber S, et al. Gastroenrol. 2007;132(Suppl 2): Sandbom W, et al. Gastroentol. 2010;138 (Suppl 1): S1031. [ Links ] 54. Peyrin-Biroulet L and S. Gastroenrol. 2010;139:1059-1061. [ Links ] 55. DHaens G, et al. Lancet 2008;371:660-667. [ Links ] 56. Colombel JF, et al. N Engl J Engl J Med. 2010;362:13831395. [ Links ] 57. Hanauer S, et al. Lancet. 2002;359:1541-1549. [ Links ] 58. Colombel JF, et al. Gastroenrol. 2007;132:52-65. [ Links ] 59. Rutgeerts P, et al. Gastroenrol. 2012;e pub ahead of print. [ Links ] 60. Colombel JF, et al. Colitis. 2010;4:S11(Abstract 16). [ Links ] 61. Colombel JF, et al. Gut. 2010;59 (Suppl 3):A80: OP371 at UEGW 2010. [ Links ] 62. Sndborn W, et al. Am J Gastroenrol. 2010; 105(Suppl 1): S442-443. [ Links ] 63. Panaccione R, et al. J Crohns Colitis. 2009:3;S69:Poster P148 presented at ECCO 2009. [ Links ]