Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Gen
versión impresa ISSN 0016-3503
Gen vol.67 no.1 Caracas mar. 2013
Hiperamonemia en niños: clasificación y opciones terapéuticas
Autores: Andrea Nogales, Karolina López, Dianora Navarro, Adalis Rossell, Betzabeth Quintana, Enicar Perla, Credy Figuereo, Katiuska Belandria
Afiliación: Unidad de Gastroenterología y Nutrición Pediátrica, "Dra. Georgette Daoud" Hospital Dr. Miguel Pérez Carreño, IVSS. Caracas, Venezuela
Revista GEN (Gastroenterología Nacional) 2013;67(1):11-15. Sociedad Venezolana de Gastroenterología, Caracas, Venezuela. ISSN 0016-3503.
Autor Correspondiente: Dra. Dianora Navarro. Médico Gastroenterólogo Pediatra. Unidad de Gastroenterología y Nutrición Pediátrica, Dra. Georgette Daoud, Hospital Dr. Miguel Pérez Carreño, IVSS, Caracas,Venezuela.
Correo-e: dianora.navarro@gmail.com
Resumen
Introducción: La hiperamonemia se presenta en forma secundaria por aumento en la producción de amonio, como en la hemorragia gastrointestinal o disminución de la eliminación, como ocurre en errores innatos del metabolismo, principalmente en aquellos con defectos en el ciclo de la urea, insuficiencia hepática o fármacos. Objetivo: clasificar la hiperamonemia y reportar las opciones terapéuticas en niños, su abordaje clínico y revisión de la literatura. Método: Estudio prospectivo, descriptivo y transversal de niños con hiperamonemia. Variables: edad, género, etiología, niveles de amonio, clínica, tratamiento. Resultados: 21 pacientes, 12 (57,12%) varones y 9 (42,88%) hembras. Edad promedio 3,91 años (rango:<1mes-14 años). Amonio promedio general 214,66 mmol/l (rango:110-980), clasificados según severidad: sin insuficiencia hepática 11/21 con promedio de amonio 99,44 y 201 mmol/l en hiperamonemia leve y moderada respectivamente. Clínica y laboratorio de insuficiencia hepática en 10/21 con promedio de amonio de 114,44, 287,51 y 756,66 en leve, moderada y severa hiperamonemia, con una diferencia significativa entre el nivel de amonio y la presencia o ausencia de insuficiencia hepática (p<0,0001); 5/10 con insuficiencia hepática ingresaron a terapia intensiva, 4 de ellos presentaron encefalopatía hepática, un paciente fallecido. Etiología: Error innato del metabolismo 33,33%, toxicidad por medicamentos 23,80%, hepatitis viral A fulminante 19,04% y otros virus 9,52%, hepatitis autoinmune 4,76% y urosepsis 4,76%. En los casos leves-moderados se administró lactulosa dosis respuesta vía oral 19/21 y por enema rectal 7/21 con L-carnitina en 15/21 y en Hiperamonemia severa adicionalmente Benzoato de sodio en 4/21 y hubo indicación de hemodiálisis en 3 pacientes. Restricción proteica en todos, vitaminoterapia y 6 niños tratados con ácido ursodeoxicólico. Conclusiones: la hiperamonemia es multifactorial, requiere diagnóstico temprano, la clasificación de severidad permite el tratamiento oportuno para evitar complicaciones y desarrollo de secuelas neurológicas irreversibles.
Palabras clave: Hiperamonemia, insuficiencia hepática, encefalopatía hepática, benzoato de sodio, lactulosa, L-carnitina.
Hyperammonaemia in children: Classification and therapeutic options
Summary
Introduction: Hyperammonaemia occurs secondarily by increased production of ammonia, as gastrointestinal bleeding or decreased elimination, as occurs in inborn errors of metabolism, especially in those with defects in the urea cycle, liver failure or drugs. Objective: To classify the report hyperammonaemia and therapeutic options in children, its clinical approach and review of the literature. Methods: Prospective, descriptive and transversal children with hyperammonaemia. Variables: age, gender, etiology, ammonia levels, clinical treatment. Results: 21 patients, 12 (57,12%) males and 9 (42,88%) females. Mean age 3,91 years (range: <1m-14a). ammonium 214,66 mmol / l (range :110-980), classified according to severity: no hepatic impairment 11/21 with 99,44 average ammonium and 201 mmol / l in Hyperammoanemia mild and moderate respectively. Clinical and laboratory liver failure 10/21 with ammonium averaging 114,44, 287,51 and 756,66 as mild, moderate and severe hyperammonemia, with a significant difference between the level of ammonia and the presence or absence of liver failure (p < 0,0001), 5/10 with liver failure admitted to intensive care, 4 of them had hepatic encephalopathy, a patient died. Etiology: An inborn error of metabolism 33,33%, 23,80% drug toxicity, fulminant viral hepatitis and other viruses 19,04% 9,52% 4,76% autoimmune hepatitis and urosepsis 4,76%. In mild-moderate cases were given oral lactulose Dose 19/21 and by enema rectal 7/21 with L-carnitine in 15/21 and further severe Hyperammonemia sodium benzoate 4/21 and was indication of hemodialysis in 3 patients. Protein restriction at all, vitamin therapy and 6 children treated with ácidoursodeoxicólico. Conclusions: hyperammonemia is multifactorial, requires early diagnosis, classification of severity allows early treatment to avoid complications and development of irreversible neurological sequelae.
Key words: Hyperammonemia, liver failure, hepatic encephalopathy, sodium benzoate, lactulose, L-carnitine.
Fecha de Recepción: Septiembre 2012. Fecha de Revisión: Septiembre 2012. Fecha de Aprobación: Noviembre 2012.
Introducción
El amonio es una fuente importante de nitrógeno para la síntesis de aminoácidos y necesario para el normal balance ácido base. Cuando las concentraciones de amonio son elevadas se convierte en un compuesto tóxico.1 En el proceso de síntesis, degradación y excreción, intervienen riñón, músculo, intestino, hígado y cerebro.2-3 Es producto del metabolismo de las proteínas y sintetizado en el túbulo renal proximal a partir de la glutamina, pasa al torrente sanguíneo para ser degradado en el hígado a través del ciclo de la urea, se filtra en los riñones y se excreta por la orina.2-5 La correcta biosíntesis de urea es necesaria, la deficiencia de una de las enzimas de la ureagénesis o el fallo de transporte de sus metabolitos, implica la síntesis inadecuada de urea y la acumulación de amonio en todas las células del organismo.6
Los valores normales de amonio dependen del laboratorio pero la definición de hiperamonemia varía de acuerdo con la edad del paciente. En forma general se establece como hiperamonemia, valores superiores a 40 mmol/l (6) y en el recién nacido se consideran valores superiores a 110 -150 mmol/l.4,6
Por otra parte, el correcto diagnóstico de hiperamonemia debe establecerse en base a la clínica, el estado de hidratación del paciente, la forma de obtención de la muestra, su manipulación y transporte, porque puede conducir a errores en los valores plasmáticos reportados.7
La hiperamonemia puede ser congénita o adquirida. Entre las causas de hiperamonemia congénita se encuentran, los errores innatos del metabolismo (EIM) que causan acidemias orgánicas, defectos de oxidación de ácidos grasos y síndrome hiperinsulinismo-hiperamonemia; debido a defectos de las enzimas del ciclo de la urea y arginasa; o bien por falla en el transporte intermediario del ciclo de la urea (lisinuria con intolerancia a proteínas y síndrome de hiperornitinemia-homocitrulinuria-hiperamonemia).4,8-9
La hiperamonemia adquirida es causada por persistencia del conducto venoso, shunt porto-cava, hipovolemia, falla cardíaca congestiva,10 asfixia perinatal,11-12 infecciones por gérmenes productores de ureasa, tratamiento con ácido valproico,13 desnutrición, falla hepática de origen tóxico o infeccioso14 y síndrome de Reye.6
La clínica es similar en ambos grupos, observándose manifestaciones neurológicas, vómitos persistentes, hepatomegalia, alcalosis respiratoria por estimulación del centro respiratorio, insuficiencia hepática que puede progresar en algunos casos hasta encefalopatía.15 El tratamiento busca evitar la acumulación del amonio, recuperar la homeostasis y asegurar una ingesta que permita el crecimiento y desarrollo de los niños afectados sin comprometer el futuro neurológico y su vida.9,15 En este estudio el objetivo fue clasificar la hiperamonemia y reportar las opciones terapéuticas en niños, su abordaje clínico y revisión de la literatura para mejorar la atención del paciente y reducir la morbilidad y mortalidad asociada a esta entidad clínica en la edad pediátrica
Pacientes y métodos
Se realizó un estudio prospectivo, descriptivo y transversal donde se incluyeron niños con diagnóstico de hiperamonemia atendidos en la Unidad de Gastroenterología y Nutrición Pediátrica del Hospital Dr. Miguel Pérez Carreño, en el periodo comprendido desde Enero 2008 hasta Marzo 2012. Las variables estudiadas fueron: edad, género, etiología, niveles de amonio, presentación clínica, insuficiencia hepática con o sin encefalopatía y tratamiento.
Los niveles de amonio fueron analizados según los rangos normales para la edad. De acuerdo a la literatura y laboratorios de referencia, los valores de amonio considerados como normales fueron: pretérminos <150 mmol/l, recién nacidos <110 mmol/l, lactantes, niños y adolescentes <40 mmol/l.16,17 La escala de severidad para la clasificación de hiperamonemia utilizada en este estudio se elaboró considerando referencias médicas establecidas para indicaciones de tratamiento,16-18 Cuadro 1. Resultados de amonio dudosos fueron repetidos.
Los resultados se procesaron con medidas de resumen, frecuencia y porcentajes. Se utilizo el T de student para determinar la asociación entre el promedio de amonio y la presencia o ausencia de insuficiencia hepática.
Resultados
De 21 pacientes estudiados, en la Cuadro 2, se muestra la edad y distribución según el género, donde el 57,12% fueron de género masculino y 42,88% femenino. La edad promedio de los niños fue 3,91 años, rango de <1 mes y 14 años. El grupo conformado con lactantes mayores y preescolares fue el más afectado 47,61%, seguido de los lactantes menores con 33,33%.
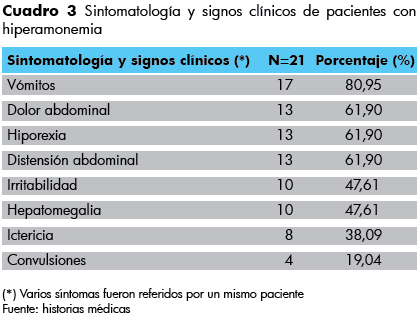
La sintomatología más frecuentemente referida fue vómitos (80,95%), hiporexia, dolor y distensión abdominal cada uno (61,90%), Cuadro 3.
Se encontró que el promedio general de amonio fue 214,66 mmol/l con un rango entre 110-980 mmol/l. Considerando la presencia o ausencia de insuficiencia hepática, 11/21(52,38%) pacientes reportaron hiperamonemia sin insuficiencia hepática; de los cuales 9 niños presentaron hiperamonemia leve y 2 moderada, el promedio de amonio fue 99,44 y 201 mmol/l para hiperamonemia leve y moderada respectivamente. Ningún niño sin insuficiencia hepática presentó hiperamonemia severa.
Clínica y laboratorio de insuficiencia hepática se observó en 10/21 (47,62%), 5 niños con hiperamonemia leve, 2 con moderada y 3 con severa; el promedio de amonio fue de 114,44, 287,51 y 756,66 mmol/ en leve, moderada y severa, respectivamente.
Al comparar los promedios de hiperamonemia y la presencia de insuficiencia hepática se encontró una diferencia significativa (p<0,0001) entre los grupos, los mayores niveles de amonio se asociaron con insuficiencia hepática, Cuadro 4.
En el Cuadro 5, se muestra la relación entre el nivel de amonio promedio y la presencia de insuficiencia hepática con o sin encefalopatía, donde 4/10 niños con insuficiencia hepática, presentaron encefalopatía hepática; 5/10 ingresaron a terapia intensiva, y uno falleció por hiperamonemia severa de 980 mmol/l; se trataba de un escolar de 10 años con hepatitis tipo A fulminante, con indicación de hemodiálisis, no disponiendo de este recurso en el centro hospitalario. También se observó hiperamonemia severa en una niña con hepatitis autoinmune y en el lactante que presentó con hepatitis colestásica secundaria a urosepsis.
En la Figura 1, se muestra la etiología de los niños evaluados. Las causas más frecuente fueron: EIM en el 33,33%, toxicidad por medicamentos 23,80% y hepatitis viral A fulminante 19,04%. Entre los niños con error innato del metabolismo, 6 tenían déficit de biotinidasa, 3 desarrollaron hiperamonemia moderada, de ellos 2 con insuficiencia hepática con colestasis, y un niño presentó acidemia orgánica. Los medicamentos que ocasionaron toxicidad fueron el ácido valproico en 4 niños y en uno, el fenobarbital. Uno de los niños con toxicidad por ácido valproico, desarrolló insuficiencia hepática con hiperamonemia moderada. Desde el punto de vista infeccioso, otros virus implicados, además del virus A en la insuficiencia hepática fueron el Citomegalovirus y el Epstein Barr.
El tratamiento indicado en los pacientes fue durante la etapa aguda del diagnóstico, todos se encontraban hospitalizados. En el caso de hiperamonemia leve y moderada se indicó restricción proteica entre 0,3-0,5 gr/kg de peso/día, mantenimiento del estado de hidratación, vía endovenosa con aporte adecuado de glucosa, dependiendo de las condiciones. La administración de lactulosa a dosis respuesta se utilizó vía oral en 19/21 (90,47%) y por enema rectal 7/21 (33,33%). La L-carnitina se administró vía oral a dosis entre 50-100mg/kg/día dividido en dos o tres tomas diarias en 15/21 (71,42%). En 4/21 (19,04%), pacientes con hiperamonemia severa que se encontraban en terapia intensiva se les administró benzoato de sodio en a dosis de 250-300 mg/kg de peso/día, cada 6 horas por vía oral o endovenosa.
En los pacientes con encefalopatía hepática se omitió el aporte de proteínas, recibieron antibiótico vía endovenosa y descontaminación intestinal con gentamicina vía oral o rifaximina, adicionalmente al uso de lactulona, L-carnitina y benzoato de sodio.
El ácido ursodeoxicólico fue recibido por 6 niños. A los pacientes con déficit de biotinidasa se les suministró biotina, en algunos casos se adicionó al tratamiento coenzima Q10, vitamina E, K y C. Los 3 pacientes en terapia intensiva tenían indicación de hemodiálisis.
Discusión
El correcto diagnóstico de hiperamonemia debe establecerse en base a la clínica, el estado de hidratación del paciente, y la forma de obtención de la muestra, lo cual es primordial porque puede conducir a errores diagnósticos. Existen factores que pueden influir en los valores, por ello en este trabajo los resultados dudosos fueron repetidos, tal como lo sugiere Broomfieldy cols.,16 quienes mencionan además la importancia del amonio como indicador del deterioro del metabolismo intermediario. Por otra parte, se recomienda usar una vía venosa o arterial de calibre grueso, sin manguito, la sangre debe depositarse en un tubo con EDTA, y medidas especiales para el transporte (no contacto con aire ambiente, conservación en frio) ya que después de una hora el amonio es sintetizado en células sanguíneas.18
La clasificación de severidad de hiperamonemia elaborada en este trabajo fue de utilidad y permitió realizar el diagnóstico de acuerdo a la edad del niño y según la severidad, se instauró el tratamiento. Así mismo, el nivel de amonio y su interpretación según la edad, como fue adoptado en este estudio, ha sido igualmente aceptado por algunos autores, ya describen que el nivel de normalidad varía con la edad.2,17 A diferencia de otros, que señalan que los niveles de amonio probablemente no varíen tanto con la edad, aunque los recién nacidos pueden tener valores de hasta 65 mmol/, y hacen la excepción de que los prematuros y recién nacidos enfermos, aun aquellos que no tengan un trastorno del metabolismo primario pueden tener valores mucho mayores, dado la capacidad del amonio de elevarse durante una enfermedad generalizada, particularmente en el periodo neonatal.16
Por otra parte, considerando la etiología, la hiperamonemia es un problema frecuente en pacientes pediátricos especialmente en recién nacidos con EIM, en este trabajo el 33,33% fue por esa causa y eran menores de 6 meses, y durante el periodo de estudio de 4 años, la mitad presentó hiperamonemia moderada y el 25% insuficiencia hepática. Bruno y cols.,19 en Montreal, en 9 años, ingresaron 91 niños a terapia intensiva por hiperamonemia, de los cuales el 23,30% era por EIM. También, en relación al tipo de EIM, la literatura reporta que la mayor incidencia ocurre en niños con defectos del ciclo de la urea (DCU) variando de 1 en 3.000 a 1 en 40.000 nacimientos,20 a diferencia de nuestra casuística donde el déficit de biotinidas fue lo frecuente, y se manifestó como una hiperamonemia secundaria a causa hereditaria, autosómica recesiva. Estimaciones internacionales plantean 1 de cada 123 personas es portador de un gen para la deficiencia.21
La toxicidad por medicamentos fue de un 23,80% en este trabajo, la mayoría por ácido valproico simultáneamente uno recibía fenobarbital. La prevalencia de hiperamonemia por intoxicación por ácido valproico en estudios retrospectivos varía de un 70 a 100%, y de 16 a 100%, en estudios transversales y longitudinales respectivamente; considerando como hiperamonemia el doble del nivel basal. Las terapias combinadas con fenitoína o carbamazepina, y especialmente con fenobarbital y topiramato, parece contribuir también a la hiperamonemia.22-24
La sintomatología presentada por los pacientes en este estudio fue similar a lo reportado en la literatura.1-2 Los síntomas son inespecíficos, varían con la edad del paciente y con el nivel de amonio y pueden incluir, entre los hallazgos más comunes: hipotonía, vómitos, letargo, convulsiones, coma, ataxia, anorexia, patrones de comportamiento anormal, debilidad, hepatomegalia.1-2,17,19
En este trabajo se observó una diferencia significativa entre el nivel de amonio y la presencia o ausencia de insuficiencia hepática (p <0,0001), donde los mayores niveles de amonio se asociaron con insuficiencia hepática, y el promedio de amonio fue de 214,66 mmol/l, cifras cercanas a lo reportado por Bruno y cols.,19 quienes estudiaron a 90 niños críticamente enfermos y encontraron que los pacientes con insuficiencia hepática con un umbral de amonio superior a 200 mmol/l, en las primeras 48 horas, tenían un riesgo aumentado de mortalidad, y el riesgo era mayor en insuficiencia hepática que en pacientes con trastornos del ciclo de la urea, y observaron una mortalidad en 31,1%. En este trabajo la mortalidad fue baja en 4,7%. Así mismo, los pacientes con hiperamonemia severa presentaron encefalopatía hepática. Urdaneta,25 en un estudio retrospectivo en adultos, encontró que existe relación entre los niveles de amonio sérico y la severidad de la encefalopatía.
Las opciones terapéuticas instauradas en los pacientes con medicamentos y medidas de sostén según la severidad de hiperamonemia, se encontraron en concordancia con diversos reportes,17-18 pero diferente a otros que recomiendan terapias según la instalación aguda o crónica.28-29 No obstante, todas fueron orientadas a la disminución del amonio.
En relación al tratamiento la restricción proteica y la vitaminoterapia en todos los pacientes, fue similar a lo señalado en los artículos.1,17,26 Se debe resaltar que en el caso de sospecha de EIM, la restricción proteína incluso su omisión puede ser una medida válida hasta que sea aclarada la etiología.18 La lactulosa y la administración de neomicina se utilizan para disminuir la absorción de amonio desde la luz intestinal.2,19 En este estudio se utilizó, la lactulosa para acidificar el medio colónico y disminuir la absorción de amonio en los casos leves-moderados con evolución satisfactoria, igual a lo descrito en la literatura.1,29 En vez de neomicina, se empleó la gentamicina vía oral y la rifaximina como descontaminación intestinal en los casos de encefalopatía. Este último medicamento, aunque aprobado en adultos con encefalopatía, fue utilizado en una niña con cirrosis hepática y encefalopatía con buenos resultados.27 La rifaximina es tan eficaz como la neomicina sin sus efectos colaterales como aumento de urea y creatinina.30
En los casos de toxicidad por ácido valproico se procedió a omitir previa consulta al servicio de neurología con normalización de niveles de amonio.
En la hiperamonemia severa adicionalmente se utilizó el benzoato de sodio como los reportados18,25 con descenso progresivo del amonio sérico. El benzoato de sodio provee una vía alterna de excreción renal del amonio,10,28-29 su administración vía oral puede ser con los alimentos y vía endovenosa con infusión al 10% lenta para evitar vómitos, hipernatremia y acidosis metabólica.28-29
El tratamiento con suplementos de L-carnitina puede conducir a una respuesta clínica favorable debido a la deficiencia de carnitina inducida por ácido valproico,22,29-30-31 como fue utilizado en esos casos, así como en otros niños, ya que la L-carnitina tiene un efecto metabólico en la disminución de niveles de lactato cerebral y contribuye con el manejo de edema, o lo evita.28-29
La exanguinotransfusión y la diálisis peritoneal conjuntamente o hemodiálisis cuando existen valores por encima de 500 mml/l son utilizadas como opciones terapéuticas en hiperamonemia severa y en coma metabólico por hiperamonemia.17 Estas medidas son formas efectivas para eliminar el amoníaco y han sido útiles en el tratamiento de la hiperamonemia asociada con trastornos del ciclo de la urea en niños y adultos. Estas intervenciones podrían servir como un puente potencial para los adultos con insuficiencia hepática fulminante que están en espera de trasplante.29 No obstante, son técnicas no siempre disponibles y existe poca experiencia en niños muy pequeños. La diálisis debe ser una prioridad, ya que puede ser el método ideal para la rápida remoción del amonio. Además, las intervenciones a través de diálisis aguda en pacientes con hiperamonemia llevan a mejores resultados.1,18,26 En este estudio, 3 pacientes tuvieron indicación de hemodiálisis pero por la limitación de este recurso en el centro hospitalario no se pudo realizar.
Actualmente existe la posibilidad de trasplante hepático y de hepatocitos3,19 que sumado al diagnóstico precoz y al manejo dietario y farmacológico, ha mejorado el pronóstico. Se concluye, que la hiperamonemia es multifactorial, requiere diagnóstico temprano, la clasificación de severidad permite indicar el tratamiento oportuno para evitar complicaciones y desarrollo de secuelas neurológicas irreversibles.
Clasificación del trabajo
Área: gastroenterología
Tipo: clínico
Tema: hiperamonemia en niños
Patrocinio: este trabajo no ha sido patrocinado por ningún ente gubernamental o comercial.
Referencias bibliográficas
1. Auron A, Brophy PD. Hyperammonemia in review: pathophysiology, diagnosis and treatment. Pediatr Nephrol 2012;27(2):207-222. [ Links ]
2. Carrillo R, Noriega M, Sánchez R. Amonio e hiperamonemia. Su significado clínico. Revista de Investigación Médica Sur, 2008; 15(3):209-213. [ Links ]
3. Verrotti A, Trotta D, Morgese G, Chiarelli F. Valproate-induced hyperammonemic encephalopathy. Metab Brain Dis 2002;17:367-73. [ Links ]
4. Enns G, Packman S. Diagnosing Inborn Errors of Metabolism in the Newborn: Laboratory Investigations. Neo Reviews. 2001;2:192-200. [ Links ]
5. Mathias RS, Kostiner D, Packman S. Hyperammonemia in urea cycle disorders: role of the nephrologist. Am J Kidney Dis 2001;37: 1069-80. Review. [ Links ]
6. Pintos G, Vilaseca MA, Briones P, Sanjurjo P. Trastornos del ciclo de la urea Protocolo de diagnóstico y tratamiento de los trastornos del ciclo de la urea. Disponible en: http://www.ae3com.org/documentos/ciclourea.Pdf. Citado, mayo 12. [ Links ]
7. Dufour R. Guías del laboratorio para screening, diagnóstico y monitoreo de la lesión hepática. Acta Bioquímica Clínica Latinoamericana 2005. [ Links ]
8. Ogier H. Management and emergency treatments of neonates with a suspicion of inborn errors of metabolism. Semin Neonatol. 2002;7:17-26. [ Links ]
9. Martins I. Una aproximación a los desórdenes hereditarios del ciclo de la urea en el hombre. Rev Biomed 2005;16(3):196-204. [ Links ]
10. Kaisa A, Enns G. Pharmacology Review: Sodium Phenylacetate and Sodium Benzoate in the Treatment of Neonatal Hyperammonemia. Neo Reviews. 2006;7:e486. [ Links ]
11. Wilcken B. Problems in the management of urea cycle disorders. Molecular Genetics and Metabolism. 2004;81:S86-S91. [ Links ]
12. Scaglia F, Carter S, O´Brien W, Leea B. Effect of alternative pathway therapy on branched chain amino acid metabolism in urea cycle disorder patients. Molecular Genetics and Metabolism. 2004; 81:S79-S85. [ Links ]
13. Enkai S, Yamamoto M, Hayashi K, Kobayashi M, Sasajima T, Amizuka T, Abo W. Experience of continuous haemodiafiltration in a male neonate with ornithine transcarbamylase deficiency. Eur J Pediatr. 2003;162:729-730. [ Links ]
14. Augusto Quevedo V, José Ignacio Duque M. El niño en estado crítico. Corporación para investigaciones biológicas. Primera Edición. Medellín, Colombia. 2001. [ Links ]
15. Pelligra G, Cortiana C, Brundi M. Hiperamoniemia Neonatal. Revisión Bibliográfica. A propósito de un caso. Revista del Hospital Materno Infantil Ramón Sarda. Buenos Aires. Argentina. 2003;22(4). [ Links ]
16. Broomfield A, Grunewald S. How to use serum ammonia. Arch Dis Child Educ Pract 2012;97:72-77. [ Links ]
17. Häberle J. Clinical practice. The management of hyperammonemia. Eur J Pediatr 2011;170(1):21-34. [ Links ]
18. Protocolo Hispanoluso de diagnóstico y tratamiento de la hiperamonemia en pacientes neonatos y de más de 30 días de vida. 2da Edición 2009 ERGON. Disponible en: http://www.ae3com.eu/noticias/protocolo-hispano-luso-hiperonemias.pdf. [ Links ]
19. Ozanne B, Nelson J, Cousineau J, Lambert M, Phan V, Mitchell G. Threshold for toxicity from hyperammonemia in critically ill children. J Hepatol 2012;56:123-128. [ Links ]
20. Brusilow S, Horwich A. Urea cycle enzymes. En: Scriver Ch, Beaudet A, Sly W, Valle D, editores. The metabolic and molecular bases of inherited disease. 8th ed. New York: McGraw-Hill Inc. 2001;2:1937. [ Links ]
21. González E, Marrero N. Deficiencia de Biotinidasa. Bioquimica 2002;27(3):80-86. [ Links ]
22. Segura-Bruna N, Rodríguez-Campello A, Puente V, Roquer J. Valproate-induced hyperammonemic Encephalopathy. Acta Neurol Scand 2006;114:1-7. [ Links ]
23. Young P, Finn BC, Álvarez F, Bruetman JE, Trimarchi H. Encefalopatía asociada a valproato. Rev Med Chile 2007;135:1446-9. [ Links ]
24. Alqahtani S, Federico P, Myers RP. A case of valproate-induced hyperammonemic encephalopathy: look beyond the liver. Can MedAssoc J 2007;177:568-9. [ Links ]
25. Urdaneta Y. Relación del amonio sérico con la severidad de la encefalopatía hepática. Gen. 2008;62(1):44-48. [ Links ]
26. Galal NM, Fouad HM, Saied A, Dabnon M. Hiperamonemia en el servicio de urgencias de atención pediátrica. Pediatr Emerg Care. 2010;26(12):888-91. [ Links ]
27. Mallaa I, Torres V, Villac A, Cheanga Y, Giacovea G, Pedreiraa A, Silvad M. Rifaximina para encefalopatía hepática en niños. Caso clínico. Arch Argent Pediatr 2011;109(6):113-115. [ Links ]
28. Arnold K, Olivares Z, Francisco N, Ibarra I, Belmont L, Vela M. Tratamiento de la hiperamonemia en pediatría. Acta Pediatr Méx 2005;26(6):313-324. [ Links ]
29. Clay A, Hainline B. Hyperammonemia in the ICU. Chest 2007;132(4):1-19. [ Links ]
30. Phongsamran P, Kim J, Cupo Abbott J, Rosenblatt A. Pharmacotherapy for hepatic encephalopathy. Drugs 2010;70(9):1131-48. [ Links ]
31. Lheureux P, Penaloza A, Zahir S, Gris M. Carnitine in the treatment of valproic acid-induced toxicity-what is the evidence. Critical Care 2005;9:431-40. [ Links ]