Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Gen
versión impresa ISSN 0016-3503
Gen vol.68 no.2 Caracas jun. 2014
Ecoendoscopia digestiva radial y lineal como método diagnóstico de las lesiones quísticas del páncreas. Hallazgos
Leonardo Sosa-Valencia,1 Gustavo Navas,2 Lidia Rodríguez,1 Julio Ramos,1 Alejandro Bethelmy,1 Víctor González1
1 Gastroenterólogo-ecoendoscopista.
2 Anatomopatólogo-citólogo. CITE. Centro de Investigaciones Tecnológicas Ecoendoscópicas. Caracas - Valencia - Barquisimeto - Puerto Ordaz - Maturin - Puerto La Cruz, Venezuela.
Autor correspondiente: Dr. Leonardo Sosa-Valencia. 1 Gastroenterólogo-ecoendoscopista. CITE. Centro de Investigaciones Tecnológicas Ecoendoscópicas. Caracas - Valencia - Barquisimeto - Puerto Ordaz - Maturin - Puerto La Cruz, Venezuela. Correo-e: lsosavalencia@gmail.com
Introducción
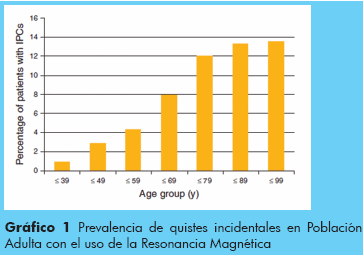
Los quistes del páncreas comprenden un amplio espectro de lesiones que se diagnostican muchas veces de forma incidental, o porque producen complicaciones que pueden llegar a dar síntomas como dolor abdominal, obstrucción bilio-pancreática o pancreatitis aguda o recurrente.1 Sin embargo los quistes de páncreas son lesiones más frecuentes de lo estimado, actualmente casi tres personas de cada cien personas asintomáticas desde el punto de vista pancreático son portadoras de un quiste pancreático, desde variedades benignas pasando por lesiones con potencial maligno de diferentes grados hasta quistes con adenocarcinoma localmente avanzado. En un trabajo reciente de Laffan et al2 se detectaron 74 (2,6%) quistes pancreáticos en 2832 tomografías de pacientes sin síntomas pancreáticos como se observa en la Figura 1.
Otras cifras son más alarmante como la publicada por Lee y col (3), en donde 84 (13,5%) quistes pancreáticos fueron detectados en 616 estudios de resonancia magnética, observamos entonces una nueva prevalencia que varía entre 2,6% a 13,5% en diferentes series dependiendo de la edad de los pacientes, lo cierto es que nuestra apreciación anterior estaba muy por debajo de la realidad actual, es posible que el desarrollo tecnológico contribuya con este aumento y no un aumento directo de la enfermedad quística del páncreas (Gráfico 1).
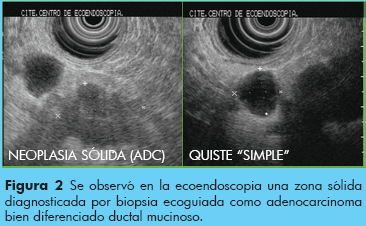
Otros se diagnostican al producir manifestaciones clínicas como dolor abdominal, ictericia, pancreatitis aguda (a veces recurrente), pérdida de peso.1 Sin embargo, entre 50 y 80% son diagnosticados actualmente en forma incidental al realizar una resonancia magnética nuclear y/o tomografía multicorte o un ultrasonido endoscópico (USE) (USE) por razones no relacionadas con el quiste ya que en estos casos son asintomáticos. Algunas de estas lesiones asintomáticas durante su evaluación son malignas o tienen potencial maligno significativo, de allí el problema de establecer conductas de tratamiento o seguimiento. Por ejemplo en el paciente anterior se detecto un adenocarcinoma menor a 15 mm incluido en el quiste simple de la tomografía previa, ver Figura 2 y 3.
La nomenclatura de dichas lesiones ha sido confusa e inconsistente; en general se clasifican en,4 adaptación del autor:
a. Quistes congénitos verdaderos:
- Quiste simple verdadero.
- Enfermedad poliquística del páncreas aislada.
- Enfermedad poliquística del páncreas asociada con la enfermedad de Von Hippel Lindau.
- Quiste del páncreas asociado con enfermedad poliquística de los riñones.
- Macroquiste pancreático asociado con fibrosis quística.
- Quiste dermoide.
b. Neoplasias quísticas primarias:
BENIGNAS
- Cistoadenoma seroso.
- Linfangioma.
- Teratoma quístico.
- Hemangioma.
- Paranganglioma.
PREMALIGNOS
- Neoplasia quística mucinosa (Cistadenoma mucinoso).
- Neoplasia epitelial quística papilar (sólido papilar o pseudopapilar).
- Neoplasia mucinoso papilar intraductal benigno (NMPI-b) o neoplasia intraductal papilar mucinosa (NIPM-b) o ectasia ductal mucinosa, que se subclasifica a su vez, según su localización en tipo ducto principal, ducto secundario o ductal mixta principal y secundario
MALIGNOS
- Cistoadenocarcinoma mucinoso.
- Neoplasia mucinoso papilar intraductal maligno (NMPI-m) o neoplasia intraductal papilar mucinosa (NIPM-m).
- Cistoadenocarcinoma de células acinares.
- Coriocarcinoma quístico.
c. Quistes adquiridos:
- Pseudoquiste pancreático.
- Quistes de retención.
- Quistes parasitarios (por equinococo y por Taenia solium).
d. Quistes extrapancreáticos que simulan quistes pancreáticos:
- Quistes esplénicos.
- Quistes retroperitoneales.
- Quistes adrenales.
- Quistes de duplicación.
e. Lesiones quísticas misceláneas:
- Quiste linfoepitelial.
- Quiste endometrial.
- Necrosis quística de carcinoma pancreático y linfoma.
- Tumores quísticos de células de los islotes o neuroendocrino quístico.
Desde el punto de vista práctico el siguiente algoritmo podría ser muy útil: Gráfico 2.
Hasta hace poco la literatura mostraba las siguientes cifras: de todos los quistes pancreáticos los pseudoquistes representan el 70 al 90%, las neoplasias quísticas primarias representan el 10 a 15% (más frecuentes las mucinosas), y el resto corresponden a menos del 5%.3 Menos del 1% de los cánceres pancreáticos se originan en una neoplasia quística.6 Los sitios más comunes de localización intrapancreática de estas lesiones son el cuerpo y el cuello. La sobrevida a 5 años para los tumores malignos quísticos pancreáticos es de menos del 5%.
Actualmente estas cifras han cambiado y aún están por definirse sin embargo podríamos sugerir en que menos del 50% de los quistes son pseudoquistes, el resto son predominantemente lesiones mucinosas donde en su mayoría son NMPI-b y de estas un 30% ya tienen degeneración maligna por tanto son NMPI-m, con grupo menor al 10% restante de lesiones como cistadenomas serosos, neoplasias sólidos pseudopapilares, neoplasias quísticas mucinosas (cistadenomas mucinosos) y quistes neuroendocrinos, datos obtenidos basándonos en un centro de referencia de lesiones pancreáticas como CITE en Venezuela.
Entre las neoplasias quísticas, las de mayor potencial de malignidad y peor pronóstico, son las neoplasias productoras de mucina, que incluyen la neoplasia mucinoso papilar intraductal (NMPI-m), el neoplasia quística mucinoso y el cistoadenocarcinoma mucinoso.7,8 Sin embargo siempre se deben tener en mente en el diagnóstico diferencial la gran variedad de lesiones benignas y benignas con bajo potencial maligno (NMPI-b), que implican pronóstico, seguimiento y tratamiento diferentes.9,10,11 Es importante señalar que muchas neoplasias quísticas mucinosas pueden tener segmentos de adenocarcinoma y la masa observada no representa un tumor maligno en su 100%, igualmente las neoplasias mucinosas papilares intraductales se malignizan en forma segmentaria y a veces multifocal por lo cual no necesariamente constituyen una lesión maligna en un 100%. Por último en las zonas sólidas podemos encontrar células de páncreas benigno que pasan por diferentes grados de diferenciación hasta transformarse en una verdadera neoplasia maligna tipo adenocarcinoma.
La historia clínica contribuye poco al diagnóstico etiológico al igual que la ecografía abdominal y la tomografía multicorte. En los Pseudoquistes pancreáticos generalmente existe la historia de la pancreatitis aguda la cual difícilmente pasa inadvertida, también la pancreatitis aguda puede preceder el diagnóstico de un NMPI-m fundamentalmente, y a veces en casos de NMPI-b. La mayoría de los quistes malignos (85%) son sintomáticos en su presentación (dolor abdominal, nauseas, vómito, pérdida de peso); por su localización ocasionalmente producen ictericia en estadios avanzados cuando se originan del cuerpo e invaden la cabeza o en estadios incipientes que están próximos a la vía biliar principal (zona retro-pancreática de la cabeza); para que se produzca pancreatitis se requiere que obstruyan el conducto pancreático lo cual también es ocasional. La historia de pancreatitis reciente o la clínica de pancreatitis crónica orientan hacia el Pseudoquiste pancreático como etiología de la lesión,12 sin embargo, la pancreatitis recurrente no descarta un tumor quístico como etiología.13 Se debe ser muy cuidadoso en la evaluación dado que el error clínico más común es tratar una neoplasia quística como un Pseudoquiste benigno con las implicaciones pronosticas de esta conducta.14
El Ultrasonido Endoscópico (USE) por su capacidad de evaluar completamente el páncreas con mayor detalle y resolución que cualquier otro método diagnóstico, cada vez tiene mayor papel en la evaluación y manejo de estas lesiones; además permite evaluar a través de la biopsia la celularidad del quiste y obtener líquido para realizar estudios especiales que incluyen marcadores tumorales como el ACE, Ca19-9, Ca 72-4, junto con amilasa, lipasa, mucina y más aún estudios del DNA al igual que mutaciones del K-ras entre otras. Las neoplasias quísticas del páncreas se dividen desde el punto de vista histológico de acuerdo al tipo de epitelio de revestimiento en su superficie interna, en dos grandes grupos: neoplasias serosas y neoplasias mucinosas. En este capítulo profundizaremos en las características de las diferentes imágenes y en las biopsias transendoscópicas de las lesiones quísticas pancreáticas de mayor frecuencia clínica.
Es importante señalar que la evaluación es producto de una imagen de conjunto que implica visualización de la lesión y del páncreas desde el proceso uncinado hasta la cola ubicándose en la segunda porción del duodeno desde la zona de la papila de váter hasta el cuerpo del estómago en curvatura mayor y cara posterior, logrando en tiempo real cortes milimétricos ayudados por la utilización de diferentes frecuencias y diferentes ganancias y contrastes de grises lo cual yo he denominado el protocolo endosonográfico del páncreas que permite aflorar detalles de los quistes que muchas veces son desapercibidos por la técnica convencional debido a los procesos de pancreatopatía de esteatosis y de pancreatitis crónica que generalmente acompañan en el parénquima pancreático circunvecino.
Hallazgos Endosonográficos más frecuentes
PSEUDOQUISTE PANCREATICO
Lesión quística que en el ultrasonido endoscópico (USE) se ve como lesión redondeada anecoica y de pared gruesa, que generalmente es adherente a la pared gástrica o duodenal; generalmente en el páncreas adyacente, se encuentran signos de pancreatitis aguda o crónica; pueden verse linfonodos inflamatorios regionales; rara vez se encuentran septos en su interior, y de acuerdo a su evolución pueden encontrarse frecuentemente detritos en su interior, que lo ayudan a diferenciar de otro tipo de lesiones quísticas, en las cuales los detritos son muy raros. El paciente por lo general tiene historia de pancreatitis moderada a severa reciente. La fisiopatología es necrosis de licuefacción de áreas de pancreatitis, su evolución tiene varios estadíos que incluyen: colección líquida aguda, pseudoquiste agudo, pseudoquiste crónico, necrosis pancreática temprana, necrosis pancreática organizada tardía y ocasionalmente puede llegar a absceso pancreático; el líquido interno se caracteriza por ser delgado, turbio y generalmente de color marrón. A la citología se encuentran histiocitos, neutrófilos y macrófagos, el encontrar abundantes leucocitos sugiere infección activa; La coloración para mucina es negativa. Tienen altos niveles de amilasa y lipasa. Son susceptibles de tratamiento endoscópico (USE) ecoguiado o quirúrgico cuando son persistentes, o causan síntomas como dolor o pancreatitis recurrente.15 No tienen potencial maligno.16 En fin, una lesión quística sin tabiques o septos, con componente líquido fluido (anecogénico) sin componente tumoral verdadero, sino áreas ecogénicas flotando o en zonas de declive (necrosis y o coágulos), y dentro o en la periferia de un páncreas con anomalías parenquimatosas sugiere pseudoquiste con sensibilidad de 94% y Especificidad de 85%. Existen pseudoquiste múltiples que pueden separarse por tabiques finos y a veces observamos restos de páncreas hacia el área superior y derecha. El conducto de wirsung puede dilatarse en presencia de un pseudoquiste aunque esto debe sugerir más NMPI de páncreas. Los vasos arteriales y venosos podrían presentar signos de trombosis, y existe generalmente red venosa perigástrica aumentada, por lo cual su biopsia puede acarrear complicaciones de hemorragia e infección. Los pseudoquistes pequeños (intrapancreáticos) con áreas de necrosis aséptica pueden simular una neoplasia sólida necrosada por lo cual se sugiere antibioticoterapia a dosis terapéuticas antes de realizar una punción ecoguiada con fines diagnósticos y poder prevenir infección secundaria de la necrosis. La obtención de un macro con material grisáceo grumoso grueso es casi diagnóstica de necrosis (Figura 4).

La ausencia de una pancreatitis aguda reciente se traduce en un diagnóstico muy poco probable de pseudoquiste y siempre está desprovisto de epitelio de recubrimiento interno.
NEOPLASIA MUCINOSO PAPILAR INTRADUCTAL (NMPI) o NEOPLASIA INTRADUCTAL PAPILAR MUCINOSA (NIPM)
Se define como una patología consistente en dilatación del conducto pancreático principal y/o conductos colaterales, asociados con sobreproducción de mucina;17,18 es más frecuente en hombres de 60 a 70 años de edad, y a diferencia de las otras lesiones mucinosas, se localiza más frecuentemente en la cabeza del páncreas; 19 Se ha propuesto en la patogénesis que sigue la secuencia Hiperplasia, luego adenoma y luego carcinoma, aunque con una progresión muy lenta; se encuentran alteraciones genéticas del gen delecionado en cáncer pancreático (DPC-4) en 100% de los casos, y de los genes de mucina (MUC 2) en el 81% y (MUC5AC) en el 83% de los casos. Se encuentra una lesión intraductal en la cual la imagen quística corresponde en realidad a una dilatación marcada del conducto pancreático del área de la lesión, además de dilatación retrógrada del resto del conducto. Está filogenéticamente relacionado con las lesiones quísticas mucinosas, pero a diferencia de estas, se origina en el epitelio ductal.20


En la ultrasonografía endoscópica se observa dilatación del conducto pancreático principal o de ramas colaterales, y puede verse la lesión como un quiste septado que puede tener componentes sólidos, con o sin áreas hiperecóicas en su interior; también se puede encontrar engrosamiento hiperecoico o hipoecoico de la pared ductal y lesiones hiperecóicas intraductales;21 El ultrasonido endoscópico (USE) tiene sensibilidad de 86%, especificidad del 99%, valor predictivo positivo de 78% y valor predictivo negativo de 99% para el diagnóstico de estos tumores.22 Es muy difícil diferenciar mediante ultrasonido las lesiones benignas de las parcialmente malignas, así como definir resecabilidad de estas lesiones, dado que no es posible con el ultrasonido diferenciar entre áreas hipoecoicas de malignidad y áreas de inflamación focal que infiltren el paremquima pancreático; por el contrario, es relativamente fácil diferenciar este tipo de lesión de otros tipos de quistes, dados sus componentes sólidos papilares definidos;23 como la clínica es muy similar a la de los pacientes con pancreatitis crónica, es importante diferenciarlos mediante el ultrasonido; se ha descrito que si existe menos de 1 parámetro de pancreatitis crónica en el paremquima pancreático, es muy probable el diagnóstico de este tumor con OR=43.84 (95% IC: 4, 465). Se encuentra cáncer en el 15 al 60% de las resecciones pancreáticas por este tipo de tumor, aunque en estos casos el pronóstico es mejor que en pacientes con adenocarcinoma pancreático ductal, dado que da metástasis linfonodales hasta en un 22% de los casos y la sobrevida a cinco años es de hasta 81%.24,25 Frecuentemente el paciente tiene historia de dolor abdominal y pancreatitis, aunque también se pueden encontrar de forma incidental. El líquido que lo compone es transparente, viscoso o fibroso; este se aspira directamente del ducto pancreático; en la citología se encuentran células columnares mucinosas con atipia variable y cohesividad disminuida, con celularidad moderada a alta; la coloración para mucina es marcadamente positiva.26,27,28 Tiene potencial maligno. En la endoscopia o en la colangiopancreatografía retrógrada endoscópica puede verse salir moco del orificio pancreático, lo cual aunque es un signo patognomónico, tiene sensibilidad de solo 20 a 55%. Si el ducto pancreático esta dilatado y no se encuentran en paremquima pancreático importantes signos de pancreatopatia crónica, se debe sospechar esta lesión.
El IPMT es a su vez subclasificado en dos categorías de acuerdo a la distribución del tumor: tipo ducto principal y tipo ducto secundario. El tipo ducto principal se caracteriza por la presencia de la masa tumoral principal en el ducto principal, de forma focal, segmental o difusa, y usualmente asociado a dilatación de todo el ducto pancreático principal; en el tipo ducto secundario, la masa tumoral principal se localiza en el ducto colateral, el cual esta dilatado, quístico y en etapas tardías puede invadir el ducto principal, este tipo se localiza más frecuentemente en el proceso uncinado del páncreas y tiene mejor pronóstico que el del tipo ducto principal, cuando su diámetro es menor de 25 mms casi siempre son benignos, y cuando su diámetro es mayor de 30 mms se recomienda manejo quirúrgico.29
En el diagnóstico del NMPI es importante: diferenciarlo de otras enfermedades pancreáticas, diferenciar lesiones benignas de malignas, evaluar la extensión del tumor a lo largo del conducto pancreático principal e investigar la presencia de carcinoma pancreático ductal coexistente.
Para definir malignidad en estas lesiones se han propuesto como criterios: protrusión de masa dentro del conducto tenga más de 3 mms de tamaño, conducto pancreático principal con diámetro mayor de 8 mms, o disrupción de la pared del ducto pancreático por el tumor; sin embargo para definir esto se requiere el uso de minisondas de ultrasonido, las cuales alcanzan una sensibilidad de 91% y una especificidad de 82% para definirla. Otros criterios que sugieren malignidad son tamaño del tipo ductal principal mayor de 15 mms o del tipo ducto colateral mayor de 30 a 40 mms, presencia de septos irregulares gruesos, la presencia de masa mural grande, mayor de 10 mms de diámetro, la demostración de invasión vascular o linfonodal o manifestaciones clínicas como edad avanzada, síntomas de diabetes o pancreatitis crónica, historia de abuso de alcohol, o la presencia de ictericia.30 El tratamiento es quirúrgico con resección definida por la localización de la lesión.
La citología por punción ecoguiada de estas lesiones tiene una Sensibilidad diagnóstica del 91%, si se toma muestra del componente sólido, lo cual es muy útil para el diagnóstico en los casos en los que no se observa salida de moco por la papila; sin embargo la citopatología tiende a subestimar el grado histológico del tumor; la citología del aspirado del ducto pancreático no es muy útil.
Los pacientes con este tipo de tumores sufren de otras neoplasias no pancreáticas con mayor frecuencia que la población general, entre las cuales las más frecuentes son adenomas y carcinomas de colon, por lo que estos pacientes deben recibir el tamizaje correspondiente; La razón propuesta es que comparten anomalías genéticas comunes, como mutaciones de los genes k-ras, p53 y c-erbB-2 entre otros; rara vez se asocian a tumores papilares intraductales de los ductos biliares.31
La neoplasia intraductal papilar mucinosa (NIPM) es una neoplasia epitelial de células productoras de mucina, que se origina en el ducto pancreático principal o en una de sus ramificaciones. El epitelio neoplásico es usualmente papilar, y presentan grados variables de secreción mucinosa, dilatación ductal (formación quística) y displasia.
Macroscópicamente, usualmente son lesiones mayores de 1 cm. de diámetro, que se subdividen de acuerdo al tipo de ducto que afectan, en NIPM de ducto principal (usualmente uniquísticas) y NIPM de ramifi cación, o de rama secundaria (usualmente multiquísticas). Los extendidos citológicos obtenidos por punción con aguja fina muestran abundante de mucina extracelular gruesa, con presencia de variable cantidad de células epiteliales, cuya morfología varía de acuerdo al tipo de epitelio proliferante (gástrico, intestinal, pancreatobiliar u oncocítico).
Desde el punto de vista histopatológico, la NIPM carece del estroma tipo ovárico observado en las neoplasias quísticas mucinosas. Se caracterizan por proliferación intraductal de células productoras de mucina, que desde el punto de vista arquitectural, el epitelio puede observarse aplanado o constituyendo formaciones papilares con ejes fibrovasculares. Sobre la base de la arquitectura predominante y del patrón de diferenciación celular, la NIPM se subclasifica en cuatro tipos: gástrico, intestinal, pancreatobiliar y oncocítico. Al igual que las neoplasias quísticas mucinosas, la NIPM puede mostrar displasia de bajo grado, de grado intermedio y de alto grado. Asímismo, pueden mostrar áreas de carcinoma invasor (30% de las lesiones)32 (Figura 5).
Desde el punto de vista práctico podría sugerir el algoritmo de la Universidad de Johns Hopkins en su Departamento de Gastroenterología (Gráfico 4).
NEOPLASIA QUÍSTICA MUCINOSA O CISTADENOMA MUCINOSO
Lesión quística más frecuente en mujeres con edad promedio de 50 años, que produce síntomas principalmente por el efecto de masa de la lesión, tales como distensión abdominal, dolor o saciedad temprana, aunque cerca del 40% se descubren incidentalmente. Se localizan más frecuentemente en cuerpo y tallo pancreático, midiendo en general 5 a 6 cms de diámetro; tienen forma de balón, cubiertos por cápsula relativamente gruesa y con quistes que son convexos en la cavidad.33 En el ultrasonido endoscópico (USE) se ve como una lesión con componentes macroquísticos (mayores a 10 mms de diámetro), ocasionalmente septada, aunque en general los septos son raros, que puede tener calcificaciones, las cuales típicamente son periféricas, componentes sólidos (los cuales son más frecuentes que en los cistoadenomas serosos), y adenopatías regionales cuando es maligno.36 El líquido que lo compone es transparente, viscoso o fibroso. En la citología se encuentran células columnares mucinosas con atipia variable y coloración positiva para Mucina. Las preparaciones citológicas muestran en todos los casos moco anormal, grueso, viscoso y brillante. La medición de otras sustancias tales como el Antígeno Carcinoembriónico, son útiles dado que se encuentran marcadamente elevadas en estas lesiones; otras son el CA19-9, el CA 125 y el CA 72-4. Un Antígeno carcinoembrionico mayor de 192 ng/ml diferencia quiste mucinoso de los otros tipos de quiste con una sensibilidad de 75%, especificidad de 84%, y exactitud de 79%, (35,36), aunque su utilidad clínica es controvertida para este fin; Un CA 72-4 mayor de 7 ng/ml también diferencia mucinoso de no mucinoso con Sensibilidad de 80%, Especificidad de 61% y Exactitud de 72%. Un CA 19-9 mayor de 90000 U/L es 100% específico para quiste mucinoso. La presencia de células epiteliales mucinosas tiene sensibilidad de 50% y especificidad de 100% para el diagnóstico de lesiones mucinosas. Con solo la morfología endosongráfica de las lesiones se puede diferenciar mucinoso de no mucinoso con una exactitud de solo 51%; el adicionar la citología aumenta la exactitud de diferenciación a 59%. El elemento diagnóstico de mayor valor predictivo positivo para diagnóstico de quiste mucinoso y diferenciación con lesiones no mucinosas, es la determinación de mucina en el aspirado del quiste (83%), lo cual es estadísticamente signifi cativo (p=0.009).37 Al realizar la punción ecoguiada para análisis citológico se debe tener cuidado de no contaminar la muestra con células de duodeno o estómago, que dan falsos positivos de tumor mucinoso quístico. Esta lesión tiene potencial maligno; puede convertirse en adenocarcinoma mucinoso, el cual generalmente es de gran tamaño (8 a 11 cms de diámetro) y se caracteriza más frecuentemente por masas sólidas-quísticas hipoecoicas o quistes complejos, frecuentemente asociados a dilatación del ducto pancreático principal. Los hallazgos endosonográficos que sugieren malignidad en este tipo de lesiones son: presencia de nódulos murales, engrosamiento irregular de la pared, ecos mucosos, y tumor sólido con patrón mixto.38 La citología de este tumor es similar a la citología del adenocarcinoma ductal pancreático, con celularidad moderada a alta, racimos celulares tridimensionales, alto radio núcleo/ citoplasma e irregularidades en la membrana nuclear, pero con mayor cantidad de mucina, aunque en la práctica, solo por citología es imposible distinguirlos. Se encuentra cáncer en 20% de las resecciones pancreáticas por cistoadenoma mucinoso, y en estos casos la sobrevida a 5 años es de 33 a 64%, mientras que la sobrevida de un cistoadenocarcinoma mucinoso evidente al momento del diagnóstico es de menos de 5% a 5 años, aunque es un poco mejor el pronóstico de estas lesiones que el pronóstico del adenocarcinoma ductal pancreático.

Las neoplasias quísticas mucinosas del páncreas constituyen un grupo de lesiones epiteliales quísticas que usualmente no se comunican con el sistema ductal pancreático, y que están compuestas por un epitelio columnar productor de mucina; asociado a un estroma subepitelial tipo ovárico.
Macroscópicamente se presentan como masas esféricas únicas, de superficie blanda, con una pseudocápsula fibrosa de espesor variable. El tamaño de las lesiones varía entre 2-35 cm. A la superficie de corte, el tumor puede ser unilocular o multilocular, con quistes que van desde escasos milímetros hasta varios centímetros. Los quistes contienen un material mucoide espeso que puede ser hemorrágico-necrótico. Los frotis citológicos obtenidos por aspiración con aguja fina contienen variable cantidad de mucina y ocasionalmente escasas células epiteliales cilíndricas. Éstas se disponen en grupos de tamaño variable, los núcleos usualmente se encuentran localizados basalmente, y el citoplasma contiene mucina. Las células pueden mostrar además grados variables de atipia citológica y arquitectural (Displasia) (Figura 7 y 8).
Histopatológicamente, las neoplasias quísticas mucinosas tienen dos componentes distintivos: Un epitelio de revestimiento y un estroma subepitelial tipo ovárico. Los quistes se encuentran revestidos internamente por un epitelio columnar con células productoras de mucina. El grado de atipia puede ir desde una apariencia benigna completa hasta severamente atípico. Sobre la base del grado más severo de atipia citológica y arquitectural (displasia), las neoplasias quísticas mucinosas se categorizan en neoplasia quística mucinosa con displasia de bajo grado, displasia de grado intermedio y displasia de alto grado. El estroma tipo ovárico distintivo subepitelial consiste en células fusiformes densamente empaquetadas, con núcleos redondeados o alargados y citoplasma poco evidente.
Hasta un tercio de las neoplasias quísticas mucinosas tienen asociado carcinoma invasor, el cual puede ser focal. Dicho componente invasor usualmente recuerda el adenocarcinoma ductal infiltrante común, formando estructuras tubulares y estructuras tipo ductos. Sin embargo, otras variantes menos comunes de carcinoma invasor se han descrito en asociación con neoplasias quísticas mucinosas.39,40


CISTOADENOMA SEROSO
Lesión quística benigna, más frecuente en mujeres y en la sexta década de la vida; ocasionalmente se descubre por dolor abdominal o masa palpable, pero en un 50% de los casos el diagnóstico es incidental; se debe tener en mente en el diagnóstico diferencial de la etiología de pancreatitis, sobre todo en mujeres sin historia de alcoholismo o de enfermedad litiasica biliar.41 No tiene potencial maligno reconocido. Se localiza en cualquier parte del páncreas, aunque más frecuente en la cabeza del páncreas; usualmente mide de 4 a 6 cms de diámetro y tiene contorno lobulado y pared delgada. En el ultrasonido endoscópico (USE) se encuentra que está formado por microquistes (cavidades de menos de 3 mms de diámetro), con apariencia interna de panal de abejas, característica que al ser encontrada le da una exactitud diagnóstica de 92 a 96% para diferenciarla de otro tipo de lesiones; generalmente tienen un área central compleja de fi brosis y estroma altamente vascular; hasta en un 25% pueden presentarse con patrón macroquístico, pero incluso en estos casos se les encuentra con ultrasonido también microquistes;42 ocasionalmente tiene calcifi caciones, que característicamente son centrales y en forma de estrella. Muy rara vez tienen detritus en su interior. Por lo general, no tienen comunicación con el ducto pancreático principal.43 En general, independientemente de las características morfológicas del interior del quiste, encontrar dos de las siguientes tres características, tiene exactitud de 83% para diagnosticar cistoadenoma seroso: 1. Localización en la cabeza del páncreas, 2. Contorno lobulado, y 3. Ausencia de realce de pared.
El líquido aspirado se caracteriza por ser delgado, y de color transparente a serosanguiñolento. La citología muestra epitelio de tipo cuboidal con coloración positiva para glicógeno. Ocasionalmente se observa en la citología diferenciación papilar.44 En general son negativas o con bajos títulos para amilasa, lipasa y antígeno carcinoembriónico.

Las neoplasias quísticas serosas del páncreas son lesiones quísticas epiteliales compuestas por células epiteliales cuboidales, ricas en glucógeno, que producen un fluido acuoso similar al suero. En su mayoría son benignas, y solo casos raros producen metástasis (Cistadenocarcinoma seroso). Su forma más frecuente es el tipo microquístico (Cistadenoma seroso), sin embargo se han descrito otras variedades, como la neoplasia serosa quística macroquística, la neoplasia serosa sólida, la neoplasia quística serosa asociada al Síndrome de von Hippel-Lindau y las neoplasia mixtas serosas y neuroendocrinas.
El cistadenoma seroso (Neoplasia serosa microquística) usualmente es una lesión única, bien circunscrita, redondeada, con diámetros que varían entre 1 y 25 cm. Al corte muestran un aspecto esponjoso y están compuestas por múltiples quistes pequeños (2-10 mm) que contienen fluido seroso. Los frotis citológicos obtenidos por aspiración con aguja fina usualmente muestran muy escasa celularidad. Las células se disponen formando grupos pequeños, y muestran moderado a abundante citoplasma, con núcleos redondos y uniformes (Figura 10).
Desde el punto de vista histológico, los cistadenomas serosos del páncreas muestran múltiples quistes, revestidos internamente por un epitelio cuboidal o aplanado. El citopasma de las células casi siempre es claro, pero raramente puede verse eosinofílico (oncocítico) y granular. El núcleo es de localización central, redondeado, uniforme, con nucléolo poco evidente. Atipia nuclear y figuras mitóticas son prácticamente ausentes39,40 (Figura 11).
NEOPLASIA ENDOCRINA QUISTICA
Ocasionalmente los tumores neuroendocrinos pancreáticos pueden tener morfología que incluya quistes en su interior, o presentarse como una lesión predominantemente quística; en estos casos, pueden o no acompañarse de las manifestaciones clínicas secundarias a la hiperproducción de hormonas específi cas; En general en la ultrasonografía endoscópica se encuentran como un quiste unilocular que ocupa la mayoría de la neoplasia. El líquido aspirado se caracteriza por ser delgado y transparente; en la citología se encuentran células tumorales endocrinas monomórfi cas, con coloración positiva para cromogranina y sinaptofisina. Si no se aclara el diagnóstico con el estudio de la punción citológica ecoguiada, es imposible diferenciar estas lesiones de las demás lesiones quísticas antes de la cirugía.45 Estas lesiones tienen potencial maligno. Después de los cistoadenomas serosos, estas lesiones son las segundas lesiones quísticas no mucinosas, de más común presentación clínica.46
NEOPLASIA SÓLIDA PSEUDOPAPILAR
Lesión muy rara, que ocurre casi predominantemente en mujeres jóvenes, con predilección por la raza negra, que en general se comportan como lesiones malignas de bajo grado, con buen pronóstico; su tamaño usualmente es mayor de 8 cms de diámetro y dan síntomas por el efecto de masa, con dolor abdominal y plenitud, aunque también se pueden diagnosticar de forma incidental. En el ultrasonido endoscópico (USE) se observa una lesión mixta con componentes sólidos y quísticos; el líquido interior es hemorrágico con detritos necróticos; la citología muestra células monomórficas con núcleo redondeado y citoplasma eosinófilo; con coloración positiva para vicentina y alfa 1-antitripsina.
La neoplasia sólido-pseudopapilar del páncreas es una neoplasia maligna de bajo grado histológico, compuesta de abundantes células epiteliales monomórfi cas cohesivas, formando estructuras sólidas y pseudopapilares. Frecuentemente muestran degeneración quística y hemorragia, y ocurren predominantemente en mujeres jóvenes.
Desde el punto de vista macroscópico, son masas únicas, grandes, redondeadas (tamaño: 8-10 cm., rango: 0,5-25 cm.); bien demarcadas del parénquima pancreático circundante, rodeadas por una cápsula fibrosa. Los extendidos citológicos obtenidos por punción con aguja fina, muestran un fondo marcadamente hemorrágico, con presencia de abundantes células epiteliales dispuestas individualmente, en grupos pequeños cohesivos y en estructuras papilares lineales y ramificadas (disposición en letras chinas). Éstas últimas muestran ejes fibrovasculares revestidos por una o varias capas de células neoplásicas.
Histopatológicamente, muestran un patrón de crecimiento heterogéneo, con una combinación de áreas sólidas, pseudopapilas, áreas hemorrágicas-necróticas y estructuras pseudoquísticas en variable proporción. Las áreas sólidas muestran abundantes células poco cohesivas, monomórfi cas, separadas por bandas hialinizadas a mixoides que contienen vasos de paredes engrosadas. Las pseudopapilas se forman cuando las células poco cohesivas de las áreas sólidas se separan, dejando variable cantidad de células sueltas entre los tallos fibrovasculares. Las células neoplásicas muestran un citoplasma eosinofílico o claro vacuolado. Los núcleos de las células son redondeados con cromatina dispersa47 (Figura 12).
ADENOCARCINOMA DUCTAL CON QUISTE
Ocasionalmente el cáncer de páncreas puede presentar degeneración quística y confundirse con otro tipo de lesiones quísticas; cuando esto ocurre las lesiones son por lo general sintomáticas, presentando el paciente ictericia, dolor abdominal o dorsal y rara vez pancreatitis; en el ultrasonido endoscópico (USE) se encuentra una lesión predominantemente sólida con espacios quísticos; el líquido es hemorrágico con detritus; a la citología se evidencia adenocarcinoma maligno con grados variables de atipia; estos tumores también son productores de mucina aunque en menor proporción que las neoplasias quísticas mucinosas.
OTRAS LESIONES QUÍSTICAS
Los quistes congénitos simples y los quistes postinflamatorios de retención usualmente tienen septos en su interior; estos últimos pueden tener conexión con el ducto pancreático principal y encontrarse altos niveles de amilasa en su contenido. Los quistes hidatídicos tienen morfología similar a los pseudoquistes. Los quistes linfoepiteliales son quistes benignos generalmente únicos, compuestos de un líquido amarillento o grisáceo, que en la citología muestra numerosas células escamosas enucleadas, con detritos amorfos y queratinosos.48
Muchas veces no es posible realizar solamente con las características endosonográficas el diagnóstico diferencial de las anteriores lesiones; sin embargo existe además de las descritas algunas características morfológicas que se deben tener en cuenta; se deben evaluar la presencia de componentes sólidos, los septos, la presencia de detritos, los bordes y cápsula del quiste, las anomalías del conducto y del parénquima pancreático.49,50 Se ha propuesto por los japoneses, una clasificación morfológica que ayude a definir la etiología de los quistes; ellos los clasifi can en seis tipos de lesiones (Figura 13).
1. Tipo de pared gruesa. En esta presentación se incluyen los cistoadenomas mucinosos, cistoadenocarcinoma mucinoso, los IPMT y la neoplasia sólida papilar.
2. Tipo de tumor protruyente. Se incluyen los cistoadenomas mucinosos, cistoadenocarcinomas mucinosos y los tumores Hiperplásicos.
3. Tipo de septos gruesos. Incluyen cistoadenomas mucinosos y tumores hiperplásicos.
4. Tipo microquístico. Incluye los cistoadenomas serosos.
5. Tipo de septos delgados. Incluye los pseudoquistes y los quistes congénitos simples.
6. Tipo simple. Incluye los pseudoquistes y los quistes congénitos simples.
Para aumentar la exactitud diagnóstica también se ha utilizado la punción ecoguiada con estudio citológico del líquido y de los componentes sólidos del quiste, así como para el estudio químico, inmunológico y genético, con resultados variables; Las agujas 19 y las 22 tienen similar utilidad. Se debe aspirar primero el contenido líquido y solo posteriormente hacer aspiración de los elementos sólidos del quiste. Se considera que la exactitud diagnóstica al usar esta estrategia está entre 54 y 97%, siendo mayor para las lesiones quísticas grandes. Se recomienda que al hacer punción de una lesión quística, para prevenir complicaciones infecciosas, se realice punción única en la cual se drene todo el contenido del quiste y se administren antibióticos (Fluoroquinolonas) por 3 a 5 días después de la punción; si se realiza más de una punción se pueden producir fístulas. Se debe evitar aspirar primero los detritos y el moco si están presentes para prevenir la obstrucción de la aguja. Se presenta infección hasta en el 1% de las punciones, además de otras complicaciones como hemorragia intraquística en 1% y pancreatitis hasta en un 2-3% de los casos. Es importante minimizar el atravesar con la aguja el tejido pancreático normal para disminuir el riesgo de pancreatitis. Se debe utilizar el doppler para identificar los vasos sanguíneos y dirigir de esta forma la punción evitándolos. Se debe evitar contaminación de la punción con células del duodeno o estómago que pueden dar falso positivo para tumor mucinoso. El otro riesgo a tener en cuenta es el de siembra de células malignas en el trayecto de la aguja, que aunque es pequeño y menor que en la punción guiada por otros métodos, obliga a sopesar siempre el riesgo-beneficio. En las lesiones intraductales para el estudio del líquido se punciona directamente el conducto pancreático principal, aplicando las mismas precauciones durante la punción que para los otros quistes, con muy baja tasa de complicaciones y con utilidad diagnóstica en el 75% de los casos, a pesar de la menor utilidad de la citología en estos casos.51 Para IPMT, la medición de telomerasa en el Jugo pancreático aspirado podría ayudar a definir malignidad de la lesión.
Para un adecuado examen se debe también tomar muestra de la pared del quiste para el estudio citológico, aunque está discutido si la sola citología aumenta el rendimiento diagnóstico del ultrasonido endoscópico (USE); existen reportes que muestran para la citohistología sensibilidad 97%, especificidad 100%, valor predictivo positivo 100% y valor predictivo negativo da hasta 95%, aunque otros reportes no son tan optimistas; se debe realizar en lo posible coloración para glicógeno (acido periódico de Schiff-PAS),y para mucina (PAS, alcian blue o coloración mucicarmine), así como medir los niveles de mucina, amilasa, Antígenocarcinoembriónico y demás marcadores inmunológicos disponibles en cada institución.52,53 Se debe tomar muestra parcial en formaldehído (formol) para estudio del bloque celular, que es muy útil principalmente en IPMT.
Una publicación reciente resume así los puntos de corte de los niveles de las sustancias usualmente estudiadas en el líquido para el diagnóstico etiológico de las lesiones quísticas más frecuentes: (Figura 14).


El antígeno carcinoembriónico y el CA 19-9 Tienen limitaciones para diferenciar quistes mucinosos de No mucinosos, y para diferenciar lesiones benignas de malignas. El Antígeno carcinoembriónico esta bajo o ausente en los cistoadenomas serosos y en los pseudoquistes; moderadamente aumentado en los quistes mucinosos, y muy aumentado en los cánceres.54 La amilasa se encuentra elevada en los pseudoquistes y en los quistes que comunican con el ducto pancreático, como por ejemplo con el IPMT de ramas secundarias. Sin embargo aún falta perfeccionar la punción ecoguiada y sus marcadores para el diagnóstico etiológico por medio de ella de cualquier lesión quística en el páncreas.
Otras tecnologías no tienen la capacidad de evaluar los quistes pancreáticos como el ultrasonido endoscópico (USE), ni de evaluar el páncreas normal, aunque su uso puede ser complementario en la evaluación de estas lesiones; La Tomografía axial computarizada (TAC) tiene una exactitud diagnóstica de solo 60% en la evaluación de estas lesiones, similar a la Resonancia Nuclear magnética, pero en comparación de esta tiene la ventaja de detectar mejor las calcificaciones periféricas presentes frecuentemente en los cistoadenomas mucinosos.55
Las minisondas de ultrasonido (miniprobes), son útiles para evaluar lesiones muy pequeñas y para la evaluación del IPMT; con ellas se puede defi nir malignidad en estas lesiones incluso cuando tienen 3 mms de diámetro, con una sensibilidad de 91% y especificidad de 82%, aunque en el 10% de los pacientes en que se usan se describen elevaciones transitorias de las enzimas pancreáticas.56
En muchas ocasiones no se puede establecer el diagnóstico etiológico de la lesión por los métodos mencionados, pero hay autores quienes consideran que es quizás más importante para elegir el tratamiento más apropiado para cada paciente, definir la probabilidad de malignidad de la lesión quística; aunque la mayoría de las lesiones quísticas malignas (85%) son sintomáticas a su presentación, esto por si solo no es parámetro que permita definir manejo, por lo que se han definido parámetros endosonográficos predictores de malignidad en dichas lesiones; La presencia de una masa hipoecoica asociada a un quiste pancreático tiene sensibilidad de 83%, especificidad de 95%, valor predictivo positivo de 83.3%, valor predictivo negativo de 95% y exactitud de 92.3% para adenocarcinoma; y si esto se asocia a un conducto pancreático dilatado, tiene una sensibilidad de 47% y especificidad de 78% para IPMT.
El pequeño tamaño no excluye malignidad; 20% de las lesiones menores de 20 mms son malignas y 45% tienen potencial maligno; sin embargo entre las lesiones menores de 20 mms pero que son asintomáticas, solo el 3.5% son malignas.
La presencia de cualquiera de las siguientes características tiene sensibilidad de 91% y especificidad de 60% para detectar lesiones con potencial maligno: 1) Grosor de la pared del quiste mayor de 3 mms; 2) Compartimentos intraquísticos mayores de 10 mms de diámetro (macroseptaciones); 3) Presencia de masa intramural; y 4) Dilatación quística del conducto pancreático principal.
Los hallazgos más ominosos que sugieren malignidad en estas lesiones son la coexistencia de pared gruesa, presencia de septos y masa hipoecoica asociada (A10). Otro hallazgo que la sugiere es engrosamiento irregular de la pared.
Un estudio mostró que basados únicamente en los parámetros morfológicos, existía una pésima concordancia interobservador (Kappa=0.24) entre endosonografistas experimentados en definir malignidad en lesiones quísticas pancreáticas, y otro mostró que con solo las características morfológicas en un gran número de casos, no se podía diferenciar de forma confiable entre lesiones quísticas pancreáticas benignas de malignas.57
La exactitud diagnóstica del ultrasonido endoscópico (USE) para defi nir potencial malignidad en una lesión está entre 40 y 93%. La punción ecoguiada (FNA-EUS) y el análisis del contenido obtenido tiene una sensibilidad de 25 a 88% y una especificidad del 100% para identificar malignidad dentro de la lesión. La presencia de septos delgados y compartimientos uniloculares simples, prácticamente descartan malignidad.
Para predecir resecabilidad en las neoplasias quísticas (ausencia de invasión vascular, ausencia de ascitis maligna y ausencia de metástasis hepáticas), el ultrasonido endoscópico (USE) tiene una sensibilidad de 100%, especificidad de 100%, valor predictivo positivo de 100%, valor predictivo negativo de 100% y exactitud de 100%; para predecir lo mismo en IPMT, la exactitud es menor (47%) y esto se debe a la incapacidad del ultrasonido endoscópico (USE) de diferenciar entre áreas de malignidad y áreas de inflamación focal que infiltren el parénquima.
En los IPMT, los predictores de malignidad son protrusión papilar mayor de 3 mms, diámetro del conducto pancreático principal mayor de 8 mms, disrupción de la pared del conducto pancreático, septos irregulares gruesos, masa ductal grande (mayor de 10 mms), lesión de ducto principal mayor de 15 mms o lesión de ducto secundario mayor de 30 mms e invasión del tumor a vasos o a linfonodos.
Para todas las lesiones quísticas pancreáticas, por el contrario, son predictores de benignidad: 1. Pared delgada y nítida; 2. Contorno liso; 3. Forma oval o redondeada; 4. Ausencia de septos y de nódulos; 5. Ausencia de hallazgos de pancreatitis crónica y 6. Paciente asintomático.58
Por todo lo anterior se recomienda ante una lesión quística en el páncreas que para el enfoque diagnóstico se debe hacer lo siguiente:
1. Evaluar la morfología endosonográfica de la lesión principalmente buscando la presencia de microquistes, macroquistes y masas asociadas.
2. Se realice punción ecoguiada con drenaje completo si es posible.
3. Se realice análisis completo del fluido que además de la citología, incluya medición de mucina, glicógeno, amilasa, antígeno carcinoembriónico y demás marcadores tumorales disponibles en la institución, idealmente incluyendo la medición de CA 72-4 y si es posible, CA 19-9.
4. Se interpreten los resultados en conjunto con la Historia clínica y los hallazgos del TAC.
En cuanto al tratamiento, generalmente se define de acuerdo a una combinación de factores que incluyen los síntomas, el tamaño del quiste, la morfología endosonográfica, los resultados del análisis del líquido y la condición médica general del paciente; todas las lesiones con potencial de malignidad se deben resecar, escogiendo la cirugía de acuerdo a su localización en el páncreas, más si son sintomáticas, grandes y el paciente es un aceptable candidato quirúrgico. Por el contrario, si la lesión no tiene ningún parámetro que sugiera potencial maligno, en pacientes asintomáticos, se puede realizar un seguimiento con vigilancia cada 6 meses y con manejo quirúrgico en el momento que se demuestre que cambiaron las características de la lesión, aunque la mayoría de centros tienen una estrategia activa con indicación quirúrgica ante la menor duda diagnóstica en cuanto al potencial de malignidad.59
Existen algunos datos emergentes de tratamiento ecoguiado de algunos tumores quísticos pancreáticos en pacientes malos candidatos quirúrgicos, mediante inyección de alcohol, aunque faltan estudios al respecto.60
Del tratamiento de los pseudoquistes pancreáticos se profundizará en el capítulo respectivo, aunque podemos decir en general, que se deben drenar los sintomáticos, los complicados (infectados), y los que se demuestra que están creciendo después de un periodo adecuado de observación; no se deben drenar de esta forma los tumores quísticos, ni los quistes de duplicación, ni los otros quistes no inflamatorios.
Por lo anterior, podemos afirmar que el ultrasonido endoscópico (USE) tiene utilidad clínica en la evaluación y definición de manejo de las lesiones quísticas pancreáticas; aunque no es un método absoluto, y tiene sus limitaciones para definir por si sola el diagnóstico etiológico y el potencial maligno de muchas de estas lesiones.61,62 Es el mejor método disponible en la actualidad para evaluar lesiones menores de 2 cms de diámetro, tanto con los equipos lineares como con los radiales, y tanto a frecuencias de 7.5 MHz como de 12.5 MHz, pero no es útil para evaluar lesiones de más de 6 cms de diámetro; además ocasionalmente el quiste que se ve en la imagen radiológica. No puede ser identificado por el ultrasonido endoscópico (USE); las posibles causas para esto son: que la lesión quística sea extrapancreática; esto es comúnmente encontrado al localizar pseudoquistes, porque la colección de fluido puede cambiar de localización con el tiempo y puede ubicarse entre el páncreas y el tracto digestivo superior; otras lesiones quísticas que el TAC las asume como pancreáticas, son en realidad, de origen mesentérico o renal; los ductos biliares o pancreáticos dilatados, cuando son vistos en sección transversa u oblicua, pueden aparecer como un quiste en la cabeza del páncreas; otros falsos positivos son divertículos de la pared media del Duodeno.
En conclusión, aunque para este tema no existen aún suficientes publicaciones que cumplan criterios para sacar conclusiones de Medicina Basada en la Evidencia, podemos inferir de la literatura lo siguiente:63
1. En la evaluación de las lesiones quísticas pancreáticas, el ultrasonido endoscópico (USE) es clave para definir sus características y posible potencial maligno.
2. De estas lesiones, las de mayor frecuencia clínica son las neoplasias mucinosas tipo neoplasia quística mucinosa y neoplasia papilar intraductal mucinosa como lesiones con diferente potencial maligno y el pseudoquiste pancreáticocomo lesión benigna.
3. La historia clínica sola y los hallazgos por otros métodos diferentes al USE, contribuyen en forma parcial al diagnóstico etiológico de dichas lesiones.
4. El ultrasonido endoscópico (USE) sin punción, tiene limitaciones en la evaluación de dichas lesiones para definir potencial malignidad por lo que debe ser acompañado en muchos casos de una biopsia ecoguiada.
5. El ultrasonido endoscópico (USE) es el método disponible en la actualidad, más exacto en la evaluación de estas lesiones, más cuando se combina con el análisis del líquido obtenido mediante punción ecoguiada.
6. El tratamiento a seguir se define en la mayoría de los casos después del USE con o sin punción ecoguiada dependiendo de los criterios.
7. Las neoplasias quísticas del páncreas deben ser resecadas después de evaluar todos los criterios expuestos en este texto, aplicando las individualidades cuando estén presentes.
8. Están emergiendo tratamientos ecoguiados para algunas de estas lesiones (drenaje, alcoholización, etc), que continúan en fase de evaluación y no se deberán emplear por fuera de protocolos bien establecidos.
9. En los últimos años los conocimientos de las lesiones quísticas de páncreas han evolucionado gracias al USE y continúan aún en plena investigación.
10. Las neoplasias quísticas del páncreas contribuyen en forma más importante de la antes planteada en la génesis del adenocarcinoma del páncreas el cual podría ser prevenible al ser evaluadas estas con USE en el momento de su diagnóstico.
Agradecimiento a todo el personal de anestesia, enfermeras y administrativo de CITE Centro Nacional de Ecoendoscopia en Venezuela y muy especialmente a la doctora Anne Marie Lennon M.D., Ph.D. directora de Pancreatic Cyst Clinic The Johns Hopkins Hospital, Baltimore-USA.
Todas las imágenes de citohistología fueron procesadas en nuestro grupo durante el studio de ecoendoscopia y en una segunda lectura del bloque cellular.
Autor: Leonardo Sosa Valencia correo lsosavalencia@gmail.com
Referencias bibliográficas
1. Brugge WR. Evaluation of pancreatic cystic lesions with EUS. Gastrointest Endosc. 2004;59(6):698-707. [ Links ]
2. Laffan TA, Horton KM, Klein AP, et al. Prevalence of unsuspected pancreatic cysts on MDCT. Am J Roentgenol. 2008;191: 802-807. [ Links ]
3. Lee KS, Sekhar A, Rofsky NM, Pedrosa I, et al. Prevalence of incidental pancreatic cysts in the adult population on MR imaging. Am J Gastroenterol 2010;105:2079-2084. [ Links ]
4. Goldschmiedt M, Gutta K. Other Tumors and Diseases of the Pancreas Gastrointestinal an Liver Disease. Sleisenger and fordtron. 6ª Edition. Pag. 895-898.
5. Song MH, Lee SK. EUS in the evaluation of pancreatic cystic lesions. Gastrointest Endosc. 2003;57(7). [ Links ]
6. Van Dam J. EUS in cystic lesions of the pancreas. Gastrointest Endosc. 2002;56(4Suppl):S91-3. [ Links ]
7. Recine M, Kaw M. Fine-needle aspiration cytology of mucinaus tumors of the pancreas. Cancer. 2004;102:92-9. [ Links ]
8. Eloubeidi MA, Hawes RH. Mucinous tumors of the exocrine pancreas. Cancer control. 2000;7:445-51. [ Links ]
9. Capitanich P, Covaldi ML. Lymphoepithelial cysts of the pancreas: Case report and review of the literature. J. Gastrointest Surg. 2004;8:342-5. [ Links ]
10. Morise Z, Yamafuji K. A giant retention cyst of the pancreas (cystic dilatation of dorsal pancreatic duct) associated with pancreas divisum. J. Gastroenterol. 2002;37:1079-82. [ Links ]
11. Oruc MT, Kulacoglu IH. Primary hydatid cyst of the pancreas related to main pancreatic duct. A case report. Hepatogastroenterology. 2002;49:383-4. [ Links ]
12. Green JA, Barkin JS. Can EUS alone differentiate between malignant and benign cystic lesions of the pancreas? Am J. Gastroenterol. 2002;97(11):2918-9. [ Links ]
13. Aquel B, Scolapio J. Recurrent pancreatitis due to a cystic pancreatic tumor: A rare presentation of acinar cell carcinoma. JOP. 2004;5:151-4. [ Links ]
14. Mishra G, Forsmark CE. Cystic Neoplasm of the Pancreas. Curr. Treat Options Gastroenterol. 2000;3:355-62. [ Links ]
15. Brugge WR. The role of EUS in the diagnosis of cystic lesions of the pancreas. Gastrointest Endosc. 2000;52(6Suppl):S18-22. [ Links ]
16. Jacobson BC, Baron TH. ASGE Guideline: The role of Endoscopy in the diagnosis and the management of cystic lesions and infl amatory fl uid collections of the pancreas. Gastrointest Endosc. 2005;61(3):363-70. [ Links ]
17. Valette O, Cuilleron M. Imaging of Intraductal papillary Mucinous tumor of the pancreas: Literature review. J. Radiol. 2001;82:633-45. [ Links ]
18. Yamao K, Nakamura T. Endoscopic diagnosis and staging of Mucinous cystic neoplasm and Intraductal papillary- Mucinous tumors. J. Hepatobiliary Pancreat Surg. 2003;10:142-6. [ Links ]
19. Farrell JJ, Brugge WR. Intraductal papillary Mucinous tumor of the pancreas. Gastrointest Endosc. 2002;55(6):701-14. [ Links ]
20. Nadler EP, Novikov A. The use of endoscopic ultrasound in the diagnosis of solid pseudopapillary tumors of the pancreas in children. J. Ped. Surg. 2002;37(9):1370-3. [ Links ]
21. Gress F, Gotlieb K. Endoscopic ultrasound characteristic of Mucinous cystic neoplasm of the pancreas. Am J. Gastroenterol. 2000;95:961-5. [ Links ]
22. Aithal GP, Chen RY. Accuracy of EUS for detection of Intraductal papillary Mucinous tumor of the pancreas. Gastrointest Endosc. 2002;56:701-7. [ Links ]
23. Kubo H, Chijiiwa Y. Intraductal-papillary Mucinous tumors of the pancreas: Differential diagnosis between benign and malignant tumors by endoscopic ultrasonography. Am J. Gastroenterol. 2001;96:1429-34. [ Links ]
24. Brandwein SL, Farrell JJ. Detection and tumor staging of malignancy in cystic Intraductal and solid tumors of the pancreas by EUS. Gastrointest Endosc. 2001;53(7):722-7. [ Links ]
25. Fujita N, Noda Y. IPUS in the Diagnosis of IPMT. Digestive Endoscopy. 2004;16:s225. [ Links ]
26. Bounds BC. Diagnosis and fine-needle aspiration of Intraductal papillary Mucinous tumor by Endoscopic ultrasound. Gastroint Endos. Clin North Am. 2002;12(4):735-45. [ Links ]
27. Stelow EB, Stanley MW. Intraductal papillary-mucinous neoplasm of the pancreas. The findings and limitations of cytologic samples obtained by endoscopic ultrasound-guided fine-needle aspiration. Am J. Clin Pathol. 2003;120:398-404. [ Links ]
28. Beunds BC. Diagnosis and fine-needle aspiration of Intraductal papillary mucinous tumor by endoscopic ultrasound. Gastrointest Endosc. Clin North Am. 2002;12:735-45. [ Links ]
29. Wakabayashr T, Kawaura Y. Clinical management of Intraductal papillary mucinous tumors of the pancreas based on imaging findings. Pancreas. 2001;22:370-7. [ Links ]
30. Maire F, Couvelard A. Intraductal papillary mucinous tumors of the pancreas: The preoperative valve of cytologic and histopathologic diagnosis. Gastrointest Endosc. 2003;58(5):701-6. [ Links ]
31. Clay KA, Fickling WE. Intraductal papillary mucinous tumor of the pancreas and multiple adenomas of the colon. Gastrointest Endosc. 2003;57(3):420-3. [ Links ]
32. Bellizzi A, Stelow E. Pancreatic cytopathology. A Practical Approach and Review. Arch Pathol Lab Med. 2009;133:388-404. [ Links ]
33. Frossaid JL, Ampuyal P. Performance of endosonography-guided fine needle aspiration and biopsy in the diagnosis of pancreatic cystic lesions. Am J. Gastroenterol. 2003;98(7):1516-24. [ Links ]
34. Koito K, Namieno T. Solitary cystic tumor of the pancreas: EUSpathologic correlation. Gastrointest Endosc. 1997;45(3):268-76. [ Links ]
35. Brugge WR, Lewandrowski K. Diagnosis of pancreatic cystic neoplasm: a report of the cooperative pancreatic cyst study. Gastroenterology. 2004;126(5):1330-6. [ Links ]
36. OToole D, Palazzo L. Macrocystic pancreatic cistoadenoma: the role of EUS and cyst fluid analysis in distinguishing mucinous and serous lesions. Gastrointest Endosc. 2004;59:823-9. [ Links ]
37. Walsh RM, Henderson JM. Prospective preoperative determination of mucinous pancreatic cystic neoplasms. Surgery. 2002;132:628-33. [ Links ]
38. Inui K, Nakazawa S. Mucin-producting tumor of the pancreas- intraluminal ultrasonography. Hepatogastroenterol. 2000;45:1996-2000. [ Links ]
39. Khalid A, Brudge W. ACG practice guidelines for the diagnosis and management of neoplastic pancreatic cysts. Am J Gastroenterol 2007;102:2339-2349. [ Links ]
40. Basturk O, Coban I, Adsay V. Pancreatic cysts. Pathologic Classification, Differential Diagnosis, and Clinical Implications. Arch Pathol Lab Med. 2009;133:423-438. [ Links ]
41. Sperti C, Pasquali C. Mucinous cystadenoma of the pancreas as a cause of acute pancreatitis. Hepatogastroenterology. 1998;45:2421-4. [ Links ]
42. Kaneto H, Endo T. Macrocystic serous cystadenoma of the pancreas? Importance of co-existent tiny cysts depicted by EUS. J. Gastroenterol. 2000;35:472-5. [ Links ]
43. Hashimoto M, Watanabe G. Macrocystic type of serous cystadenoma with a communication between the cyst and pancreatic duct. J. Gastroenterol Hepatol. 2001;16:836-8. [ Links ]
44. Rampy BA, Waxman I. Serous cystadenoma of the pancreas with papillary features: a diagnostic pitfall on fi ne-needle aspiration biopsy. Arch Pathol. Lab Med. 2001;125:1591-4. [ Links ]
45. Gerke H, Byrne MF. A wolf in sheeps clothing: a non-functioning islet cell tumor of the pancreas masoverading as a microcystic (serous cystic) adenoma. JOP. 2004;5:225-30. [ Links ]
46. Anderson MA, Scheiman JM. Nonmucinous cystic pancreatic neoplasms. Gastrointest Endosc. Clin North Am. 2002;12:769-79. [ Links ]
47. Chakhachiro Z, Zaatari G. Solid-Pseudopapillary Neoplasm. A pancreatic enigma. Arch Pathol Lab Med. 2009;133:1989– 1993. [ Links ]
48. Liu J, Shin HJ. Cytologic features of Lymphoepithelial cyst of the pancreas: two preoperatively diagnosed cases based on fineneedle aspiration. Diagn. Cytopathol. 1999;21:346-50. [ Links ]
49. Ahmad NA, Kochman ML. Interobserver agreement among endosonographic for the diagnosis of Neoplastic versus non neoplastic pancreatic cystic lesions. Gastrointest Endosc. 2003;58(1):59-64. [ Links ]
50. Schwartz DA, Wiersema MJ. Endoscopic ultrasound techniques for pancreatic cystic neoplasms. Gastrointest Endosc. Clin North Am. 2002;12(4):709-18. [ Links ]
51. Lai R, Stanley MW. Endoscopic ultrasound-guided pancreatic duct aspiration: diagnostic yield and safety. Endoscopy. 2002;39(9):715-20. [ Links ]
52. Breslin N, Wallace MB. Diagnosis and fine-needle aspiration of pancreatic pseudocysts: the role of endoscopic ultrasound. Gastroint Endosc. Clin North Am. 2002;12(4):781-90. [ Links ]
53. Hernandez LV, Mistra G. Role of Endoscopic ultrasound (EUS) and EUS- guided fine needle aspiration in the diagnosis and treatment of cystic lesions of the pancreas. Pancreas. 2002;25:222-8. [ Links ]
54. Brugge WR. Role of endoscopic ultrasound in the diagnosis of cystic lesions of the pancreas. Pancreatology. 2001;1:637-40. [ Links ]
55. Bounds BC, Brugge WR. EUS diagnosis of cystic lesions of the pancreas. Int J. Gastroint. Cancer. 2001;30:27-31. [ Links ]
56. Invi K, Nakazawa S. Endoluminal ultrasonography for pancreatic diseases. Gastroenterol. Clin North Am. 1999;28:771-81. [ Links ]
57. Ahmad NA, Kochman ML. Can EUS alone differentiate between malignant and beningn cystic lesions of the pancreas? Am J. Gastroenterol. 2001;96:3295-300. [ Links ]
58. Michael H, Gress F. Diagnosis of cystic neoplasms with endoscopic ultrasound. Gastroint Endos. Clin North Am. 2002;12(4):719-33. [ Links ]
59. Gasslander T, Arnelo U. Cystic tumors of the pancreas. Dig Dis. 2001;19:57-62. [ Links ]
60. Bhutani MS. Role of endoscopic ultrasonography in the diagnosis and treatment of cystic tumors of the pancreas. JOP. 2004;5:266-72. [ Links ]
61. Sedlack R, Affi A. Utilidad de EUS. In the evaluation of cystic pancreatic lesions. Gastrointest Endosc. 2002;56(4):543-7. [ Links ]
62. Snady H. Endoscopic ultrasonography in benign pancreatic disease. Surg. Clin North Am. 2001;81:329-44. [ Links ]
63. Palazzo L, Otoole D, et al. Echoendoscopie Digestive . Springer Verlag Francia 2012; (29) 245-256. [ Links ]