Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Gen
versión impresa ISSN 0016-3503
Gen vol.69 no.2 Caracas jul. 2015
Microbiota gastrointestinal aeróbica en niños con trastorno del espectro autista. Estudio preliminar
Autores
Xiomara Moreno,¹ Giancarlo Santamaria,² Roger Sánchez,² Beatriz De la Torre,³ Fátima
Garcés,³ Celsy Hernández,³ Clara Martínez,³ Ana Márquez,4 Karolina López5
Afiliaciones
¹Departamento de Microbiología Instituto Médico la Floresta. Caracas-Venezuela
²Escuela de Bioanálisis Universidad Central de Venezuela, Caracas-Venezuela
³Laboratorio de Investigaciones Básicas y Aplicadas. Escuela de Bioanálisis Universidad Central de Venezuela. Caracas-Venezuela.
4Unidad de Autismo Maternidad Concepción Palacios, Caracas-Venezuela
5Unidad de Gastroenterología y Nutrición Pediátrica Hospital General Dr. Miguel Pérez Carreño, IVSS. Caracas-Venezuela
Revista GEN (Gastroenterología Nacional) 2015;69:(2):36-44 Sociedad Venezolana de Gastroenterología, Caracas, Venezuela. ISSN 0016-3503.
Autor correspondiente: Xiomara Moreno Calderón. Especialista en Micología Médica. Microbiólogo del Departa- mento de Microbiología del Instituto Médico la Floresta.
Correo-e: x.morenoc@hotmail.com ; xmorenoc@cantv.net
Resumen
Introducción: la alteración de la microbiota intestinal o Dis- biosis ha sido implicada en los cambios de comportamiento del neurodesarrollo y problemas gastrointestinales en pacientes con trastorno del espectro autista (TEA). Objetivo: evaluar la micro- biota intestinal aeróbica (MGIA) y clasificarla en beneficiosa, transitoria y enteropatógena en niños con TEA en la Unidad de Autismo-Maternidad Concepción Palacios. Pacientes y métodos: desde el 26/02/2015 al 12/05/2015 se estudiaron de forma experimental y prospectiva 39 niños diagnosticados con TEA; en el estudio de la MGIA se utilizaron muestras de heces. Se aplicó una encuesta para recopilar datos epidemiológicos, clínicos y comportamientos del neurodesarrollo. Se propone la clasificación de severidad de la disbiosis en grado I,II,III o ausente para la evaluación de la MGIA. Resultados: Fueron 27 niños (69,23%) y 12 niñas (30,77%), con una edad media de 6,3. Disbiosis 31 (79,5%), Disbiosis ausente 8 (20,5%). Según el grado de disbiosis, 5 (16,13%) Grado I, 7 (22,58%) Grado II, 19 (61,29%) Grado III. Los principales agentes causales de disbiosis fueron Klebsiella spp. 16, Proteus mirabilis 8, Streptococcus sp, 6, Serratia marcensces 5, Candida spp. 4. Dos niños presentaron Campylobacter coli como MGIA patógena. Manifestaciones gastrointestinales: 25,80% dolor abdominal, 16,13% diarrea y 38.7% estreñimiento. Trastornos del neurodesarrollo: 50% aleteos, 34% autoagresión, 61% berrinches, insomnio un 34.3%. Conclusiones: Se hace necesario comparar esta investigación con un grupo de niños sin TEA para confirmar que la presencia de disbiosis como causante de alteración de la MGIA se presenta con más frecuencia en niños con TEA.
Palabras clave: Trastornos del Espectro Autista, Disbiosis, Microbiota Gastrointestinal aeróbica, Manifestaciones gastrointesti- nales, Alteraciones en el Neurodesarrollo.
GASTROINTESTINAL MICROBIOTA AEROBIC IN CHILDREN WITH AUTISM SPECTRUM DISORDERS. PRELIMINARY STUDY
Summary
Background: altering the intestinal microbiota or Dysbiosis has been implicated in the changes the behavior of neurodevelopmen- tal and gastrointestinal problems in patients with autism spectrum disorder (ASD). Objective: To evaluate aerobic intestinal micro- biota (AMGI) and rank it beneficial, transitory and enteropathogenic in children with ASD, the Autism Unit-Maternidad Concepcion Palacios. Patients and Methods: From 26/02/2015 to 05/12/2015 were studied experimentally and prospectively 39 children diagnosed with ASD; in this study the AMGI stool samples were used. A survey to collect epidemiological, clinical and neu- rodevelopmental behavior was applied. Severity classification dysbiosis proposed in grade I, II, III or absent for evaluating the AMGI. Results: There were 27 kids (69.23%) and 12 girls (30.77%) with a mean age of 6.3. Dysbiosis 31 (79.5%), Dysbiosis absent eight (20.5%). Depending on the degree of dysbiosis, 5 (16.13%) Grade I, 7 (22.58%) Grade II, 19 (61.29%) Grade III. The main causative agents of dysbiosis were Klebsiella spp. 16, Proteus mirabilis 8, Streptococcus sp. 6, Serratia marcensces 5, Candida spp. 4. Two children presented MGIA pathogenic Campylobacter coli. Gastrointestinal symptoms: 25,80% abdominal pain, 16.13% diarrhea and 38.7% constipation. Neurodevelopmental disorders: 50% flapping, 34% self-harm, 61% tantrums and 34.3% insomnia. Conclusion: It is necessary to compare this research with a group of children without ASD to confirm the presence of dysbiosis to cause impaired MGIA occurs most often in children with ASD.
Key words: Autism Spectrum Disorders, Dysbiosis, Aerobic Microbiota Gastrointestinal, Gastrointestinal Manifestations, Neuro- developmental Disorders.
Introducción
El autismo es un trastorno del neurodesarrollo, caracterizado por alteraciones en la interacción social, el desarrollo del len- guaje y un patrón restringido o estereotipado de los intereses y las actividades, relacionándose con el desarrollo anormal del cerebro antes del nacimiento y durante la infancia.1,2 El Centro para el Control y Prevención de Enfermedades (CDC), reporta en su informe semanal de Morbilidad y Mortalidad del 28 marzo 2014, que la incidencia del Trastorno del Espectro Autista (TEA), se estima en 14,7 de cada 1,000 niños, en el que 1 de 68 niños con un promedio de 8 años son diagnosticados con TEA en los Estados Unidos; señalando un aumento del 30% de prevalencia respecto a estadísticas anteriores donde 1 de cada 88 niños presentaban TEA.3 En Venezuela, no existe un registro oficial de incidencia de TEA, pero se manejan algunas estadísticas, entre las cuales destaca la pre- sentada por el servicio de Neuropediatría de la Maternidad Concepción Palacios, en la que registran que ocho de cada
10 pacientes atendidos son diagnosticados con el trastorno.4
En la década de los sesenta se plantearon posibles causas microbiológicas como bacterias, virus, hongos y patógenos intracelulares, sobre todo a nivel del Tracto Gastrointestinal (TGI) que pudieran inducir una respuesta inmune, resultando en una inflamación neurológica, reacciones autoinmunes y posibles daños cerebrales.1,5
Estudios sobre la inflamación del TGI afirman que en el autismo estos síntomas se presentan con mayor severidad. El equilibrio de la pared intestinal cumple un papel importante en la adecuada absorción de nutrientes, la cual permite el bloqueo de ciertas toxinas provenientes de bacterias, alérgenos y péptidos procedentes de los alimentos, los cuales pueden ser ofensivos, al pasar a circulación sistémica por una alteración en la Permeabilidad Intestinal (PI), causando una diversidad de alteraciones en el neurodesarrollo, descritas en el autismo.2
Esta alteración en la PI sobreviene a causa de la inflamación de las paredes del TGI, donde puede verse involucrado el uso prolongado de antibióticos, antiinflamatorios no esteroideos, pesticidas, ausencia o insuficiencia de enzimas, toxinas microbianas, alimentos, malabsorción de proteínas, entre otros.2,6,7 Al existir inflamación en la membrana intestinal, se altera su función inmunológica, por lo que la capacidad de absorción de nutrientes en la dieta es deficiente, presentándose un déficit en la producción enzimática, conduciendo a una alteración del microambiente donde se desarrollan los microorganismos que conforman el epitelio intestinal.8,9 Estos microorganismos integran la denominada flora o microbiota intestinal, las cuales son entidades microbianas que conviven en las superficies mucosas, manteniendo un equilibrio simbiótico y benéfico con el hospedero en el que habitan.8,10
Algunos problemas de conducta relacionados con el neurodesarrollo en niños con TEA se han vinculado con el desequilibrio de la microbiota gastrointestinal causando confusión, hiperactividad, falta de concentración, letargo, irritabilidad y agresión, así como dolor abdominal, estreñimiento, gases, entre otros.11 Sin embargo, la exposición repetida a los antibióticos, puede destruir la microbiota intestinal, lo cual puede dar lugar a un crecimiento excesivo de especies de Candida, Clostridium difficile y la aparición por selección de bacterias resistentes a vancomicina como Enterococcus gallinarum.12
Toda esta alteración gastrointestinal es denominada disbiosis intestinal y para hacer referencia sobre la misma, se necesita de la evaluación microbiológica de la microbiota intestinal presente en niños con TEA, razón por la cual se plantea evaluar la microbiota intestinal aeróbica (MGIA), clasificarla en beneficiosa, transitoria y enteropatógena, a la vez que se propone una clasificación de la disbiosis en niños con TEA en la Unidad de Autismo-Maternidad Concepción Palacios.
Pacientes y Métodos
Estudio transversal, prospectivo, experimental y descriptivo basado en la recolección de datos epidemiológicos, clínicos y comportamientos del neurodesarrollo y muestras de heces, provenientes de 39 niños con TEA, evaluados en la Unidad de Autismo de la Materniad Concepción Palacios y la Unidad de Gastroenterología y Nutrición del Hospital Dr. Miguel Pérez Carreño IVSS Caracas-Venezuela, entre febrero y mayo de 2015. A los padres se les solicitó el consentimiento informado, como también se les explicó la forma correcta para la recolección de la muestra de heces, conservación y transporte en medios microbiológicos: Stuart o Ammies y Cary-Blair, los cuales contienen nutrientes específicos, de bajo potencial oxido-reducción y un pH adecuado para la recuperación de microorganismos.13 Los criterios de inclusión fueron niños entre 3 y 13 años, que no estuvieran recibiendo antibióticos, antmicóticos y probióticos mínimo un mes antes de realizarse el estudio de la MGIA. Se elaboró una ficha para recolectar la información proveniente de las historias médicas, observaciones del médico y padres; registrándose edad, sexo clínica, signos, síntomas gastrointestinales y conductas del neurodesarrollo.
En el procesamiento de las muestras en el laboratorio se emplearon medios de cultivo selectivos y diferenciales como Levine (Oxoid), MacConkey (Oxoid), SS agar (Oxoid), XLD (Oxoid), TCBS (Oxoid), Campylobacter libre de sangre (Oxoid) y CNA (Agar sangre con suplemento CNA-Oxoid), para la obtención de bacterias enteropatógenas, flora benéfi- ca y transitoria incluyendo Gram negativos y Gram positivos. Para la recuperación de hongos levaduriformes y filamentosos se emplearon medios de Sabouraud Dextrosa Agar (Oxoid), Sabouraud Dextrosa Agar+Gentamicina, Chromo Agar (Oxoid) y Mycosel Agar (BBL). En la semicuatificación de los componentes de la microbiota gastrointestinal, se utilizó un gramo de heces correspondiente a unidades formadoras de colonia/gramo de heces (UFC/gH). Las muestras de heces se sembraron en base a cuatro cuadrantes, para su posterior lectura e interpretación. Los microorganismos en estudio se identificaron por pruebas bioquímicas convencionales, prueba de filamentización en suero, medios automatizados (VITEK® 2 Compact) y pruebas de aglutinación.
Las condiciones de la MGIA fueron evaluadas en base al crecimiento de microorganismos beneficiosos, transitorios y/o presencia de enteropatógenos aeróbicos, utilizando como indicador de microbiota beneficiosa a Escherichia coli (E. coli) y Enterococcus faecalis (E. faecalis) los cuales siempre deben estar en mayor cantidad que los demás, en una proporción de 3 a 4 cruces (+) de crecimiento en placa. Mientras que la flora transitoria como Proteus spp., Klebsiella spp., Enterobacter spp., Candida spp, entre otras,14 deberían encontrarse ausentes o hasta 1 (+). La microbiota enteropatógena no es evaluada por cuadrantes debido a que son patógenos verdaderos como Salmonella sp., Shiguella sp., Aeromonas sp., Plesiomonas sp., Vibrions sp. y Campylobacter sp. Cada cruz corresponde a un cuadrante de siembra y la escala es la siguiente (15): 1(+): cre- cimiento escaso (<103) UFC/gH; 2(+): crecimiento leve (103-104) UFC/gH; 3(+): crecimiento moderado (105-106) UFC/gH; 4(+): crecimiento abundante (>107) UFC/gH.
En la interpretación de la disbiosis se propone clasificarla en números romanos de la siguiente manera: Grado de disbiosis I: microbiota gastrointestinal transitoria con crecimiento hasta el segundo cuadrante (2+). Grado de disbiosis II: microbiota gastrointestinal transitoria con crecimiento hasta el tercer cuadrante (3+). Grado de disbiosis III: microbiota gastrointestinal transitoria con crecimiento hasta el cuarto cuadrante (4+). Ausencia de disbiosis: microbiota gastrointestinal transitoria ausente o con crecimiento en el primer cuadrante el cual es considerado normal para este tipo de gérmenes 1(+).
En los procedimientos estadísticos de esta investigación se utilizó el programa estadístico SPSS versión 20 para Windows. Todas las variables fueron descritas utilizando porcentajes. Para comparar los datos cualitativos se utilizó Chi-cuadrado, como también la prueba de Kruskal Wallis para la comparación de poblaciones microbianas. El intervalo de confianza fue de un 95% con una significancia de p < 0.05.
Resultados
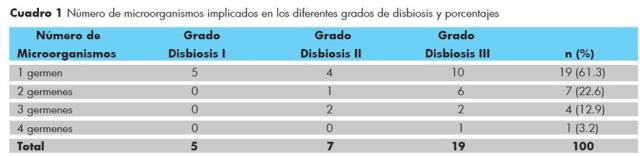
El grupo en estudio fue de 39 niños con edades comprendidas entre 3 y 13 años cuya media fue de 6.8 ± 2.98. De los cuales 28 (71.8%) fueron género masculino y 11 (28.2%) género femenino. No se reportó disbiosis en 8 niños (20.50%). Se encontró disbiosis en 31 niños (79.48%), los cuales fueron agrupados en Grado I: 5 pacientes con 16.13%. Grado II: 7 pacientes con 22.58% y Grado III: 19 pacientes con 61.3%; este grupo representa la mayoría de niños que presentaron disbiosis con un único microorganismo como agente causal de disbiosis. También se observa que la multicasualidad en el desarrollo de disbiosis presenta un porcentaje decreciente a medida que más microorganismos están implicados en el grado. Solo se reportó un caso de disbiosis con cuatro microorganismos en un paciente con disbiosis grado III, que representa un 3.2%, Cuadro 1.
Cuadro 1 Número de microorganismos implicados en los diferentes grados de disbiosis y porcentajes
La presencia de E. coli como flora benéfica se encontró en 34 niños (87.2%) en condiciones normales de acuerdo a los criterios establecidos en la interpretación del estudio de disbiosis, mientras que en 3 niños (7.7%) hubo ausencia, y en 2 niños (5.1%) se encontró disminuida. La presencia de E. faecalis como flora benéfica estuvo ausente en 3 niños (7.7%) y se encontró disminuido en 9 niños (23.1%) Cuadro 2; la microbiota transitoria debido a la gran variedad encontrada se detalla de acuerdo a su crecimiento, interpretación y porcentajes en los Cuadros 2 y 3. Al aplicar la prueba estadística de Kruskal-Wallis para determinar si existe diferencia entre K. pneumoniae, P. mirabilis y S. marcensces como gérmenes transitorios mayormente aislados y los diferentes grados de disbiosis propuestos, se obtuvo un valor de P 0.030 < p0.050, expresando que el crecimiento de estos tres gérmenes varía entre los diferentes grados de isbiosis (Cuadro 5) es decir, que su crecimiento varía según el grado de disbiosis y la media de crecimiento se ubica entre el grado de disbiosis II y III , ver Figura 1. Dos niños presentaron Campylobacter coli como agente enteropatógeno.
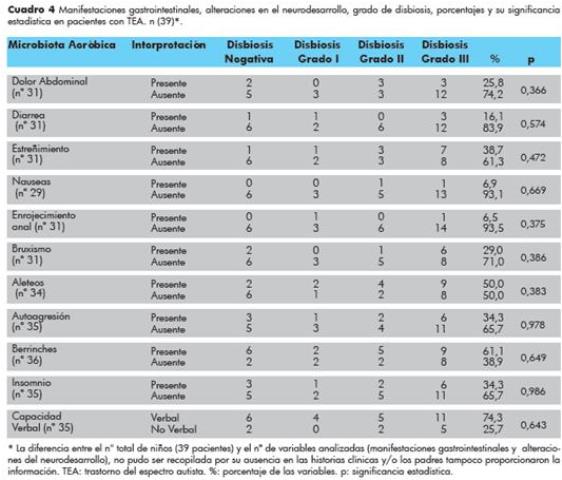
Las manifestaciones gastrointestinales como signos y síntomas más comunes en niños con TEA fueron dolor abdominal 8 (25.80%), diarrea 5 (16.13)% y estreñimiento 12 (38.7%), los restantes se detallan en el Cuadro 4. Entre los trastornos de conducta más relevantes en el neurodesarrollo de niños con TEA que se tomaron en consideración fueron: aleteos 17 (50%), autoagresión 12 (34%), berrinches, 22 (61%) e insomnio 12 (34.3%), datos más detallados en el cuadro 4. La diferencia entre el número total de niños (39 pacientes) y el número de variables analizadas (manifestaciones gastroinestinales y alteraciones del neurodesarrollo), no pudieron ser recopiladas por su ausencia en las historias clínicas y/o los padres tampoco proporcionaron la información.
Cuadro 2 Microbiota aeróbica benéfica (E. coli y E. faecalis) y transitoria (todas las
demás investigadas diferentes a E. coli y E. faecalis), su interpretación y porcentajes en niños con TEA.
Escherichia coli, Enterococcus faecalis: normal de 4 a 3 (+), disminuido: de 2 a 1 (+), Ausente: ningún crecimiento. Otras enterobacteria diferentes a Escherichia coli: normal hasta 1(+), aumentado de 2 a 4 (+). nº: número de microorganismos. %: porcentajes de los microorganismos de acuerdo a su crecimiento. TEA: trastorno del espectro autista.
En este estudio la disbiosis por especies de Candida solo estuvo incrementada en 4 niños, a expensas de Candida tro- picalis en 2 niños (5.1%), Candida glabrata y Candida krusei con 1 niño por especie (2.6%) respectivamente. Las demás especies aisladas se observan en el Cuadro 3.
Cuadro 3 Microbiota aeróbica transitoria, interpretación y porcentajes en niños con TEA.
Cocos gram positivos diferentes a Enterococcus faecalis, especies de Candida y levaduras: normal hasta 1 (+), aumentado de 2 a 4 (+). nº: número de microorganismos. %: porcentajes de los microorganismos de acuerdo a su crecimiento. TEA: trastorno del espectro autista.
Cuadro 4 Manifestaciones gastrointestinales, alteraciones en el neurodesarrollo,
grado de disbiosis, porcentajes y su significancia estadística en pacientes con TEA. n (39)*.
* La diferencia entre el n° total de niños (39 pacientes) y el nº de variables analizadas (manifestaciones gastrointestinales y alteraciones del neurodesarrollo), no pudo ser recopilada por su ausencia en las historias clínicas y/o los padres tampoco proporcionaron la información. TEA: trastorno del espectro autista. %: porcentaje de las variables. p: significancia estadística.
Cuadro 5 Prueba de Kruskal-Wallis para determinar si existe diferencias
significativas en el crecimiento de Klebsiella pneumoniae, Proteus mirabilis y Serratia marcescens en los diferentes grados de disbiosis.


Figura 1 Gráfico de barras de error, que demuestran la existencia de diferencias significativas en el crecimiento de Klebsiella pneumoniae, Proteus mirabilis y Serratia mercescens en los diferentes grados de disbiosis en niños con TEA
Discusión
En el presente estudio se determinó que los niños con TEA presentan disbiosis en diferentes grados. En los últimos años se han descrito hipótesis donde se discute la variación en la composición de la microbiota intestinal como posible causa de alteraciones en las conductas del neurodesarrollo en estos niños. Estos cambios vienen relacionados con la población en estudio que se seleccione, la cual no debe ser directa sino al azar para obtener una mejor incidencia en la investigación. La mayoría de estudios poblacionales en niños con TEA el género masculino prevalece sobre el femenino, los datos obtenidos en este estudio fueron más niños que niñas (28/11) datos que coinciden con otras publicaciones.15,11,16
Los microorganismos que constituyen el ecosistema de la microbiota gastrointestinal, se clasifican en dos importantes grupos: el grupo de microorganismos que habitan permanentemente como colonizantes y que van a aportar funciones benéficas al sistema, y el grupo de microorganismos que se comportan como microbiota transitoria proveniente de la ingesta y digestión diaria de los alimentos.14
La microbiota gastrointestinal aeróbica constituye aproximadamente el 30%, mientras que el 70% pertenece a la microbiota anaeróbica,17 caracterizándose este estudio por el análisis de la MGIA. Existen pocos estudios sobre la evaluación de esta parte de la microbiota gastrointestinal, sobre todo en niños con TEA que presentan problemas gastrointestinales. E. coli representa a nivel de colon solo un 0.1% de la microbiota aeróbica que compone el grupo de las enterobacterias.18 Las especies de E. coli diferentes a E. coli enterotoxigénica, estimulan el sistema inmunitario y la síntesis de defensina e inmodulación, por lo que una disminución o ausencia de E. coli en la microbiota fecal podría afectar negativamente la nutrición de los enterocitos.19,20 Enterobacterias diferentes a E. coli, también sintetizan sustancias tóxicas contra las bacterias enteropatógenas, entre ellas tenemos: Klebsiella spp., Proteus spp., Citrobacter spp., Serratia spp., Morganella spp., Providencia spp., Pseudomonas spp., entre otras. Este tipo de enterobacterias se encuentran en el humano en cantidades limitadas, asociándose a la ingesta diaria de alimentos.14,18 En el presente estudio fueron investigadas de acuerdo a los criterios establecidos, denominándolas transitorias. Klebsiella pneumoniae (K. pneumoniae) fue el germen más aislado, en 11 niños (28.2%) y el que mayor prevaleció en el grado III, seguido de Proteus mirabilis (P. mirabilis), aislado en 8 niños (20.5%) y 5 niños (12.8%) con aislamientos aumentados de Serratia marcensces (S. marcensces).
K. pneumoniae y P. mirabilis son responsables de inducir colitis y cáncer colorectal.19,20,21 Gonzalez et al.,16 en 36 niños con TEA reportaron 73.91% de colitis crónica activa severa con hiperplasia linfoide y un 26.09% de colitis crónica activa severa sin hiperplasia linfoide. Este estudio no confirmo el agente causal de la colitis. Infecciones oportunistas por K. pneumoniae y P. mirabilis, son más conocidas causando infecciones a nivel respiratorio y urinario, sin embargo se observa con más frecuencia en heces de pacientes con colitis ulcerosa que en controles sanos.21 Malas condiciones de higiene se relacionan con colonizaciones tempranas por enterobacterias, por lo que se produce un desequilibrio en la composición de la microbiota gastrointestinal,10 así como también la exposición temprana a antibióticos. Estudios relacionan a Klebsiella oxytoca (K. oxytoca) como causante de colitis hemorrágica asociada a antibióticos tales como amoxacilina, amoxacilina-acido clavulánico y claritromicina.22,23 Un estudio realizado por Adams et al.,15 encontraron 1.7% de aislados de K. oxytoca en 58 niños con TEA.
E. faecalis favorece la protección de mucosas, la síntesis de IgA y la resistencia a la colonización.24,25 Un estudio en niños con TEA aislaron 0.81± 1.4 de E. faecalis en un rango de 0-4.15 Especies de Enterococcus diferentes a E. faecalis resistentes a ampicilina y a vancomicina no fueron aislados en esta nvestigación. En la presente investigación Streptococcus α hemolítico se encontró aumentado en 6 niños (15.4%), S. aureus en 2 niños (5.1%) y Staphylococcus coagulasa negativa en 1 niño (2.6%), Cuadro 3. Un estudio en niños con TEA identificó 13.8% de S. aureus, con resultados casi similares a esta investigación y 13% de Streptococcus α hemolíticos.15 Especies de Candida y levaduras son consideradas como microbiota normal a nivel intestinal, y no superan 104 UFC/ gH.14,26 Una alteración en el sistema gastrointestinal puede aumentar el crecimiento de este tipo de hongos, pero espe- cies de Lactobacillus, Bifidobacterias y algunas especies de Bacteroides actúan de manera inhibitoria mediante la producción de ácidos grasos de cadena corta y bacteriocinas.24
Otro estudio venezolano identificó de manera indirecta 8 niños con aislamientos de Candida, pero no establecieron las condiciones de microbiota normal o si estaban aumentadas.2 Emam et al,11 describen un estudio sobre Candida albicans donde 15 niños (18.1%) tenían cultivos negativos, 22 niños (26.5%) tenían crecimiento mínimo y 46 niños (55.4%) tenían crecimiento elevado; pero los criterios de recolección de las muestras no fue la adecuada, ni hubo referencia del método utilizado para su recuento.
En cuanto a bacterias enteropatógenas, en 2 niños (5.13%) se aisló Campylobacter coli (C. coli), no se evidenciaron aislamientos de especies de Salmonella, Shiguella, Plesiomonas, Aeromonas y Vibrions. La prevalencia de Campylobacter coli es cosmopolitan, tanto en países desarrollados como en vías de desarrollo. Un gran número de infecciones por C. coli, son asintomáticas. Entre 5-10% de los casos presentan recaídas si no es tratada la campylobacteriosis. El hallazgo de portado- res sanos en países sudamericanos es muy frecuente.25,27
Las diversas manifestaciones gastrointestinales observadas en niños con TEA en este estudio, coincide con diversos estudios realizados.15,28 Un estudio realizado en los Estados Unidos en una población de 137 niños con TEA, el síntoma más común fue diarrea con un 17%,29 resultado similar a esta investigación. Así también, un estudio recopilatorio publicado por la revista The American Academy of Pediatrics, 28 donde analizaron 15 publicaciones para un total de 2215 niños con TEA, refieren una prevalencia de mayor a menor: diarrea 80%, estreñimiento 60% y dolor abdominal 53%. Un estudio realizado en Venezuela donde evaluaron 45 niños con TEA el vómito fue el síntoma predominante en un 55,5%.16 En el presente trabajo, el vómito solo se presentó en 1 niño (2,6%). Sin embargo, como se observa en el Cuadro 4, en este estudio no se encontró correlación significativa p <0.05, entre la evidencia de estas manifestaciones gastrointestinales y el grado de disbiosis, dado que dichas manifestaciones presentan una misma distribución en cada uno de los niveles de disbiosis planteados. Igualmente no hubo significancia estadística p<0.05 entre las alteraciones o conductas del neurodesarrollo y los diferentes grados de disbiosis propuestos.
Los problemas gastrointestinales son comunes en niños con TEA, y varían de acuerdo a la población en estudio y la metodología empleada. Cabe resaltar que en esta investigación en relación a la MGIA se encontraron microorganismos que cuando sobrepasan su estado normal de crecimiento, pueden verter al sistema intestinal toxinas y productos de su metabolismo capaces de causar signos y síntomas gastrointestinales, las bacterias principalmente involucradas fueron Klebsiella pneumoniae, Proteus mirabilis y Serratia marscensces. La propuesta sobre la clasificación de los grados de disbiosis permite evaluar el tipo y duración del tratamiento. En cuanto a las conductas del neurodesarrollo y los grados de disbiosis, estas pudieran estar relacionadas con la condición, más que con la presencia de la infección gastrointestinal, por lo que pudieran presentarse con mayor intensidad en niños con TEA, que en niño con condiciones del neurodesarrollo normal. Se necesitan más estudios sobre la microbiota para poder entender la complejidad de los signos y síntomas y la etiología del TEA.
Agradecimientos
Agradecemos al Concejo de Desarrollo Científico y Humanís- tico de la Universidad Central de Venezuela (CDCH-UCV) por su aporte parcial a nivel económico. Al Laboratorio de Investigaciones Básicas y Aplicadas. Al Departamento de Microbiología del Instituto Médico la Floresta especialmente a la Lcda. Carolina Macero y al Lcdo. Gustavo Martínez, por su valiosa colaboración en el desarrollo parcial de la parte experimental de este trabajo.
Clasificación
Área: pediatría. Tipo: clínico.
Tema: microbiota gastrointestinal. Autismo.
Patrocinio: Aporte parcial a nivel económico por el Concejo de Desarrollo Científico y Humanístico de la Universidad Cen- tral de Venezuela (CDCH-UCV).
Referencias bibliográficas
1. Ratajczak H. Theoretical aspects of autism: Causes - A review. Journal of Immunotoxicology. 2011;8(1):68-79.
2. González L. Manifestaciones Gastrointestinales en Trastor- nos del Espectro Autista. Colombia Médica. 2005 Abril-Junio;36(2):36-38.
3. Autism and Developmental Disabilities Monitoring Network Surveillance Year 2010 Principal Investigators. Prevalence of Autism Spectrum Disorder Among Children Aged 8 Years Autism and Developmental Disabilities Monitoring Network, 11 Sites, United States, 2010. Morbility and Mortality Weekly Report. 2014 Marzo; 63(2):1-22.
4. De la Torre B, Hernández C. Trastornos del Espectro Autis- ta: Caracterización a Través de Biomarcadores. Acta Científi- ca de la Sociedad Venezolana de Bioanalistas Especialistas. 2013;16(2):62-69. [ Links ]
5. Cuxart F. El Autismo. Aspectos Descriptivos y Terapéuticos Málaga: Ediciones Aljibe, S.L.; 2000. [ Links ]
6. Vallés Runge A. Estudio Observacional de un Tratamiento Biológico y Dietético de los Trastornos del Espectro Autista. 2007;1-35. [ Links ]
7. Hawrelak J. The Causes of Intestinal Dysbiosis: A Review. Alternative Medicine Review. 2014;9(2):180-197. [ Links ]
8. Marcus N. Síndrome del Intestino Permeable (Leaky Gut) y su Relación con las Enfermedades. In 27 Congreso Nacional AMMFEN; 2012; Puerto Vallerta. p. 1-5. [ Links ]
9. Dupont A, Dupont H. The Intestinal Microbiota and Chronic Disorder of the Gut. Nature Reviews Gastroenterology & He- patology. 2011;8(9):523-531. [ Links ]
10. Gómez Duque M, Acero F. Composición y Funciones de la Flora Bacteriana Intestinal. Repertorio de Medicina y Cirugía. 2011;20(2):74-82. [ Links ]
11. Emam M, Mamdouh E, Abdelrahim S. Candida albicans Infection in Autism. Journal of American Science. 2012; 8(12):739-744. [ Links ]
12. Rodríguez C, García S, Barberis C, Saposnik E, Weyland B, Nastro M. Enterococcus sp: Resistencia Antimicrobiana en Infecciones Intrahospitalarias. Acta Bioquimica Cliníca Latinoamericana. 2013;47(1):155-160. [ Links ]
13. Murray P. Manual of Clinical Microbiology. 7th ed. Washington DC; 1999. [ Links ]
14. Soyucen E, Gulcan A, Cigdem Aktuglu-Zeybek A, Onal H, Kiykim E, Aydin A. Differences in the gut microbiota of healthy children and those with type 1 diabetes. Pediatrics Internatio- nal. 2014;56:336-343. [ Links ]
15. Adams A, Johansen L, Powell L, Quig D, Rubin R. Gas- trointestinal Flora and Gastrointestinal Status in Children with Autism-Comparisons to Typical Children and Correlation with Autism Severity. BMC Gastroenterology. 2011;11(22):1333-1341. [ Links ]
16. González L, López K, Navarro D, Negrón L, Flores L, Rodríguez R, et al. Características Endoscópicas, Histológicas e Inmunológicas de la Mucosa Digestiva en Niños Autistas con Síntomas Gastrointestinales. Archivos Venezolanos de Puericultura y Pediatría. 2006;69(1):19-25. [ Links ]
17. Cortes B. La flora bacteriana intestinal.. Instituto de medicina biologica y antienvejecimiento. 2009. [ Links ]
18. Beckman G, Rüffer A. Mikroökologie Des Darmes: Grundlagen, Diagnostik, Therapie, Schlüttersche. 2000. [ Links ]
19. Chow J, Tang H, Mazmanian S. Pathobionts of the gastrointestinal microbiota and inflamatory disease. Curr Opin Inmunol. 2011;23(4):473-480. [ Links ]
20. Garret W. Colitis-associated colorectal cancer driven by T-bet deficiency in dendritic cells. Cancer Cell. 2009;16(3): 208-219. [ Links ]
21. Garret W et al. Enterobacteriaceae act in cert with the gut microbiota to induce spontaneaus and maternally trasmitted colitis. Cell Host Microbe. 2010;2(3):292-300. [ Links ]
22. Beagerie L, Metz M, Barbut F. Klebsiella oxytoca as an agent of antibiotic-associated hemorrhagic colitis. Clin Gas- troenterol Hepatol. 2003;1:370-376. [ Links ]
23. Högenauer C, Langner C, Beubler E, Lippe I, Schicho R, Gorkiewicz G. Klebsiella oxytoca as a causative organism of antibiotic-associated hemorrhagic colitis. N Engl J Med. 2006;355:2418-2426. [ Links ]
24. Sonoyama K, Miki A, Sugita R. Gut colonization by Candida albicans aggravates, inflammation in the gut and extragut tissues in mice. Med Mycol. 2011;49:237-247. [ Links ]
25. Fernández H. Campylobacter y campylobacteriosis una mirada desde america del sur. Rev. Peru Med Exp Salud Publica. 2011;28(1):127-27. [ Links ]
26. Bernhard H, Wellmer A, Zimmerman K, Knoke M. Growth of Candida albicans in normal and altered faecal flora in the model of continous flow culture. Mycoses. 1995;38:265-270. [ Links ]
27. Nielsen H, Engberg J, Ejlertsen T, Bucker R. Short-term and medium term clinical outcomes of Campylobacter concius infection. Clin Microbiol Infect. 2012;18:E459-E465. [ Links ]
28. Mc Elhanon B, Mc Cracken C, Karpen S, Sharp W. Gastrointestinal symptoms in autism spectrum disorders: A metaanalysis. Pediatrics. 2014 Mayo; 133(5):872-883. [ Links ]
29. Molloy C, Manning-Courtney P. Prevalence of chronic gastrointestinal symptoms in children with autism and autistic spectrum disorders. Autism 2003. 2003 Jul;2:165-171. [ Links ]