Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Obstetricia y Ginecología de Venezuela
versión impresa ISSN 0048-7732
Rev Obstet Ginecol Venez v.64 n.1 Caracas ene. 2004
Secreción extrahipofisaria de prolactina. Revisión
Drs. Nelson Velásquez, Marianela Fernández -Michelena
Departamento de Obstetricia y Ginecología, Hospital Chiquinquirá de Maracaibo. Universidad del Zulia
INTRODUCCIÓN
A pesar de que la prolactina (PRL) ha sido la hormona más ancestralmente conocida (1,2), su molécula fue identificada hace apenas tres décadas, en el año 1970 (3), y poco tiempo después fue aislada de la adenohipófisis. Hubo muchas dudas sobre la existencia de una hormona lactogénica hipofisaria diferente de la hormona de crecimiento (hGH), aunque se conocían evidencias de su separación. La hGH tiene una gran actividad lactogénica en muchos animales y aunque en varios de ellos se había logrado separar ambas hormonas, hubo grandes dificultades técnicas para lograrlo en los primates (4). Por ejemplo, se sabe que la hGH purificada posee actividad lactogénica; así, la administración de hGH de primates a los humanos ejerce actividad mamotrópica. Entre las evidencias se mencionan:hipertrofia y crecimiento del buche de las palomas mediante bioensayo y que la administración de extracto de adenoma hipofisario de una paciente con galactorrea en una mujer normal, logró obtener actividad propia de PRL que no fue neutralizada por antisueros dirigidos específicamente contra hGH (5,6). Por otro lado, se había descrito lactancia posparto normal en una enana ateliótica con ausencia congénita de hGH (7).
La PRL es una hormona polipeptídica de 198 aminoácidos cuyo gen se localiza en el cromosoma 6, donde también está el del antígeno leucocitario humano (HLA) (8,9). Se han descrito varias isoformas circulantes de su molécula: la "pequeña prolactina" que es muy activa biológicamente y ocupa el 80 % de la producción, es la que presenta más actividad sobre el receptor específico y se halla en la mayoría de los casos con hiperprolactinemias (10). La "prolactina grande-grande", la "prolactina grande", la "pequeña- pequeña prolactina", y la forma glicosilada; sus pesos moleculares son diferentes y probablemente tengan funciones distintas (10,11).
El subtipo eritrosinofílico de células acidófilas de la adenohipófisis que produce PRL el lactotropo se encuentra situado en las porciones postero-laterales de la parte distal de la glándula adenohipofisaria; lo que facilita el abordaje quirúrgico transesfenoidal de los tumores que de allí se derivan (12), y que por mucho tiempo llevó a clasificarlos como adenomas acidofílico por teñirse de rosado con el colorante compuesto de hematoxilina y eosina (13). Para que esta célula especializada se desarrolle necesita de la presencia de un factor de transcripción llamado Pit 1, que es común para otras células hipofisarias (somatotropos y tirotropos) y que también se une al gen de prolactina en varios sitios (14). La secreción de PRL está tónicamente inhibida por la dopamina secretada en los núcleos hipotalámicos y que alcanza la hipófisis a través de los capilares del sistema portal hipotálamo-hipofisario, donde a su vez se ha descrito una circulación de retorno desde la glándula al hipotálamo (14-16). Varios neuropéptidos también la inhiben, entre los que se encuentran: el ácido gamma-amino-butírico (GABA) en la hipófisis, las catecolaminas (17) y acetilcolina (18). Otras sustancias son inhibidoras: la levodopa (19,20) y alcaloides derivados del ergot (21). Por el contrario, su secreción es estimulada por la hormona estimulante de tirotropina (TSH), serotonina (5- HT), histamina, betaendorfinas, colecistoquinina (CCK), polipéptido intestinal vasoactivo (VIP), bombesina, neurotensina y sustancia P (16,18,2 1,22) y por varios medicamentos tales como los derivados de las fenotiazinas, y cloropromazina y drogas utilizadas como antieméticos o antiulcerosas (cimetidina y derivados). La PRL se sintetiza en los ribosomas de los prolactinotropos o lactotropos adenohipofisarios, es concentrada en el aparato de Golgy y almacenada en forma de gránulos en el citoplasma celular, de donde es liberada al recibir las señales secretagogas. Su liberación es episódica, en forma de pulsos de duración, amplitud y elevación variables y modificada en varias condiciones fisiológicas como el sueño, movimientos no rápidos de los ojos (REM), la ingesta alimenticia, embarazo, lactancia y estímulos locales en mama o arcos reflejos como la visión o el llanto del niño (4,14,22).
La hiperprolactinemia es común en algunas enfermedades como el hipotiroidismo, el síndrome de ovario poliquístico, la acromegalia e insuficiencia hepática o renal.
La síntesis extrahipofisaria de prolactina humana es controlada por un promotor diferente al de la PRL hipofisaria, envuelve un exón alternativo "aguas arriba" del sitio inicial pituitario que genera un ácido ribonucleico (RNA) transcriptor mayor que el hipofisario (14). El RNA mensajero (mRNA) de la PRL no hipofisaria posee una secuencia distinta 5 no traducida (UTR) correspondiente a un exón adicional: el exón lA (23). Este exón lA y los elementos promotores asociados a él están localizados a 8 000 bp del sitio de iniciación para la transcripción de la PRL hipofisaria (24) (Figura 1). En algunos roedores la síntesis extrahipofisaria de PRL pudiera estar condicionada a factores de crecimiento locales (24).
Además de los receptores nativos en la glándula mamaria para la acción de la prolactina en sus diferentes isoformas, otros tipos de receptores para PRL se han localizado en hígados de ratas (25) con una secuencia de aminoácidos similares a los de la hGH (26); son más abundantes en las hembras. Los estrógenos aumentan el número de receptores de PRL en el hígado de las ratas (27), mientras que la testosterona, la medroxiprogesterona y el cortisol los inhiben (28). La hormona de crecimiento y otros factores como los esteroides gonadales o suprarrenales, además de la propia PRL, pueden modularlos (15). También se encuentran en hipotálamo, suprarrenales, riñón, páncreas, ovarios, testículos, tejido linfoide, próstata, vesículas seminales y cerebro (10). El receptor de PRL es codificado por un gen en el cromosoma 5pl3-l4, cerca del gen para el receptor de hormona de crecimiento y pertenece a una familia que incluye a citoquinas y algunos factores de crecimiento, lo que le ha dado soporte a su dualidad como hormona y citoquina (14).
Se ha detectado PRL en otros tejidos como en neuronas hipotalámicas, endometrio, decidua, mamas (14), células del sistema gastrointestinal y de algunos tejidos cancerosos de pulmón y riñón (16).
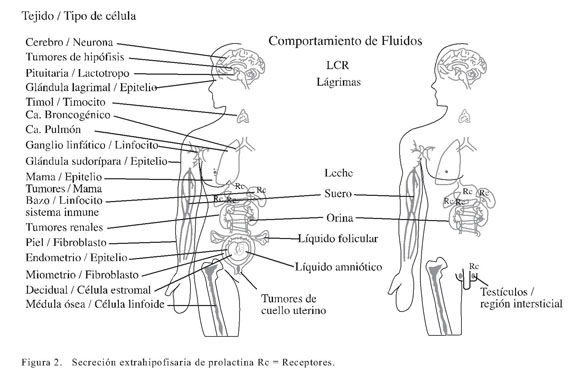
En esta revisión exponemos en forma detallada la formación de la hormona lactogénica prolactina en sitios diferentes de los lactotropos hipofisarios y sus posibles acciones sobre algunos órganos distantes de la glándula mamaria (Figura 2).
Otras fuentes de producción de prolactina Decidua
El endometrio humano decidualizado sintetiza y secreta prolactina (29); Maslar y Riddick (30) la hallaron entre los días 22 y 28 del ciclo menstrual normal. En el embarazo temprano el líquido amniótico muestra concentraciones crecientes de PRL hasta la décima semana; pero aumenta marcadamente hacia la 20, llegando a alcanzar valores 10 a 100 veces más altos que en plasma materno y fetal, para luego disminuir (22). Por el hecho de que la PRL materna no pasa al líquido amniótico o que sus concentraciones no suelen disminuir al administrar análogos dopaminérgicos, se estableció que debería existir un origen propio para su producción. Tal sitio es la decidua: la PRL aquí elaborada es biológica, química e inmunológicamente igual que la sérica (31,32); allí su producción es iniciada por la progesterona, pero después de la decidualización su secreción continúa aún en ausencia de estrógeno y progesterona (33).
La PRL decidual es un polipéptido de 197-199 aminoácidos (14) y se necesita la integridad del amnios y del corion para su síntesis. La producción aumenta con la progesterona y con la mezcla de estrógeno y progesterona, pero no con el estrógeno solo (34). El ácido araquidónico, la endotelina 1 y la interleuquina 1 reducen la tasa de secreción de PRL decidual (35,36). Una proteína purificada placentaria:23,5 kD, demostró estimular la síntesis y secreción de PRL en los cultivos deciduales (37).
La insulina, el factor de crecimiento parecido a la insulina a través de sus propios receptores y la relaxina también estimulan la síntesis y liberación de PRL decidual (38). Como hemos expuesto, la regulación de la PRL decidual difiere de la hipofisaria in vitro; por ejemplo: la dopamina, bromocriptina y la hormona hipotalámica liberadora de tirotrofina (TRH) no la modifican (34), igual ocurre cuando se administra dopamina o sus agonistas y antagonistas a la mujer gestante, es decir, estas sustancias no modifican la concentración amniótica de PRL (39).
No es clara la función de la PRL en el líquido amniótico; pudiera intervenir en la modulación del equilibrio hidroelectrolítico fetal, protegerlo de la deshidratación controlando el transporte de agua y sodio a través del amnios, reduciendo a su vez la permeabilidad de éste en el sentido feto-madre (40) y aún, se presume que pueda intervenir en el crecimiento del endom etrio crecimiento y desarrollo fetal y coadyuvar en la preparación de la glándula mamaria para la lactancia (41). Hasta se ha comentado que pudiese tener influencias en el paso del feto del medio líquido-acuoso materno al aéreo, o exterior. Otra de las funciones atribuibles a la PRL decidual es la relacionada a la madurez pulmonar fetal porque hay receptores en sus pulmones para la PRL (41). El síndrome de membrana hialina ha sido asociado a bajas concentraciones de PRL en el líquido amniótico (42).
Se presume que la PRL decidual tenga un papel sobre la contracción uterina (22) porque se ha establecido que el miometrio produce PRL (43) o una sustancia muy parecida a ella (44). Otros sugieren que la PRL puede contribuir a evitar el rechazo del embrión recién implantado por supresión de la respuesta inmune materna (14).
Se ha encontrado elevación de los niveles de PRL plasmática en casos de hipertensión arterial asociada al embarazo, al inicio y final del mismo, y se halló correlación entre las cifras altas de la presión arterial y las concentraciones sanguíneas elevadas de PRL, por lo que se sugiere algún papel de esta hormona en la hipertensión asociada al embarazo, bien a través de modificaciones en la respuesta vascular a agentes vasopresores o en la producción de retención de sal, con mayor sensibilidad a la angiotensina circulante y/o que actúe controlando la síntesis de prostaglandinas en el riñón (45). Neuronas hipotalámicas
Por estudios de inmunohistoquímica se ha logrado establecer la presencia de hGH y TSH en áreas neuronales extrahipofisarias (46). No existe duda de que el cerebro produce y libera hormona adrenocorticotrópica (ACTH) (47) y, dado que hay PRL en condiciones normales en líquido cefalorraquídeo (LCR), se puede inferir que esta hormona también sea secretada por células neuronales distintas a los prolactinotropos hipofisarios. El gen de la PRL también se "expresa" en el cerebro (24,43); y en los vertebrados este órgano es un "blanco" para la acción de la PRL, cuya actividad se ha relacionado al cuidado de sus neonatos y, a algunas conductas como la de migración de las aves e incubación de sus "polluelos" (48).
Por otro lado, ciertos estudios han sugerido que normalmente existe correlación entre las concentraciones de hormonas adenohipofisarias plasmáticas y las del LCR, lo cual ha sido demostrado también por nosotros (datos sin publicar); pero sobre todo en los enfermos con acromegalia, donde se han encontrado altas concentraciones de hGH en ambos fluidos (49). Algunos investigadores han notado niveles altos de PRL en LCR (50-54) y, otros han pensado que las concentraciones muy elevadas pueden sugerir la expansión extrasellar de tumores (51). Assies y col. (50) han demostrado fuerte correlación entre las concentraciones séricas y del LCR sugiriendo que su presencia deriva del suero sanguíneo, lo que se apoya en el hecho de que se presentan incrementos en LCR con la administración de sustancias que elevan las concentraciones plasmáticas de PRL en pacientes sin evidencia de tumores hipotalámicos o hipofisarios que causan hiperprolactinemia (50,55).
Se han propuesto 3 modalidades para explicar la presencia de PRL en el líquido cefalorraquídeo; una de ellas se refiere al hecho de que las hormonas pueden entrar al LCR a través de los plexos coroideos por filtración desde la sangre, esta parece ser la vía en los pacientes con prolactinomas y la correlación entre los niveles séricos y los del LCR, parecen apoyar esta teoría (47), lo cual no ha sido posible demostrarse para hGH, ACTH, hormona estimulante del folículo ovárico (FSH) o la luteinizante (LH) (49,51,52). Otro mecanismo propuesto es, que pudiese existir pérdida de hormonas hipofisarias directamente en el LCR por la distorsión de las relaciones anatómicas de las regiones selares y paraselares, como ocurre con expansión tumoral extraselar; sin explicar las altas concentraciones en tumores pequeños intraselares o en el síndrome de silla turca vacía que también distorsionan la anatomía local (51,54). Por último las hormonas y entre ellas la PRL, pueden entrar al espacio subaracnoideo, por secreción directa, por un proceso que se ha llamado "exocitosis fuera de lugar" (56), lo que ha sido demostrado por estudios morfológicos en adenomas hipofisarios, liberando gránulos que contienen hormonas en múltiples sitios y no solamente dentro del capilar (56). Este mecanismo puede tomar lugar en los casos de tumores que se salen de la silla turca.
En un estudio de Braunstein y col. (47) se encontró elevación de otras hormonas glicoproteicas como la TSH, FSH y LH en pacientes con tumores primarios hipofisarios con o sin expansión extraselar. Estos autores cuantificaron y no hallaron elevación de la subunidad alfa común para estas hormonas; mientras Kourides y col. (57) la encontraron elevada en 5 de 60 pacientes con adenoma pituitáricos, dos de ellos con crecimiento extraselar.
A pesar de haberse investigado no ha sido posible dar explicación fisiológica de la presencia de prolactina en líquido cefalorraquídeo de personas normales o con adenomas productores de PRL.
Mamas
Normalmente, la PRL hipofisaria viaja por vía sanguínea a la mama, atraviesa el epitelio para estimular la síntesis láctea dentro del lumen alveolar, pero la mama "per se" es una fuente importante de prolactina que es producida y procesada en las células de la glándula y pasa directamente a la leche (43). Se cree que pueda intervenir en su función inmunológica; pero el mecanismo y la razón exacta de su presencia allí no ha podido ser determinada (14). En las ratas hay significantes cantidades en la leche, que al ser absorbida por el intestino del neonato puede producir cambios en la maduración del sistema endocrino hipotalámico de sus crías (58).
Tumores
A diferencia de los tradicionalmente conocidos adenomas hipofisarios o hipotalámicos que secretan PRL o los adenomas mixtos hipofisarios comunes que producen prolactina y hormona de crecimiento, existen algunas publicaciones con referencia a la producción por ciertos tumores producción ectópica de sustancias similares o iguales a la prolactina hipofisaria mezcladas con secreción de ACTH, TSH y FSH/LH (59). Así, Ginsburg y Vonderhaan (60) han demostrado que algunos tumores malignos de las mamas sintetizan y secretan PRL.
1. Carcinomas secretantes de prolactina hipofisaria. Los carcinomas hipofisarios productores de PRL son extremadamente raros y tienen la particularidad de un rápido crecimiento hacia las estructuras adyacentes y subyacentes creando destrucción masiva de la silla turca, piso y paredes; invaden el seno esfenoidal, el seno cavernoso y dan metástasis a distancia, dentro y fuera del sistema nervioso central (61); aunque también se han descrito en muy raras ocasiones diseminación visceral (62,63). Tienen como característica que poseen bajo número de mitosis e histológicamente se diferencian poco de los cúmulos celulares hiperplásicos que acompañan a otros adenomas no secretantes de PRL y que se hacen insensibles rápidamente a los análogos dopaminérgicos y a los agentes quimioterapéuticos; aunque la cirugía y la radioterapia son beneficiosos (64).
2. Mamas
Desde hace mucho tiempo se ha incriminado a los excesos estrogénicos como factores asociados a la aparición del cáncer mamario; es conocido, cómo el riesgo de cáncer de mama aumenta en las pacientes que cursan con elevados y prolongados niveles de estrógenos como las que presentan síndrome de ovarios poliquísticos o tumores productores de estrógenos, con la terapia estrogénica con o sin agregado de progestágenos, la menarca temprana o menopausia tardía y, como la síntesis de PRL hipofisaria es estimulada por los estrógenos, no sería raro ver la asociación de cáncer de mamas y el incremento sérico de PRL (60,65). Hay respuestas exageradas en la secreción de PRL a la infusión de hormona estimuladora del tiroides o tirotrofina (TSH) en mujeres que han padecido de carcinomas mamarios y en sus hermanas (66). Se conoce de algunas publicaciones que demuestran síntesis y secreción de PRL local en casos de tumores malignos de la mama y de publicaciones de aparición de prolactina en el contenido líquido de algunos quistes de la mama (60).
3. Pulmones
Una de las primeras descripciones de síntesis local de prolactina por células tumorales de un carcinoma broncogénico fue en 1971. Turkington (67) narré el caso de un hombre de 53 años con carcinoma broncogénico indiferenciado que presentaba altas concentraciones de prolactina sérica, que disminuyé con la radioterapia. También describié una mujer de 49 años con hipernefroma, hiperprolactinemia y galactorrea que mejoré después de la reseccién del tumor y noté que 1 de 21 pacientes con carcinoma pulmonar tenía hiperprolactinemia. Davis y col. (68) también demostraron hiperprolactinemia en pacientes con cáncer de pulmén, pero ninguno presenté galactorrea o hipogonadismo.
Molitch y col. (69) al analizar 215 pacientes con cánceres de diferentes tipos, encontraron 15 con hiperpolactinemia (7 %). Sin embargo 12 de las 15 usaron fenotiazinas u opiáceos o habían recibido radiaciones al térax o cerebro, que como se sabe, aumentan las concentraciones de PRL. Sélo en el 1 % de los que presentaron hiperprolactinemia, no se encontré causa conocida.
4. Cuello uterino
Hsu y col. (70) encontraron que el 31 % de las pacientes con carcinoma del cuello uterino tenían hiperprolactinemia, lo hallaron en 229 de 743 mujeres estudiadas. Estos mismos autores encontraron prolactina en tejidos aislados del cáncer cervical cuando realizaron estudios inmunohistoquímicos a las células tumorales; pero no mencionan administracién de medicamentos que elevan la PRL en sus pacientes.
Líquido folicular
No está esclarecido el papel de la PRL en el líquido del folículo ovárico. Existen cambios en la produccién de progesterona cuando se disminuyen o aumentan las concentraciones de PRL en medios de cultivos de células de la granulosa (71). Aunque no se sabe la funcién de la PRL en los ovarios, McNatty (72) demostré que la progesterona casi desaparece de los cultivos de células de la granulosa con concentraciones foliculares de 100 ng/mL de PRL; pero no es inhibida cuando hay 10 a 20 ng/mL. En los estados hiperprolactinémicos se ha observado alteracién del desarrollo folicular y defectos de la fase luteal (73,74).
En el hombre los niveles plasmáticos de PRL son comparables o algo menor que los de las mujeres (4) y, los factores que regulan su síntesis son similares a las del sexo femenino (75): disminuye su concentracién con la hipofisectomía y aumentan con administracién de esteroides gonadales (14,15,4). En una cepa de ratones que presentan enanismo con ausencia de células acidéfilas hipofisarias y que producen poca o nula secreción de la misma, se logra aumentar la cuenta espermática y mejorar la tasa de fertilidad cuando se les administra PRL.
Testículo
Algunos estudios indican que los receptores para la PRL en el testículo, se encuentran en la regién intersticial, que el sistema reproductor masculino presenta receptores de membrana para PRL (75) y que la propia PRL aumenta el complejo receptor de andrégenos (76). Se ha establecido que la PRL presenta accién antigonadal en vertebrados mamíferos o no, pero se ha reportado que una cepa de ratones con daño al gen de PRL o al de su receptor, son fértiles (77).
Un papel análogo a lo que ocurre en el ovario y sus células de la granulosa con relacién a la concentracién de PRL local, pudiese establecerse para la funcién testicular ya que al aumentar la concentracién plasmática o local de PRL en la regién intersticial del testículo, traería una disminucién de la testosterona y como consecuencia pudiese ocurrir impotencia y/o azoospermia de aquellos hombres con altos niveles de PRL sérica, lo cual se hace reversible al tratarlos con bromocriptina (10,78).
Sistema inmune
Se ha establecido que los linfocitos presentes en el bazo y la médula ésea producen ciertas cantidades de PRL (24) y que existen una serie de receptores de PRL en grupos de células inmunes derivadas de la médula ésea. Pellegrini y col. (79) demostraron que la PRL actúa sobre estas células modificando funciones inmunes "muy selectivas". También se han descrito receptores para PRL en bazo y timo y se piensa que pueda potenciar las funciones o el crecimiento de las células linfoides, mieloides y receptores de citoquinas hematopoyéticas (24). La PRL tiene efecto sobre el crecimiento en ciertas células de linfomas y ha mostrado actividad antiapoptética, que se ha utilizado ampliamente como un modelo de accién sobre células inmunes (24). Zellwerger y col., citado por Horseman (24), demostraron que la PRL estimula el sistema inmune y el de citoquinas en modelo experimental de shock hemorrágico en ratas y, en los humanos, la secrecién de PRL se correlaciona con la severidad del lupus eritematoso diseminado, enfermedad autoinmune que afecta a mujeres jóvenes (80). Se ha sugerido que la PRL contenida en la leche materna sea parte responsable de sus efectos inmunológicos (14).
Otros tejidos y fluidos
Hay receptores para prolactina en el hígado, bazo y páncreas y se ha demostrado que causa regeneración hepática después de la hepatectomía parcial; produce crecimiento del intestino delgado (81,82) y acelera el transporte de bilis y taurocolatos durante la lactancia (82,83); también parece que modula la proliferación de células beta del páncreas(83).
Es frecuente observar en los recién nacidos de ambos sexos una elevación o tumefacción de ambas glándulas mamarias y si se hace presión en ellas puede aparecer una secreción blanquecina conocida en la lengua alemana como "hexenmilch," o "leche de brujas", en el cual el epitelio glandular secretor de la mama elabora, en el protoplasma, una sustancia similar en su composición a la leche madura (84). Lyons citado por Meites y Clemens (84) en 1937 halló prolactina en orina de recién nacidos que se relacionó con la aparición de esta condición.
Se sabe de la producción de PRL por el epitelio que recubren las glándulas lagrimales y sudoríparas, a pesar de su presencia en las lágrimas y sudor, no se ha podido precisar el papel fisiológico o patológico (43). Pudiera especularse que contribuiría al metabolismo hidroelectrolítico, transporte de sodio y agua.
REFERENCIAS
1.Hwang P, Guyda H, Friesen HG. Purification of Human Prolactin. J Biol Chem. 1972;247: 1955-1958. [ Links ]
2.Lewis UJ, Sing NP, Seavey BK. Human prolactin:Isolation and some properties. Biochem Biophys Res Commun. 1971;44:1169-1176. [ Links ]
3.Friesen H, Guyda H, Harcly J. Biosintesis of human growth hormone and prolactin. J Clin Endocrino 1 Metab.1970;31:611-624.
4.Yen SSC. Physiology of human prolactin. En: YenSSC, Jaife RB, editores. Reproductive endocrinology,physiology, pathophysiology and clinical management. 4d edición. Filadelfia: W 5 Saunders Co.; l978.p.lS2-170.
5.Jacobs LS, Daughaday WH. Pathophysiology and control of prolactin secretion in patients with pituitary and hypothalamic disease. En: Pasteels JL, Robyin C, editores. Human prolactin. New York: Elsevier; l973.p.l73-l8O.
6.Peake GT, McKeel DW, Jarret L, Daughaday W.Ultrastructural, histologic hormonal characterization of a prolactin-rich human pituitary tumor. J Clin Endocrinol Metab. l969;29:l383-l387.
7. Rimoin DL, Holzman GB, Merimee TJ, Rabinowitz D, Barnes AC, Tison SEA, et al. Lactation in the absence of human growth hormone. J Clin Endocrinol Metab. l968;28:l 183-1185.
8. Owerbach D, Rutter WJ, Cooke NE, MartialJA, Shows TB. The prolactin gen is located on chromosome 6 in humans. Science. l98l;2l2: 815-818.
9. Farit N, Bear JC. The human histocompatibility complex and endocrine disease. Endocrine Rey. 198 l;2:50-54.
10. Terán-Dávila J. Prolactina humana: biosíntesis, regulación neuroendocrina y estados hiper prolactinémicos. En: Terán-Dávila J, Febres-Ballestrini F, editores. Endocrinología ginecológica y reproducción humana. 1" edición. Caracas: Editorial Ateproca; l99S.p.487-Sl3.
11. Botero Ruiz W. Estados de hiperprolactinemia. En: Botero-Uribe J, Jubiz Hazbun A, Henao G, editores. Obstetricia y Ginecología. Texto Integrado. 1" edición. Antioquía: Editorial Quebecor; l999.p.S22-S26.
12. Barrow DL, Tindail GT. Surgical management of prolactin-secreting pituitary tumors (Prolactinomas). Parte 1. Contemporary Neurosurg. 1 982;4: 1-4.
13. Kovacs K, Horvath E. Pathology ofpituitary adenomas. Bull Los Angeles Neurol Soc. l977;42:92-ll0.
14. SperoffL, Glass RH, Kase N G. Clinical Gynecology Endocrinology and Infertility. 3" edición. Baltimore: Williams y Wilkins; 1983. [ Links ]
15.Yen SSC. Prolactina en reproducción humana. En: Yen SSC, Jaife RB, editores. Endocrinología de la reproducción. 3 edición. Bogotá: Editorial Panamericana; l993.p.382-4l3.
16. Chapler FK. Hiperprolactinemia. En: Pitkin RM. Zlatnik FJ, editores. Year Book de Obstetricia y Ginecología. Buenos Aires: Editorial Médica Panamericana; l98S.p.383-396.
17. Birge CA, Jacobs LS, Hammer CT, Daughaclay WH. Carthecholamine inhibition of prolactin secretion by isolated rat adenohypophyses. Endocrinology. 1970; 86:120- 130. [ Links ]
18. Schran HR, Bhuta SI, Scbwarz HJ, Thorner MO. The pharmacokinetics of bromocriptine in man. En: Goldstein M, Calne D, Lieberman A, Thorner M, editores. Ergot compounds and brain function: Neuroendocrine and neuropsychiatrie aspect. New York: Rayen; l98O.p.l2S-l89.
19. Malarkey WB, Jacobs LS, Daughaday WH. Levodopa suppression of prolactin in nonpuerperal galactorrea. N EnglJMed l97l;285:ll6O-ll63.
20. Frantz AG, Habid DU, Iman GA, Suh KH. Remission of metastatic breast cancer after reduction of circulating prolactin in patients treated with L-dopa. Clin Res. 1972 ;20: 234-24 1.
21. MacLeod RM. Regulation of prolacin secretion. En: Martini L, Ganong WF, editores. Frontiers in neuroendocrinology. Vol 4. New York: Rayen Press Publishers; 1976.p.169-194.
22. Molilth ME. Disorders of the pituitary lactotroph. En: Adashi EY, Rock JA, Rosenwaks Z, editores. Reproductive endocrinology, surgery and technology. Vol 2. Filadelfia: Lippincott-Raven Publishers; l996.p.l303-l323.
23. Gellersen B, Dimattia GE, Friesen HG. Prolactin (PRL) mRNA from human decidua differs from pituitary PP Mena but resembles the IM-9-P3 lynfoblast PRL transcript. Mol Cel Endocrinol. 1 989;64: 127-130. [ Links ]
24. Horseman ND. Prolactin. En: DeGroot U, Jamenson JL, editores. Endocrinology. 4d edición. Filadelfia: WB Saunders Co.; 2001.p.2O9-22O.
25. Boutin J-M, Jolicoeur C, Okamura H, Gagnon J, Edery M, Shirota M, et al. Cloning and expression of the rat prolactin receptor, a member of the growth hormone/ prolactin receptor family. Cell 1998;53:69-73. [ Links ]
26. SperoffL, Glass RH, Kase NG. Clinical Gynecology Endocrinology and Infertility. 6d edición. Baltimore: Lipincott Williams y Wilkins; 1999.
27. Kelly P, Posner B, Tsushima T, Friesen H. Studies of insulin, growth hormone and prolactin binding: Ontogenesis, effects of sex and pregnancy. Endocrinology. 1974;95:532-535. [ Links ]
28. Sherman BM, Stagner JI, Zamudio R. Regulation of lactogenic hormone binding in rat liver by steroid hormones. Endocrinology. 1977; 100:101-104. [ Links ]
29. Riddck DH, Daly D. Decidual prolactin production in human gestation. Semin Perinatol. 1 982;6:229-234. [ Links ]
30. Maslar JA, Riddick DH. Prolactin production by human endometrium during normal menstrual cycle. Am J Obstet Gynecol. 1979;135:751-754.
31. Lee DW, Markoff E. Synthesis and release of glycosylated prolactin by human decidua in vitro. J Clin Endocrinol Metab. 1986;62:990-993. [ Links ]
32. Handwerger 5, Brar A. Placental lactogen, placental growth hormone, and decidual prolactin. Semin Reprod Endocrinol. 1992;10:106-1 10.
33. Daly DC, Kuslis 5, Riddick DH. Evidence of shortloop inhibition of decidual prolactin synthesis by decidual proteins. Parte 1. Am J Obstet Gynecol. 1986; 155:358-362.
34. Huang JR, Tseng L, BischofP, Jaén OA. Regulation of prolactin production by progestin, estrogen and relaxin in human endometrial stromal cells. Endocrinology. 1987;12:201 1-2017. [ Links ]
35. Handwerger 5, Barry 5, Barrett J, MarlcoffE, Zeiter P, Cwikel B, et al. Inhibition ofthe synthesis and secretion of decidual prolactin by arachidonic acid. Endocrinology. 1981;109:2016-2018.
36. Chao HS, Poisner R, Handwerger 5. Endothelin 1 modulates renina and prolactin release from human decidual by different mechanism. Am J Physiol. 1994;267:842-845.
37. Golancler A, Richards R, Thrailkill K, Capel D, Rogers D, Handwerger 5. Decidual prolactin (PRL) releasing factors stimulate the synthesis of PRL from human decidual cells. Endocrinology. 1988; 123:335-340.
38. Thrailkill KM, Golander A, Underwood LE, Handwerger 5. Insulin-like factor 1 stimulate the synthesis andrelease of prolactin from human decidual cells. Endocrinology. 1988; 123:2930-2934.
39. Handwerger 5, Markoff E, Richard R. Regulation of the synthesis and release of decidual prolactin by placental and autocrine/paracrine factors. Placenta. 1991; 12: 121-130.
40. Raabe MA, McCoshen JA. Epithelial regulation of prolactin effect on amniotic permeability. Am J Obstet Gynecol. 1986;130:154-158. [ Links ]
41. Salzman A, Cooke NE. Prolactin. En: Adashi E, Rock JA, Rosenwaks Z, editores. Reproductive endocrinology, surgery and technology. Vol 1. Filadelfia: Lippincott-Raven Publishers; l996.p.747-768.
42. Zinder JM, Dekowsky MD. The role of prolactin in fetal lung maturation. Semin Reprod Endocrinol. 1992;10:287-293. [ Links ]
43. Ben-Jonathan, NeMershon JL, Allen DL. Extrapituitary prolactin: Distribution, regulation, funtions and clinical aspects. Endocrinol Rey. 1997; 17:639-645.
44. Gellersen B, BonhoffA, Hunt N, Bonet HG. Decidualtype prolactin expression by the human miometrium. Endocrinology. 1991;129:158-168. [ Links ]
45. Jenskis DM, Perry LA. Prolactina plasmática en la hipertensión inducida por el embarazo. En: Pitkin RM, Zlatnic FJ, editores. Year Book de Obstetricia y Ginecología. Buenos Aires: Editorial Panamericana; l98O.p .54-55.
46. Krieger DT. Pituitary hormones in dic brain: What is their function? Fed Proc. 1980;39:2937-2945. [ Links ]
47. Braunstein GD, Hassen G, Kamdar V, Nelson JC. Anterior pituitary hormone levels in the cerebrospinal fluid of patiens with pituitary and parasellar tumors. Fertil Steril. 198 1;36:164-172. [ Links ]
48. Horseman ND, Butin JD. Regulation of pigeon crop milk secretions and parental behaviors by prolactin. AnnRevNutr. 1995;15:213-216. [ Links ]
49. Linfoot JA, García JF, Wei W, Fink R, Sarin R, Born JL, et al. Human growthhormone levels in cerebrospinal fluid. J Clin Endocrinol Metab. 1970;31:230-233. [ Links ]
50. Assies J, Schellekens AP, Touber JL. Prolactin in human cerebrospinal fluid. J Clin Endocrinol Metab. 19 78 ;46: 5 76-5 86. [ Links ]
51. Jordan RM, Kendall JW, Seaich JL, Allen IP, Paulsen CA, Kerber CW, et al. Cerebrospinal fluid hormone concentration in the evaluation of pituitary tumors. Ann lntern Med. 1976;85:49-55. [ Links ]
52. Turpin G, Heshmati HM, Roger M, Cesselin F, Lagoguey M, Baulieu, et al. Determination of pituitary hormones in cerebrospinal fluid in normal subjects and in hypothalamo-pituitary diseases: Secreting or nonsecreting pituitary adenoma, empty sella syndrome, hypothalamic syndromes. Ann Endocrinol. (París) 1980;41 :21-30. [ Links ]
53. Post KD, Biller BJ, Jacson IMD. Pituitary hormone concentrations in cerebrospinal fluid in patiens with pituitary tumors. En: Post KD, Jackson IMD, Reichlin 5, editores. The pituitary adenoma. New York: Plenum Medical Book Co.; l98O.p.239-25O.
54. Schroeder LL, Jonhson ID, Malarkey WB. Cerebrospinal fluid prolactin: A reflection of abnormal prolactin secretion in patients with pituitary tumors. J Clin Endocrinol Metab. 1976;43:1255-1258. [ Links ]
55. Wode-Helgodt B, Eneroth P, Fyro B, Gullberg B, Sedvali G. Effect of chlorpromazine treatment on prolactin levels in cerebrospinal fluid and plasm in phychotic patients. Acta Phychiatr Scand. 1 977;5 6:280- 284. [ Links ]
56. Horvacth E, Kovacs K. Misplaced exocytosis. Arch Pathol 1974;97:221-223. [ Links ]
57. Kourides JA, Weintraub BD, Rosen SW, Ridway EC, Kilman B, Maloof F. Secretion of alpha subunit of glycoprotein hormones by pituitary adenomas. J Clin Endocrinol Metab. l976;43:97-lOO.
58. Kacsóh B, Veress Z, Tóth BE. Bioactive and immunorreactive variants of prolactin in milk and serum of lactanting rats and their pups. J Endocrinol. 1993; 138:243-246. [ Links ]
59. Horvatch E, Kovacks K. The adenohypophysis. En: Kovacks K, Asa SL, editores. Functional Endocrine Pathology. Vol 1. Cambridge: Blackwell; l99l.p.245- 281.
60. Ginsburg E, Vonderhaan BK. Prolactin synthesis and secretion by human breast cancer. Cell. 1995 ;55 :2591 - 2594. [ Links ]
61. Faglia G. Prolactinomas and hyperprolactinemic syndrome. En: DeGroot U, Jamenson JL, editores. Endocrinology. 4d edición. Filadelfia: WB Saunders Co.; 2001.p.329-342.
62. Pernicone PJ, Scheithauer BW, Sebo TJ. Pituitary carcinoma. A clinicophatology study of 15 cases. Cancer. l997;79:804-8l2.
63. Rockwell BH, Pica R, Raji MR. Case report- intrathecal metastatic pituitary prolactinoma. AJR 1996; 167:1295 - 1296. [ Links ]
64. Hurel SH, Harris PE, McNicol AM. Metastatic prolactinoma: Effect of octreotide, cabergoline, carboplatin y etoposide: Immunocytochemical analylisis of protooncogen expression. J Clin Endocrinol Metab. l997;82:2962-2968.
65. Henderson BE, Gerkins V, Rosario 1, Casagrande J, Pyke MC. Elevated serum levels of estrogen and prolactin in daughters of patiens with breast cancer. N Engl J Med. l975;293:790-795.
66. Shozo Ohgo, Yuzuro Kato, Kazuo Chihara, Hiroo Imura. Plasma prolactin response to thyrotropin-releasing hormone in patiens with breast cancer. Cancer. l976;37: 1412-1416.
67. Turkington RW. Ectopic production of prolactin. N EnglJ Med. l97l;285:l455-l460.
68. Davis 5, Proper 5, May PB, ErtelNH. Elevated prolactin levels in bronchogenyc cancer. Cancer. l979;44:676- 679.
69. Molitch ME, Schwartz 5, Mukherji B. Is prolactin secreted ectopically? Am J Med. 198 l;70:803-807.
70. Hsu CT, Yu MH, Lee CYG, Jong HL, Yeh MY. Ectopic production of prolactin in uterine cervical cancer. Gynecol Oncol. l992;44:l66-l69.
71. McNatty KP, Hunter WN, McNeylly AS. Changes in the concentration of pituitary and steroid hormones in the follicular fluid of human graafian follicules throughout the menstrual cycle. J Endocrinol. 1975; 64:555-571. [ Links ]
72. McNatty KP. Relationship between plasma prolactin and the endocrine microenvironment of the developing human antral follicle. Fertil Steril. l979;32:433-438.
73. Kauppila A, Leinonen P, Vikho R, Ylostalo P. Metoclorpramida-induced hyperprolactinemia impairs ovarian follicle maturation and corpus luteum function in women. J Clin Endocrinol Metab. 1 982;54:995-999. [ Links ]
74. Martínez JT, Velásquez N, Martínez de Marín O, Mann M. La insuficiencia luteal. Esquema terapéutico. Rey Obstet Ginecol Venez. 1981 ;4l:6l-65.
75. Ehara Y, Siler MT, Yen SSC. Effects of large dosis of estrogens on prolactin and growth hormone release. Am J Obstet Gynecol. l976;l25:455-458.
76. Hebert DC, Tayasida T. Effects of estradiol benzoate (EB) on the number of prolactin cell in the primate pituitary. Fourth International Congress of Endocrinology. Amsterdam: Excerpta Medica; Abstract 391. 1972. [ Links ]
77. Ormandy CJ, Camus A, Barra J. Null mutation of the prolactin receptor gene produce multiple reproductive defects in the mouse. Genes Dey. l997;ll:l67-l7l.
78. Febres-Ballestrini F, Terán-Dávila JH. Azoospermia en el paciente con hiperprolactinemia. Rey Obstet GinecolVenez. l983;43:ll2-ll4.
79. Pellegrini 1, Lebrun JJ, Ah 5, Kehly PA. Expression of prolactin and its recept in human lymphoid cells. Mol Endocrinol. l992;6:l023-lO3l.
80. Walker SE, Allen SH, McMurray RW. Prolactin and autoinmune disease. Trends Endocrinol Metab 1993; 4: 147-152. [ Links ]
81. Buckley AR, Crowe PD, Russel DR. Rapid activation ofprotein kinase C in isolate rat liver nuclei by prolactin, a known hepatic mitogen. Proc Ntl Acad Sci. USA l988;85:8649-8655.
82. Liu Y, Hyde JF, Vore M. Prolactin regulates maternal bile secretory function post partum. J Pharmacol Exp Ther. l992;26l:560-564.
83. Brelje TC, Sorenson RL. Role of prolactin versus growth hormone on islet B-cell proliferation in vitro: Implication for pregnancy. Endocrinology. 1991; 128:45-50. [ Links ]
84. Meites J, Clemens JA. Hypotalamic control ofprolactin secretion. En: Harris RS, Munson PL, Diczfalucy E, Glover J, editores. Vitamins and hormones. Advances in research and applications. New York: Academic Press; l972.p.l6S-22l.