Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Obstetricia y Ginecología de Venezuela
versión impresa ISSN 0048-7732
Rev Obstet Ginecol Venez v.67 n.4 Caracas dic. 2007
Modificaciones fisiológicas del embarazo e implicaciones farmacológicas: maternas, fetales y neonatales
Drs. Paúl Tejada Pérez*, Aaron Cohen**, Ingrid J. Font Arreaza***, Carlos Bermúdez****, Juan B. Schuitemaker Requena*****
* Instructor de la Cátedra de Clínica Anestesiológica, Universidad Central de Venezuela, Hospital Universitario de Caracas.
** Médico Obstetra-Ginecólogo del Hospital Universitario de Caracas.
*** Médico Anestesiólogo, Unidad Oftalmológica Caracas y Centro Médico Loira.
**** Perinatólogo del Hospital Universitario de Caracas.
***** Residente del curso de especialización en Anestesiología, Hospital Universitario de Caracas.
INTRODUCCIÓN
El establecimiento de una terapia médica, anestésica o analgésica durante el embarazo, si bien no es una situación normal, se torna muy común en nuestros días. Las pacientes pueden recibir desde una simple y transitoria medicación hasta tratamientos durante todo el período de la gestación. Estas prescripciones médicas, muestran un alto porcentaje, alcanzando cifras de hasta un 50 % de todas las gestantes (1). Como causas de estas prescripciones encontramos: presencia de patologías maternas previas o incipientes, anormalidades de la gestación, enfermedad fetal y cirugía materna o fetal.
El comportamiento farmacocinético y farmacodinámico de las drogas en la embarazada muestra una condición especial, y están presentes desde las primeras semanas de la gestación hasta 15 días del puerperio. Las modificaciones en aparatos y sistemas, oscilaciones hormonales y enzimáticas que alcanzan a todos los tejidos y líquidos corporales durante el embarazo, son los factores responsables de observar diferentes efectos clínicos. Por otra parte, la creación de una nueva red vascular representada por la placenta y el feto, no sólo denota un compartimiento más por donde circularán las drogas, sino otro paso dinámico y significativo en el metabolismo, excreción y almacenamiento de las mismas, así como su potencial efecto sobre un nuevo ser, el feto, pudiendo alcanzarlo hasta la vida extrauterina, bien por repercusiones directas, niveles residuales o lactancia materna.
Modificaciones fisiológicas e implicaciones en la farmacocinética
Sistema respiratorio
A partir de la octava semana de la gestación aparecen cambios en casi todas las capacidades, volúmenes y ventilaciones pulmonares, los cuales obedecen principalmente a cambios anatómicos, mecánicos y hormonales (2) (Cuadro 1).
a) Anatómicos.
Los diámetros: vertical interno y circunferencial de la caja torácica muestran cambios importantes, en el primero hay una disminución de hasta 4 cm, debido a la elevación del diafragma por el útero grávido, mientras que por otro lado los ejes trans-versal y antero-posterior incrementan la circunferencia torácica en unos 6 cm, aproximadamente. Las costillas desde el primer trimestre se posicionan más horizontales, elevando el ángulo subcostal desde 68º hasta 103º al final de la gestación (3).
b) Mecánicos.
La inspiración en la embarazada es casi totalmente atribuida al movimiento del diafragma, ya que la caja torácica tiene disminuida su movilidad. Otros parámetros como volumen espiratorio forzado al primer minuto (FEV1), la relación del FEV1 con la capacidad vital forzada (FVC), y capacidad de cierre (CC) no muestra cambios.
c) Hormonales.
Una dilatación de la gran vía aérea es normal durante el embarazo, disminuyendo en un 50 % la resistencia pulmonar, esto se debe a un efecto directo de la progesterona y a su incremento en la actividad beta-adrenérgica, también a otras hormonas como la cortisona y relaxina. Otros efectos no menos importantes en la vía aérea son: la ingurgitación capilar en las mucosas: nasal, orofaríngea y laríngea, proporcionando un incremento en la vascularidad, lo cual puede traducirse con mayor absorción de drogas así como riesgo para epistaxis. El edema de las cuerdas vocales falsas y la región aritenoides, a cambios en la voz.
Los volúmenes y capacidades pulmonares muestran modificaciones interesantes, si bien la frecuencia respiratoria se altera muy poco durante el embarazo normal, sin embargo, el volumen corriente (VC), la ventilación minuto (VM), ventilación alveolar (VA) y el consumo de oxígeno, son algunos de los parámetros que aumentan considerablemente a medida que avanza la gestación (4).
La capacidad residual funcional (CRF) y el volumen residual (VR) están disminuidos como consecuencia de la elevación del diafragma.
Gases sanguíneos
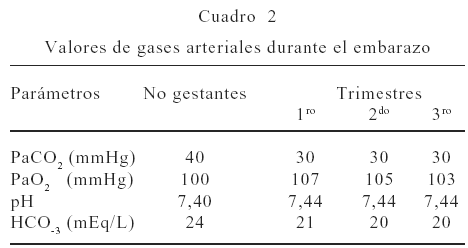
Un descenso en los valores de la PaCO2 hasta alcanzar 30 mmHg, son evidenciados a partir de las 12 semanas de gestación, permaneciendo en esas cifras hasta el final del embarazo, para algunos esto ha sido denominado como disnea fisiológica, (por el esfuerzo respiratorio) producido en gran parte por efecto de la progesterona y en menor proporción por los estrógenos. La PaO2 se incrementa de manera brusca durante el primer trimestre a 107 mmHg, para luego descender progresivamente hasta 103 mmHg en el último trimestre. Un descenso en el bicarbonato sérico que alcanza a 20 mEq/L por incremento en la excreción renal, modifican ligeramente los valores de pH en 0,02 a 0,06, lo cual es interpretado como una compensación metabólica a una alcalosis respiratoria (Cuadro 2).
Dentro de las alteraciones que revisten importancia farmacológica son señaladas: un descenso del 20 % CRF y elevación en la VM en un 45 %, son responsables del corto período de latencia ante la exposición de cualquier agente anestésico o droga por vía respiratoria. La recaptación de los agentes inhalatorios más insolubles estaría favorecida por la disminución de la CRF, mientras que la de los más solubles se ve potenciada por el aumento de la VM. Adicionalmente el incremento del gasto cardíaco que acompaña a la embarazada, induciría una mayor distribución corporal del fármaco, siendo más acentuado el fenómeno de "arrastre" pulmonar durante la etapa de inducción anestésica (5). Los cambios descritos se cumplen para cualquier tipo de droga, siendo importante tener en cuenta estas variaciones cuando se establece una medicación por vía inhalatoria.
En conclusión, las sumas de los cambios del aparato respiratorio durante el embarazo, provocan una elevación en la concentración anestésica alveolar, cuando se expone a un agente durante ventilación espontánea o controlada.
McAuliffe y col. (6) estudiaron parámetros de función pulmonar en 140 embarazos simples normales, 68 embarazos gemelares y 22 no embarazadas. No hubo diferencias significativas al comparar embarazos simples con embarazos gemelares. No obstante demostraron diferencias significativas al comparar embarazadas versus las que no lo estaban, reportando en la paciente embarazada una disminución del 20 % en la CRF y disminución del 30 % en el volumen de reserva espiratorio en el tercer trimestre. La ventilación por minuto aumentó 30 % incluso en el primer trimestre.
d) Oxígeno rutinario durante una cesárea con anestesia neuroaxial.
Muchos anestesiólogos colocan tradicionalmente una máscara o bigote nasal con oxígeno en todas aquellas gestantes sometidas a cesárea segmentaria bajo anestesia epidural o subaracnoidea. Si bien existen cambios en parámetros como capacidad vital forzada (CVF), FVE1, flujo pico espiratorio (PFE), flujo espiratorio forzado (FEF) (25-75), cuando una embarazada está bajo anestesia subaracnoidea, la administración de una fracción inspirada de oxígeno (FIO2) del 35 % por máscara facial, no resultó estadísticamente significativo en cuanto a valores de presión arterial de oxígeno en vena umbilical (PaO2 VU), diferencial entre las presiones parciales de oxígeno de vena umbilical-arteria umbilical (UVUA PO2), o el pH de la vena umbilical, cuando fue comparado con neonatos obtenidos de madres que no recibieron oxígeno con el mismo tipo de anestesia (7).
Una revisión realizada sobre este punto por Khaw y Ngan Kee (8), concluyen que para una cesárea electiva bajo anestesia regional, el oxígeno administrado por máscara o bigote nasal es innecesario. Para una cesárea de emergencia, se requieren mayores datos de investigación para concluir entre efectos benéficos o adversos, por lo que hasta ahora debe continuarse la administración. Si bien el objetivo es mejorar la oxigenación en el feto, esto se logra en corto tiempo cuando se emplean muy altas FIO2. Existe la posibilidad de que el incremento de oxígeno en el tejido fetal aumenta las lesiones por repercusión, al liberar mayor número de radicales libres, sobre todo en fetos pretérminos o que no estén en trabajo de parto, acá también aún se requieren mayor número de trabajos antes de llegar a una conclusión definitiva.
Sistema cardiovascular
El sistema cardiovascular debe ajustarse a las demandas fisiológicas del feto, manteniendo la integridad cardiovascular materna, para ello múltiples factores intervienen en la función hemodinámica global.
En el embarazo normal el corazón y la circulación presentan adaptaciones fisiológicas importantes, sobre todo durante las primeras ocho semanas de la gestación. El gasto cardíaco (GC) se incrementa en cifras de hasta un 50 % del valor de una no gestante, los cambios en las primeras semanas son atribuidos a una elevación de la frecuencia cardíaca, la cual puede alcanzar un 15 % a 25 % por arriba de una no embarazada. Otra variable hemodinámica que influye en el GC, es el volumen latido (VL) el cual se eleva hasta en un 25 % a 30 % al final de la gestación, y por último un descenso en la resistencia vascular sistémica de un 20 % (disminuyendo la poscarga), así como la disminución en la presión coloido-osmótica completan las modificaciones hemodinámicas más resaltantes. Otros parámetros como volumen sistólico final del ventrículo izquierdo (LVESV), presión venosa central (PVC), presión diastólica de la arteria pulmonar (PADP) y presión capilar de la "cuña" pulmonar (PCWP) no muestran cambios, pero sí hay incrementos tanto en la fracción de eyección (EF) como en el volumen diastólico final del ventrículo izquierdo (LVEDV) (9).
El GC también se modifica por la postura materna, en etapas avanzadas del embarazo es mucho mayor en la embarazada en decúbito lateral; en esta posición el útero crecido no limita el retorno venoso.
La elevación progresiva del diafragma rota y desplaza el corazón hacia arriba y a la izquierda, observándose un aumento de la silueta cardíaca en las radiografías; más aún las embarazadas tienen algún grado de derrame pericárdico benigno que pudiera presentarse como cardiomegalia. Cambios electrocardiográficos observados en una embarazada son: desviación del eje cardíaco hacia la izquierda, acortamiento del PR, depresión del segmento ST, así como alteraciones en la onda T. Hay mayor disposición a las arritmias supraventriculares, por incremento de las cuatro cámaras cardíacas así como efecto de la progesterona (10). En la ecocardiografía puede encontrarse una hipertrofia del ventrículo izquierdo hasta de un 50 %, debido a crecimiento excéntrico por sobrecarga de volumen.
En los embarazos múltiples, el GC materno es mayor casi en un 20 % debido a mayor volumen sistólico (15 %) y aumento de la FC (3,5 %). Durante el primer período del trabajo de parto el GC aumenta de forma moderada y durante el segundo período con los esfuerzos de expulsión vigorosos el incremento es mucho mayor. Todos estos cambios han sido corroborados por Clark y col. (11), quienes realizaron monitorización invasiva para valorar la función hemodinámica en diferentes etapas del embarazo.
Otro aspecto de alto interés es el incremento tanto de la volemia como del volumen plasmático, los cuales puedes alcanzar hasta un 45 % y 55 % respectivamente al final de la gestación.
El gran útero gestante no sólo comprime la vena cava inferior dificultando el retorno venoso de la mitad inferior del cuerpo, sino que además comprime la aorta abdominal aminorando la presión arterial por debajo del sitio de compresión, así la presión de las arterias uterinas es mucho menor que la presión de la arteria humeral. La compresión aorto-cava será detallada entre los cambios no hormonales del sistema nervioso central (12).
Algunos de los valores al final de la gestación con implicaciones farmacológicas son mostrados en el Cuadro 3.
El primero de los puntos en importancia sobre estas variaciones fisiológicas, consideraría al aumento del volumen plasmático (aumento de la precarga) y gasto cardíaco, los cuales incrementan el volumen de distribución de las drogas, sobre todo las de tipo hidrosoluble.
Otra situación interesante, es la referente a los niveles de proteínas séricas, aunque se produce un ligero incremento de ellas durante la gestación, el estado de hemodilución que presenta la embarazada cambia las proporciones de la albúmina y alfa –1- glicoproteína ácida (AAG), siendo éstas menores en comparación a la no embarazada.
La albúmina presenta mayor afinidad para el transporte de drogas ácidos débiles (Ej. benzodiazepinas, tiopental sódico) mientras que la AAG es de bases débiles (Ej. anestésicos locales, opioides, etc.). Esta última tiene la característica de presentar alta afinidad y poca capacidad de transporte, a la inversa de la albúmina que presenta baja afinidad y alta capacidad para transportar, estas modificaciones reflejarían cambios en la duración, pasos por barreras biológicas y comportamiento de las fracciones libres.
Pocas situaciones clínicas disminuyen las cantidades de AAG, estos descensos son observados en: feto, neonato y al final del embarazo (13). Además, los altos niveles de progesterona presentes durante la gestación, ocasionan una disminución de los receptores disponibles para el transporte de anestésicos locales (AL) como lidocaína y bupivacaína (14), ocasionando mayor fracción libre, cambios en la farmacodinamia y potencial riesgo de toxicidad (15).
Los niveles de AAG pueden incrementarse por lesión tisular, tales como cirugía, traumatismos, infección, inflamación y procesos neoplásicos. La anestesia epidural no bloquea el aumento de la AAG en respuesta a la cirugía (16).
El efecto del volumen de distribución del embarazo sobre la acción de una droga, puede ejemplificarse con la succinilcolina (SC) un relajante muscular despolarizante (RMD). Hacia el final de la gestación la actividad de la colinesterasa plasmática está disminuida un 24 %, incrementándose hasta un 33 % a los tres días del puerperio, para retornar a la normalidad a las 2 a 4 semanas posparto. Este cambio no prolonga el tiempo de duración de acción de la SC, por lo que las dosis clínicas no varían. Otro factor es la óptima calidad de la enzima circulante, capaz de realizar los procesos de hidrólisis (17).
Sistema renal
Numerosos cambios se observan en el sistema urinario durante el embarazo. El tamaño del riñón aumenta ligeramente, se aprecia un aumento de la longitud de 1 a 1,5 cm, existe además dilatación de pelvis, cálices y uréteres (que simulan hidronefrosis) Durante la gravidez, el flujo sanguíneo renal (FSR) y la tasa de filtración glomerular (TFG) se incrementan en un 50 % - 60 %, la reabsorción de agua y electrólitos también están elevados, consecuentemente el balance hídrico y electrólitos se mantienen normales.
La osmorregulación se altera, disminuyen los umbrales osmóticos para la secreción de hormona arginina vasopresina, aumentan las tasas de desecho hormonal por lo tanto disminuye la osmolaridad sérica (10 mOsm/mL) pudiendo producirse diabetes insípida transitoria durante el embarazo. Se pierden aminoácidos y vitaminas hidrosolubles en la orina de las embarazadas en mucha mayor cantidad. Debido a todos estos cambios, la interpretación de las pruebas de funcionalismo renal también varían, la creatinina y el nitrógeno ureico séricos disminuyen, de esta forma, una creatinina sérica mayor a 0,9 es sospechosa de enfermedad renal subyacente (18), igualmente la depuración de creatinina es 30 % mayor a valores fuera del embarazo y cualquier valor inferior a 137 mL/min debe ser cuidadosamente investigado.
Durante la gestación la glucosuria no es necesariamente anormal, mientras que la proteinuria no es evidente y sus valores oscilan entre 115 y 260 mg/día (19).
Los cambios anteriormente descritos pudiesen tener efectos significativos en la farmacocinética (20) como sería un aumento en el clearance de ciertas drogas, conllevando a concentraciones subterapéuticas en comparación con la no embarazada. Estas observaciones no son compartidas por todos los autores, para algunos la excreción no requiere ajustes en las dosis.
Sistema gastrointestinal
Durante el trabajo de parto, sobre todo después de la administración de agentes analgésicos, el tiempo de vaciamiento gástrico puede prolongarse mucho. El estómago presenta modificaciones debido a factores mecánicos y hormonales. El elemento mecánico está representado por el útero grávido, siendo más intenso este estímulo a medida que cursa la gestación, un efecto de compresión, rotación y desplazamiento hacia arriba de este órgano generan un retraso en el vaciamiento gástrico (21). Este suceso está potenciado por un segundo factor, representado por los elevados niveles de progesterona, que mediante una acción directa disminuye el peristaltismo gástrico e intestinal, e indirectamente influye en la disminución de la motilina (22), la cual facilita la contracción del músculo liso gastrointestinal. No menos importantes, son los grandes volúmenes así como la mayor acidez gástrica al final de la gestación, posiblemente por un factor diferente a la elevación sérica de gastrina (23), sobre este último punto se ha establecido una controversia, en cuanto al cambio real o si solamente obedece a la acentuación del factor mecánico (24). La embarazada presenta presiones intraesofágicas menores y gástricas mayores, como un menor tono tanto del esfínter esofágico inferior como superior.
No obstante, publicaciones en la última década han señalado controversia sobre el retardo del vaciamiento gástrico para agua, "líquidos claros" y hasta bebidas isotónicas o deportivas, pero no para dieta ligera (25). Wong y col. (26) estudiaron el tiempo de vaciamiento gástrico con 300 mL de agua mediante ultrasonido gástrico seriado y niveles plasmáticos de acetaminofén (administrado por vía oral). Los autores concluyen que el vaciamiento gástrico en la embarazada a término, sana, no obesa y que no esté en trabajo de parto no presenta retardo después de la ingestión de 300 mL de agua en comparación al grupo control. En cuanto a las bebidas deportivas (27), han demostrado que la toma de 750 - 1 000 mL durante un trabajo de parto, disminuyen la cetosis materna sin incrementar el volumen gástrico.
La evidencia actual sugiere que los sólidos y semisólidos deben evitarse una vez que la embarazada entre en fase activa de trabajo de parto o requiera analgesia. Un consejo apropiado sería el de introducir de manera cautelosa la ingestión de bebidas isotónicas o deportivas, las cuales han mostrado un medio apropiado para proveer calorías sin incrementar el contenido gástrico, esta nueva política durante el parto, es poco probable que altere la mortalidad materna por broncoaspiración, la cual ha desaparecido virtualmente en los últimos 50 años debido a conductas de ayuno consideradas como extremas (28).
Es importante tomar en consideración todas estas variaciones y discusiones al momento de establecer una terapéutica oral (29), porque pudiese presentarse retardos en la absorción, según la ingesta del tipo de alimentos así como la presentación farmacéutica. La presencia de un pH menor, favorecerá la absorción de ácidos débiles, por el contrario retardará las de bases débiles (30). El retraso del vaciamiento gástrico, se acentúa en situaciones de dolor (trabajo de parto) como de medicación con opioides. Los posibles efectos colaterales gastrointestinales deben vigilarse y ajustar el tipo de presentación farmacéutica.
Hígado y metabolismo de algunas drogas
La morfología, histología y flujo sanguíneo de este órgano no experimenta mayores cambios durante la gestación. Estudios en modelo animal han señalado que el embarazo disminuye el metabolismo de drogas por esta vía, este efecto ha sido relacionado con un descenso en los niveles de citocromo P450 (CYP) microsomal hepático, siendo evidente una reducción en la actividad de CYP1A2 (31). La evidencia atribuye este efecto a un factor hormonal, muy posiblemente la progesterona, la cual juega un papel importante en la regulación del metabolismo hepático en humanos. Un estudio realizado en 12 embarazadas, cuyo objetivo fue investigar los cambios en la actividad de CYP1A2, xantina oxidasa (XO) y N-acetiltransferasa 2 (NAT2), en cuatro momentos durante la gestación y puerperio, de la siguiente manera: al inicio (8-16 semanas), a la mitad (20-28 semanas), al final (32 a 39 semanas) y la cuarta observación posnatal (4 a 6 semanas del puerperio). Los autores concluyen que la actividad de la CYP1A2 está disminuida en las tres etapas del embarazo, siendo esta disminución de significancia clínica para drogas de ajustado margen terapéutico (32).
Algunas pruebas utilizadas para valorar la función hepática son notoriamente diferentes durante el embarazo, así la fosfatasa alcalina sérica casi se duplica durante el embarazo normal mientras que las aminotransferasas, gammaglutamiltranspeptidasa y bilirrubina total tienen concentraciones ligeramente menores. La albúmina sérica está disminuida por mayor volumen de distribución y puede disminuir la relación albúmina-globulina respecto a la no embarazada.
a) Relajantes musculares no despolarizantes.
Para el grupo de relajantes musculares no despolarizantes (RMND), la situación es variada, por una parte hay una mayor sensibilidad al bromuro de vecuronio, reduciéndose hasta un 50 % de la dosis ED50 en conejos (3). En las pacientes sometidas a cesáreas se manifiesta un corto período de latencia con una prolongada recuperación neuromuscular en comparación con un grupo control no gestante (33), esta elevada sensibilidad no se corresponde a cambios en la farmacocinética, por el contrario esta droga presenta tanto una disminución en la vida media como un clearance aumentado. Otros agentes con iguales observaciones en la farmacodinamia durante el embarazo y puerperio son el bromuro de pancuronio (34) y bromuro de rocuronio (35) que prolonga la recuperación hasta en un 25 %. Por el contrario el dobesilato de atracurio no presenta modificaciones en su vida media, clearance y volumen de distribución como en la farmacodinamia durante el embarazo (36).
b) Drogas antiepilépticas.
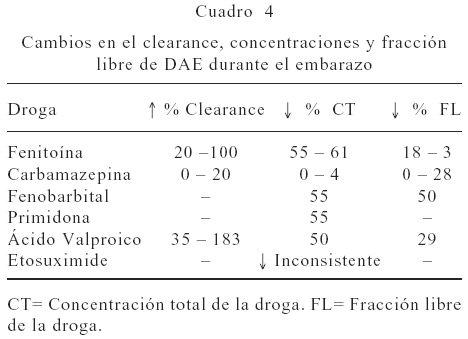
Muchas de las drogas antiepilépticas (DAE) son relativamente ácidos débiles, algunas con alta unión a proteína y metabolismo hepático por citocromo diferente al CYP1A2 (37). Un aspecto de importancia, ya que el manejo ideal de las embarazadas con epilepsia es mantener una dosis efectiva de la droga con mínima exposición fetal. En aquellas drogas con alta unión a proteínas plasmáticas es recomendable realizar el monitoreo de la fracción libre al inicio de cada trimestre, una disminución de la concentración total o descenso de los niveles de la forma libre, incidirían en el ajuste de estos fármacos (Cuadro 4). La etiología de estos cambios señalan las alteraciones del metabolismo como responsables. Para Kochenour y col. (38), la gestación aumentaría el metabolismo hepático (inducción del sistema microsomal CYP) de la fenitoína y otras DAE. Esta afirmación es totalmente opuesta al trabajo citado anteriormente de Tsutsumi y col. (32), donde observan un descenso en la actividad de la CYP1A2. Otros factores que pudiesen explicar este fenómeno estarían: síndromes de mala absorción al ingerirse fenitoína en presencia de antiácidos, o el bajo transporte proteico que ofertaría mayor fracción libre en aquellas DAE con alta unión a proteínas y en consecuencia incremento de la excreción.
Sistema nervioso central (SNC) y sistema nervioso
periférico (SNP)
Los movimientos de las drogas y sus efectos clínicos en este sistema presentan alteraciones basadas en dos factores principalmente: hormonales y no hormonales.
I. Hormonales.
Estudios realizados en animales gestantes, han mostrado una disminución de los requerimientos anestésicos y analgésicos frente a estímulos dolorosos (39). Distintas sustancias endógenas y posibles mecanismos han sido examinados para explicar la formación de una condición analgésica durante la gestación.
La progesterona desde hace varias décadas ha sido señalada como responsable de este fenómeno, tiene efecto sedativo y en grandes dosis induce pérdida de la conciencia en humanos. Uno de sus metabolitos la 5-alfa-progesterona (5AP) administrada por vía intratecal en ratas (40), potenció el efecto analgésico del sufentanilo, la posible vía analgésica sea mediante estímulos de receptores opioides. Glintz y col. observaron que el efecto analgésico de la progesterona desaparecía cuando era administrado un antagonista de opioides (41).
Los niveles plasmáticos que alcanza la progesterona durante el embarazo es 53 veces mayor comparado con la no gestante, mientras que el incremento en líquido cefalorraquídeo (LCR) es 10 a 20 veces superior (42), esta elevación es menos acentuada durante el puerperio inmediato.
Entre otras sustancias asociadas con la modulación del dolor durante la gestación, tenemos:beta-endorfinas, encefalinas y serotonina. Hasta ahora no está claro el mecanismo de las betaendorfinas, su elevación durante el embarazo no guarda relación con los niveles de progesterona, es potenciada por la placenta, el dolor durante el trabajo de parto. La administración subaracnoidea de betaendorfinas mayor a las concentraciones fisiológicas produce analgesia efectiva durante el trabajo de parto (43).
Los datos evidencian la presencia de una cantidad significativa de sustancias para descender el umbral al dolor y ajustar las dosis tanto de analgésicos como anestésicos, este último punto establece la otra gran causa de los cambios en la farmacodinamia durante el embarazo.
a) Agentes de inducción.
La dosis de tiopental sódico (TPS) está disminuida en un 18 % desde las primeras semanas de la gravidez. Este descenso es relacionado con endorfinas (beta-endorfinas) y dinorfinas (44). Por el contrario la prolongación de dos veces la vida media del TPS es atribuida al alto volumen de distribución de la droga aunque su clearance está aumentado. La unión a proteínas plasmáticas no presenta cambios en comparación a la no gestante.
La sensibilidad del propofol durante embarazo no ha sido determinada, a diferencia del TPS el embarazo no afecta la vida media.
b) Inhalatorios.
Con relación a los inhalatorios, diferentes reportes coinciden en la disminución de aproximadamente un 30 % de las concentraciones a administrar, siendo los porcentajes para cada agente los siguientes: isoflurano (28 %) (45), halotano (27 %) y enflurano (30 %) respectivamente (46), igualmente descenso es recomendado para el sevoflurano (47) y desflurano (48).
c) Anestésicos locales.
La actividad anestésica local de la progesterona ha sido evaluada, sin embargo, la aplicación directa a los nervios aislados no afectan la conducción nerviosa (49). Por el contrario, los animales con períodos de exposición a la progesterona han presentado un incremento de la sensibilidad (50), igualmente este efecto se ha conseguido con preparaciones aisladas sumergidas en baños de esta hormona (51). Esto apuntaría a un efecto indirecto que requiere de algún tiempo de exposición, como ocurriría hacia el final de la gestación. Al respecto varias investigaciones clínicas han mostrado una disminución en la latencia del bloqueo de conducción nerviosa en gestantes en comparación con las no embarazadas (52). Los mecanismos hipotéticos por los que la progesterona intervendría sobre el potencial de acción de los nervios, son los siguientes:
a) alteración en la actividad del receptor
b) modulación de los canales del sodio
c) alteración en la permeabilidad de la membrana nerviosa.
Espacio subaracnoideo
Un cambio en la densidad del LCR que repercute en la dispersión (53) y comportamiento de los fármacos es observado durante la gestación (54). Los valores de densidad señalados para el LCR expresados en promedio de desviación estándar son de 1,00030 ± 0,00004 g/mL (1, 00049 ± 0, 00004 g/ mL en la no embarazada) (55), este efecto es atribuido particularmente a elevados niveles de estrógenos y progesterona, los cuales pueden observarse desde el primer trimestre de la gestación (56). El mecanismo no es bien conocido, pero se piensa que la progesterona fisiológicamente alteraría la actividad de la potasio-ATPasa y del sodio en los plexos coroideos, modificando la producción de LCR. Esta variación de densidad en el LCR determina otros límites para términos como hipobaricidad e hiperbaricidad, necesitándose menor cantidad de dextrosa unida a la solución contentiva de anestésicos locales para elevarla de isobara a hiperbara (57), o drogas isobaras que pueden comportarse discretamente como hiperbaras (58,59).
Si bien no se ha conseguido una correlación entre los niveles de progesterona del LCR y dispersión de la anestesia espinal, la elevación de esta hormona genera cambios eléctricos y excitatorios tanto en el sistema nervioso central como periférico, siendo causante del incremento de la sensibilidad a los A.L.
Otro evento interesante observado en las últimas décadas es el relacionado a las dosis efectivas de los A.L. tanto para anestesia como analgesia obstétrica, otro estudio ha señalado una disminución de las mismas (60), y esto posiblemente involucraría otro factor como las variaciones intercontinentales.
II. No hormonales.
a) Espacio epidural.
Tanto la absorción como dispersión de drogas administradas en el espacio epidural han sido estudiadas, reportándose importantes cambios. La compresión aorto-cava, evento presente a partir de la semana 16 de la gestación, genera una especie de pseudo-pinzamiento en la vena cava que incrementa la circulación colateral, representada por los plexos venosos epidurales, creando un aumento de la trama vascular y por consiguiente generando una especie de efecto de masa dentro del espacio peridural. Este incremento en la trama vascular ha sido observado mediante epiduroscopia (61) desde el primer trimestre de la gestación, alcanzando su mayor consecuencia al final de la misma. Estas mismas modificaciones han sido reportadas mediante resonancia magnética nuclear (RMN), mostrando no sólo una ingurgitación de vasos epidurales, sino también un desplazamiento de la duramadre con la consecuente disminución de LCR a nivel lumbar (62).
Otros componentes que contribuyen a modificar el espacio epidural, son el aumento de presión intraabdominal, cuyos niveles más altos son registrados al final de la gestación, embarazo gemelar, polihidramnios o durante las contracciones uterinas de la fase activa del trabajo de parto.
b) Espacio subaracnoideo
El espacio subaracnoideo experimenta similares cambios a los descritos en el epidural y por igual motivo, la compresión aorto-cava. Un trabajo realizado en voluntarios empleando RMN (63), mostró una amplia variabilidad del volumen del LCR, evidenciada una disminución al momento de realizar una compresión abdominal externa. Otra investigación similar a la descrita anteriormente (64), emplearon 12 voluntarios y un equipo de RMN de mayor capacidad (tridimensional), evaluaron los posibles cambios en el volumen de LCR asociado con las siguientes maniobras: reposo, hiperventilación, compresión abdominal e hiperventilación más compresión intra-abdominal. Los hallazgos de este estudio revelaron reducciones del volumen de LCR en el siguiente orden: hiperventilación 10 %, compresión abdominal externa 28 % e hiperventilación más compresión abdominal externa 41 %, visualizando como causa directa la ingurgitación del plexo venoso epidural, estos importantes cambios tendrían implicaciones en la anestesia espinal o subaracnoidea.
Takiguchi y col. (65), emplearon RMN en embarazadas, reportando cambios de manera significativa como son: incremento de los plexos epidurales de manera extensiva, no sólo limitado a nivel de región lumbar, sino que los cambios son descritos desde región torácica inferior hasta sacra, los plexos venosos epidurales anteriores están más ingurgitados que los posteriores y que la compresión del espacio subaracnoideo es mayor a nivel lumbar que en otros niveles. Una menor cantidad de LCR a nivel lumbar, pudiera complementar en conjunto con los cambios hormonales, la respuesta de las menores dosis efectivas (menor cantidad de miligramos empleados) que son señaladas para la población gestante.
El estado ácido-base del LCR durante el embarazo y su efecto en la anestesia subaracnoidea también ha sido estudiado; Hirabayashi y col. (66), evidenciaron cambios estadísticamente significativos en el pH, siendo éste más alcalino en el segundo y tercer trimestre del embarazo, como también un significativo incremento de la presión de CO2 fue apreciado para los mismos trimestres, los investigadores concluyen que estos cambios tienen mínimo efecto en la dispersión de la anestesia intratecal, sin embargo, esta dispersión es clínicamente diferente a la encontrada en la no embarazada.
Glándulas mamarias
La cantidad de droga excretada por leche materna depende de dos grupos de factores, aquellos que regulan la concentración plasmática de droga materna, y los que intervienen en la transferencia de fármaco desde plasma hacia leche.
Sólo la fracción libre o no unida a proteínas de la droga es capaz de difundir a través de las membranas, una vez que el fármaco alcanza la leche, se unirá a proteínas como lactoalbúmina, caseína y parcialmente a lactoferrina (67). La cantidad de proteínas, grasa y valores de pH en leche materna varían ampliamente en comparación con los de plasma, además de evidenciarse modificaciones entre el calostro (secreción de los primeros 5 días) y la llamada leche madura (luego de los 30 días). Las diferencias en cuanto a concentración de proteínas entre las dos leches es de 23 g/L para el calostro y 9 g/L para la de la leche madura, mientras que la cantidad de grasa es 29 g/L y 42 g/L respectivamente. Otra variable es el pH el cual puede ser de 6,6 para el calostro y 7,35 en leche madura.
Por consiguiente, las drogas con características físicoquímicas como: menor unión a proteínas, mayor liposolubilidad, y estado no ionizado, mostrarán mayor facilidad en el paso de sangre hacia los conductos galactóforos.
La cantidad de droga que ingiere el recién nacido es, casi siempre, muy pequeña, la relación existente entre la concentración del fármaco en la leche materna y la del plasma materno se denomina índice de concentración farmacológica entre leche y plasma.
La relación entre la concentración de droga en leche materna y la del plasma, ha sido denominada como relación leche/plasma (L/P, siglas en inglés M/P). El 60 % de los fármacos muestran una relación L/P menor a 1, un 25 % tiene una relación mayor a 1 y alrededor del 15 % mayor a 2 (68). Este número varía de acuerdo a las siguientes causas:
a. Proporciones de los componentes de la leche al inicio o luego del 5to día.
b. Método empleado para la determinación.
c. Número de muestras tomadas para el estudio.
d. Intervalo de recolección posterior a la ingestión del fármaco (estado de equilibrio).
e. Cantidad de droga ingerida por la madre.
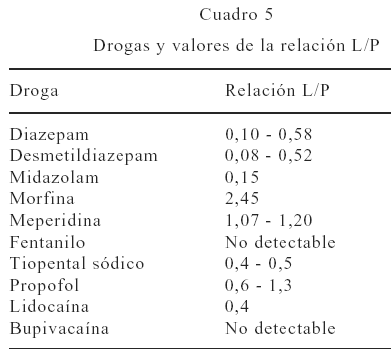
Este conjunto de eventos puede mostrar diferentes rangos en los números de L/P (69). Para predecir el posible efecto clínico en el recién nacido, debe tenerse pendiente la cantidad de leche ingerida por el neonato, siendo éstas de 150 mL/kg para 24 horas o 30 mL/kg por lactada (Cuadro 5).
Muchos agentes anestésicos son excretados por la leche, pero hasta ahora no hay evidencia de que una dosis única conduzca al detrimento del neonato. El riesgo de efectos adversos se incrementa con: administraciones continuas, neonatos pretérmino, con enfermedades concomitantes o de bajo peso al nacer. Ante estos casos debe tenerse precaución de ajustar las dosis de opioide o benzodiazepinas (sin son altas), sometiendo a juicio los posibles riesgos /beneficios que pueda tener. Un procedimiento rutinario en la actualidad es el de proporcionar analgesia posoperatoria, la vía intravenosa es menos frecuente, sin embargo, es la mejor opción cuando existe contraindicación de analgesia neuroaxial. Baka y col. (70), estudiaron la relación L/P de la morfina vía intravenosa para analgesia poscesárea mediante el sistema de bombas controladas por la paciente, determinando los niveles tanto de morfina como de su metabolito activo morfina-6-glucurónido en calostro y plasma, consiguiendo muy bajas cantidades de ambos en calostro y por tanto compatible con la lactancia sin efectos colaterales en los neonatos.
En algunos casos es indispensable mantener una terapéutica durante la gestación, los fármacos cardiovasculares son un ejemplo de esta situación. Un buen número de investigaciones revelan que muchos de ellos atraviesan fácilmente la placenta y se encuentran en leche materna, acompañándose de elevados índices L/P (71). Los potenciales efectos sobre el neonato son independientes de los índices L/P para ciertas drogas, en este sentido el Comité de Drogas de la Academia Americana de Pediatría (AAP), basándose sobre reportes y estudios clínicos, precisa sobre la compatibilidad o incompatibilidad de lactancia asociada a la terapéutica cardiovascular, y de esa manera mantener o descontinuar un tratamiento (Cuadro 6).
Otro grupo de medicamentos como analgésicos, que en ciertas situaciones como casos de cefalea y otras algias, es imprescindible su prescripción, a las dosis correctas son compatibles con la lactancia, como lo son: acetaminofén, cafeína, ibuprofeno, naproxeno, indometacina, codeína y meperidina. Otras drogas como la oxicodona y sumatriptan son señalados como de bajo o mínimo riesgo en lactancia, mientras que la aspirina su administración debe realizarse con precaución (72).
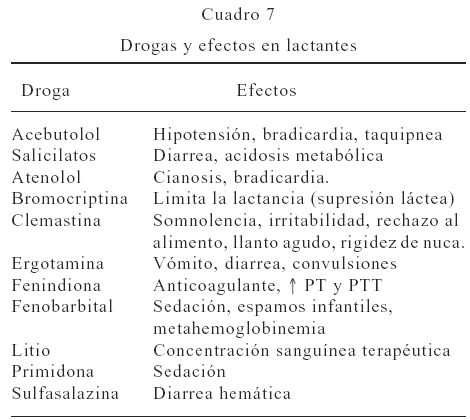
La American Academy of Pediatrics y el American College of Obstetricians and Gynecologists (ACOG) (73) han enumerado ciertos fármacos que han mostrado algunos efectos importantes en lactantes entre ellos, acebutolol, salicilatos, atenolol, bromocriptina, ergotamina, fenobarbital, litio, y otros (Ver Cuadro 7).
Cuando exista inquietud sobre la administración de un medicamento, es importante definir si es necesaria, si existe una alternativa menos peligrosa y en última instancia pedirle a la madre que lo ingiera inmediatamente después de alimentar a su hijo.
En el Cuadro 8 se muestra una síntesis del efecto del embarazo y sus posibles implicaciones farmacológicas.
Transferencia de drogas: placenta y feto
La placenta humana es una compleja estructura transitoria que muestra una serie de funciones, y representa una importante variable a estudiar en la farmacología de la embarazada.
Estructura de la placenta. La placenta con una forma discoide muestra dimensiones aproximadas de 15 a 20 cm de diámetro, 2 cm de espesor y un peso de 500 g, con dos caras una fetal y una materna.
Inicia su morfogénesis a partir del 6to día de gestación (período prelacunario del prevelloso), creciendo de manera acelerada entre el 13er día al 4to mes de gravidez (período de elaboración del velloso) continuando su evolución desde ese tiempo hasta el término del embarazo (período de estado del velloso).
La unidad estructural de la placenta son las vellosidades coriales, las vellosidades son proyecciones muy vasculares de tejido fetal rodeadas por el trofoblasto (hoja nutritiva) o corion, y éste a su vez está constituido de dos capas u hojas de diferente composición que desarrollarán distintas funciones:
1. Sincitiotrofoblasto, capa externa, sin estructura celular, constituido por un citoplasma multinucleado denso y más oscuro, es la verdadera hoja nutritiva.
2. Citotrofoblasto, capa interna, una hoja bien diferenciada de células altas y más claras, con un gran núcleo central, es una hoja de soporte a la anterior.
Las vellosidades coriales pueden dividirse en primarias, secundarias y terciarias. Las primarias solo cuentan con la bicapa corial anteriormente descrita, las secundarias se forman al extenderse el corion y penetrar en su interior un eje conjuntivo desprovisto de vasos, posteriormente presentan sangre extravasada de las arteriolas maternas perforadas por el sincitiotrofoblasto, formando a futuro los senos materno-fetales.
Mientras que las vellosidades terciarias o definitivas, se establecen cuando por diferenciación del citotrofoblasto, generan los vasos que van ocupar el eje conjuntivo de la vellosidad y que se comunicará con los vasos embrionarios, quedando establecida definitivamente la circulación madre feto (74).
Al final de la gestación, la placenta es una organización muy vascular, con una circulación útero-placentaria de aproximadamente 600 mL/min (500-700 mL/min) careciendo este flujo de mecanismos de autorregulación, donde los sistemas materno y fetal se ponen en contacto mediato, ya que ambas circulaciones están en realidad separadas por el epitelio de la vellosidad corial, que se baña en el espacio intervelloso, correspondiendo a una placenta hemocorial en la clasificación de Grossner (75). Es importante resaltar el sistema de baja presión que maneja el flujo sanguíneo del espacio intervelloso (FSEI), en la transferencia placentaria esta zona representa la "frontera" madre-feto, cuyo valor aproximado es de 10 mmHg (fluctuando entre 5 a15 mmHg) cuando la presión arterial materna es de 80 mmHg (76).
Por lo tanto aquellas drogas que lleguen al feto desde la madre, una vez localizadas en el espacio intervelloso deberán atravesar dos capas de trofoblasto, una de tejido conectivo fetal y finalmente la pared del capilar fetal (77).
Las funciones o actividades que cumple la placenta pudiésemos dividirlas en tres categorías:
1. Síntesis y metabolismo.
2. Barrera e intercambio de sustancias.
3. Respiratoria.
1) Síntesis y metabolismo.
La placenta contiene sistemas enzimáticos que producen hormonas entre estas tenemos estrógenos, progesterona, gonadotrofina coriónica, lactógeno placentario, somatotropina coriónica humana. También tiene receptores celulares especializados tipo beta-adrenérgicos, y enzimas como la adenilciclasa, fosfatasa alcalina, pseudocolinesterasa, catecol-o-metil transferasa y monoamino oxidasa, además de otras sustancias como encefalinas y endorfinas. Algunas enzimas pueden identificarse como inducibles, principalmente del grupo 3-metilcolantreno, las cuales por su papel oxidativo pudiesen reducir la exposición fetal a drogas.
Existe cierta actividad metabólica por la parte de la placenta, la cual puede presumirse por la presencia de varios citocromo P450, esta actividad varía entre el primer y tercer trimestre de la gestación, siendo detectables la actividad correspondientes a las clases CYP 1A1, CYP 1A2, CYP 1B1, CYP 2E1, CYP 3A4 durante el primer período, mientras que los tipos CYP 1A1 y CYP 1B1 son detectables al final de la gestación, otras formas detectadas por inmunohistoquímica en los primeros tres meses, pareciese encontrarse en una especie estado "apagado" al final de la gestación (78).
Una variedad de situaciones maternas y ambientales pueden conducir a la alteración de este grupo de enzimas y en consecuencia alterar el metabolismo. En embarazadas con abuso de drogas, las sustancias tóxicas servirían de estímulo y pondrían las enzimas que no debiesen estar funcionando (apagadas en el tercer trimestre) en actividad normal. Otras situaciones como el consumo de tabaco, alcohol, comida contaminada o presencia de aire contaminado alteran la actividad.
2) Barrera e intercambio de sustancias.
Él termino de permeabilidad es usado para denotar el número de moléculas de un soluto dado que cruzan una determinada área de una membrana, en un período de tiempo establecido, conociendo la diferencia de concentración al otro lado de la misma, expresándose en unidades de longitud y tiempo, clásicamente cm/seg.
La placenta es definida como una barrera imperfecta, siendo diversas las variables que proporcionan un grado de permeabilidad. Pudiéndose agrupar en cuatro factores las condiciones que provocan el paso o impermeabilidad de las sustancias, ellos son los maternos, droga (características físico-químicas), placentarios y fetales.
A) Factores maternos.
Uno de los componentes claves de este grupo, es la dosis de droga administrada, ya que a mayor cantidad suministrada hay mayor exposición y acumulación de droga en el feto. La vía de administración, influye de manera significativa en los niveles que alcanzará determinada droga en sangre materna, originando mayor gradiente de concentración y favoreciendo la transferencia placentaria. Es significativo recalcar el aumento de la red vascular en región epidural lumbar, transformándola en un área de elevada absorción de medicamentos, mientras que en la región subaracnoidea la absorción es muy baja o nula. Otra circunstancia básica es el tiempo de exposición al fármaco, para un mismo inhalatorio o intravenoso (infusión continua) a igual dosis, incrementarían los niveles plasmáticos al otro lado de la barrera, por la prolongación del tiempo de mantenimiento del agente empleado.
El pH plasmático, es otra condición que modifica la ionización de la droga, influenciando la farmacocinética y farmacodinamia de la misma. La condición física de la embarazada, puede decirnos cuán rápida pueden realizarse los fenómenos de metabolismo y excreción de medicamentos, declinando los niveles plasmáticos cuando son estos óptimos e indirectamente limitando el paso de sustancias hacia el feto, un caso a considerar es la succinilcolina. Las contracciones uterinas reducen el flujo sanguíneo del útero (FSU), pudiendo teóricamente mermar el paso de medicamentos hacia el feto de manera transitoria, ya que una vez interrumpidas las mismas vuelve a la exposición de fármacos. Por último la hemodinamia, recordando que la fórmula del FSU es directamente proporcional a la presión de la arteria uterina (PAU) menos la presión de la vena uterina (PVU), e inversamente proporcional a la resistencia vascular uterina (RVU), cambios en el numerador como hipovolemia, estasis venoso (ejemplo, la compresión de la cava), hipertonía uterina o en el denominador como hipertensión, vasoconstricción, indican un desequilibrio en el aporte y demanda de la circulación hacia ese territorio, aunado a la carencia de autorregulación limitaría el traspaso de sustancias.
B) Factores placentarios.
Mediante el mecanismo de difusión simple muchos gases respiratorios y drogas cruzan la placenta, la tasa de transferencia puede explicarse en estos casos por la ecuación de Fick, la cual se expresa de la siguiente manera Q/T = K . A. C / D. En donde Q/T representa la cantidad de sustancia transferida por unidad de tiempo; K es la constante de difusión de la droga determinada por sus características físico-químicas, A es el área disponible para el intercambio; C es el gradiente de concentración entre la madre y el feto (Cm, concentración madre, Cf la concentración fetal) y D el grosor de la membrana.
En animales y modelos de perfusión de cotiledón humano, la transferencia placentaria puede ser expresada como clearance placentario, con la ecuación Clx= UF .([Fv] – [Fa])/M. En donde Clx es el clearance placentario, UF es el flujo del cordón umbilical, Fv representa las concentraciones de una determinada droga en vena umbilical, Fa sería la concentración para la misma droga en arteria umbilical y M correspondería a los niveles en sangre arterial materna, este método para calcular la transferencia de fármacos es muy complicado, y actualmente es poco apropiada en estudios in vivo en humanos (79).
El área de la placenta humana a término es de 11 m2 en comparación con el área pulmonar que es de 70 m2. Esta superficie para intercambios puede encontrarse disminuida en el caso del desprendimiento prematuro de placenta (DPP), patologías con producción de zonas de microinfartos como la preeclampsia, diabetes, en infecciones intrauterinas y condiciones hidrópicas. La distancia promedio para que una sustancia difunda en la placenta es de aproximadamente 3,5 m mucho mayor que la alveolo-capilar pulmonar, de 0,5 m, y puede estar aumentada retardando el paso de sustancias en condiciones clínicas como las descritas anteriormente (80).
Las formas de transporte de sustancias a través de la placenta se señalan a continuación:
a. Difusión simple, la transferencia es guiada solamente por el gradiente de concentración y diferencias de potenciales, no requiere de gasto de energía; la mayoría de los agentes farmacológicos utilizados en terapéutica, atraviesan la placenta por esta vía.
b. Transporte facilitado, llamado también difusión facilitada, difiere de la simple ya que esta demuestra saturación cinética, inhibición competitiva y no competitiva, estéreoespecificidad y variación con la temperatura (mayor temperatura mayor transferencia) (31); lactato, glucosa y otros carbohidratos son ejemplos de transporte facilitado.
c. Transporte activo, este procedimiento es realizado en contra de un gradiente de concentración, eléctrico o de presión, además de requerir de energía.
d. Pinocitosis, algunas moléculas grandes como las inmunoglobulinas son trasladadas de esta manera.
Otro aspecto de relevancia es el metabolismo placentario, el cual puede en algún momento limitar la exposición de drogas en el feto. Un caso interesente, es el del oxígeno, en donde la PO2 arterial fetal nunca sobrepasará los 50 a 60 mmHg aunque la madre reciba una fracción inspirada de (FiO2) de 1.0. Esto puede obedecer a diversas razones, en primer lugar, por un lado la placenta presenta una alta tasa de consumo de oxígeno, cayendo la cantidad transferida a la circulación umbilical, una segunda condición, es el número de derivaciones en la circulación fetal y uterina, otra condición es la alta concentración de hemoglobina fetal y su mayor afinidad por el oxígeno que presenta la hemoglobina materna.
C) Factor droga.
Las características físico-químicas de un fármaco en particular es otro factor del grupo de condiciones que permitirán la entrada o impermeabilidad de las sustancias a la placenta. Dentro de estas tenemos al peso molecular, liposolubilidad, unión a proteínas, grado de ionización (pKa), y configuración espacial (81).
El peso molecular juega un importante papel en la transferencia de drogas, se considera que aquellos solutos con un peso superior a 1 000 daltons (Da) no cruzan la placenta, entre 500 a 1 000 atraviesan lentamente y por debajo de 500 su paso es fácil para drogas liposolubles, mientras que para las hidrosolubles el límite es de aproximadamente 100 Da (82), igualmente se cumple para la configuración espacial de la molécula. Los anticoagulantes representan un ejemplo aplicable a la relación peso molécula y paso de drogas por placenta (83) como se observa en el Cuadro 9.
La liposolubilidad es directamente proporcional al ingreso de sustancias, mientras que la unión a proteínas es otra circunstancia limitante, siendo inversamente proporcional al porcentaje de unión, a mayor afinidad menor posibilidad de transferencia. El grado de ionización explicaría por qué ciertas drogas con un peso molecular menor a 400 daltons (succinilcolina, 361 Da) no accedan al feto, esto corresponde a que estando polarizadas son rechazadas por la placenta mientras a que sólo las no ionizadas la atraviesan.
D) Factores fetales.
La circulación fetal presenta unas condiciones especiales para las drogas provenientes de la madre, en donde la vena umbilical que transporta toda sustancia que atraviesa la placenta, pasa primero por el hígado, una pequeña proporción entra a la vena cava inferior por medio del ductus venoso, donde se mezclan la sangre de la vena umbilical con sangre venosa proveniente de los miembros inferiores y vísceras. La vena cava inferior entra a la aurícula derecha junto con la vena cava superior, mediante el foramen oval se comunica la aurícula derecha con la aurícula izquierda, una pequeña proporción de sangre pasa al ventrículo derecho, viajando luego hacia el tronco pulmonar, pero debido a la elevada resistencia vascular pulmonar como a la presencia del ductus arterioso de Botalli, este flujo pasa hacia la aorta descendente. La sangre de la aurícula izquierda cae hacia el ventrículo ipsilateral, saliendo por la aorta para luego distribuirse hacia cabeza y otros tejidos fetales. Las arterias umbilicales, originadas de la aorta abdominal, retornan la sangre a la placenta.
La fisiología fetal y sus variaciones, indican la farmacocinética y farmacodinamia de los agentes anestésicos y drogas en general.
La primera de las variables, es la disminución del pH plasmático fetal, en donde drogas bases débiles como los anestésicos locales, cambian su polaridad haciéndose ionizados y quedando atrapada la molécula en la circulación fetal (84,85), esto es nocido con el nombre de "atrapamiento iónico", cabe destacar que en el caso de los anestésicos locales en medio ácido desciende la unión a proteínas permitiendo mayor cantidad de fracción libre (86), los efectos clínicos del atrapamiento iónico no están bien claros hasta ahora. No solamente con los anestésicos locales se observa este fenómeno, otro grupo de drogas como los opioides presentan idéntico comportamiento (87).
Otro aspecto significativo en la acidosis fetal, es un incremento en la migración de las drogas con pH básico hacia la zona acidótica.
Los fetos presentan un alto volumen de agua corporal total, 94 % del peso en el feto de 10 semanas de gestación y 75 % del recién nacido a término, con una distribución del mismo en mayor porcentaje para el líquido extracelular, un 53 %, y para el líquido intracelular, 47 %, relación muy diferente a la observada en el adulto (88). Estos cambios sumados a una baja masa muscular, un gran hígado, alto flujo sanguíneo cerebral, menor cantidad de proteínas y poco contenido de mielina, constituyen una combinación para potenciar los efectos de medicamentos exógenos sobre el sistema nervioso.
Las drogas son eliminadas del feto por tres ecanismos:
- Metabolismo
- Excreción urinaria
- Difusión hacia la madre (retrógrada)
Los sistemas enzimáticos en el feto maduro están presentes, sobre todo los enzimáticos microsomales hepáticos, pero son en su mayoría menos eficaces que el de los adultos, por lo tanto esta vía es muy limitada y los posibles efectos de las drogas impredecibles. La segunda forma de eliminación, es la renal, siendo excretados al líquido amniótico las fracciones puras o sus metabolitos, de ahí son ingeridas entrando nuevamente a circulación sistémica una vez absorbidas del tracto gastrointestinal, este último mecanismo sería el responsable de la exposición crónica a medicamentos o sustancias que conllevarían a las dosis tóxicas o letal en el feto.
Relación materno/fetal
Diversas publicaciones han cuantificado el grado de transferencia para cada droga anestésica que pasa de la madre al feto y su captación por los tejidos fetales.
Esto es realizado por mediciones de la concentración en diferentes puntos de la circulación, como son una vena (periférica) materna (MV), vena umbilical (UV), arteria umbilical (UA), más recientemente se emplean las muestras obtenidas de una arteria materna (MA).
Relacionando estas muestras entre sí, puede suponerse el movimiento del fármaco madre-feto-madre, estos cocientes son la UV/MV, conocido como el índice de transferencia fetal del fármaco, donde índices altos significan mayor transferencia que índices bajos, usualmente aparece en los textos como relación F/M. La relación UV/MA tiene el mismo concepto de transferencia fetal que la UV/ MV, pero para algunos autores el muestreo hecho en arteria difiere notablemente del de la vena, ya que pueden observarse más tempranamente los niveles picos de las drogas estudiadas, haciendo más exacta la fracción con el empleo de este denominador (89).
Otra fracción empleada es el UA/UV, éste es el índice de captación tisular fetal del fármaco, valores menores a 1 señalan una captación tisular activa, resultados iguales a 1 reportan un equilibrio maternofetal, mientras los superiores a 1, predicen una captación tisular finalizada y eliminación retrógrada hacia el compartimiento materno (90).
Algunas objeciones sobre estos cocientes indican que tienen numerosas limitaciones y no siempre son correlacionados con la clínica, como sería el ejemplo del alfentanilo, el cual tiene una fracción UV/MV de 0,29, alta unión proteica, menor potencia que el fentanilo y corta vida media, sobresaliendo como un opioide ideal para obstetricia, pero su baja captación placentaria (91) con alta captación tisular fetal y una elevada fracción libre plasmática del mismo, lo coloca en un rango de menor seguridad (92).
Un esquema sobre los factores que contribuyen para el paso transplacentario de drogas, es mostrado en el Cuadro 10.
Modelos usados para el estudio de los mecanismos de transferencia en placenta humana
A continuación se resumen las diferentes técnicas empleadas para el conocimiento de la transferencia de sustancias en placenta humana (ver Cuadro 11).
Agentes anestésicos y relación materno/fetal
Se describen algunas de las drogas anestésicas más comúnmente empleadas para anestesia o analgesia en la paciente embarazada (ver Cuadro 12).
A. Inhalatorios
Los anestésicos inhalatorios cruzan muy bien la placenta por difusión simple, son sustancias liposolubles, con bajo peso molecular y no ionizados, son variables en algunos estudios los cocientes F/M, dependiendo de las concentraciones administradas, tiempo de exposición y presencia de óxido nitroso en la mezcla. Para el sevoflurano y desflurano, no tenemos estudios de farmacocinética en humanos, sólo reportes de casos en gestantes donde se ha empleado estos agentes.
B. Intravenosos
Todos los agentes empleados para inducción anestésica, exhiben transferencia placentaria y en algunos ésta es muy rápida. El tiopental sódico (TPS) con bajo peso molecular, alta liposolubilidad, alcanza el equilibrio entre vena materna y vena umbilical a los 3 minutos aproximadamente. La ketamina, a dosis de 2 mg/kg peso a 1 minuto y 30 segundos muestra una alta relación F/M (93). El propofol ha venido empleándose en anestesia obstétrica, presenta una rápida captación tisular fetal (UA/UV 1.07) y equilibrio (94), existen publicaciones que la sitúan como droga de segunda elección ya que su papel en ciertas condiciones obstétricas (sufrimiento fetal agudo) no está aclarado del todo.
El etomidato, menos empleado como agente de inducción para obstetricia, quizás su efecto de mioclonía y dolor asociado a la inyección lo coloquen en desventajas a otros, tiene buena transferencia placentaria además de una completa captación tisular fetal (95), puede inducir a una disminución del cor-tisol plasmático en neonatos, haciéndose más evidente este efecto a las 2 horas de vida posnatal y posiblemente su empleo deba acompañarse de evaluación glicémica en los recién nacidos (96).
C. Opioides
Todos los opioides rebasan la barrera placentaria en mayor o menor grado dependiendo de sus características físico-químicas, es importante recalcar en el caso de la meperidina, la presencia de su metabolito activo, la normeperidina, el cual tiene actividad farmacológica induciendo un efecto depresor neonatal. Esta depresión neonatal es menor cuando la administración ocurre en un lapso menor a 1 hora o mayor a 4 horas del nacimiento, siendo el período crítico entre este intervalo de tiempo, es detectada a los 90 segundos de su colocación en vena umbilical. El fentanilo, muestra un paso rápido pero los efectos respiratorios neonatales son escasos cuando se utiliza de 50 mg a 100 mg asociados a la mezcla anestésica en espacio epidural o cuando es empleado en infusión continua en el mismo espacio a razón de 2 mg/mL para analgesia obstétrica, con una dosis máxima total para un trabajo de parto de 300-400 mg. Alfentanilo, ya ha sido comentado su paradoja como excelente agente para obstetricia desde el punto de vista teórico, sin embargo, no ha cubierto las expectativas en la práctica clínica (97). Sufentanilo posee mayor grado de difusión que el fentanilo, pero con una alta captación materna, lo que disminuiría la exposición al feto (98), su uso en anestesia obstétrica es bien aceptada por vía neuroaxial. Remifentanilo cuando es administrado por vía intravenosa una vez que supera la placenta es rápidamente metabolizado y redistribuido en el feto, observado por una UA/UV de 0,29 (99), actualmente su empleo para vía intravenosa en obstetricia es limitado, aunque tiende a desplazar a las otras drogas de su grupo, e incluso se propone como el opioide de elección para anestesia obstétrica (100), pero para espacio espinal, la presencia de un excipiente, la glicerina lo rechaza de su aplicación en técnicas neuroaxiales. Por último la morfina, en la actualidad es aplicada en espacio subaracnoideo para analgesia obstétrica, otras rutas parenterales están casi prohibidas, por su alta depresión respiratoria materna y neonatal. Pueden observarse efectos sobre la frecuencia cardíaca fetal (bradicardia) con el uso de fentanilo en espacio espinal, esto se cree se debe principalmente a un efecto indirecto sobre la contractilidad uterina, produciendo una hipertonía transitoria.
Los agentes agonistas-antagonistas, también cruzan fácilmente la placenta, su aplicación para la analgesia durante el trabajo de parto pudiese ser una opción cuando los procedimientos de neuroaxiales están contraindicados o la parturienta no manifiesta una analgesia adecuada, para el butarfonol la F/M es de 0,84, mientras que para nalbufina es de 0,97.
D. Relajantes musculares.
La succinilcolina no penetra la barrera placentaria a menos que se empleen dosis superiores a 300 mg en el paciente, mientras otros autores afirman que este efecto de impenetrabilidad desaparece cuando las dosis alcanzan los 500 mg.
Para los relajantes musculares no despolarizantes (RMND), su gran configuración molecular, pertenecientes o derivadas del amonio cuaternario además de ser altamente polarizadas las convierten en drogas que no cruzan o cruzan muy poco la placenta. Las cifras de sus cocientes F/M son mínimas.
Los agentes anticolinesterásicos, como neostigmina, piridostigmina y edrofonio empleados para la reversión de la acción de los RMND como tratamiento en la miastenia gravis, son componentes de amonio cuaternario altamente ionizados por lo que difícilmente atravesarían la barrera.
E. Anestésicos locales (AL)
Este grupo de drogas presenta características a favor de la transferencia placentaria como, liposolubilidad, bajo peso molecular que oscila entre 234 Da y 288 Da y no ionización, mientras que otras presentan además elevada unión a proteínas (bupivacaína, ropivacaína y levobupivacaína 96 %) (101), que es un factor en contra. Tienen captación tisular fetal, incrementándose en presencia de acidosis, en donde los efectos cardiovasculares y del sistema nervioso central sobre el mismo pueden acentuarse, al igual que la tasa de transferencia madre-feto, en ausencia de acidosis, no se observan cambios deletéreos o colaterales en el neonato. En el caso de la 2-cloroprocaína es metabolizada en el feto en 43 segundos.
F. Benzodiazepinas
Cruzan muy bien la placenta con buena unión a proteínas. El diacepam es más lipofílico, tiene metabolitos con actividad farmacológica y como efectos clínicos observables en los neonatos, pudiesen presentarse hiporreflexia, hipotonicidad e hipotermia, y con dosis superiores a 30 mg de diacepam se han reportado casos de hiperbilurrubinemia. Este último signo, es relacionado con un componente empleado como buffer en el diacepam, el benzoato de sodio, el cual pudiese competir con la bilirrubina por su sitio de unión, incrementando los niveles de bilirrubina, otros reportes han encontrado estas manifestación con dosis mucho menores a 30 mg (102). Las relaciones F/M para diacepam y midazolam son de 1,0 y 0,76 respectivamente.
G. Drogas antiepilépticas (DAE)
Algunas pacientes no pueden interrumpir su tratamiento durante el embarazo, bien sea monoterapia o politerapia. Como fue señalado en la parte de metabolismo, las concentraciones plasmáticas de estas drogas disminuyen durante el embarazo, siendo imperativo realizar determinaciones de los niveles plasmáticos con la finalidad de tener un punto de referencia en caso de que se deba ajustar la dosis. La mayoría de las DAE presentan un peso molecular por debajo de 300 Da, excepto la tiagabina que se encuentra alrededor de 400 Da, otra propiedad físico-química es el pKa, cuyos valores están alrededor del fisiológico, cifras que indican un buen paso placentario. Este movimiento de droga, pudiese desarrollar desde anomalías en el labio y paladar fetal ("síndrome anticonvulsivante fetal") hasta alteraciones en la coagulación del neonato, como el llamado síndrome hemorrágico del recién nacido. El primer evento es atribuido a la inhibición en los transportadores de carnitina (103), y el segundo fenómeno descrito sería inducido por la deficiencia de los factores de la coagulación que dependen de la vitamina K, ya que las DAE inhiben el transporte de esta vitamina hacia la placenta, siendo en mayor proporción la fenitoína y fenobarbital.
H. Drogas antivirales
El empleo de drogas antirretrovirales en la embarazada portadora de virus de inmunodeficiencia humana (HIV), es una terapia empleada con el objetivo de disminuir la transmisión del virus hacia el feto. Este grupo de drogas también presenta cambios en su farmacocinética debido a las modificaciones fisiológicas del embarazo. Su administración está sujeta a dos consideraciones bien importantes, por una parte que el medicamento pueda sobrepasar la barrera placentaria (104), llegando al feto para generar su efecto protector, y por otra, los posibles efectos colaterales que pueda desencadenar en el binomio madre-feto (105). Muchos de estos agentes presentan relaciones F/M que señalan un rápido y fácil paso hacia el feto.
I. Drogas cardiovasculares
Este amplio grupo de drogas, abarca a varios tipos de agentes que incluyen desde los antihipertensivos, antiarrítmicos, vasodilatadores periféricos, vasoconstrictores, alfa y beta adrenérgicos entre otros, empleándose en esquemas terapéuticos para patología cardíaca, trastornos hipertensivos del embarazo, o bien ante un cuadro de hipotensión inducida por un bloqueo simpático.
Muchas de estas drogas atraviesan muy bien la placenta (106), sus características físico-químicas y gradientes de concentración en el tiempo (administración continua) permiten alcanzar la circulación fetal, en algunos casos representa la ventaja de manejar patologías fetales, tales como en las arritmias o insuficiencia cardíaca, pero en otros constituirá un efecto colateral del tratamiento materno.
J. Anticoagulantes
La terapia con anticoagulantes es rutinaria ante cuadros como trombosis venosa profunda o presencia de prótesis valvular. Un estado de hipercoagulabilidad es derivado de las modificaciones inducidas por el embarazo sobre los factores de la coagulación, la tromboprofilaxia rutinaria, mantienen una controversia entre los diferentes grupos de evaluación en cuanto a su verdadero beneficio. La heparina no fraccionada presenta un peso molecular de aproximadamente 6 000 Da, lo que la hace impermeable a la barrera placentaria, por otro parte tanto la heparina de bajo peso molecular como la fondaparina no presentan paso transplacentario en modelos in vitro de perfusión de placenta humana. La warfarina atraviesa la placenta, si bien no se ha obtenido su relación F/M, las modificaciones de la coagulación y efectos teratogénicos en el feto confirman este paso, y contraindican su uso durante el primer trimestre.
K. Drogas antitiroideas
La presencia de un hipertiroidismo moderado o severo durante el embarazo es una indicación de drogas antitiroideas. Dos agentes son comúnmente indicados, el propiltiuracilo y metimazol. El propiltiuracilo presenta una relación feto-materna que oscila de 0,27 a 0,35, considerándolo de baja transferencia placentaria, mientras que el metimazol muestra valores F/M de 072 a 1, siendo de alto paso hacia el feto (1). En la práctica muchos prefieren propiltiuracilo sobre el metimazol, por su limitada transferencia placentaria, sin embargo, los niveles séricos del primero en cordón umbilical son más altos que los maternos, indicando una muy baja tasa de clearance fetal (108).
J. Otras drogas
Otras drogas como la escopolamina y metoclopramida presentan una relación F/M de 1 y 0,6 respectivamente.
Finalmente, el Cuadro 13 muestra diferentes drogas y sus índices F/M.
Efectos fetales
Si bien es importante señalar la mayor o menor transferencia de drogas hacia el feto, es interesante resaltar los potenciales efectos teratogénicos de éstas. En este sentido la FDA (Food and Drug Administration) ha establecido una clasificación de riesgo para teratogenicidad, basada en los resultados procedentes de estudios en animales como reportes en humanos, las cuales indican la presencia o ausencia de riesgos de teratogenicidad durante el embarazo, esta clasificación presenta 5 categorías (1), las cuales se denominan como A, B, C, D, X.
CONCLUSIÓN
Múltiples factores modifican tanto la farmacocinética como farmacodinámica de las drogas en la embarazada, conllevando a diferentes requerimientos anestésicos y analgésicos en comparación con la no embarazada, estos mismos comportamientos son extrapolables a los otros grupos de drogas terapéuticas y de abuso. La formación de un nuevo compartimento, el feto, no sólo involucra el movimiento de moléculas hacia una zona de características especiales tanto por su flujo sanguíneo como la condición de barrera imperfecta (placenta), es también la vía terapéutica ante una determinada patología fetal o la ruta para ocasionar potenciales efectos tóxicos o letales sobre éste.
REFERENCIAS
1. Andrade SE, Gurwitz JH, Davis RL, Chan KA, Finkelstein JA, Fortman K, et al. Prescription drug use in pregnancy. Am J Obstet Gynecol. 2004;191:398-407. [ Links ]
2. Cheek TG, Gutsche BB. Maternal physiologic alterations during pregnancy. En: Hughes SC, Levinson G, Rosen MA, editores. Anesthesia for obstetrics. 4ª edición. Filadelfia: LW & W; 2002.p.3-18. [ Links ]
3. Chang AB. Physiologic changes of pregnancy. En: Chesnut DH, editor. Obstetric Anesthesia Principles and Practice. 3ª edición. Filadelfia: Elsevier Mosby; 2004.p.3-14. [ Links ]
4. Cunningham GF, Leveno KJ, Bloom, SL, Haut. JC, Gilstrap III LC, Wenstrom KD. Obstetricia de Williams. México: McGraw Hill Ed; 2005. [ Links ]
5. Gorman SR, Rosen MA. Anesthetic implications of maternal physiological changes during pregnancy. Seminars in Anesthesia, Periop Med and Pain. 2000;19:1-9. [ Links ]
6. McAuliffe F, Kametas NA, Costello J, Rafferty G, Greenough A, Nicolaides K, et al. Respiratory function in singleton and twin pregnancy. Br J Obstet Gynaecol. 2002;109:765. [ Links ]
7. Kelly MC, Fitzpatrick KT, Hill DA. Respiratory effects of spinal anaesthesia for caesarean section. Anaesthesia. 1996;51:1120-1122. [ Links ]
8. Khaw KS, Ngan Kee WD. Fetal effects of maternal supplementary oxygen during caesarean section. Curr Opin Anaesthesiol. 2004;17:309-313. [ Links ]
9. Conklin KA. Maternal physiological adaptations during gestation, labor and puerperium. Semin Anesth. 1991;10:221-234. [ Links ]
10. Fujitani S, Baldisseri MR. Hemodynamic assessment in a pregnant and peripartum patient. Crit Care Med. 2005;33(Suppl):354-361. [ Links ]
11. Clark SL, Cotton DB, Lee W, Bishop C, Hill T, Southwick J, et al. Central hemodynamic assessment of normal term pregnancy. Am J Obstet Gynecol. 1989;161:1439-1442. [ Links ]
12. Conklin KA, Backus AM. Physiologic changes of pregnancy. En: Chesnut DH, editor. Obstetric Anesthesia: Principles and practice. 2ª edición. St. Louis: Mosby Year-Book; 1999.p.17-42. [ Links ]
13. Wood N, Wood AJ. Changes in plasma drug binding and a1- acid glycoprotein in mother and newborn infant. Clin Pharmacol Ther. 1981;29:522-526. [ Links ]
14. Fragneto RY, Bader AM, Rosinia F, Arthur R, Datta S. Measurements of protein binding of lidocaine throughout pregnancy. Anesth Analg. 1994;79:295-297. [ Links ]
15. Tsen LC, Tarshis J, Denson DD, Osathanondh R, Datta S, Bader AM. Measurements of maternal protein binding of bupivacaine throughout pregnancy. Anesth Analg. 1999;89:965-968. [ Links ]
16. Wulf H, Winckler K, Denzer D. Plasma concentrations of alpha-1- acid glycoprotein following operations and its effect of the plasma protein binding of bupivacaine. Prog Clin Biol Res. 1989;300:457-460. [ Links ]
17. Leighton BL, Cheek TG, Gross JB, Apfelbaum JL, Shantz BB, Gutsche BB, et al. Succinylcholine pharmacodynamics in peripartum patients. Anesthesiology. 1986;64:202-205. [ Links ]
18. Arias F. Enfermedades renales durante la gestación, en Guía Práctica para el Embarazo y parto de alto riesgo. 2ª edición. Ed. Madrid. Mosby; 1994. [ Links ]
19. Higby K, Suiter CR, Phelps JY, Siler-Khodr T, Langer O. Normal values of urinary albumin and total protein excretion during pregnancy. Am J Obstet Gynecol. 1994;171:984-989. [ Links ]
20. Koffel BL. Physiologic adaptation to pregnancy. The healthy parturient. En: Norris MC, editor. Obstetric Anesthesia. 2ª edición. Filadelfia: Lippincott Williams & Wilkins; 1999.p.3-28. [ Links ]
21. Jayaram A, Bowen MP, Desphande S, Carp HM. Ultrasound examination of the stomach contents of women in the postpartum period. Anesth Analg. 1997;84:522-526. [ Links ]
22. Christofides ND, Ghatei MA, Bloom SR, Borberg C, Gillmer MD. Decrease plasma motilin concentrations in pregnancy. Br Med J (Clin Res Ed). 1982;285:1453-1454. [ Links ]
23. Hong JY, Park JW, Oh JI. Comparison of preoperative gastric contents and serum gastrin concentrations in pregnant and nonpregnant women. J Clin Anesth. 2005;17:451-455. [ Links ]
24. Carp H, Jayaran, Stoll M. Ultrasound examination of the stomach contents of parturients. Anesth Analg. 1992;74:683-687. [ Links ]
25. O´Sullivan GO. Gastric emptying during pregnancy and the puerperium. Int J Obst Anesth. 1993;2:216-224. [ Links ]
26. Wong CA, Loffredi M, Ganchiff JN, Zhao J, Wang Z, Avram MJ. Gastric emptying of water in term pregnancy. Anesthesiology. 2002;96:1395-1400. [ Links ]
27. Kubli M, Scrutton MJ, Seed PT, MSc OSullivan G. An evaluation of isotonic "sport drinks" during labor. Anesth Analg. 2002;94:404-408. [ Links ]
28. OSullivan G, Scrutton M. NPO during labor is there any scientific validation?. Anesthesiology Clin N Am. 2003;21:87-98. [ Links ]
29. Wald A, Van Thiel DH, Hoechstetter L, Gavaler JS, Egler KM, Verm R, et al. Effect of pregnancy on gastrointestinal transit. Dig Dis Sci. 1982;27:1015-1018. [ Links ]
30. Benet LZ, Kroetz DL, Sheiner LB. Pharmacokinetics. En: Hardman JG, Limbird LE, editores. The pharmacological basis of therapeutics. 9ª edición. Nueva York: McGraw-Hill; 1996.p.1-27. [ Links ]
31. Borlakogku JT, Scott A, Henderson CJ, Wolf CR. Alternations in rat hepatic metabolism during pregnancy and lactation. Biochem Pharmacol. 1993;46:29-36. [ Links ]
32. Tsutsumi K, Kotegawa T, Matsuki S, Tanaka Y, Ishii Y, Kodama Y, et al. The effect of pregnancy on cytochrome P4501A2, xantine oxidasa, and Nacetyltransferase activities in humans. Clin Pharmacol Ther. 2001;70:121-125. [ Links ]
33. Baraka A, Jabbour S, Tabboush Z, Sibai A, Bijjani A, Karam K. Onset of vecuronium neuromuscular block is more rapid in patients undergoing caesarean section. Can J Anaesth. 1992;39:135-138. [ Links ]
34. Duvaldestin P, Demetriou M, Henzel D, Desmonts JM. The placental transfer of pancuronium and its pharmacokinetics during cesarean section. Anesthesiology. 1984;60:569-574. [ Links ]
35. Pühringer FK, Sparr HJ, Mitterschiffthaler G, Agoston S, Benzer A. Extended duration of action of rocuronium in postpartum patients. Anesth Analg. 1997;84:352-354. [ Links ]
36. Backus AM. Muscle relaxants during pregnancy and the puerperium. Semin Anesth. 1995;14:301-307. [ Links ]
37. Pennell PB. Antiepileptic drug pharmacokinetics during pregnancy and lactation. Neurology. 2003;61(Suppl):35-42. [ Links ]
38. Kochenour N, Emergy M, Sawchuck R. Phenytoin metabolism in pregnancy. Obstet Gynecol. 1980;56:577-582. [ Links ]
39. Gintzler AR. Endorphin-mediated increases in pain threshold during pregnancy. Science. 1980;210:193-195. [ Links ]
40. Jayaram A, Carp H. Progesterone-mediated potentiation of spinal sufentanil in rats. Anesth Analg. 1993;76:745-750. [ Links ]
41. Gintzler ER. Endorphin-mediated increases in pain threshold during pregnancy. Science. 1980;210:193-195. [ Links ]
42. Datta S, Harley RJ, Naulty S, Stern P, Lambert DH, Concepcion M, et al. Plasma and cerebrospinal fluid progesterone concentrations in pregnant and non pregnant women. Anest Analg. 1986;65:950-954. [ Links ]
43. Abboud TK, Noueihid R, Khoo S, Hoffman DI, Varakian L, Henriksen E, et al. Effect of induction of general and regional anesthesia for caesarean section and maternal plasma beta-endorphin levels. Am J Obstet Gynecol. 1983;146:927-930. [ Links ]
44. Gin T, Mainland P, Chan MTV, Short TG. Decreased thiopental requirements in early pregnancy. Anesthesiology. 1997;86:73-78. [ Links ]
45. Gin T, Chan MT. Decreased minimum alveolar concentration of isoflurane in pregnant humans. Anesthesiology. 1994;81:829-832. [ Links ]
46. Chan MT, Mainland P, Gin T. Minimum alveolar concentration of halothane and enflurane are decreased in early pregnancy. Anesthesiology. 1996;85:782-786. [ Links ]
47. Gambling DR, Sharma SK, White PF, Van Beveren T, Bala AS, Gouldson R. Use of sevoflurane during elective cesarean birth: A comparison with isoflurane and spinal anesthesia. Anesth Analg. 1995;81:90-95. [ Links ]
48. Thomas BA, Anzalone TA, Rosinia FA. Progesterone decreases the MAC of desflurane in the nonpregnant ewe. Anesthesiology. 1995;83:A952. [ Links ]
49. Bader Am, Datta S, Moller B, Covino BG. Acute progesterone treatment has no effect on bupivacaineinduced conduction blockade in the isolated rabbit vagus nerve. Anesthesiology. 1990;72:962-965. [ Links ]
50. Datta S, Lambert DH, Gregus J, Gissen AJ, Covino BG. Differential sensitivities of mammalian nerve fibers during pregnancy. Anesth Analg. 1983;62:1070-1072. [ Links ]
51. Flanagan HL, Datta S, Lambert DH, Gissen AJ, Covino B. Effect of pregnancy on bupivacaine-induced conduction blockade in the isolated rabbit vagus nerve. Anesth Analg. 1987;66:123-126. [ Links ]
52. Butterworth JF, Walker FO, Lyzak SZ. Pregnancy increases median nerve susceptibility to lidocaine. Anesthesiology. 1990;72:962-965. [ Links ]
53. Choi DH, Ahn HJ, Kim MH. Bupivacaine-sparing effect of fentanyl in spinal anesthesia for cesarean delivery. Reg Anesth Pain Med. 2000;25:240-245. [ Links ]
54. Lui AC, Polis TZ, Cicutti NJ. Densities of cerebrospinal fluid and spinal anaesthetic solutions in surgical patients at body temperature. Can J Anaesth. 1998;45:297-303. [ Links ]
55. Richardson MG, Wissler RN. Density of lumbar cerebrospinal fluid in pregnant and nonpregnant humans. Anesthesiology. 1996;85:326-330. [ Links ]
56. Hirabayashi Y, Shimizu R, Sayito K, Fukuda H. Cerebrospinal fluid progesterona in pregnant women. Br J Anaesth. 1995;75:683-687. [ Links ]
57. McLeod GA. Density of spinal anaesthetic solutions of bupivacaine, levobupivacaine, and ropivacaine with and without dextrose. Br J Anaesth. 2004;92:547-551. [ Links ]
58. Connolly C, McLeod GA, Wildsmith JAW. Spinal anaesthesia for caesarean section with bupivacaine 5 mg mL –1 in glucose 8 or 80 mg mL –1. Br J Anaesth. 2001;86:805-807. [ Links ]
59. Vercauteren MP, Coppejans HC, Hoffman VL, Saldien V, Andriansen HA. Small-dose hyperbaric versus plain bupivacaine during spinal anesthesia for cesarean section. Anesth Analg. 1998;86:989-993. [ Links ]
60. Ben-David B, Miller G, Gabriel R, Gurevitch A. Lowdose bupivacaine-fentanyl spinal anesthesia for cesarean delivery. Reg Anesth Pain Med. 2000;25:235-239. [ Links ]
61. Igarashi T, Hirabayashi Y, Shimizu R, Saitoh K, Fukuda H, Suzuki H. The fiberscopic findings of the epidural space in pregnant women. Anesthesiology. 2000;92:1631-1636. [ Links ]
62. Hirabayashi Y, Shimizu R, Fukuda H, Sayito K, Igarashi T. Soft tissue anatomy within the vertebral canal in pregnant women. Br J Anaesth. 1996;77:153-156. [ Links ]
63. Hogan QH, Prost R, Kulier A, Taylor ML, Liu S, Mark L. Magnetic resonance imaging of cerebrospinal fluid volume and the influence of body habitus and abdominal pressure. Anesthesiology. 1996;84:1341-1349. [ Links ]
64. Lee RR, Abraham RA, Quinn CB. Dynamic physiologic changes in lumbar CSF volume quantitatively measured by three-dimensional fast spin-echo MRI. Spine. 2001;26:1172-1178. [ Links ]
65. Takiguchi T, Yamaguchi S, Tezuka M, Furukawa N, Kitajima T. Compression of the subarachnoid space by the engorged epidural venous plexus in pregnant women. Anesthesiology. 2006;105:848-851. [ Links ]
66. Hirabayashi Y, Shimizu R, Saitoh K, Fukuda H, Igarashi T. Acid-base state of cerebrospinal fluid during pregnancy and its effect on spread of spinal anaesthesia. Br J Anaesth. 1996;77:352-355. [ Links ]
67. Wilson JT. Determinants and consequences of drug excretion in breast milk. Drug Metab Rev. 1983;14:619-653. [ Links ]
68. Ito S. Drug therapy for breast-feeding women. N Engl J Med. 2000;343:118-126. [ Links ]
69. Spiget O. Anaesthetic agents and excretion in breast milk. Acta Anaesthesiol Scand. 1994;38:94-103. [ Links ]
70. Baka NE, Bayoumeu F, Boutroy MJ, Laxenaire MC. Colostrum morphine concentrations during postcesarean intravenous patient-controlled analgesia. Anesth Analg. 2002;94:184-187. [ Links ]
71. Qasqas SA, McPherson C, Frishman WH, Elkayam U. Cardiovascular pharmacotherapeutic considerations during pregnancy and lactation. Cardiol Rev. 2004;12:201-221. [ Links ]
72. Martin SR, Foley MR. Approach to the pregnant patient with headache. Clin Obstet Gynecol. 2005;48:2-11. [ Links ]
73. American Academy of Pediatrics, American College of Obstetricians and Gynecologists: Guidelines for Perinatal Care. 5ª edición. Washington DC; 2002.p.154-229. [ Links ]
74. Uranga FA, Uranga (h) FA. Desarrollo del huevo después de la implantación. En: Uranga FA, Uranga (h) FA, editores. Obstetricia Práctica. 5ª edición. Buenos Aires: Editorial Intermédica; 1985.p.25-59. [ Links ]
75. Herman NL. The placenta: Anatomy, physiology, and transfer of drugs. En: Chesnut DH, editor. Obstetric Anesthesia: Principles and practice. 2ª edición. St. Louis: Mosby; 1999.p.57-74. [ Links ]
76. Rurak DW. Anatomy and physiology of the placenta. En: Bonica JJ, McDonald JS, editores. Principles and practice of obstetric analgesia and anesthesia. 2ª edición. Filadelfia: Williams & Wilkins; 1995.p.297-323. [ Links ]
77. Douglas MJ. Perinatal physiology and pharmacology. En: Norris MC, editor. Obstetric Anesthesia. 2ª edición. Filadelfia: Lippincott Williams & Wilkins; 1999.p.113-134. [ Links ]
78. Syme MR, Pastón JW, Keelan JA. Drug transfer and metabolism by the human placenta. Clin Pharmacokinet. 2004;43:487-514. [ Links ]
79. Stienstra R, Burm AGL. Perinatal pharmacology of local anesthetics and opioids. En: Birnbach DJ, Gatt SP, Datta S, editores. Textbook of Obstetric Anesthesia. Churchill Livingstone; 2000.p.96-109. [ Links ]
80. Parer JT. Uteroplacental circulation and respiratory gas exchange. En: Shnider SM, Levinson G, editores. Anesthesia for Obstetrics. 3ª edición. Baltimore: Williams & Wilkims; 1993.p.19-28. [ Links ]
81. Woods AM, Difazio CA. Pharmacology of local anesthetics and related drugs. En: Bonica JJ, McDonald JS, editores. Principles and practice of obstetric analgesia and anesthesia. 2ª edición. Filadelfia: Williams & Wilkins; 1995.p.297-323. [ Links ]
82. Thronburg KL, Burry KJ, Adams AK, Kirk EP, Faber JJ. Permeability of placenta to inulin. Am J Obstet Gynecol. 1988;158:1165-1169. [ Links ]
83. Sharma Sk, Leveno KJ. The anticoagulated patient. En: Datta S, editor. Anesthetic and obstetric management of high-risk pregnancy. 3ª edición. Nueva York: Springer-Verlag; 2004.p.369-380. [ Links ]
84. Morishima HO, Santos AC, Pedersen H, Finster M, Tsuji A, Hiraoka H, et al. Effect of lidocaine on the asphyxial responses in the mature fetal lamb. Anesthesiology. 1987;66:502-507. [ Links ]
85. Morishima HO, Pedersen H, Santos AC, Schapiro HM, Finster M, Arthur GR, et al. Adverse effects of maternally administered lidocaine on the asphyxiated preterm fetal lamb. Anesthesiology. 1989;71:110-115. [ Links ]
86. McNamara PJ, Slaughter RL, Pieper JA, Wyman MG, Lalka D. Factors influencing serum protein binding of lidocaine in humans. Anesth Analg. 1981;60:395-400. [ Links ]
87. Johnson RF, Herman N, Arney TL, Johnson HV, Paschall RL, Downing JW. The transfer of Sufentanil: Effects of fetal pH, protein binding, sufentanil concentration. Anesth Analg. 1997;84:1262-1268. [ Links ]
88. Liu LM. Control y restitución de líquidos. En: Coté CJ, Ryan JF, Todres D, Goudsouzian NG, editores. Anestesia en Pediatría. 2ª edición. México DF: Nueva Editorial Interamericana S.A; 1994.p.179-192. [ Links ]
89. Downing JW, Johnson HV, Gonzalez HF, Arney TL, Herman NL, Johnson RF. The pharmacokinetics of epidural lidocaine and bupivacaine during cesarean section. Anesth Analg. 1997;84:527-532. [ Links ]
90. Miranda A. Opiáceos espinales en obstetricia. Aspectos teóricos y criterios prácticos de utilización. Rev Esp Anestesiol Reanim. 1995;42:369-377. [ Links ]
91. Zakowski MI, Ham AA, Grant GJ. Transfer and uptake of alfentanil in the human placenta during in vitro perfusion. Anesth Analg. 1994;79:1089-1093. [ Links ]
92. Gepts E, Heytens L, Camu F. Pharmacokinetics and placental transfer of intravenous and epidural alfentanyl in parturient woman. Anesth Analg. 1986;65:1155-1160. [ Links ]
93. Ellingson A, Haram K, Sagen N, Solheim E. Transplacental passage of ketamine after intravenous administration. Acta Anesthesiol Scand. 1977;21:41-44. [ Links ]
94. Gin T, Gregory MA, Chan K, Oh TE. Maternal and fetal levels of Propofol at caesarean section. Anaesth Intensive Care. 1990:180-184. [ Links ]
95. Gregory MA, Davidson DG. Plasma etomidate levels in mother and fetus. Anesthesia. 1991;46:716-718. [ Links ]
96. Crozier TA, Flamm C, Speer CP, Rath W, Wuttke W, Jun W, et al. Effects of etomidate on the adrenocortical and metabolic adaptation of the neonate. Br J Anaesth. 1993;70:47-53. [ Links ]
97. Gin T, Ngan-Kee WD, Siu YK, Stuart JC, Tan PE, Lam KK. Alfentanil given immediately before the induction of anesthesia for elective cesarean delivery. Anesth Analg. 2000;90:1167-1172. [ Links ]
98. Loftus JR, Hill H, Cohen SE. Placental transfer and neonatal effects of epidural sufentanil and fentanyl administered with bupivacaine during labor. Anesthesiology. 1995;83:300-308. [ Links ]
99. Kan RE, Hughes SC, Rosen MA, Kessin C, Preston PG, Lobo EP. Intravenous Remifentanil placental transfer, maternal and neonatal effects. Anesthesiology. 1998;88:1467-1474. [ Links ]
100. Evron S, Glezerman M, Sadan O, Boaz M, Ezri T. Remifentanil: A novel systemic analgesic for labor pain. Anesth Analg. 2005;100:233-238. [ Links ]
101. Bader AM, Tsen LC, Camann WR, Nephew E, Datta S. Clinical effects and maternal and fetal plasma concentrations of 0,5 % epidural levobupivacaine versus bupivacaine for cesarean delivery. Anesthesiology. 1999;90:1596-1601. [ Links ]
102. Nathesnson G, Cohen MI, McNamara H. The effect o Na benzoate on serum bilirrubin of the gun rat. J Pediatr. 1975;803:799-803. [ Links ]
103. Wu SP, Shyu MK, Liou HH, Gau CS, Lin CJ. Interaction between anticonvulsants and human placental carnitine transporter. Epilepsia. 2004;45:204-210. [ Links ]
104. Mirochnick M, Capparelli E. Pharmacokinetics of antiretrovirals in pregnant women. Clin Pharmacokinet. 2004;43:1071-1087. [ Links ]
105. Delke I. Special considerations for the HIV-infected patient with preterm labor. Clin Perinatol. 2003;30:855-874. [ Links ]
106. Bustard MA, Ryan G, Seaward G, Saleniak ME, Smith GN. Human maternal and fetal plasma glyceryl trinitrate concentrations. Am J Obstet Gynecol. 2003;189:1777-1778. [ Links ]
107. Mandel SJ, Cooper DS. The use of antihyroid drugs in pregnancy and lactation. J Clin Endocrinol Metab. 2001;86:2354-2359. [ Links ]
108. Koren G, Soldin O. Therapeutic drug monitoring of antithyroid drugs in pregnancy. Ther Drug Monit. 2006;28:12-13. [ Links ]