Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Obstetricia y Ginecología de Venezuela
versión impresa ISSN 0048-7732
Rev Obstet Ginecol Venez v.68 n.3 Caracas sep. 2008
Efecto del citrato de sildenafil sobre el flujo sanguíneo de las arterias uterina, umbilical y cerebral media fetal en preeclámpticas
Drs. Eduardo Reyna-Villasmil, Duly Torres-Cepeda, Elvia Peña-Paredes, Mg. Sc. Jorly Mejía-Montilla, Nadia Reyna-Villasmil. Lic. Peggy González-Rodríguez
Servicio de Obstetricia y Ginecología - Maternidad "Dr. Nerio Belloso".
Hospital Central "Dr. Urquinaona". Maracaibo, Estado Zulia.
Correspondencia a:
Hospital Central "Dr. Urquinaona". Final Av. El Milagro. Maracaibo, Estado Zulia. Venezuela.
Teléfono: 0416-2605233.
E-mail: sippenbauch@gmail.com
RESUMEN
Objetivo: Establecer el efecto del citrato de sildenafil sobre el flujo sanguíneo de las arterias uterina, umbilical y cerebral media fetal en preeclámpticas.
Métodos: Se seleccionaron un total de 30 preeclámpticas (grupo A) y 30 embarazadas normotensas (grupo B). Las 60 pacientes eran nulíparas y tenían más de 25 semanas de embarazo. Se analizaron el flujo sanguíneo de las arterias uterinas, umbilical y cerebral media fetal. Se midieron el índice de pulsatilidad, de resistencia y relación del flujo sanguíneo sistólico / diastólico de cada arteria. El tratamiento fue de 50 mg de citrato de sildenafil por vía oral dos veces al día (100 mg/día) por dos días al grupo de las preeclámpticas (grupo A).
Ambiente: Maternidad "Dr. Nerio Belloso". Hospital Central "Dr. Urquinaona". Maracaibo, Estado Zulia.
Resultados: No se encontraron diferencias estadísticamente significativas con relación a la edad materna y gestacional (p = NS). Los resultados de las mediciones Doppler iniciales demostraron diferencias estadísticamente significativas al compararlas con los controles normotensas (P < 0,01). Después del uso del sildenafil en el grupo A, se encontró una reducción estadísticamente significativa en las mediciones del índice de pulsatilidad, de resistencia y relación del flujo sanguíneo sistólico / diastólico de la arteria uterina al compararlo con los valores promedio iniciales (P < 0,01).
Conclusión: El citrato de sildenafil produce una mejoría significativa sobre el flujo sanguíneo de las arterias uterinas sin afectar el flujo sanguíneo de las arterias umbilical y cerebral media fetal.
Palabras clave: Sildenafil. Preeclampsia. Ecografía Doppler.
SUMMARY
Objective: To establish the effect of sildenafil citrate over blood flow of uterine, umbilical and fetal middle cerebral artery in preeclamptic patients.
Methods: A total of 30 preeclamptic patients (group A) and 30 normotensive pregnant patients (Group B) were blood flow of uterine, umbilical and fetal middle cerebral artery were analyzed. Pulsatility index, resistance index and systolic / diastolic ratio of each artery were analyzed. Treatment was 50 mg of sildenafil citrate twice a day (100 mg/day) per two days in preeclamptic group (Group A).
Setting: Maternidad "Dr. Nerio Belloso". Hospital Central "Dr. Urquinaona". Maracaibo, Estado Zulia.
Results: There were not significant statically differences related to maternal and gestational age (p = NS). Initial Doppler measurements showed statically significant differences when compared to normotensive control patients (P < 0.01). After the use of sildenafil in the group A, there was found a significant reduction in pulsatility index, resistance index and systolic / diastolic ratio in uterine artery when compared to mean initial values (P < 0.01).
Conclusion: Sildenafil citrate produces a significant improvement over blood flow of uterine arteries without affecting blood flow of umbilical and fetal middle cerebral artery.
Key words: Sildenafil. Preeclampsia. Doppler ultrasound.
INTRODUCCIÓN
La preeclampsia es una enfermedad multisistémica, observada únicamente en los embarazos humanos, que afecta del 3 % al 5 % de las primigestas y es una de las principales causas de morbilidad perinatal y materna. El proceso patogénico de la enfermedad es en dos pasos, en los que se describen modificaciones de las arterias espirales que lleva a una disminución de la perfusión posteriormente en el embarazo, lo que lleva a liberación de factores por parte de la placenta que activan el endotelio vascular materno (1-4). Existe evidencia de la alteración del endotelio en la preeclampsia (3-7).
En el embarazo normal, el flujo sanguíneo uterino se incrementa de aproximadamente 50 mL/min a las 10 semanas a más de 1 200 mL/min al llegar al término (8). La preeclampsia disminuye la perfusión placentaria por incremento de la resistencia vascular, lo que causa alteraciones en la hemodinámica fetal. Estas alteraciones pueden ser analizadas utilizando la ecografía Doppler (9-12). Los signos de incremento de la resistencia vascular en la arteria uterina son alteraciones en el índice de pulsatilidad, índice de resistencia y de la relación del flujo sanguíneo sistólico/diastólico en el tercer trimestre (10,12). La resistencia al flujo sanguíneo en la arteria uterina es observada frecuentemente en las preeclámpticas (9,13). La evaluación ecográfica de la arteria umbilical suministra información directa sobre el flujo sanguíneo fetal. Existe un incremento en la pulsatilidad, resistencia y relación de flujo sistólico/diastólico debido a la disminución en el flujo de sangre en la arteria uterina (14,15). La arteria cerebral media fetal se comporta diferente a las otras arterias en el caso de condiciones hipóxicas crónicas. En las preeclámpticas, existe un espasmo vascular en la arteria umbilical, y por tanto, vasodilatación de la cerebral media fetal. Las condiciones que llevan a la hipoxia disminuirían el espasmo del flujo sanguíneo arterial y esta disminución afectaría la pulsatilidad, la resistencia y la relación de flujo sistólico/diastólico (11,16).
Los niveles circulantes de marcadores celulares endoteliales (como la fibronectina, el antígeno del factor VIII, el factor de Von Willebrand, el activador del plasminógeno tisular y el inhibidor 1 del activador del plasminógeno) están elevados en las preeclámpticas (17,18). Las respuestas dependientes del endotelio en una variedad de vasos sanguíneos en las preeclámpticas son evidentemente diferentes comparadas con embarazadas normotensas (19-21). Se ha demostrado disminución de la respuesta dependiente del endotelio a la bradikinina en las arterias miometriales de preeclámpticas (20,21).
El papel de óxido nítrico en la preeclampsia es incierto. Los estudios clínicos de óxido nítrico en la preeclampsia son contradictorios (22-26). La exposición de células endoteliales cultivadas al plasma de las preeclámpticas incrementa la producción de óxido nítrico y la expresión de la sintetasa de óxido nítrico (27,28). Sin embargo, los estudios clínicos que aplicaron trinitrato de glicerilo transdérmico (un donador de óxido nítrico) al final del segundo trimestre del embarazo no fueron efectivos para disminuir la incidencia de preeclampsia, parto pretérmino y restricción del crecimiento intrauterino (29). Evidencias anteriores demuestran que un incremento de la concentración "total" de óxido nítrico puede ser perjudicial en la preeclampsia, pues el incremento del óxido nítrico, en presencia de estrés oxidativo, puede llevar a la formación de peroxinitritos (26,30-32). En
tales circunstancias las intervenciones diseñadas para aumentar la biosíntesis de óxido nítrico pueden ser perjudiciales.Las células del endotelio vascular por mecanismos mediados por receptores, o en ausencia de estos, aumentan el calcio intracelular produciendo óxido nítrico. Éste estimula la producción de guanosin monofostato cíclico (GMPc), promoviendo la relajación por diferentes mecanismos. La duración de la acción del GMPc es controlada por el metabolismo utilizando una enzima citosólica, la
fosfodiesterasa (33,34). La forma predominante de la fosfodiesterasa presente en el músculo liso vascular es la fosfodiesterasa específica de la GMPc (33,34). Recientemente se han desarrollado y utilizado inhibidores selectivos en el tratamiento de la disfunción eréctil (34,35).El objetivo de la investigación fue establecer el efecto del citrato de sildenafil sobre el flujo sanguíneo de las arterias uterina, umbilical y cerebral media fetal en preeclámpticas.
MÉTODOS
Se realizó un estudio longitudinal con un muestreo no probabilístico en el cual se seleccionaron 30 preeclámpticas (grupo A) y 30 embarazadas normotensas (grupo B). Las 60 pacientes eran nulíparas y tenían más de 25 semanas de embarazo. Se excluyeron las pacientes con hipertensión crónica, diabetes mellitus pre-gestacional o gestacional y enfermedades sistémicas crónicas. Las pacientes que necesitaron interrupción inmediata del embarazo o algún medicamento adicional para el tratamiento de la preeclampsia también fueron excluidas del estudio. En tal sentido para el estudio, la preeclampsia se definió como presión arterial mayor de 140/90 mmHg en dos o más ocasiones con 4 horas de diferencia entre las mediciones después de la vigésima semana de gestación, con proteinuria de más de dos cruces, en dos ocasiones diferentes con 6 horas de diferencia.
La presión sanguínea se midió en posición sentada después de 15 minutos de descanso.Todas las preeclámpticas (grupo A) fueron hospitalizadas y se realizó la ecografía antes del uso del fármaco. La ecografía Doppler fue realizada en forma ambulatoria sólo una vez en las pacientes del grupo B (normotensas). Se analizaron el flujo sanguíneo de las arterias uterinas, umbilical y cerebral media fetal. Se midieron el índice de pulsatilidad, índice de resistencia y relación del flujo sanguíneo sistólico/diastólico de cada una de las arterias. El tratamiento en el grupo A fue de 50 mg de sildenafil por vía oral dos veces al día (100 mg/día) al grupo de las preeclámpticas. Después de 24 y 48 horas del
inicio del tratamiento, se repitieron las mediciones ecográficas utilizando los mismos parámetros. El índice de pulsatilidad, resistencia y relación del flujo sanguíneo sistólico/diastólico de la arteria uterina, umbilical y cerebral media fetal se tomaron como parámetros de medición de la ecografía Doppler.En todas las pacientes se recogieron los datos sobre la edad materna, edad gestacional, presión arterial sistólica y diastólica al momento del inicio del estudio. Las mediciones ecográficas se realizaron con un ecógrafo Doppler color de 3,5 Mhz marca
General Electric.Se compararon los parámetros de medición Doppler en los controles y en las preeclámpticas antes del tratamiento, para lo cual se utilizó la prueba t de Student para muestras no relacionadas. También se compararon las preeclámpticas (grupo A) antes y después de 24 y 48 horas de tratamiento con sildenafil, en las cuales se usó la prueba ANOVA para mediciones repetidas con pos-test de Dunnett utilizando como mediciones controles aquellas obtenidas antes de la administración del fármaco. Se consideró P < 0,05 como estadísticamente significativo.
RESULTADOS
Cuando se comparó al grupo de estudio con los controles, no se encontraron diferencias estadísticamente significativas con relación a la edad materna y la edad gestacional (P = NS). Se encontraron diferencias estadísticamente significativas con respecto a las cifras de presión arterial sistólica y diastólica (P < 0,01; Cuadro 1).
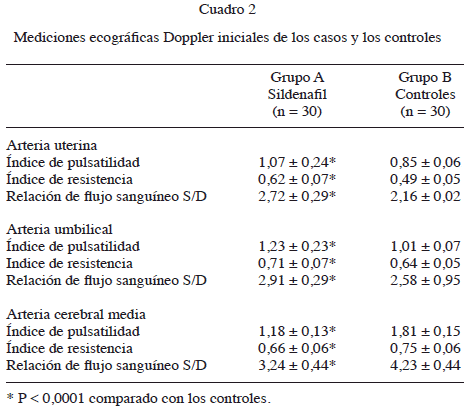
Las mediciones Doppler se aplicaron tres veces (antes del uso de sildenafil y a las 24 y 48 horas después de su uso) en el grupo de pacientes preeclámpticas y una vez en los controles (Cuadro 2). Los resultados de las mediciones Doppler iniciales en ambos grupos demostraron que las 3 mediciones realizadas en la arteria uterina y umbilical eran significativamente más altas en las pacientes del grupo de estudio comparado con los controles (P < 0,01), mientras que las 3 mediciones en la arteria cerebral media fetal de las preeclámpticas fueron significativamente menores al compararlas con los controles normotensas (P < 0,01).
En el Cuadro 3 se muestra la evaluación con ecografía Doppler luego de la administración del sildenafil en las preeclámpticas (grupo A). No se registraron diferencias estadísticamente significativas a las 24 y 48 horas después del tratamiento en índice de
pulsatilidad, índice de resistencia y relación sistólico / diastólico de la arteria umbilical y cerebral media fetal (P = NS). Sin embargo, se encontró una reducción estadísticamente significativa en las mediciones del índice de pulsatilidad (Figura 1), índice de resistencia Cuadro 2 Mediciones ecográficas Doppler iniciales de los casos y los controles Grupo A Grupo B Sildenafil Controles (n = 30) (n = 30) Arteria uterina Índice de pulsatilidad 1,07 ± 0,24* 0,85 ± 0,06 Índice de resistencia 0,62 ± 0,07* 0,49 ± 0,05 Relación de flujo sanguíneo S/D 2,72 ± 0,29* 2,16 ± 0,02 Arteria umbilical Índice de pulsatilidad 1,23 ± 0,23* 1,01 ± 0,07 Indice de resistencia 0,71 ± 0,07* 0,64 ± 0,05 Relación de flujo sanguíneo S/D 2,91 ± 0,29* 2,58 ± 0,95 Arteria cerebral media Índice de pulsatilidad 1,18 ± 0,13* 1,81 ± 0,15 Índice de resistencia 0,66 ± 0,06* 0,75 ± 0,06 Relación de flujo sanguíneo S/D 3,24 ± 0,44* 4,23 ± 0,44 * P < 0,0001 comparado con los controles.(Figura 2) y relación sistólico / diastólico de la arteria uterina (Figura 3) a las 24 y 48 horas al compararlo con los valores promedio iniciales (P < 0,01). La mayor disminución de todos los parámetros se consiguió a las 48 horas de tratamiento.DISCUSIÓN
La preeclampsia es una de las principales causas de morbilidad materna y neonatal. El daño vascular endotelial y el vasoespasmo juegan un papel importante en la patogénesis del síndrome. Con el uso de diferentes fármacos para el tratamiento de la enfermedad la mortalidad ha disminuido en forma significativa (36).
Debido a que el problema principal en la preeclampsia es el vasoespasmo, un fármaco que evite esta modificación resolvería el problema. Los resultados de esta investigación demuestran que el citrato de sildenafil producen reducción significativa en las mediciones del índice de pulsatilidad, índice de resistencia y relación del flujo sanguíneo sistólico / diastólico de la arteria uterina a partir de las 24 horas de uso, sin producir modificaciones en los parámetros de las arterias umbilical y cerebral media fetal. Los resultados de este estudio son apoyados por estudios previos en arterias de preeclámpticas realizados in vitro (37).
La disminución del flujo úteroplacentario, sugeridos por la comparación de los hallazgos en las mediciones Doppler entre las preeclámpticas y los controles normotensas, demostrado por los resultados de esta investigación, puede ser el resultado directo de un incremento inapropiado de la vasoconstricción acompañado de una disminución de la relajación dependiente del endotelio como previamente reportaron Bower y col. (38). Lo que determinaría que la utilidad clínica del citrato de sildenafil, por sus características de donador de óxido nítrico, mejoraría la relajación de los vasos maternos mediada por el óxido nítrico inducida por la preeclampsia (39).
Después del estudio inicial de Ashworth (21), se ha demostrado que la respuesta mediada por el endotelio en las preeclámpticas es mediada completamente por el óxido nítrico. Los vasos miometriales son vitales para el embarazo normal, debido a que su tono determina el flujo de sangre a la unidad fetoplacentaria. Sin embargo, la preeclampsia está caracterizada por una hipoperfusión de la placenta y el feto y, por tanto, esto está frecuentemente acompañado de restricción del crecimiento intrauterino (11,12,39).
Las variaciones en la resistencia de las arterias maternas, y en especial las miometriales, durante el embarazo demuestran ser importantes para la función placentaria normal. Debido a que las arterias espirales se transforman en vasos de conducción por la invasión trofoblástica durante la placentación (40), es probable que el control de la perfusión placentaria
pueda ser a un nivel más alto del árbol vascular. Se ha sugerido que la relajación dependiente del endotelio en la preeclampsia está disminuida y que esto puede alterar la perfusión placentaria (41,42)
. Sin embargo, se ha indicado que la disminución de la reactividad vascular en las arterias maternas no es completamente responsable de la reducción del flujo placentario.Los resultados de esta investigación apoyarían el hecho de que la inhibición de la fosfodiesterasa usando el citrato de sildenafil mejoraría la relajación mediada por el óxido nítrico de las arterias uterinas, probablemente por una disminución de la alta
resistencia en los vasos miometriales en pacientes con embarazos complicados por la preeclampsia. Estudios sobre la disfunción eréctil han suministrado evidencia de que la inhibición selectiva de la fosfodiesterasa 5, utilizando principalmente citrato de sildenafil, puede modificar la función vascular in vivo (33,34). Aunque se ha sugerido que el citrato de sildenafil tiene un leve efecto dilatador arterial en la vasculatura periférica (35), el mayor efecto del citrato de sildenafil es principalmente debido al incremento resultante del GMPc (33-35,43, 44). Además, la inhibición de la fosfodiesterasa 5 puede producir una mejoría potencial en diferentes territorios vasculares con reducción de la presión sanguínea en estas regiones (45).Se ha demostrado que la disminución de la síntesis de óxido nítrico después de la aplicación sistémica de N-nitro-L-arginina, un inhibidor de la sintetasa de óxido nítrico, provoca hipertensión y restricción del crecimiento intrauterino en ratas (46). Algunos donantes de óxido nítrico (como el trinitrato de glicerilo y el mononitrato de isosorbide) pueden producir relajación de la arteria umbilical (47,48) y disminución de la presión de perfusión de la circulación placentaria humana in vitro (49). Los
datos de esta investigación señalan que los parámetros ecográficos de la arteria umbilical no se ven afectados por el uso del sildenafil.Se seleccionó para el estudio una dosis de 50 mg dos veces al día (100 mg/día) de citrato de sildenafil por vía oral debido a que las concentraciones plasmáticas exceden los 100 nmol/L a las 4 horas después de la administración, pues se ha comprobado que estas concentraciones serían efectivas a nivel uterino
in vivo (39,50). Esta concentración es 100 veces menor a la necesaria para producir inhibición de otras isoformas de la fosfodiesterasa cuando se utiliza el citrato de sildenafil, lo cual se ha indicado que está en la escala de 1 a 10 nmol/L (43).Según los hallazgos de esta investigación, y basado en la literatura revisada, el uso del citrato de sildenafil sólo se justificaría por el momento en aquellas pacientes sin enfermedades cardiovasculares en las cuales las mediciones de la ecografía Doppler están alteradas para aumentar el flujo úteroplacentario y la perfusión placentaria y, por ende, mejorar las condiciones fetales (39). Esto puede ser particularmente importante en embarazos menores de 30 semanas (51).
Otra consideración importante es la posibilidad que el sildenafil atraviesa la barrera placentaria afectando la hemodinámica fetal (39). Los datos de esta investigación demuestran que en las 48 horas siguientes a la administración de 100 mg/día no produce modificaciones en los parámetros ecográficos de la arteria umbilical y cerebral media fetal; sin embargo, los datos estructurales demuestran que el sildenafil podría atravesar la placenta. Sin embargo, se conoce de una investigación en la que se trataron 35 preeclámpticas con dosis de hasta 240 mg/día, sin efectos neonatales importantes (52).
En conclusión, el citrato de sildenafil produce una disminución significativa sobre el flujo de las arterias uterinas sin afectar el flujo sanguíneo de las arterias umbilical y cerebral media fetal.
REFERENCIAS
1. Lunell N, Lewander R, Mamoun I, Nylund L, Sarby S, Thornstrom S. Uteroplacental blood flow in pregnancy induced hypertension. Scand J Clin Lab Invest. 1984;169:28-35. [ Links ]
2. Zhou Y, Fisher S, Janatpour M, Genbacev O, Dejana E, Wheelock M. Human cytotrophoblasts adopt a vascular phenotype as they differentiate: A strategy for successful endovascular invasion? J Clin Invest. 1997;99:2139-2151. [ Links ]
3. Roberts J, Lain K. Recent insights into the pathogenesis of pre-eclampsia. Placenta. 2002;23:359-372. [ Links ]
4. Lain K, Roberts J. Contemporary concepts of the pathogenesis and management of preeclampsia.
JAMA. 2002;287:3183-3186. [ Links ]5. Ferris T. Pregnancy, preeclampsia, and the endothelial cell. N Engl J Med. 1991;325:1439-1440. [ Links ]
6. Roberts J, Redman C. Pre-eclampsia: More than pregnancy-induced hypertension. Lancet. 1993;341:1447-1451. [ Links ]
7. Contreras F, Martínez J, Fouillioux C, Colmenares Y, Guevarra E, Torres D, et al. Endotelio y trastornos
hipertensivos en el embarazo. Rev Fac Med (Caracas). 2002;25:121-129. [ Links ]8. Lang U, Baker R, Braems G, Zygmunt M, Kunzel W, Clark K. Uterine blood flow: A determinant of fetal growth. Eur J Obstet Gynecol Reprod Biol. 2003;110(Suppl):55-61. [ Links ]
9. Joern H, Funk A, Rath W. Doppler ultrasonographic findings for hypertension in pregnancy and HELLP syndrome. J Perinatal Med. 1999;27:388-394. [ Links ]
10. Bower S, Campbell S. Doppler velocimetry of the uterine artery as a screening test in pregnancy. Ultrasound Obstet Gynaecol. 1993;57:579-586. [ Links ]
11. Romero G, Aguilar I, Chávez A, Ponce L. Predicción del bienestar fetal mediante el perfil flujométrico Doppler en embarazadas con hipertensión. Ginecol Obstet Méx. 2001;69:480-486. [ Links ]
12. Quintero J, Villamediana J, Paravisini I, Brito J, Cadena L. Velocimetría Doppler de la arteria uterina como factor de predicción de preeclampsia y crecimiento fetal restringido. Rev Obstet Ginecol Venez. 2002;62:153-159. [ Links ]
13. Van Asselt K, Gudmundsson S, Lindqvist P. Uterine and umbilical artery velocimetry in preeclampsia. Acta Obstet Gynecol Scand. 1998;77:614-619. [ Links ]
14. Trudinger B, Giles W, Cook C. Flow velocity waveforms in the maternal uteroplacental and fetal umblical placental circulations. Am J Obstet Gynecol. 1985;152:155-163. [ Links ]
15. Trudinger B, Giles W, Cook C. Fetal umblical artery flow velocity wave forms and placental resistance. Br J Obstet Gynaecol. 1985;92:23-30. [ Links ]
16. Vyas S, Campbell S. Fetal Doppler studies in the hypoxic fetus. Ultrasound Obstet Gynaecol.
1993;62:619-624. [ Links ]17. Friedman S, Schiff E, Emeis J, Dekker G, Sibai B. Biochemical corroboration of endothelial involvement
in severe preeclampsia. Am J Obstet Gynecol. 1995;172:202-203. [ Links ]18. Roberts J, Taylor R, Musci T, Rodgers G, Hubel C, McLaughlin M. Preeclampsia: An endothelial cell disorder. Am J Obstet Gynecol.
1989;161:1200-1204. [ Links ]19. McCarthy A, Woolfson R, Raju S, Poston L. Abnormal endothelial cell function of resistance arteries from women with preeclampsia. Am J Obstet Gynecol. 1993;168:1323-1330. [ Links ]
20. Ashworth J, Warren A, Baker P, Johnson I. A comparison of endothelium-dependent relaxation in omental and myometrial resistance arteries in pregnant and nonpregnant women. Am J Obstet Gynecol. 1996;175:1307-1312. [ Links ]
21. Ashworth J, Warren A, Baker P, Johnson I. Loss of endothelium-dependent relaxation in myometrial
resistance arteries in pre-eclampsia. BJOG. 1997;104:1152-1158. [ Links ]22. Conrad K, Kerchner L, Mosher M. Plasma and 24-h NO(x) and cGMP during normal pregnancy and preeclampsia in women on a reduced NO(x) diet. Am J Physiol. 1999;277:F48-F57. [ Links ]
23. Davidge S, Stranko C, Roberts J. Urine but not
plasma nitric oxide metabolites are decreased in women with preeclampsia. Am J Obstet Gynecol. 1996;174:1008-1013. [ Links ]24. Smarason A, Allman K, Young D, Redman C. Elevated levels of serum nitrate, a stable end product of nitric oxide, in women with pre-eclampsia. BJOG.
1997;104:538-543. [ Links ]25. Ranta V, Viinikka L, Halmesmaki E, Ylikorkala O. Nitric oxide production with preeclampsia. Obstet Gynecol. 1999;93:442-445. [ Links ]
26. Reyna-Villasmil E, Prieto-Franchi M, Torres-Montilla M, Reyna-Villasmil N, Mejía-Montilla J. Metabolitos del óxido nítrico plasmático y niveles de peróxidos lipídicos en pacientes preeclámpticas antes y después del parto. Rev Obstet Ginecol Venez.
2002;62:89-92. [ Links ]27. Davidge S, Baker P, Roberts J. NOS expression is increased in endothelial cells exposed to plasma
from women with pre-eclampsia. Am J Physiol. 1995;269:H1106-H1112. [ Links ]28. Baker P, Davidge S, Roberts J. Plasma from women
with preeclampsia increases endothelial cell nitric oxide production. Hypertension. 1995;26:244-248. [ Links ]29. Lees C, Valensise H, Black R, Harrington K, Byiers S, Romanini C. The efficacy and fetal-maternal cardiovascular effects of transdermal glyceryl trinitrate in the prophylaxis of pre-eclampsia and its complications: A randomized double-blind placebo-controlled trial. Ultrasound Obstet Gynecol.
1998;12:334-338. [ Links ]30. Davidge S. Oxidative stress and altered endothelial cell function in preeclampsia. Semin Reprod Endocrinol. 1998;16:65-73. [ Links ]
31. Roggensack A, Zhang Y, Davidge S. Evidence for peroxynitrite formation in the vasculature of women with preeclampsia. Hypertension. 1999;33:83-89. [ Links ]
32. Cooke C, Davidge S. Peroxynitrite increases iNOS through NF-kappaB and decreases prostacyclin synthase in endothelial cells. Am J Physiol Cell Physiol. 2002;282:C395-C-402. [ Links ]
33. Zusman R. Cardiovascular data on sildenafil citrate: Introduction. Am J Cardiol. 1999;83:1C-2C. [ Links ]
34. Bivalacqua T, Champion H, Hellstrom W, Kadowitz P. Pharmacotherapy for erectile dysfunction. Trends Pharmacol Sci. 2000;21:484-489. [ Links ]
35. Jackson G, Benjamin N, Jackson N, Allen M. Effects of sildenafil citrate on human hemodynamics. Am J
Cardiol. 1999;83:13C-20C. [ Links ]36. Geirsson R, Arngrimsson R, Apalset E. Falling population incidence of eclampsia. A case-control study of short term outcome. Acta Obstet Gynaecol Scand. 1994;73:465-467. [ Links ]
37. Kenny L, Baker P, Kendall D, Randall M, Dunn W. Differential mechanisms of endothelium-dependent vasodilator responses in human myometrial small arteries in normal pregnancy and pre-eclampsia. Clin
Sci. 2002;103:67-73. [ Links ]38. Bower S, Kingdom J, Campbell S. Objective and subjective assessment of abnormal uterine artery Doppler flow velocity waveforms. Ultrasound Obstet Gynecol. 1998;12:260-264. [ Links ]
39. Wareing M, Myers J, O´Hara M, Baker P. Sildenafil citrate (Viagra) enhaces vasodilatation in fetal growth restriction. J Clin Endocrinol Metab. 2005;90:2550-2551. [ Links ]
40. Pijnenborg R, Bland J, Robertson W, Brosens I. Uteroplacental arterial changes related to interstitial trophoblast migration in early human pregnancy. Placenta. 1983;4:397-413. [ Links ]
41. Moore R, Strachan B, Tyler D, Duncan K, Baker P, Worthington B. In utero perfusing fraction maps in normal and growth restricted pregnancy measured using IVIM echo-planar MRI. Placenta.
2000;21:726-732. [ Links ]42. Ong S, Moore R, Tyler D, Baker P, Johnson I, Gowland P. Reduced placental perfusion in compromised pregnancies can be demonstrated in vivo using magnetic resonance imaging. J Soc Gynecol Investig. 2001;8:54A. [ Links ]
43. Wallis R, Corbin J, Francis S, Ellis P. Tissue distribution of phosphodiesterase families and the effects of sildenaWl on tissue cyclic nucleotides, platelet function, and the contractile responses of trabeculae carneae and aortic rings in vitro. Am J
Cardiol. 1999;83:3C-12C. [ Links ]44. Zusman R, Morales A, Glasser D, Osterloh I. Overall cardiovascular profile of sildenafil citrate. Am J Cardiol. 1999;83:35C-44C. [ Links ]
45. Wareing M, Myers J, O´Hara M, Kenny L, Warren A, Taggart M, et al. Effects of a phosphodiesterase 5 (PDE5) inhibitor on endothelium-dependent relaxation of myometral small arteries. Am J Obstet Gynecol. 2004;190:1283-1290. [ Links ]
46. Yallampalli C, Garfield R. Inhibition of nitric oxide synthesis in rats during pregnancy produces signs similar to those of preeclampsia. Am J Obstet Gynecol.
1993;169:1316-1320. [ Links ]47. Cahuduri G, Buga G, Gold M, Woods K, Ignarro L. Characterization and actions of human umbilical endothelium derived relaxing factor. Br J Pharmacol. 1991;102:331-336. [ Links ]
48. Izumi H, Garfield R, Makino Y, Shirazawa K, Itoh T. Gestational changes in endothelium-dependent vaso-relaxation in human umbilical artery. Am J Obstet Gynecol. 1994;170:236-245. [ Links ]
49. Myatt l, Brewer A, Brockman D. The action of nitric oxide in the human feto-placental circulation. Am J Obstet Gynecol. 1991;164:507-513. [ Links ]
50. Boyce E, Umland E. Sildenafil citrate: A therapeutic update. Clin Ther. 2001;23:2-23. [ Links ]
51. Hoekstra R, Ferrara T, Couser R, Payne N, Connett J. Survival and long-term neurodevelopmental outcome of extremely premature infants born at 23B26 weeks= gestational age at a tertiary center. Pediatrics.
2004;113:e1-e6. [ Links ]52. Smith R, Skillern L, Mires G, Shennan A, McLeod A, Hirsch I, et al. Sildenafil does not prolong pregnancy in women with established pre-eclampsia: Results of a phase 2 randomised placebo controlled trial. SGI Abstract. 2007;27:212. [ Links ]