Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Obstetricia y Ginecología de Venezuela
versión impresa ISSN 0048-7732
Rev Obstet Ginecol Venez v.69 n.4 Caracas dic. 2009
¿Se justifica la ooforectomía profiláctica en histerectomías?
Drs. Linder Díaz*, Daniel Omaña**, Manuel Santos***, Belkys Zambrano*
* Médico Obstetra-Ginecólogo del Centro Clínico Quirúrgico CARALI II. Barquisimeto, Venezuela.
** Médico Obstetra-Ginecólogo del Hospital de Colón, Estado Táchira, Venezuela.
*** Médico Obstetra-Ginecólogo. Oncólogo-Ginecólogo. Profesor Asociado de Obstetricia y Ginecología de la Universidad de Los Andes. PhD en Medicina y Cirugía de la Universidad Autónoma de Barcelona–España. Jefe del Departamento de Obstetricia y Ginecología del Instituto Autónomo Hospital Universitario de Los Andes. Mérida, Venezuela
RESUMEN
Objetivo: Evaluar la ooforectomía como medida profiláctica para la disminución del riesgo de cáncer de ovario en mujeres con antecedente de histerectomía y conservación de ovarios, debida a patología benigna, que consultaron desde enero 2000 a diciembre 2006.
Métodos: Se realizó un estudio retrospectivo observacional de tipo descriptivo y transversal, mediante la revisión de historias médicas, determinando el sistema de variables y registrando los datos en una ficha preelaborada, siendo procesados estadísticamente con el programa SPSS 12.
Ambiente: Instituto Autónomo Hospital Universitario de Los Andes
Resultados: De un total de 1 030 histerectomías en un período de 7 años, 603 fueron por causa benigna, conservando uno o ambos ovarios en 423. Además, se revisaron 490 historias con diagnóstico de tumor de ovario, de las cuales 35 pacientes tuvieron antecedente de histerectomía (durante el mismo período de años, pero con 1 año de diferencia en más, para dar margen a la aparición del tumor), en las que 30 (18 institucionales) presentaron reporte histopatológico a su resolución, posterior al diagnóstico, 68,6:% resultaron benignos, 17,1 % malignos, y 14,3 % quedó sin conocerse. Se determinó que el riesgo de cáncer de ovario en las pacientes a las que se les conserva los ovarios en esta institución, corresponde entre el 0,23 % - 1,37 %, por lo que serían necesarias 423 ooforectomías rutinarias para prevenir 1 caso de cáncer de ovario, en un lapso que correspondió a 7 años.
Conclusión: La ooforectomía profiláctica no se justifica según los hallazgos de esta investigación.
Palabras clave: Histerectomía. Cáncer de ovario. Ooforectomía profiláctica.
SUMMARY
Objective: To evaluate oophorectomy as prophylactic measure to reduce ovarian cancer in women with history of hysterectomy and ovarian conservation secondary to a benign cause, who consulted from January 2000 to December 2006.
Methods: A retrospective observational, descriptive and transversal study was performed by reviewing medical charts, and gathering the data in a designed collection form. Statistical analysis was made by using SPSS 12 software.
Setting: Instituto Autonomo Hospital Universitario de Los Andes
Results: From a total of 1 030 hysterectomies reviewed in a 7 year period, 603 were performed secondary to a benign cause; and in 423 of them one or both ovaries were not removed. From 490 cases of patients with diagnosis of ovarian tumor, only 35 patients had history of previous hysterectomy. Out of these 35 patients, 30 (18 institutional) patients had biopsy report of the ovarian tumor after diagnosis: 68.6 % were benign, 17.1 % were malignant, and 14.3 % were undetermined. It was established that the risk of ovarian cancer in patients who underwent hysterectomy due to a benign cause with ovarian conservation was 0.23 % to 1.37 %. 423 routine oophorectomies would be necessary to prevent one case of ovarian cancer (number needed to treat: 423).
Conclusion: Prophylactic oophorectomy is not justified for this purpose.
Key words: Hysterectomy. Ovarian cancer. Prophylactic oophorectomy.
INTRODUCCIÓN
El tumor de ovario debe diagnosticarse y valorarse por la posibilidad de que sea maligno. Los exámenes ginecológicos anuales tienen una función esencial ya que a menudo las masas anexiales son asintomáticas y, el gravísimo problema de los tumores malignos es que producen una alta mortalidad, hasta el punto de que, excluido el cáncer de mama, suponen en la mayor parte de las estadísticas la primera causa de muerte por cáncer ginecológico, a pesar de que su frecuencia es menor que la del útero. Ello es debido a las dificultades que presenta su diagnóstico, lo que determina que éste se efectúe muchas veces en estadios avanzados. Las lesiones malignas son las que plantean el desafío clínico de mayor magnitud y representan un reto quirúrgico de primera importancia, requieren tratamientos intensivos y a menudo complejos, y demandan en grado extremo energía psicológica y física de la paciente (1).
El tumor anexial es una de las causas más frecuentes de cirugía ginecológica. Tradicionalmente la probabilidad de obtener un determinado diagnóstico anatomopatológico ante un tumor anexial se ha basado en las frecuencias de distribución reportadas por centros extranjeros a países latinoamericanos (2).
La miomatosis uterina es la patología tumoral benigna más frecuentemente hallada en la edad reproductiva de la mujer; su frecuencia oscila entre un 20 % y 30 % (3).
Dentro de la profilaxis de los tumores de ovario, puede considerarse la extirpación o la conservación de los anexos cuando se practica una histerectomía. La posible aparición de un tumor en el llamado "ovario restante" suscita siempre una fuerte controversia. Según las estadísticas publicadas, entre un 2 y un 4 por 10 000 mujeres a las que se practica histerectomía sufren después un tumor de ovario, siendo malignos aproximadamente la mitad de ellos (entre 0 % y 0,3 %) (4), esto se explica pues la histerectomía al igual que las ligaduras tubáricas se asocian a disminución del riesgo de cáncer de ovario, posiblemente por la obstrucción al ascenso de factores oncogénicos desde el tracto genital inferior (5,6). Los partidarios de la extirpación aducen que no es lógico asumir ese riesgo una vez que se ha realizado una operación abdominal. Sin embargo, es bien cierto que la extirpación de los ovarios va acompañada de problemas diversos, entre los cuales los psicológicos, que no se compensan del todo con una terapia hormonal sustitutiva.
La práctica de ooforectomías unilaterales, que durante muchos años ha sido frecuente a nivel mundial, no goza de demasiados adeptos en la actualidad, pues científicamente se ha comprobado por una parte que disminuye claramente la producción hormonal y por otra no disminuye el riesgo de cáncer de ovario (7).
La conservación de los ovarios involucra un riesgo de reintervención quirúrgica por tumores de anexos (8). Por ejemplo, investigadores de la Universidad de Miami encontraron que entre 4 % y 14 % de pacientes a las que se sometió a histerectomía por enfermedad benigna, desarrollaron posteriormente, cáncer de ovario (9). Además se ha reportado que un 1 %-4 % de mujeres a las que se ha realizado una ooforectomía unilateral, han presentado síndrome de ovario residual, lo cual ocurre con mayor frecuencia a medida que baja la edad en que se opera la paciente (10).
La posible devastación de ser afligida con un cáncer de ovario tiene que ser balanceado cuidadosamente con el efecto existente en la extirpación de órganos saludables de estas mujeres que no corren alto riesgo de padecer la enfermedad (11).
La existencia de cáncer de ovario, o su prevención, parece ser la única razón racional para considerar una ooforectomía durante una histerectomía. La probabilidad de conseguir cáncer de ovario en la población general agrupado según edades depende altamente del historial familiar (5,12). Una mujer que no cuenta con una historia de cáncer de ovario en la familia tiene aproximadamente un riesgo al nacer de padecer esta patología en algún momento es casi de 1,5 % y el de morir por esta causa se aproxima a 1 % (13,14).
Según Parazzini (15), quién comparó 943 casos de cáncer de ovario con un grupo control de 2 503, el riesgo de reducción después de una histerectomía depende del tiempo, alcanzando un riesgo de 0,5 después de 15 años poshisterectomía. A la vez que Herbst (16), concluye que las intervenciones quirúrgicas puede que sean apropiadas sólo para mujeres diagnosticadas con el síndrome de cáncer de ovario en el historial familiar. Esto es una enfermedad hereditaria autosomal que ocurre en menos de 1.% de todos los casos de cáncer de ovario, y produce un riesgo de un 50 % de desarrollarse en un cáncer de ovario durante la vida de una persona. Por el contrario, la presencia de uno, dos, o tres miembros de familia con cáncer de ovario aumenta el riesgo en la vida de un 1 % entre todas las mujeres, y hasta un 5 % o 7 % dependiendo del número de parientes afligidos (17).
Si se asume una incidencia anual de 22 000 casos de cáncer de ovario en Estados Unidos y combinando la información con el porcentaje de estos cánceres que ocurren en mujeres entre la edad de 40 años o más, los autores concluyen que 1 000 mujeres pueden salvarse del cáncer de ovario sometiéndose a la castración rutinaria de todas las mujeres mayores de 40 años durante una histerectomía. Es decir que se estima que 399 000 castraciones innecesarias tendrían que ser practicadas durante una histerectomía para patologías benignas con el fin de prevenir 1 000 casos de cáncer de ovárico en EE.UU por año (11). Podemos notar que por lo menos el 99,75 % de las ooforectomías profilácticas son innecesarias.
Previamente, antes de que los documentos de investigación empezaran a revelar los varios efectos negativos de este tipo de práctica (ooforectomía profiláctica), ovarios saludables eran removidos rutinariamente a través de histerectomías en Norte América durante los años 70 y 80 (11).
Se sugiere que la práctica de castración profiláctica (la extirpación quirúrgica de ovarios saludables), basado solamente en la posibilidad de enfermedades en el futuro, no resisten escrutinio (11).
Uno de los puntos más controvertidos cuando se realiza una histerectomía por causa benigna, es la necesidad o no de practicar una ooforectomía concomitante, siempre que se piensa en el riesgo de desarrollarse a futuro una patología ovárica maligna.
El objetivo del presente estudio fue: establecer el valor de la ooforectomía como medida profiláctica para la disminución del riesgo del cáncer de ovario en mujeres a quienes se les realizó histerectomía por causa benigna, las cuales consultaron al Instituto Autónomo Hospital Universitario de Los Andes (IAHULA) durante el período enero 2000 – diciembre 2006.
MÉTODOS
Se llevó a cabo un análisis retrospectivo observacional de tipo descriptivo y transversal, para establecer el valor de la ooforectomía como medida profiláctica para la disminución del riesgo de cáncer de ovario en mujeres con antecedentes de histerectomía y conservación de ovarios, debida a patología benigna, las cuales consultaron al Servicio de Ginecología del Instituto Autónomo Hospital Universitario de Los Andes durante el período de enero 2000 al 31 de diciembre 2006.
Mediante la revisión de las historias médicas, se determinaron los datos los cuales fueron registrados en una ficha de recolección (formato preelaborado), siendo llevados posteriormente al análisis estadístico.
Se realizó la revisión de historias clínicas en dos grupos: el primer grupo conformado por pacientes a las que se les realizó histerectomía entre el período de enero 1999 a diciembre 2005, y el segundo grupo por pacientes con diagnóstico de tumor de ovario desde enero 2000 a diciembre 2006 (la diferencia de 1 año entre los dos grupos, es con el objeto de dar un margen mínimo para el desarrollo del tumor).
La población estuvo conformada por 1.030 pacientes con historia de histerectomía y 490 expedientes de pacientes en los que reportaban tumor de ovario.
La muestra de la investigación estuvo constituida por 423 casos de histerectomías a las cuales se les conservó uno o ambos ovarios, realizadas en el período de enero 1999 a diciembre 2005, y 35 pacientes que acudieron a la institución con antecedente de histerectomía (por patología benigna) y conservación de uno o ambos ovarios, a las cuales se les diagnosticó tumor de ovario.
Criterios de inclusión
Pacientes mayores de 35 años con antecedente de histerectomía y conservación de uno o ambos ovarios, debida a patología benigna.
Criterios de exclusión
Pacientes con histerectomía por patología maligna.
Pacientes sin histerectomía y con tumor de ovario diagnosticado.
Pacientes con histerectomía por causa obstétrica.
Pacientes menores de 35 años.
Los datos recaudados en las fichas de recolección, se mantiene en total confidencialidad entre los integrantes del equipo de investigación.
Los datos obtenidos fueron analizados mediante el programa estadístico SPSS versión 12 para Windows®. Las variables se expresaron en frecuencias y porcentajes, se utilizó media, Chi cuadrado y test exacto de Fisher; para las variables cuantitativas se utilizó tabla de ANOVA. La significancia estadística se estableció en un valor de P < 0,05. Los datos obtenidos se presentaron en cuadros y figuras.
RESULTADOS
De un total de 1 030 histerectomías revisadas en los archivos del IAHULA, se encontró que 603 casos fueron debidos a patología benigna, de los cuales a 423 se les conservó uno o ambos ovarios representando el 70,1 %.
El promedio de edad de las pacientes fue de 46 ± 9,12 años, con un rango que osciló entre 35 y 80 años, observándose el mayor porcentaje de 57,4 % (346/603) en el grupo de 40 a 49 años. Según la conservación de los ovarios, el grupo de edad de mayor porcentaje se correspondió con el de 35 – 39 años: 97,5 % (79/81) seguido del grupo de 40 – 44 años: 91,5 % (162/177), pudiéndose observar una disminución paulatina según avanza la edad, aunque con un repunte luego de los 60 años, mostrándose una P= 0,001. Respecto a la ubicación, ambos ovarios tuvieron la mayor incidencia de conservación: 65,7 % (278/423), seguido por el izquierdo: 24,2 % (102/423) y en menor cifra porcentual el derecho 10,1 % (43/423).
La causa más frecuente de histerectomía fue la miomatosis uterina en un 77,6 % (468/603), seguida del prolapso genital en 20 % (121/603) y la hiperplasia endometrial (simple sin atipias) en un 2,32 % (14/603).
De las pacientes histerectomizadas en esta institución, se determinó que sólo el 4,25 % (18/423) desarrollaron ulteriormente tumor de ovario. De estas 18 pacientes, 17 resultaron en patologías benignas, mientras sólo 1 reportó malignidad, lo que quiere decir que la incidencia de malignidad de las pacientes histerectomizadas en esta institución para el período correspondiente fue de 0,23 %.
Ahora bien, si se adicionan las otras pacientes que acuden a este centro hospitalario con diagnóstico de tumor ovárico y antecedente de histerectomía (pero ésta realizada en otro centro asistencial), se aumenta el número de la muestra a 35 casos.
Por el estudio anatomopatológico de los tumores extirpados se clasificó el 68,6 % (24/35) en benignos, el 17,1 % (6/35) malignos y un 14,3 % (5/35) no se encontró en las historias el resultado de biopsia. De estos 6 pacientes con tumor maligno de ovario poshisterectomía, 5 (83,33 %) llegaron referidas a este centro siendo histerectomizadas previamente en otras instituciones de salud.
Si se adicionan los 17 casos referidos a la institución por presentar tumor de ovario poshisterectomía de los cuales 5 fueron malignos se tendría un total de 6 casos de cáncer de ovario en 440 pacientes histerectomizadas, para una incidencia de 1,36 %.
El diagnóstico anatomopatológico reportó un 54,3 % para cistoadenoma seroso, mientras que un 14,3 % se correspondió con cistoadenocarcinoma seroso, 11,4 % para endometrioma, 2,9 % para fibrosarcoma y otro 2,9 % para cistoadenoma mucinoso, desconociéndose los resultados en un 14,3 %.
El 62,9 % (22/35) de las histerectomías, previas al desarrollo del tumor, se realizaron en el IAHULA, mientras que el 37,1 % (13/35) restante se practicaron en otras instituciones públicas y/o privadas. Según el tipo de histerectomía, se encontró que el 68,6 % (24/35) fue por abordaje abdominal conservándose ambos ovarios, mientras que a un 20 % (7/35) (también por abordaje abdominal) sólo se les conservó 1 ovario, el 11,4 % (4/35) restante se realizaron por abordaje vaginal y conservándose ambos ovarios.
El 29,4 % (5/17) de los tumores ováricos poshisterectomía de otras instituciones resultaron ser malignos, en contraste a solo 5,6 % (1/18) de malignidad en patología tumoral de ovario luego de histerectomía en esta institución.
No se encontró significancia estadística de tumores malignos y benignos en lo que se refiere a los antecedentes familiares, menarquía, antecedente de esterilización quirúrgica, uso de anticonceptivos orales.
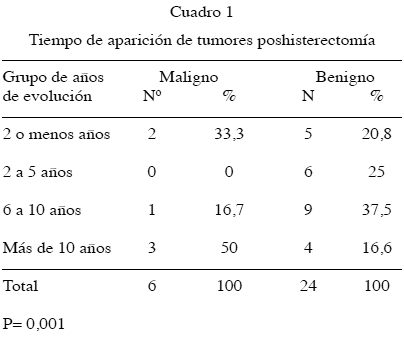
Según el promedio del tiempo de aparición del tumor con respecto a la clasificación del mismo, se tuvo una media de 12,49 años para los malignos y 5,12 años para los benignos, lo que expresa una significancia estadística de P = 0,007 al combinar los grupos.
En la relación entre el tiempo de aparición del tumor luego de la histerectomía según la malignidad, se encontró que los malignos se presentaron en un 50 % (3/6) después de transcurrir más de 10 años, a diferencia de sólo 16,66 % (4/24) en los benignos (P = 0,007) (Cuadro 1).
Ninguno de los tumores (malignos o benignos) presentó preferencia real de lateralidad.
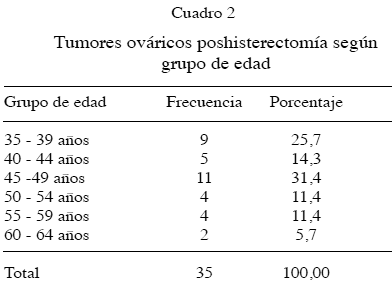
El grupo de edad con mayor frecuencia de tumores ováricos poshisterectomía se ubicó entre los 45 – 49 años: 31,4 % (11/35), con una media de edad de 47 ± 7,86 años y un rango que osciló entre 35 y 64 años (Cuadro 2).
Respecto a las pacientes con tumores malignos, el promedio de edad fue de 55,83 años, con un peso de 56,67 kg, una talla de 150,83 cm y un índice de masa corporal (IMC) promedio de 24,91 kg/m2. Las pacientes con tumores benignos tuvieron una media de edad de 45,42 años, con un peso de 64,33 kg, una talla de155,38 cm e IMC de 26,64 kg/m2; con lo que se pudo observar una significación estadística para la edad (P = 0,003) y no así para las características antropométricas.
El 100 % (6/6) de las pacientes con cáncer de ovario luego de histerectomía presentó al momento del diagnóstico masa abdominopélvica palpable, dolor pélvico y aumento de volumen abdominal; encontrándose de estos tres parámetros antes mencionados sólo diferencia estadística significativa (P = 0,001) al compararse con los tumores benignos en lo que respecta al aumento de volumen abdominal, con un 12,5 % (3/24).
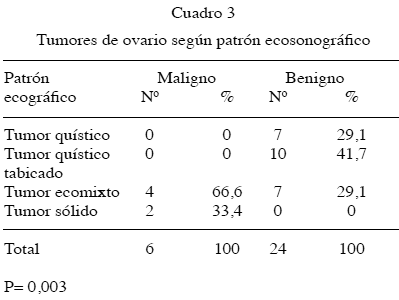
El 100 % (6/6) de los cánceres presentó aspecto sólido o ecomixto al estudio ecosonográfico del tumor; en cambio la mayoría de los tumores benignos se mostraron quísticos, con un 70,83 % (17/24), P = 0,003 (Cuadro 3).
DISCUSIÓN
Investigadores de California y Nueva Zelanda afirman que el 90 % de las histerectomías se realiza por causas no cancerosas (18) y de éstas, es la miomatosis uterina la causa más frecuente a nivel mundial (3). Dichos datos son compatibles con los obtenidos en esta investigación, donde se registró un 77,6 % de intervenciones debidas a la misma causa.
La conservación de ovarios durante las histerectomías según grupos de edad presentó un comportamiento bimodal, siendo muy cercana al 100 % en edades entre 35 y 44 años, disminuyendo esta conducta entre 45 y 59 años para presentar un repunte a partir de los 60 años de edad, lo que pudiera explicarse por la mayor frecuencia de histerectomías vaginales en este último grupo de pacientes.
La gran mayoría de los tumores de ovarios resultaron ser de origen epitelial, coincidiendo este hallazgo con el reportado en otros estudios venezolanos (19,20).
La edad media del cáncer de ovario fue de 55,83 años siendo similar a otros estudios; en Venezuela Zenzola y col. en año 2005 (19) reportaron edad media de 60 años para estadios avanzados de la enfermedad, y en México se encontró 50,39 años como promedio de edad para estas pacientes (21).
Aproximadamente la mitad (55 %) de las histerectomías realizadas en EE.UU, por causa benigna (600 000 por año), involucran la extirpación de uno o ambos ovarios (22). Tal estadística no coincide con el 29,1 % encontrado en esta investigación.
La práctica de ooforectomías unilaterales, que durante muchos años ha sido frecuente a nivel mundial, no goza de demasiados adeptos en la actualidad, pues científicamente se ha comprobado por una parte que disminuye claramente la producción hormonal y por otra no disminuye el riesgo de cáncer de ovario (7); se comprobó que en este hospital aunque esta conducta ha ocurrido en la minoría de las pacientes: 34,3 %, aún se considera importante esta cifra. A pesar que la ooforectomía profiláctica fue notablemente mayor del lado derecho: 89,9 % la mitad de los tumores malignos se observaron en dextrolateralidad. Se ha intentado explicar la preferencia derecha de la ooforectomía profiláctica unilateral, para evitar confusión diagnóstica con patología apendicular y por existir una tendencia mayor de malignización en el lado derecho, aunque esto último no ha podido ser demostrado (23).
La conservación de los ovarios involucra un riesgo de reintervención quirúrgica por tumores de anexos, ya que hasta 14 de cada 100 mujeres que se sometieron a histerectomía por enfermedad benigna, desarrollaron posteriormente, cáncer de ovario (9). Otros reportes restan importancia a los tumores ováricos poshisterectomías, al decir que las cifras de patología ovárica benigna, tras histerectomía, son de hasta un 10.% teniéndose en cuenta que en la anatomía patológica de estas lesiones, la mitad aproximadamente son quistes funcionales y el resto son pseudoquistes peritoneales o más raramente cistoadenomas (24). Evidencias muestran que habría que practicar por lo menos 300 ooforectomías bilaterales por cada cáncer de ovario que se pueda prevenir (25). No hay bases con verdadero soporte científico que justifique la ooforectomía profiláctica en pacientes de bajo riesgo (26,27). Analizando estos valores, se puede inferir que sí existe una concordancia de resultados para la investigación realizada en este hospital, debido a que el riesgo de desarrollar cáncer de ovario tras histerectomía (conservando ovarios) se encontró en el 0,23 % pudiendo aumentar al 1,36.%, con lo que serían necesarias 423 ooforectomías rutinarias para prevenir 1 solo caso de cáncer ovárico. Incluso se ha determinado que las pacientes se arrepienten de no haber buscado más información antes de decidir la ooforectomía profiláctica (28).
El riesgo de malignidad ovárica aumenta en pacientes con antecedentes familiares de cáncer de ovario (5,29,30). Las mutaciones de los genes BRCA1 y BRCA2 aumentan el riesgo de presentar cáncer de ovario y de mama, y es en estas pacientes en los que se puede justificar la ooforectomía profiláctica y no en forma indiscriminada (12,31,32). Éste fue un punto crítico que no evaluó nuestra investigación, debido a que ninguna de las pacientes tenía estudios de dichos genes. Igualmente debe tenerse en cuenta que la ooforectomía profiláctica disminuye pero no desaparece por completo el riesgo de padecer cáncer de mama y/o de ovario en estas pacientes (33).
La incidencia de cáncer en las pacientes histerectomizadas que presentaron tumor de ovario fue de 17,1 % lo cual representa una incidencia menor a la encontrada en la literatura cuando ésta se refiere a cáncer de ovario en pacientes sin antecedente de histerectomía (34). Se confirma así que el riesgo relativo de cáncer de ovario tras histerectomía es menor, tal como se expone en otras investigaciones (15,35).
Se ha estimado en 7 años el promedio, entre el tiempo transcurrido entre la histerectomía y la aparición del cáncer (36), lo cual difiere con lo encontrado en este centro de salud, se obtuvo una media de 12,49 años para los malignos y 5,12 años para los benignos.
Según el origen epitelial predominaron cuantitativamente los serosos y luego los mucinosos, coincidiendo con lo reportado en la literatura (13).
Debe tomarse en cuenta la asociación de masa pélvica palpable, aumento del volumen abdominal, dolor pélvico y el hallazgo ultrasonográfico de patrón sólido, ya que estas características se presentaron en todos los tumores ováricos malignos encontrados.
La obesidad en muchos estudios se relaciona con mayor riesgo para presentar cáncer de ovario (37-40), no evidenciándose tal asociación en estas pacientes.
La conservación ovárica hasta por lo menos la edad de 65 años, beneficia la sobrevida a largo plazo para mujeres con un riesgo promedio de cáncer de ovario cuando se someten a histerectomía por enfermedad benigna (18). La salpigooforectomía profiláctica se relaciona con disminución de la calidad de vida en cuanto a mayor dolor, menos vitalidad, menos vida social, menos capacidad física y menor satisfacción sexual (41). Los ovarios aun después de la menopausia son los responsables de la producción del 50 % de la cantidad de andrógenos por un lapso de 12 años o más (42), influenciando así su conservación o exéresis en el comportamiento sexual de estas pacientes. A favor de la preservación de ovarios: la disminución de los precursores esteroidogénicos ováricos condiciona un incremento del factor 1 de crecimiento insulínico lo cual aumenta el riesgo de cáncer de colon (43). Podemos recomendar que ovarios saludables visibles al momento de una histerectomía por causa benigna, inclusive a los 50 años de edad, deban ser conservados para procurar lo fisiológico y disminuir la severidad de los cambios hormonales de la menopausia además de otros como eventos físicos, sexuales y psicológicos.
Un estudio húngaro reciente recomienda la exéresis de trompas de Falopio durante la histerectomía con conservación de ovarios, para evitar masas pélvicas posteriores originadas de estas estructuras (44). Este punto no era objetivo de la investigación, sin embargo, no encontramos tales patologías debido a que en el Servicio de Ginecología del IAHULA se recomienda realizar de rutina la extirpación de trompas de Falopio cuando se conservan ovarios.
En general los datos acerca de la incidencia de patología tumoral ovárica en pacientes con histerectomía previa no justifican la ooforectomía profiláctica.
Esta investigación nos permite recomendar:
Crear pautas de consenso dentro de los servicios que manejen la patología quirúrgica de la mujer, para así aplicar la misma sistemática y evitar efectos indeseables a largo plazo.
Es necesario en cualquier edad un diálogo y un consentimiento de la paciente explicándole los riesgos y beneficios.
Ovarios saludables deben ser evaluados y preservados ante una histerectomía por causa benigna hasta por lo menos los 50 años de edad.
En esas pacientes con antecedentes de síndromes de cáncer familiar (aun cuando en este estudio los antecedentes familiares de cáncer no fueron determinantes para el desarrollo de malignidad), se sugiere realizar detecciones de mutaciones en los genes supresores de tumores BRCA1 y BRCA2, en cuyos casos positivos se debe plantear la ooforectomía profiláctica una vez cumplida la fertilidad, luego de los 35 años. Hay que tomar en cuenta que aun cuando la ooforectomía profiláctica disminuye el riesgo de cáncer de ovario en esas pacientes portadoras de mutaciones de BRCA1 y BRCA2, este riesgo no se elimina por completo, ya que se han reportado casos de cánceres del peritoneo pélvico después de la ooforectomía.
A esas mujeres menores de 50 años y principalmente aquellas de 45 o menos con justificación de ooforectomía profiláctica, debe instaurárseles terapia hormonal de reemplazo una vez practicada la intervención, ya que se ha demostrado mejoras en la calidad y expectativa de vida de las mismas.
En general, el rol del médico debería ser el de:
- Definir el problema.
- Describir el verdadero riesgo, el cual es bajo, de desarrollar cáncer de ovario.
- Aclarar los riesgos inminentes arraigados en el método de la castración y sus efectos a la salud.
REFERENCIAS
1. Argenta PA, Nezhat F. Approaching the adnexal mass in the new millenium. J Am Assoc Gynecol Laparosc. 2000;7:455-571. [ Links ]
2. Cuello M, Merino P, Etchegaray A, Ortega JP, Pomés C, Barrena N, et al. Distribución de la patología anexial en mujer chilena: experiencia de la Universidad Católica de Chile. Rev Chil Obstet Ginecol. 2004;69:429-440. [ Links ]
3. Flores HD, Flores PD, Flores D, Flores D. Miomectomía. Rev Obstet Ginecol Venez. 1998; 58:187-190. [ Links ]
4. Chu C, Coukos G. Prophylactic oophorectomy for ovarian cancer. Reviews in Gynaecological and Perinatal Practice. 2006;6:12-19. [ Links ]
5. van Nagell JR, Gershenson DM. Cáncer de ovario: etiología, screening y cirugía. En: Rock JA, Jones III HW, editores. Te Linde Ginecología Quirúrgica. 9ª edición. Buenos Aires, Editorial Médica Panamericana; 2006. p. 1601-1639. [ Links ]
6. Fathalla MF. Incessant ovulation: a factor in ovarian neoplasia?. Lancet. 1971;2:163. [ Links ]
7. Farquhar CM, Steiner CA. Hysterectomy Rates in the United States 1990-1997. Obstet Gynecol. 2002;99:229-234. [ Links ]
8. Paredes A, Díaz P, Dávila A, Arce F. Ventajas y desventajas de la ooforectomía incidental en pacientes entre 35 y 45 años. Avances. 2004;1:15-19. [ Links ]
9. Averette HE, Sightler SE, Boike GM, Estape RE. Ovarian cancer in women with prior hysterectomy: A 14-year experience at the University of Miami. Obstet Gynecol. 1991;78:681-684. [ Links ]
10. Molina M, Rojas E, Escobar D. Dolor pélvico crónico: un desafío interesante. Disponible en: http://www.med.ufro.cl/obgin/Fronteras/vol2num1/dolorpelvico.pdf [ Links ]
11. Cutler WB. Oophorectomy at hysterectomy after age 40? A practice that does not withstand scrutiny. Menopause Management. 1996;5:10-14. [ Links ]
12. Bergfeldt K, Rydh B, Granath F, Gronberg H, Thalib L, Adami HO, et al. Risk of ovarian cancer in breast-cancer patients with a family history of breast or ovarian cancer: A population-based cohort study. Lancet. 2002;360:891-894. [ Links ]
13. Scully RE, Young RH, Clement PB. Tumors of the ovary, maldeveloped gonads, fallopian tube, and broad ligament. In: Atlas of tumor pathology, fascicle 23 3rd series. Washington, DC: Armed Forces Institute of Pathology, 1998:1-168. Cited in: Berek JS. Cáncer ovárico epitelial. En: Berek JS, Hacker NF, editores. Practical gynecologic oncology. 4ª edición. Filadelfia: McGraw-Hill; 2005.p. 443-509. [ Links ]
14. Dorigo O, Baker VV. Premalignant and malignant disorders of the ovaries and oviducts. En: DeCherney AH, Nathan L, et al. Current obstetric & gynecologic diagnosis & treatment. 9ª edición. Nueva York, McGraw-Hill; 2003. p. 933-946. [ Links ]
15. Parazzini F, Negri E, La Vecchia C, Luchini L, Mezzopane R. Hysterectomy, oophorectomy, and subsequent ovarian cancer risk. Obstet Gynecol. 1993;81:363-366. [ Links ]
16. Herbst AL. The epidemiology of ovarian carcinoma and the current status of tumor markers to detect disease. Am J Obstet Gynecol. 1994;170:1099-1105. [ Links ]
17. Nguyen HN, Sevin BU, Perras JP, Averette HE. Review of data on gynecologic cáncer cell lines: Potential applications of ATP-cell viability assays. Contrib Gynecol Obstet. 1994;19:132-144. [ Links ]
18. Parker WH, Broder MS, Liu Z, Shoupe D, Farquhar C, Berek JS. Ovarian conservation at the time of hysterectomy for benign disease. Clin Obstet Gynecol. 2007;50:354-361. [ Links ]
19. Zenzola V, Sanchez J, Hidalgo F, Soto G, Castillo J, Andrade A, et al. Cirugía citorreductora posterior a quimioterapia neoadyuvante: en cáncer epitelial de ovario avanzado. Rev Venez Oncol. 2005;17:122-128. [ Links ]
20. Rodriguez O, Rodriguez J, Sustacha P, Lehofer K. Cáncer de ovario: incidencia en el Hospital de Clínicas Caracas período 1995-1997. Clin Med HCC. 1998;3:156-159. [ Links ]
21. Martínez-Saíd H, Rincón DG, Montes de Oca MM, Ruiz GC, Ponce JL, López-Graniel CM. Predictive factors for irresectability in advanced ovarian cancer. Int J Gynecol Cancer. 2004;14:423-430. [ Links ]
22. ACOG Practice Bulletin, Number 07, September 1999. Available in: www.acog.org/publications/pdfs/pb020.pdf [ Links ]
23. Sánchez J. Carcinoma epidermoide primario del ovario originado en teratoma quístico maduro. Consideraciones patológicas. Histogénesis. Evaluación. Acta Cancerol. 2005;33:16-27. [ Links ]
24. Maresh MJ, Metcalfe MA, McPherson K, Overton C, Hall V. The value national hysterectomy study: Description of the patients and their surgery. BJOG. 2002;109:302-312. [ Links ]
25. Benchimol M, Gagneur O, Beddock R, Mention JE, Gondry J, Boulanger JC. Conservation ou ablation des ovaires lors des hysterectomies pour lesions benignes. J Gynecol Obstet Biol Reprod. 2001;30:476-483. [ Links ]
26. Kontoravdis A, Kalogirou D, Antoniou G, Kontoravdis N, Karakitsos P, Zourlas PA. Prophylactic oophorectomy in ovarian cancer prevention. Int J Gynecol Obstet. 1996;54:257-262. [ Links ]
27. Mayo Clinic. Prophylactic oophorectomy: Preventing cancer by surgically removing your ovaries. Available in: http://www.mayoclinic.com/health/breast-cancer/WO00095 [ Links ]
28. Swisher EM, Babb S, Whelan A, Mutch DG, Rader JS. Prophylactic Oophorectomy and Ovarian Cancer Surveillance: Patient Perceptions and Satisfaction. J Reprod Med. 2001;46:87-94. [ Links ]
29. Schildkraut JM, Thompson WT. Familial ovarian cancer: A population based case-control study. Am J Epidemiol. 1988;128:456-466. [ Links ]
30. Botella J. Nuestra experiencia sobre el cáncer de ovario. Acta Gin. 2001;58:143-150. [ Links ]
31. Schwartz MD, Kaufman E, Peshkin BN, Isaacs C, Hughes C, DeMarco T, et al. Bilateral prophylactic oophorectomy and ovarian cancer screening following BRCA1/BRCA2 mutation testing. J Clin Oncol. 2003;21:4034-4041. [ Links ]
32. King MC, Marks JH, Mandell JB. Breast and ovarian cancer risks due to inherited mutations in BRCA1 and BRCA2. Science. 2003;302:643-646. [ Links ]
33. González M, Larrain D, Figueroa M. ¿Se justifica la ooforectomía, como medida profiláctica en la disminución del riesgo del cáncer de ovario y mama, en las pacientes portadoras de mutaciones en los genes BRCA1 o BRCA2?. Rev Chil Obstet Ginecol. 2004;69:100-106. [ Links ]
34. Disaia PJ, Creasman WT. La masa anexial y el cáncer ovárico precoz. En: Disaia PJ, Creasman WT, editores. Oncología ginecológica clínica. 6ª edición. Madrid, Mosby; 2002. p. 259-288. [ Links ]
35. Reich H. Issues Surrunding Surgical Menopause. Indications and Propedures. J Reprod Med. 2001;46:297-306. [ Links ]
36. Loft A, Lidegaard O, Tabor A. Incidence of ovarian cancer after hysterectomy: A nationwide controlled follow up. BJOG. 1997;104:1296–1301. [ Links ]
37. Engeland A, Tretli S, Bjorge T. Height, body mass index, and ovarian cancer: A follow-up of 1.1 million Norwegian women. J Natl Cancer Inst. 2003;95:1244-1248. [ Links ]
38. Pavelka JC, Brown RS, Karlan BY, Cass I, Leuchter RS, Lagasse LD, et al. Effect of obesity on survival in epithelial ovarian cancer. Cancer. 2006;107:1520-1524. [ Links ]
39. Edmondson RJ, Monaghan JM. The epidemiology of ovarian cancer. Int J Gynecol Cancer. 2001;11:423-429. [ Links ]
40. Rieck G, Fiander A. The effect of lifestyle factors on gynaecological cancer. Best Practice & Research Clinical Obstetrics & Gynaecology. 2006;20:227-251. [ Links ]
41. Fang CY, Cherry C, Devarajan K, Li T, Malick J, Daly MB. A prospective study of quality of life among women undergoing risk-reducing salpingo-oophorectomy versus gynecologic screening for ovarian cancer. Gynecol Oncol. 2009;112:594-600. [ Links ]
42. Díaz A. La histerectomía supracervical como primera elección en la patología uterina benigna. Gac Méd Caracas. 1998;106:155-159. [ Links ]
43. Fogle RH, Chang L, Patel SK, Stanczyk FZ, Paulson RJ. Increased insulin-like growth factor-1 after oophorectomy in postmenopausal women. Fertil Steril. 2008;90:1236-1239. [ Links ]
44. Repasy I, Lendvai V, Koppan A, Bodis J, Koppan M. Effect of the removal of the Fallopian tube during hysterectomy on ovarian survival: The orphan ovary syndrome. E J Obstet Gynecol Rep. 2009;144:64-67. [ Links ]