Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Obstetricia y Ginecología de Venezuela
versión impresa ISSN 0048-7732
Rev Obstet Ginecol Venez v.69 n.4 Caracas dic. 2009
Marcadores para tamizaje de trisomías
Dr. Nelson Velásquez
Hospital Chiquinquirá de Maracaibo. La Universidad del Zulia, Maracaibo. Venezuela
Médico especialista II. Departamento de Reproducción Humana. Hospital Chiquinquirá Maracaibo. Venezuela.
Profesor Titular del Departamento de Obstetricia y Ginecología de La Universidad del Zulia, Maracaibo. Venezuela.
CORRESPONDENCIA: Dr. Nelson Velásquez. Calle 73. Entre Avenidas 3 G y 3 H. Residencias Vistana. Apartamento Nº3. Maracaibo.Venezuela. Teléfonos: CANTV: 0261-7910527 Celular: 0414 3603471 E-mail:. Nelsonjv@cantv.net
INTRODUCCIÓN
Las anormalidades del número de cromosomas incluyen aquellas en las que hay cromosomas extras como las trisomías (T), falta de un cromosoma o monosomías y las poliploidías en las que existen complementos cromosómicos anormalmente múltiples. En su mayor parte, las trisomías resultan de la no disyunción de los cromosomas envueltos, en las cuales hay un apropiado par de cromosomas, pero existe una falla en la separación durante la meiosis.
El riesgo de T aumenta con la edad, aunque también lo está en las adolescentes; la mayoría de las anormalidades severas acaban en pérdidas antes o inmediatamente después de la implantación, por lo cual, relativamente, se identifican pocas trisomías; por ejemplo la 16 se encuentra en el 16 % de los abortos del primer trimestre, por tanto nunca se ven en embarazo tardío. Las aneuploidías que sobrepasan el primer trimestre son las trisomías 13 (T 13), T 18 y T 21.
Una gran proporción de las malformaciones congénitas se asocia a alteraciones cromosómicas fetales.
La T 21, llamada síndrome de Down (SD) o mongolismo, descrita por el médico británico John Langdon Down en el año 1866 (1), es el más frecuente de los síndromes cromosómicos autosómicos; está presente entre 1/600 y 1/1 000 recién nacidos. Puede presentar malformaciones mayores como defectos en el corazón en el 30 %-40 % de los casos y atresia gastrointestinal. Los individuos afectados están a riesgo de leucemias y enfermedades del tiroides. El cociente de inteligencia va de 25-50 y pocos individuos lo superan; en la mayoría sus destrezas promedian 3-4 años menos que de la edad mental de personas normales de su misma edad. El fenotipo incluye: hipotonía, protrusión de la lengua, cabeza pequeña, puente nasal amplio, fisuras palpebrales oblicuas, orejas pequeñas subimplantadas con prominente antihélix, pliegues epicantales, la piel de la nuca es redundante, pliegue palmar transverso simple, curvatura hacia adentro del 5º dedo del pie (clinodactilia) debido a hipoplasia de las falanges media, amplia separación del mismo dedo. Las féminas son fértiles con probabilidad de tener un niño afectado del 30 %, pero muy pocos varones lo son.
Los cambios socioculturales pudieran estar relacionados con el aumento de frecuencia de estas alteraciones, porque existe tendencia en las sociedades con mayores niveles de desarrollo a reducir sus tasas de natalidad y propender a postergar el inicio de la maternidad hacia etapas más tardías de la vida de la mujer.
El hecho que relaciona la edad a la aparición de T 21, pudiera ser que en las mujeres de mayor edad, los cigotos han estado presentes en la primera división meiótica de la profase desde la vida fetal y a medida que envejecen hay más tendencia a que ocurra la no disyunción; la otra teoría es que los hábitos coitivos son más erráticos a edades extremas y esto puede conducir al aumento de la frecuencia de fertilización de los ovocitos más viejos, los que pudieran ser más frecuentes la no disyunción o aceptar espermatozoides anormales (2).
Uno de los mecanismos citogénicos de su aparición, parece ser aquel en el cual una pequeña porción del cromosoma 21 se triplica, especialmente la banda q22, que puede ser causada por la adición de un cromosoma entero o por añadidura de la banda q22, sola.
El 95 % tiene trisomía primaria, es decir, 47 cromosomas en vez de los 46 normales. La translocación más común en síndrome de Down envuelve los cromosomas 14 y 21.
En 1984 se encontró disminución de la α fetoproteína (AFP) en mujeres que parieron hijos con síndrome de Down. Cuatro años más tarde se añadió la cuantificación de hCG y del estriol no conjugado en sangre materna y la posibilidad de establecer el diagnóstico prenatal de la enfermedad se incrementó al 60 %; además se permitió la detección de trisomía 18, cuyas madres presentan bajos niveles de todos estos marcadores (2).
La T18 se conoce como síndrome de Edwards y ocurre en 1/8 000 nacimientos; gran parte de los afectados son femeninos, pero en los abortos y mortinatos la distribución sexual es igual; la mayoría de ellos mueren antes de la semana 10; los que nacen vivos de término, sólo el 10 % sobrevive 1 año. El 95 % presenta cardiopatía y los rasgos incluyen: microcefalia, occipucio prominente, pabellones auriculares rotados y malformados con apariencia de "orejas de ciervos", fisuras palpebrales cortas, boca pequeña, micrognatia. Las anomalías esqueléticas incluyen superposición de los dedos: 5º sobre el 4º, éste sobre el 3º, esternon corto, tórax en escudo, pelvis estrecha, limitación para la abducción de las piernas, dislocación congénita de la cadera, protrusión del calcáneo, "dedos en martillo", cierre espasmódico de los dedos. Sobreviven pocos meses después del nacimiento y los que lo hacen presentan retardo mental y del crecimiento. Aproximadamente el 8 % son causados por no disyunción (47, XX,+ 18 ó 47, XY,+ 18).
La T13, se llama síndrome de Patau y ocurre entre 1/7 000 a 1/20 000 nacidos vivos, con anomalías que pueden existir en cualquier órgano; sólo el 10 % sobreviven 1 año, y muy pocos lo hacen después de los tres años de edad; la mitad muere el primer mes de vida. Hay pronunciado retardo del crecimiento intrauterino y del desarrollo posterior. Los defectos cardíacos ocurren en el 80 %-90 % de los casos y la holoprosencefalia en el 70 %, se presentan con anomalías oculares (microftalmia, anoftalmía o coloboma), paladar hendido y labio leporino, hemangiomas en cara y cuello, baja implantación de las orejas y anomalías del hélix. La aplasia cutis y la polidactilia sugieren fuertemente T 13.
Usualmente está asociada a no disyunción primaria: 47 + 13 y al igual que T21 se relaciona con la edad materna, mientras tanto las translocaciones ocurren en menos del 20 % e invariablemente están asociadas con 2 grupos cromosómicos uniéndose en la región centromérica, translocaciones robersonianas y existe aumento del riesgo de recurrencias (3).
El estándar de oro para el diagnóstico prenatal de las trisonomías, continúa siendo la del cariotipo fetal (CF) obtenido de biopsia de las vellosidades coriales (BVC) en el embarazo temprano y/o de la sangre del cordón umbilical, por cordocentesis. Con la finalidad de disminuir la tasa elevada de falsas positivas y aproximarse al 98 % de los diagnósticos correctos, el resultado del estudio del cultivo de las células fetales debería prolongarse, en ocasiones a varias semanas.
En los últimos 20 años ha existido un rápido crecimiento de los métodos utilizados para la identificación de aquellos fetos con alto riesgo de presentar anomalías congénitas y en particular las trisomías 21, 18 y 13 (4). Se sospechaba que existía incremento de riesgo de SD o T21, en mujeres con embarazo en edades tardías.
Según la acepción de la Federación Internacional de Ginecología y Obstetricia (FIGO), una primigesta añosa o tardía es aquella cuyo primer embarazo ocurre a los 35 años o más (5). Para el año 1985 el 5,6 % de los embarazos en EE.UU ocurrió en mujeres de 35 años o más; para el 2002 se elevó a 12,5 % y se estima que para la fecha actual un poco más del 20.% de los embarazos ocurra en madres de 34 años, las que necesitarán métodos confiables para estimar riesgo de tener un feto con T 18 o T 21(6).
La frecuencia del SD en la población general es de 1 en 600 nacimientos; a la edad de 40 años asciende a 1 en 100; pero a los 45 años se presenta en 1 de cada 40 (2). Este hallazgo hizo que el Colegio Americano de Obstetras y Ginecólogos de Norteamérica recomendara que toda mujer embarazada de 35 años o más, debería realizarse una amniocentesis y en la actualidad muchas de estas pacientes son referidas al obstetra para este procedimiento, que no está exento de riesgos como la infección amniótica y el trabajo de parto pretérmino.
PRUEBAS BIOQUÍMICAS (Cuadros 1 y 2)

Desde los años 70 se ha utilizado la concentración materna sérica elevada de AFP como método de tamizaje de los defectos del tubo neural. Merckatz (7) fue quien notó que los embarazos complicados con SD presentaban bajos niveles de AFP en suero materno y más tarde se llegó a detectar un 30 % de los fetos afectados cuando se utilizaba la edad materna y la concentración baja de AFP, en múltiples de la mediana (MoM). Cuando se adicionó la determinación de la gonadotropina coriónica humana (hCG) y de estriol (E3) en sangre materna, se elevó la sensibilidad al 60 % en la población general; pero cuando se realiza en poblaciones de 35 o más años, la sensibilidad alcanza hasta 80 %, constituyéndose lo que se ha denominado triple marcador; aunque no hay acuerdo si se debe solicitar la molécula entera o las fracciones α o β de la hCG (8).
Posteriormente aparecieron datos para la adición del análisis de la inhibina-A (IA) como un nuevo ensayo que añadió un 5 % más de sensibilidad al marcador triple, es decir, hay un cuarto marcador, la inhibina-A. Ha sido por demás interesante que se ha podido disminuir la práctica de amniocentesis innecesarias, conservándose la posibilidad de que tengan fetos normales.
Las dos primeras pruebas utilizadas para la determinación de fetos de riesgo de SD en el suero de la mujer embarazada fueron: la determinación de la fracción libre de la β hCG y la proteína plasmática A asociada al embarazo (PAPP-A, por sus siglas en inglés); la primera, la β hCG tiende a estar elevada y la segunda deprimida. El promedio de hCG en SD ha sido estimado en 1,9 MoM y del PAPP-A de 0,44 MoM.
Cuando los dos métodos se utilizan juntos alcanzan una sensibilidad de 62 % para SD con una tasa de selección positiva de 5 %. Algunos prefieren utilizar el término de tamizaje positivo en lugar de falsas positivas cuando se describen este tipo de pruebas, ya que pudiere significar que el feto tiene un problema que se está investigando y que la prueba fue errónea; en el primer aspecto el término tiene una connotación más suave (9). Durante tres décadas se han utilizado como marcadores en suero materno: la AFP, hCG, estriol libre (E3l); este último y AFP se encuentran en bajas concentraciones en los casos de T21; mientras que la hCG se encuentra elevada. En el segundo trimestre la AFP y E3l son bajos; mientras que la β hCG y la IA están elevadas.
En el primer trimestre la PAPP-A parece ser más sensible, la β hCG es razonablemente sensible en las semanas 8-13 de gestación. Si se combinan las 2 pruebas la sensibilidad para detectar T21 es 60 % con tasa de falsa positiva de 5 % en poblaciones no seleccionadas de < 35 años de edad, hallazgos similares a los reportados para el trimestre medio cuando se usa AFP, hCG y E3l. La sensibilidad se incrementa a 75 %-80 % con igual porcentaje de falsos positivos en mujeres de 35 o más años de edad.
En los embarazos portadores de T 18 y T13 los niveles séricos maternos de β hCG y PAPP-A en el primer trimestre están disminuidos, mientras que los fetos con anormalidades cromosómicas la β hCG es normal, con PAPP-A baja (8). Existen controversias en si se considera útil sólo después de 15 semanas de gestación (10,11).
Estos marcadores se han estudiado en la orina y los resultados coinciden con los de suero materno; la β hCG libre y la fracción β-core están elevadas; mientras que el estriol está reducido en madres portadoras de fetos con SD (12).
MARCADORES ULTRASONOGRÁFICOS (Cuadro 3)
Desde hace algún tiempo la ultrasonografía ha sido una herramienta sensible para detectar malformaciones congénitas fetales; tiene el inconveniente de que como la sensibilidad aumenta a medida que lo hace la edad fetal, hay que esperar más allá del primer trimestre para obtener confiabilidad. Ahora se han introducido nuevas tecnologías que han mejorado las imágenes y han permitido ver más anomalías durante el primer trimestre, que son de mucha utilidad, evitando la realización de medidas invasivas, como la biopsia corial, amniocentesis o cordocentesis.
Varias imágenes ecosonográficas han sido utilizadas para tratar de incrementar las posibilidades diagnósticas de T, entre ellas las mediciones de: la translucencia nucal (TN), de los huesos nasales (HN), de la velocidad del flujo sanguíneo del ductos venosus (FDV), del ángulo facial fronto-maxilar (AFFM), la longitud corona-rabadilla (CRL), la frecuencia cardíaca fetal (FCF) y la observación de regurgitación tricuspídea (RT). Las 2 primeras han tenido mucha aceptación en la práctica clínica. Últimamente se hacen grandes esfuerzos para detectar anomalías cromosómicas con el uso de la ultrasonografía durante el primer trimestre del embarazo y han aparecido investigaciones con relación a la longitud del maxilar inferior, tamaño de las orejas, del fémur, del húmero, de la vejiga urinaria o de la arteria umbilical; además se ha estudiado la presencia de exomphalo, quistes de los plexos coroideos, pieloectasias, hiperecogenicidad cardíaca, volumen placentario y estudios con Doppler; todos estos aspectos se relacionan con anormalidades cromosómicas, pero cualquiera de éstas se presentan en fetos normales y ninguna de ellas por sí sola puede detectarlas.
Frecuencia cardíaca fetal
Usando la medición de la FCF, la TN y la edad materna en conjunto, Jauniaux y col. (13) reportaron un 83 % de sensibilidad con 5 % de falsas positivas, mucho más alta que cuando utilizaba FCF (26 %) o TN solos (72 %). Hyett y col. (14) reportaron un aumento significativo de FCF en fetos con T21, comparado con los normales durante el primer trimestre. Cuando se utilizó como normal cifras de 154 a 182 latidos por minuto a la 10ª semana y de 148 a 172 a la 13ª, en mujeres de edad avanzada y con antecedentes de defectos cromosómicos previos o riesgo aumentado de trastornos mendelianos, Martínez y col. (15), lograron aumentar la sensibilidad diagnóstica de TN sola, en los casos de T21 y T18 de 62,5 % a 75 % y de algunas otras cromosomopatías de 27,2 % a 81,8 %. Otros autores reportan aumento de la FCF en T13, T21 y síndrome de Turner y bradicardia en T18 y triploidías, aunque dudan de la utilidad que pudiera tener el uso de FCF en mejorar la sensibilidad diagnóstica (16). El uso de cuantificación de los latidos cardíacos fetales como marcador para cromosomopatías sigue siendo controversial (12).
Longitud corona-rabadilla
La mayoría de las anormalidades de los cromosomas sexuales y las T21 tienen desarrollo normal de su tamaño durante el primer y segundo trimestre, mientras que los que presentan T13 o T18 tienen una CRL más pequeña que lo esperado, así como también una tasa de crecimiento más lenta durante toda la gestación. Conociendo con exactitud la fecha del último período menstrual (UPM) el riesgo de aneuploidías fue 2,5 veces mayor en los embarazos con discrepancia entre la edad gestacional determinada por la longitud corona-rabadilla (CRL) y la calculada por UPM, que en los embarazos en los cuales, estos factores concordaron (17). Behado-Singh y col. (18), en una revisión de 144 fetos aneuploides encontraron un CRL muy corto en los fetos portadores de T21 y T13 y riesgo de aneuploidías en fetos que presentaban una diferencia más o menos de 14 mm entre lo esperado por CRL a las 12 semanas, comparado con los controles.
Cuando los embarazos excedan de 13 semanas y 6 días, una CRL de 84 o más mm debe ser ofrecida como un triple test y si el riesgo es mayor de 1/270 debe ofrecérsele una amniocentesis diagnóstica; si es normal o dudosa deberá realizarse estudios ecosonográficos entre 18-23 semanas (19,12).
Hay que señalar que aun cuando sea exacto el UPM se hace difícil saber si hay crecimiento restringido del feto y por tanto aneuplodías en el primer trimestre de la gestación, excepción hecha en los casos de reproducción asistida, en los cuales aunque el CRL es significativamente menor que lo esperado, es un test mucho mas apropiado para T13 y T18 que utilizar métodos más invasivos.
Flujo sanguíneo del "ductus venosus"
El "ductos venosus" (DV) es un vaso sanguíneo delgado que conecta la vena umbilical con la vena cava inferior durante la vida intrauterina y provee de sangre oxigenada al hígado. Penetra en la vena cava inferior antes de que entre en el atrium derecho; es uno de los 3 shunts fisiológicos en la que la sangre fetal pasa después de dejar la vena umbilical y constituye una parte del sistema de adaptación circulatoria a la vida intrauterina (12,21).
A las 20 semanas de gestación el 30 % de la sangre umbilical desvía al hígado a través del ductus venosus, pero a las 30-40 semanas disminuye al 20 %. La sangre bien oxigenada fluye directamente hacia el foramen oval mezclándose muy pobremente con sangre poco oxigenada de la vena cava inferior y suple órganos vitales, como el cerebro.
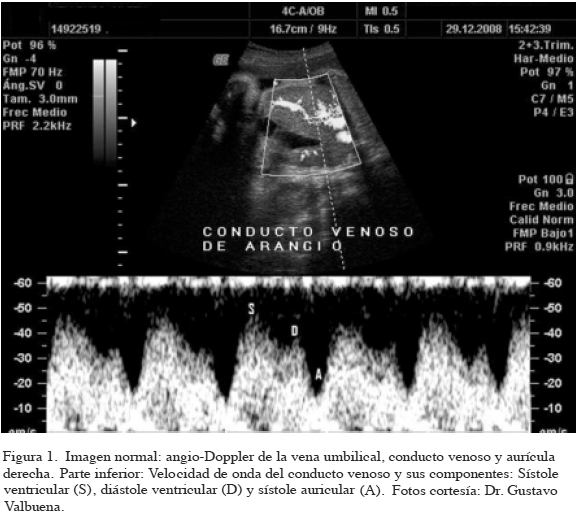
Los estudios de velocimetría con Doppler a color han demostrado 3 tipos de ondas, la S de sístole, la D de diástole y la A que corresponde a la contracción atrial; esta última es la más importante para diagnóstico (21).
Se realiza un corte medio-sagital ventral derecho del tronco fetal y usando Doppler a color se identifica el DV; el Doppler se coloca en la entrada al DV y se obtiene una clásica onda trifásica del FDV, que normalmente es dirigido hacia delante. Se considera anormal cuando desaparece o se hace flujo reverso durante la contracción atrial en la fase diastólica tardía, es decir, durante la onda A, la cual está asociada con otros defectos cardíacos mayores y regurgitación tricuspídea (22,23) (Figura 1).
La velocidad del flujo de ductos venosus ha sido considerada un nuevo marcador de tamizaje usado entre 11 a 13+6 semanas y se ha encontrado anormal en el 80 % de los fetos con T21 y en el 5 % de euploides (24); Matías (25) y col., han reportado flujo anormal en 90,5 % de las aneuploidías y 3,1 % de los fetos euploides, en las mismas semanas de gestación. Esta anormalidad en las ondas del flujo del ductus está presente en múltiples cardiopatías y aunque los estudios sugieren que tiene algún lugar en el diagnóstico de anomalías cromosómicas, faltan más estudios para su aplicabilidad en la población general.
Regurgitación tricuspídea
En toda paciente a quien se le realice ecograma del primer trimestre, debería buscarse si existe regurgitación de la válvula tricúspide, que está presente en una gran cantidad de defectos cardíacos mayores.
La RT se logra determinar, usando la onda del Doppler pulsado; para precisar su ausencia o presencia hay que obtener una visualización apical de las 4 cámaras cardíacas y luego aplicando el Doppler en la válvula tricuspídea e incluyendo al atrium y al ventrículo derechos, con ángulo menor de 30º a la dirección del flujo. Se determina la presencia de regurgitación a una velocidad mínima de 60 cm/s durante la mitad de la sístole (26). El ultrasonografista debe estar alerta de una falsa regurgitación que ocurre por encima de 50 cm/s causada por las arterias pulmonar o aórtica o por una "espiga reversa" causada por el cierre de la válvula tricuspídea. Usando RT han reportado 95 % de detección de T21 con 5 % de falsas positivas y del 90 % con falsa positividad en el 2 % (26).
Ha sido reportada en 70 % de los fetos con T21, 50 % en los T18 o T13 y sólo en el 5 % de los fetos normales, cuando se investigó entre 11- 13 + 6 semanas de gestación (23,27).
Ángulo facial frontomaxilar
El ángulo facial frontomaxilar se define como aquel situado entre dos líneas imaginarias que pasan por la superficie más superior de la mandíbula y la externa del hueso frontal. Mide más de 85º en el 69 % de los fetos con T21 y sólo es así en el 5 % de los normales (28). Esta promisoria medida ecosonográfica realizada entre las 11-13 semanas es utilizada más razonablemente con la finalidad de disminuir el porcentaje de falsas positivas y debe ser menor de 90º en los fetos sanos. Los estudios tridimensionales deberían proporcionar mejores datos, aun así, no existe relación entre esta medida, la CRL, NT o la presencia o ausencia de HN (20).
Hueso nasal
El hueso nasal inicia su osificación después de la semana 11 de vida intrauterina. Por ultrasonido debe ser analizado entre 11-13+6 días, mediante un corte medio sagital del feto que incluya solamente la cabeza, la porción superior del tórax y el eje longitudinal del hueso nasal, perpendicularmente al transductor ultrasónico, con ángulo de inclinación de 90º, moviendo el transductor hacia ambos lados con el fin de obtener imágenes exactas y visualizarse tres líneas ecogénicas; la piel sobre el puente nasal, el hueso y la piel de la punta de la nariz. La piel sobre el puente, por encima de la horizontal y paralelo al hueso constituye el "signo de igual", que debe ser detectado en la parte delantera de la frente. El hueso nasal es más grueso y ecogénico que la piel (29,30); su estimación por ecografía debe ser realizada por ecografistas experimentados y consume bastante tiempo. En las poblaciones de bajo riesgo la presencia o ausencia de hueso nasal es una herramienta insensible de cribaje de aneuploidías fetales; pero puede ser de mucha ayuda en las poblaciones de alto riesgo (Figura 2).
Normalmente, entre las 11 y 14 semanas de embarazo el 0,5 % de la población general gestante tiene sus fetos con ausencia de los HN; pero en las de alto riesgo para T21, el 73 % de los fetos, carecen de ellos (24,31). Nicolaides y col. (24), notaron la ausencia de huesos nasales en el 70 % de los fetos con T21 y en el 55 % de los que presentaron T13.
Es de hacer notar que hay variación raciales o de grupos étnicos en el tamaño de HN, durante el primer trimestre de gestación, siendo mayor en la blanca y más corta en los chinos (32). También ha sido reportada su ausencia común en las afrocaribeñas (33). En un estudio realizado en Francia, Weingertner y col. (34), no encontraron correlación entre el tamaño del hueso nasal y el grupo étnico materno.
En las mujeres cuyo riesgo se estimó como intermedio, (> de 1: 100 a 1: 1 000) Nicolaides y col. (24), reportaron que la presencia o ausencia de hueso nasal determinado en un segundo cribado mejoró el porcentaje de detección a 90 % con falsa positividad del 2 %-3 % ; de igual forma. Cicero y col. (30) expresan que debe ser realizado solamente en pacientes con riesgo intermedio, dependiendo de los resultados del análisis del primer trimestre y han calculado que si la presencia o ausencia del hueso nasal se añade a la investigación rutinariamente en el primer trimestre el porcentaje de detección de T21 podría alcanzar más del 95 % con falsa positividad de 5 % o del 90 % con falsa positiva de 2,5 % (35). La medida del hueso nasal es un excelente marcador ultrasonográfico para detectar T21 cuando es realizado por ultrasonografistas muy entrenados, alcanzando casi 100 % de sensibilidad con valor predictivo positivo de 13,6 y negativo del 99,6 %, disminuyendo las falsas positividades al 5 %; pero es de baja confiabilidad si se hace inadecuadamente en el primer trimestre para evaluar T21 en poblaciones no seleccionadas (34).
Translucencia nucal (Figura 2)
La TN se define como una colección de líquido en el tejido celular subcutáneo del cuello fetal que puede o no ser tabicado y abarcar el cuerpo entero fetal. Debe ser observada en el primer trimestre del embarazo y ecográficamente se presenta como un área sonoluscente (36). Para su medición, puede utilizarse la vía vaginal o abdominal. Se obtiene una imagen en posición neutral, de un corte sagital del feto a mayor aumento, que abarque la cabeza y el tórax superior. El cáliper debe ser colocado en el borde interno de la translucencia, entre el tejido blando de la columna vertebral y la piel, para medir el máximo grosor perpendicularmente al eje longitudinal del cuerpo fetal; hay que enfatizar que la membrana amniótica está separada de la piel fetal, para que no exista confusión. Se recomienda hacer varias medidas, tomando el máximo grosor para el análisis (37).
Fue descrita en 1985 por Benacerraf y col. (38), como un aumento del tejido blando en la parte posterior del cuello de fetos afectados por SD evaluados en el segundo trimestre del desarrollo mediante ecosonografía; pero el término fue introducido a la literatura médica por Nicolaides en 1992, quien lo evaluó durante el primer trimestre (36).
La medida del grosor de TN debe hacerse entre las semanas 11-13 + 6 de acuerdo con la fecha del UPM; si no hay este dato debe realizarse cuando la longitud corona-rabadilla esté entre 45 y 84 mm (39). Durante esta etapa del embarazo suelen observarse bien con ecosonografía otras anormalidades como acrania y anencefalias, se detectan las 4 cámaras cardíacas y la vejiga urinaria; también se logra alcanzar una posición neutral del feto, hay menos confusión con otras acumulaciones líquidas, se puede realizar la biopsia corial y es menos peligroso la evacuación uterina (40). Los valores se expresan en mediana y percentil porque la TN aumenta con CRL (39); los valores de la mediana y percentil 95 para CRL de 45 mm son 1,2 y 2,1 mm y para un CRL de 84 mm está entre 1,9 y 2,7 mm respectivamente; el valor del percentil 99 de TN no está influenciado por CRL y corresponde a 3,5 mm. Tampoco lo está por la raza, paridad, número de embarazos, diabetes controlada, fumar cigarrillos, género, sangrado del primer trimestre o uso de técnica de reproducción asistida (20).
Se ha reportado que la presencia de translucencia de la nuca está presente en el 4,5 % de los fetos cromosómicamente normales y en el 86,1 % de las T, cuando se midió entre 10-13 semanas de gestación, con medida considerada normal de al menos de 3 mm (41).
Aumento del grosor de la translucencia nucal entre 11 a 13 semanas ha sido asociado con un considerable incremento de efectos fetales adversos aun en ausencia de aneuploidías ya que puede estar presente en otras malformaciones o deformaciones, displasias, disrupciones o síndromes genéticos. La anomalía más comúnmente encontrada es la cardíaca. En la población general es de 5-8/ 1 000; pero si mide > 3,4 mm, se incrementa a 78/1 000. Otros tipos de anormalidades con o sin componente cardíaco asociados a TN son: hernias diafragmáticas, exomphalos, anormalidades de la parte final de la columna vertebral, defectos esqueléticos, síndromes de akinesia fetal, de Noonan, de Smith-Lemli-Opitz (una enfermedad metabólica causada por la mutación en el gen de 7-dehidrocolesterol-reductasa en el cromosoma 11, en el cual los afectados son incapaces de producir cantidades normales de colesterol) y atrofia de los músculos de la columna. Los defectos del tubo neural, holoprosencefalias, gastrosquisis y las anomalías renales no están asociados con TN aumentada y parece que tampoco existe relación con retardos mentales. Por otro lado, Souka y col. (42), manifiestan que una vez que se haya descartado las aneuploidías, el riesgo perinatal no está incrementado, hasta que la TN es de 3,5 mm o más, tal como lo señala un análisis de 27 publicaciones que alcanzaron 6.153 fetos con cariotipos normales que mostró riesgo de 7,3 % de anomalías (43). Además estos autores señalan que existe un riesgo exponencial de anormalidades mayores fetales a medida que aumenta el grosor; pero los fetos que sobreviven a los cuales se les evalúa entre 20-22 semanas y son ecosonográficamente normales, el riesgo de desarrollo posnatal no se incrementa significativamente (36).
No se debe confundir la medida del grosor de la translucencia nucal con la de su longitud, que aunque tiene cierta correlación con TN, no se usa en la detección de anormalidades cromosómicas (44). En pocas ocasiones una circular del cordón puede ser confundida con líquido en la nuca fetal (45).
Platt y col. (46) en un estudio patrocinado por The National Institute of Child Health and Human Development, conocido como Grupo de estudio BUN publicaron un análisis de 4 325 mujeres, originalmente eran 7 392, que previamente habían sido evaluadas con TN y bioquímica en el primer trimestre (hCG total, estriol no conjugado y AFP) con el objetivo de evaluar riesgo de T 21, hallaron que 4 145 tuvieron tamizaje negativo y 180 positivos (> 1:270).
Del total de 4 325 muestras negativas del primer trimestre, hubo 7 fetos con T21, 6 de las cuales fueron reveladas por las pruebas bioquímicas del segundo trimestre. Todos los 7 casos de T 21 que fueron positivos también fueron identificados por los análisis bioquímicos del 2º trimestre, pero con un porcentaje de selección positivas del 38 %. Este estudio demostró que al usar estos métodos juntos de esta manera, durante el primer y segundo trimestre, en forma secuencial, la sensibilidad es de 98 % en T 21 con porcentaje global de falsos positivos de 17 %, con punto de corte de 1:270 para T21 (46).
Existen razones para tratar de establecer metodologías poco invasivas, que permitan acercarse al diagnóstico prenatal de las trisomías, en particular para SD y en los últimos 10 años han emergido combinaciones de ellas; a saber: a) utilización de TN sola, con o sin evaluación de los huesos nasales, b) método combinado de TN y estudios bioquímicos del primer trimestre, c) método integrado que combina TN, marcadores bioquímicos del 1º y evaluación de 4 marcadores del 2º trimestre: hCH, E3, AFP e IA, utilizado en el estudio FASTER (siglas inglesas de First and Second Trimester Evaluation of Risk Trial) (47) y el más moderno el d) que utiliza marcadores de ambos trimestres de manera secuencial y TN.
La diferencia entre el método integrado con el secuencial es que en el primer caso se genera una sola figura de riesgo que se le informa a la paciente después de haber obtenido los resultados bioquímicos del segundo trimestre. En el segundo caso, secuencial, cada paciente obtiene 2 resultados uno al final del 1º trimestre y el otro al inicio del 2º y puede sopesar las 2 opciones al menos 2 y media semanas más temprano que en el integrado; mientras que la ventaja de este último es que es más sensitivo que el secuencial y genera menos falsos positivos.
El estudio FASTER (47), representa la evaluación de una población norteamericana, en la que se prueba la verdadera eficacia de la TN en el cual se utilizó una metodología estandarizada con personal entrenado para realizar las mediciones de TN, similar a los utilizados en el estudio BUN y en datos de Gran Bretaña (48).
Es clara la situación que la combinación de TN y marcadores bioquímicos del primer trimestre es mejor que la TN sola; pero aunque la sensibilidad aumente poco porcentualmente, desde el punto de vista de salud pública representa costos extras, porque amerita 2 procedimientos.
Aunque hay datos limitados en relación con la utilización de los métodos combinados, el estudio BUN de Wapner y col. (49) establecieron que con un punto de corte de 1/ 270 y porcentaje de 9 %, el 85 % de los fetos con SD deben ser diagnosticado con NT, β hCG y PAPP-A y que los datos publicados del estudio FASTER de 2003 muestran un 90 % de sensibilidad y porcentaje de tamizaje positivo del 14 % con NT, PAPP-P y β hCG (50).
Este mismo grupo reportó un estudio de tamizaje de SD en el primer trimestre realizado en 38 167 pacientes de las cuales hubo 117 fetos afectados y con falsas positivas del 5 % en las que la combinación de pruebas realizadas a las 11, 12 y 13 semanas obtuvieron 87 %, 85 %, 82 %, respectivamente; con el estudio secuencial obtuvieron el 95 %, con el integrado 88 % y con el completamente integrado y medidas realizadas en la semana 11 el 96 % de positividad. Cuando se hizo comparación estadística hubo diferencias significativas, excepto para el tamizaje integrado y el combinado; concluyendo que el cribado combinado a las 11 semanas es mejor que el cuádruple marcador del segundo trimestre, pero que a las 13 los resultados son similares y que ambos métodos el secuencial y completamente integrado tienen alto porcentaje de detección de SD con bajas tasas de falsos positivos (51).
Con menor proporción que las técnicas ultrasonográficas descritas, otras modalidades han sido utilizadas para detectar anomalías cromosómicas, e incluyen: acranias, excencefalias/anencefalias, encefalocele, hidrocefalias y holoprosencefalias en el sistema nervioso central, defectos cardíacos como septos atrioventriculares, "ectopia cordis", isomerismo de la aurícula izquierda e hipoplasia del ventrículo derecho que se observan con relativa facilidad en el primer trimestre y cuando se asocian a TN son bastante sensitivos. Los defectos de tubo digestivo y de la pared abdominal pueden ser diagnosticados en el primer trimestre; pero algunos pueden traer confusiones como las hernias que se parecen a la herniación fisiológica del intestino medio que puede ser normal hasta la semana 12 y el onfalocele que se no observa hasta las 12 semanas o antes de que el feto tenga un CRL de 45 mm; la gastrosquisis se puede diagnosticar por ecografía transabdominal o transvaginal en el primer trimestre. Los riñones y la vejiga urinaria se pueden observar durante la semanas 11 y 12, pero la enfermedad poliquística renal a veces se observa en embarazos de mayor duración. El higroma quístico se identifica con facilidad en el primer trimestre, se asocia a aneuploidías y muerte fetal intrauterina, a diferencia de TN, ellos son tabicados y de gran tamaño (52-55). Algunas de las malformaciones renales del sistema nervioso central se asocian al síndrome de Meckel-Gruber, que es un trastorno autosómico-recesivo caracterizado por una combinación de quistes renales y rasgos que incluyen anomalías del sistema nervioso central- típicamente encefalocele, displasia quística-ductal hepática y polidactilia (55).
Algunas pacientes de edades avanzadas quieren saber con exactitud que su feto no presenta SD y ellas preferirán la utilización de la amniocentesis; otras sobrepesarán los riesgos, exigirán mayor información sobre las técnicas no invasivas disponibles y si el riesgo es desproporcionado declinarán de la amniocentesis.
La meta que se pretende alcanzar con la metodología no invasiva para la detección precoz de las madres portadoras de T 21 es la limitación de técnicas invasivas, como la biopsia de vellosidades coriales, la amniocentesis y la cordocentesis y ofrecerles la confianza necesaria para que sepan que éstas son muy seguras y de más bajo riesgo.
TÉCNICAS NO INVASIVAS DEL PRIMER TRIMESTRE
Basados en el hallazgo frecuente de células de origen fetal en la sangre materna circulante, en los últimos años se ha intentado aislarlas para tratar de investigar la presencia de aneuploidías. Se han encontrado linfocitos, granulocitos, eritroblastos (células rojas nucleadas, de alta transferencia placentaria), células del cito y sincitiotrofoblasto. Estas últimas no son utilizadas para diagnóstico prenatal porque no expresan antígeno HLA I y II, no inducen respuesta inmunológica materna y pueden permanecer en la sangre materna por mucho tiempo, lo que trae confusiones ya que se pudiesen estar analizando las de previos embarazos (56,57). Los glóbulos blancos, tampoco son buenos porque pasan en pocas cantidades a la placenta; mientras que los rojos abundan y tiene vida corta, reduciendo el riesgo de que se analicen los de embarazos anteriores al actual, se aíslan fácilmente, están presentes a la semana 10, constituyendo una buena fuente de análisis (58).
Cuando la cantidad es pequeña se pueden utilizar técnicas de enriquecimiento celulares o de clasificación, como la de fluorescencia activada (FACS), células magnéticas activadas (MACS), flujo de cargas para separación (CFS), la reacción en cadena de la polimerasa (PCR) y técnicas de hibridización in situ fluorescentes; con esta última se ha reportado un 97 % de éxito, con 13 % de falsas positivas (59).

Células fetales en cuello uterino
Las células fetales pueden ser recogidas por lavado uterino o endocervical, cepillos cervicales o aspiración del moco y también pueden enriquecerse por técnicas similares a como se realiza en las maternas; se ha aplicado entre las 6 y 13 semanas (60). La calidad de las células recolectadas es un factor limitante; cuando es buena, hay alto porcentaje diagnóstico, sin embargo, este método es poco confiable (61).
DNA de células fetales en sangre materna y DNA fetal libre en sangre materna
Las técnicas para la obtención y manipulación de células fetales en sangre materna son costosas, engorrosas y no son altamente confiables, por lo cual se ha tratado de analizar el DNA fetal que circula libremente en la sangre materna, que ha podido ser detectado a los 32 días de gestación, alcanzando el 6 % del total de DNA circulante al tercer trimestre (62). Este método que ha sido utilizado para la determinación del sexo, con casi el 100 % de exactitud (63,64) puede ser usado para diagnosticar los trastornos genéticos ligados al cromosoma X (65).
Costa y col. (65), analizaron suero de 129 mujeres entre 10-13 semanas de embarazo con mucho riesgo de este tipo de afección e identificaron correctamente a 70 fetos machos y 50 femeninos. Otros estudios se han realizado con el fin de diagnosticar hemofilia, distrofia muscular, retardo mental ligado al cromosoma X, síndrome de Alports, deficiencia de 21 hidroxilasa, para determinar pacientes Rh negativos, aunque a la fecha todavía se considera como un método de investigación (12).
Una técnica que puede identificar DNA fetal, que había sido un obstáculo para distinguirlo del DNA materno ha sido ensayada y publicada recientemente por Dhallan y col. (66), usando un simple polimorfismo de nucleótidos, y determinar el número de cromosomas fetales presentes en sangre materna. Analizaron 57 muestras de sangre de padre y madre de embarazadas normales y de tres embarazadas con fetos con SD, utilizando el tratamiento con formaldehído y las muestras maternas cuantificadas como múltiples polimorfismos de simples nucleótidos. La cantidad de DNA fetal libre en las muestras fue variable con promedio de 34 %, pero muy bajo en el primer trimestre. La amniocentesis realizada a los recién nacidos fue correctamente determinada en 58 de 60 muestras, identificando 56 de 57 muestras normales y 2 de 3 muestras con T21; lo que se tradujo en 1 falsa negativa y una falsa positiva, con sensibilidad y valor predictivo positivo de 6 % y un valor predictivo negativo de 98,2 %. Aunque la muestra fue pequeña se piensa que podría ser utilizada en conjunción con otros métodos de tamizaje como TN, bioquímica y ecosonogramas genéticos.
Más recientemente fue publicado un estudio de revisión bibliográfica en el cual se revelan métodos de enriquecimientos físicos y moleculares de ácidos nucleicos del plasma materno, que incluyeron uso de fraccionamiento del DNA plasmático, tratamiento con formaldehído y uso de PCR digital, concluyendo que después de 10 años de estudios se ha podido detectar aneuploidías por este tipo de estudio; es decir, del análisis de nucleótido plasmáticos de sangre materna, y que se espera que se desarrollen marcadores de DNA y RNA como nuevos métodos analíticos, para detectar mayor número de aneuploidías que puedan ser utilizadas en la práctica rutinaria en el futuro cercano (67,68).
ADAM 12
La desintegrina A y la metaloproteasa 12 (ADAM 12), pertenecen a una familia de más de 30 proteínas de la superfamilia de la metzincina, de las proteasas dependientes de zinc; en los humanos se expresa en 2 formas, ensambladas. La forma corta, soluble (ADAM 12-S) se halla en suero y la forma larga (ADAM12-L) que es una proteína transmembrana. ADAM 12 se sintetiza como un zimógeno en la placenta y se consigue en la sangre de la mujer embarazada, tiene actividad proteolítica en contra de la proteína de unión del factor de crecimiento parecido a la insulina 3 y 5 (IGFBP 3,5). La proteolisis ocasionada a la IGFBP estimula el crecimiento fetal aumentando los niveles del factor de crecimiento parecido a la insulina 1 y 11 (IGF 1,11) (69,70).
En 2006, Laigaard y col. (71), establecieron que las glicoproteínas placentarias, desintegrina A y la metaloproteasa 12 (ADAM 12), están reducidas en el primer trimestre de las madres embarazadas portadoras de SD y síndrome de Edward; pero el grado de esta reducción disminuye a medida que avanza el embarazo. Examinaron los niveles de ADAM 12 entre 9-12 semanas, utilizando 16 casos de SD y 2 síndrome de Edward, mediante una prueba semiautomática de inmunofluorometría y encontraron que la mediana en SD fue de 0,94 MoM con rango de 10 a 90 percentil de 0,22 a 1.63 MoM comparado con 1 y 0,33 a 2,24 MoM en los no afectados que sirvieron de controles. Los 2 casos de síndrome de Edward tuvieron valores de 0,31 y 2,17 MoM, concluyeron que el ADAM 12 no puede ser usado actualmente con otros marcadores en la parte lejana del primer trimestre; sin embargo, pudieran ser evaluados en el primero junto con otros marcadores o en protocolos secuenciales (71). Más tarde este mismo grupo encontró reducción significativa en suero de madres portadoras de fetos con SD y que al ser medido con PAPP-A entre 8-9 semanas y con TN y β hCG libre entre 11-12 semanas, podía alcanzar detección de 97 % con 5 % de falsas positivas (72).
Cuando utilizaron PAPP-A y ADAM 12 solos entre 8-9 semanas pudieron identificar el 91 % de los casos, con 5 % de falsas positivas; creen que su uso es eficiente en SD, aumentando la eficiencia su uso secuencial en el primer trimestre, además puede ser beneficioso en aquellos lugares en los que exista baja calidad de los estudios de ultrasonido (72). Posteriormente, Christiansen y col. (73) lo utilizaron en el segundo trimestre (14-19 semanas), en 88 mujeres con fetos portadores de SD y 343 embarazadas que sirvieron como controles e hicieron correlación con AFP, βhCG libre; encontraron que ADAM 12 estaba significativamente aumentada en SD, con una mediana de 1,85 MoM y un logaritmo medio de 0,268 MoM comparado con los controles
normales en las que se obtuvo un logaritmo medio de 0,013. Además ADAM 12 se correlacionó con raza (mayor en afrocaribeñas) y peso materno; pero no con la edad materna o gestacional y marginalmente con AFP y βhCG. Concluyeron que el uso de ADAM 12 tiene valores similares al de E3 cuando se aplica en el doble test, y lo consideran método eficiente para SD en el segundo trimestre.
Cocciolone y col. (74), utilizando un método de fase sólida, llamado AutoDELFIA/DELFIA ADAM 12, analizaron retrospectivamente sueros congelados, almacenados durante 2 años, de 47 madres del primer trimestre y 27 del segundo, afectadas de SD y comparado con 306 muestras normales. Sesenta muestras que habían resultado falsas positivas también se analizaron para ver si ADAM 12 era capaz de reducir las falsas positivas y encontraron que ADAM 12 fue reducida significativamente en los afectados en el primer trimestre y elevados en el segundo, mostrando una reducción del 36 %-40 % de los casos no afectados; concluyeron que añadir ADAM 12 como marcador sérico del 1º y 2º trimestre para SD, reduce las falsas positivas, mejorando su detección.
Desde la primera publicación del síndrome conocido como síndrome de Down en 1866 se ha tratado de encontrar métodos confiables para su detección precozmente durante la gestación y existen grandes adelantos al respecto, simples, complejos, bioquímicos, morfológicos y genéticos; aunque con alta sensibilidad, la especificidad no alcanza al porcentaje ideal. Se esperan nuevos avances.
REFERENCIAS
1. Langdon Down J. Observation on a ethnic classification of idiots. Clin Lectures and Reports, London Hospital. 1866;3:259-262. [ Links ]
2. Manipalviratn S, Trivax B, Huang A. Genetic disorders & sex chromosome abnormalities. En: DeCherney AH, Nathan L, Goodwin TM, Laufer N, editores. Current diagnosis & treatment obstetrics & gynecology. Nueva York, McGraw; 2007. p. 95-125. [ Links ]
3. Simpson JL. Genetic counseling and prenatal diagnosis. En: Gabbe S, Niebyl JR, Simpson JL, editores. Obstetrics: Normal and problem pregnanccies. 4ª edición. Nueva York, Curchill Livingstone; 2002. p. 187-219. [ Links ]
4. Nicolaides KH. First trimestre screening for Down´s Syndrome. N Engl J Med. 2004;350:619-621. [ Links ]
5. Zighelboin I, Uzcátegui O. Reproducción en edades extremas. En: Zighelboim I, Guariglia D. Clínica Obstétrica. 2ª. edición. Caracas, Disinlimed, CA; 2005. p. 529-534. [ Links ]
6. Hobbins JC. Contemporary prenatal diagnosis. Ob/Gyn Clinical Alert. 2005;22:5-8. [ Links ]
7. Merckatz IR, et al. An association between low maternal serum alpha-fetoptritein and fetal chormosomal abnormalities. Am J Obstet Gynecol. 1984;148:866-894. [ Links ]
8. Spencer K, Tul N, Nicolaides KH. Maternal serum free beta hCG y PAPP-A in fetal sex chromosome defects in the first trimester. Prenat Diagn. 2000;20:390-394. [ Links ]
9. Hobbins JC. Non-invasive approach to prenatal diagnosis. Ob/Gyn Clinical Alert 2004; 21: 5-8. [ Links ]
10. Sherer D M, Bombard A T, Kellner L H, Divon M Y. Noninvasive first-trimester screening for fetal aneuploidy. Obstet Gynecol Surv. 1997;52:123-129. [ Links ]
11. Canick JA, Kellner LH. First trimestre screening for aneuploidy: Serum biochemical markers. Semin Perinatol. 1999;23:359-368. [ Links ]
12. Ndumbe FM, Navti O, Chilaka VN, Konje JC. Prenatal diagnosis in the first trimestre of pregnancy. Obstet Gynecol Surv. 2008;63:317-328. [ Links ]
13. Jauniaux E, Gavrill P, Khun P, et al. Fetal heart rate and umbilico-placental Doppler flow velocity waveforms in early pregnancies witrh a chromosomal abnormality and/or increased nucheal translucency thickness. Human Reprod. 1996;11:435-439. [ Links ]
14. Hyett J, Noble PL, Snijders RJM, Montenegro N, Nicolaides KH. Fetal heart rate in trisomy 21 and other chromosoma abnomalities at 10-14 weeks of gestation. Ultrasound Obstet Gynecol. 1996;7:239-244. [ Links ]
15. Martínez JM, Echevarria M, Borrell A, Puerto B, Ojuel J. Fetal heart rate and nuchal translucecncy in detecting chromosomal abnormalities other than Down´s syndrome. Obstet Gynecol. 1998;92:68-71. [ Links ]
16. Liao AW, Snijders R, Geerts L, Spencer K, Nicolaides KH. Fetal heart rate in chromosomally abnormal fetuses. Ultrasound Obstet Gynecol. 2000;16:610-613. [ Links ]
17. Drugan A, Johnson MP, Isada NB, Holzgreve W, Zador IE, Dombrowski MP, et al. The smaller than expected first trimestre fetus is at increased risk for chromosome anomalies. Am J Obstet Gynecol. 1992;167:32-1525-1528. [ Links ]
18. Behado-Singh RO, Lynch L, Deren O, Morroti R, Copel JA, Mahoney MJ, et al. First trimestre aneuploidy and gestacional age. Am J Obstet Gynecol. 1997;176:976-979. [ Links ]
19. Rozenberg P, Brussiere I, Chevret S, Bernard JP, Malagrida L, Cuckle H, et al. Screening for fetal Down syndrome using frist-trimester combined screening followed by second-trimester ultrasound examination in an unselected population. Am J Obstet Gynecol. 2006;195:1379-1387. [ Links ]
20. Canda MT, Demir N. Contemporary screening in pregnancy. J Turkish-German Gynecol Assoc. 2007;8:332-338. [ Links ]
21. Kiserud T. Ductus venosus. En: Maulik D, editor. Doppler ultrasound in obstetrics and gynecology. Berlín, Springer-Verlag; 2005:28:413-427. [ Links ]
22. Toyama JM, Brizot ML, Liao AW, Lopez RMY. Ductus venosus blood flow assessment at 11 to 14 weeks of gestation and fetal outcome. Ultrasound Obstet Gynecol. 2004;23:341-345. [ Links ]
23. Faiola S, Tsoi E, Huggon JC, Allan KH. Likelihood ratio for trisomy 21 in fetuses with tricuspid regurgitation at the 11-13+6 weeks scan. Ultrasound Obstet Gynecol. 2005;26:22-27. [ Links ]
24. Nicolaides KH, Spencer K, Avgidou K, Faiola S, Falcon O. Multicenter study of first-trimester screening for trisomia 21 in 75 821 pregnancies. Results and estimation of the potential impact of individual risk-orientated two-stage first-trimester screening. Ultrasound Obstet Gynecol. 2005;25:221-226. [ Links ]
25. Matias A, Gomes C, Flack N, Montenegro N, Nicolaides KH. Screening for chromosomal abnormalities at 10-14 weeks: The role of ductos venosus blood flow. Ultrasound Obstet Gynecol. 1998;12:380-384. [ Links ]
26. Falcon O, Auer M, Gerovassilli A, Spencer K, Nicolaides KH. Screening for trisomia 21 by fetal tricupid regurgitation, nuchal translucency and maternal serum free B-hCG and PAPP-A at 11+0 to 13+6 weeks. Ultrasound Obstet Gynecol. 2006;27:151-155. [ Links ]
27. Nicolaides KH. First- trimestre screening for chromosomal abnormalities. Semin Perinatol. 2005;29:190-194. [ Links ]
28. Plascencia W, Dagklis T, Sotiriadis A, Borestein M, Nicolaide KH. Frontomaxillary facial angle at 11+0 to 13+6 week´s-gestation reproducibility of measurements. Ultrasound Obstet Gynecol. 2007;29:18-21. [ Links ]
29. Sonek JD, Cicero S, Neiger S, Nicolides KH. Nasal bone assessment in prenatal screening for trisomy 21. Am J Obstet Gynecol. 2006;195:1219-1230. [ Links ]
30. Cicero S, Avgidou K, Rembouskos G, Kogam KO, Nicolaides KH. Nasal bone in the first-trimester screening for trisomy 21. Am J Obstet Gynecol. 2006;195:109-114. [ Links ]
31. Malone FD, Ball RH, Nyberg DA, Comstock CH, Saade G, Berkowitz RL, et al. First trimestre nasal bone evaluation for aneuploidy in the general population. Obstet Gynecol. 2004;104:1222-1228. [ Links ]
32. Collado F, Bombard A, Li V, Julliard K, Aptekar L, Weinr Z. Ethnic variation of fetal nasal bone length between 11-14 week´s gestation. Prenat Diagn. 2005;25:690-692. [ Links ]
33. Cicero S, Rembouskos G, Vandecruys H, Hogg M, Nicolaides KH. Likehood ratio for trisomy 21 fetuses with absent nasal bone at 11-14 weeks of gestation. Ultrasound Obstet Gynecol. 2004;23:218-223. [ Links ]
34. Weingertner AS, Kohler M, Firtion C, Vayssière C, Favre R. Interest of foetal nasal bone measurement at first trimestre trisomy 21 screening. Fetal Diagn Ther. 2006;21:433-438. [ Links ]
35. Cicero S, Spencer K, Avgidou K, et al. Maternal serum biochemestry at 11-13+6 weeks in relation to the presence or absence of the fetal nasal bone on ultrasonography in chromosomally abnormal fetuses: An updated analisis of integrated ultrasound and biochemical screening. Prenat Diagn. 2005;25:977-983. [ Links ]
36. Nicolaides KH, Azar G, Byrne, Manzur C, Marks K. Fetal nuchal translucency: Ultrasound screening for chromosomal defects in the first trimestre of pregnancy. BMJ. 1992;304:867-869. [ Links ]
37. Nicolaides KH. Nuchal translucency and others first-trimester sonographic markers of chromosomal abnormalities. Am J Obstet Gynecol. 2004;191:45-67. [ Links ]
38. Benacerraf BR, Frigoletto FD, Laboda LA. Sonographic diagnosis of Down syndrome in the second trimestre. Am J Obstet Gynecol. 1985;153:49-52. [ Links ]
39. Snijders RJ, Noble P, Sebire N, Souka A, Nicolaides KH. UK multicentre project on assessment of risk trisomy 21 by maternal age and fetal translucency thickness at 10-14 week of gestation. Fetal Medicine Foundation First Trimester Screening Group. Lancet. 1998;352:343-346. [ Links ]
40. Nicolaides KH. Nuchal translucency and others first-trimester sonographic markers of chromosomal abnormalities. Am J Obstet Gynecol. 2004;191:45-67. [ Links ]
41. Nicolaides KH, Brizot ML, Snijders RJM. Fetal translucency; ultrasound screening for fetal trisomy in the first trimester of pregnancy. Br J Obstet Gynaecol. 1994;101:782-786. [ Links ]
42. Souka A, von Kaisenberg C, Hyett J, Sonek K, Nicolaides K. Increased nucal translucency with normal karyotype. Am J Obstet Gynecol. 2005;192:1005-2021. [ Links ]
43. Hobbins JC. Increased nucal translucency with normal karyotype. Abstract and commentary. Ob/Gyn Alert 2005;22:20-21. [ Links ]
44. Molina FS, Avgidou K, Kagan KO, Poggi S, Nicolaides KH. Cystic higromas, nuchal edema, and nuchal translucency at 11-14 weeks of gestation. Obstet Gynecol. 2006;107:678-683. [ Links ]
45. Schaefer M, Laurichesse-Delmas H, Ville Y. The effect of nuchal translucency measurement at 10-14 weeks. Ultrasound Obstet Gynecol. 1998;11:271-273. [ Links ]
46. Platt LD, Greene N, Johnson A, Zachary J, Thom E, Krantz D, et al. Sequential pathways of testing after first-trimester screening for trisomy 21. Obstet Gynecol. 2004;104:661-666. [ Links ]
47. Simpson JL. Choosing the best prenatal screening protocol. NEJM. 2005;353:2068-2070. [ Links ]
48. Hobbins JC. Non-invasive prenatal diagnosis screening. Abstract & Commentary Ob/Gyn Clin Alert. 2005;21:89-90. [ Links ]
49. Wapner R, Tom E, Simpson JL, Pergament E, Silver R, Filkins K, et al. First-trimester screening for trisomies 21 and 18. N Engl J Med. 2003;349:1405-1413. [ Links ]
50. Malone FD, Wald NJ, Canick JA, Ball RH, Nyberg DA. First-and second- trimestre evaluation of risk (FASTER) trial: Principal results of the NICHD multicenter Down syndrome screening study. Abstract No. 1. Am J Obstet Gynecol. 2003;189(6 Suppl):56. [ Links ]
51. Malone FD, Canick JA, Ball RH, Nyberg DA, Comstock CH, Bukowski R, et al. First-trimester or second-trimester screening, or both, for Down´s Syndrome. N Engl J Med. 2005;353:2001-2011. [ Links ]
52. Chatzipapas IK, Whitlow BS, Economides DL. The diagnosis of anencephaly in early pregnancy: The "Mickey Mouse" sign. Ultrasound Obstet Gynecol. 1999;13:196-200. [ Links ]
53. Becker R, Werner RD. Detailed screening for fetal anomalies and cardiac defects at the 11-14 weeks scan. Ultrasound Obstet Gynecol. 2006;27:613-618. [ Links ]
54. Fong KW, Toi A, Salem S, Hornberget LK, Chitayat D, Keating SJ, et al. Detection of fetal structural anomalies with US during early pregnancy. Radiographics. 2004;24:57-174. [ Links ]
55. Fraser FC, Lytwyn A. Spectrum of anomalies in the Meckel syndrome, or: ¡Maybe there is a malformation syndrome with at least one constan anomaly!. Am J Med Genet. 1981;9:67-73. [ Links ]
56. Simpson JL, Elias S. Isolating fetal cells in maternal circulation for prenatal diagnosis. Prenat Diagn. 1994;14:1229-1242. [ Links ]
57. Adinolfi M. On a nonivasive approach to prenatal diagnosis base don the selection of fetal nucleated cell in maternal blood samples. Prenat Diagn. 1991;11:799-804. [ Links ]
58. Adinolfi M. Non- or minimally invasive prenatal diagnostic. Tests on maternal blood samples or transcervical cells. Prenatal Diagn. 1995;15:889-896. [ Links ]
59. Al-Mufti R, Hambley H, Farzaneh F, Nicolaides KH. Investigation of maternal blood enriched for fetal cells: Role in screening and diagnosis of fetal trisomies. Am J Med Genet. 1999;85:66-75. [ Links ]
60. Adinolfi M, Sherlock J, Tutsheck B, Halder A, Delhanty J, Rodeck C. Detection of fetal cells in transcervical samples and prenatal diagnosis of chromosomal abnormalities. Prenat Diagn. 1995;15:943-989. [ Links ]
61. Overton TG, Lighten AD, BChir NM, Bennett PR. Fetus-placenta-newborn: Prenatal diagnosis by minimally invasive first-trimester transcervical sample is unreliable. Am J Obstet Gynecol. 1996;175:382-387. [ Links ]
62. Moise KJ. Fetal RhD typing with free DNA in maternal plasma. Am J Obstet Gynecol. 2005;192:663-665. [ Links ]
63. Lion JD, Pao CC, Horr JJ. Fetal cells in maternal circulation during first trimestre pregnancies. Hum Genet. 1993;92:309-311. [ Links ]
64. Lion JD, Hsieh TT, Pao CC. Presence of cell of fetal origin in maternal circulation of pregnant women: Fetal cell in maternal blood. En: Simpson JC, Elias S, editores. Prospect of non-invasive prenatal diagnosis. Nueva York, Academy of science; 1994. p. 237-241. [ Links ]
65. Costa JM, Benachi A, Gautier E. New strategies for prenatal diagnosis of X-linked disorders. N Engl J Med. 2002;346:1502. [ Links ]
66. Dhallan R, Guo X, Emche S, Damewood M, Bayliss P, Cronin M, et al. A noninvasive test for prenatal diagnosis based on fetal DNA present in maternal blood: A preliminary study. Lancet. 2007;369:474-481. [ Links ]
67. Dennis Lo YM, Chiu RWK. Noninvasive prenatal diagnosis of fetal chrosomal aneuploidies by maternal plasma nucleic acid analisis. Lancet. 2007;369:474-481. [ Links ]
68. Dennis Lo YM, Chiu RWK. Review. Noninvasive prenatal diagnosis of fetal chrosomal aneuploidies by maternal plasma nucleic acid analysis. Clin Chem. 2008;54:461-466. [ Links ]
69. Wewer UM, Mörgelin M, Holck P, Jacobsen J, Lyndolph MC, Johnsen AH, et al. ADAM 12 is a Four-Leafed Clover, the exised prodomains bound to the mature enzyme. J Bio Chem. 2006;281:9418-9422. [ Links ]
70. Shi Z, Xu W, Loechel F, Wewer UM, Murphy LJ. ADAM 12, a Desintegrin metalloprotease, interacts with insuli-like growth factor-binding protein-3. J Bio Chem. 2000;273:18574-18580. [ Links ]
71. Laigaard J, Cuckle H, Wewer UM, Christiansen M. Maternal serum ADAM 12 levels in Down and Edward syndrome pregnancies at 9-12 weeks gestation. Prenatal Diag. 2006;26:689-691. [ Links ]
72. Laigaard J, Spencer K, Christiansen M, Cowans NJ, Larsen SO, Pedersen BN, et al. Adam 12 as a first-trimester maternal serum marker in screening for Down syndrome. Prenat Diagn. 2006;26:973-979. [ Links ]
73. Christiansen M, Spencer K, Laigaard J, Cowans NJ, Larsen SO, Wewer UM. ADAM 12 as a second-trimester maternal serum marker in screening for Down syndrome. Prenat Diag. 2007;27:611-615. [ Links ]
74. Cocciolone R, Bird R, Martin E, Penhall D, Raniolo L. ADAM 12 a promising new maternal serum marker in screening for Down syndrome in both first and second trimestres of pregnancy. South Australian Maternal Serum Antenatal Screening (SAMSAS) Program Department of Genetic Medicine, Women´s and Children Hospital, Adelaide. Abstracts for the 32nd Human Genetics Society of Australasia Annual Scientific Meeting. Human Genetic in Australia. Jozef Gecz, Guest editor. 2008.p.431-473. [ Links ]