Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Obstetricia y Ginecología de Venezuela
versión impresa ISSN 0048-7732
Rev Obstet Ginecol Venez v.70 n.3 Caracas sep. 2010
Tratamiento quirúrgico de la menopausia, un modelo experimental
Drs. Ramón Rafael Guevara Marín*, Mireya González Blanco**, Ilenia Virgilii*
* Médicos especialistas en Obstetricia y Ginecología,
** Jefa del Servicio de Ginecología y Directora del Curso de Especialización en Obstetricia y Ginecología de la Universidad Central de Venezuela, Hospital Maternidad "Concepción Palacios". Caracas-Venezuela
CORRESPONDENCIA:
(maternofetalmedicine@hotmail.com)
RESUMEN
Objetivo: Evaluar la utilidad de los implantes subcutáneos de tejido ovárico autólogo criopreservado como tratamiento hormonal en ratas con menopausia inducida quirúrgicamente.
Métodos: Estudio experimental, aleatorio y controlado. Se estudiaron 14 ratas Sprague Dawnley, divididas en dos grupos. Se realizó ooforectomía en el grupo control y ooforectomía más criopreservación del tejido ovárico en el grupo estudio. Un mes posooforectomía se realizó implante subcutáneo autólogo del tejido criopreservado al grupo estudio. Las concentraciones de estradiol fueron determinadas basal, posooforectomía y posimplante en ambos grupos. Se realizó citología vaginal diaria.
Ambiente: Cátedra de Reproducción Humana de la Universidad Simón Bolívar y Maternidad "Concepción Palacios".
Resultados: Se logró reestablecer las concentraciones de estradiol a las existentes previo a la ooforectomía y reanudar los cambios citológicos característicos de los ciclos estrales.
Conclusión: El uso de implantes subcutáneos autólogos de ovario criopreservados restablece el ambiente hormonal en ratas con menopausia inducida quirúrgicamente.
Palabras clave: Menopausia. Criopreservación. Implantes ováricos
SUMMARY
Objective: To evaluate the utility of subcutaneous implants of autologous cryopreserved ovarian tissue and hormonal therapy in rats with surgically induced menopause.
Methods: We performed a randomized controlled trial. We studied 14 Sprague Dawnley, divided into two groups. Oophorectomy was performed in the control group and oophorectomy more cryopreservation of ovarian tissue in the study group. Postooforectomy month subcutaneous implant was performed cryopreserved autologous tissue to study group. Estradiol concentrations were determined at baseline, and postimplant postooforectomy in both groups. Daily vaginal cytology was performed.
Setting: Catedra de Reproduccion Humana de la Universidad Simon Bolivar y Maternidad "Concepcion Palacios".
Results: We managed to restore the concentrations of estradiol to the existing pre-oophorectomy and resume the cytological changes characteristic of the estrous cycle.
Conclusion: The use of subcutaneous implants restored autologous cryopreserved ovarian hormonal environment in rats with surgically induced menopause.
Keywords: Menopause. Cryopreservation. Ovarian implants
INTRODUCCIÓN
La menopausia se define como el cese permanente de la menstruación durante un año consecutivo en una mujer de 40 años o más y se correlaciona con el cese de la secreción de estrógenos por la pérdida de la función folicular y el aumento de la hormona folículo estimulante (FSH) (1).
Aunque el cese final de las menstruaciones representa un acontecimiento único, hay una serie de modificaciones clínicas que comienzan alrededor de 4 años antes sobre la base de las irregularidades menstruales (2), cerca de 8 años antes cuando se consideran los cambios hormonales y unos 10 años antes cuando se estima la disminución de la fertilidad; estos fenómenos constituyen lo que se ha denominado climaterio premenopáusico. Cuando se inicia la transición menopáusica hay un aumento gradual de las concentraciones circulantes de FSH y disminución de las concentraciones de estradiol (E2), inhibina y progesterona (P4) (3,4). La producción decreciente de E2 e inhibina por el ovario elimina la inhibición por retroalimentación negativa sobre el sistema hipotálamo-hipofisario, lo que produce un aumento gradual de las gonadotrofinas, con una FSH que se eleva antes y hasta concentraciones más altas que la hormona luteinizante (LH). Cuando se realiza la exéresis de los ovarios durante la vida reproductiva, el tiempo que tardan en elevarse las gonadotrofinas varía, pero a menudo demora menos de 30 días en alcanzar concentraciones menopáusicas finales (6). La producción de estrógenos del ovario posmenopáusico es mínima y en este momento la exéresis ovárica no se acompaña de una disminución adicional en las concentraciones de estrógenos; sin embargo, el ovario aún produce andrógenos en cantidades importantes. Aun cuando la cantidad de estrógenos secretados por los ovarios después de la menopausia es insignificante, todas las mujeres siguen teniendo concentraciones detectables de E2 y estrona durante el resto de sus vidas (7). Es probable que en esta circunstancia el E2, provenga sobre todo de la conversión por aromatización del andrógeno suprarrenal androstenodiona a estrona.
La menopausia se acompaña de profundos efectos sobre los sistemas cardiovascular, musculoesquelético y nervioso central, muchos de los cuales, se cree, son el resultado del cese de la producción ovárica de 17b estradiol. Estos incluyen inestabilidad vasomotora, sequedad e irritación vaginal, pérdida de la elasticidad cutánea, disminución de la densidad mineral ósea y aumento de la incidencia de arteriopatía coronaria.
La terapia hormonal (TH) tiene por objeto restablecer el ambiente hormonal que ha disminuido o se ha perdido con la menopausia, con la finalidad de aminorar o evitar las consecuencias inmediatas, mediatas y tardías propias del climaterio.
La TH ha evolucionado a lo largo del tiempo al cambiar los tipos de esteroides utilizados, las dosis, las vías de administración, así como los esquemas y las indicaciones. Sin embargo, los datos obtenidos de la literatura muestran tasas bajas de adherencia a la terapia hormonal (8).
En los últimos años ha habido un crecimiento impresionante en la disponibilidad de información no sesgada acerca de los riesgos y beneficios de la TH sobre las enfermedades que se desarrollan en las pacientes posmenopáusicas. El mayor y más influyente de todos los trabajos multicéntricos es el Women´s Health Initiative (9) (WHI). Un metanálisis de los resultados de este y otros trabajos multicéntricos ha demostrado que la TH es un tratamiento efectivo para los síntomas vasomotores, la resequedad vaginal y otros síntomas como los trastornos del sueño (10). Tanto la terapia solo con estrógenos, como la de estrógenos combinados con progestágenos reducen el riesgo de fracturas, sin embargo, ninguna parece disminuir el riesgo de enfermedad cardiovascular y ambas aumentan el riesgo de accidente cerebro vascular y trombosis venosa profunda. El tratamiento combinado también aumenta el riesgo de cáncer de mama y reduce el de cáncer de colon (11).
Una alternativa más fisiológica de tratamiento podría consistir en el uso de implantes de tejido ovárico para reestablecer el ambiente hormonal perdido.
El trasplante autólogo de tejido ovárico criopreservado está adquiriendo gran importancia como una alternativa para preservar la fertilidad en pacientes jóvenes con enfermedades malignas, que necesitan ser sometidas a quimioterapia o radioterapia (12-14), sin embargo, es poco lo que se ha investigado acerca de su uso como una alternativa a la terapia hormonal en mujeres menopáusicas.
En 1953, Parkes y col. (15) realizaron el primer intento de criopreservar y trasplantar tejido ovárico. El tejido ovárico del ratón fue congelado a –73° C en glicerol y solución salina, descongelado y trasplantado subcutáneamente en animales previamente ooforectomizados. Ello produjo actividad hormonal suficiente para cornificar el epitelio vaginal. En 1960 se logró restaurar la fertilidad de ratones mediante el autotrasplante de tejido ovárico descongelado (16).
El ciclo ovárico de la mayoría de los mamíferos está organizado de una manera que ha sido denominada ciclo estral. El estro se define como el intervalo que ocurre durante los períodos de apareamiento. La mayoría de los mamíferos se hacen sexualmente receptivos y ovulan espontáneamente a intervalos definidos. Un ciclo estral está formado por cuatro estadios: proestro, estro, metaestro y diestro, los cuales ocurren de manera cíclica y secuencial. Durante la fase denominada proestro ocurre la regresión del cuerpo lúteo, lo cual se acompaña de una disminución en las concentraciones de progesterona, los folículos preovulatorios experimentan su fase de crecimiento final con aumento simultáneo de los valores de estradiol; durante el estro ocurre la ovulación, lo cual coincide con la conducta de apareamiento. El cuerpo lúteo se desarrolla durante el metaestro y alcanza su función óptima durante el diestro. El proestro y el estro comprenden la denominada fase folicular; el
metaestro y el diestro conforman la fase lútea del ciclo ovárico (17,18).El ciclo ovárico de las ratas de la especie
Sprague-Dawley se corresponde a los denominados ciclos estrales. Las hembras de esta especie alcanzan la pubertad entre los 65 y 100 días de vida, cuando tienen un peso corporal entre 220 y 250 g. El ciclo estral de la rata tiene en promedio una duración de 4 días y la fase estro dura, aproximadamente 12 horas (17,18).La maduración cíclica del epitelio vaginal es determinada por la acción local de las hormonas esteroides que promueven cambios en el tamaño celular, en la relación núcleo-citoplasma y la reacción
a los colorantes acidófilos o basófilos (19).Las células epiteliales exfoliadas de la vagina se pueden colectar y examinar en el microscopio, con
la finalidad de establecer la fase del ciclo en la cual se encuentra el animal (17).Durante la fase diestro del ciclo el frotis va a estar constituido por leucocitos polimorfonucleares, con escaso o muy poco moco, el proestro se va a caracterizar por la presencia de células redondeadas nucleadas y la fase estro por la presencia de células epiteliales queratinizadas, excepto en sus fases más tempranas cuando también se pueden observar escasas células nucleadas (18).
Se ha demostrado una estrecha correlación entre los cambios citológicos del epitelio vaginal y los cambios en las concentraciones de esteroides sexuales, características de cada una de las fases del ciclo estral.
El estudio del ciclo estral de las ratas mediante citologías es un recurso experimental importante debido a su corta duración, su fácil interpretación y lo simple de la técnica de recolección, esto representa una valiosa herramienta como modelo para el estudio de aspectos reproductivos y farmacológicos (19).
Al realizar el presente estudio nos propusimos evaluar la utilidad de la colocación de implantes subcutáneos de tejido cortical ovárico autólogo criopreservado, como tratamiento hormonal en ratas con menopausia inducida mediante ooforectomía bilateral.
MÉTODOS
Se realizó un estudio experimental, aleatorio y controlado. La muestra estuvo conformada por 20 ratas hembras de la especie Sprague Dawley, en edad reproductiva (entre 65 y 100 días de nacidas), con pesos corporales comprendidos entre los 250 y 400 g. Estos animales fueron mantenidos en cautiverio bajo condiciones habituales de laboratorio.
Al momento de ingreso en el estudio cada animal fue pesado y marcado, con un número en el dorso con tinta indeleble no tóxica. Los datos fueron registrados en un instrumento diseñado para tal fin (Anexo 1).
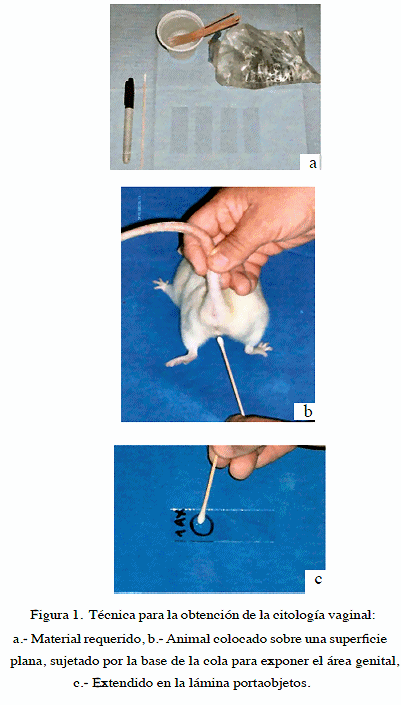
Para determinar la presencia de ciclo estral, se realizaron citologías vaginales diarias a cada uno de los individuos; la técnica para la obtención de la citología fue la siguiente: cada rata fue colocada sobre una superficie plana sujetándolas por la base de la cola, se elevó ligeramente la parte posterior del animal de manera de exponer el área genital. Se utilizaron hisopos humedecidos en solución fisiológica, los cuales fueron introducidos en el canal vaginal y rotados 360° en sentido de las agujas del reloj. El material obtenido fue extendido sobre láminas portaobjetos identificadas con el número del animal (Figura 1). Las láminas se colorearon sumergiéndolas en azul de metileno al 1 %, y se las dejó secar a temperatura ambiente, para luego observarlas con microscopia de luz con objetivos de 10 X sin el uso de lentes de condensación. Se definió como duración del ciclo estral el tiempo transcurrido desde el primer día en que aparecían los cambios citológicos característicos del estro hasta el primer día donde volvían a aparecer dichos cambios. Se tomó como duración de la fase estro el tiempo transcurrido en el cual única y exclusivamente, había células poligonales planas en el extendido vaginal.
El día en que se apreciaban los cambios típicos del estro, previa anestesia de los individuos vía intramuscular con ketamina (80 mg/kg) y xylazina (10 mg/kg), se procedió a obtener muestras de sangre (3 mL) mediante punción intracardíaca con inyectadoras de 3 ml y agujas 22 G (Figura 2). Las muestras fueron centrifugadas a 10 000 rpm durante 10 min; el suero obtenido se congeló a -10° C para la determinación posterior de las concentraciones plasmáticas de E2. Estos resultados fueron tomados como los valores basales de esta hormona. Posterior a la punción intracardíaca se le administraba 3 mL de solución Ringer lactato por vía intraperitoneal a cada animal, para reexpandir su volumen intravascular y evitar el shock hipovolémico.
Se pudo demostrar la presencia de ciclos estrales regulares mediante citología solo en 14 individuos del grupo inicial, los cuales constituyeron la muestra. Los otros 6 fueron excluidos del estudio. Entre los 14 incluidos, se seleccionaron al azar, utilizando la tabla de número aleatorios, a 7 individuos para formar parte del grupo estudio y 7 para el grupo control.
A los integrantes de ambos grupos, bajo anestesia con ketamina 80 mg/kg más xylazina 10 mg/kg vía intramuscular y bajo medidas de antisepsia, se les practicó ooforectomía bilateral a través de una incisión abdominal media (Figura 3) (17). El tejido ovárico de los individuos pertenecientes al grupo estudio fue criopreservado según el protocolo propuesto por Harp y col. (20). Una vez realizada la ooforectomía, el tejido ovárico fresco intacto fue colocado en una placa de Petri que contenía 10 mL de solución de dimetil sulfóxido 1,4 M en solución Tyrodes estéril (DMSO/Tyrodes), a temperatura ambiente durante 5 minutos. Posteriormente, el tejido fue transferido a un vial criogénico Nalgene®
(Nalgene Company, Rochester, NY) que contenía 0,5 mL de DMSO/Tyrodes, identificado con el número correspondiente del individuo y enfriado en un refrigerador hasta alcanzar 10° C. A continuación se procedía a suspender el vial criogénico a 15 cm por encima de la superficie del nitrógeno líquido, este método permitió obtener un perfil térmico reproducible y establecer una tasa de enfriamiento 0,5° C/min. Cuando la muestra alcanzaba -55° C era sumergida en el nitrógeno líquido donde permanecía congelada a -196° C durante 30 días (Figura 4). 
Las soluciones crioprotectoras (solución Tyrodes, dimetisulfoxido 1,4 M) fueron preparadas en la Cátedra de Reproducción Humana de la Universidad Simón Bolívar. La esterilidad de las mismas se logró pasándolas a presión a través de un filtro milipore (poros de 4,5 mm) en una campana de flujo laminar.
Realizada la ooforectomía se dejó reposar a los animales durante una semana, sin manipulación alguna. Transcurrido este período se reinició la toma diaria de extendidos citológicos vaginales durante 2 semanas en todos los individuos, con el objetivo de identificar la presencia o no de los cambios típicos de los ciclos estrales. Posterior a este período, se procedió nuevamente a la toma de muestras de sangre, siguiendo el método anteriormente descrito. Todas las muestras fueron tomadas simultáneamente pues no se pudo demostrar la presencia de estro.
Una semana más tarde se procedió a realizar el implante del tejido ovárico autólogo a los individuos pertenecientes al grupo de estudio; para tal fin se extrajeron las muestras de tejido ovárico del nitrógeno líquido permitiéndoles descongelarse a temperatura ambiente durante 15 min, posteriormente el tejido fue transferido a un tubo de ensayo que contenía 5 mL de solución Tyrodes estéril, para luego ser implantados.
La técnica quirúrgica usada para la colocación del implante fue la siguiente: se realizó una incisión de aproximadamente 2 cm en la cara externa del muslo izquierdo del animal, con divulsión roma del plano entre el tejido celular subcutáneo y la aponeurosis de los músculos de la pata, se colocaron ambos ovarios intactos en el bolsillo creado, dejándolos in situ sin puntos de sutura. La síntesis de la incisión en piel se hizo con Nylon 2-0 a puntos separados.
A las ratas del grupo control igualmente se les practicó una incisión en la pata con divulsión y síntesis idéntica a la ratas del grupo estudio, pero sin colocar implante tisular alguno.
A todos los animales del estudio se les administró una dosis diaria de 15 mg/kg de ácido acetil salicílico durante los 7 días siguientes al implante con la finalidad de facilitar la revascularización del injerto (21).
Una semana después de realizado el implante se reinició la toma de citologías vaginales diarias, a todos los individuos de ambos grupos, con el objetivo de identificar los cambios citológicos característicos del restablecimiento de los ciclos estrales. La toma de la muestra de sangre mediante punción intracardíaca para la determinación de E2 se llevó a cabo durante la fase estro, en caso de demostrarse la reaparición de los ciclos estrales o transcurridas 4 semanas posterior al implante en los individuos del grupo estudio en los que no se demostró el estro y en todos los integrantes del grupo control. Estos valores representan las concentraciones de E2 posimplante en el grupo estudio y el segundo valor posooforectomía en el grupo control.
Las muestras de suero (preooforectomía, posooforectomía y posimplante) fueron congeladas y procesadas juntas, al final del estudio, mediante la técnica de quimioluminiscencia, en el Laboratorio Clínico Olimpo, S.A.
La toma de las citologías, procesamiento e interpretación, así como los procedimientos de extracción de muestras de sangre, la anestesia de los animales, los procedimientos de criopreservación y todas las intervenciones quirúrgicas fueron realizados por uno de los investigadores.
Una muestra representativa (10 %) de las citologías, fue evaluada al azar por un patólogo de la Maternidad "Concepción Palacios", experto en el área ginecológica, con la finalidad de verificar la concordancia de los resultados obtenidos.
Para la realización del presente trabajo se contó con la infraestructura del Servicio de Cirugía Experimental y el Bioterio de la Escuela de Medicina "José María Vargas" de la Universidad Central de Venezuela y el Departamento de Hemoparásitos de la Escuela de Biología de la Universidad Simón Bolívar.
El protocolo de investigación fue revisado y aprobado por la Comisión de Bioética de la Escuela de Medicina "José María Vargas" de la Universidad Central de Venezuela, para investigaciones que involucran animales de experimentación, bajo el código CBIE/012. Los animales fueron manipulados durante todo el estudio siguiendo las normas bioéticas internacionales vigentes para uso de animales de experimentación y las normas de Bioética y Bioseguridad del Ministerio de Ciencia y Tecnología (MCT) y del Fondo Nacional de Ciencia, Tecnología e Innovación (FONACIT).
Todos los datos obtenidos son descritos mediante frecuencias absolutas, porcentajes, medias y su desviación estándar, comparados por diferencias de media (valor de t), diferencia de proporciones (valor de z), para una P<0,05. Son representados en cuadros y/o gráficos estadísticos elaborados para tal fin.
RESULTADOS
El peso promedio de los individuos fue de 325,95 ± 22,54 g, la duración promedio del ciclo estral fue 6,35 ± 1,48 días y de la fase estro 2,21 ± 0,60. En el Cuadro 1 se presentan las características de los individuos del grupo control y el grupo estudio, no hubo diferencias estadísticamente significativas en cuanto a peso inicial, peso final, duración del ciclo estral o duración de la fase estro entre ambos grupos. La duración del ciclo estral, fue de 6,57 ± 1,29 días para el grupo control y 6,14 ± 1,68 días en el grupo estudio (P>0,05). La duración de la fase estro del ciclo fue de 2,14 ± 0,40 y 2,28 ± 0,81 días en el grupo control y el grupo estudio (P>0,05).
Se realizaron 988 citologías vaginales, 400 preooforectomía, 294 posooforectomía y 294 posimplante. La concordancia entre nuestros resultados y los del patólogo que revisó las láminas fue de 100 %.
A los individuos de ambos grupos se les practicó ooforectomía bilateral, logrando identificar claramente ambos ovarios en el 100 % de los procedimientos. No hubo complicaciones intra o posoperatorias; la mortalidad por la intervención quirúrgica fue de cero.
Al descongelar las muestras criopreservadas se pudo recuperar e identificar el tejido ovárico en todos los casos.
Se realizó el implante subcutáneo en la cara externa de la pata trasera izquierda en los 7 individuos pertenecientes al grupo estudio, sin complicaciones intra o posoperatorias.
El control citológico demostró la pérdida de la ciclicidad de los cambios celulares típicos de los ciclos estrales en todos los individuos sometidos a ooforectomía menos en una rata perteneciente al grupo control, la cual continuaba presentando los cambios en la citología vaginal. Este individuo fue excluido al momento de realizar el análisis estadístico (Cuadro 2).
Se pudo evidenciar el restablecimiento de los cambios citológicos cíclicos en 6 de 7 individuos (85,72 %) del grupo con implante ovárico autólogo heterotópico. El restablecimiento de los ciclos estrales ocurrió en promedio transcurridos 13 días del implante. Transcurridas 4 semanas posimplante no se detectaron cambios en la citología vaginal del individuo restante del grupo estudio, ni en ninguna de las ratas del grupo control.
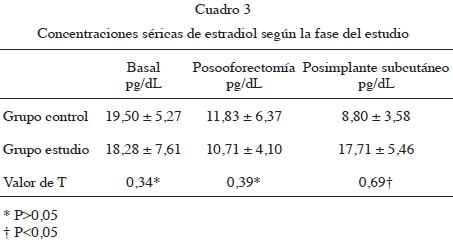
El resultado de E2 basal durante la fase estro fue de 19,50 ± 5,27 pg/dL en el grupo control y 18,28 ± 7,61 pg/dL en el grupo estudio.
El promedio de las concentraciones de E2 transcurrido un mes posooforectomía fue de 11,83 ± 6,37 pg/dL y 10,71 ± 4,10 pg/dL en el grupo estudio y grupo control respectivamente. Este valor resultó significativamente más bajo que el basal pero sin diferencias estadísticamente significativas entre los grupos.
Las concentraciones de E2 posimplante fueron de 8,80 ± 3,58 pg/dL en el grupo control y 17,71 ± 5,46 pg/dL en el grupo estudio respectivamente, esta diferencia fue estadísticamente significativa (Cuadro 3).
DISCUSIÓN
Actualmente, la esperanza de vida de la mujer venezolana es de 75 años (22). Debido a que la menopausia ocurre en promedio a los 51,3 años (2), resulta obvio que la mayoría de las mujeres viven cerca de un tercio de sus vidas después que la función ovárica ha cesado (23). La TH hace algún tiempo fue vista como una estrategia útil para prevenir o retrasar alguno de los padecimientos crónicos característicos de la menopausia (18), sin embargo, una de las decisiones más difíciles a las que se enfrenta el ginecólogo clínico es la de balancear los potenciales riesgos y beneficios de este tipo de terapia en una paciente particular, sobre todo después de los resultados de grandes estudios multicéntricos como el WHI (9).
Una alternativa a la TH podría consistir en el uso de tejido ovárico autólogo, criopreservado durante la etapa reproductiva de la vida e implantado durante el climaterio.
La corta duración del ciclo estral de la rata la hace un modelo biológico ideal para estudiar los cambios que ocurren durante el ciclo reproductivo (19).
Según Steinetz y col. (24) existe una relación directa entre la maduración cíclica del epitelio vaginal estudiada mediante citología y la producción hormonal ovárica. En nuestro estudio se realizaron 988 citologías vaginales, en promedio la toma, coloración y evaluación de las mismas no consumía más de 30 min diarios, resultando una manera rápida y sencilla de evaluar la condición hormonal.
La duración del ciclo estral fue de 6,57 días en el grupo control y 6,14 días en el grupo estudio. La duración de la fase estro del ciclo fue de 2,14 y 2,28 días para el grupo control y estudio respectivamente. Estos resultados difieren de la duración media reportada en la literatura de 4 días para el ciclo estral y de tan solo medio día para la fase estro del ciclo (18), sin embargo, Marcondes y col. (18) señalan la posibilidad de que algunos individuos puedan presentar ciclos regulares de mayor duración o ciclos irregulares caracterizados por mantenerse en la misma fase durante períodos de 4 a 5 días, situaciones que producen ciclos estrales de mayor duración a la habitual. Además, aunque no estudiamos el impacto que el medio ambiente y la situación de estrés puedan ejercer sobre la biología reproductiva de la rata, quizás estos aspectos también deban ser tomados en consideración al tratar de explicar las diferencias en la duración de los ciclos. Se sabe que en la mujer diversos estados de estrés físico, psicológico o nutricional, solos o en combinación, pueden influir sobre la liberación hipotalámica de hormona liberadora de gonadotropina (GnRH) lo que altera la duración del ciclo menstrual y en casos extremos llega incluso a producir amenorrea (25)
.Se pudo inducir con éxito la menopausia mediante ooforectomía bilateral en todas las ratas, menos en una perteneciente al grupo control, la cual presentaba cambios citológicos típicos de los ciclos estrales la semana siguiente de haberle practicado la ooforectomía, lo que es sugestivo de que la exéresis ovárica fue incompleta y quedó algún remanente con capacidad funcional.
Las citologías obtenidas posooforectomía se caracterizaron por la presencia de fase metaestro persistente o frotis hipocelulares. Desde el punto de vista citológico se demostró la reaparición de los ciclos estrales en 6 de 7 individuos del grupo estudio, posterior al implante.
A pesar de una intensa búsqueda, no se pudo encontrar concentraciones de estradiol de referencia en las ratas de las especie
Sprague Dawnley para compararlos con los resultados de este estudio. Por tal motivo se utilizaron las concentraciones obtenidas durante el primer día de la fase estro antes de realizar la ooforectomía como valor basal o de referencia y se contrastaron los resultados obtenidos después de la ooforectomía y luego del implante con estos primeros valores.Hubiese sido ideal evaluar los cambios en las concentraciones de FSH en respuesta a las diferentes intervenciones realizadas, pero debido a la naturaleza polipeptídica de esta hormona y al elevado costo de los reactivos específicos necesarios para su determinación, se optó por utilizar las concentraciones de E2 y los cambios citológicos como marcadores de la función ovárica.
Después de realizada la ooforectomía y en ausencia de cambios citológicos cíclicos, aun fue posible obtener concentraciones detectables de E2, aunque significativamente más bajos que las basales, este hallazgo se puede explicar por la conversión periférica de androstenodiona en estrona y de esta en estradiol mediante aromatización sobre todo en el músculo y el tejido adiposo (26)
.Es importante resaltar que a pesar de detectarse concentraciones de E2 posooforectomía, estas parecieran no ser suficientes para inducir cambios cíclicos en las células del epitelio vaginal de la rata.
Se demostró la reaparición de los ciclos estrales en 85,72 % de los individuos del grupo estudio posterior al implante, alcanzando concentraciones de E2 significativamente mayores a las del grupo control, similares a las concentraciones basales. El porcentaje de reaparición de estro obtenido en este estudio fue discretamente superior al 75 % obtenido por Harp y col. (20) empleando la misma técnica de criopreservación. La reaparición de los ciclos estrales y las concentraciones alcanzadas de estrógenos sugieren revascularización y vitalidad del tejido implantado.
Quedó demostrada una clara asociación entre la reanudación de los ciclos estrales y el reestablecimiento de las concentraciones de estradiol en el grupo estudio.
En el presente estudio se criopreservó el ovario completo y no sólo la corteza como en otros protocolos realizados en humanos (12), ratas (13)
u ovejas (14). La criopreservación de tejidos difiere sustancialmente de la criopreservación de células en suspensión, porque en un tejido organizado como el ovario, la difusión del agua y los crioprotectores pueden verse obstaculizados, además la presencia de varios tipos de células, cada una con función particular hace importante asegurar la supervivencia posdescongelación de cada tipo celular.A pesar de la complejidad que implica la criopreservación del ovario entero, quedó demostrado que mediante la técnica utilizada se pudo obtener tejido viable posdescongelación.
La técnica quirúrgica empleada para realizar los implantes fue sencilla, sin necesidad de microcirugía o anastomosis vasculares, sin morbi-mortalidad intra o posoperatoria asociada.
La aplicación de criopreservación ovárica para conservar la función gonadal tiene implícito un enorme potencial. El uso de implantes de ovario no es nada nuevo, pues desde hace algún tiempo genera gran interés, sobre todo como terapia para pacientes jóvenes con patologías oncológicas que ameritan tratamiento con radioterapia o quimioterapia que se sabe afectarán negativamente su potencial reproductivo (27-32). Incluso recientemente se ha descrito la obtención de un recién nacido vivo, producto de una madre receptora de un implante autólogo ortotópico de ovario, posterior a haber recibido quimioterapia por un linfoma Hodgkin (26).
Lo que resulta novedoso de esta investigación es la propuesta de utilizar este procedimiento como una fuente natural de estrógenos en pacientes menopáusicas. La obtención de tejido ovárico autólogo durante la vida reproductiva de la paciente para ser criopreservado e implantado heterotópicamente durante el climaterio puede constituir una alternativa natural a la terapia hormonal, contribuyendo a mantener o mejorar la calidad de vida de un enorme grupo de pacientes, mientras evitan el uso de hormonas artificiales.
La intención al colocar el implante en el tejido subcutáneo, es la de mantener el tejido en un sitio anatómico accesible, utilizando anestesia local para su colocación, sin necesidad de abordar la cavidad pélvica o abdominal; todo lo cual redundará en simplicidad técnica y menores costos, además de permitir vigilar clínica y ecográficamente el implante, con la finalidad de detectar cualquier patología que pudiera desarrollarse, incluyendo la neoplásica.
Queda claro que el tratamiento quirúrgico de la menopausia es, hasta el momento, solo un modelo experimental. Se necesitan más estudios antes que el autotrasplante ovárico pueda ser utilizado para esta indicación en seres humanos.
Aun queda por determinar la duración funcional del tejido trasplantado, las características de los ciclos estrales logrados con estos implantes y el impacto sobre otras variables biológicas presentes en las pacientes menopáusicas.
Después de haber realizado esta investigación, se puede concluir que la colocación de un implante de tejido ovárico autólogo en ratas
Sprague-Dawley con menopausia inducida quirúrgicamente restablece la condición hormonal a la existente antes de la ooforectomía bilateral.REFERENCIAS
1. Hurd W, Amesse L, Randolph J. Menopausia. En: Berek J, Adashi E, Hillard P, editores. Ginecología de Novak. 13ª edición. México: Mc Graw- Hill Interamericana; 2003.p.891-911. [ Links ]
2. McKinlay S, Brambilla D, Posner J. The normal menopausal transition. Maturitas. 1992;14(2):103-115. [ Links ]
3. Sherman B, West J, Korenman S. The menopausal transition: Analysis of LH, FSH, estradiol and progesterone concentrations during menstrual
cicles of older women. J Clin Endocrinol Metab. 1976;42(4):629-636. [ Links ]l4. Baird D, Smith K. Inhibin and related peptides in the regulation of reproduction. Oxf Rev Reprod Biol. 1993;15:191-232. [ Links ]
5. Yen S, Tsai C, Naftolin F, Vanderberg G, Ajabor L. Pulsatile patterns of gonadotropin release in subjects with and without ovarian function. J Clin Endocrinol Metab. 1972;34(4):671-675. [ Links ]
6. Monroe S, Jaffe R, Midgley A. Regulation of human gonadotropins. Changes in serumgonadotropins in menstruating women in response to oophorectomy. J Clin Endocrinol Metab. 1972; 34(2):420-422. [ Links ]
7. Adashi E. The climacteric ovary as a functional gonadotropin-driven androgen-producing gland. Fértil Steril. 1994;62(1):20-27. [ Links ]
8. Carranza L. Terapia hormonal de reemplazo. En: Carranza L, editor. Atención integral del climaterio. México: Mc Graw Hill Interamericana; 1998.p.241-271. [ Links ]
9. Rossouw JE, Anderson GL, Prentice RL, LaCroix AZ, Kooperberg C, Stefanick ML, et al.
Risks and benefits of estrogen plus progestin in healthy postmenopausal women: Principal results from the Womens Health Initiative randomized controlled trial. JAMA. 2002;288(3):321-333. [ Links ]10. Beral V, Reeves G, Banks E. Current evidence about the effect of hormone replacement therapy on the incidence of major conditions in postmenopausal women. BJOG. 2005;112(6):692-695. [ Links ]
11. Barrett-Connor E, Grady D, Stefanick M. The rise and fall of menopausal hormone therapy. Ann Rev Public Health. 2005;26:115-140. [ Links ]
12. Oktay K, Buyuk E, Rosenwaks Z, Rucinski J. A technique for tranplantation of ovarian cortical strips to the forearm. Fertil Steril. 2003;80(1):193-198. [ Links ]
13. Von Eye Corleta H, Corleta O, Capp E, Edelweiss M. Subcutaneous autologous ovarian transplantation in Wistar rats maintains hormone secretion. Fertil Steril. 1998;70(1):16-19. [ Links ]
14. Gutierrez A, Vargas M, Corona M, Becerra E, González C, Mendoza S, et al. Gestaciones en ovejas autotrasplantadas con tejido ovárico criopreservado: evidencia de la viabilidad ovocitaria posterior al proceso de congelación y trasplante. Ginecol Obstet Mex. 2003;71:5-11. [ Links ]
15. Parkes A, Smith A. Regeneration of rat ovarian tissue grafted after exposure to low temperatures. Proc R Soc Lond B Biol Sci. 1953;140(901):455-470. [ Links ]
16. Parrot D. The fertility of mice with orthotopic ovarian grafts derived from frozen tissue. J Reprod Fertil. 1960;1:230-241. [ Links ]
17. Waynforth H, Flecknell P. Experimental and surgical technique in the rat. 2ª edición. Londres: Academic Press; 1995. [ Links ]
18. Marcondes F, Bianchi F, Tanno A. Determination of the estrous cycle phases of rats: some helpful considerations. Braz J Biol. 2002;62(4A):609-614. [ Links ]
19. Martins R, Lemos N, Araújo T. Liquid-base cytology: A new method for oestral cycle study in wistars rats. Acta Cir Bras. 2005;20:78-81. [ Links ]
20. Harp R, Leibach J, Black J, Keldahl C, Karow A. Cryopreservation of murine ovarian tissue. Criobiology. 1994;31(4):336-343. [ Links ]
21. Imthurn B, Cox S, Jenkin G, Trounson A, Shaw J.
Gonadotrophin administration can benefit ovarian tissue grafted to the body wall: Implications for human ovarian grafting. Mol Cell Endocrinol. 2000;163(1-2):141-146. [ Links ]22. Ministerio de Salud y Desarrollo Social. Indicadores básicos de la Salud de la República Bolivariana de Venezuela. 4ª publicación. Caracas: MSDS; 2001. [ Links ]
23. Manson J, Martin K. Clinical practice. Postmenopausal Hormone-replacement therapy. N Engl J Med. 2001;345(1):34-40. [ Links ]
24. Steinetz B. Secretion and function of ovarian estrogens. En: Handbook of Physiology. Washington DC: Am Physiol Soc. 1986.p.439-452. [ Links ]
25. Robert L. Amenorrea. En: Copeland L, Jarrel J, editores. Ginecología. Filadelfia: Médica Panamericana; 2000.p.593-595. [ Links ]
26. Jones N, Judd H. Menopause and postmenopause. En: De Cherney A, Nathan L, editores. Current Obstetric and Gynecology Diagnosis and Treatment. 9ª edición. Mc Graw-Hill; 2003.p.1018-1039. [ Links ]
27. Sklar C. Maintenance of ovarian function and risk of premature menopause related to cancer treatment. J Natl Cancer Inst Monogr. 2005; 34:25-27. [ Links ]
28. Kiran G, Kiran H, Coban Y, Guven A, Yuksel M. Fresh autologous transplantation of ovarian cortical strips to the anterior abdominal wall at the pfannenstiel incision site. Fertil Steril. 2004;82(4):954-956. [ Links ]
29. Lee D, Ouhibi N, Battaglia D. Cryopreservation of ovarian tissue: Banking reproductive potential for the future. Curr Womens Health Rep. 2001;1(2):152-156. [ Links ]
30. Oktay K. Ovarian tissue cryopreservation and
transplantation: preliminary findings and implications for cancer patients. Hum Reprod Update. 2001; 7(6):526-534. [ Links ]31. Oktay K, Economos K, Kan M, Rucinski J, Veeck L, Rosenwaks Z. Endocrine function and oocyte retrieval after autologous transplantation of ovarian cortical strips to the forearm. JAMA. 2001;286(12):1490-1493. [ Links ]
32. Meirow D. Reproduction post-chemotherapy in young cancer patients. Mol Cell Endocrinol. 2000;169(1-2):123-131. [ Links ]