Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Obstetricia y Ginecología de Venezuela
versión impresa ISSN 0048-7732
Rev Obstet Ginecol Venez v.71 n.4 Caracas dic. 2011
Legrado uterino o nifedipina durante el posparto en pacientes con preeclampsia severa
Drs. Joel Santos-Bolívar, Mery Guerra-Velásquez, Eduardo Reyna-Villasmil, Jorly Mejia-Montilla, Nadia Reyna-Villasmil
Servicio de Obstetricia y Ginecología. Maternidad Dr. Nerio Belloso. Hospital Central Dr. Urquinaona. Maracaibo. Estado Zulia.
Correspondencia a: Dr. Eduardo Reyna-Villasmil. Hospital Central Dr. Urquinaona. Final Av. El Milagro. 4002 Maracaibo. Venezuela Teléfono: 0416-2605233. Email: sippenbauch@gmail.com.
RESUMEN
Objetivo: Comparar la eficacia del legrado uterino o la nifedipina durante el posparto en pacientes con preeclampsia severa. Ambiente: Maternidad Dr. Nerio Belloso, Hospital Central Dr. Urquinaona, Maracaibo. Estado Zulia. Métodos: Se realizó una investigación en 60 pacientes con diagnóstico de preeclampsia severa que fueron divididas de la siguiente manera: grupo A (n = 30) que fueron sometidas a legrado uterino inmediatamente después del parto y grupo B (n = 30) que recibieron nifedipina (10 mg vía oral cada 8 horas x 24 horas). Se evaluaron los cambios en la presión arterial, contaje de plaquetas, parámetros de laboratorio y efectos adversos. Resultados: La edad materna, edad de la gestación al momento del parto y tipo de parto fueron similar para las pacientes del grupo nifedipina y las pacientes del grupo de legrado uterino (p = ns). No se encontraron diferencias significativas en los valores promedio de presión arterial sistólica, presión arterial diastólica y contaje de plaquetas en ninguno de los períodos estudiados entre ambos grupos de estudio (p = ns). Tampoco encontraron diferencias estadísticamente significativas entre los grupos en los valores inicial y a las 24 horas de hemoglobina, hematocrito, bilirrubina y transaminasas (p =ns). El único efecto adverso que presentó una diferencia estadísticamente significativa y una alta incidencia fue la cefalea en el grupo de preeclámpticas severas tratadas con nifedipina (26 casos, P < 0,05). Conclusión: La nifedipina es tan eficaz como el legrado uterino durante el posparto en pacientes con preeclampsia severa.
Palabras clave: Nifedipina, Preeclampsia, Legrado uterino.
SUMMARY
Objective: To compare the efficacy of uterine curettage or nifedipine during postpartum in patients with severe preeclampsia. Setting: Maternidad Dr. Nerio Belloso, Hospital Central Dr. Urquinaona, Maracaibo. Estado Zulia. Methods: A research was done in 60 patients with diagnosis of severe preeclampsia that were divided of following way: group A (n = 30) who were submitted to uterine curettage and group B (n = 30) who received nifedipine (10 mg orally every 8 hours x 24 hours). Blood pressure changes, platelet count, laboratory parameters and adverse effects were evaluated. Results: Maternal age, gestational age at the moment of delivery and type of delivery were similar to patients of group nifedipine and patients of uterine curettage group (p = ns). There were not significant differences in mean values of systolic blood pressure, diastolic blood pressure and platelet count between groups (p = ns). There was also not significant differences between groups in initial and at 24-hours values of hemoglobin, hematocrit, bilirubin and transaminases (p = ns). The only adverse effect that presented a significant difference and a high incidence was headache in group of severe preeclamptic patients treated with nifedipine (26 cases; P < 0.05). Conclusion: Nifedipine is as effective as uterine curettage during postpartum in patients with severe preeclampsia.
Key words: Nifedipine, Preeclampsia, Curettage.
INTRODUCCIÓN
La preeclampsia incluye la presencia de inflamación subclínica local del lecho placentario y en la circulación materna (1). La hipótesis actual de la etiología de la preeclampsia está enfocada a la mala adaptación de la respuesta del sistema inmune y a la invasión trofoblástica defectuosa. Una respuesta inflamatoria materna excesiva, quizá directamente en contra de los antígenos fetales extraños, produce una cadena de eventos que incluyen; escasa invasión trofoblástica, remodelación defectuosa de las arterias espirales, infartos placentarios y liberación de citokinas proinflamatorias y fragmentos placentarios a la circulación sistémica (1,2).
La preeclampsia aparece en dos fases: fase preclínica caracterizada por invasión insuficiente de las arterias espirales maternas por el citotrofoblasto, llevando a hipoxia placentaria y posteriormente, aumento de la producción de factores placentarios en respuesta a la hipoxia, secretadas por el trofoblasto. Este defecto local lleva a la segunda fase donde se observan respuestas clínicas sistémicas en la madre que lleva a la aparición de hipertensión, proteinuria, alteraciones de la coagulación y otras alteraciones orgánicas secundarias a la disfunción endotelial (2).
En la actualidad, los esquemas de tratamiento para acelerar la recuperación de la preeclampsia severa incluyen el legrado uterino inmediato o tardío (3-5). Las pacientes tratadas de esta forma han demostrado una disminución rápida y significativa de la presión arterial y un aumento en la diuresis comparado con los controles (3,4). Las potenciales complicaciones del legrado uterino incluyen perforación uterina, infección y sinequias intrauterinas.
La nifedipina, un bloqueador de los canales de calcio, está entre los agentes recomendados para el tratamiento de la hipertensión moderada a severa. Inhibe el paso transmembrana de los iones de calcio en el músculo cardíaco y liso, siendo utilizado para el tratamiento de la hipertensión arterial y de las enfermedades coronarias con buenos resultados (7). La reducción de la presión arterial es una de las metas principales en el manejo de la hipertensión durante y después del embarazo, ya que disminuye rápida y efectivamente la hipertensión arterial (6). Como agente hipotensor disminuye las cifras tensionales en las pacientes embarazadas sin alteración de la circulación útero-placentaria, mientras que incrementa la perfusión renal y la diuresis (8). Diferentes investigaciones (3,9) han reportado que el uso en el puerperio inmediato y mediato producía efectos benéficos en la recuperación temprana de la preeclampsia, pero no se conocen estudios más recientes con confirmen las conclusiones de esas investigaciones.
El objetivo de la investigación fue comparar la eficacia del legrado uterino o la nifedipina durante el posparto en pacientes con preeclampsia severa.
MÉTODOS
La investigación se realizó en la Maternidad Dr. Nerio Belloso del Hospital Central Dr. Urquinaona en el período de octubre de 2009 y diciembre de 2010. Se seleccionaron 60 pacientes con diagnóstico de preeclampsia severa y fueron divididas en dos grupos para ser tratadas con legrado uterino o con nifedipina.
Se incluyeron pacientes embarazadas primigestas con diagnóstico de preeclampsia severa con más de 34 semanas de gestación. El diagnóstico de preeclampsia severa se estableció de la siguiente manera: presión arterial al menos de 160/110 mmHg, proteinuria ≥ 300 mg/24h, síntomas neurológicos: cefalea, tinnitus y / o escotomas; síntomas gastrointestinales: epigastralgia y trombocitopenia. Se excluyeron las pacientes con hipertensión crónica, diabetes mellitus pregestacional o gestacional y enfermedades sistémicas crónicas.
Una vez realizada la interrupción del embarazo por vía vaginal o cesárea de las 60 pacientes que cumplieron con los criterios de inclusión fueron divididas al azar en dos grupos de 30 pacientes. Al grupo A se les realizó legrado uterino inmediatamente posterior a la interrupción de la gestación. Al grupo B se le procedió a la administración de nifedipina 10 mg vía oral cada 8 horas por 24 horas, no se permitió el uso de ningún otro medicamento que interfiera con la acción del medicamento. Ambos grupos recibieron tratamiento con sulfato de magnesio (4 g de sulfato de magnesio al 50 % en bolo EV en 20 minutos, y luego 1 gramo/hora según monitoreo clínico).
La duración del estudio fue de 24 horas, se evaluaron parámetros clínicos: la presión arterial al inicio y luego cada 6 horas, y parámetros de laboratorio: hemoglobina, hematocrito, transaminasas, bilirrubina y plaquetas al inicio y luego cada 12 horas. Los efectos adversos de la nifedipina se obtuvieron del reporte espontáneo de los pacientes o los observables por los investigadores. Todas las pacientes fueron evaluadas por los investigadores.
Los datos cuantitativos de las pacientes de ambos grupos se analizaron con la prueba t de Student para muestras no relacionadas y los datos cualitativos fueron analizados mediante la prueba exacta de Fisher. Se consideró P < 0,05 como estadísticamente significativo.
RESULTADOS
Las características generales de las pacientes se muestran en el Cuadro 1. La edad promedio de las pacientes del grupo de legrado uterino (grupo A) fue de 19,8 ± 4,3 años mientras que la de las pacientes en el grupo de nifedipina (grupo B) fue de 19,1 ± 4,2 años. La edad gestacional al momento del parto fue de 38,4 ± 0,5 semanas para las pacientes del grupo A y 38,1 ± 0,5 semanas para las pacientes del grupo B. No se encontraron diferencias estadísticamente significativas entre ambos grupos (p = ns).
Tampoco se encontraron diferencias significativas en el tipo de parto en cada uno de los grupos (p = ns). En el Cuadro 2 se muestran las variaciones de la presión arterial. Con respecto a la presión arterial sistólica, los valores promedio iniciales fueron de 163,1 ± 13,9 mmHg para el grupo A y 162,8 ± 13,4 mmHg para el grupo B (p = ns). Los valores de presión presentaron disminuciones marcadas hasta alcanzar un valor promedio a las 24 horas de 143,4 ± 4,9 mmHg para las pacientes sometidas a legrado uterino y 142,2 ± 5,5 mmHg para las preeclámpticas tratadas con nifedipina. No se encontraron diferencias significativas en los valores promedio de presión arterial sistólica en ninguno de los períodos estudiados (p = ns).
Los valores promedio de presión arterial diastólica en cada uno de los períodos de estudio se muestran en el Cuadro 2. El valor promedio inicial fue de 110,8 ± 6,7 mmHg para las preeclámpticas severas del grupo A y 111,2 ± 5,3 mmHg para las pacientes del grupo B (p = ns). No se consiguieron diferencias estadísticamente significativas en los valores de presión arterial diastólica a las 6, 12 y 18 horas. Los valores promedio a las 24 horas fueron de 93,5 ± 5,3 mmHg para aquellas pacientes sometidas a legrado uterino y 92,2 ± 6,3 mm de Hg para aquellas pacientes que recibieron nifedipina. Esta diferencia tampoco se consideró significativa (p = ns).
Con respecto al contaje de plaquetas (Cuadro 3), se observó que el valor inicial para las pacientes del grupo A fue de 147 035 ± 50 180 x mm3 y para las pacientes del grupo B fue de 149 607 ± 58 553 x mm3, diferencia que se consideró no significativa (p = ns).
No se encontraron diferencias estadísticamente significativas entre los grupos en los valores promedio de plaquetas a las 6, 12, 18 y 24 horas después del tratamiento (p = ns). Al analizar los valores de otros parámetros de laboratorio (Cuadro 4), no se encontraron diferencias estadísticamente significativas entre los grupos en los valores iniciales y a las 24 horas de hemoglobina, hematocrito, bilirrubina directa, bilirrubina indirecta, bilirrubina total y transaminasas (p = ns).
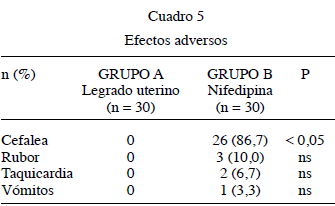
Con relación a los efectos adversos (Cuadro 5), todos se presentaron en el grupo de pacientes tratadas con nifedipina, aunque el único efecto adverso que presentó una diferencia estadísticamente significativa y una alta incidencia fue la cefalea (26 casos, P < 0,05). El resto de efectos adversos (rubor, taquicardia y vómitos) estuvieron presentes con una baja frecuencia de aparición y una incidencia no significativa al compararlas con las preeclámpticas sometidas a legrado uterino (p = ns).
DISCUSIÓN
Los resultados de la investigación demuestran que la nifedipina es igual de efectiva que el uso rutinario del legrado uterino para producir disminución de la presión arterial sistólica y diastólica y el contaje de plaquetas, sin producir modificaciones significativas en los otros parámetros de laboratorio de rutina para evaluar el curso clínico de la preeclampsia, pero se debe ser cuidadoso con la presencia de efectos adversos secundarios a su uso.
El tratamiento definitivo para la preeclampsia es la obtención del recién nacido y la extracción de la placenta. Sin embargo, esto no es la única garantía para disminuir las complicaciones maternas y perinatales, ya que la persistencia de trofoblasto está asociada al desarrollo de las complicaciones (10,11). Hirshfeld-Cytron y col. (12) reportaron elevación de kinasa de tirosina soluble similar al FMS y del factor de crecimiento endotelial vascular en las eclámpticas al final del embarazo, lo cual sugiere las interacciones entre los factores angiogénicos en el tejido trofoblástico persistente después del parto en las preeclámpticas. Estos hallazgos pueden explicar la relación característica entre la presión sanguínea y la severidad-duración de la enfermedad.
El legrado uterino, una forma de asegurar la eliminación de los residuos placentarios durante el posparto, acelera la recuperación en la preeclampsia severa y la eclampsia (4,5,13,14). Se ha descrito que se logra una resolución más rápida del cuadro (evaluado por presión arterial, contaje de plaquetas y diuresis en pacientes sometidas a legrado uterino (4).
La nifedipina es una dihidropiridina que bloquea los canales lentos de calcio (tipo L), disminuye el tono vascular y tiene un efecto antihipertensivo (15). El primer reporte del uso de nifedipina en la hipertensión durante el embarazo fue realizado por Brown y col. (16), quienes administraron 2,5 mg en pacientes con hipertensión severa. Desde la presentación de ese estudio, se han presentado una cantidad importante de evidencia enfocada al uso de nifedipina para disminuir la presión arterial durante el embarazo (6,17). Varias revisiones sobre la farmacocinética y farmacodinámica indican que la nifedipina está asociada con una reducción del 25 % de la presión arterial sistólica, presión arterial diastólica y presión arterial media en el 98 % de los pacientes (6,18). Rubin y col. (19) observaron que la nifedipina puede tener la ventaja agregada de incrementar el contaje de plaquetas, lo cual la hace una droga atractiva para el tratamiento de las pacientes con preeclampsia severa y trombocitopenia. Sin embargo, este aspecto ha sido poco estudiado hasta la actualidad.
Los resultados de la presente investigación, al igual que lo descrito por Magann y col. (3), demuestran que el uso de nifedipina en el puerperio inmediato en pacientes con preeclampsia severa produce efectos similares a los del legrado uterino. Y en contraste con el legrado uterino, la nifedipina no está asociada a complicaciones potenciales como infección, perforación o sinequias uterinas. Por tanto la nifedipina puede ser el tratamiento de elección en preeclámpticas severas para disminuir la presión arterial y aumentar el contaje plaquetario sin exponer a las pacientes al riesgo quirúrgico y / o anestésico.
Pero a diferencia de lo reportado por Magann y col. (3), los resultados de la presente investigación no demostraron que las pacientes con legrado uterino presentaran una resolución más rápida de la trombocitopenia que aquellas tratadas con nifedipina. Se observó una respuesta similar en la evaluación clínica y de laboratorio en las pacientes de ambos grupos en todos los períodos de tratamiento. Estos nuevos hallazgos demostrarían que las preeclámpticas severas podrían ser tratadas con cualquiera de las dos variedades de tratamiento. Aunque se deben realizar otras investigaciones para establecer si existe alguna diferencia entre el uso de nifedipina o el legrado uterino luego de las primeras 24 horas de uso.
Los efectos adversos más comúnmente reportados por el uso de nifedipina son cefalea y taquicardia (20), con datos similares a los encontrados en el presente estudio. Los efectos cardiovasculares descritos son mínimos en los pacientes normotensos (20). La nifedipina ejerce efectos tanto vasculares como cardíacos. Produce vasodilatación y ejerce un efecto inotrópico - cronotrópico negativo sobre el corazón (21). La relación vascular cardíaca de la nifedipina es de 10:1. El efecto depresor cardíaco de la nifedipina in vivo es contrarrestado por los reflejos mediados por los barorreceptores activados por la vasodilatación los cuales incrementan el tono simpático produciendo una cardioestimulación indirecta. El incremento del tono simpático compensa las acciones inotrópicas - cronotrópicas negativas de la nifedipina en el corazón (22). Se puede comprender que bajo ciertas circunstancias en la cual la vasodilatación es muy acentuada (por ejemplo, embarazo múltiple) la compensación simpática del corazón está ausente posterior al uso de nifedipina. Los vasos pueden estar dilatados a tal grado que la respuesta de los barorreceptores no se logra y el incremento del tono simpático no ocurre. El resultado final sería una acción negativa sobre la función cardíaca secundaria a los efectos de la nifedipina, produciendo disnea, hipoxia y edema agudo de pulmón.
La nifedipina está contraindicada en pacientes con compromiso cardíaco y se debe administrar en forma cuidadosa en aquellas pacientes que reciben sulfato de magnesio (15,20). La de acción corta se utiliza frecuentemente para tratar las pacientes con hipertensión severa, por lo cual en la mayoría de las ocasiones se puede utilizar ambos medicamentos en conjunto con el objetivo de controlar la presión arterial y prevenir las convulsiones. Van Geijn y col. (21) encontraron que el uso de nifedipina y sulfato de magnesio en preeclámpticas no se asocia con un exceso de los efectos adversos (debilidad y bloqueo neuromuscular).
Se concluye que la nifedipina es tan eficaz como el legrado uterino durante el posparto en pacientes con preeclampsia severa.
REFERENCIAS
1. Reyna E, Briceño C, Torres D. Inmunología, inflamación y preclampsia. Rev Ginecol Obstet Venez. 2009;69:97-110. [ Links ]
2. Wang Y, Lewis D, Alexander J, Granger D. Endothelial barrier function in preeclampsia. Front Biosci. 2007;12:2412-2424. [ Links ]
3. Magann E, Bass J, Chauhan S, Perry K, Morrison J, Martin J. Accelerated recovery from severe preeclampsia: Uterine curettage versus nifedipine. J Soc Gynecol Investig. 1994;1:210-214. [ Links ]
4. Magann E, Martin J, Isaacs J, Perry K, Martin R, Meydrech E. Immediate postpartum curettage: Accelerated recovery from severe preeclampsia. Obstet Gynecol. 1993;81:502-506. [ Links ]
5. Vilela O, Colmenares B, Silva D. Legrado uterino como terapia coadyuvante en el tratamiento de la preeclampsia severa. Rev Obstet Ginecol Venez. 2007;67:87-91. [ Links ]
6. Aali B, Nejad S. Nifedipine or hydralazine as a first-line agent to control hypertension in severe preeclampsia. Acta Obstet Gynecol Scand. 2002;81:25-30. [ Links ]
7. Guclu S, Gol M, Saygili U, Demir N, Sezer O, Baschat A. Nifedipine therapy for preterm labor: Effects on placental, fetal cerebral and atrioventricular Doppler parameters in the first 48 hours. Ultrasound Obstet Gynecol. 2006;27:403-408. [ Links ]
8. Guclu S, Saygili U, Dogan E, Demir N, Baschat A. The short-term effect of nifedipine tocolysis on placental, fetal cerebral and atrioventricular Doppler waveforms. Ultrasound Obstet Gynecol. 2004;24:761-765. [ Links ]
9. Barton J, Hiett A, Conover W. The use of nifedipine during the postpartum period in patients with severe preeclampsia. Am J Obstet Gynecol. 1990;162:788- 792. [ Links ]
10. Chu W, Chapman J, Persons D, Fan F. Twin pregnancy with partial hydatidiform mole and coexistent fetus. Arch Pathol Lab Med. 2004;128:1305-1306. [ Links ]
11. Kunjara S, Greenbaum A, Wang D, Caro H, McLean P, Redman C, et al. Inositol phosphoglycans and signal transduction systems in pregnancy in preeclampsia and diabetes: Evidence for a significant regulatory role in preeclampsia at placental and systemic levels. Mol Genet Metab. 2000;69:144-158. [ Links ]
12. Hirshfeld-Cytron J, Lam C, Karumanchi S, Lindheimer M. Late postpartum eclampsia: Examples and review. Obstet Gynecol Surv. 2006;61:471-480. [ Links ]
13. Hunter C, Howard W, McCormick C. Amelioration of the hypertension of toxemia by postpartum curettage. Am J Obstet Gynecol. 1961;81:884-889. [ Links ]
14. Robinson H, Schelin E, Fort W. Postpartum curettement for hypertension. Am J Obstet Gynecol. 1964;88:788-790. [ Links ]
15. Tranquilli A, Giannubilo S. Use and safety of calcium channel blockers in obstetrics. Curr Med Chem. 2009;16:3330-3340. [ Links ]
16. Seabe S, Moodley J, Becker P. Nifedipine in acute hypertensive emergencies in pregnancy. S Afr Med J. 1989;76:248-250. [ Links ]
17. Brown M, Buddle M, Farrell T, Davis G. Efficacy and safety of nifedipine tablets for the acute treatment of severe hypertension in pregnancy. Am J Obstet Gynecol. 2002;187:1046-1050. [ Links ]
18. Barton J, Prevost R, Wilson D, Whybrew W, Sibai B. Nifedipine pharmacokinetics and pharmacodynamics during the immediate postpartum period in patients with preeclampsia. Am J Obstet Gynecol. 1991;165:951-954. [ Links ]
19. Rubin P, Butters L, McCabe R. Nifedipine and platelets in preeclampsia. Am J Hypertens. 1988;1:175-177. [ Links ]
20. Silberschmidt A, Kühn-Velten W, Juon A, Zimmermann R, von Mandach U. Nifedipine concentration in maternal and umbilical cord blood after nifedipine gastrointestinal therapeutic system for tocolysis. BJOG. 2008;115:480-485. [ Links ]
21. van Geijn H, Lenglet J, Bolte A. Nifedipine trials: Effectiveness and safety aspects. BJOG. 2005;112:79- 83. [ Links ]
22. Bal L, Thierry S, Brocas E, Adam M, Van de Louw A, Tenaillon A. Pulmonary edema induced by calciumchannel blockade for tocolysis. Anesth Analg. 2004;99:910-911. [ Links ]