Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Obstetricia y Ginecología de Venezuela
versión impresa ISSN 0048-7732
Rev Obstet Ginecol Venez v.72 n.1 Caracas mar. 2012
Motilidad y morfología espermática, en estudiantes de la Universidad de Oriente
Lic. Evelin Flores, Dr. Aníbal Lobo, Lic. Mariela Chelhod, Ph. D. Luisa Rojas, Ph. D. Raquel Salazar, Lic. Luzmila Albarado
Departamento de Bioanálisis, Universidad de Oriente, Núcleo de Sucre. Venezuela
RESUMEN
Objetivo: Evaluar la motilidad y morfología espermática en los estudiantes de la Universidad de Oriente. Métodos: Se realizó el espermatograma a 100 estudiantes de la Universidad de Oriente, Núcleo de Sucre, Cumaná, Venezuela, y se aplicó a los datos un análisis de regresión lineal simple con un nivel de confianza del 95 %. Resultados: El 12 % de los estudiantes fueron astenospérmicos, 11 % oligospérmicos y 9 % oligoastenospérmicos. Los astenospérmicos, tuvieron una correlación negativa moderada entre motilidad y anormalidades de la pieza principal (r=-0,58), estadísticamente significativa. En los oligoastenospérmicos hubo una correlación lineal negativa moderada (r=-0,57) entre motilidad y anormalidades de cabeza, estadísticamente no significativa. Conclusión: Se sugiere que la causa probable de alteración de la motilidad progresiva, es por defectos de la cola y exceso de citoplasma residual en espermatozoides de estudiantes astenospérmicos, y anormalidades de cabeza en espermatozoides de oligoastenospérmicos.
Palabras clave: Astenospérmicos. Oligoastenospérmicos. Espermatograma. Motilidad, Morfología.
SUMMARY
Objective: To evaluate motility and sperm morphology in students of the Universidad de Oriente. Method: We performed semen analysis to 100 students from the Universidad de Oriente, Nuclei Sucre, Cumana, Venezuela, according to WHO criteria, 1999, and applied to the data a simple linear regression analysis with a confidence level of 95 %. Results: Diagnosis was 12 % asthenozoospermic, 11 % oligozoospermic and 9.% oligoasthenozoospermic. The asthenozoospermic, had a moderate negative linear correlation between motility and principal piece abnormalities (r =- 0.58) statistically significant. In oligoasthenozoospermic there was a moderate negative correlation (r =-0.57) between motility and abnormalities of the head, not statistically significant. Conclusion: We suggest that the probable cause of altered motility is principal tail defects and excess residual cytoplasm in sperm asthenozoospermic students, and abnormalities in sperm head oligoasthenozoospermic.
Key words: Asthenozoospermic. Oligoasthenozoospermic. Semen analysis. Motility. Morphology.
INTRODUCCIÓN
La disminución de la calidad del semen representa un gran problema para la población humana. Los parámetros del espermatograma usados para evaluar la calidad del semen son, fundamentalmente, concentración de espermatozoides por mililitro, contaje total de espermatozoides, motilidad, viabilidad y morfología normal de los espermatozoides (1,2).
El espermatozoide es una célula formada por dos zonas con distintas funciones: la cabeza y la cola. La cola se divide a su vez en cuatro segmentos
que, por orden cráneo-caudal, se denominan cuello, pieza intermedia, pieza principal y pieza terminal. La cabeza contiene el núcleo y posee una estructura altamente especializada llamada acrosoma. La estructura flagelar del espermatozoide permite su desplazamiento en el líquido seminal, en la cavidad vaginal, útero y trompas uterinas, representando la motilidad uno de los parámetros más importantes de la analítica seminal. La importancia en sí de la motilidad espermática progresiva, se relaciona con las tasas de embarazo. Asimismo, cuando se aplican los criterios estrictos de morfología del espermatozoide, la evaluación morfológica, tiene un alto poder predictivo de fertilidad (3-5). Los espermatozoides con morfología anormal pueden presentar anomalías en la cabeza, pieza intermedia o pieza principal. Los espermatozoides anormales, por lo general, tienen un menor potencial fertilizante, en función a los tipos de anomalías, y pueden también tener ADN anormal (6-9).
De acuerdo al manual de laboratorio para el análisis del semen humano e interacción de espermatozoides con el moco cervical de la Organización Mundial de la Salud (OMS) (10), se considera semen normal en relación con la motilidad espermática, cuando al menos el 50 % de los espermatozoides están dotados de motilidad progresiva o cuando haya más de un 25 % con motilidad progresiva recta; mientras que en relación a la morfología de acuerdo el criterio estricto de Kruger, valores iguales o superiores al 15 % de espermatozoides con morfología normal es considerado normal. Recientemente, la OMS disminuyó estos valores a 32 % o más espermatozoides con movimiento progresivo y 4.% o más espermatozoides con morfología normal, para los parámetros motilidad y morfología normal, respectivamente, no obstante, para considerar estos valores de referencia, la muestra de semen debe ser procesada cumpliendo las pautas de la nueva quinta edición de este manual (4).
La disminución de la motilidad espermática se denomina astenozoospermia, la oligozoospermia es la disminución en la concentración de los espermatozoides y la terminología teratozoospermia, se refiere a la alteración de la morfología; en los espermatogramas se pueden observar combinaciones entre los tres parámetros y la combinación más común es la oligoastenozoospermia (5).
La astenozoospermia es una de las principales causas de infertilidad masculina y su causa, en la mayoría de los casos, es desconocida, no obstante, se ha asociado con importantes anomalías morfológicas del flagelo (11,12). Con el fin de aportar información respecto al posible origen de alteración en la motilidad progresiva, el objetivo del presente estudio fue evaluar la motilidad y morfología espermática, en estudiantes de la Universidad de Oriente.
MÉTODOS
Se realizó el espermatograma a 100 estudiantes de la Universidad de Oriente, Núcleo de Sucre, Cumaná, Venezuela, de acuerdo al criterio de la OMS (10), en el período enero-julio 2008. Los estudiantes que presentaron alteraciones en los parámetros del espermatograma, se les solicitaron dos muestras de semen adicionales con intervalo de seis a ocho semanas, con el fin de confirmar los resultados preliminares (13). Para este estudio se siguieron las normas de la declaración de Helsinki para investigaciones con humanos (14).
A los resultados se les aplicó un análisis de regresión lineal con un nivel de confianza del 95.%, para establecer relación entre el porcentaje de espermatozoides con motilidad progresiva y con las categorías de anormalidades de cabeza, pieza intermedia y pieza principal, así como exceso de citoplasma residual, en espermatozoides de estudiantes astenospérmicos y oligoastenospérmicos, empleando el programa estadístico Statgraphics Centurion XV.
RESULTADOS
En el estudio el 68 % de los estudiantes fueron normospérmicos, 12 % astenospérmicos, 11 % oligospérmicos y 9 % oligoastenospérmicos. La edad promedio en los estudiantes normospérmicos y con astenozoospermia, oligozoospermia y oligoastenozoospermia fue de 24,12±4,49; 24,83±7,22; 20,91±2,34 y 25,44±9,25, respectivamente.
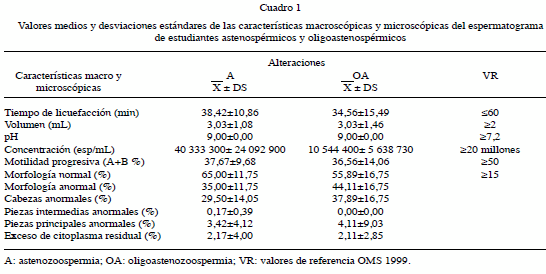
La media del porcentaje de espermatozoides con motilidad progresiva (A+B) en los estudiantes astenospérmicos fue de 37,67±9,68, y en los estudiantes oligoastenospérmicos de 36,56±14,06; mientras que la media del porcentaje de espermatozoides con morfología normal fue de 65,00±11,75 en los individuos astenospérmicos, y 55,89±16,75 en los estudiantes oligoastenospérmicos (Cuadro 1). Se hallaron alteraciones morfológicas en cabeza (Figura 1), pieza intermedia y principal, y exceso de citoplasma residual (Figura 2). Las anormalidades morfológicas principalmente observadas fueron a nivel de la cabeza.
En los estudiantes astenospérmicos hubo una correlación lineal negativa moderada entre motilidad progresiva y anormalidades de la pieza principal (r=-0,58) y exceso de citoplasma residual (r=-0,56), siendo estadísticamente significativo en el primer caso, mientras que en los estudiantes oligoastenospérmicos, se obtuvo una correlación lineal negativa moderada entre motilidad y anormalidades de cabeza (r=-0,57) estadísticamente no significativo (Cuadro 2).
DISCUSIÓN
En el presente estudio en los estudiantes astenospérmicos la disminución del porcentaje de la motilidad progresiva de espermatozoides estuvo correlacionada con un incremento en el porcentaje de espermatozoides con anormalidades de la cola del espermatozoide. Estos hallazgos guardan relación con investigaciones sobre la ultraestructura del espermatozoide, donde la astenozoospermia se ha asociado a anomalías estructurales de la pieza principal de la cola del espermatozoide como mal ensamblaje del axonema (15-19) o de la vaina fibrosa (20), con insuficiencia posterior de la motilidad espermática progresiva (21). Por otro lado, en una investigación llevada a cabo en ratones, la motilidad progresiva se ha asociado a proteínas filamentosas estructurales del axonema, que sugiere la presencia de genes codificadores de estas proteínas en humanos astenospérmicos (22). Igualmente, la astenozoospermia se ha asociado a defectos genéticos de la estructura del flagelo, como en el síndrome de Kartagener. La deficiencia motriz del espermatozoide puede proceder desde su origen testicular, en su paso por el epidídimo o al confluir con otros elementos del plasma seminal (5).
En los estudiantes astenospérmicos, aunque la correlación no fue significativa entre motilidad espermática y exceso de citoplasma residual (r= -0,56, P= 0,06), así como tampoco entre motilidad y defectos de cabeza en los oligoastenospérmicos (r= -0,57, P= 0,11), se observa una tendencia entre las variables. Al respecto, a pesar de que no existen publicaciones, que determinen una asociación entre motilidad y exceso de citoplasma residual, se observó en un estudio sobre espermatograma y características morfológicas de los espermatozoides en el testículo y epidídimo de cerdos blancos, que los espermatozoides mótiles progresivos aparecen primero en testículos (6.%-10.%), en la cabeza (20 %-30 %), cuerpo (40.%-50 %) y en la cola de epidídimo (85 %) y que en la medida en que los espermatozoides se trasladan ascendiendo hasta el epidídimo, pierden la gota citoplasmática (23), en base a ello se puede insinuar que la pérdida del citoplasma residual es importante en la motilidad del espermatozoide. Se señala que el exceso de citoplasma residual está asociado con la producción de espermatozoides anormales por un proceso de espermatogénesis defectuoso (4).
En relación con los defectos morfológicos de la cabeza del espermatozoide y su relación con motilidad, se ha comprobado que una pequeña proporción de espermatozoides móviles (menor de 25 %) de hombres fértiles, tiene capacidad para unirse in vitro a la zona pelúcida; tal capacidad está relacionada con la morfología de la cabeza espermática (24), del mismo modo, estudios recientes han demostrado que los daños morfológicos de la cabeza están relacionados con la fragmentación de ADN (25), y que el daño en el ADN de los espermatozoides y la motilidad, tienen una correlación negativa (26). Se ha evidenciado que el daño al ADN es ocasionado por estrés oxidativo, lo cual conduce a rupturas de cadenas individuales y dobles en el ADN de los espermatozoides, también la apoptosis y embalajes anormales cromosómicos contribuyen al daño del ADN (27).
Este estudio orienta hacia la causa probable de alteración de la motilidad progresiva, sugiriendo que este parámetro es afectado por defectos en la pieza principal de la cola y probablemente exceso de citoplasma residual en espermatozoides de estudiantes astenospérmicos y anormalidades de cabeza en espermatozoides de los oligoastenospérmicos. Se recomienda profundizar esta problemática con estudios que permitan descifrar y dar respuestas sobre las causas de motilidad progresiva afectada, en jóvenes estudiantes astenospérmicos y oligoastenospérmicos.
AGRADECIMIENTOS
A los estudiantes de la Universidad de Oriente, Núcleo de Sucre por el aporte de las muestras de semen y al Consejo de Investigación por la contribución financiera al proyecto número CI-02-010202-1390/08.
REFERENCIAS
1. Husáková P, Ulcová Z, Bibková K, Micanová Z. Semen quality of Pilsner University students. Cas Lek Cesk. 2008;147:85-88. [ Links ]
2. Álvares C, Castilla J, Martínez L, Ramírez J, Vergara F, Gaforio J. Biological variation of seminal parameters in healthy subjects. Hum Reprod. 2003;18:2082-2088. [ Links ]
3. Geneser F. Histología. 3ª edición. Madrid, Editorial Médica Panamericana S.A.; 2003.p.643-647. [ Links ]
4. World Health Organization. WHO laboratory manual for the examination and processing of human semen. 5ª edición. Cambridge, Cambridge University Press; 2010. [ Links ]
5. Teppa GA, Palacios TA. Evaluación actual de la infertilidad masculina. Invest Clín. 2004;45:355-370. [ Links ]
6. Gandini L, Lombardo F, Paoli D, Caponecchia L, Familiari G, Verlengia C, et al. Study of apoptotic DNA fragmentation in human spermatozoa. Hum Reprod. 2000;15:830-839. [ Links ]
7. Chemes H, Rawe V. Sperm pathology: A step beyond descriptive morphology. Origin, characterization and fertility potential of abnormal sperm phenotypes in infertile men. Hum Reprod. 2003;9:405-428. [ Links ]
8. Sun F, Ko E, Renée H, Martin R. Is there a relationship between sperm chromosome abnormalities and sperm morphology? Reprod Biol Endocrinol. 2006;4:1-6. [ Links ]
9. Kably A, Carballo E, Estévez S. Impacto de las anormalidades de la cabeza del espermatozoide como factor pronóstico en la infertilidad de causa no determinada. Ginecol Obstet Mex. 2008;76:151-155. [ Links ]
10. World Health Organization. WHO Laboratory Manual for the Examination of human semen and spermcervical mucus interaction. 4ª edición. Cambridge University Press; 1999. [ Links ]
11. Martínez J, de Mateo S, Vidal JM, Ballescà JL, Oliva R. Identification of proteomic differences in asthenozoospermic sperm samples. Hum Reprod. 2008;23:783-791. [ Links ]
12. Lhuillier P, Rode B, Escalier D, Lorès P, Dirami T, Bienvenu T, et al. Absence of annulus in human asthenozoospermia: Case Report. Hum Reprod. 2009;24:1296-1303. [ Links ]
13. Panidis D, Rousso D, Kourtis A, Gianoulis C, Papathanasiou K, Kalachanis J. Headless spermatozoa in semen specimens from fertile and subfertile men. J Reprod Med. 2001;46:947-950. [ Links ]
14. Asociación Médica Mundial. Declaración de Helsinki (DoH). 59ª Asamblea General, Seúl, Corea, octubre 2008. [ Links ]
15. Afzelius BA, Eliasson R. Flagellar mutants in man: On the heterogeneity of the immotilecilia syndrome. J Ultrastruct Res. 1979;69:43-52. [ Links ]
16. Escalier D. The cytoplasmic matrix of the human spermatozoon: Cross-filaments link the various cell components. Biol Cell. 1984;51:347-363. [ Links ]
17. Chemes HE, Olmedo SB, Carrere C, Oses R, Carizza C, Leisner M, et al. Ultrastructural pathology of the sperm flagellum: Association between flagellar pathology and fertility prognosis in severely asthenozoospermic men. Hum Reprod. 1998;13:2521-2526. [ Links ]
18. Mitchell V, Rives N, Albert M, Peers MC, Selva J, Clavier B, et al. Outcome of ICSI with ejaculated spermatozoa in a series of men with distinct ultrastructural flagellar abnormalities. Hum Reprod. 2006;21:2065-2074. [ Links ]
19. Moretti E, Pascarelli NA, Federico MG, Renieri T, Collodel G. Abnormal elongation of midpiece, absence of axoneme and outer dense fibers at principal piece level, supernumerary microtubules: A sperm defect of possible genetic origin? Fertil Steril. 2008;90:1201.e1203–e1208. [ Links ]
20. Escalier D. New insights into the assembly of the periaxonemal structures in mammalian spermatozoa. Biol Reprod. 2003;69:373-378. [ Links ]
21. El-Taieb MA, Herwig R, Nada EA, Greilberger J, Marberger M. Oxidative stress and epididymal sperm transport, motility and morphological defects. Eur J Obstet Gynecol Reprod Biol. 2009;144(Suppl 1):199- 203. [ Links ]
22. Roy A, Lin Y, Agno J, DeMayo F, Matzuk M. Tektin 3 is required for progressive sperm motility in mice. Mol Reprod Dev. 2009;76:453-459. [ Links ]
23. Matthew O, Oniovosa U. Spermiogram and morphological characteristics in testicular and epididymal spermatozoa of large white woar in Nigeria. Int J Morphol, 2005;23:235-239. [ Links ]
24. Cruz I, Colmenares M, Berrueta CL, Gómez PR, Montes H, Berrueta L. Evaluación de la calidad del espermatozoide humano: comparación entre la integridad del ADN espermático y variables del semen. Invest Clín. 2010;51:87-99. [ Links ]
25. Mehdi M, Khantouche L, Ajina M, Saad A. Detection of DNA fragmentation in human spermatozoa: Correlation with semen parameters. Andrologia. 2009;41:383-386. [ Links ]
26. Tug N, Sandal S, Ozelgun B, Yilmaz B. Correlation of spermiogram profiles with DNA damage in sperm cells of infertile men: A comet assay study. Gynecol Endocrinol. 2010;26:1-6. [ Links ]
27. Shamsi MB, Kumar R, Dada R. Evaluation of nuclear DNA damage in human spermatozoa in men opting for assisted reproduction. Indian J Med Res. 2008;127:115-123. [ Links ]