Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Obstetricia y Ginecología de Venezuela
versión impresa ISSN 0048-7732
Rev Obstet Ginecol Venez vol.73 no.2 Caracas jun. 2013
Uso del balón SOS Bakri en atonía uterina. Serie de casos en un hospital universitario de tercer nivel
Drs. Javier Rodriguez-Kovacs*, Jesús Veroes*, Leonel González*, Mireya González Blanco*, Freddy Bello*
* Médicos Especialistas en Obstetricia y Ginecología. Maternidad Concepción Palacios. Caracas, Venezuela
RESUMEN
Objetivo: Describir el uso del balón SOS Bakri en el tratamiento de la hemorragia posparto vaginal por atonía uterina después de la falla del tratamiento médico. Métodos: Se presenta una serie de 15 pacientes con hemorragia posparto vaginal por atonía uterina, tratadas satisfactoriamente con taponamiento uterino con balón SOS Bakri luego de no responder a tratamiento médico ni a masaje uterino. Resultados: La edad promedio de las pacientes fue 22,7 (± 6,8) años. La edad gestacional promedio fue 36,3 (± 2,6) semanas. El balón se insertó en los primeros 30 minutos del diagnóstico de la atonía uterina. El tiempo total que permaneció el balón en útero fue de 13,6 (± 6,1) horas. La pérdida hemática posterior a la colocación del balón fue en total 265,3 (± 258,1) cm3. El balón SOS Bakri fue efectivo en 100 % de las pacientes. Ninguna de las pacientes ameritó histerectomía. Conclusiones: El balón SOS Bakri es una alternativa eficaz mínimamente invasiva, económica y de fácil acceso en la terapéutica de la AU que no responde al tratamiento médico.
Palabras clave: Atonía uterina, Hemorragia posparto, Balón SOS Bakri, Taponamiento uterino.
SUMMARY
Objective: To describe the use of SOS Bakri Balloon in the treatment of postpartum hemorrhage after unsuccessful medical treatment of uterine atony. Method: We describe a case series of 15 patients with severe uterine atony after vaginal delivery that were successfully managed with SOS Bakri balloon after failed uterine massage and medical treatment. Results: The mean patient age was 22.7 (± 6.8) years. The mean gestational age was 36.3 (± 2.6) weeks. The balloon was inserted within 30 minutes of diagnosis of uterine atony. The mean length of balloon placement was 13.6 (± 6.1) hours. The mean total blood loss post balloon insertion was of 265.3 (± 258.1) cm3. The SOS Bakri balloon was effective 100 % of the time. None of the patient required hysterectomy. Conclusion: Insertion of SOS Bakri balloon is a simple conservative live saving alternative in the management of postpartum uterine atony.
Key words: Uterine atony. Postpartum hemorrhage. SOS Bakri balloon. Uterine tamponade.
INTRODUCCIÓN
Según la Organización Mundial de la Salud (OMS), la mortalidad materna se estima actualmente en 529.000 muertes por año, un número que se traduce en una tasa global de 400 muertes maternas por 100 000 nacidos vivos (1). La hemorragia posparto (HPP), es la primera causa responsable de más de un cuarto de todas estas muertes en el mundo, lo que corresponde a una muerte materna cada 4 minutos, y de estas muertes más de un 50 % ocurren las primeras 24 horas posparto. La causa que encabeza la lista de estas hemorragias es la atonía uterina (AU) (1). La AU complica 1 de cada 20 partos, y se produce por una falla en la contracción miometrial luego del alumbramiento (2).
En países en vías de desarrollo el riesgo de morir a causa de HPP es aproximadamente 1 de cada 1 000 nacimientos (1). En Venezuela la hemorragia como causa de muerte materna se ubica dentro de los 3 primeros lugares. En Maracaibo, entre 1993 y 2002, representó un 35,38 % ocupando el primer lugar (3). En el Hospital Universitario de Los Andes (1974- 2005) ocupó el segundo lugar con 32,22 % (4). En el Estado Carabobo se encuentra en primer lugar con 33,33 %, según una revisión de mortalidad materna de 2001-2004 (5). En la Maternidad Concepción Palacios, en el período 1982-1991, se reportó la hemorragia como la tercera causa de muerte materna con 17,4 % (6).
No existe una definición satisfactoria para HPP. Se ha utilizado como criterio diagnóstico la pérdida de sangre superior a 500 mL posterior a un parto vaginal o mayor a los 1 000 mL posterior a una cesárea, sin embargo, el volumen medio de sangre perdido en un parto no complicado se puede acercar a estas cantidades (7,8). La estimación subjetiva de la pérdida de sangre en el parto es notoriamente inexacta, y la subestimación es la regla (8). También se ha utilizado, un descenso en el hematocrito del 10 % para definir HPP, pero determinaciones de las concentraciones de la hemoglobina y del hematocrito no pueden reflejar una pérdida aguda. Los signos de inestabilidad hemodinámica y oliguria no ocurren hasta que la pérdida hemática es del 10 % o más del volumen total de la sangre (9).
La HPP se clasifica cronológicamente como primaria y secundaria; la primaria ocurre en las primeras 24 horas del parto y la secundaria entre las 24 horas y las 6 semanas posparto. La HPP primaria ocurre en 4 % a 6 % de los embarazos, y es causada por AU en el 80 % o más de los casos (10,11).
Los factores de riesgo para AU incluyen condiciones en las que el útero se encuentra sobredistendido (polihidramnios, gestación múltiple, macrosomía fetal, anormalidad fetal como hidrocefalia severa, etc.), fatigado (inducción/conducción de trabajo de parto, parto precipitado o prolongado, multiparidad, nuliparidad, antecedente de HPP, corioamnionitis, fiebre), o simplemente es incapaz de contraerse (uso de agentes relajantes como tocolíticos o anestesia general, leiomiomas uterinos, placenta previa, retención placentaria) (2,12,13). Se describen otros factores de riesgo que están directamente relacionados con la AU, a pesar de no tener un efecto demostrable sobre el miometrio como son, edad menor a 20 años o mayor a 40 años, trastornos hipertensivos del embarazo (THE), retención de restos placentarios, así como antecedente de hemorragias del tercer trimestre (12,14). A pesar de la identificación de factores de riesgo, la AU se mantiene impredecible en las mujeres de bajo riesgo (1,10,12).
Al tratar la HPP, es necesaria la toma de decisiones por un equipo multidisciplinario, con el objetivo de controlar el sangrado y lograr la hemostasia. En primer lugar se inicia masaje uterino bimanual, acompañado de la administración de uterotónicos (oxitocina, metilergonovina y prostaglandinas sintéticas) (14-16); en caso de continuar la pérdida hemática se recurre a tratamiento quirúrgico inicialmente conservador (taponamiento uterino, ligadura de arterias hipogástricas, uterinas y/u ováricas, suturas compresivas B-Lynch, hasta la embolización de arterias uterinas y/o hipogástricas) y como última opción la histerectomía (17-19). El tratamiento de la HPP puede variar enormemente entre pacientes, dependiendo de la etiología del sangrado, las opciones terapéuticas disponibles, y el deseo de fertilidad futura (14).
Una evaluación en el Reino Unido demostró que la histerectomía era el procedimiento quirúrgico más común en mujeres que no responden a una combinación de uterotónicos para el tratamiento de la AU (19). Como la cirugía que sigue una HPP puede causar la pérdida adicional de sangre y un período de convalecencia largo, se han investigado procedimientos no quirúrgicos para su resolución.
La técnica de primeros auxilios para parar un vaso sangrante es aplicar un torniquete, o bien presión sobre el vaso que sangra con vendaje compresivo. La aplicación de presión suficiente al comprimir un vaso sanguíneo trae a menudo la resolución del sangrado. Esta técnica funciona porque la presión del torniquete o vendaje es superior a la del vaso sanguíneo. Si la presión se aplica durante el tiempo suficiente, la sangre se puede coagular, y formar un sello permanente (13,20,21).
La sangre fluye en el útero con una presión de aproximadamente 120/80 mmHg, para una presión arterial media de 90 mmHg. La trama de arterias espiraladas del útero baja la presión arterial con la cual la sangre entra en el útero. Cuando la placenta se separa, se exponen los senos venosos y las arterias espiraladas, y el sangrado ocurre desde el lecho placentario. La contracción uterina produce hemostasia inmediata. Si en cambio, posterior a esto se produce la AU, ocurre sangrado profuso. Entonces se procede a la administración de uterotónicos, y compresión bimanual, para la estimulación uterina (20,22).
El balón SOS Bakri mide 58 cm de largo y está hecho de silicona. La capacidad del globo, cuando es inflado con agua o solución salina estéril, es de 800 cm3 máximo, pero el uso recomendado es de 500 cm3. El balón puede ser llenado con un volumen de menos de 500 cm3 para los casos de menor tamaño uterino. Sin embargo, se recomienda que sea mínimo de 250 cm3 para lograr la hemostasia en las condiciones clínicas indicadas para su aplicación. La punta de la sonda está diseñada con dos agujeros para los fines de drenaje (23, 24).
Este balón fue inicialmente diseñado para el tratamiento de la HPP secundaria a placenta previa y de inserción baja (23,24), y en los primeros trabajos se consideraba la AU como contraindicación para su uso (23). Sin embargo, en un trabajo en el que se usó el balón SOS Bakri como tratamiento de la HPP, que incluyó 15 casos de HPP de los cuales 8 fueron por AU, el taponamiento con balón tuvo 100 % de efectividad (25).
El control de la hemorragia uterina con taponamiento intracavitario ha sido descrito por más de un siglo para evitar la histerectomía (26). Drucker y col. (27) informaron la utilización con éxito de taponamiento uterino con gasa estéril en el caso de que todas las otras medidas hayan fracasado y recomendaron su uso para los casos en que las lesiones traumáticas del tracto genital habían sido excluidas. Esto se hizo eco de las opiniones de autores anteriores quienes trataban las pacientes con HPP, de forma efectiva sin el beneficio de los poderosos agentes farmacológicos actuales (28,29).
El taponamiento con balón ha sido utilizado con éxito en prostatectomía (30), hemorragia masiva de vejiga (31) y várices esofágicas. Goldrath (32) utilizó una sonda Foley 30 mL para taponamiento intrauterino en pacientes con hemorragia después de una variedad de procedimientos ginecológicos como la ablación endometrial con láser, con éxito total en 17 de 20 pacientes, y sin complicaciones. La sonda de Foley ha sido utilizada de manera efectiva por otros autores para el control de la HPP (33). El volumen del útero posparto inmediato es demasiado grande para lograr eficazmente el taponamiento con una sonda Foley, lo que indujo a la utilización de hasta 5 sondas de Foley de 80 mL simultáneas (34) y sondas de mayor capacidad como la de Sengstaken-Blakemore (21,35,36,37), el catéter urológico de Rüsh (38,39), y hasta condones (40,41); lo que motivó el diseño de una sonda exclusiva para el tratamiento de la hemorragia uterina posparto (24). La primera serie en la que se describe el uso de taponamiento uterino como tratamiento en HPP por AU consiste en 16 casos en los que se utilizó un balón de Sengstaken-Blakemore para la prueba de taponamiento, como última medida antes de la laparotomía. La hemorragia cedió inmediatamente en 14 pacientes, sin requerir intervención adicional. En las 2 pacientes en quienes el sangrado no cesó, hubo una reducción significativa del mismo, lo que permitió varias horas para estabilización antes de la cirugía (21).
La prueba de taponamiento uterino con balón es una alternativa quirúrgica, mínimamente invasiva (20). Tan pronto falla el uso de uterotónicos, la prueba de taponamiento podría reducir la cantidad de sangre perdida e indicar si la cirugía definitiva es necesaria, en solo pocos minutos.
MÉTODOS
Es un estudio descriptivo, tipo serie de casos que se realizó en una población de pacientes que acudieron al Servicio de Sala de Partos de la Maternidad Concepción Palacios quienes presentaron HPP vaginal por AU refractaria a tratamiento médico, posterior a embarazo igual o mayor a 28 semanas. Se excluyeron las pacientes que tenían retención de restos ovulares, inversión uterina, rotura uterina, cicatrices uterinas previas, malformaciones uterinas, laceraciones del tracto genital inferior no resueltas, acretismo placentario, cáncer cervical, descarga purulenta a través de cérvix o vagina y HPP secundaria a traumatismo abdominal. El estudio se realizó en apego a la Convención de Helsinki y Ley de Ejercicio de la Medicina, con el consentimiento informado de las pacientes y la aprobación del comité de bioética del hospital.
Todas las pacientes tuvieron monitoreo de signos vitales (nivel de conciencia, pulso, tensión arterial, y saturación de oxígeno), dos vías venosas periféricas con catéter calibre 14 o 16 gauge, se les administró de 2 000 - 3 000 cm3 de soluciones cristaloides vía endovenosa a goteo rápido, oxígeno al 100 % por máscara a 4 litros por minuto, se les cateterizó la vejiga urinaria con sonda de Foley conectado a recolector para monitoreo de líquidos eliminados. Se realizaron pruebas de laboratorio que incluyeron hematología completa, tiempo de protrombina, tiempo parcial de tromboplastina y fibrinógeno, pruebas de funcionalismo renal y hepático, grupo sanguíneo ABO y Rh. Se fijaron 2 a 4 unidades de concentrado globular. Se realizó revisión uterina y del canal del parto bajo anestesia regional o general para excluir la retención de restos ovulares, rotura uterina y/o laceraciones del tracto genital inferior. En caso de demostrar retención intrauterina de restos ovulares, se realizó la remoción manual o instrumental y si se hallaban laceraciones del tracto genital inferior fueron reparadas. Todas las pacientes fueron tratadas inicialmente con masaje uterino bimanual y uterotónicos: oxitocina vía endovenosa 30 unidades en 500 cm3 de solución salina al 0,9 %, o solución Ringer lactato a 21 gotas por minuto, más metilergonovina vía intramuscular 0,2 mg, dosis única, solo si la paciente tenía cifras de tensión arterial menores a 140/90 mmHg y negaba THE; más misoprostol vía rectal, 800 μg en dosis única. Los casos que no respondieron a estas medidas, fueron seleccionadas para la realización de la prueba de taponamiento uterino con balón SOS Bakri. Se incluyó un total de 15 pacientes.
El balón fue previamente esterilizado con óxido de etileno. La prueba de taponamiento uterino con balón SOS Bakri se realizó con la paciente en posición ginecológica bajo normas de antisepsia, se realizó pinzamiento del labio anterior del cuello uterino con una pinza de Föester. Se sostuvo el balón desinflado en la punta con una segunda pinza de Föester para facilitar su inserción en la cavidad uterina hasta tener contacto con el fondo uterino (Figura 1). Se llenó el balón con 500 cm3 de solución salina estéril (Figura 2) hasta ser apenas visible en el canal cervical. Luego se conectó a una bolsa recolectora, y se aplicó tracción suave para confirmar que se encontraba firmemente fijado a la cavidad uterina. Si se observaba sangrado mínimo (menor o igual a 100 cm3) o nulo a través del cérvix o el lumen del balón en los primeros 5 minutos posterior a su colocación la prueba de taponamiento fue considerada positiva, posteriormente se empaquetaba la vagina con una compresa húmeda con solución salina estéril para evitar la expulsión del balón. Si se evidenciaba sangrado significativo (mayor a 100 cm3) a través del cérvix o del lumen del balón, en los primeros 5 minutos posteriores a su colocación, se consideraría una prueba de taponamiento negativa y se procedería al tratamiento quirúrgico expedito.
Se monitorizaron: pérdida hemática por balón, diuresis, presión arterial, pulso, saturación del oxígeno, altura uterina horaria, sangrado vaginal activo, y resultados de exámenes de laboratorio. Se utilizó una infusión de oxitocina vía endovenosa 30 unidades en 500 cm3 de solución salina al 0,9 %, o solución Ringer lactato a 28 gotas por minuto las primeras 24 horas. Se administraron antibióticos profilácticos intravenosos de amplio espectro mientras el balón permanecía in útero.
El balón SOS Bakri permaneció in útero durante un mínimo de 6 horas en pacientes hemodinámicamente estables, y en pacientes que no cumplieron con este criterio el balón permaneció in útero hasta la estabilización hemodinámica por un máximo de 24 horas, en este período se realizó la transfusión de hemoderivados de ser necesario.
Al corroborar la estabilidad hemodinámica y un gasto bajo (menor a 100 cm3/hora) en la bolsa recolectora conectada al SOS Bakri, el globo fue desinflado y se retiró tanto el taponamiento vaginal como el balón. En caso de observarse sangrado genital activo se procedería a inflar nuevamente el balón, para cumplir un máximo de 24 horas in útero, si posterior a este lapso al desinflar el balón se observaba sangrado activo se llevaría a cabo el tratamiento quirúrgico expedito.
Se monitorizaron: pérdida hemática por balón, diuresis, presión arterial, pulso, saturación del oxígeno, altura uterina horaria, sangrado vaginal activo, y resultados de exámenes de laboratorio. Se utilizó una infusión de oxitocina vía endovenosa 30 unidades en 500 cm3 de solución salina al 0,9 %, o solución Ringer lactato a 28 gotas por minuto las primeras 24 horas. Se administraron antibióticos profilácticos intravenosos de amplio espectro mientras el balón permanecía in útero.
El balón SOS Bakri permaneció in útero durante un mínimo de 6 horas en pacientes hemodinámicamente estables, y en pacientes que no cumplieron con este criterio el balón permaneció in útero hasta la estabilización hemodinámica por un máximo de 24 horas, en este período se realizó la transfusión de hemoderivados de ser necesario.
Al corroborar la estabilidad hemodinámica y un gasto bajo (menor a 100 cm3/hora) en la bolsa recolectora conectada al SOS Bakri, el globo fue desinflado y se retiró tanto el taponamiento vaginal como el balón. En caso de observarse sangrado genital activo se procedería a inflar nuevamente el balón, para cumplir un máximo de 24 horas in útero, si posterior a este lapso al desinflar el balón se observaba sangrado activo se llevaría a cabo el tratamiento quirúrgico expedito.
Todos los datos fueron recolectados mediante un instrumento en el que se incluyeron datos personales, antecedentes médicos, quirúrgicos y obstétricos, estado hemodinámico inicial, tiempo de aparición de la AU posterior al parto, maniobras farmacológicas y no farmacológicas previas, pérdida hemática, hemoderivados utilizados, tiempo de estabilización de la paciente, así como el resultado de la prueba de taponamiento reportada como positiva o negativa. Los resultados fueron descritos mediante frecuencias absolutas, porcentajes, media y desviación estándar, comparados por diferencias de proporciones y aproximación a la curva normal para una P <0,05 cuyos valores topes fueron 1,96 y 2,58 respectivamente. Se presentaron mediante cuadros y/o gráficos estadísticos diseñados para tal fin.
RESULTADOS
El promedio de edad fue 22,7 ± 6,8 años, tenían en promedio 3 ± 2 embarazos, con 1 ± 1 partos y 1 ± 1 abortos anteriores. La edad de gestación media fue 36,3 ± 2,6 semanas, con un mínimo de 31,4 y un máximo de 41,1 semanas.
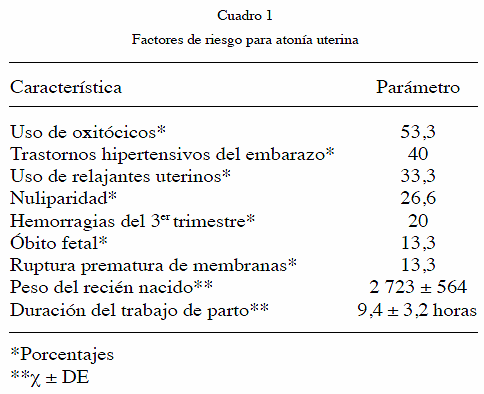
En cuanto a los factores de riesgo para AU (Cuadro 1) destaca un 53,3 % de uso de oxitócicos, 40 % de THE, 33,3 % de uso de relajantes uterinos y 26,6.% de nuliparidad. Al agrupar a las pacientes por número de factores de riesgo la distribución es la siguiente: ningún factor de riesgo, 2 pacientes (13,3 %), un factor de riesgo, 4 pacientes (26,6 %), dos o más factores de riesgo, 9 pacientes (60 %). La dosis de oxitocina empleada durante el trabajo de parto fue 8 ± 2 mUI/min.
Respecto a la distribución según el peso de los recién nacidos, el 66,6 % pesaron entre 2 500 y 3 999 gramos y el 33,3 % menos de 2 500 gramos.
El tiempo promedio entre el período expulsivo y el inicio del sangrado por AU fue 20,5 ± 5,6 minutos, con extremos entre 14 y 270 minutos, correspondiendo este valor a una sola paciente que actuaba como factor desviador, por lo que no se incluyó en el cálculo. La moda fue de 20 minutos. El tiempo promedio entre el inicio de la AU y la colocación del balón fue de 29,3 ± 7 minutos, con extremos entre 20 y 40 minutos y una moda de 30 minutos. El tiempo que permaneció el balón in útero fue de 13 ± 6,1 horas con un mínimo de 6 y un máximo de 23 horas.
La pérdida hemática promedio a los 5 minutos de insertado el balón fue de 65,3 ± 37,2 cm3 y la pérdida hemática total promedio fue de 265,3 ± 258,1 cm3 (Figura 3). La prueba de taponamiento fue eficaz en 100 % de las pacientes.
La diferencia entre los parámetros clínicos durante y después de la atonía fue significativa para todos los parámetros excepto para la altura uterina (Cuadro 2). El tiempo requerido para la estabilización hemodinámica de las pacientes fue de 88,7 ± 38,3 min. De estas, 4 pacientes (26,66 %) se estabilizaron en menos de una hora mientras que 5 pacientes (33,3.%) requirieron 2 horas o más, el 40 % restante se estabilizó entre los 60 y 120 min.
En relación con los parámetros paraclínicos, se observa (Cuadro 3) que las cifras de hemoglobina, hematocrito y plaquetas descendieron. Se prolongaron tanto el tiempo de protrombina como el tiempo parcial de tromboplastina. Todas las diferencias fueron estadísticamente significativas.
Solo 5 pacientes requirieron ingresar en la unidad de terapia intensiva de adultos (UTIA). El tiempo promedio de estancia en UTIA fue de 1,33 ± 0,89 días. Permanecieron hospitalizadas entre 2 y 11 días, con una media de 4,33 ± 2,35 días. Las pacientes requirieron un promedio de 2 ± 1 unidades de concentrado globular por paciente, con un mínimo de 0 y un máximo de 12, cifra que se presentó en una sola paciente quien fue excluida del cálculo por representar un factor desviador. Observamos que las pacientes con THE (6 pacientes) necesitaron un promedio de 4,2 unidades de concentrado globular (UCG) por paciente versus 1,7 UCG en aquellas sin THE (9 pacientes) (P 0,023). 5 pacientes (33,3.%) se complicaron con coagulación intravascular diseminada (CID) y fueron transfundidas con 6 unidades de plasma fresco congelado, 6 unidades de crioprecipitado y 6 unidades de concentrado plaquetario respectivamente.
DISCUSIÓN
Durante y después de la tercera etapa del trabajo de parto ocurren eventos fisiológicos cruciales para la prevención de la AU. La contracción y retracción de las fibras de músculo liso uterino funcionan obliterando los vasos sanguíneos que proveen al lecho placentario con un flujo hemático aproximado de 800 cm3/min. Si estos mecanismos fallan, clínicamente se evidencia un útero de consistencia pastosa, se produce un descenso brusco en la volemia, disminuye el aporte de oxígeno a los tejidos y como consecuencia un estado de hipoxia tisular. El metabolismo anaeróbico resultante tanto de la fibra de músculo liso uterino, así como de otros tejidos, aumenta la producción de óxido nítrico, peróxidos de lípidos y otros metabolitos tóxicos que tienen el potencial de dañar la membrana celular del miocito, lo que hace a la célula incapaz de reaccionar ante el estímulo de agentes uterotónicos bien sea endógenos o exógenos (22,42). Este proceso fisiopatológico, en muchos casos, hace a la AU posparto intratable con agentes farmacológicos.
Existen factores de riesgo que clásicamente se han asociado con AU, como son la inducción/conducción de trabajo de parto, trabajo de parto prolongado, parto precipitado, retención de restos ovulares, placenta previa, corioamnionitis, multiparidad, primiparidad, THE y las causas de sobre distensión uterina como embarazo múltiple, macrosomía fetal, polihidramnios entre otros (14,22,43).
De estos factores de riesgo clásicos el grupo de pacientes incluidas en esta serie demostró una combinación de 2 o más en el 60 % de los casos; los más resaltantes fueron: uso de oxitócicos en 53,3.%, los THE en 40 % (6 pacientes) a las que a su vez se les sumó el uso de relajantes uterinos (sulfato de magnesio) como profilaxis para eclampsia en 5 de ellas. Oyelese y col. (44) en su trabajo sobre HPP describen el efecto negativo que tiene el sulfato de magnesio sobre la respuesta del músculo uterino a los uterotónicos, por lo que remarcan que durante una AU debe omitirse el uso de sulfato de magnesio, se deben utilizar medicamentos alternativos como profilaxis de las convulsiones eclámpticas y reanudar el tratamiento con sulfato de magnesio luego de tratada la atonía.
Se halló un factor de riesgo único asociado a AU en 26,6 % de los casos (4 pacientes) distribuidos de la siguiente forma, 3 nulíparas y 1 conducción de trabajo de parto, y a su vez no se demostró factor de riesgo en 2 pacientes. En ninguno de los casos se presentó como factor de riesgo la sobredistensión uterina; de hecho, el peso promedio de los recién nacidos fue 2 723 ± 564 g y el peso máximo fue 3 500 g, Zhang y col. (45) describen como factor de riesgo para HPP un peso al nacer superior a los 4 500 g lo que corresponde a 1 000 g por encima del peso máximo neonatal en esta serie.
La nuliparidad está fuertemente relacionada con AU cuando se realiza inducción de trabajo de parto (46,47), en este grupo no hubo inducción de trabajo de parto, solo una de las nulíparas incluidas en el estudio (1 de 4) recibió oxitócicos para conducción de trabajo de parto.
A las mujeres a quienes se les realizó conducción del trabajo de parto (53,3 %), se les administró en promedio una infusión endovenosa de oxitocina de 8 mUI/min ± 2, lo que según Smith y col. (48) se corresponde con protocolo de alta dosis. Existe un riesgo teórico de AU posterior a la conducción de trabajo de parto demostrado por publicaciones de algunos autores como Orhue y col. (47) y Hourvitz y col. (49). La debilidad de estos trabajos es que incluyen poblaciones de estudio pequeñas. La publicación de Merrill y col. (50) con más de 1 300 parturientas le da un vuelco a esta teoría por tratarse de un trabajo prospectivo y doble ciego donde se demostró en el brazo de conducción de trabajo de parto con protocolo de alta dosis, que el uso de infusiones tan altas como 80 mUI/min, no aumentó el riesgo de hemorragia puerperal.
Stones y col. (51) describen el trabajo de parto precipitado y el trabajo de parto prolongado como factores de riesgo en HPP, Friedman (52) establece el trabajo de parto prolongado como aquel mayor a 18 horas en nulíparas y mayor a 14 horas en multíparas, así como define el trabajo de parto precipitado aquel menor a 3 horas. El tiempo promedio de trabajo de parto en este grupo fue 9,4 horas con un mínimo de 6,2 horas y un máximo de 12,6 horas respectivamente.
Al igual que en los trabajos epidemiológicos sobre HPP de Callaghan y col. (53) y Bateman y col. (12) en este trabajo se demostró que la AU con frecuencia ocurre en ausencia de factores de riesgo (13,3 %). Bateman y col. (12) hallaron que solo 38 % de la población estudiada presentó un factor de riesgo identificable, en contraste con 26,6 % en la presente serie. Esto resulta de gran importancia, al poner de manifiesto que no siempre es posible predecir la aparición del cuadro, lo que nos obliga a permanecer alertas ante la evolución de las pacientes, independientemente de que se trate de un parto completamente normal.
El promedio de edad de las pacientes incluidas fue 22,7 ± 6,8 años, cabe resaltar que Bateman y col. (12) en su trabajo poblacional identifica la edad como un factor de riesgo independiente para AU, donde las pacientes con edades menores a 20 años y mayores de 40 años tienen un riesgo aumentado. La edad en la presente serie se distribuyó entre 16 y 40 años y 7 de las pacientes fueron menores de 20 años (46 %).
Según las revisiones de Lalonde y col., (20) Combs y col. (10) y la ACOG (14), la HPP primaria es causada en un 80 % aproximadamente por AU, mientras que en la HPP secundaria la AU es responsable de menos del 1 % de los casos. En este trabajo la distribución del tiempo posterior al parto en el que aparece la atonía, demuestra que todas las pacientes sangraron en las primeras 24 horas posparto, y no solo eso, sino que en el 93,3 % el tiempo de aparición de la atonía fue igual o menor a los 30 minutos; solo una paciente se vio afectada después de los 30 minutos.
Al ser identificada la AU se inician las maniobras de reanimación tanto físicas como farmacológicas con la finalidad de lograr el cierre de los vasos sanguíneos que nutren al lecho placentario por contracción del miometrio, las conocidas ligaduras vivientes de Pinard, o por compresión directa sobre los vasos sangrantes; este momento es determinante en la vida de la paciente y ha sido denominado por Lalonde y col. (20) como la hora dorada, período durante el cual se debe restituir la volemia y contrarrestar el sangrado. La probabilidad de supervivencia disminuye considerablemente después de la primera hora si la paciente no se encuentra efectivamente estabilizada. Es en este momento donde la compresión directa del lecho sangrante por el Balón SOS Bakri cobra vital importancia. En esta serie, el tiempo transcurrido entre la aparición de la atonía y la colocación del Balón SOS Bakri fue en promedio de 29,3 ± 7 minutos, con un máximo de 40 minutos. Cabe destacar que durante este período se aplicaron todas las medidas para cohibir el sangrado y revertir el proceso porque las pacientes a quienes se les colocó el balón fueron solo aquellas en quienes no se obtuvo la respuesta esperada.
Durante la atonía existe un torrente hasta de 800 cm3/min de sangre hacia el lecho placentario sin control; en este trabajo no fue posible calcular la pérdida hemática previa a la inserción del balón, sin embargo, de forma indirecta se observó un descenso promedio de hemoglobina de 10,5 g/dL a 6,8 g/dL entre el inicio del sangrado y la inserción del balón, similar a los hallazgos obtenidos por Doumouchtsis y col. (36) quienes reportaron cifras de hemoglobina preparto promedio de 11,5 g/dL y poshemorragia de 7,3 g/dL.
A los 5 minutos de la inserción del Balón SOS Bakri, la pérdida hemática fue de 65,3 ± 37,2 cm3 con un mínimo de 0 cm3 y un máximo de 100 cm3 a través de la luz del catéter; esto fue traducido como una prueba de taponamiento positiva, como fue descrita por Condous y col. (21) en su serie en la que utilizó el catéter esofágico de Sengstaken–Blakemore y describió la prueba de taponamiento positiva como aquella que tenía subjetivamente una pérdida nula o mínima de sangre a través del catéter posterior a su colocación. Esta descripción hace la prueba de taponamiento muy inespecífica en cuanto a tiempo y cantidad de sangre perdida. En la presente investigación se limitó el tiempo de la prueba de taponamiento a 5 minutos y se cuantificó la pérdida hemática resultante en un máximo de 100 cm3 en ese periodo para hablar de una prueba positiva. Con estos parámetros, no se obtuvo ninguna prueba de taponamiento negativa. Vitthala y col. (25) describieron una efectividad del 100 % en el tratamiento de la HPP vaginal por AU en 8 casos utilizando el balón SOS Bakri, lo que se compara con esta serie. Llama la atención que Condous y col. (21) en su serie de 16 casos de taponamiento uterino con catéter esofágico de Sengstaken–Blakemore incluyó 10 pacientes con diagnóstico de AU, de las cuales 1 paciente no respondió positivamente al taponamiento por lo que se llevó a mesa operatoria para histerectomía obstétrica de emergencia. Posteriormente los autores analizaron este caso y atribuyen la falla de la prueba de taponamiento uterino al volumen utilizado para insuflar el balón, el cual describen fue en promedio 167 cm3. Esto contrasta significativamente con el grupo de pacientes de esta serie, en quienes se utilizó un volumen de insuflación del catéter de 500 cm3 fijo, sin pruebas de taponamiento negativas; ello equivale a una presión intraluminal generada por el balón SOS Bakri, que alcanzaba cifras de hasta 300 mmHg según el trabajo original (23), suficientes como para contrarrestar la presión arterial sistólica y así yugular la hemorragia.
La altura uterina fue un parámetro clínico que se utilizó para descartar la acumulación de sangre entre el balón y la pared uterina. En ninguno de los casos hubo ascenso del fondo uterino, por el contrario, llama la atención que posterior al taponamiento existe una ligera tendencia al descenso de la altura uterina, probablemente debido a la contracción del miometrio. Este parámetro no había sido considerado en publicaciones previas de taponamiento uterino con balón.
El gasto total a través de la luz del catéter fue de 265,3 ± 258,1 cm3 con un mínimo de 0 cm3 y un máximo de 1 050 cm3; se trató de una única paciente con gasto mayor a 500 cm3, quien desde el punto de vista estadístico desvía el promedio, por lo que es importante considerar que la mayoría de las pacientes perdió 50 cm3 durante todo el tiempo que estuvo el balón in útero, este tiempo fue en promedio, 13 ± 6,12 horas con un mínimo de 6 horas y un máximo de 23 horas, valores que se encuentran muy por debajo a los obtenidos por Doumouchtsis y col. (36) quienes reportaron en promedio 25 horas con un rango entre 5 horas 20 minutos y 50 horas. Condous y col. (21) por su parte, reportaron un tiempo medio de 26 horas 14 minutos.
El comportamiento de los parámetros clínicos y para clínicos recopilados aquí expresan la agresividad del sangrado. Durante la atonía, las pacientes cursaron con inestabilidad hemodinámica importante, con signos compatibles con shock moderado a severo que, según Martel y col. (54) representa una pérdida hemática entre 1 500 a más de 2 000 cm3, o el equivalente al 20 % - 40 % de la volemia, con niveles falsamente normales de hemoglobina y hematocrito.
Debido a lo rápido de su instalación, el descenso de la volemia no produjo cambios inmediatos en la concentración de sus componentes, como era de esperarse. Debido a esta falsa normalidad se inició la terapia transfusional sobre la base de la clínica, más que en valores de laboratorio. Lo contrario sucedió inmediatamente después de la colocación del balón y la reanimación con líquidos, cuando se constató un descenso en los valores de hemoglobina y hematocrito que resultaron estadísticamente significativos con respecto a los tomados durante la atonía, esto a causa de la hemodilución posreanimación.
El tiempo necesario para reanimar a la paciente y lograr la estabilidad hemodinámica después de la colocación del balón fue de 88,7 ± 38,3 minutos con un máximo de 140 minutos. Solo 2 de las 15 pacientes se reanimaron únicamente con cristaloides y coloides, las 13 restantes ameritaron como mínimo 2 unidades de concentrado globular, en promedio 2 y en 1 solo caso se necesitaron 12 unidades de concentrado globular.
Es de destacar que si bien la recuperación hemodinámica de las pacientes es producto de la terapia con hemoderivados, la utilidad real del balón fue permitir la posibilidad de recuperar a la paciente sin aplicar otras medidas más agresivas como la realización de la histerectomía con o sin ligadura de las arterias hipogástricas u otras técnicas quirúrgicas. Incluso se describe que de requerirse estos procedimientos después de colocado el balón, se podrían realizar en mejores condiciones.
Solo 5 de las 15 pacientes ingresaron a UTIA (33,3.%) con un mínimo de 1 día y un máximo de 3 días, cifras similares a las presentadas por Doumouchtsis y col. (36) quienes describen que de 27 pacientes incluidas, 7 fueron transferidas a UTIA (25,9 %).
Si del total de mujeres, se analizan solo a las que cursaron con THE (6 pacientes) se observa que necesitaron más transfusiones, con un promedio de 4,2 unidades de concentrado globular (UCG) por paciente versus 1,7 UCG en aquellas sin THE (P 0,023). Este dato concuerda con el trabajo de Bateman y col. (11) en el que se expone como factor de riesgo independiente para transfusión de hemoderivados en pacientes con AU, las que a la par presentan THE.
Según Vitthala y col. (25) el uso del balón SOS Bakri es rentable, en comparación con la sutura de B-Lynch, para el tratamiento de la HPP por AU porque no requiere laparotomía o personal altamente capacitado para su aplicación. Por otra parte, la sutura de B-Lynch puede afectar la fertilidad a futuro debido a la posible necrosis del músculo uterino, situación que hasta el momento no se ha descrito con el uso del balón SOS Bakri.
Es interesante señalar que cuando se comenzó a colocar el balón, se observó una gran resistencia tanto en el personal de sala de partos como de los servicios de cirugía y terapia intensiva, razón por la que probablemente el balón se colocó un poco más tardíamente en relación al momento del diagnóstico. A medida que se aplicó el balón y se obtuvieron los resultados que se presentan, se fue ganando la confianza en el procedimiento, y en consecuencia se favoreció el uso más precoz del balón con resultados aún mejores, hasta el punto de que las dos últimas pacientes de la serie solo ameritaron cristaloides y coloides para su estabilización hemodinámica.
Vale la pena destacar que todas las pacientes incluidas en este trabajo hubiesen entrado en protocolo de histerectomía obstétrica, de no haber recibido tratamiento con el balón SOS Bakri.
De lo expuesto anteriormente podemos concluir que:
El taponamiento uterino con balón SOS Bakri es eficaz en el tratamiento de las pacientes con AU, es de fácil uso, permite la estabilización, detiene el sangrado y evita tratamientos más agresivos.
La hemorragia por AU no siempre es un evento predecible. Un alto porcentaje de las pacientes no tiene factores de riesgo o presenta solo un factor de riesgo. Cuando están presentes, los factores de riesgo más importantes son: uso de oxitócicos, THE, uso de relajantes uterinos y nuliparidad.
La AU se presenta en los primeros 30 minutos posparto en más del 90 % de los casos. La inserción del balón SOS Bakri permite la estabilización de las pacientes en alrededor de dos horas.
Por tanto, se recomienda incluir el uso del taponamiento uterino con Balón SOS Bakri, en los protocolos de atención de las pacientes que presentan AU y adiestrar al personal médico respecto a su uso.
AGRADECIMIENTOS
Los autores expresan su agradecimiento a la empresa ENDOMEDICA, representante en Venezuela de COOK®; quien realizó la donación del balón SOS Bakri utilizado en la investigación.
REFERENCIAS
1. World Health Organization. Attending to 136 million births, every year: make every mother and child count: The World Report 2005. Geneva, Switzerland WHO. 2005:61-3. [ Links ]
2. Dildy G. Postpartum haemorrhage. Contemp Ob/ Gyn. 1993:21-29. [ Links ]
3. García J, Molina R, Cepeda M. Tasas de mortalidad materna en los hospitales de Maracaibo: 1993-2000. Rev Obstet Ginecol Venez. 2002;62(2):103-108. [ Links ]
4. Chacón G, Monsalve N. Mortalidad materna en el Instituto Autónomo Hospital Universitario de Los Andes (IAHULA) 1974-2005. Rev Obstet Ginecol Venez. 2007;67(2):99-105. [ Links ]
5. Faneite P, García F. Mortalidad materna. Hospital Dr. Adolfo Prince Lara. 2001-2004. Rev Obstet Ginecol Venez. 2005;65(3):123-127. [ Links ]
6. Brito J, Cabrera C, Gutiérrez C, Gutiérrez M, Porras F. Mortalidad materna en la Maternidad Concepción Palacios: 1982-1991. Rev Obstet Ginecol Venez. 2007;67(1):31-39. [ Links ]
7. Pritchard J, Baldwin R, Dickey J, Wiggins K. Blood volume changes in pregnancy and the puerperium. Am J Obstet Gyencol. 1962;84:1271-1282. [ Links ]
8. Clark S, Yeh S, Phelan J, Bruce S, Paul R. Emergency hysterectomy for obstetric hemorrhage. Obstet Gynecol. 1984;64:376-380. [ Links ]
9. Patel A, Goudar S, Geller S. Drape estimation vs. visual assessment for estimating postpartum hemorrhage. Int J Gynecol Obstet. 2006;93:220-224. [ Links ]
10. Combs C, Murphy E, Laros R Jr. Factors associated with postpartum hemorrhage with vaginal birth. Obstet Gynecol. 1991;77:69-76. [ Links ]
11. Dildy G, Paine A, George N, Velasco C. Estimating blood loss: Can teaching significantly improve visual estimation? Obstet Gynecol. 2004;104:601-606. [ Links ]
12. Bateman B, Berman M, Riley L, Leffert L. The epidemiology of postpartum hemorrhage in a large, nationwide sample of deliveries. Anesth Analg. 2010;110:112. [ Links ]
13. Ramanathan G, Arulkumaran S. Postpartum haemorrhage. Curr Obstet & Gynaecol. 2006;16:6-13. [ Links ]
14. ACOG Practice Bulletin Clinical Management Guidelines for Obstetrician-Gynecologists. Number 76, October 2006. [ Links ]
15. Hofmeyr J, Abdel-Aleem H. Prevention of postpartum hemorrhage in the absence of uterotónics. Int J Gynecol Obst. 2006;94(2):124-125. [ Links ]
16. Abdel-Aleem H, Hofmeyr J, Shokry M. Uterine massage and postpartum blood loss. Int J Gynecol Obst. 2006;93:238-239. [ Links ]
17. Bruinse H, Metz G, Kwee A. Surgical treatment of postpartum haemorrhage. International Congress Series. 2005;1279:369-375. [ Links ]
18. Tamizian O, Arulkumaran S. The surgical management of postpartum haemorrhage. Opin Obstet Gynecol. 2001;13:127-131. [ Links ]
19. Mousa H, Alfirevic Z. Major postpartum hemorrhage: Survey of maternity units in the United Kingdom. Acta Obstet Gynecol Scand. 2002;81(8):727-730. [ Links ]
20. Lalonde A, Daviss B, Acosta A, Herschderfer K. Postpartum hemorrhage today: ICM/FIGO initiative 2004-2006. Int J Gynecol Obst. 2006;94:243-253. [ Links ]
21. Condous G, Arulkumaran S, Symonds I, Chapman R, Sinha A, Razvi K. The Tamponade Test in the management of massive postpartum hemorrhage. Obstet Gynecol. 2003;101:767-772. [ Links ]
22. Breathnach F, Geary M. Uterine Atony: Definition, Prevention, Nonsurgical Management, and Uterine Tamponade. Semin Perinatol. 2009;33(2):82-87. [ Links ]
23. Bakri Y, Amri A, Abdul J. Tamponade balloon for obstetrical bleeding. Int J Gynaecol Obstet. 2001;74:139-142. [ Links ]
24. Bakri Y. Balloon device for control of obstetrical bleeding. Euro J Obstet Gynecol Rep Biol. 1999;86:84. [ Links ]
25. Vitthala S, Tsoumpou I, Anjum Z, Aziz N. Use of Bakri balloon in post-partum haemorrhage: A series of 15 cases. ANJZOG. 2009;49:191-194. [ Links ]
26. Ramsbotham F. Principles and practice of obstetrical medicine and surgery. Philadelphia, Collins printer; 1865. p. 371-416. [ Links ]
27. Drucker M, Wallach R. Uterine packing: A reappraisal. Mount Sinai J Med. 1979;46:191-194. [ Links ]
28. Lester W, Bartholomew R, Colvin E. Reconsideration of the uterine pack in postpartum hemorrhage. Am J Obstet Gynecol. 1965;98:321-329. [ Links ]
29. Pierce J, Winkler E. Why not pack the postpartum uterus? MN Med. 1956;39:89-90. [ Links ]
30. Blandy J. Operative Urology. Oxford, Lippincott Co; 1978. p. 162. [ Links ]
31. Harrison J, Gittes R, Perlmutter A. Campbells Urology. Filadelfia, Philadelphia Press; 1978. p. 1064. [ Links ]
32. Goldrath M. Uterine tamponade for the control of acute uterine bleeding. Am J Obstet Gynecol. 1983;147:869-872. [ Links ]
33. Bowen L, Benson J. Use of a large Foley catheter balloon to control postpartum haemorrhage resulting from a low placental implantation. J Reprod Med. 1985;30:623-625. [ Links ]
34. De Loor J, Van Dam P. Foley catheters for uncontrollable obstetrics or gynecologic hemorrhage. Obstet Gynecol. 1996;88:737-738. [ Links ]
35. Dabelea V, Schultze P, McDuffie R. Intrauterine balloon tamponade in the management of postpartum hemorrhage. Am J Perinatol. 2007;24(6):359-364. [ Links ]
36. Doumouchtsis S, Papageorghiou A, Vernier C, Arulkumaran S. Management of postpartum hemorrhage by uterine balloon tamponade: Prospective evaluation of effectiveness. Acta Obstetricia et Gynecologica. 2008;87:849-855. [ Links ]
37. Katesmark M, Brown R, Raju K. Successful use of a Sengstaken-Blakemore tube to control massive postpartum haemorrhage. Br J Obstet Gynaecol. 1994;101:259-260. [ Links ]
38. Johanson R, Kumar M, Obhrai M, Young P. Management of massive postpartum haemorrhage: Use of a hydrostaticballoon catheter to avoid laparotomy. Br J Obstet Gynaecol. 2001;108:420-422. [ Links ]
39. Lau M, Tee J. Use of a large Rusch hydrostatic catheter balloon to control postpartum haemorrhage resulting from a low placental implantation. Singapore Med J. 2009;50(9):321-323. [ Links ]
40. Akhter S, Begum M, Kabir Z, Rashid M, Laila T, Zabeen F. Use of a condom to control massive postpartum haemorrhage. Med Gen Med. 2003;5:71- 73. [ Links ]
41. WHO guidelines for the management of postpartum haemorrhage and retained placenta. Geneva, Switzerland WHO. 2009:1-54. [ Links ]
42. Soltan M, Mohamed A, Ibrahim E, Gohar A, Ragab H. El-Menia Air Inflated Balloon in Controlling Atonic Postpartum Hemorrhage. Int J of Health Sci. 2007;1(1):65-71. [ Links ]
43. Bibi S, Danish N, Fawad A, Jamil M. An audit of primary postpartum hemorrhage. J Ayub Med Coll Abbottabad. 2007;19(4):102-106. [ Links ]
44. Oyelese Y, Scorza W, Mastrolia R, Smulian J. Postpartum hemorrhage. Obstet Gynecol Clin North Am. 2007;34(3):421-441. [ Links ]
45. Zhang X, Decker A, Platt R, Kramer M. How big is too big? The perinatal consequences of fetal macrosomia. Am J Obstet Gynecol. 2008;198(5):603-604. [ Links ]
46. Al-Zirqi I, Vangen S, Forsén L, Stray-Pedersen B. Effects of onset of labor and mode of delivery on severe postpartum hemorrhage. Am J Obstet Gynecol. 2009;201:273. [ Links ]
47. Orhue A. Incremental increases in oxytocin infusion regimens for induction of labor at term in primigravidas: A randomized controlled trial. Obstet Gynecol. 1994;83(2):229-233. [ Links ]
48. Smith J, Merrill D. Oxytocin for induction of labor. Clin Obstet Gynecol. 2006;49(3):594-608. [ Links ]
49. Hourvitz A, Alcalay M, Korach J, Lusky A, Barkai G, Seidman D. A prospective study of high- versus low-dose oxytocin for induction of labor. Acta Obstet Gynecol Scand. 1996;75(7):636-641. [ Links ]
50. Merrill D, Zlatnik F. Randomized, double-masked comparison of oxytocin dosage in induction and augmentation of labor. Obstet Gynecol. 1999;94(3):455-463. [ Links ]
51. Stones R, Paterson C, Saunders N. Risk factors for major obstetric haemorrhage. Eur J Obstet Gynecol Reprod Biol. 1993;48(1):15-18. [ Links ]
52. Friedman E. The labor curve. Clin Perinatol. 1981;8(1):15-25. [ Links ]
53. Callaghan WM, Kuklina EV, Berg CJ. Trends in postpartum hemorrhage: United States, 1994-2006. Am J Obstet Gynecol. 2010;202(4):353. [ Links ]
54. Martel M, MacKinnon K, Arsenault M, Bartellas E, Klein M, Lane C, et al. Hemorrhagic shock. J Obstet Gynaecol Can. 2002;24(10):780. [ Links ]