Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Obstetricia y Ginecología de Venezuela
versión impresa ISSN 0048-7732
Rev Obstet Ginecol Venez vol.73 no.3 Caracas set. 2013
Tripanosomiasis en el embarazo
Drs. Vincenzo Mastrolonardo*, Damarys Ramos*, Iván Paravisini*, Jasmín Morales*, Hernán Carrasco**, Shiuna Lo Huang***, Carlos Lemma***
*Médicos Especialistas en Obstetricia y Ginecología, adjuntos de la Maternidad Concepción Palacios. Caracas, Venezuela.
**Biólogo molecular en enfermedades infecciosas, Instituto de Medicina Tropical, Universidad Central de Venezuela. Caracas, Venezuela.
***Médicos Especialistas en Obstetricia y Ginecología, egresados de la Maternidad Concepción Palacios. Caracas, Venezuela.
RESUMEN
Objetivo: Describir la morbimortalidad materna y perinatal causada por la tripanosomiasis en las gestantes que asisten a control en el Servicio Prenatal de la Maternidad Concepción Palacios y al Hospital Central de Biscucuy. Métodos: Se incluyó una muestra de 828 pacientes, 178 de la zona rural y 650 de la urbana. Se realizó la pesquisa para tripanosomiasis mediante prueba rápida y confirmación por serología, de las madres positivas para tripanosomiasis. Se tomó muestra de la sangre del cordón umbilical para determinar la transmisión congénita de la enfermedad. Resultados: Fueron positivas para enfermedad de Chagas 6 pacientes, para una frecuencia global de 0,72 %. Cinco de las pacientes provenían de la zona rural (2,8.%) y una del medio urbano (0,15 %). Entre las 6 pacientes positivas, 83,3 % provenía de la zona rural y 16,7 % de la urbana. La serología de los recién nacidos fue positiva en cuatro casos del medio rural y un caso del medio urbano. La reacción en cadena de la polimerasa fue positiva en 2 de los 6 neonatos de madres con la enfermedad. Las pruebas parasitológicas fueron negativas en el 100.% de los neonatos en riesgo. Conclusiones: La frecuencia de tripanosomiasis fue de 0,72 %. No hubo transmisión congénita de la enfermedad.
Palabras clave: Tripanosomiasis congénita. Frecuencia. Chagas.
SUMMARY
Objective: To describe maternal and perinatal morbidity and mortality caused by trypanosomiasis in pregnant women attending prenatal control in the obstetric service of Maternidad Concepcion Palacios and Hospital Central de Biscucuy. Methods: A sample of 828 patients was included from both areas, 178 in rural and 650 urban. Research was performed by rapid test for trypanosomiasis and confirmation by serology, from mothers positive for trypanosomiasis. Sample was taken from the umbilical cord blood to determine congenital transmission of the disease. Results: Were positive for Chagas disease 6 patients, for an overall frequency of 0.72 %. Five of the patients were from rural areas (2.8 %) and in urban areas (0.15 %). Between 6 positive patients, 83.3 % came from rural and 16.7 % urban areas. The newborns serology was positive in four cases of rural and urban case. The chain reaction polymerase was positive in 2 of the 6 infants of mothers with the disease. Parasitological tests were negative in 100 % of infants at risk. Conclusions: The frequency of trypanosomiasis was 0.72 %. There was not congenital transmission of the disease.
Key words: Congenital trypanosomiasis. Frecquency. Chagas.
INTRODUCCIÓN
La enfermedad de Chagas es una parasitosis endémica americana, desde México hasta la Argentina, estimándose unas 16 millones de personas infectadas. La enfermedad transcurre silenciosamente; el paciente, el personal de salud y la población en general pueden ignorar su existencia tanto en el período crónico como en el período agudo, debido a la ausencia de signos y síntomas que demanden atención médica. En tanto, si no se piensa en la enfermedad esta puede transcurrir libremente y solo detectarse cuando los daños fisiopatológicos provocados se tornan irreversibles (1).
Anteriormente la enfermedad se presentaba en zonas rurales donde predominaban las viviendas de bahareque y paja, sin embargo, se ha visto en los últimos años la presencia de brotes agudos de la enfermedad en las principales ciudades de algunos países de América Latina; Venezuela no escapa a esta realidad, se observó en el año 2007 un brote de tripanosomiasis aguda en el municipio Chacao del Estado Miranda, debido a la diseminación por alimentos; esto hace suponer la transmisión activa de la enfermedad en las zonas urbanas y en esa oportunidad le costó la vida a uno de los estudiantes de dicha zona. Posteriormente, se notificó un nuevo brote en el sector La Pedrera de Antímano, donde se comprobó un total de 17 casos positivos, lo que plantea la necesidad de ampliar acciones de vigilancia en la lucha antichagásica en todo el territorio nacional, con extensión a la pesquisa congénita (1).
La enfermedad recibe su nombre en honor del Dr. Carlos Chagas, médico brasileño que describió la enfermedad por primera vez en 1909 e identificó al tripanosoma dándole el nombre de su profesor, el Dr. Oswaldo Cruz. El Dr. Chagas también desarrolló el ciclo de vida del parásito y los insectos que lo transmiten, así como el grupo de pequeños mamíferos que actúan como reservorio en la naturaleza (2).
La tripanosomiasis es una de las principales epidemias que sufren los países latinoamericanos. En Argentina existe una población de 4 500 000 personas que habitan en zonas chagásicas, y casi la mitad de esta cifra está infectada, de las cuales un 13 % presentan manifestaciones patológicas con predominio cardíaco (3).
En Venezuela, la enfermedad de Chagas se considera un problema de riesgo para aproximadamente 6 millones de personas que viven en 198 municipios de 14 entidades federales, los estados más afectados son Trujillo, Lara, Portuguesa y Barinas, debido a sus características geográficas de piedemonte, con zonas cafetaleras y viviendas de bahareque y paja, que facilitan la infestación por triatominios como son el Rhondnius prolixus, Triatoma maculata y Pastrongylus geniculatus, vectores de la enfermedad (1).
La enfermedad de Chagas o tripanosomiasis americana, ubicada en la categoría B57 de la clasificación internacional de enfermedades (CIE-10), es producida por la infección con Trypanosoma cruzi (T. cruzi), parásito unicelular que se transmite a través de triatominios, insectos hematófagos, que pueden compartir la vivienda con el hombre y mamíferos domésticos y silvestres (1).
Este agente causal de la enfermedad, T. cruzi, infecta diversas especies de insectos, llamados vectores, que se nutren de sangre, ya sea de animales o seres humanos infectados, que tengan parásitos circulantes en la sangre llamados tripomastigotos, estos parásitos ingeridos se transforman en el intestino medio del insecto en epimastigotos, que se multiplican en el intestino medio del agente vector y en este se transforman nuevamente en tripomastigotos en la parte caudal del intestino, cerrando de esta manera el ciclo evolutivo, cuando este agente infectado chupa sangre para alimentarse, defeca depositando las heces sobre la piel, o las conjuntivas del ojo, las formas metacíclicas infecciosas. De esta manera llega el Trypanosoma cruzi a un organismo vertebrado, los parásitos pueden penetrar en diversos tipos de células transformándose aquí en amastigotas intracelulares, dentro de dichas células crecen, se reproducen se alargan y se transforman en tripomastigotos móviles y hacen estallar las células que lo contienen pasando a la circulación sanguínea, o penetrando a nuevas células y así sucesivamente. El Trypanosoma cruzi llega generalmente de esta manera al organismo, pero puede también hacerlo, cuando el huésped receptor ingiere comidas infectadas por el parásito (4). Existen otras formas de transmisión no vectoriales en las que podemos mencionar la congénita, transfusional y ocupacional.
El diagnóstico de la enfermedad de Chagas aguda requiere la detección de los parásitos. El examen microscópico de la sangre fresca con anticoagulante o de la capa leucocítica es la forma más sencilla de descubrir los microorganismos móviles. Los parásitos pueden observarse también en extensiones sanguíneas finas o gruesas teñidas con Giemsa. Los tubos de microhematocrito que contiene colorante naranja de acridina se pueden usar para el mismo fin. Si son infructuosos los intentos de visualizar los microorganismos, cabe recurrir a la reacción en cadena de polimerasa o al hemocultivo en medios especializados. Las pruebas serológicas que detectan anticuerpos específicos para antígenos expresados por diferentes estados del desarrollo del parásito son bien adecuadas para un diagnóstico fácil y rápido de la enfermedad. Las pruebas inmunocromatográficas han sido diseñadas para la determinación cualitativa de anticuerpos contra el antígeno de T. cruzi. Este método emplea una combinación única de anticuerpo específico unido a una proteína la cual está conjugada a partículas doradas y un antígeno el cual es unido a la membrana. Este método muestra un alto grado de sensibilidad y especificidad. En manos de personal experto todos los métodos mencionados generan una elevada proporción de pacientes con enfermedad de Chagas. El hemocultivo tiene la desventaja de que se necesita que transcurran semanas para obtener resultados positivos (4). También se puede realizar una prueba rápida de tamizaje inmunocromatográfico para la detección de anticuerpos para T. cruzi en plasma, suero o sangre total que presenta una sensibilidad 99,2 % y especificidad 100 %.
La enfermedad crónica se diagnostica al detectar anticuerpos específicos que se fijan a antígenos de T. cruzi. No es indispensable demostrar la presencia del parásito. En países de América Latina se pueden obtener en el comercio alrededor de 20 métodos diagnósticos que incluyen algunos basados en antígenos obtenidos por bioingeniería. Sin embargo, la sensibilidad y especificidad de tales pruebas son variables y hay falsas reacciones positivas frecuentes, principalmente en enfermos que tienen otras infecciones o infestaciones, o enfermedades autoinmunitarias (4).
Las embarazadas infectadas, pueden transmitir la enfermedad por vía de transmisión vertical o transplacentaria a su hijo; es la vía que interesa a los obstetras y ginecólogos por dar lugar al Chagas congénito. Es la forma de Chagas que puede existir en zonas no endémicas. El recién nacido chagásico es sintomático en el 20 % de los casos y asintomático en el 80 % restante, pero siempre presenta examen de laboratorio positivo para T. cruzi (5).
En la trasmisión congénita los obstetras juegan un papel importante en la detección a tiempo de la enfermedad durante el control prenatal, para permitir aplicar medidas oportunas a la hora del nacimiento y los primeros meses de vida a fin de indicar tratamiento oportuno y ayudar a la erradicación de la enfermedad, que es una de las principales metas de la Organización Mundial de la Salud (OMS) porque con el tratamiento precoz del recién nacido se logra un 100 % de efectividad, evitando complicaciones agudas y crónicas (6). Es importante el diagnóstico y tratamiento precoz del Chagas congénito. Si no se trata a tiempo, pasará de una fase aguda, a las fases indeterminada y crónica; por lo que convendría estudiar a las embarazadas de zonas endémicas, y si son seropositivas, corresponde solicitar estudios parasitológicos y luego serológico a sus hijos desde el nacimiento hasta el año de edad (5).
La transmisión congénita genera manifestaciones clínicas variables en el neonato, desde un cuadro asintomático, hasta producir la muerte perinatal. Esta enfermedad, sin embargo, puede ser diagnosticada al momento del nacimiento y, tratada en forma oportuna, se puede lograr la curación en el 100 % de los casos. Sin embargo, a pesar que Venezuela es un país endémico, no hay estudios recientes que demuestren la transmisión transplacentaria, hecho demostrado en otros países de la región, pudiendo existir un subregistro de la misma.
Desde que se ha demostrado que el feto puede adquirir la enfermedad in útero, esta zoonosis adquiere real importancia dada la gravedad de las lesiones por ella producidas. En Chile, se demostró la forma congénita de la enfermedad en un centro de prematuros, con una incidencia de 1 en 200 recién nacidos. En Argentina, en el control de 775 recién nacidos prematuros se ha demostrado una incidencia de 2,58 % (3).
En diversos estudios sobre pacientes embarazadas en Buenos Aires, el porcentaje de reacciones Machado-Guerreiro positivas oscila entre 9 % y 14.%. En Córdoba, estas cifras son mucho mayores: 28 %. En Buenos Aires, mediante el xenodiagnóstico, han señalado un 3,87 %. Pero en las zonas infectadas la incidencia es mucho mayor: en Brazil (Jujuy, Tuli) se encuentra un 10,7 % y un informe verbal en la reunión de investigadores de Chagas de San Luis en junio de 1977, se refiere una incidencia de hasta 15.% en Ciudad de Córdoba (3).
El pasaje transplacentario de los tripanosomas desde la circulación materna, sea con infección aguda o crónica, es posible aunque no obligada. Se han observado nacimientos de niños no infectados cuyas placentas demostraron elevado parasitismo. Pero en otros casos en cuyas placentas no se observaron parásitos, los neonatos tenían enfermedad de Chagas (hepatoesplenomegalia, edema, fiebre y parasitemia) (3).
La presentación clínica de la enfermedad neonatal es similar a la causada por las infecciones conocidas como grupo TORCHS. Las siglas TORCHS (toxoplasmosis, otras, rubeola, citomegalovirus, herpes virus y sífilis) fueron propuestas para designar un grupo de enfermedades infecciosas de la gestante que pueden originar lesiones fetales y neonatales por transmisión vertical que deben ser diagnósticos diferenciales de la tripanosomiasis en relación con la similitud de presentación de las manifestaciones clínicas de la enfermedad. La mayoría de estas enfermedades son asintomáticas o presentan síntomas poco específicos y leves, pero transmiten al feto y al recién nacido un espectro amplio de lesiones, desde alteraciones transitorias hasta lesiones graves persistentes, o incluso la muerte fetal o neonatal (7).
En cuanto al tratamiento, está contraindicado en la embarazada con Chagas por los riesgos teratogénicos del fármaco; en cambio, hay que tratar en forma inmediata, una vez diagnosticado, al enfermo chagásico congénito durante las primeras 48 horas, porque los fármacos actúan sobre los parásitos circulantes en sangre y tendrán poco efecto cuando estén en los tejidos. La posibilidad de curación es del 100 % cuando se trata precozmente, aunque puede producir importantes reacciones adversas (2,8,9).
El tratamiento se administra con base en benznidazol, 5-10 mg/kg/día vía oral, cada 12 horas durante 30-60 días y nifurtimox, 10-15 mg/kg/día vía oral, cada 12 horas durante 90 días (2,8,9).
En la literatura internacional, existen diferentes trabajos que tratan el tema de la tripanosomiasis en el embarazo. Hermann y col. (10) en la Sociedad Americana de Hematología (2002) determinaron la respuesta inmunológica fetal mediada por linfocitos T CD8 en sangre de cordón de recién nacidos infectados por Trypanosoma cruzi y evidenciaron marcadores de activación y expansión oligoclonales en respuesta a la presencia del parásito por las células fetales, lo que indica que en vida intrauterina son capaces de desarrollar una respuesta inmunológica.
En Latinoamérica, Virreira y col. (11) en 2003, trabajaron en Bolivia, con la colaboración de la Universidad de Bruselas; compararon diferentes métodos para la detección de tripanosomiasis congénita y evidenciaron que la reacción de cadena de polimerasa (PCR) del parásito, es un método sencillo, seguro y de bajo costo para determinar la presencia del T. cruzi en el recién nacido, incluso para laboratorios que no están equipados para realizar el estudio. Un año después, Torrico y col. (12) determinaron que la incidencia de la tripanosomiasis en la embarazada es de 22,4 % con una frecuencia de transmisión materno fetal de 5 % a 6 % de las madres infectadas, la mortalidad de los recién nacidos infectados es de 2.% a 13 % y las principales complicaciones son Apgar bajo al nacer, prematuridad y bajo peso.
En Venezuela, Figallo (13), en un estudio prospectivo a 500 embarazadas encontró una incidencia de la enfermedad (en 57 pacientes) 11,4.%. Concluyó que no todas la madres portadoras transmitían la enfermedad a sus hijos durante el embarazo por lo que se sospecha el paso de anticuerpos a través de la placenta, los cuales impiden con mayor frecuencia la prevalencia de la enfermedad en los recién nacidos. Todas las pacientes seropositivas tenían el antecedente epidemiológico de provenir del interior del país.
Gavalier (14), realizó observación anatomopatológica en unos gemelos en los que demostró la presencia de tripanosomiasis congénita en ellos, los cuales murieron a las 2 y 81 horas de nacidos, respectivamente. La autopsia reveló en ambos fetos prematuridad, hepatoesplenomegalia, edema subcutáneo generalizado e hipoplasia pulmonar. El estudio histológico reportó: en el ombligo, vasos sanguíneos dilatados y congestionados con focos hemorrágicos; en el corazón, lesiones degenerativas del miocardio desde atrofia, degeneración hialina y necrosis; además nidos de tripanosomiasis en corazón, cerebro, músculo esquelético y pulmón. Comentó que el primer caso de tripanosomiasis congénita en Venezuela fue observado en el año 1949 en Chaguaramas, Estado Guárico, donde se observó el tripanosoma en un estudio de gota gruesa de sangre del recién nacido.
En el año 2009, Rízquez (15), médico pediatra y epidemiólogo venezolano publicó en la Gaceta Médica de Caracas un estudio retrospectivo donde determinó la mortalidad anual por tripanosomiasis entre los años 1997 al 2006 con un total de 797 muertes predominantemente en el sexo masculino con edad promedio a los 60 años de edad. Además revela un nuevo método de trasmisión, la vía oral, la cual es responsable de brotes agudos de la enfermedad al consumir alimentos infectados con tripanosomiasis.
En vista de la importancia de la enfermedad, se realizó el presente trabajo para describir la morbimortalidad materna y perinatal causada por la tripanosomiasis existente en gestantes.
MÉTODOS
Se realizó un estudio prospectivo, descriptivo, que incluyó 650 gestantes que acudieron a control prenatal en la Maternidad Concepción Palacios en Caracas (zona urbana) y 178 gestantes que acudieron a control prenatal en el Hospital de Biscucuy, Estado Portuguesa (zona rural), donde se realizaron jornadas de pesquisa de seroprevalencia. Se excluyeron las gestantes que resultaron positivas en la pesquisa de TORCHS en fase activa.
Se elaboró un cuestionario clínico materno que incluyó los siguientes parámetros: identificación de la paciente, edad, número de historia clínica, procedencia (desde su nacimiento hasta la actualidad), datos epidemiológicos que incluyen el conocimiento del vector y patologías médicas asociadas, antecedentes familiares, antecedentes ginecobstétricos, así como el diagnóstico de tripanosomiasis y el método utilizado para el mismo. Todas las pacientes firmaron un formulario de consentimiento informado para ser incluidas en el estudio.
Posteriormente se procedió a la toma de la muestra de sangre venosa (1 cm3), para el diagnóstico por prueba rápida por inmunocromatografía. Las pacientes positivas fueron referidas al Instituto de Medicina Tropical de la Universidad Central de Venezuela (a cargo del Dr. Hernán Carrasco), para realizar su confirmación serológica. El estudio de la madre incluyó ELISA, fijación de complemento y hemaglutinación indirecta; por su parte, el estudio del recién nacido incluyó: serología, reacción en cadena de polimerasa (PCR) y pruebas parasitológicas (hemocultivo e inoculación de ratones).
Se garantizó la apertura de una historia clínica para la evaluación integral de la paciente con énfasis en el sistema cardiovascular, que permitió efectuar un control y seguimiento posterior de las mismas, incluyendo síntomas inespecíficos maternos, tales como: fiebre, malestar general, astenia, entre otros y una evaluación morfológica integral del feto, mediante ecografía, haciendo énfasis en los órganos afectados, tales como: hígado, bazo y corazón, hasta el momento de la resolución obstétrica. En ese momento se procedió a elaborar el cuestionario clínico neonatal que incluyó los siguientes parámetros: identificación del recién nacido, fecha de nacimiento, datos relacionados con la atención del parto y del recién nacido específicamente, tomando en cuenta el examen clínico neonatal, así como el diagnóstico de tripanosomiasis del recién nacido mediante toma de muestra de sangre del cordón y su posterior confirmación. Dichos neonatos, fueron enviados al mismo instituto, donde se les suministró el tratamiento oportuno, con el fin de curar la enfermedad.
Una vez obtenidos esos datos, se procedió a calcular la frecuencia de la transmisión congénita de la tripanosomiasis en la población y las manifestaciones clínicas de la patología en los recién nacidos.
Todos los datos recogidos fueron descritos mediante frecuencias absolutas, %, media y desviación estándar, mediana y moda, comparados mediante diferencia de proporciones, diferencia de medias para P< 0,01 cuyos valores topes críticos son 2,74 y 3,56, respectivamente.
RESULTADOS
Se incluyeron 828 pacientes, distribuidas en 650 urbanas (78,50 %) y 178 rurales (21,50 %). Resultaron positivas para enfermedad de Chagas 6 pacientes, para una frecuencia global de 0,72 %. Cinco de las pacientes provenían de la zona rural (2,8 %) y una del medio urbano (0,15 %) (P=0,0014). Entre las 6 pacientes positivas, 83,3 % provenía de la zona rural y 16,7 % de la urbana.
El promedio de edad de todas las pacientes fue de 25,25 años ± 7,32, siendo 23,9 ± 6,8 para las rurales y 25,6 ± 7,5 para las urbanas. En relación con los antecedentes obstétricos hubo una mediana de dos embarazos (rango: 1-13) en la población general, 3 embarazos (rango: 1 – 13) en el medio rural y 2 embarazos (rango: 1 – 12) en la población urbana.
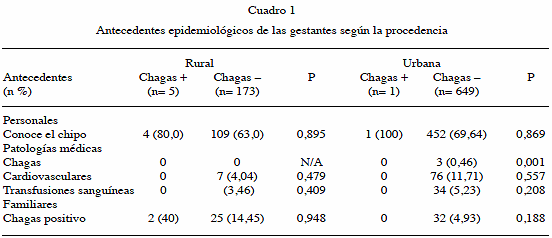
Los antecedentes epidemiológicos según la procedencia se presentan en el Cuadro 1. Se observó que 566 pacientes (68,6 %) conocían el vector. De las 6 pacientes Chagas positivas 5 (83,33 %) conocían al chipo; cuatro de las cinco del medio rural (80 %) y la única paciente del medio urbano (100 %).
Tres pacientes (0,36 %) del total de la población mencionaron entre sus antecedentes haber padecido de enfermedad de Chagas y su estudio serológico fue negativo. Estas pacientes fueron todas del medio urbano. Hubo 83 pacientes con antecedente de patología cardiovascular y 40 con antecedente de transfusiones sanguíneas, todas fueron negativas para enfermedad de Chagas.
Cincuenta y nueve pacientes tenían antecedentes familiares de enfermedad de Chagas, en dos de ellas (3,39 %) la serología fue positiva, ambas del medio rural.
No se evidenciaron hallazgos clínicos atribuibles a la enfermedad de Chagas. Dentro de las complicaciones obstétricas en las pacientes con serología positiva para tripanosomiasis, hubo una paciente con rotura prematura de membranas a término con feto vivo y otra con parto prematuro de óbito fetal.
En relación con la transmisión congénita de la tripanosomiasis, la serología fue positiva en cuatro casos del medio rural (80 %) y en el neonato del medio urbano. La reacción en cadena de polimerasa (PCR) fue positiva en 2 de los 5 neonatos provenientes de la zona rural. Las pruebas parasitológicas: hemocultivo e inoculación de ratones, fueron negativas en el 100.% de los casos. Hubo un óbito fetal en el grupo del área rural cuyo estudio no se realizó (Cuadro 2).
DISCUSIÓN
El despistaje de la enfermedad de Chagas en el control prenatal en Venezuela, está claramente justificado debido a que sabemos que Venezuela es un país endémico para la enfermedad en zonas rurales, y además están demostrados nuevos brotes de transmisión oral en zonas urbanas con altas tasas de morbimortalidad (9).
Hay escasa información sobre la transmisión transplacentaria de tripanosomiasis. Sin embargo, en el año 1947 se determinó la presencia del parásito en un recién nacido mediante la observación directa del mismo en gota gruesa. En 1962, Figallo (13) demostró la presencia de la enfermedad con una incidencia de 11,4 %, tomando en cuenta una población similar a la del presente estudio, en el que se encontró, una frecuencia global de 0,72 %. Se observa una disminución importante en la prevalencia de la enfermedad y esto se debe a las políticas sanitarias y las medidas de difusión por parte de entes gubernamentales, en la búsqueda de la erradicación del vector. Además se ha contado con la participación de medios de información tanto audiovisuales como escritos que han educado a la población (1). En 2010, Noya y col. (16) estudiaron la serología en 678 pacientes embarazadas de la consulta Prenatal del Hospital Universitario de Caracas, sin encontrar pacientes positivas para el estudio. Es importante destacar que en este estudio, la frecuencia del área rural es 2,80 % y en el área urbana es 0,15 %, esta diferencia es estadísticamente significativa, lo que hace pensar que el ambiente para la supervivencia del vector es imprescindible para la transmisión de la enfermedad.
La enfermedad de Chagas aguda, si es diagnosticada a tiempo puede ser tratada con los esquemas ya establecidos y se garantiza de esta manera un 100 % de curación de la enfermedad, logrando una vida sana. Por el contrario, si no se cuenta con el tratamiento inmediato, pasará a convertirse en un problema crónico, presentando principalmente cardiopatía chagásica, patología en la que la entidad principal es la miocardiopatía (17).
Gavalier (14) en 1968, realizó estudios anatomopatológicos en 2 mortinatos y determinó la presencia del tripanosoma. En este estudio, en todas las pacientes positivas para la enfermedad de Chagas (5 en el área rural y 1 en el área urbana) se encontró serología positiva para Chagas en las muestras neonatales, lo cual se debe a la presencia de anticuerpos maternos contra el parásito. Sin embargo, la PCR fue positiva en solo 2 neonatos de la zona rural, esto demuestra ácido desoxirribonucleico (ADN) parasitario, es decir, hubo pasaje transplacentario de parásitos muertos pero no necesariamente existe la enfermedad. La determinación de las pruebas parasitológicas fueron negativas, estas incluyen hemocultivo e inoculación de ratones, lo cual denota que no hubo transmisión congénita y amerita realizar pruebas confirmatorias al año de edad.
En este estudio, se realizó el estudio anatomopatológico de 3 placentas provenientes de las madres positivas para enfermedad de Chagas, sin lograrse encontrar cambios propios de la enfermedad ni evidenciar la presencia del parásito en las mismas.
Los cambios anatomopatológicos que se presentan en la placenta son descritos por Gompel y col. (18) quienes señalan la existencia de las dos presentaciones de infección fetoplacentaria, que son infección aguda y crónica, pudiendo afectar el binomio feto-placenta, o cada uno por separado. Existen dos vías principales de infección placentaria, la vía ascendente y la hematógena. La vía hematógena, se relaciona con patógenos que penetran los espacios intervellosos y cruzan las vellosidades coriales o mediante la infección de la decidua, lo que conlleva a una afección de las estructuras placentarias. La enfermedad de Chagas es considerada una infección crónica, cuyos signos clínicos in útero incluyen, retardo del crecimiento intrauterino y parto pretérmino. Por otra parte, puede ser evidenciada la placentomegalia, particularmente acompañada de hidrops fetal. La autopsia de óbitos fetales, producto de esta patología, revela: hidrops, ictericia, púrpura, enrojecimiento cutáneo, lesiones oculares, hepato-esplenomegalia, anomalías del sistema nervioso central y células parenquimatosas plasmáticas. La transmisión materno-fetal de la enfermedad de Chagas, ocurre por diseminación hematógena a la placenta. El tripanosoma infecta el trofoblasto y las células de Hofbauer (placentarias), y luego entra a la circulación fetal. Las placentas infectadas son pesadas y pálidas, demostrando destrucción crónica de las vellosidades con depósito de fibrina, lo cual conlleva a destrucción vellositaria con fibrosis cicatrizal.
Blanco y col. (19), describen que en Santiago de Chile, en varios estudios realizados en 1975 que la transmisión congénita de enfermedad de Chagas en 2,4 % de las pacientes embarazadas con serología positiva y que en Argentina se estimó la probabilidad de transmisión en 4 %. La diferencia en la tasa de transmisión se puede asociar con el hecho de que existen varios genotipos de T. cruzi, de distribución geográfica diferente en toda Latinoamérica, T. cruzi 1 y T cruzi 4, predominantes en las cordilleras de Bolivia y Argentina, tienen mayor riesgo de transmisión transplacentaria (20). En Venezuela no está determinado actualmente el genotipo de tripanosoma existente.
Es importante destacar, que de las pacientes estudiadas en la zona urbana, tres mencionaron tener antecedente patológico de enfermedad de Chagas. Dos de estas pacientes lo atribuyen a la ingesta de alimentos contaminados con el parásito (Antímano, Distrito Capital) y la tercera paciente, procedente de Bolivia, es conocida con la enfermedad de Chagas de larga data, con complicaciones crónicas de tipo megacolon chagásico. Sin embargo, al momento de hacer la pesquisa con inmunocromatografía y las pruebas confirmatorias que incluyen serología, PCR y xenodiagnóstico, los resultados fueron negativos; esto se puede atribuir, tal como lo expresan Abbas y col. (21) a que existe un mecanismo inmunológico mediante el cual el parásito es capaz de desencadenar una respuesta de evasión de los mecanismos inmunitarios. Esta evasión se puede explicar, debido a que estos escapan a la inmunidad protectora mediante la reducción de su inmunogenicidad y la inhibición de las respuestas inmunitarias del huésped. Diferentes parásitos han desarrollado formas muy eficaces para resistir la inmunidad. El mecanismo de evasión inmunitaria del tripanosoma es la variación antigénica. Los parásitos cambian sus antígenos de superficie durante sus ciclos vitales en huéspedes vertebrados por dos mecanismos de variación antigénica: la primera es un cambio en la expresión antigénica específica del estadio. El segundo ejemplo es la continua variación de los principales antígenos de superficie de los tripanosomas.
Los parásitos inhiben las respuestas inmunitarias del huésped por medio de múltiples mecanismos. Se ha descrito anergia específica a los antígenos parasitarios. En la tripanosomiasis se observa una inmunosupresión más inespecífica y generalizada. Este déficit inmunitario se ha atribuido a la producción de citoquinas inmunosupresoras por las células T y los macrófagos activados y a defectos en las respuestas de las células T.
El resto de las variables estudiadas, antecedente personal de patologías cardiovasculares, transfusiones sanguíneas y antecedentes familiares de enfermedad de Chagas, no mostraron relevancia estadística.
En relación con las complicaciones obstétricas relacionadas con la enfermedad, se evaluaron tres parámetros: parto pretérmino, rotura prematura de membranas ovulares y óbito fetal. Se encontró un caso de cada una de dichas complicaciones, lo que constituye un 16,7 %; sin embargo, por la baja frecuencia, no se puede atribuir directamente la complicación obstétrica a la presencia de tripanosomiasis. Es importante destacar que al óbito fetal no se le pudo realizar el estudio de anatomía patológica por deseo materno.
Finalmente se puede concluir:
La frecuencia absoluta de la enfermedad de Chagas fue de 0,72 %.
El único antecedente epidemiológico relacionado con la enfermedad de Chagas fue la procedencia: 2,8.% en el medio rural y 0,15 % en el medio urbano. El comportamiento fue similar en ambas poblaciones.
No hubo asociación estadística con ninguna complicación obstétrica.
No hubo transmisión congénita de la enfermedad. Se recomienda la implementación de la pesquisa de la enfermedad de Chagas en las áreas endémicas del país y entre la población de riesgo. Además, utilizar medidas educativas para todos los habitantes, en especial a las mujeres de edad fértil, porque se desconoce dentro de la población de Venezuela el riesgo de transmisión transplacentaria de la enfermedad.
AGRADECIMIENTOS
Los autores expresan su agradecimiento al Instituto de Medicina Tropical, por facilitarnos el procesamiento de las muestras realizado en el presente estudio. A la Universidad Centrooccidental Lisandro Alvarado, en la persona del Dr. Luis Herice, coordinador de pasantía rural, y a la Dra. Esther León, jefe de Servicio de Ginecología y Obstetricia del Hospital de Biscucuy, por abrirnos las puertas y poder llegar al ambulatorio rural. Al Servicio Prenatal de la Maternidad Concepción Palacios. Dra. Mireya González Blanco por su asesoría metodológica, al Dr. Freddy Bello y al Licenciado Douglas Angulo, por la asesoría estadística.
REFERENCIAS
1. Boletín Epidemiológico N17. Año LVII. Gobierno Bolivariano de Venezuela. Ministerio del Poder Popular para la Salud. p.1-10. [ Links ]
2. Cabero L, Saldivar D, Cabrillo E. Obstetricia y Medicina Materno-Fetal. Editorial Médica Panamericana. 2007:727-735. [ Links ]
3. Uranga F. Obstetricia Práctica. 5ª edición. Buenos Aires, Argentina: Editorial Inter-medica.; 1981:805- 811. [ Links ]
4. Kasper D, Braunwald E, Fauci A, Hauser S, Longo D, Jameson J. Harrison Principios de Medicina Interna. 16ª edición. Mc Graw Hill Interamericana; 2005:1373-1376. [ Links ]
5. Cusnaider C, Gómez D, Amat L, Aguilo F, Hernandez A, Laila J. Chagas congénito, ¿es posible en España? Ginecología y Obstetricia Clínica. 2004;5:198-203. [ Links ]
6. Organización Mundial de la Salud. Enfermedad de Chagas: control y eliminación. 63ª Asamblea Mundial de la Salud. 22 de abril de 2010. [ Links ]
7. Merlo J, Vicens J, Gonzalez E. Obstetricia. 5ª edición. Editorial Masson. 2006:695-730. [ Links ]
8. De Andrade A, Zicker F, De Oliveira R, Almeida S, Luquetti A, Travassos L, et al. Randomised trial of efficacy of benznidazole in treatment of early Trypanosoma cruzi infection. Lancet. 1996;348:1407-1413. [ Links ]
9. Moya P, Paollasso R, Blanco S, Lapasset M, San Martino C, Basso B, et al. Tratamiento de la enfermedad de Chagas con Nifurtimox durante los primeros meses de vida. Medicina (Bs As). 1989;45:553-558. [ Links ]
10. Hermann E, Truyens C, Vega C, Even J, Rodríguez P, Berthe A, et al. Human fetuses are able to mount an adultlike CD8 T-cell response. The American Society of Hematology. Blood. 2002;100:2153-2158. [ Links ]
11. Virreira M, Torrico F, Truyens C, Vega C, Solano M, Carlier Y, et al. Comparison of polymerase chain reaction methods for reliable and easy detection of congenital Trypanosoma cruzi infection. Am J Trop Med Hyg. 2003;68:574-582. [ Links ]
12. Torrico F, Vega C, Suarez E, Rodríguez P, Torrico M, Dramaix M, et al. Maternal Trypanosoma cruzi infection, pregnancy outcome, morbidity, and mortality of congenitally infected and non-infected newborns in Bolivia. Am J Trop Med Hyg. 2004;70:201-209. [ Links ]
13. Figallo L. La enfermedad de chagas congénita. Tesis Doctoral. Archivos Venezolanos de Medicina Tropical y Parasitología Médica. 1962;4:243-261. [ Links ]
14. Gavallier B. Enfermedad de Chagas congénita. Observación anatomo-patológica en gemelos. Boletín MCP. 1953;4:59-64. [ Links ]
15. Rísquez A. Mortalidad por enfermedad de Chagas. A propósito de los brotes de Chagas agudo como enfermedad reemergente de transmisión alimentaria. Gac Méd Caracas. 2009;117:319-321. [ Links ]
16. Noya B, Romero J, Sánchez E, Lugo J, Salinas R, Ortiz L, et al. Despistaje de toxoplasmosis y enfermedad de Chagas en la Consulta Prenatal del Hospital Universitario de Caracas. Rev Obstet Ginecol Venez. 2010;70:75-81. [ Links ]
17. Piat G, Almirón J, Romano J, Romano M. Chagas congénito. Revisión de una enfermedad curable y subestimada. Rev Posgrado de la VI Cátedra de Medicina. 2009;193:16-21. [ Links ]
18. Gompel C, Silverberg S. Patología en Ginecología y Obstetricia. 4ª edición. J.B. Lippincott Co. 1994:473- 487. [ Links ]
19. Blanco S, Segura E, Gürtler R. El control de la transmisión congénita de Trypanosoma cruzi en la Argentina. Medicina (Bs As). 1999;59 (Supl II):138- 142. [ Links ]
20. Duffy T, Bisio M, Cura C, Marcet P, Burgos J, Da Silva A, et al. PCR en tiempo real. Perspectivas. Desarrollo y evaluación de ensayos para el diagnóstico y tipificación de linajes de Trypanosoma cruzi. Disponible en http://www.parasitologia.cl/doc/LIBRO%20DE%20RESUMENES%20SIMPOSIO%20INTERNACIONAL%20ENFERMEDAD%20DE%20CHAGAS%20COQUIMBO%202010.pdf. Revisado julio 2011. [ Links ]
21. Abbas A, Lichtman A, Pober J. Inmunología celular y molecular. 4ª edición. Mc Graw Hill Interamericana; 2001:367-372. [ Links ]