Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Obstetricia y Ginecología de Venezuela
versión impresa ISSN 0048-7732
Rev Obstet Ginecol Venez vol.74 no.3 Caracas set. 2014
Tensión arterial y masa corporal en mujeres infértiles con
síndrome de ovario poliquístico y su relación con el perfil hormonalLcdo. Cruz Gutiérrez 1, Dr. Ricardo Lozano-Hernández 2, Lcda. Carmen-A Lozano2, Dr. Antonio Villavicencio 1,2
1 Centro de Atención Médica Integral de la Universidad de Los Andes, Mérida, Venezuela.
2 Centro Diagnóstico de Infertilidad y Enfermedades Genéticas. Cátedra de Fisiopatología. Facultad de Farmacia y Bioanálisis. Universidad de Los Andes. Mérida, Venezuela.
RESUMEN
Objetivo: Evaluar perfil hormonal, índice de masa corporal y tensión arterial en 40 mujeres infértiles con ovario poliquístico. Métodos: En la consulta del Centro de Atención Integral de la Universidad de Los Andes se valoró talla, peso y tensión arterial. Durante la fase folicular del ciclo menstrual en ellas se midió en sangre las hormonas sexuales e insulina (basal y 2 horas poscarga glucosada) por electroquimioluminiscencia. Resultados: El índice de masa corporal se correlacionó directamente con el valor de tensión arterial sistólica, la relación LH/FSH y la testosterona sérica; e inversamente con las hormonas FSH y PRL. Los datos clínicos y de laboratorio se observaron dentro de los límites de referencia; sin embargo, la testosterona guardó relación directa con LH/FSH, índice de masa corporal y tensión arterial sistólica. Al compararse dos grupos de paciente con base al valor de la mediana poblacional, los grupos masa corporal > 24 kg/m2 y tensión arterial sistólica >120 mmHg mostraron niveles de DHEA-S e insulina (basal y 2 h) más elevados que en mujeres con índice de masa corporal y tensión arterial sistólica más bajos. Conclusiones: Existe correlación entre niveles séricos de andrógenos con sobrepeso e hipertensión arterial por mecanismos etiológicos interrelacionados. Síndrome de ovario poliquístico es de origen multicausal eventualmente con hiperandrogenemia. La falla metabólica debe controlarse en estas pacientes, lo que permitiría bajar el efecto de los andrógenos y favorecer el estado de fertilidad, pero sobre evita a largo plazo complicaciones como obesidad, diabetes mellitus tipo 2 e hipertensión arterial.
Palabras clave: Ovario poliquístico. DHEA-S. Insulina poscarga. Hipertensión arterial.
SUMMARY
Objective: To evaluate hormonal profile, body mass index and blood pressure in 40 infertile women with polycystic ovary. Methods: In the out patien clinic of the Centro de Atencion Integral de la Universidad de Los Andes, height, weight and blood pressure were assessed. During follicular phase of the menstrual cycle in blood of them sex hormones and insulin (basal, 2 hours post glucose load) were measured by electrochemiluminescence. Results: The body mass index was directly correlated with the value of systolic blood pressure, ratio LH/ FSH and testosterone in serum, and it was inversely correlated with the hormones FSH and PRL. Clinical and laboratory data were observed within the reference limits, but kept directly related to testosterone LH / FSH, BMI and systolic blood pressure. When comparing two patient groups based on the value of the population median, body mass groups > 24 kg/m2 and systolic blood pressure > 120 mmHg, they showed levels of DHEA- S and insulin (basal and 2 h) higher than those women with lower values of BMI and systolic blood pressure. Conclusions: There is a correlation between serum androgen levels with overweight and hypertension by aetiological mechanisms interrelated. Polycystic ovary syndrome is multicausal origin eventually with hyperandrogenemia. Metabolic failure should be monitored in these patients, which would lower the effect of androgens and promote fertility status, but prevents long-term complications such as obesity, type 2 diabetes mellitus and high blood pressure.
Key words: Polycystic ovary. DHEA-S. Insulin afterload. Arterial hypertension.
INTRODUCCIÓN
El síndrome de ovario poliquístico (SOP) es causa importante de desórdenes reproductivos y metabólicos.(1) que se asocian con hiperandrogenismo y fallas en el ciclo menstrual (2). Ablan (3) considera que es la endocrinopatía más frecuente en mujeres con problemas reproductivos.
Se ha sugerido integrar tres características fundamentales para su definición que son hiperandrogenismo (hirsutismo y/o hiperandrogenemia) más disfunción ovárica (oligo-anovulación y/o ovarios poliquísticos) más los criterios ultrasonográficos de Rotterdam (4). En el Consejo de Amsterdan (2011) se recomendó apreciar más allá de los criterios de Rotterdam, al observar al menos uno de estos fenotipos: a) Exceso de andrógenos más disfunción ovulatoria; b) Exceso de andrógenos más morfología de ovarios poliquísticos; c) Disfunción ovulatoria más morfología de ovarios poliquísticos; d) Exceso de andrógenos más disfunción ovulatoria más morfología de ovarios poliquísticos (4).
La oligo-ovulación o anovulación en la mujer con SOP es la principal causa de infertilidad. Cambios en los estilos de vida pueden ser beneficiosos reduciendo las alteraciones metabólicas y endocrinas y así, mejorar la infertilidad causada por la anovulación. Evidencias sugieren que el SOP tiene un impacto negativo durante el embarazo, incrementando el riesgo de diabetes gestacional, hipertensión durante el embarazo y partos prematuros (5).
Desde el punto de vista endocrino se ha postulado que existe un descontrol en la secreción de las gonadotropinas LH y FSH que resulta en un exceso de andrógenos circulantes, FSH es normal o baja con elevación de la relación LH/FSH en la fase folicular temprana en mujeres jóvenes (6-8). Cerca del 50.% de las pacientes con SOP presentan aumento de la relación LH/FSH, especialmente cuando padecen obesidad (9,10). También la producción androgénica adrenal específicamente por aumento de dehidroepiandrosterona sulfato (DHEA-S) puede estar involucrada en la fisiopatología de esta enfermedad (11).
En el consenso venezolano de ovario poliquístico (12) se destacó que la obesidad se presenta al menos en el 30 % de los casos, particularmente se manifiesta aumento de la circunferencia abdominal asociada a hiperandrogenismo, resistencia a la insulina, intolerancia a la glucosa, hipertensión arterial (HTA) y dislipidemia. Sin embargo, el valor del índice de masa corporal (IMC) puede ser variado en mujeres con SOP (12). Otro aspecto interesante es que, cerca del 40 % de las mujeres con SOP presentan curva de tolerancia glucosada alterada y un 10 % de estas tienden a desarrollar en la cuarta década de la vida diabetes mellitus tipo 2, mientras que un 33 % de las mujeres no diabéticas desarrollan síndrome metabólico antes de los 50 años (12). En este sentido, el valor de la insulina podría estar relacionado con hipertensión o sobrepeso. Algunas pacientes desarrollan hipertensión arterial aislada y son de alto riesgo para hipertensión asociada al embarazo (13). Estudios en mujeres infértiles con sobrepeso e hipertensión en nuestra población son pocos. Desde un punto de vista de diagnóstico de laboratorio es importante diferenciar la hiperplasia suprarrenal congénita no clásica o de expresión tardía, que puede presentarse en forma muy similar al SOP (13). No existe consenso en relación con un esquema de exámenes de laboratorio que deban practicarse en la evaluación de la mujer con SOP (14). En este trabajo evaluamos el IMC y la tensión arterial en mujeres infértiles con SOP en quienes se les determinó la insulinemia basal y a las dos horas con carga de glucosa; y las hormonas sexuales LH, FSH, prolactina, testosterona y DHEA-S.
Se estudió una población de 40 pacientes que consultaron por infertilidad en el Centro de Atención Médica Integral de la Universidad de Los Andes, (CAMIULA), Mérida, Venezuela. A las pacientes se les diagnosticó SOP según el Consenso de Rotterdam (4) destacándose en ellas oligo o anovulación, 2) hiperandrogenismo con o sin hiperandrogenemia; y 3) ovarios poliquísticos en el examen ultrasonográfico.
Se excluyeron las pacientes que presentaban otras patologías como hiperplasia suprarrenal congénita, hiperprolactinemia, hipotiroidismo, síndrome de Cushing y tumores secretores de andrógenos, también aquellas que en los últimos seis meses habían ingerido fármacos que afectaban los niveles de hormonas sexuales o el metabolismo de los carbohidratos.
En la consulta se les midió la tensión arterial sistólica (TAS), tensión arterial diastólica (TAD), y se les calculó el IMC (peso/talla2). Luego en el laboratorio se les tomó una muestra de sangre en la que se midió la concentración de LH, FSH, prolactina, estradiol, progesterona, DHEA-S y testosterona total durante la fase folicular temprana de 2 a 4 días del ciclo menstrual. La respuesta del páncreas también se estudió midiendo insulina basal y a los 120 min. (0-2 h) con una carga inicial de 75 g de glucosa. La respuesta se consideró normal con insulina basal <15 μUI/mL, a los 120 min <60 μUI/ mL (15). LH, FSH, testosterona, estradiol, prolactina, DHEA-S e insulina fueron medidas con el método de electroquimioluminiscencia (Cienvar-Roche). El estudio siguió los lineamientos de la Declaración de Helsinski para investigación en humanos reseñados en el Código de Bioética y Bioseguridad del FONACIT (16). Los resultados se expresaron en valores promedio ± Desviación estándar de la muestra (X ± DE) y mediana poblacional para IMC y TAS. Se compararon cada una de las variables a estudiar a través de las distintas medidas para variables numéricas. Para esto se realizó un ANOVA y se obtuvo el coeficiente de correlación (r) entre las variables. El análisis se efectuó con un intervalo de confianza del 95 %.
RESULTADOS
Los valores promedio de peso, talla, IMC, TAS y TAD se presentan en el Cuadro 1, se observó que se mantenían dentro de los rangos normales de referencia. Los valores promedio expresados en X ± DE de IM, TAS y TAD fueron similares o a los valores de mediana poblacional calculada (Me).
En cuanto a la concentración sérica de las hormonas sexuales LH, FSH, prolactina, progesterona, DHEA-S e insulina basal y 2 horas poscarga se observa que los valores se mantenían dentro de los rangos normales de referencia. Los valores promedio de testosterona se mantenían dentro de los rangos normales de referencia y ligeramente superiores al valor de la mediana poblacional calculada (Cuadro 2).
Con base en el valor de la Me de tensión arterial sistólica e índice de masa corporal, las pacientes se separaron en dos grupos con dos subgrupos c/u. Para IMC se compararon los subgrupos <24 (n=20) y >24 kg/m2 (n=20), y para tensión arterial sistólica los subgrupos TAS <120 (n=20) y >120 kg/m2 (n=20).
En el Cuadro 3 se presentan los valores promedio de hormonas sexuales, insulinas (0-2 h), cuando se compararon en pacientes con rangos por encima y por debajo del valor de la mediana poblacional del IMC. Se observó que en mujeres con SOP con mayor IMC los niveles de estradiol fueron más bajos, DHEA-S (P<0,05) e insulina basal (P<0,05) y a las 2 (P<0,005) h. fueron más altos que en mujeres con menor IMC.



Al compararse las hormonas sexuales e insulina 0-2 h en grupos con valores Me de TAS > y <120 mmHg, se observó que los valores de insulina 0-2 h se encontraban más elevados (P<0,05) en las pacientes con valores más elevados de tensión arterial sistólica.
El análisis de correlación de Pearson entre hormonas sexuales, IMC y TA muestra una correlación positiva entre FSH con LH; de LH con testosterona y testosterona con IMC; hubo una importante relación directa entre LH/FSH y testosterona (P<0,005). Por otra parte, se observó correlación negativa entre FSH y PRL; y de LH con TAS (P<0,05).
Los niveles de insulina basal guardaron relación directa con TAS, TAD e IMC; mientras que los niveles de insulina a las 2 horas guardaron relación con LH, LH/FSH e IMC.
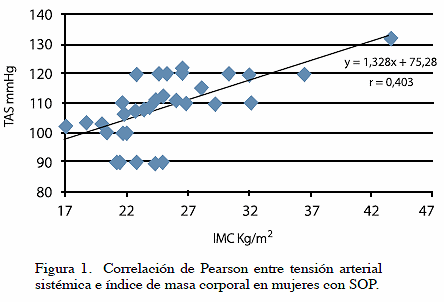
Dos parámetros clínicos se correlacionaron entre ellos, se observó que a mayor IMC era mayor el valor de la TAS. No se observó esta relación entre IMC y TAD (r=0,13). En la Figura 1 se observa la curva de correlación entre IMC y TAS en las mujeres evaluadas (r=0,40; P<0,05).
DISCUSIÓN
En mujeres con SOP cerca del 50 % de los casos podemos encontrar valores normales de tensión arterial sistémica y masa corporal. El análisis de correlación sugiere que la patología del SOP aun sin sobrepeso ni hipertensión amerita la revisión exhaustiva de los datos de laboratorio que deben ser correctamente interpretados.
Los niveles de gonadotropinas hipofisarias aun manteniéndose dentro de los rangos de referencia pueden presentar aumento de la relación LH/FSH en algunos casos. Su aumento se ha demostrado en un 60 % a un 70 % de mujeres con SOP, especialmente, en mujeres no obesas. En un estudio se consideró que valores de LH y FSH no eran determinantes. La variabilidad de sus resultados puede estar influenciada por la pulsatilidad natural de la secreción de LH y por la supresión que ocurre en la obesidad. Lewandowski y col. (17) demostraron que el aumento de pulsos de la hormona liberadora de gonadotropinas (GnRH) estimula la relación LH/FSH siendo parámetro en la identificación de los pacientes con síndrome de ovario poliquístico.
Los andrógenos no se encontraron elevados en estas pacientes; aun así guardaron relación con LH/ FSH, IMC y TAS. Los andrógenos provenientes en un 50 % de la médula adrenal y un 50 % de los ovarios pueden tener un efecto si es un hecho que existe disminución de la síntesis de SHBG en el hígado si existe el SOP, aumentando así los índices de testosterona libre con un consecuente hiperandrogenismo. En este estudio se evaluaron dos andrógenos DHEA-S y testosterona total (T inmunorreactiva), pero el impacto de los andrógenos podría apreciarse si se estudian las diferentes formas de expresión de estos incluyendo androstenediona, SHBG y albúmina para aportar datos más confiables, aun más que la testosterona libre inmunorreactiva, tales como índice de andrógenos libres, testosterona biodisponible y la testosterona libre calculada.
Aun así se encontró asociación entre testosterona y TAS. El mecanismo por el cual el hiperandrogenismo predispone al desarrollo de enfermedad cardiovascular e hipertensión, aún no está claro. Algunos autores proponen que la testosterona libre estimula el sistema renina-angiotensina (SRA) en los túbulos renales proximales, y que induce insulino-resistencia en los adipocitos. El hiperandrogenismo se relaciona también con disfunción endotelial, pues se libera la endotelina 1, un potente vasoconstrictor que se libera cuando la angiotensina II se une al endotelio vascular (18). La medición de andrógenos suprarrenales puede ser útil en el diagnóstico de este síndrome, puesto que SOP no escaparía de tener cambios en la TAS a expensas de un aumento de la DHEA-S (19). Las pacientes con TAS sobre los 120 mmHg son las que tienden a presentar respuesta anormalmente elevada a la secreción de insulina.
El valor promedio de IMC indica que al menos la mitad de las pacientes alcanzan el límite normal superior de masa corporal dependiente del peso. Está establecido que aproximadamente 40 %-60 % de las mujeres con SOP padecen de sobrepeso u obesidad. Esta proporción observada fue similar a la encontrada en estudios previos (20-23). Las correlaciones significativas entre IMC, insulina y presión arterial fueron observadas en las pacientes evaluadas. Esta es una observación importante porque las consecuencias metabólicas de la grasa abdominal son muy bien conocidas. Este estudio pone en alerta que las mujeres con SOP con sobrepeso e hiperinsulinemia son de alto riesgo para padecer hipertensión y diabetes (24).
El IMC se relaciona con la resistencia a la insulina. Se puede especular que no solo obesidad contribuye a una disminución de la sensibilidad a la insulina en las mujeres con SOP. Se ha demostrado que las pacientes con este síndrome tienen niveles más altos de insulina y se reduce la sensibilidad a la insulina en comparación con los controles sin síndrome de ovario poliquístico, independientemente del grado de sobrepeso (24).
Según lo indica el Cuadro 3 las mujeres delgadas parecen tener menos resistencia a la insulina. Por tanto, en el SOP, la resistencia a la insulina se traduce como hiperinsulinemia y se asocia a efectos diversos y complejos sobre la regulación del metabolismo de los lípidos, la síntesis proteica y la modulación de la producción de andrógenos. La causa de la resistencia a la insulina es compleja y multifactorial, con la intervención de factores genéticos y ambientales. Cuando una mujer con SOP tiene sobrepeso también puede tener resistencia a la insulina extrínseca asociada con adiposidad, lo cual puede ser mecánicamente diferente de la resistencia a la insulina presente en las mujeres delgadas con SOP (1).
Encontramos que cerca del 50 % de estas pacientes sufren de obesidad o sobrepeso. Los datos revelaron una correlación significativa entre IMC y los niveles de insulina. Se observó una correlación positiva entre IMC y la presión arterial sistólica. Se podría argumentar que la corta edad de las pacientes explica al menos en parte estos datos relativamente positivos. La cuestión de si la presencia de factores de riesgo en pacientes con SOP contribuye a un aumento precoz de eventos cardiovasculares es un tema de amplia discusión, ya que los estudios de seguimiento han traído resultados divergentes. En un largo plazo de seguimiento, hay un aumento en el riesgo de muertes relacionadas con enfermedades cardiovasculares durante 30 años, mientras que en otro ensayo, un exceso de eventos cerebrovasculares no fatales en las mujeres con SOP fue demostrado (23,25).
En este estudio no se pretende establecer patrones de hiperandrogenemia, hipertensión o hiperinsulinemia sobre los ya establecidos, nos referimos a las tendencias de pacientes estudiadas en esta región donde fue posible apreciar diferencias al compararse dos subgrupos en relación con valores de mediana poblacional en cuanto a tensión arterial sistémica e IMC. Hay algunas limitaciones en nuestro estudio. En primer lugar, que sufre de la falta de un grupo de control adecuado de mujeres sanas, en segundo lugar los resultados del perfil tiroideo, la testosterona libre (calculada y biodisponible), el lipidograma, índice HOMA e índice de Legro no se completaron en esta población. En tercer lugar, se incluye un número relativamente pequeño de las pacientes estudiadas.
Concluimos que en SOP sin evidencias de obesidad e hipertensión debe considerarse como punto central terapéutico las medidas que conduzcan a una mejor calidad de vida preventiva del desorden metabólico. Manteniendo un óptimo control metabólico en estas pacientes no solo se podría favorecer el estado de fertilidad sino de garantizar mayor calidad de vida al evitar obesidad, diabetes mellitus tipo 2 e hipertensión provenientes de mecanismos estrechamente interrelacionados.
REFERENCIAS
1. Teede HT, Deeks A, Moran L. Aspectos psicológicos, reproductivos y metabólicos del síndrome de ovario poliquístico. BMC Medicine. 2010;8:41. [ Links ]
2. Benyto S, Ferreira M, Galfrascoli A, González A, Sosa S. Síndrome de ovarios poliquísticos. Revista de Posgrado de la VIa Cátedra de Medicina. Mar. 2003;125:37-40. [ Links ]
3. Ablan F. Síndrome de ovario poliquístico. En: Urbina, Lerner Biver, editores. Fertilidad y Reproducción asistida. Caracas: Editorial Médica Panamericana; 2008.p.149-153.
4. Fauser B, Tarlatzis B, Rebar RW, Legro RS, Balen AH, Lobo R, et al. Consensus on womens health aspects of polycystic ovary syndrome (PCOS): The Amsterdam ESHRE/ASRM-Sponsored 3rd PCOS Consensus Workshop Group. Fertil Steril. 2012;97(1):28-38. [ Links ]
5. Ross N, Kieles H, Sahlin L, Ekman G, Falconer H, Stephansson O. Risk of adverse pregnancy outcomes in women with PCOS: Population based cohort study. BMJ. 2011;343:1-9. [ Links ]
6. Yildiz OB, Gedik O. Resistencia a la insulina en el síndrome de ovario poliquístico: hiperandrogenemia frente a normoandrogenemia. Eur J Obstet Gynecol Reprod Biol. 2002;2:114-118. [ Links ]
7. Vargas M, Sánchez G, Polanco J, Vargas L. Síndrome de ovario poliquístico: abordaje diagnóstico terapéutico. Rev BIOMED. 2003;14:191-203. [ Links ]
8. Discacciati V. Síndrome de ovario poliquístico. Evid Actual Pract Ambul. 2007;10(6):178-180. [ Links ]
9. Checa M, Espiós J, Matorras R. Síndrome de ovario poliquístico. Madrid, España: Editorial Médica Panamericana; 2007. [ Links ]
10. Botella J. El ovario: fisiología y patología. Madrid, España: Ediciones Díaz de Santos; 1995. [ Links ]
11. Ferriman D, Gallwey D. Clinical assesment of body hair growth in women. J Clin Endocrinal Metab. 1992;21:1440-1447. [ Links ]
12. Centeno I. Consenso Venezolano de Síndrome de Ovario Poliquístico. Marzo. 2013. Disponible en: http://intervalolibre.files.wordpress.com/2012/06/consenso-de-ovario-poliquistico-sogv.pdf
13. Ehrmann DA, Liljenquist DR, Kasza K, Asís R, Legro R, Ghazzi M. PCOS/Troglitazone Study Group. Prevalence and prediction of the metabolic syndrome in women with polycystic ovary syndrome. J Clin Endocrinol Metab. 2006;91:48-53. [ Links ]
14. Jovanovich L, Carmina E, Lobo KA. Not all women diagnosed with policystic ovary syndrome share same cardiovascular risk profiles. Fert Steryl. 2010;94:826- 832. [ Links ]
15. Del Río M, Ramírez J, Cortés M, Martí G, Godoy A, Vigil P. Análisis de resistencia insulínica, tolerancia a la glucosa y testosterona en mujeres jóvenes con síndrome de ovario poliquístico agrupadas por índice de masa corporal. Rev Chil Obstet Ginecol. 2006;71(5):299-306. [ Links ]
16. Briceño E, Suárez E, Michelangi C, Feliciangeli D, Ptaiza E, Mendible J. Código de Bioética y Bioseguridad 2002. Ministerio de Ciencia y Tecnología (FONACIT). 2ª edición. Venezuela.
17. Lewandowski KC, Cajdler-Luba A, Bieńkiewicz M, Lewiński A. Women with oligo-/amenorrhoea and polycystic ovaries have identical responses to GnRH stimulation regardless of their androgen status: Comparison of the Rotterdam and Androgen Excess Society diagnostic criteria. Neuro Endocrinol Lett. 2011;32(6):847-856. [ Links ]
18. Yildrim B, Sabir N, Kaleli B. Relation of intraabdominal fat distribution to metabolic disorders in non obese patients with polycystic ovary syndrome. Fertil Steril. 2003;79:1358-1364. [ Links ]
19. Puder JJ, Varga S, Kraenzlin M, De Geyter C, Keller U, Müller B. Central fat excess in polycystic ovary syndrome: Relation to low grade inflammation and insulin resistance. J Clin Endocrinol Metab. 2005;90:6014-6021. [ Links ]
20. Faloia E, Canibus P, Gatti C, Frezza F, Santangelo M, Garrapa GG, et al. Body composition, fat distribution and metabolic characteristics in lean and obese women with polycystic ovary syndrome. J Endocrinol Invest. 2004;27:424-429. [ Links ]
21. Radenković SP, Kocić RD, Peić MM, Dimić DN, Golubović MD, Radojković DB, et al. The hypertriglyceridemic waist phenotype and metabolic syndrome by differing criteria in type 2 diabetic patients and their relation to lipids and blood glucose control. Endokrynol Pol. 2011;62(4):316-323. [ Links ]
22. Diamanti-Kandarakis E, Dunaif A. Insulin resistance and the polycystic ovary syndrome revisited: An update on mechanisms and implications. Endocr Rev. 2012;33(6):981-1030. [ Links ]
23. Pierpoint T, McKeigue PM, Isaacs AJ, Wild SH, Jacobs HS. Mortality of women with polycystic ovary syndrome at long-term follow-up. J Clin Epidemiol. 1998;51(7):581-586. [ Links ]
24. Wild S, Pierpoint T, McKeigue P, Jacobs H. Cardiovascular disease in women with polycystic ovary syndrome at long-term follow-up: A retrospective cohort study. Clin Endocrinol (Oxf). 2000;52(5):595- 600. [ Links ]
25. Wild S, Pierpoint T, Mc Keigue P, Jacobs H. Cardiovascular disease in women with polycystic ovary syndrome at long-term follow-up: A retrospective cohort study. Clin Endocrinol (Oxf). 2000;52(5):595- 600. [ Links ]