Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Obstetricia y Ginecología de Venezuela
versión impresa ISSN 0048-7732
Rev Obstet Ginecol Venez vol.75 no.3 Caracas set. 2015
Genotipos del virus papiloma humano en el cuello uterino de mujeres de la región central de Venezuela
Drs. Aldo Reigosa1, Ángel Fernández1, Chien Yang Hung1, Iraida Graterol1, Yolima Fernández1, José D. Espinal1, Maritza Álvarez2
1 Centro de Investigaciones Médicas y Biotecnológicas de la Universidad de Carabobo. Facultad de Ciencias de la Salud. Universidad de Carabobo. Valencia, Venezuela.
2 Genomik. Laboratorio de Biología Molecular. Maracay, Venezuela.
RESUMEN
Objetivo: Realizar la detección y tipificación del virus papiloma humano, con la finalidad de conocer los genotipos más frecuente en la región central de Venezuela.
Métodos: La muestra estuvo constituida por 24 734 pacientes de sexo femenino en edades comprendidas entre 12 y 82 años, con sospecha clínica, citológica y/o histopatológica de infección por el virus papiloma humano. Las muestras provenían de diferentes consultas de ginecología del Estado Carabobo, Venezuela, y fueron recolectadas entre los años 1999 y 2009. Se obtuvieron muestras de hisopado, biopsia fresca y biopsia incluida en parafina.
Resultados: La frecuencia del virus fue de 68,7 % (16 991/24 734), de los cuales 70 % correspondieron a mujeres en rango de edad entre 12 a 30 años. Predominaron los genotipos de bajo riesgo oncogénico con 61,6 %, con respecto a los de alto riesgo 33,5 % y de probable alto riesgo 4,9 %. El genotipo más frecuente para el grupo de bajo riesgo fue la 6 (59,2 %) y para los grupos de alto riesgo y posible alto riesgo fue la 31 (31,4 %) y 53 (99,3 %), respectivamente.
Conclusiones: Considerando el número de muestra utilizada, este estudio constituye un importante marco de referencia para futuros trabajos, debido a que proporciona datos relevantes, relacionados con el estado de la infección por el virus papiloma humano en el país.
Palabras clave: Virus papiloma humano. Genotipos. Reacción en cadena de la polimerasa.
SUMMARY
Objective: To perform the detection and typing of human papilloma virus, in order to know the most common genotypes in the central region of Venezuela.
Methods: The sample consisted of 24 734 female patients aged between 12 and 82 years, with clinical suspicion, cytological and/or histopathology of infection by the human papillomavirus. The samples came from different gynecological Carabobo, Venezuela, and were collected between 1999 and 2009. Swab samples, fresh biopsy and paraffin embedded biopsy were obtained.
Results: The frequency of the virus was 68.7 % (16 991 / 24 734), of which 70 % were women in the age range of 12-30 years. Predominated low oncogenic risk genotypes with 61.6 % compared to 33.5 % of high risk and high risk probable 4.9 %. The most frequent genotype for low-risk group was 6 (59.2 %) and for high-risk groups and possible high risk was 31 (31.4 %) and 53 (99.3 %), respectively.
Conclusions: Considering the number of sample used, this study is an important framework for future work, because it provides relevant data related to the state of infection by the human papilloma virus in the country.
Key words: Human papilloma virus. Genotypes. Polymerase chain reaction.
INTRODUCCIÓN
El cáncer de cuello uterino es el cuarto tipo de cáncer más frecuente en mujeres a nivel mundial. Para el año 2012, la Agencia Internacional para la Investigación del Cáncer (IARC, por sus siglas en inglés), estableció que existieron más de 260 000 muertes por cáncer de cuello uterino en todo el mundo (1). En países subdesarrollados, representa un problema de salud pública por la alta mortalidad que genera. En Venezuela, constituye la segunda causa de muerte por cáncer en la mujer, ocupando el primer lugar el carcinoma de mama (2).
Son numerosos los factores que han sido relacionados con la génesis del cáncer de cuello uterino, siendo la infección por el virus papiloma humano (VPH) el principal factor etiológico, debido a que está relacionado con más del 99 % de todos los casos de cáncer. En la actualidad, se acepta que existe una relación directa entre la prevalencia de la infección por VPH y la incidencia de cáncer cervical (3,4).
El VPH es un virus de doble cadena de ácido desoxirribonucleico (ADN) que infecta el epitelio y mucosa del tracto anogenital, respiratorio y piel, y su principal vía de transmisión es a través del contacto sexual, de esta manera, tanto hombres como mujeres están involucrados en la historia natural de la infección (5,6). Se estima que por lo menos 75 % de la población sexualmente activa puede adquirir la infección durante la vida y más del 40 % de mujeres jóvenes se infectarán en los tres años siguientes al inicio de su actividad sexual (6,7).
La mayoría de las mujeres infectadas con un sistema inmune competente, no presentan manifestaciones clínicas, debido al desarrollo de una respuesta de células T citotóxicas que inactiva el virus, dando como resultado la remisión clínica de la infección. Solo una pequeña proporción de los casos se manifiesta clínicamente y resulta en lesiones benignas, lesiones precancerosas o cáncer (8,9). El resultado final de una infección por VPH, está determinado, entre otros cofactores, por la carga viral, respuesta inmune del hospedador y el tipo de VPH (5,6).
Hasta hoy se han identificado más de 100 tipos de VPH según sus diferencias en la secuencia de ADN. Los genotipos se han dividido en alto y bajo riesgo de acuerdo con su alta o baja asociación oncogénica (5,10). En 2003, se estableció una clasificación epidemiológica de los 40 tipos de VPH asociados con infecciones que se transmiten por contacto sexual e infectan la región anogenital, con base en un estudio internacional de casos y controles realizado en 13 países por Reina y col. (11) de la IARC. Un total de 15 tipos se clasificaron como de alto riesgo (AR), siendo ellos los tipos: 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73 y 82, porque su presencia estaba asociada con un riesgo muy alto de cáncer cervical; 12 como de bajo riesgo (BR), los tipos: 6, 11, 40, 42, 43, 44, 54, 61, 70, 72, 81 y CP6108, asociados con un riesgo no significativo de desarrollar cáncer cervical; además, 3 tipos se catalogaron como de riesgo intermedio o probable alto riesgo (PAR), ellos son el 26, 53 y 66.
La infección por VPH de BR, sobre todo por los genotipos 6 y 11, produce lesiones ano-genitales benignas (verrugas o condilomas) o infecciones subclínicas que suelen ser transitorias y casi siempre de resolución espontánea (alrededor del 90 %). Los tipos de AR, además del cáncer cervical, se asocian con carcinoma de vulva, vagina, ano y pene (3-5). La asociación del VPH con la malignidad, es debido a que el virus puede causar la transformación de las células normales en cancerosas, como consecuencia de su habilidad para integrar su información genética dentro del ADN de la célula hospedadora (3,11).
La infección por VPH es la infección de transmisión sexual más frecuente en el mundo, especialmente en personas jóvenes (menores de 25 años) sexualmente activas (5,6,12). Un estudio de metanálisis de la prevalencia del virus en cinco contenientes en más de 1 000 000 de mujeres con citología normal, mostró una tasa de prevalencia global estimada de 11,7 % y en regiones como África subsahariana (24 %), Europa del este (21,4 %) y América latina (16,1 %) (13).
Un estudio realizado en más de 1 000 mujeres con carcinoma cervical invasor en 22 países de varias regiones del mundo, demostraron que el VPH es una de las principales causas asociadas al desarrollo de cáncer de cuello uterino, encontrando que el 99,7.% de estos son producto de infección por VPH (14).
Diversos estudios han investigado sobre la prevalencia de los tipos de VPH en distintas regiones del mundo (15-18). En este sentido, Clifford y col. (19) en 2005, en un estudio con 15 613 mujeres sexualmente activas pero sin anomalías citológicas, provenientes de 11 países, obtuvieron que existe una heterogeneidad de infección por tipos de VPH de alto riesgo entre las regiones: Europa, Sudamérica, Asia y África subsahariana. Observando que el genotipo 16 es el más frecuente en esas regiones excepto en la región subsahariana, donde el genotipo 35 comparte la misma prevalencia con el genotipo 16, asimismo, el segundo tipo VPH de AR más frecuente fueron el 33 y 56 en Asia, el 58 en Suramérica y el 31 en Europa.
Por otro lado, Li y col. (20) en 2011, observaron que los genotipos 16 y 18, fueron los tipos de VPH de AR más frecuentes diagnosticados en 30 848 casos de cáncer de cuello uterino provenientes de diferentes países. También, indicaron que existen variaciones en determinadas áreas del mundo, por ejemplo, el tercer genotipo de VPH de AR más frecuente en África, Norteamérica y Oceanía es el 45, mientras que en Europa y Suramérica es el 31.
En América del Sur, aproximadamente 13,2 % de las mujeres en la población general están infectadas con el VPH y 67,7 % de los casos de cáncer cervical invasivo están atribuidos a los genotipos 16 y 18 del VPH. En Venezuela, para el año 2010, se estimó que 4 116 mujeres fueron diagnosticadas con carcinoma invasor del cuello uterino y 1 853 murieron a consecuencia de la enfermedad (21).
Se encontraron 13 trabajos publicados en Venezuela sobre los genotipos de VPH en cuello uterino, con un total de 2 718 casos estudiados, donde se incluyen muestras de la población femenina en general, trabajos con mujeres que tienen sospecha de infección viral y otros de pacientes con neoplasia intraepitelial o carcinoma invasor. Incluyen además diferentes técnicas de determinación, reacción en cadena de la polimerasa (PCR) y captura híbrida (21-33).
Las publicaciones en la población femenina en general comprenden 544 mujeres, con porcentajes de positividad que oscilan entre 15,6 a 52,83 % (22- 26). Los estudios realizados en mujeres con sospecha clínica o citológica de infección por VPH abarcan 3 160 pacientes con índices de positividad de 51,85 a 100 % (21,27-31). Finalmente, las investigaciones en pacientes con lesiones neoplásicas comprenden 497 casos con porcentajes de positividad a infección por VPH entre 72,06 y 98,9 % (32-34).
La disponibilidad de pruebas moleculares de alta sensibilidad, como por ejemplo, la PCR, han permitido la detección de ADN-VPH y la tipificación de los genotipos del virus, asimismo, proveen la posibilidad de superar las limitaciones del despistaje por citología, con la finalidad de adoptar oportunas medidas terapéuticas o de seguimiento, especialmente en mujeres con factores de riesgo y mayor susceptibilidad a desarrollar cáncer cervical (35,36).
Finalmente, y considerando que en el país aún no existe un número suficiente de estudios que involucren un número representativo de mujeres, acerca de la distribución de los genotipos de VPH, este trabajo tiene como propósito determinar los genotipos virales más frecuentes en el cuello uterino.
MÉTODOS
Se realizó un estudio de campo, descriptivo y transeccional. Con la aprobación del Comité de Ética y de la Comisión de Investigación del Centro de Investigaciones Médicas y Biotecnológicas de la Universidad de Carabobo en Valencia, Venezuela. Se conformó una muestra no aleatoria, de tipo intencional, con 24 734 pacientes provenientes de consultas ginecológicas privadas y públicas del Estado Carabobo, Venezuela, entre los años 1999 a 2009, de acuerdo a los siguientes criterios de inclusión: a) sexo femenino; y b) hallazgos clínicos al examen ginecológico y/o cito-histológicos de sospecha de infección por VPH. Se excluyeron todos los casos con diagnóstico anatomopatológico de carcinoma cervical invasor. Todas las muestras fueron enviadas al Laboratorio de Citología de la Maternidad del Este (centro de recepción) en Valencia, para luego ser trasladadas, siguiendo las instrucciones recomendadas internacionalmente, al Laboratorio Genomik C.A., ubicado en Maracay, Estado Aragua, donde fueron procesadas por PCR y el fragmento amplificado, digerido con enzimas de restricción para obtener el genotipo viral específico. La edad de la mujer fue recopilada de la solicitud del estudio de ADN-VPH por PCR.
Muestra. Se obtuvo por uno de los siguientes tres métodos diferentes: a) hisopado, realizando un raspado firme con hisopo de algodón estéril, pero sin producir sangrado, del exocérvix y endocérvix, colocando este en un tubo de plástico estéril seco y preservándolo a 4 ºC hasta su procesamiento, b) biopsia en fresco del material, un fragmento de tejido de aproximadamente 0,5 x 0,5 x 0,2 mm, colocado en tubo con tampón lisis conservante (Tris 10 mM pH 8, EDTA 5 mM y SDS 1 %) y almacenado a 4 °C hasta su procesamiento y c) biopsia fijada en formol al 10 % e incluida en parafina siguiendo los métodos convencionales. Se utilizó el bloque donde se hizo el diagnóstico anatomopatológico.
Extracción de ADN. a) Hisopado. Se adicionó 1 mL de solución salina 0,9 % y agitó en vortex por 1 min, posteriormente, se centrifugó a 12 500 rpm por 10 min a 4 °C. El concentrado celular, de acuerdo al tamaño del precipitado, se resuspendió con 100 μL a 450 μL de tampón de lisis (Tris 10 mM pH 8, EDTA 5 mM pH 8, IGEPAL 0,45 % y Tween 20 0,45 %) y proteinasa K (100 μg/mL) por cada muestra y se incubó por 3 h a 56 °C. b) Biopsia en fresco. Se fragmentó con bisturí mediante procedimiento estéril sobre un portaobjeto. Los fragmentos no mayores a 2 mm de diámetro fueron digeridos en tampón de lisis con proteinasa K (200 μg/mL) por 3 h a 56 °C. c) Biopsia incluida en parafina. Con material estéril y desechable, se obtuvo 5 cortes de 10 μm, realizando disección manual de la lesión identificada microscópicamente, para luego colocarlos en microtubos de 1,5 mL e incubarlos en tampón de lisis con proteinasa K (200 μg/mL) por 3 h a 56 °C. La extracción se hizo siguiendo el método fenol-cloroformo-alcohol isoamílico (25:24:1) pH 8 y precipitación del ADN con etanol y sales. El ADN obtenido se resuspendió en tubos Eppendorf con 50 μL de agua libre de nucleasas, conservándose a –20ºC hasta su uso.
La integridad del ADN fue verificada mediante electroforesis en gel de agarosa al 2 %.
Detección y tipificación de VPH por PCR. La detección del ADN del VPH se realizó mediante amplificación por PCR utilizando el kit PVH-Fast de Laboratorios Pharmagen (España), con cebadores específicos a la secuencia de 450 pares de base (pb) correspondiente a la región L1 del marco abierto de lectura del virus (secuencia de ADN similar entre los distintos genotipos del VPH), siguiendo las instrucciones del fabricante. La amplificación fue realizada en un equipo de PCR System 9700 (Applied Biosystems). Posteriormente, el producto de la amplificación fue sometido a electroforesis en gel de agarosa al 2 % con tinción de bromuro de etidio (0,2 μg/mL) y visualizado en un sistema de documentación de geles (Gel Doc it, UVP). Fueron utilizados los controles (positivo y negativo), además del control interno positivo (CIP) de la reacción de PCR (provistos en el kit) y 0,5 μg del marcador de peso molecular de 100 pb (Promega).
Interpretación de los resultados. Se consideró una muestra como: a) negativa, cuando se visualizó solo una banda de 1 200 pb correspondiente al CIP y b) positiva, cuando se observó una banda de 450 pb más una banda de 1200 pb del CIP. En los casos positivos, el fragmento amplificado de 450 pb fue digerido con dos enzimas de restricción suministradas en el kit (Rsa I y II), para obtener el genotipo viral específico. Para visualizar el patrón de bandas, el digerido fue sometido a electroforesis en gel de agarosa al 2 % con tinción de bromuro de etidio (0,2 μg/mL) y visualizadas en el sistema de documentación de geles. Los productos de la digestión fueron comparados con los patrones de restricción facilitados por el fabricante del kit. Para el análisis de los datos, se excluyeron las muestras con genotipo viral indeterminado.
Análisis estadístico. Los datos se presentan como distribuciones de frecuencia (absolutas y porcentajes) de las variables cualitativas, media y desviación estándar de las cuantitativas. Se realizaron tabulaciones cruzadas de las variables cualitativas, utilizando la prueba Chi cuadrado de Pearson para explorar la significación estadística de la posible asociación. El análisis de los datos recogidos se realizó mediante el paquete estadístico SPSS versión 19 (IBM Statistical Package for Social Sciences, Inc., Chicago, IL). Se consideraron significativos valores de P≤0,05.
RESULTADOS
El estudio comprendió 24 734 casos de pacientes con hallazgos clínico-patológicos anormales al examen ginecológico, a la colposcopia y/o por presentar hallazgos sospechosos de infección por VPH en la citología o biopsia.
La edad media de las pacientes al momento de estudio fue de 29,19 años, con una desviación estándar de 11,55 y un rango de 70 años (12-82 años); más de la mitad de las mujeres (53,9 %) tenían entre 12 y 30 años. El método de obtención de la muestra más utilizado fue el hisopado cervical, con el 76,6 % de las mismas. Se confirmó por PCR la positividad de infección por VPH en 68,7 % de los casos analizados. Los grupos etarios, métodos de obtención de la muestra y resultados de la prueba de ADN-VPH por PCR se detallan en el Cuadro 1.
En los casos positivos para ADN-VPH se realizó la tipificación del virus y la clasificación consiguiente del riesgo oncogénico del genotipo encontrado. Los tipos de BR representaron el 61,6 % (10 474/16.991), mientras que las de AR 33,5 % (5 692/16 991) y las de PAR 4,9 % (825/16 991) (Cuadro 2). La asociación del riesgo oncogénico del VPH con la edad de las pacientes se presenta en el Cuadro 3. Destaca que las mujeres de 31 a 50 años, la infección con tipos de AR es relativamente mayor que en los otros grupos etarios analizados, con diferencia estadística significativa (P<0,001).
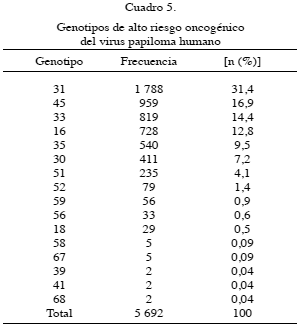
En relación con la frecuencia de tipos de BR oncogénico del VPH, se encontró que la más frecuente fue la 6 (59,2 %, 6 201/10 474) (Cuadro 4); por su parte, el tipo de AR más frecuente fue el 31 (31,4 %, 1 788/5 692) (Cuadro 5) y para las de PAR resultó la 53 (99,3 %, 819/825) (Cuadro 6). Cabe señalar, que se observaron 51 infecciones múltiples (0,2 % del total de los casos); de estas, las asociaciones más frecuentes fueron: 45+6, 31+6 y 33+6, que sumaron un total de 31 casos (60,8 %). En todas estas coinfecciones estaban involucrada un genotipo de AR.
En el Cuadro 7 se observa que al asociar la positividad al VPH, el método con mayor porcentaje de casos positivos para ADN-VPH por PCR fue la biopsia fresca, con el 81,4 % (3 837/4 716), con diferencia estadísticamente significativa (P<0,001).
DISCUSIÓN
El cáncer invasor de cuello uterino es una de las neoplasias malignas más comunes a nivel mundial; en Venezuela, en la actualidad, constituye la segunda causa de mortalidad femenina por cáncer (1,2).
La infección por VPH de AR oncogénico es el principal factor de riesgo para el desarrollo de cáncer de cuello uterino y de sus lesiones precursoras. Es considerada la infección de transmisión sexual más común a nivel mundial y al menos el 50 % de los individuos sexualmente activos la adquieren en algún momento de sus vidas. En la mayoría de los casos la infección es de carácter transitoria (4-6).
La asociación entre VPH y cáncer cervical sugiere que la pesquisa del virus representa una estrategia importante para identificar mujeres con alto riesgo de desarrollar una neoplasia cervical, además, el conocimiento de que el cáncer de cuello uterino está relacionado con genotipos específicos, indica la importancia como valor pronóstico que tiene la tipificación del VPH (19,37,38).
La frecuencia de las infecciones por VPH en la población general son muy diversas (1,16,20). A pesar del gran número de reportes publicados, los datos disponibles son de utilidad limitada debido a las edades de las pacientes comprendidas en los estudios y los diferentes métodos utilizados para la detección del virus (19). Tradicionalmente las alteraciones atípicas en las células del cuello uterino producidas por el VPH son reveladas por el estudio citológico. Desde algunos años, se puede seleccionar a las mujeres con mayor riesgo a desarrollar este tipo de lesiones, a través de la detección de secuencias de ADN por métodos de biología molecular, como la PCR (35,37,38).
La distribución por edad de la infección por VPH es variable en las diferentes regiones del mundo y aún en diferentes grupos de una misma área geográfica (39,40). En nuestro estudio, el grupo etario que presentó un mayor porcentaje de infección fue el de 12 a 30 años (70 %), bajando progresivamente esta relación con medida que aumenta la edad. Consistente con estos datos, otros autores han referido un patrón epidemiológico de distribución similar por edad de la infección por VPH, especialmente en mujeres menores de 30 años (21,22,26). No se encontró en esta serie el segundo pico después de la quinta década, que da lugar a una característica curva bimodal, reportada en la mayoría de los países latinoamericanos (19,41,42).
El grupo etario de 31 a 50 años presentó un mayor porcentaje de VPH-AR, coincidiendo con la edad en la cual se presentan con mayor frecuencia las lesiones neoplásicas en el cuello uterino. Esta relación se ha señalado también por varios autores (43,44), mientras otros, más bien establecen que a medida que aumenta la edad de las pacientes, disminuye el número de casos con VPH-AR (27,45).
En este estudio, se compararon los resultados obtenidos en los tres tipos de métodos de toma de muestra más frecuentemente empleados: hisopado, biopsia en fresco y biopsia incluida en parafina. Se demostró que la detección de ADN-VPH fue significativamente mayor en muestras obtenidas por biopsia fresca (81,4 % de casos positivos), en comparación con las que estaban incluidas en parafina (75,6 %) o por hisopado (65,2 %).
La diferencia entre el análisis de una muestra de biopsia en fresco y las muestras que siguen el proceso de fijación e inclusión en parafina, pudiera ser debido a la degradación del ADN viral durante el proceso de fijación con formol, resultando en la consecuente pérdida antigénica del material en estudio y por ende, en menor capacidad de detección del virus por PCR (34). Sin embargo, resulta favorable conocer que la biopsia, incluida en parafina, cuando es suficiente y el ADN no está degenerado, puede proporcionar un diagnóstico con una sensibilidad superior al 90 %. La posibilidad de deterioro del material genético está por debajo del 10 % (32).
Otros autores, indican que estas diferencias pueden ser atribuibles al método, en sí mismo, utilizado para obtener la muestra. Cuando es una biopsia, se obtiene un mínimo fragmento de mucosa que probablemente no representa lo que ocurre en todo el cuello uterino. En algunas publicaciones se ha señalado que el método del hisopado es el más adecuado, pues realiza un raspado de gran parte del cuello uterino, lo cual aumenta el número de células recogidas, adicional a esto, es un método que no está sometido a procedimientos que puedan introducir inhibidores de la PCR o provocar degradación del ADN. Su procesamiento se realiza en fresco y no es necesario congelar ni someter a fijación la muestra, elevando por tal motivo la sensibilidad del método (38,46,47). Sin embargo, en este trabajo fue el método con mayor porcentaje de casos negativos.
No obstante, hay que considerar que la biopsia fresca proporciona células de todo el espesor del epitelio, hecho importante para la detección del virus, teniendo en cuenta que las células con mayor carga viral no siempre están en el estrato superficial del epitelio (46,47).
Son pocos los estudios en la literatura que han comparado la calidad de las muestras tomadas a través de estos tres tipos de obtención; sin embargo, los que han cotejado la capacidad de detección del virus en muestras obtenidas entre hisopado cervical y biopsia incluida en parafina, han encontrado que el primero tiene mayor sensibilidad para la detección del ADN viral (32,35), diferente a lo obtenido en el presente estudio, con una diferencia de significación estadística (P<0,001).
Es importante destacar que en el presente estudio, la serie corresponde a mujeres con hallazgos clínicopatológicos sospechosos de infección por VPH al examen ginecológico, en la citología y/o cambios histopatológicos en la biopsia, excluyéndose los casos con diagnóstico de cáncer de cuello uterino, factor que podría ocasionar frecuencias de infección por VPH diferentes a las encontradas en la serie estudiada.
Utilizando la técnica de PCR para VPH, se detectaron 16 991 casos positivos (68,7 %), lo que coincide con la frecuencia de infección por VPH, reportada en diversos estudios nacionales, realizados en muestras con criterios similares a los de este estudio, en los cuales los porcentajes de positividad oscilan entre 53 % y 90 % (21,27-31).
Por otra parte, el 31,3 % de los casos resultaron negativos para ADN-VPH, a pesar de la sospecha clínica y/o citológica. Es conocido que existen numerosas causas que explican esta discordancia, entre las que se pueden mencionar el sobre diagnóstico clínico, presencia de alteraciones celulares reactivas que confundan con los cambios específicos de la infección viral, así como la posibilidad de hallazgos falsos negativos en la PCR, debido a problemas con la muestra, ya sea en la toma, manejo o la técnica (sobrefijación, número de cortes de secciones de los bloques de parafina, entre otros) (33,35,36).
En el 33,5 % y 4,9 % de los casos se encontró VPH de AR y PAR, respectivamente, cuya sumatoria de frecuencias fue de 38,4 %. Es importante recordar, que las tipos de PAR son halladas en los carcinomas cervicales invasores, al igual que las de AR, aunque en menor proporción (6,48,49).
Por su parte, los genotipos de VPH-AR resultaron con menor frecuencia que los VPH-BR (61,6 %), lo que no coincide con la literatura internacional, en la cual, la mayoría de los trabajos señala que la incidencia de infección con tipos virales oncogénicos es más alta que con tipos virales no oncogénicos (15,19). En Venezuela, hay trabajos que refieren una mayor frecuencia de la genotipos de BR (21,24,28,32), mientras otros indican lo contrario (25,33). A pesar que solo una pequeña proporción de pacientes con VPH del cuello uterino desarrollan carcinoma invasor, estos hallazgos son contradictorios, sabiendo que en Venezuela existe una alta incidencia de carcinoma invasor del cuello uterino, que se conoce tiene como principal agente etiológico el VPH de AR.
En el presente estudio, los 10 primeros genotipos de AR en orden decreciente de frecuencia fueron: 31 (31,4 %), 45 (16,9 %), 33 (14,4 %), 16 (12,8 %), seguido por las tipos 35, 30, 51, 52, 59 y 56. La distribución de genotipos VPH-AR es diferente a la citada en la literatura, la cual señala en su mayoría, que el genotipo de mayor prevalencia en el mundo y en Venezuela es el VPH-16 (15,19-21).
Al respecto, la Organización Mundial de la Salud señala que en Suramérica el genotipo más común detectado en muestras de cérvix es VPH-16. Sin embargo, para esta serie el comportamiento no es igual. Si bien el VPH-16 se encuentra en los primeros lugares de incidencia a nivel mundial y es la tipo más comúnmente involucrado en el desarrollo de malignidad, resulta interesante que el mismo sea superado por genotipos 31, 45 y 33, los cuales no han sido señalados de alta prevalencia internacional (21). En Venezuela, algunas publicaciones han señalado una mayor frecuencia de genotipos diferentes a la 16, entre ellos, el trabajo de Rivas y col. (21) en 725 mujeres, que señala que el tipo de AR más frecuente en su estudio fue la 52 y el de Somogyi y col. (30) en 175 mujeres analizadas y donde la más frecuente fue la 31.
Estos hallazgos indican que posiblemente los tipos 31 y las otras que son más frecuentes que la 16, tengan un potencial oncogénico menor, considerando que el genotipo 16 es el que mayormente está relacionada con los casos de carcinoma invasor de cuello uterino (11,32,34).
En cuanto a las tipos de PAR oncológico, el tipo VPH-53 (99,3 %) fue el más común entre ellas. En el caso del VPH-BR los genotipos predominantes fueron VPH-6 (59,2 %) y VPH-11 (36,3 %), otros genotipos de BR estuvieron muy escasamente representados. Consistente con estos datos, otros autores han referido un patrón epidemiológico de distribución similar para estas tipos de VPH (19,20,34).
Cabe resaltar, que solo en el 0,2 % de los casos se detectaron infecciones mixtas; de estas, las asociaciones más frecuentes fueron: 45+6, 31+6 y 33+6. La presencia de infecciones mixtas en un mismo paciente es un hecho bien documentado; a nivel mundial las coinfecciones varían entre 9 % y 40 %. Solo 2 de 51 infecciones múltiples presentaron VPH 16, lo que no coincide a lo descrito en reportes internacionales, donde los genotipos predominantes en estos casos son la 16 y 18 (50,51).
En la actualidad, el cáncer cervical es un problema de salud pública en nuestro país. La tipificación del virus permite en cada paciente aplicar una estrategia específica, de seguimiento clínico y conductas terapéuticas oportunas si estuvieran indicadas, según sea el caso; medidas que pudieran contribuir a reducir la elevada morbimortalidad por causa de esta patología (27,32).
En conclusión, como hallazgos relevantes de este estudio, se puede señalar en primer lugar, que los fragmentos de biopsia (tanto en fresco como en parafina) son adecuados para el estudio de los genotipos virales de VPH por PCR. En segundo lugar, las tipos de BR fueron más frecuentes en la serie estudiada y finalmente, los genotipos de AR 31, 45 y 33 se encontraron en mayor número de casos que la 16.
Aun cuando las muestras analizadas no provienen de todas las regiones del territorio nacional, el número elevado de casos involucrados en este estudio constituye una significativa contribución a conocer el estado de la infección por VPH en el país.
AGRADECIMIENTOS
A todos los médicos ginecólogos del Estado Carabobo que colaboraron con la obtención de las muestras en sus respectivas consultas públicas y privadas. A los médicos anatomopatólogos y técnicos citólogos que evaluaron las biopsias y citologías, y al personal de Laboratorio Genomik C.A.
REFERENCIAS
1. Ferlay J, Soerjomataram I, Ervik M, Dikshit R, Eser S, Mathers C, et al. Cancer Incidence and Mortality Worldwide: IARC Cancer Base No. 11. GLOBOCAN 2012. International Agency for Research on Cancer 2013. [ Links ]
2. Ministerio del Poder Popular para la Salud. Anuario de mortalidad 2011. [Documento en línea, consultado en febrero 2014]. Disponible en: http://www.mpps.gob.ve/index.php?option=com_phocadownload & view=category & id=11:anuarios-de-mortalidad. [ Links ]
3. McLaughlin-Drubin ME, Meyers J, Munger K. Cancer associated human papillomaviruses. Curr Opin Virol. 2012;2:459-466. [ Links ]
4. Faridi R, Zahra A, Khan K, Idrees M. Oncogenic potential of Human Papillomavirus (HPV) and its relation with cervical cancer. Virol J. 2011;8:269-277. [ Links ]
5. Ibeanu OA. Molecular pathogenesis of cervical cancer. Cancer Biol Ther. 2011;11:295-306. [ Links ]
6. Gravitt PE. The known unknowns of HPV natural history. J Clin Invest. 2011;121:4593-4599. [ Links ]
7. Insinga RP, Dasbach EJ, Elbasha EH. Epidemiologic natural history and clinical management of Human Papillomavirus (HPV) Disease: A critical and systematic review of the literature in the development of an HPV dynamic transmission model. BMC Infect Dis. 2009;9:119-145. [ Links ]
8. Adefuye A, Sales K. Regulation of inflammatory pathways in cancer and infectious disease of the cervix. Scientifica (Cairo). 2012;2012:1-8. [ Links ]
9. Sasagawa T, Takagi H, Makinoda S. Immune responses against human papillomavirus (HPV) infection and evasion of host defense in cervical cancer. J Infect Chemother. 2012;18:807-815. [ Links ]
10. Burk RD1, Chen Z, Van Doorslaer K. Human papillomaviruses: Genetic basis of carcinogenicity. Public Health Genomics. 2009;12:281-290. [ Links ]
11. Reina J, Muñoz N, Sánchez I. El estado del arte de las infecciones producidas por el virus del papiloma humano. Colomb Med. 2008;39:189-195. [ Links ]
12. Ault KA. Epidemiology and natural history of human papillomavirus infections in the female genital tract. Infect Dis Obstet Gynecol. 2006;2006:1-5. [ Links ]
13. Martín-Hernán F, Sánchez-Hernández JG, Cano J, Campo J, del Romero J. Oral cancer, HPV infection and evidence of sexual transmission. Med Oral Patol Oral Cir Bucal. 2013;18:439-444. [ Links ]
14. Walboomers JM, Jacobs MV, Manos MM, Bosch FX, Kummer JA, Shah KV, et al. Human papillomavirus is a necessary cause of invasive cervical cancer worldwide. J Pathol. 1999;189:12-19. [ Links ]
15. Bruni L, Diaz M, Castellsagué X, Ferrer E, Bosch FX, de Sanjosé S. Cervical human papillomavirus prevalence in 5 continents: Meta-analysis of 1 million women with normal cytological findings. J Infect Dis. 2010;202:1789-1799. [ Links ]
16. Wheeler CM, Hunt WC, Joste NE, Key CR, Quint WG, Castle PE. Human papillomavirus genotype distributions: Implications for vaccination and cancer screening in the United States. J Natl Cancer Inst. 2009;101:475-487. [ Links ]
17. kamperle M, Kocjan BJ, Maver PJ, Seme K, Poljak M. Human papillomavirus (HPV) prevalence and HPV type distribution in cervical, vulvar, and anal cancers in central and eastern Europe. Acta Dermatovenerol Alp Panonica Adriat. 2013;22:1-5. [ Links ]
18. Deluca GD, Marin HM, Blanco NS, Basiletti JA, González JV, Merino AL, et al. Distribution of human papillomavirus genotypes in women with cervical alterations from north Argentina. Indian J Med Microbiol. 2013;31:138-141. [ Links ]
19. Clifford GM, Gallus S, Herrero R, Muñoz N, Snijders PJ, Vaccarella S, et al. IARC HPV Prevalence Surveys Study Group. Worldwide distribution of human papillomavirus types in cytologically normal women in the International Agency for Research on Cancer HPV prevalence surveys: A pooled analysis. Lancet. 2005;366:991-998. [ Links ]
20. Li N, Franceschi S, Howell-Jones R, Snijders PJ, Clifford GM. Human papillomavirus type distribution in 30 848 invasive cervical cancers worldwide: Variation by geographical region, histological type and year of publication. Int J Cancer. 2011;128:927-935. [ Links ]
21. Rivas E, Verlezza S, Flores M. Distribución genotipoespecífico del virus papiloma humano entre hombres y mujeres de Caracas, Venezuela. Rev Obstet Ginecol Venez. 2012;72:171-176. [ Links ]
22. Núñez-Troconis J, Delgado M, González J, Mindiola R, Velásquez J, Conde B, et al. Prevalence and risk factors of human papillomavirus infection in asymptomatic women in a Venezuelan urban area. Invest Clin. 2009;50:203-212. [ Links ]
23. Suárez C, Mijares A, Castillo L, Briceño J. Tipificación del VPH en cáncer de cuello uterino en la población venezolana. Rev Venez Oncol. 2006;18:221-225. [ Links ]
24. Contreras L, Correnti M, Avila M, Guerrero A, León A. Virus Papiloma Humano (VPH) en contexto ecológico venezolano: diagnóstico citológico y molecular. Salus. 2008;12:68-77. [ Links ]
25. Nicita G, Reigosa A, Torres J, Vázquez C, Fernández Y, Álvarez M, et al. Infección por virus del papiloma humano (VPH) en una población indígena del Amazonas venezolano. Salus. 2010;14:51-59. [ Links ]
26. Reigosa A, Álvarez M, De Vasconcelo M, Cristina R, Salas W, Rebolledo V, et al. Diagnóstico del virus papiloma humano en cuello uterino de mujeres que acuden a su consulta anual citológica. Salus. 2003;8:33-42. [ Links ]
27. López M, Morella G, Quintero M, Cruz J, Puig J, Toro M. Infección por virus papiloma humano en pacientes con células escamosas atípicas de un programa de pesquisa de cáncer cervical. Rev Obstet Ginecol Venez. 2012;72:19-27. [ Links ]
28. Araujo E. Infección por virus de papiloma humano en mujeres: hallazgos paraclínicos. Rev Obstet Ginecol Venez. 2010;70:82-89. [ Links ]
29. Quintero M, Cruz J, Bastidas M, Márquez L, Puig J. Detección y tipificación de virus del papiloma humano (VPH) mediante PCR- RFLP. Rev Obstet Ginecol Venez. 2008;68:25-31. [ Links ]
30. Somogy L, Malpica C, Alvarado B, García M. Virus del papiloma humano (VPH) detección y tipificación en la consulta privada. Rev Obstet Ginecol Venez. 2010;70:160-166. [ Links ]
31. Correnti M, Cavazza ME, Herrera O, Rodríguez A. Presence of human papillomavirus infection determined by hybrid capture assay in cervical lesions in a Venezuelan population. Invest Clin. 2010;51:27- 35. [ Links ]
32. Carrillo C, López G, González M, Caraballo L, Venegas C. Detección del virus papiloma humano: influencia del tipo de muestra y la severidad de la lesión intraepitelial cervical. Rev Obstet Ginecol Venez. 2010;70:240-248. [ Links ]
33. Salazar E. Detección del virus de papiloma humano en pacientes con lesiones intraepiteliales escamosas de cuello uterino. Rev Obstet Ginecol Venez. 2007;67:47-54. [ Links ]
34. Sánchez-Lander J, Cortiñas P, Loureiro C, Pujol F, Medina F, Capote-Negrín L, et al. Human papillomavirus in invasive cervical cancer and cervical intraepithelial neoplasia 2 and 3 in Venezuela: A crosssectional study. Cancer Epidemiol. 2012;36:284-287. [ Links ]
35. Abreu AL, Souza RP, Gimenes F, Consolaro ME. A review of methods for detect human Papillomavirus infection. Virol J. 2012;9:262-271. [ Links ]
36. Saslow D, Solomon D, Lawson HW, Killackey M, Kulasingam SL, Cain JM, et al. American Cancer Society, American Society for Colposcopy and Cervical Pathology, and American Society for Clinical Pathology screening guidelines for the prevention and early detection of cervical cancer. J Low Genit Tract Dis. 2012;16:175-204. [ Links ]
37. Jin XW, Lipold L, Sikon A, Rome E. Human papillomavirus vaccine: Safe, effective, underused. Cleve Clin J Med. 2013;80:49-60. [ Links ]
38. Picconi MA. Human papilomavirus detection in cervical cancer prevention. Medicina (B Aires). 2013;73:585-596. [ Links ]
39. Insinga RP, Liaw KL, Johnson LG, Madeleine MM. A systematic review of the prevalence and attribution of human papillomavirus types among cervical, vaginal, and vulvar precancers and cancers in the United States. Cancer Epidemiol Biomarkers Prev. 2008;17:1611- 1622. [ Links ]
40. Ciapponi A, Bardach A, Glujovsky D, Gibbons L, Picconi MA. Type-specific HPV prevalence in cervical cancer and high-grade lesions in Latin America and the Caribbean: Systematic review and meta-analysis. PLoS One. 2011;6:e25493. [ Links ]
41. Ferreccio C, Prado RB, Luzoro AV, Ampuero SL, Snijders PJ, Meijer CJ, et al. Populationbased prevalence and age distribution of human papillomavirus among women in Santiago, Chile. Cancer Epidemiol Biomarkers Prev. 2004;13:2271- 2276. [ Links ]
42. Molano M, Posso H, Weiderpass E, van der Brule ACJ, Ronderos M, Franceschi S, et al. Prevalence and determinants of HPV infection among Colombian women with normal cytology. Br J Cancer. 2002;87:324-333. [ Links ]
43. Wu MH, Zhang SW, Zhang WY, Zhou BL, Xie Z, Wang JD, et al. Epidemiological study of high risk human papillomavirus infection in 25 to 54 years old married women in Beijing. Zhonghua Fu Chan Ke Za Zhi. 2009;44:892-897. [ Links ]
44. Syrjänen K, Kulmala SM, Shabalova I, Petrovichev N, Kozachenko V, Zakharova T, et al. Epidemiological, clinical and viral determinants of the increased prevalence of high-risk human papillomavirus (HPV) infections in elderly women. Eur J Gynaecol Oncol. 2008;29:114-122. [ Links ]
45. Nobre RJ, Cruz E, Real O, Pereira L, Martins TC. Characterization of common and rare human papillomaviruses in Portuguese women by the polymerase chain reaction, restriction fragment length polymorphism and sequencing. J Medical Virol. 2010;82:1024-1032. [ Links ]
46. Melo A, Roa I, Montenegro S, Capurro I, Roa JC. Detection of human papilloma virus in cytologic samples or biopsies of the cervix. Rev Med Chil 2005;133:639-644. [ Links ]
47. Gutiérrez-Xicoténcatl L, Plett-Torres T, Madrid-González CL, Madrid-Marina V. Molecular diagnosis of human papillomavirus in the development of cervical cancer. Salud Pública Mex. 2009;3:479-488. [ Links ]
48. Matah M, Sareen S. Detection of HPV by PCR-A Novel Step in the Prevention of Cancer Cervix. J Obstet Gynaecol India 2012; 62:188-191. [ Links ]
49. Tchernev G. Sexually transmitted papillomavirus infections: Epidemiology pathogenesis, clinic, morphology, important differential diagnostic aspects, current diagnostic and treatment options. An Bras Dermatol. 2009;84:377-389. [ Links ]
50. Valdivia I, Aguayo F, Pruyas M, Snijders P, Corvalán A, Ferreccio C. Genotipos de virus papiloma humano (VPH) en pacientes con cáncer cervico-uterino en un hospital público y una clínica privada de Santiago, Chile. Rev Chil Infect. 2010;27:11-16. [ Links ]
51. Tsiodras S, Georgoulakis J, Chranioti A, Voulgaris Z, Psyrri A, Tsivilika A, et al. PCR screening of cervical human papilloma virus infections. Cytological and histological associations in 1 270 women. BMC Cancer. 2010;10:53-61. [ Links ]