Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Obstetricia y Ginecología de Venezuela
versión impresa ISSN 0048-7732
Rev Obstet Ginecol Venez vol.75 no.4 Caracas dic. 2015
Niveles de hormona antimülleriana en pacientes con síndrome de ovario poliquístico
Dras. Rita Pizzi, Indira Centeno, Liliana Fung, Yohana Pérez, Fanny Toro, Yennifer González, Marisol Fernández
Hospital Universitario de Caracas. Caracas, Venezuela, Unidad de Endocrinología y Reproducción
Dirigir correspondencia a: pizzi.rita@gmail.com
Trabajo presentado en el 16° Congreso Mundial de Endocrinología Ginecológica, 5 al 8 de marzo de 2014, Florencia, Italia.
RESUMEN
Objetivo: Determinar los valores de hormona antimülleriana en pacientes con síndrome de ovario poliquístico de la consulta de Endocrinología Ginecológica del Hospital Universitario de Caracas en el lapso de marzo-septiembre de 2013.
Métodos: Se realizó un estudio de tipo prospectivo, descriptivo y longitudinal, con muestreo secuencial simple de 30 pacientes entre los 18-39 años que cumplían con los criterios de Rotterdam. Se realizaron determinaciones de hormona antimülleriana tomando como valor control 3,5 para síndrome de ovario poliquístico. Se determinaron los niveles de hormona antimülleriana en los diferentes grupos etarios y se correlacionaron los valores de la hormona según la presencia de ciclos ovulatorios o anovulatorios y su relación con el índice de masa corporal y con niveles de andrógenos.
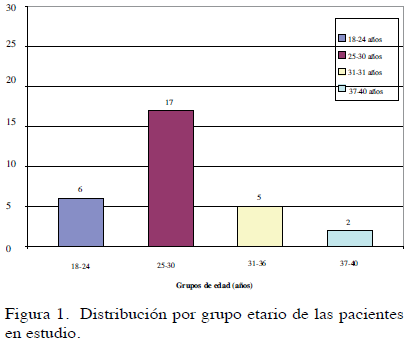
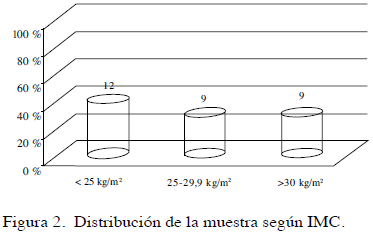
Resultados: El total de la muestra fue de 30 pacientes: 20 % (6/30) entre los 18 y 24 años, 56,5 7 % (17/30) 25-30 años, 16, 7 % (5/30) 31-36 años y 6, 7 %(2/30) 37-40 años. El índice de masa corporal osciló entre 19 y 48 kg/m2 con mediana en 26,10 kg/m2. Los valores de hormona antimülleriana oscilaron entre 1,90 y 22,20, ẋ=10,22. El 3,33 %(1/30) presentó valores inferiores a 3 y el 96,6 7 % (29/30) superaron este valor. Se establecieron los valores de hormona antimülleriana para los distintos grupos etarios que componen la muestra. El coeficiente de correlación de Pearson entre índice de masa corporal y hormona antimülleriana reporta un valor r=0,03 lo que sugiere una relación directa muy baja entre ambas variables. Al considerar la condición de ciclos anovulatorios dependiente de hormona antimülleriana, el coeficiente alcanza el valor 0,95, con una relación muy alta, donde 24 pacientes anovulatorias tienen valores de hormona antimülleriana que oscilan entre 4,80 y 22,20, ẋ=10,86. El coeficiente de correlación de Pearson r=-0,03 indica una relación inversa muy baja entre hormona antimülleriana y 17OHPG y el coeficiente de correlación de Pearson r=0,04 indica una relación directa muy baja entre hormona antimülleriana y testosterona.
Conclusiones: La hormona antimülleriana se encuentra elevada en pacientes con síndrome de ovario poliquístico (valores superiores a 3). No se encontró relación significativa entre niveles de hormona antimülleriana e índice de masa corporal y una relación directa muy baja con la presencia de hiperandrogenismo bioquímico. Sin embargo, si se encontró correlación entre los ciclos anovulatorios y más elevados de hormona antimülleriana.
Palabras clave: Síndrome de ovario poliquístico. Hormona antimülleriana. Oligoamenorrea.
SUMMARY
Objective: To determine the values of antimülleriana hormone in patients with polycystic ovary syndrome who were treated at the Gynecology office of the University Hospital of Caracas between March to September 2013.
Methods: A prospective, descriptive and longitudinal study with simple sequential sampling of 30 patients between the ages of 18-39 who met the Rotterdam criteria was performed. Antimülleriana hormone determinations were performed using a 3.5 value as a control for polycystic ovary syndrome. Antimülleriana hormone levels were determined in the different age groups and hormone values were then correlated according to the presence of ovulatory or anovulatory cycles and its relationship with BMI and androgen levels.
Results: 30 patients were recruited for the study: 20 % (6/30) between 18 and 24 years old, 56.5 7 % (17/30) between 25-30 years old, 16. 7 % (5/30) between 31-36 years old and 6. 7 % (2/30) between 37-40 years old. The BMI ranged between 19 and 48 kg/m2 with a median of 26.10 kg/m2. The antimülleriana hormone values ranged between 1.90 and 22.20, x = 10.22. 3.33 % (1/30) had values less than 3 and 96.6 7 % (29/30) exceeded this value. Antimülleriana hormone values were established for the different age groups. The Pearson correlation coefficient between BMI and antimülleriana hormone yielded a value of r = 0.03 suggesting a very low direct relationship between the two variables. When considering the anovulatory cycles condition dependent of antimülleriana hormone, the eta coefficient value reached 0.95 with a very high relationship, where 24 anovulatory patients with antimülleriana hormone values ranging between 4.80 and 22.20, x = 10, 86. The Pearson correlation coefficient r = -0.03 indicates a very low inverse relationship between the antimülleriana hormone and the 17OHPG. Also the Pearson correlation coefficient r = 0.04 indicates a very low direct relationship between antimülleriana hormone and testosterone.
Conclusions: The antimülleriana hormone is elevated in patients with polycystic ovary syndrome (values greater than 3). No significant relationship was found between antimülleriana hormone and BMI levels and a very low direct relationship with the presence of biochemical hyperandrogenism. However, a dependency among the anovulatory cycles dependent of the higher values of antimülleriana hormone was found.
Key words: Polycystic ovary syndrome. Antimülleriana hormone. Oligomenorrhea.
INTRODUCCIÓN
El síndrome de ovario poliquístico (SOP) es una alteración endocrino-metabólica que se define como una disfunción ovulatoria cursando con hiperandrogenismo o hiperandrogenemia. El SOP es la endocrinopatía más frecuente en la edad reproductiva, con una prevalencia estimada de 5.%- 10 % (1), pudiendo también manifestarse durante la etapa prepuberal. Está asociado a un mayor riesgo para desarrollar diabetes mellitus tipo 2, hipertensión arterial, enfermedad cardiovascular y cáncer de endometrio, considerando en la actualidad a este síndrome como la expresión clínica más temprana de síndrome metabólico.
Han transcurrido más de siete décadas desde la primera descripción del SOP, en 1935, por Stein y Leventhal (2), en las cuales se han hecho grandes avances en el conocimiento de los mecanismos intrínsecos que explican la fisiopatología de este desorden, siendo el reconocimiento de un estado de resistencia a la insulina e hiperinsulinismo compensatorio, uno de los mecanismos subyacentes de la disfunción ovulatoria, hiperandrogenismo, infertilidad y anormalidades metabólicas como la dislipidemia y trastornos de la tolerancia a la glucosa. A pesar de que han pasado varias décadas desde las primeras descripciones del SOP, su etiología aún se mantiene en discusión.
Las mujeres con síndrome de ovario poliquístico tienen un aumento de la frecuencia y la amplitud de los pulsos de LH, con un incremento tanto en su bioactividad como en su producción diaria (2). Esta alteración es consecuencia de un incremento anormal de la frecuencia de pulsos de GnRH por parte del generador de pulsos del hipotálamo, lo cual favorece la mayor producción hipofisiaria de LH, creando un desbalance entre LH y FSH, a favor de la primera. Este desbalance estimula la producción ovárica de andrógenos por las células de la teca al estimular las enzimas intra ováricas involucradas en la producción de testosterona y sus precursores. La anormalidad resultante de la esteroidogénesis ovárica influye en el generador de pulsos lo que condiciona a un patrón acelerado en la secreción de GnRH y un aumento de la LH sobre la FSH, lo cual crea un círculo vicioso que perpetúa el hiperandrogenismo ovárico y por tanto la anovulación y las demás manifestaciones clínicas de este síndrome (2).
El diagnóstico de SOP se confirma con la presencia de dos de los tres siguientes criterios propuestos en 2003 en la reunión internacional de Consenso de Rotterdam (3): 1) oligoanovulación, 2) hiperandrogenismo clínico y/o bioquímico, 3) ovarios poliquísticos por ecosonografía. El SOP se relaciona con alteraciones hormonales del eje hipófisisovario (disfunción menstrual, hiperandrogenismo, infertilidad y ovarios poliquísticos) y resistencia a la insulina (4). La heterogeneidad de los síntomas, de la apariencia ovárica y de los hallazgos endocrinológicos, ha hecho que se considere a este síndrome como una enfermedad sin identidad (5). Este síndrome puede tener manifestaciones clínicas generales, endocrinológicas y metabólicas, lo que le otorga un gran espectro.
Básicamente este síndrome es el resultado de una combinación de irregularidades en el ciclo menstrual como manifestación de la disfunción ovulatoria, presencia de hirsutismo, acné y/ hieprandrogenemia.
Igualmente las pacientes con SOP, presentan 2-3 veces el número normal de folículos antrales (2-5 mm), los cuales detienen su crecimiento y desarrollo cuando llegan a 4-7 mm y con un mayor número de células de la teca, esteroidogénicamente activas, que contribuyen a la producción de andrógenos ováricos (2).
En la actualidad, existe un marcador hormonal que cada día está siendo más estudiado e involucrado en cuanto a función ovárica se refiere, la hormona antimülleriana (HAM), y se ha reportado su variación en pacientes con SOP.
La HAM es un miembro de la superfamilia del factor de transformación de crecimiento-B (TGF). El gen de la HAM se encuentra en el cromosoma 19 y codifica una glicoproteína dimérica de 140 kDa (6). La AMH se sintetiza como una pro-hormona, que se somete a escisión en el sitio de acción para generar un fragmento C-terminal biológicamente activo que actúa en su propio receptor específico. Se pensó inicialmente que la HAM era producida únicamente por el feto masculino durante la diferenciación sexual para promover la regresión de los conductos de Müller. En la última década, sin embargo, un papel nuevo e interesante ha surgido para HAM en el ovario. La HAM bioactiva, se detectó por primera vez en células de la granulosa en la década de 1980 (7). Más tarde se informó que la HAM se produce a partir de la semana 36 de gestación en los humanos y es expresada hasta la menopausia, teniendo la más alta expresión en los pequeños folículos antrales, mientras que su producción disminuye gradualmente a medida que los folículos crecen (8,9); una vez que los folículos han alcanzado un tamaño en el que son dominantes, la HAM ha desaparecido en gran medida. Su disminución en estos folículos más grandes, parece ser un requisito importante para la selección del folículo dominante y la progresión de la ovulación; la HAM tiene un papel inhibitorio en el ovario, reduciendo tanto la iniciación folículo primordial y la sensibilidad del folículo a la FSH por la inhibición de la aromatasa (9). La HAM producida en mayor cantidad por las células de la granulosa de pacientes con SOP también está relacionada por su acción paracrina con el hiperandrogenismo ovárico y probablemente interfiera con la aromatización de andrógenos inducida por FSH, lo que contribuye a la detención del desarrollo folicular observado en estas pacientes. Es por esta razón que la HAM es un foco de interés en el SOP (10).
La HAM se ha demostrado que es de dos a tres veces mayor en el suero de mujeres con SOP que en mujeres con ovarios normales (11). Esto se cree que es debido al incremento en el número de pequeños folículos antrales. Sin embargo, en 2007, se demostró que la producción de HAM, fue en promedio 75 veces más alta en las células de la granulosa de pacientes anovulatorias con SOP. En un estudio adicional, la concentración sérica de HAM se correlacionó con la gravedad de los síntomas, ya que el grupo de pacientes con SOP ovulatorio parece tener concentraciones más bajas que las pacientes anovulatorias, aun siendo ambas hiperandrogénicas (9).
En las mujeres, HAM ha sido reportada como un marcador de envejecimiento y de reserva ovárica en los seres humanos (12).
En un grupo de pacientes con diagnóstico de SOP que acudan a la consulta de Endocrinología Ginecológica del Hospital Universitario de Caracas, en el período comprendido entre marzo y septiembre de 2013, se planteó determinar y analizar los niveles de HAM en dichas pacientes.
Para ello, se evaluó los niveles de HAM a todas las pacientes, y se evaluó las relación existente entre dicha hormona y factores como: la edad, el IMC, el fenotipo de SOP, presencia de hiperandrogenismo bioquímico, y con la presencia de ciclos ovulatorios y anovulatorios.
MÉTODOS
Se realizó un estudio prospectivo, descriptivo y transversal. Se obtuvo una muestra de 30 pacientes con diagnóstico de SOP confirmado a través de los criterios de Rotterdam con edades comprendidas entre los 18 y 40 años, vistas en la consulta de endocrinología ginecológica del Hospital Universitario de Caracas, dentro del período de estudio. Se excluyeron aquellas pacientes con hiperandrogenismo por otras causas, como hiperplasia suprarrenal congénita, tumores secretores de andrógenos y síndrome de Cushing; pacientes con uso de medicamentos hasta 60 días antes de ingresar al estudio, con potencial para afectar la función reproductiva o metabólica, tales como anticonceptivos orales, antiandrógenos, hipoglucemiantes orales, estatinas o terapia con glucocorticoides y mujeres embarazadas.
Las pacientes fueron incluidas en el estudio previo consentimiento informado por escrito y una vez aceptadas las condiciones del mismo. Se les registró en una ficha de recolección de datos diseñada para ello, que incluía datos de identificación, edad, antecedentes familiares, personales y gineco-obstétricos de importancia. Posteriormente se les realizó el examen físico completo, donde se incluían como parte de su evaluación tensión arterial, peso, talla, índice de masa corporal (IMC), circunferencia abdominal, evaluación de la escala de hirsutismo de Ferriman y Gallway, evaluación de presencia de acné, acantosis nigricans, alopecia y seborrea. Dicha evaluación fue realizada por el mismo observador y con el uso de los mismos instrumentos (tensiómetro, peso y cinta métrica). Se midió la circunferencia abdominal mediante cinta métrica flexible colocada en el punto medio de la línea entre el último arco costal y la cresta ilíaca, y en base a los valores obtenidos, se clasificaron a las pacientes según el criterio de Adult Treatment Panel III (ATP III) en: circunferencia abdominal normal (≤88 cm) y obesidad abdominal (>88 cm). Se determinó el IMC, mediante la fórmula peso/talla2. Según los valores obtenidos, y bajo las categorías de IMC según la Organización Mundial de la Salud (OMS) (13), se agruparon a las pacientes en 5 categorías: Bajo peso (<18,5 kg/m2), Normopeso (18,5 – 24,9 kg/ m2), Sobrepeso (25 – 29,9 kg/m2), Obesidad grado I (30 – 34,9 kg/m2), Obesidad grado II (35 – 39,9 kg/ m2) y Obesidad grado III (>40 kg/m2).
A cada paciente se les realizó la evaluación ultrasonográfica transvaginal (entre el día 1 a 3 del ciclo menstrual o en amenorrea) con el equipo ALOKA IPC-1530, empleando transductor transvaginal de 5 MHz, para determinación de la presencia o no de criterios ultrasonográficos de ovarios poliquísticos. Para ello, dicha evaluación fue realizada por el mismo observador. Este mismo día se les realizó la toma de muestras de sangre venosa, para lo cual las pacientes debían cumplir entre 10 a 12 horas de ayuno. Dichas muestras fueron enviadas el laboratorio del Ambulatorio Docente Asistencial del Hospital Universitario de Caracas, para su procesamiento. En dicho laboratorio fueron procesadas las muestras para determinación de: Hematología completa, curva de glicemia e insulina con carga de 75 g de glucosa (0, 60y 120), AST, ALT y perfil lipídico (colesterol total, HDL, LDL y triglicéridos). A partir de las muestras sanguíneas tomadas, se tomó parte de ellas y fueron trasladadas con cadena de frío hasta el laboratorio Dr. Félix Gómez del centro de investigaciones endocrinometabólicas, Facultad de Medicina, Universidad del Zulia; en el cual fueron procesadas dichas muestras para la determinación de: Testosterona libre, 17- OH progesterona, TSH, Prolactina y HAM. Estos laboratorios fueron realizados como protocolo de estudio diagnóstico para SOP.
Los niveles séricos de HAM se determinaron el método ELISA, con el kit inmunoenzimático de ensayo (ELISA), para la medición cuantitativa de HAM en suero y plasma con heparina de litio. El principio de la prueba (Inmunoensayo AMH GEN II ELISA) se basa en un inmunoensayo enzimático amplificado de dos sitios. El ensayo, calibradores, controles y muestras se incuban en pocillos de microtitulación que han sido recubiertos con anticuerpo anti - HAM. Después de la incubación y el lavado, el anticuerpo de detección anti- HAM marcado con biotina se añade a cada pocillo. Después de tres pasos de incubación, se determina el grado de recambio enzimático del sustrato por medición de la absorbancia de longitud de onda dual a 450nm y entre 600 y 630nm. La absorbancia medida es directamente proporcional a la concentración de HAM en las muestras. Un conjunto de calibradores HAM se utiliza para trazar una curva de calibración de la absorbancia frente a la concentración de HAM. Las concentraciones de HAM en las muestras se pueden calcular a partir de esta curva de calibración.
Para este trabajo, en vista que no existen hasta la fecha, en el país, datos que señalen valores específicos de HAM ni en pacientes sanas, ni pacientes con SOP, para la interpretación de los resultados se tomó como valor de referencia de HAM el nivel control arrojado por el kit de inmunoensayo, el cual fue 3,5 ng/dL.
Tratamiento estadístico: El análisis estadístico se fundamentó en las técnicas de estadística descriptiva y el análisis clásico de tablas de contingencia con apoyo en el paquete SPSS Statistics 19. Para evaluar las posibles relaciones entre variables de escala planteadas en este estudio, se calcularon los respectivos coeficientes de Pearson cuando se correlacionó variables de escala, y el coeficiente eta cuando se correlacionó una variable de escala con una variable nominal. Para su interpretación se tomaron como criterio orientador las0 indicaciones de Morales (14), que se indican a continuación:
Valor Relación
0 y .20.............................. Muy baja.
.20 y .40............................. Baja.
.40 y .60............................. Moderada.
.60 y .80............................. Apreciable, más bien alta.
.80 y 1................................ Alta o muy alta.
Dado que la muestra es no probabilística, se desconoce el grado de representatividad que tiene la misma y, en consecuencia, no se puede medir o controlar el error probable de muestreo sobre cualquier generalización acerca de la población, por lo que no es adecuado utilizar técnicas de estadística inferencial y las conclusiones de esta investigación se circunscriben a la muestra estudiada.
RESULTADOS
Caracterización de la muestra:
La muestra estuvo constituida por un total de 30 pacientes que reunieron los criterios de inclusión, las cuales tienen edades comprendidas entre los 18 y los 39 años, media (ẋ) = 27,73 años y mediana= 27 años. En cuanto a su distribución, 6 pacientes (20 %) entre los 18 y 24 años, 17 pacientes (56,5 7 %) entre los 25 y los 30 años, 5 pacientes (16, 7 %) entre los 31 y 36 años y 2 pacientes (6, 7 %) entre los 37 y 40 años. (Figura 1).
El peso corporal osciló entre 47 kg y 116,50 kg, con x=72,23 kg y mediana de 71, 15 kg. El índice de masa corporal (IMC) oscila entre 19 y 48 kg/m2, ẋ=27,70; s=5,88. La mediana se ubica en 26,10 kg/m2 y la moda en 24,6 kg/m2. En cuanto a su distribución, 12 pacientes (40,00 %) se encuentran dentro del rango normal, con IMC menor de 25 kg/m2, 9 pacientes (30,00 %) tienen sobrepeso con un IMC entre 25 y 29,9 kg/m2 y otras 9 pacientes (30,00 %) tienen algún grado de obesidad, con IMC igual o mayor a 30 kg/ m2 (Figura 2).
La circunferencia abdominal (CA) oscila entre 62 y 125 cm, ẋ = 91,70 cm; s=13,88, mediana = 90,50 cm. En cuanto a su distribución, 13 pacientes (43,33 %) tienen una CA inferior a 88 cm, mientras que la de 17 pacientes (56,6 7 %) supera este valor.
La acantosis nigricans se encuentra presente en 24 pacientes (80 %), el hiperandrogenismo clínico se encuentra presente en 22 pacientes (73,3 %) y el hiperandrogenismo bioquímico en 8 pacientes.
En cuanto a los valores HAM, se observa que los valores encontrados oscilan entre 1,90 ng/dL y 22,20 ng/dL, ẋ=10,22 ng/dL; s=4,40 ng/dL. Su distribución correspondió a 1 paciente (3,33 %) presentó valores inferiores a 3,5 ng/dL y las 29 pacientes restantes (96,6 7 %) superaron este valor (Figura 3).
Cuando correlacionamos valores de HAM y edad, encontramos que el valor promedio más alto de HAM fue 11,73 ng/dL, se encontró en el grupo de pacientes con edades comprendidas entre 18-24 años (6/30). Mientras que el valor promedio de HAM más bajo 9,70 ng/dL, se evidencia en el grupo de pacientes con edades comprendidas 24-30 años (17/30). Por su parte, pacientes con edades comprendidas entre 31-36 años (5/30) y edades 37 a 40 años (2/30), tuvieron valores promedios de HAM muy cercanos, de 10,22 ng/dL y 10,10 ng/dL respectivamente. (Cuadro 1).
Cuando se relaciona ambas variables, HAM y edad, con el coeficiente de Pearson, r = - 0,13, se evidencia una relación inversa directa, aunque muy baja.
Cuando relacionamos niveles de HAM y peso corporal, se evidencia que el valor promedio de HAM más alto, 15,4 ng/dL, se observa en aquellas pacientes con peso > 109 kg (2/30), mientras que el valor promedio más bajo de HAM, 7,9 ng/dL, se observa en pacientes con peso comprendido entre 47- 67 kg (11/30). Y al aplicar el coeficiente de Pearson entre ambas variables, r=0,17, se interpreta como una relación directa, aunque muy baja, entre las variables.
Por su parte, al correlacionar HAM e IMC, se observa que aquellas pacientes con IMC> 30 (9/30), tienen valor promedio de HAM más elevado, 11,38 ng/dL, y las pacientes con IMC < 25, (12/30), tienen valor promedio de HAM más bajos, 9,70 ng/dL, y al aplicar el coeficiente de Pearson, r= 0,03, se sugiere una relación directa muy baja entre dichas variables. (Cuadro 2).
Al enfocar los resultados relacionando los niveles de HAM y los diferentes fenotipos de SOP, encontramos que el fenotipo más frecuente observado fue el fenotipo A (19/30), y el menos frecuente el fenotipo D (5/30), y por último el fenotipo C (5/30), no encontrándose pacientes con fenotipo B. El nivel promedio más alto de HAM (11,47 ng/dL) se observa en pacientes con fenotipo A, mientras que el valor promedio más bajo (7,58 ng/dL) se observa en pacientes con fenotipo C. (Cuadro 3).
Al correlacionar niveles de HAM y regularidad de los ciclos, encontramos que aquellas pacientes con ciclos ovulatorios (6/30), tuvieron niveles promedio de HAM más bajos, 7,63 ng/dL, mientras que aquellas pacientes con ciclos anovulatorios, oligoamenorrea y/o amenorrea (24/30), tiene valor promedio de HAM más elevado 10,86 ng/dL. (Cuadro 4). Al aplicar el coeficiente eta cuando se considera HAM dependiente de la condición de amenorrea-oligoamenorrea es de r= 0,30 lo que sugiere una relación directa baja. Sin embargo, cuando se considera la condición de amenorrea-oligoamenorrea dependiente de HAM, el coeficiente alcanza el valor 0,95, lo que sugiere una relación directa muy alta entre las variables. Según estos resultados, se sugiere que los niveles de HAM parece que influyen en la normalidad o anormalidad de los ciclos.
Por último, al correlacionar niveles HAM con la presencia de hiperandrogenismo bioquímico, encontramos que al aplicar coeficiente de Pearson entre HAM y niveles de testosterona, el coeficiente es r=0,04, lo cual sugiere una relación directa entre las variables, aunque muy baja. Pero al correlacionar HAM y niveles de 17OHPG, el coeficiente de Pearson es r=- 0,03, lo cual sugiere una relación inversa directa muy baja entre las variables.
En el Cuadro 5, se resumen las diferentes relaciones de HAM con las distintas variables estudiadas.
DISCUSIÓN
El SOP es una condición ginecológica que afecta a las mujeres en edad reproductiva. Como ya se describió, los niveles de HAM están relacionados con el número de folículos antrales. Mujeres con SOP poseen un nivel de HAM sérica mayor, en comparación con pacientes normales (15). Esto se pensó en un principio estaba relacionado con el mayor número de folículos antrales y pre antrales (sitios productores de esta hormona) que se observan en estas pacientes. Sin embargo, en 2007, se demostró que la producción de HAM fue en promedio 75 veces mayor por células de la granulosa de las pacientes con SOP y anovulación, en relación con ovarios normales (16). Y que esta elevación no solo se debe al aumento del número de folículos, sino que también cada folículo aumenta el doble su propia producción de HAM (17).
En este trabajo pudimos demostrar que efectivamente, los niveles de HAM se encuentran elevados en pacientes con SOP, y aunque no contamos con estudios en el país que determinen valores de HAM de referencia, ni para pacientes sanas ni para pacientes con SOP, con este trabajo, tomando en cuenta el valor promedio arrojado por el kit de HAM como valor de referencia, observamos que el 96,6 7 % de las pacientes (29/30), tuvieron valores por encima de 3,5 ng/dL, mientras que solo el 3,30 % (1/30), tuvo un valor inferior. Estos resultados son similares a los datos encontrados en la literatura, como por ejemplo, el trabajo de Pellat y col. en el 2007 (16), en el cual realizando métodos de detección directa de HAM logran determinar que esta hormona se encuentra elevada en los pequeños folículos antrales y se vuelve indetectable cuando los folículos alcanzan un mayor tamaño, concluyendo que en el SOP al existir un mayor número de folículos pequeños, los niveles de HAM en estas pacientes son 2-3 veces mayor, en comparación con pacientes sanas.
Igualmente, estos resultados son similares a los resultados encontrados en el meta análisis realizado por Iliodromiti y col. en el 2013 (18), quienes concluyeron después de una extensa revisión bibliográfica, que valores de HAM por encima de 4,7 ng/dL, tienen una sensibilidad y especificidad alta (82,8 % y 79,4 % respectivamente) para realizar diagnóstico de SOP, sugiriendo que esta hormona pudiese ser incluida como criterio diagnóstico útil para esta patología.
Por lo cual, aunque todavía no contamos con un normograma de HAM para nuestras pacientes, podemos concluir con respecto a este tópico, que con este trabajo demostramos que en pacientes con SOP, los valores de HAM, en casi la totalidad de las pacientes, se encuentran con valores altos superiores a 3,5 ng/dL.
Al analizar los niveles de HAM respecto al grupo etario, en el trabajo evidenciamos que el nivel promedio más alto de esta hormona se observa en las pacientes más jóvenes, con edades comprendidas entre 18-24 años, donde los niveles de HAM alcanzaron un valor promedio elevado de 11,78 ng/dL, mientras que las pacientes con edades comprendidas de 24-30 años tuvieron un valor promedio de HAM, aunque más elevado respecto al valor de referencia (9,7 ng/ dL vs 3,5 ng/dL), pero más bajo respecto al grupo de edades anterior, y cuando correlacionamos las variables, encontramos que existe una relación inversa directa entre las variables; parece entonces que a medida que progresa la edad, los niveles de HAM disminuyen, aunque de manera no tan significativa en pacientes con SOP, a diferencia de las pacientes sanas. Estos datos son similares a los reportados por De Vet y col. en el 2002 (19), quienes demostraron que la HAM, a diferencia de otros marcadores de reserva ovárica, disminuye significativamente y de manera longitudinal a medida que avanza la edad. Van Roojj y col. en el 2004 (20) en su trabajo demostraron que la HAM obtuvo el valor predictivo más alto para predecir el paso desde la transición menopáusica a la menopausia, gracias a su disminución significativa a medida que avanza la edad.
Por lo que respecto a HAM y edad, en pacientes con diagnóstico de SOP concluimos que al parecer, aunque con una relación directa baja, parece disminuir a medida que avanza la edad, pero quizás de una manera no tan pronunciada como la observada en pacientes sanas.
Respecto a AMH y los diferentes fenotipos del SOP, logramos evidenciar que de los cuatro fenotipos principales del SOP, el más frecuente es el fenotipo A, lo cual es similar a la extensa literatura, que apoya que el fenotipo que reúne los tres criterios de Rotterdam, es el más frecuente. El segundo en frecuencia fue el fenotipo D, seguido del fenotipo C, no encontrando pacientes con fenotipo B. Cuando analizamos cada grupo, observamos que el valor promedio de HAM más alto se observa en las pacientes con fenotipo A, mientras que el fenotipo D y C exhiben valor promedio de HAM más bajo, respectivamente. Estos resultados son similares a los datos encontrados por Sahmay y col. en el 2013 (21), quienes concluyeron que aquel grupo de pacientes con el fenotipo A (oligo anovulación, hiperandrogenismo y ovarios poliquísticos), tienen valores de HAM tres veces más altos que pacientes con fenotipo D, por lo que establecen que los niveles de HAM son más altos en los casos en que existen los tres principales criterios de diagnóstico, y la presencia de valores elevados de HAM nos pueden hacer sospechar el tipo de fenotipo de SOP. Igualmente nuestros datos son similares a los resultados del trabajo de Homburg y col., en el 2013 (22), donde concluyen que existen diferencias significativas de los niveles de HAM entre los diferentes fenotipos, donde los valores más elevados se presentan en pacientes con fenotipo A, y los valores más bajos se observan en pacientes con fenotipo D.
Cuando relacionamos HAM y peso corporal e IMC, observamos en nuestros datos como ante la existencia de mayor peso corporal y mayor IMC, los niveles promedios de HAM son más altos respecto a las pacientes con menor peso e IMC. Y al aplicar el coeficiente de Pearson ( r= 0,03) hallamos que entre las tres variables (HAM, peso e IMC), la relación existente es muy baja, por lo cual podemos concluir que no encontramos relación significativa entre HAM e IMC, datos similares a los encontrados por Skalba y col. en el 2011 (23), quienes concluyeron que entre HAM e IMC no existe correlación significativa y que ambas variables se relacionan de forma independiente para el número de folículos antrales.
Relacionando HAM y la presencia de ciclos ovulatorios y anovulatorios, al analizar los datos, evidenciamos que solo 6 pacientes (6/30), presentaban ciclos ovulatorios, y que en ellas, el nivel promedio de HAM era inferior (7,63 ng/dL) respecto al resto de las pacientes (24/30), que presentaban ciclos anovulatorios, y que tenían valor promedio de HAM mucho mayor (10,86 ng/dL). Al aplicar el coeficiente Eta (r=0,95), se establece que existe una relación directa muy alta entre las variables, donde los niveles de HAM parecen determinar la regularidad del ciclo: la presencia de valores elevados de HAM condicionan la presencia de ciclos anovulatorios. Estos datos se relaciona a los encontrados por Homburg y col. en el 2013 (22), quienes concluyen que existen diferencias significativas de HAM en pacientes con ciclos anovulatorios, y que la hormona se relaciona de manera positiva con el número de folículos pequeños, como es el caso de SOP.
Así concluimos que las concentraciones de HAM en suero son capaces de diferenciar entre los ovarios normales, SOP y morfología ovárica ecográfica de ovario poliquístico.
La correlación de HAM con la presencia de hiperandrogenismo bioquímico, evidenciamos que el coeficiente de Pearson entre HAM y testosterona (r= 0,04), refleja una relación directa muy baja entre las variables, pero cuando analizamos el coeficiente de Pearson entre HAM y 17OHPG (r= -0,03), se refleja una relación inversa muy baja. Es decir, entre todas las variables, la relación bien sea inversa o directa, es muy baja, lo cual no es de importancia significativa. Podemos concluir que no encontramos relación entre estas variables, las cuales se comportan de manera independiente y que por tanto la presencia de HAM no condiciona la severidad del hiperandrogenismo. Estos datos son similares a los encontrados por Rosenfield y col., quienes en 2012 (24) concluyen que la HAM está independientemente relacionada con la función androgénica del ovario y de ovarios poliquísticos.
En la actualidad la HAM es un marcador certero de la función y de la reserva ovárica, posiblemente más fidedigno que los otros marcadores utilizados tradicionalmente (25). Se encuentra elevada en pacientes con SOP en mayor proporción en comparación con mujeres normales (26), pero aun la evidencia es insuficiente para su uso de forma sistemática en el diagnóstico de SOP.
CONCLUSIONES
En los últimos 15 años la HAM, ha sido investigada de manera importante, hecho reflejado en la riqueza del material bibliográfico disponible hasta el momento, donde la HAM se ha convertido en tópico obligado en muchas patologías ginecológicas, poniendo al descubierto algunas de sus tantas aplicaciones.
Nuestros datos nos hacen concluir que la HAM, se encuentra elevada de manera significativa en aquellas pacientes con SOP, sin embargo, es necesario realizar otros estudios para determinar en nuestra población si realmente la HAM tiene una sensibilidad y especificidad con alto valor predictivo como para incluirla como criterio definitivo en el diagnóstico del SOP.
La determinación de la AMH se continuará estudiando en el marco de toda patología o situación orgánica que comprometa la función del ovario.
Consideramos este trabajo, un estudio piloto de las variaciones de la AMH en un grupo de mujeres venezolanas para incentivar a realizar futuras investigaciones de este marcador que cada día cobra más importancia en cuanto a patología ovárica se refiere.
REFERENCIAS
1. Norman RJ, Dewailly D, Legro RS, Hickey TE. Polycystic ovary syndrome. Lancet. 2007;370:685- 697. [ Links ]
2. Bajares M, Pizzi R, Velásquez E. Consenso Venezolano de Síndrome de ovario poliquístico. 2007. [ Links ]
3. The Rotterdam ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group. Fertil Steril. 2004;81(1):19-25. [ Links ]
4. Franks S. Polycystic ovary syndrome: A changing perspective. Clin Endocrinol. 1989;31:87-120. [ Links ]
5. Moran A, Checa V, Espinós J, Matorras R. Síndrome de ovario poliquístico. Madrid: Editorial Panamericana; 2005:1-184. [ Links ]
6. Carlsen SM, Vanky E, Fleming R. Antimüllerian hormone concentrations in androgen-suppressed women with polycystic ovary syndrome. Human Reproduction. 2009;24:1732-1738. [ Links ]
7. Donahoe PK, Ito Y, Marfatia E, Hendren WH 3rd. The production of Mullerian inhibiting substance by fetal, neonatal and adult rat. Biol Reprod 1976;15:329-334. [ Links ]
8. Silva V. Infertility and Polycystic Ovary Syndrome. Rev Med Clin Condes. 2010;21(3): 387-396. [ Links ]
9. Pellatt L, Rice S, Mason H. Antimullerian hormone and polycystic ovary syndrome: A mountain too high? University of London. Reproduction. 2010;139:825- 833. [ Links ]
10. Vigier B, Picard JY, Tran D, Legeai L, Josso N. Production of antimullerian hormone: Another homology between Sertoli and granulose cells. 1984;144:1315-1320. [ Links ]
11. Fallat ME, Cook C, Siow Y, Carrillo A, Marra M. Mullerian-inhibiting substance in follicular fluid and serum: A comparison of patients with tubal factor infertility, polycystic ovary syndrome, and endometriosis. Fertil Steril. 1997;67: 962-965. [ Links ]
12. Carlsson IB, Scott JE, Visser JA, Ritvos O, Themmen A, Hovatta. Antimullerian hormone inhibits initiation of growth of human primordial ovarian follicles in vitro. Human Reproduction. 2006;21:2223-2227. [ Links ]
13. WHO. Obesity: Prevention and managing the global epidemic. Report of a WHO Consultation. WHO Technical Report Series 894. Geneva: World Health Organization. 2000. [ Links ]
14. Morales P. Estadística aplicada a las Ciencias Sociales. Universidad Pontificia, Madrid. 2008. [ Links ]
15. Catteau-Jonard S, Jamin SP, Leclerc A, Gonzales J, Dewailly D, Di Clemente N. Antimullerian hormone, its receptor, FSH receptor and androgen receptor genes are overexpressed by granulosa cells from stimulated follicles in women with polycystic ovary syndrome. J Clin Endocrinol Metabol. 2008;93:4456-4461. [ Links ]
16. Pellatt L, Hanna L, Brincat M, Galea R, Brain H, Whitehead S. Granulosa cell production of antimullerian hormone is increased in polycystic ovaries. J Clin Endocrinol Metabol. 2007;92:240- 245. [ Links ]
17. Das M, Gillott DJ, Saridogan E, Djahanbakhch O. Anti-mullerian hormone is increased in follicular fluid from unstimulated ovaries in women with polycystic ovary sundrome. Human Reproduction. 2008:2122- 2126. [ Links ]
18. Iliodromiti S, Kelsey T, Anderson R, Nelson S. Can anti-mullerian hormone predict the diagnosis of polycystic ovary syndrome? J Clin Endocrinol Metab. 2013;98(8):3332-40. [ Links ]
19. De Vet A, Laven JS, De Jong FH, Themmen AP, Fauser BC. Anti-mullerian hormone serum levels: A putative marker for ovarian aging. Fertil Steril. 2002;77:357-362. [ Links ]
20. Van Roojj IAJ, Broekmans FJM, te Velde ER, Fauser BC, Bancsi LF, de Jong FH, et al. Serum anti-Mullerian hormone levels: A novel measure of ovarian reserve. Hum Reprod. 2002;17:3065-3071. [ Links ]
21. Sahmay S, Atakul N, Oncul M, Tuten A, Aydogan B, Seyisoglu H. Serum anti-mullerian hormone levels in the main phenotypes of polycystic ovary syndrome. Eur J Obstet Gynecol Reprod Biol. 2013;170(1):157- 161. [ Links ]
22. Homburg R, Ray A, Bhide P, Gudi A, Shah A, Ttimms P, et al. The relationship of serum anti-mullerian hormone with polycystic ovarian morphology and polycystic ovary syndrome: A prospective cohort study. Human Reprod Hum. 2013;28(4):1077-1083. [ Links ]
23. Skalba P, Cygal A, Madei P, Dabkowska H, Sikoraj J, Martirosian G. Is the plasma anti-mullerian hormone (AMH) level associated with body weight and metabolic, and hormonal disturbances in women with and without polycystic ovary syndrome? Eur J Obstet Gynecol Reprod Bio. 2011;158(2):254-259. [ Links ]
24. Rosenfield R, Wroblewski K, Padmanabhan V, Littlejohn E, Mortensen M, Ehrmann D. Antimullerian hormone levels are independently related to ovarian hyperandrogenism and polycystic ovaries. Fertil Steril. 2012;98(1):242-249. [ Links ]
25. Eldar-Geva T, Margalioth EJ, Gai M, Ben-Chetrit A, Algur N, Zylber-Haran E, et al. Serum antimullerian hormone levels during controlled ovarian hyperstimulation in women in polycystic ovaries with and without hyperandrogenism. Human Reproduction. 2005;20:1814-1819. [ Links ]
26. Filertsen T, Vanky E, Carlsen S. Anti-mullerian hormone in the diagnosis of polycystic ovary syndrome: Can morphologic description be replaced? Hum Reprod. 2012;27(8):2494-502. [ Links ]
La menstruación en las niñas y adolescentes: utilizando el ciclo menstrual como un signo vital
RESUMEN: A pesar de las variaciones en todo el mundo y dentro de la población de Estados Unidos, la edad media de la menarquia se ha mantenido relativamente estable entre 12 años y 13 años a través de poblaciones bien alimentadas en los países desarrollados. Los factores ambientales, incluidas las condiciones socioeconómicas, la nutrición y el acceso a la atención sanitaria preventiva, pueden influir en el momento y la progresión de la pubertad. Una serie de condiciones médicas pueden causar sangrado uterino anormal, caracterizado por tiempo impredecible y cantidad variable de flujo. Los médicos deben educar a las niñas y sus cuidadores (por ejemplo, los padres o tutores) sobre lo que puede esperar de un primer período menstrual y el rango de la longitud del ciclo normal de menstruación posteriores. La identificación de patrones menstruales anormales en la adolescencia puede mejorar la identificación temprana de los problemas de salud potenciales para la edad adulta. Es importante que los médicos comprendan los patrones menstruales de las adolescentes, la capacidad de diferenciar entre la menstruación normal y anormal, y la habilidad para saber cómo evaluar a la paciente adolescente. Al incluir una evaluación del ciclo menstrual como un signo vital adicional, los médicos refuerzan su importancia en la evaluación de estado de salud general de las pacientes y cuidadores.
Traducido por Rogelio Pérez DGregorio de: American College of Obstetricians and Gyneologysts. Committee Opinion Número 651, Diciembre 2015. Disponible en: http://www.acog.org/Resources-And-Publications/Committee-Opinions/Committee-on-Adolescent-Health-Care/Menstruation-in-Girls-and-Adolescents-Using-the-Menstrual-Cycle-asa-Vital-Sign