Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Obstetricia y Ginecología de Venezuela
versión impresa ISSN 0048-7732
Rev Obstet Ginecol Venez vol.76 supl.1 Caracas jun. 2016
XXXI Congreso Nacional de Obstetricia y Ginecología
A continuación se reproduce el discurso de orden pronunciado por el Dr. William Sánchez, Presidente de la Sociedad de Obstetricia y Ginecología de Venezuela, 2015-2017, en la Ceremonia Inaugural del XXXI Congreso Nacional de Obstetricia y Ginecología, celebrado en la ciudad de Valencia, Estado Carabobo, del 30 de junio al 3 de julio de 2015

DISCURSO DE ORDEN
Dr. Williams Sánchez
Hoy nos encontramos nuevamente reunidos por 4ta vez, para celebrar el XXXI Congreso Nacional de Obstetricia y Ginecología, en esta bella ciudad de Valencia, capital de un estado central, Carabobo, que por su ubicación y acceso es privilegiado dentro de nuestra geografía, para la realización de eventos de esta importancia; casualmente este año celebramos los 75 años de fundada de nuestra Sociedad, lo que es un motivo especial que se une a este congreso.
La historia de la Sociedad de Obstetricia y Ginecología de Venezuela (SOGV) en sus inicios va paralela a la de la Maternidad Concepción Palacios (MCP), así en su seno, el 24 de febrero de 1940, reunidos en una pequeña sala de conferencias de la Maternidad un grupo de médicos deciden fundar la SOGV, uniéndose al grupo de sociedades que ya existían para el momento como lo eran: la Sociedad de Sifilografía y Leprología (1936), la de Tisiología (1937), la de Puericultura y Pediatría (1939) y las que comparten año de fundación con la nuestra, una que agrupaba a tres especialidades Otorrinolaringología, Oftalmología y Neurología, y la de Urología que se fundó después de 3 de junio de 1940.
Es, el 2 de marzo de 1940 cuando firman el acta constitutiva y se registra formalmente. Quedando la junta Administradora, integrada por: los Dres. Leopoldo Aguerrevere, Presidente; Gutiérrez Alfaro, Vicepresidente; Alfredo Borjas, Secretario; Antonio Castillo, Tesorero; José María Aurrecoechea, Bibliotecario; Félix Lairet, hijo Primer Suplente y Odoardo León Ponte como Segundo Suplente.
Entre los 26 firmantes del Acta Constitutiva habían trece parteros-ginecólogos, de ellos, solo 5 se dedicaban exclusivamente a la Especialidad: Leopoldo Aguerrevere, Pedro Antonio Gutiérrez Alfaro, Carlos Nouel, José María Aurrecoechea y Felipe González. Dentro de los trece cirujanos presentes encontramos a 4 que fueron insignes figuras en su especialidad: Salvador Córdova, Antonio José Castillo, Fermín Díaz y Alfredo Borjas; y formaban parte del personal de la Maternidad para ese momento 14 de los veintiséis miembros, lo que traería como consecuencia lazos indisolubles entre ambas entidades.
Hasta la fecha la Sociedad ha tenido 49 presidentes y 54 juntas directivas, durante el lapso 1940 a 1971 ejercieron sus funciones durante 1 año y a partir de ese momento los períodos comenzaron con una duración de dos años. Solo tres presidentes fueron reelectos: Leopoldo Aguerrevere 1940 y 1949, Otto Rodríguez Armas en 1978-1980 y 1980-1982 y Ofelia Uzcátegui en 1984-1986 y 1986- 1988, y cuatro que por diferentes motivos prolongaron su período por 1 año, los Dres. José María Aurrecoechea, Luzardo Canache, Leonor Zapata y Alfonso Arias.
Durante los 75 años han ejercido la presidencia de la Sociedad solo 5 mujeres, siendo la primera la Dra. Livia Escalona en el año 1970, luego la sucedieron las Dras: Ofelia Uzcátegui en 2 períodos 1984-1988, Judith Toro Merlo 1996-1998, Leonor Zapata 2001-2004, y Fanny Fleitas () 2006-2008. Cabe destacar que una de estas expresidentas la Dra. Judith Toro Merlo, hoy nos honra siendo la presidenta Honoraria de este XXXI Congreso Nacional, felicitaciones, honor que tiene bien merecido.
En el año de 1954, la Junta Directiva (JD) de la sede Nacional comenzó a realizar viajes a algunas ciudades de nuestro país para iniciar los contactos con aquellos especialistas que ejercían la obstetricia y ginecología, programándose así las seccionales en aquellas regiones en donde hubiese más de 3 miembros activos ya inscritos en la Sociedad.
El trece de febrero de 1954, en el colegio de médicos del estado Carabobo en la ciudad de Valencia, se reunió un distinguido grupo de médicos de la JD Nacional, encabezados por su presidente el Dr. Julio calcaño, y designaron el comité directivo de lo que sería la futura primera Seccional de la SOGV y queda constituido por los Dres. Arcay Sola, Guerra Méndez, Escobar Sanda y Juan Ramos Dáger, además se nombró como Miembro Honorario Nacional (1ro de la SOGV), por sus méritos y trayectoria al Dr. Luis Ravelo Pérez. Es el 1ro de mayo del mismo año cuando se lleva a cabo la instalación de la Primera Seccional de la SOGV, siendo la primera filial de la Sociedad en el interior de la república, estando presentes por la SOGV los Dres. Julio Calcaño presidente, Leopoldo Aguerrevere vicepresidente y J. R. Pitaluga secretario, además del presidente del colegio de médicos de Carabobo, Dr. Armando Arcay Solá y el gobernador entre otros. Su primera junta quedo conformada por los Dres.: Fernando Guerra Méndez, presidente; Juan Ramos Dáger, vicepresidente; J. Facchin de Boni, secretario- tesorero y Antonio Escobar y Armando Arcay Sola como vocales, comenzando así de esta forma la excelente trayectoria de esta seccional.
El número de miembros registrados en la SOGV hasta febrero de 2015 son: Afiliados 1 534, Titulares 608, Asociados 53, Agregados 3, Honorarios 32 y Meritorios 1, para un total de 2231, cantidad que esperamos continuar aumentando con la labor que se está realizando con la colaboración de las seccionales y a través del censo que inicio la Sociedad durante la gestión de Rodrigo Alfonso Arias, en el año 2012, para poder tener una base de datos actualizada que nos permita conocer la realidad de los miembros de la SOGV y de los Gineco-obstetras que existen en todo el país, haciendo inscripciones en los eventos de la Sociedad,y a través de la página web en forma interactiva, es propicio el momento para invitar a aquellos obstetra ginecólogos a que lo hagan durante este congreso en el estand de la Sociedad , actualmente contamos con 2423 censados.
La Sociedad es una asociación civil sin fines de lucro, de carácter científico, académico, cultural y social, cuya misión siempre ha sido desde su creación, trabajar en todo lo referente a la salud de la mujer en las diferentes etapas de su vida, siendo su principal objetivo el estudio, difusión y perfeccionamiento de la Obstetricia y Ginecología, así como lo relacionado a prevención, diagnóstico y tratamiento de las enfermedades que afectan a las mujeres, a fin de preservar su salud, el embarazo y la reproducción humana, para obtener los mejores resultados posibles en lo que conforma ese importante binomio madre-feto.
La SOGV está integrada por médicos especialistas en las diferentes disciplinas que abarca esta especialidad, todos unidos con el fin de lograr el mejoramiento de la profesión en la práctica diaria de la atención de la mujer venezolana.
Para alcanzar estos objetivos la Sociedad procura mejorar la formación integral de los especialistas en áreas como: medicina maternofetal, reproducción humana, salud sexual y reproductiva, oncología ginecológica, uroginecología, menopausia y todas aquellas que se relacionen con la salud femenina. Promueve la investigación científica, apoyando su ejecución y publicando sus resultados en su prestigiosa revista, llevando esta información a todos los médicos del país y a aquellas instituciones que lo requieran. Además promueve y organiza congresos, jornadas, talleres y cursos a nivel nacional, dictados por especialistas nacionales e internacionales calificados, a fin de llevar la información más actualizada a todos nuestros agremiados.
Dentro de las prioridades de la Sociedad, también está el prestar asesoría a entidades particulares y oficiales, colaborando en programas de salud, en la elaboración de pautas y protocolos de conductas en la atención de las diferentes situaciones médicas que se presentan en la especialidad, de igual forma trabaja en equipo con otras sociedades médicas en la elaboración de consensos que se adapten y apliquen a la realidad nacional y que permitan una mejor orientación y guía a los diferentes médicos generales y especialistas. Con mucha satisfacción podemos expresar que hasta ahora lo hemos logrado con éxito, y un gran esfuerzo, y continuaremos siendo a su vez garantes del buen ejercicio en la especialidad, enalteciendo el sentir humano y social con un alto nivel de ética.
Para complementar esta labor la Sociedad cuenta con un grupo de Seccionales distribuidas en todo el país y que son entidades regionales que la representan en áreas geográficas determinadas, integradas de acuerdo a su ubicación por varios estados y en algunos casos de forma individual; tienen los mismos objetivos que el estatuto señala para la Sociedad y están conformadas por un Presidente, un Secretario, un Tesorero y 2 suplentes, con sus atribuciones bien establecidas. Actualmente tenemos 9 seccionales a lo largo de todo el país.
La Sociedad tiene además, las denominadas Secciones, que agrupan a aquellos especialistas que se dediquen con más énfasis a áreas específicas dentro de la especialidad. Pueden organizar actividades científicas de su área, son de vital importancia y forman un pilar fundamental en la elaboración de los programas de congresos y jornadas, sugiriendo temas y expositores para los eventos de la Sociedad. Con el trascurso de los años y debido al incremento y aparición de nuevas subespecialidades, se han ido incorporando nuevas Secciones y actualmente contamos con 18 secciones.
Cada 5 años en el marco del Congreso Nacional se entrega el premio al Maestro de la Obstetricia y Ginecología Venezolana, galardón que se otorga a los especialistas que por su trayectoria y participación en las diferentes actividades de la Sociedad, lo merezcan. Este año lo reciben los Dres. Humberto Acosta Garnier, Wiktor Szczedrin y Freddy Guevara Zuloaga por la Sede Nacional y los Dres. Rodrigo Alfonso Arias, Pedro Faneite Antique y Germán Chacón por las Seccionales del interior; vale la pena mencionar que dos representan a la Seccional del Centro y el tercero a la del Táchira, felicitaciones a todos los galardonados.
La sociedad, con motivo de la celebración de los 75 años fue recientemente recibida a través de sus directivos en la Academia Nacional de Medicina, el 18 de junio pasado, en un acto organizado para conmemorar tan importante fecha, se llevó a cabo con la participación de 3 de los miembros de la JD, el presidente, el vicepresidente y el tesorero, así como el presidente encargado para ese momento el Dr. Alfredo Díaz Bruzual, Miembro Honorario de nuestra Sociedad, con 4 exposiciones ante los académicos individuos de número, correspondientes e invitados de cortesía y miembros de la sociedad que asistieron así como otros invitados, tocando temas de interés en nuestra especialidad
Quiero felicitar a las Dras. Ofelia Uzcátegui, Livia Escalona y Tamara Tamochin por el reciente homenaje recibido por parte de la junta directiva de la Seccional Aragua, Guárico, Apure, debido a su gran trayectoria y labor realizada a lo largo de sus años en la especialidad. De igual forma, para nuestra Sociedad es un honor contar con 2 nuevos individuos de número, uno incorporado recientemente a la Academia Nacional de Medicina, este año la Dra. Ofelia Uzcátegui quien tiene la particularidad de ser la 5ta mujer de número (Sillón 32) en la Academia y la primera obstetra ginecóloga en lograrlo y el otro próximo a incorporarse en el mes de julio del presenta año, el Dr. Pedro Faneite Antique (Sillón 20)
Pese a los múltiples inconvenientes relacionados con incrementos de costos y dificultad para traer invitados internacionales, contamos con un excelente grupo de médicos Venezolanos cuyo aporte, nos enorgullece y nos indica el grado de preparación de nuestros especialistas, y además tendremos la presencia de 4 distinguidos invitados internacionales de Colombia, el Salvador y Perú, a quienes le damos la más cordial y cálida bienvenida a nuestro país.
Hemos preparado 5 cursos pre congreso: endoscopia y piso pélvico, infanto juvenil y anticoncepción, Ian Donald School y materno fetal, enfermería y el ALSO (Soporte vital avanzado para la vida en obstetricia); diez simposios: rotura prematura de membranas, parto pretérmino, trastornos hipertensivos del embarazo, restricción del crecimiento intrauterino y otros temas que son controversia en la especialidad y causas importantes de morbimortalidad perinatal de nuestras pacientes, y en el ámbito ginecológico temas de oncología ginecológica, mastología, infertilidad, endocrinología y menopausia, la tradicional clínica de endometriosis, un taller de salud sexual y reproductiva de suma relevancia e importancia para la prevención de problemas obstétricos que incrementan la mortalidad en nuestras pacientes y la presentación y bautizo del consenso de Diabetes Gestacional, hecho en conjunto con las Sociedades de Medicina Interna, Endocrinología y Nutrición.
No podemos dejar de mencionar que nuevamente un grupo destacado de nuestros especialistas nos deleitará con su participación en la noche cultural el día miércoles, esperamos contar con su presencia
Quiero, en nombre del equipo que conforma la Junta Directiva, agradecerles por su asistencia y participación, ya que ustedes son los principales protagonistas para que podamos llevar a cabo este XXXI Congreso nacion
^rND^1A01^nWilliams^sSánchez^rND^1A01^nWilliams^sSánchez^rND^1A01^nWilliams^sSánchezXXVIII Jornada Nacional de Obstetricia y Ginecología Centenario Dr. Oscar Agüero

A continuación se reproduce el discurso de orden pronunciado por el Dr. William Sánchez, Presidente de la Sociedad de Obstetricia y Ginecología de Venezuela, 2015-2017, en la Ceremonia Inaugural de la XXVIII Jornada Nacional de Obstetricia y Ginecología, celebrada en la ciudad de Caracas, del 3 al 4 de junio de 2016
DISCURSO DE ORDEN
Dr. Williams Sánchez
Después de 49 años estamos realizando en la ciudad de Caracas una Jornada Nacional, la segunda en esta capital, pues la primera se realizó en enero de 1967, casualmente en este mismo local, siendo el Dr. Alfredo Borjas su presidente honorario y quien presidió la Sociedad durante el año 1945. Asimismo, es de hacer notar que la última Jornada Nacional se realizó en San Cristóbal en el 2013 y fue su presidenta honoraria la Dra. Marga Torrealba.
En esta oportunidad, la SOGV, dedica este evento a la memoria del Dr. Oscar Agüero, padre de la Obstetricia Moderna en Venezuela, pues el 12 de agosto de este año, se cumple el primer centenario de su natalicio.
Hemos realizado grandes esfuerzos para honrar nuestro compromiso con los Gineco obstetras Venezolanos para mantenerlos informados sobre los avances de la especialidad, y ello básicamente debido a la situación que vivimos en el país, por la crisis de salud evidenciada por el mal funcionamiento y descuido de toda nuestra red de atención médica a todos sus niveles, y a la carencia de insumos y dotación de equipos para los establecimientos de salud, la falla de medicamentos esenciales para la principales afecciones de nuestros pacientes en cada una de las diferentes especialidades médicas. La crisis, inclusive ha tocado los centros de medicina privada, que de alguna manera ayudan a solventar los problemas de carencia y atención en salud que en estos momentos afectan a todos los venezolanos.
No se justifica, que en un país que cuenta con una de las mayores riquezas del mundo, por el manejo inadecuado de nuestros recursos nos encontremos en tal situación. Vemos con angustia cómo esto se refleja en el incremento cada vez mayor de la tasa de mortalidad materna en Venezuela, la cual de manera extraoficial ya está por encima de 80 muertes maternas (MM) por cada 100.000 nacidos vivos registrados (NVR), además de los altos índices de mortalidad infantil y neonatal que se observan en todos nuestros centros hospitalarios. De igual manera vemos como colegas de otras especialidades están pasando las mismas penurias que nosotros con los pacientes, hipertensos, diabéticos, oncológicos, cardiovasculares y afectados por enfermedades del sistema nervioso central, entre otros.
Pensamos, que es el momento de que los médicos como la fuerza importante que somos en el país, levantemos
la voz de protesta como recientemente lo han hecho los médicos del estado Mérida, con la reciente huelga de hambre que iniciaron los residentes de diferentes posgrados por las condiciones infrahumanas como atienden a los pacientes, por no contar con los recursos necesarios para poder evitar la muerte de estos, y que además contaron con el apoyo de los especialistas, no es justo que tengamos que recurrir a estas medidas extremas para poder obtener lo que por ley y de acuerdo a la Constitución de la República le corresponde al Estado, como es el velar por la salud de todos los venezolanos a través de un sistema nacional de salud adecuado.
Nuestra especialidad no escapa de estas fallas, cuando tenemos pacientes muriéndose por falta de medicamentos para controlar las hemorragias posparto, los trastornos hipertensivos del embarazo y la sepsis, todas ellas causas de muerte materna de nuestro país.
Varias sociedades han denunciado esta situación y a través de la Red de Sociedades Científicas Médicas Venezolanas, que agrupa a 42 sociedades científicas de este país, ya desde hace 3 años se viene haciendo un trabajo importante denunciando todas estas fallas ante los medios de comunicación, la Comisión de Salud de la Asamblea Nacional, y el público en general, a nivel nacional, advirtiendo la problemática que se está presentando referente a la salud, no solo con respecto a la atención médica, a la situación de los hospitales y el resurgimiento y aumento de enfermedades como la malaria, y la tuberculosis por mencionar solo dos, sino aportando soluciones y la asesoría para salir de esta crisis. Me consta, porque formo parte del comité ejecutivo de la red, y bajo la actual presidencia del Dr. Jesús Pereira y la de los que precedieron, se está trabajando activamente en este problema.
No puedo dejar de mencionar el papel que ha asumido la Academia Nacional de Medicina, en la defensa de nuestros médicos y de la salud en Venezuela, a su aporte hecho en comunicados y documentos a la opinión pública, expresando su preocupación por el problema y prestando la asesoría y el apoyo necesario los integrantes de la Comisión de Salud de nuestra asamblea nacional, como le corresponde por la autoridad que representa.
Aquí estamos como Sociedad cumpliendo con uno de nuestros principales objetivos como es, la educación y la actualización de nuestros miembros, a pesar de las condiciones actuales y que gracias a Dios aun contamos con la ayuda y colaboración de algunas casas comerciales y los pocos laboratorios que aún quedan. Esta labor ha sido realizada por todas las juntas directivas de esta sociedad y sabemos que los que nos sucederán lo continuarán haciendo.
Regresamos de nuevo a la Capital para que durante estos dos días, de jornada contemos con su apoyo y asistencia a todos los diferentes simposios con temas actualizados y de interés para ustedes en obstetricia y ginecología. Presentaremos la actualización del consenso de ovario poliquístico 2016 realizado por un excelente grupo de especialistas dirigidos las Dras. Mariela Bajares de Lilue, Rita Pizzi y Elsy Velásquez, felicitaciones a todas y a todo su equipo, por este nuevo aporte para nuestros especialistas, residentes de posgrado y estudiantes; de igual forma será presentado el manual de endometriosis para pacientes, hecho por un equipo de especialistas de nuestra sociedad dirigidos por los doctores Esmely Salazar y Otto Rodríguez Armas, igualmente mis felicitaciones para ellos.
Agradecemos a los 63 invitados nacionales, miembros de nuestra Sociedad, a los invitados de otras especialidades, por su colaboración en las diferentes ponencias y a la invitada que nos acompaña del exterior la Dra. María Fernanda Escobar de Colombia quien es una de las mejores especialistas en el área de cuidados críticos en obstetricia, lamentablemente no pudimos contar con la presencia del Dr. Carlos Fuchtner, de Bolivia, recién electo presidente de FIGO para el período que comienza en 2018, que por problemas con los vuelos en su país no pudo estar acompañándonos y quien nos expreso vía telefónica su lamento por no poder estar con nosotros. Dra. María Fernanda, le damos un caluroso recibimiento a nuestro país y agradecemos su presencia sabiendo de la situación actual que estamos viviendo en nuestro país; además quiero felicitarla y darle la bienvenida a nuestra Sociedad como Miembro Honoraria, distinción que también fue concedida al Dr. Carlos Fucthner. En la Jornada serán juramentados 24 nuevos miembros titulares (5 por presentación de trabajo y 19 por examen) y 12 nuevos miembros afiliados.
No quiero terminar estas palabras sin referirme al Dr. Oscar Agüero, a pesar de que el Dr. Otto Rodríguez Armas hablará de él posteriormente. Tuve la oportunidad de conocerlo durante su ejercicio de la medicina privada, en el Centro Médico de Caracas, siendo residente de posgrado y luego de culminado este y una que vez ingresé a esa institución, trabajé ayudándolo durante años, hasta su retiro del ejercicio privado; era un hombre que imponía respeto con su sola presencia; de elegante vestir y de una pulcritud extrema, que se mantenía reflejada en forma impecable en su uniforme de partero después de realizar cualquier intervención obstétrica. De hablar, pausado y bajo de tono lo que a veces dificultaba entenderlo, pero preciso y directo en sus comentarios, meticuloso y siempre pendiente del trabajo de los obstetras de la institución, velaba por el cumplimiento de las normas en el Departamento y del cuidadoso llenado de los libros de sala de partos, donde describimos los procedimientos realizados y que de vez en cuando él completaba cuando omitíamos algún detalle. Persona de gusto refinado en el comer y conocedor de los buenos vinos.
Dispuesto a enseñar y trasmitir su experiencia y aquellos tips que cuando se complicaba algún caso, nos ayudaban a resolver el problema. Siempre pendiente y atento con sus pacientes, que lo querían y respetaban aunque decían que no era de mucho hablar y, como dato curioso, casi siempre llegaba primero que ellas a la clínica cuando lo llamaban por estar en trabajo de parto, sin importar la hora que fuera. Nunca dudó de su trabajo y aunque no lo crean, a veces aceptaba alguna sugerencia durante una intervención. Investigador nato, con una memoria prodigiosa e increíble, realizó múltiples trabajos en el Centro Médico obteniendo los datos que reflejaban los libros de sala de parto de su trabajo y de los miembros del departamento. Muy sereno y tranquilo durante la atención de sus pacientes, con una gran seguridad en lo que hacía, y un maestro en la aplicación de los fórceps.
Como ya lo dije antes, estaba siempre dispuesto a enseñar y pendiente de que lo hicieras bien; algo que no olvidaré, es la vez que tuve que hacer mi primera cesárea y le pregunté si podría ayudarme, no dudó en hacerlo, por supuesto me sentí evaluado durante toda la intervención pero pasé la prueba, y por casualidad el anestesiólogo fue el Dr. Roberto Luca, Jefe para ese momento del departamento de anestesia, y uno de los pioneros de la anestesia obstétrica en el país, dicha para mí el tener dos eminentes médicos de la institución en esa, mi primera intervención en la clínica, así podría contarles muchas anécdotas con el Maestro.
Quiero agradecer la presencia de dos de sus tres hijas que el día de hoy nos acompañan en esta jornada que conmemora el natalicio de su padre: Corina, Mariela y Frances a las cuales aprecio.Concluyo dando las gracias a ustedes por acompañarnos en esta XXVIII Jornada Nacional, a todo mi equipo de la JD, al comité científico por su trabajo y aporte, al Consejo Consultivo por su apoyo y al personal de la Sociedad, Johan, Freddy, Adriana y Tania, ya que sin su ayuda no estuviéramos aquí el día de hoy.
Adelante colegas, salgamos fortalecidos de esta crisis, como dijo Nelson Mandela La mayor gloria no es caer, sino levantarse siempre Muchas gracias
^rND^1A01^nMireya^sGonzález Blanco^rND^1A02^nRita^sPizzi^rND^1A01^nMireya^sGonzález Blanco^rND^1A02^nRita^sPizzi^rND^1A01^nMireya^sGonzález Blanco^rND^1A02^nRita^sPizziTratamiento de la menopausia: alternativas a la terapia farmacológica
Mireya González Blanco1, Rita Pizzi2.
Editora
1 Editora, Directora del Programa de Especialización en Obstetricia y Ginecología de la Universidad Central de Venezuela, con sede en Maternidad Concepción Palacios. 2 Servicio de Endocrinología, Hospital Universitario de Caracas.
La Revista de Obstetricia y Ginecología de Venezuela, como órgano de difusión de la Sociedad de Obstetricia y Ginecología de Venezuela, ha mantenido a lo largo del tiempo, una posición institucional ante los conflictos del país. Sin embargo, sin entrar a considerar las causas de la situación que se vive en Venezuela, hay una realidad que es innegable. Las dificultades de los pacientes para obtener los medicamentos para el tratamiento de las enfermedades crónicas son cada vez mayores. Esto afecta el ejercicio profesional de la medicina, puesto que el médico, una vez hecho el diagnóstico, se encuentra con la disyuntiva entre indicar el tratamiento más adecuado en cada caso particular a sabiendas de que el paciente no lo conseguirá, o preferir otro, no sobre la base de la conveniencia sino de la disponibilidad. Por supuesto, la calidad de vida de los pacientes se compromete.
Este comentario es aplicable a las mujeres en transición menopáusica y en la posmenopausia. Un grupo de mujeres menopáusicas se presenta sin ningún síntoma, mientras que otras tienen síntomas moderados a severos y discapacitantes. Es por ello, que se ha propuesto el uso de tratamientos, hormonales o no, para las molestias climatéricas o para la probable prevención de algunas enfermedades crónicas (1).
La manera de evaluar la condición clínica de las consultantes, así como la validez de ciertas modalidades terapéuticas, ha ido cambiando; sobre todo por el impacto que, sobre los médicos, como sobre sus pacientes, han tenido los resultados de algunos estudios clínico-epidemiológicos. Es así que el tratamiento en este grupo de mujeres ha evolucionado en el tiempo (1). Aproximadamente, hasta la década de los 90, toda mujer en esta etapa recibía terapia de reemplazo hormonal. Se decía que aportaba grandes beneficios, no solo en calidad de vida sino en prevención de osteoporosis y de enfermedad cardiovascular. Poco se hablaba de los riesgos. Con frecuencia se escuchaba decir que el tratamiento debía cumplirse de por vida y era frecuente encontrar pacientes de más de 70 años de edad, cumpliendo su tratamiento regularmente.
El estudio WHI (Womens health initiative), se centró en la definición de los riesgos y beneficios de las estrategias que podrían reducir potencialmente la incidencia de enfermedad cardíaca, cáncer colorrectal y de mama, y fracturas en mujeres postmenopáusicas (2). Entre 1993 y 1998, la WHI reclutó a 161 809 mujeres posmenopáusicas, entre 50 a 79 años, en un conjunto de ensayos clínicos y un estudio observacional en 40 centros clínicos de los Estados Unidos. El ensayo fue detenido antes de lo planificado en vista de que los riesgos para la salud excedían a los beneficios durante un seguimiento promedio de un poco más de cinco años. En la revisión de los datos del año 2002, se encontró que con la terapia estrógenos-progestinas, persistían los efectos adversos de las enfermedades cardiovasculares y, además, se observó un aumento del riesgo de sufrir cáncer de mama; estos hallazgos, junto a la evidencia de algún aumento de enfermedad coronaria, accidentes cerebrovasculares y embolismo pulmonar, superaban los beneficios en la reducción de fracturas y el posible beneficio por la reducción del riesgo de padecer cáncer de colon. Las conclusiones fueron que, en general los riesgos de salud excedieron los beneficios del uso de estrógeno combinado con progestina para un periodo de seguimiento de 5,2 años, entre mujeres posmenopáusicas saludables de Estados Unidos (2,3).
A partir de allí, surgió un pánico generalizado en la comunidad médica y en la población general en relación al uso de la terapia hormonal y, de usarla en todos los casos, se pasó a un periodo en el que no se indicaba prácticamente a ninguna mujer, perdiendo así los innegables beneficios que sobre la calidad de vida de algunas mujeres tiene el control de los síntomas climatéricos.
Afortunadamente, el temor dio paso a la razón, y surge entonces una forma más racional de decidir el uso de la terapia hormonal en la menopausia. La terapia hormonal está entonces indicada en pacientes con síntomas climatéricos moderados a severos, que estén en ventana terapéutica y que no tengan contraindicaciones para su uso.
La terapia hormonal es el estándar de oro en el tratamiento de los síntomas vasomotores y los debidos a atrofia urogenital. Otros, posiblemente relacionados con el proceso menopáusico, como mialgias, artralgias, cambios en el humor, alteraciones del sueño, y disfunción sexual, pudieran mejorar con la terapia hormonal (TH). Puede ser indicación de primera línea para prevenir el deterioro en la masa y calidad del hueso en mujeres menores de sesenta años con síntomas vasomotores. Existe consenso internacional en la indicación formal en las pacientes con menopausia precoz o falla ovárica primaria. Aunque las reevaluaciones recientes del estudio WHI, vuelven a plantear el posible efecto cardioprotector cuando la terapia se indica durante la ventana de oportunidad, en la actualidad no es una indicación formal en tal sentido (1).
A este respecto, la Sociedad Internacional de Menopausia en su posición de consenso del 2016 (4) concluye que en las mujeres menores de 60 años de edad, sin evidencia de enfermedad cardiovascular, el inicio de la terapia de estrógenos solos, reduce la incidencia de la cardiopatía coronaria y la mortalidad por todas las causas; la terapia combinada de estrógenos orales y progestágeno tiene datos menos robustos, pero otros regímenes terapéuticos (terapia con estrógenos transdérmicos y progesterona micronizada) parecen ser cardioprotectores, como se demostró en los estudios danés y finlandés (5). El análisis Cochrane más reciente (6) muestra una reducción consistente en la mortalidad por todas las causas en las usuarias de TH. El inicio de TH en mujeres de edad avanzada o en aquellas que tienen más de 10 años de posmenopausia, puede asociarse con un riesgo aumentado de eventos coronarios, principalmente en los primeros 2 años de uso. Por lo tanto, no es recomendable iniciar TH después de los 60 años de edad con el único fin de prevención primaria de enfermedad coronaria (4).
Los síntomas vasomotores (calorones y sudoración) son los que más perturban a la mujer menopáusica. Para la mayoría de las mujeres estos aparecen en el período de transición, se intensifican en la menopausia temprana y se resuelven en forma espontánea en pocos años, aunque, en algunas de ellas, pueden persistir toda la vida. Los síntomas vasomotores también se han relacionado con ansiedad, fatiga, trastornos del humor y del sueño. Estos síntomas se deben a un desajuste temporal del centro termorregulador hipotalámico. La FDA (Food and Drug Administration), de Estados Unidos, cataloga estos síntomas de moderados a severos cuando aparecen 7-8 veces por día o por lo menos 60 veces por semana. Los síntomas vasomotores son la principal indicación del uso de terapia hormonal la cual se considera actualmente el tratamiento de elección (7).
Lo señalado hasta aquí es del dominio de ginecólogos y endocrinólogos, sin embargo, a la hora de hacer la indicación, luego de la evaluación de la historia clínica, un examen físico integral y los exámenes complementarios requeridos, esos mismos especialistas se encuentran de manos atadas para prescribir la terapia adecuada para cada paciente debido a la escasa disponibilidad de los fármacos.
El manejo no hormonal de los síntomas vasomotores es una buena consideración cuando la terapia hormonal no es una opción, bien sea por contraindicaciones médicas o por una decisión personal de la mujer (8). Cabría incluir entre las razones para no usar la terapia hormonal adecuadamente indicada, la no disponibilidad de los fármacos. De allí que surja la necesidad de insistir en dos aspectos de vital importancia en el manejo de la menopausia, independientemente de la necesidad o no de terapia hormonal: la educación y los cambios en el estilo de vida.
Algunos estudios han señalado que las intervenciones educativas basadas en la promoción de estilos de vida saludables pueden ser usadas como una estrategia apropiada para reducir los síntomas en mujeres posmenopáusicas y mejorar su salud (9). Doce semanas de intervención en educación en salud, combinadas con dieta y ejercicios supervisados pueden mejorar los síntomas perimenopáusicos y ayudar a establecer mejores hábitos de vida. Esta mejoría se observa no solo en síntomas vasomotores, sino también en aspectos tales como la fatiga, las artralgias y mialgias, la irritabilidad, la depresión y las palpitaciones (10).
La promoción del estilo de vida saludable requiere un equipo multidisciplinario, debe iniciarse en las escuelas, los lugares de trabajo, la industria de la publicidad, así como los aseguradores médicos y las autoridades sanitarias (4). Se refiere a aspectos generales como el cese del tabaquismo, mantener el peso corporal ideal, recomendaciones nutricionales como la ingestión de 4-5 raciones al día que incluyan frutas, vegetales, fibra, granos, pescado 2 veces por semana, consumo limitado de sal y disminución de la grasa total. También se recomienda limitar el alcohol a un máximo de dos copas diarias, el uso de suplementos de calcio y la práctica de ejercicios moderados a intensos, al menos tres veces por semana. La nutrición adecuada y el ejercicio regular mejoran el perfil metabólico, la fuerza muscular, la capacidad cognitiva y la calidad de vida, reducen de manera significativa la enfermedad cardiovascular, accidentes cerebrovasculares, fracturas, cáncer de mama y cáncer de colon (11, 12).
También es importante el control médico apropiado, sobre todo para el descarte de enfermedades psicosomáticas, estrés, enfermedades tiroideas, feocromocitoma, síndrome carcinoide, leucemia y cáncer, como diagnóstico diferencial de los síntomas vasomotores, pero también para el despistaje o cribado de patologías propias de estos grupos de edad. Las modificaciones en el estilo de vida también incluyen socializar y ser física y mentalmente activa (1).
Entre las terapias alternativas no farmacológicas, también se ha recomendado el desarrollo de técnicas de relajación con control de la respiración. La respiración pausada, abdominal lenta y profunda, con sesiones durante el día o al inicio del calorón ha demostrado ser efectiva. También se recomienda el control de la temperatura corporal, evitando la elevación de la misma y manteniendo un ambiente fresco en el hogar y sitio de trabajo, con utilización de ropa ligera e ingestión de alimentos y bebidas frías (7).
Es indudable que la terapia hormonal es muy útil para muchas mujeres, sin embargo, en momentos de dificultades se deben buscar alternativas. El contacto con las pacientes debe ser una oportunidad de oro para educar. Hay que tomarse el tiempo para enseñar, para explicar a las mujeres qué está pasando en su organismo. En la medida que se comprende lo que ocurre se toleran mejor los cambios. Esta orientación educativa debe estar presente siempre, independientemente de la disponibilidad de la terapia hormonal, pero resulta particularmente importante en los casos en los que, estando indicada, no se dispone de la misma. Brindando esa orientación se puede lograr una mejor calidad de vida para la mujer en esta particular etapa.
REFERENCIAS
1. Fernández M, Molina-Vilchez R, Muñoz L, Bajares M. Atención de la mujer. En: Angelino de Blanco MC, Bajares de Lilue M, Pizzi R, editoras. Consenso Venezolano de Menopausia. Actualización 2008. Caracas: Editorial Ateproca; 2008. p.11-22. [ Links ]
2. The Womens Health Initiative Study Group. Design of the Womens Health Initiative clinical trial and observational study. Control Clin Trials. 1998;19: 61-109. [ Links ]
3. Rossouw JE, Anderson GL, Prentice RL, La Croix AZ, Kooperberg C, Stefanick ML, et al. Writing Group for the Womens Health Initiative Investigators. Risk and benefits of estrogen plus progestin in healthy postmenopausal women: principal results from the Womens Health Initiative randomized controlled trial. JAMA. 2002; 288 (3): 321-333. [ Links ]
4. Baber RJ, Panay N, Fenton A, IMS Writing Group. 2016 IMS Recommendations on womens midlife health and menopause hormone therapy. Climacteric. 2016;19 (2): 109–150. [ Links ]
5. Hodis HN, Mack WJ, Shoupe D, Azen SP, Stanczyk FZ, Hwang-Levine J, et al. Testing the menopausal hormone therapy timing hypothesis: The Early vs Late Intervention Trial with Estradiol. Circulation. 2014; 130: A13283. [ Links ]
6. Boardman HM, Hartley L, Eisinga A, Main C, Roquéi Figuls M, Bonfill Cosp X, et al. Hormone therapy for preventing cardiovascular disease in post-menopausal women. Cochrane Database Syst Rev. 2015; 3: CD002229. [ Links ]
7. Stambury G, Segnini I, Pérez L. Sistema nervioso central, sexualidad y calidad de vida. En: Angelino de Blanco MC, Bajares de Lilue M, Pizzi R, editoras. Consenso Venezolano de Menopausia. Actualización 2008. Caracas: Editorial Ateproca; 2008. p.53-60. [ Links ]
8. Nonhormonal management of menopause-associated vasomotor symptoms: 2015 position statement of The North American Menopause Society. Menopause. 2015; 22 (11): 1155-1172. [ Links ]
9. Nazari M, Farmani S, Kaveh MH, Ghaem H. The effectiveness of lifestyle educational program in health promoting behaviors and menopausal symptoms in 45- 60 years old women in Marvdasht, Iran. Glob J Health Sci. 2016;8 (10): 55414. [ Links ]
10. Xi S, Mao L, Chen X, Bai W. Effect of health education combining diet and exercise supervision in Chinese women with perimenopausal symptoms: a randomized controlled trial. Climacteric. 2017; 1: 1-6. [ Links ]
11. Sternfeld B, Wang H, Quesenberry CP Jr, Abrams B, Everson-Rose SA, Greendale GA, et al. Physical activity and changes in weight and waist circumference in midlife women: findings from the Study of Womens Health Across the Nation. Am J Epidemiol 2004; 160 (9): 912 – 922. [ Links ]
12. Maruthur NM, Wang NY, Appel LJ. Lifestyle interventions reduce coronary artery disease risk: results from the PREMIER trial. Circulation. 2009; 119 (15): 2026–2031. [ Links ]
10 datos sobre la salud de la mujer
Según la Organización Mundial de la salud (OMS), las mujeres tienen mayor esperanza de vida que los hombres en la mayoría de los países, sin embargo, hay una serie de factores sanitarios y sociales que se combinan para hacer que la calidad de vida de las mujeres sea inferior. Las desigualdades en el acceso a la información, la atención y las prácticas sanitarias básicas, aumentan aún más los riesgos para la salud de las mujeres.
En su página web, la OMS destaca 10 áreas fundamentales que tienen graves consecuencias para la salud de la mujer. Siendo ellas el centro del ejercicio profesional del especialista en Obstetricia y Ginecología, el Comité Editorial las presenta aquí.
1. A pesar de que las tasas de tabaquismo son unas 10 veces mayores en los hombres que en las mujeres, el consumo de tabaco entre las mujeres jóvenes de los países en desarrollo está aumentando rápidamente por el desarrollo de campañas comerciales dirigidas a ese grupo de población. La OMS señala que las tasas de éxito del abandono del hábito son menores en las mujeres y las recaídas son más frecuentes.
2. El 61 % de los adultos infectados con el virus de inmunodeficiencia adquirida (VIH) son mujeres. En el Caribe, región de interés particular para el país, la proporción de mujeres infectadas es de 43 %.
3. La proporción de mujeres que han sufrido violencia física o sexual por sus parejas en algún momento de sus vidas está entre 15 % y 71 %. Estos abusos ocurren en todas las clases sociales y niveles económicos y se asocian con embarazos no deseados, infecciones de transmisión sexual (ITS), depresión y enfermedades crónicas.
4. Algunos estudios señalan, según la OMS, que la quinta parte de las mujeres, esto es un 20 %, refieren haber sufrido abuso sexual antes de los 15 años.
5. Se calcula que 100 millones de niñas se casarán antes de los 18 años en los próximos 10 años. La OMS destaca el hecho de que estas adolescentes, a menudo, desconocen sobre los riesgos de contraer VIH/SIDA y otras ITS.
6. La cifra de embarazo en adolescentes es alarmante. Según la OMS, 14 millones de adolescentes se convierten en madres anualmente. La proporción es más elevada en países en desarrollo.
7. Ligado al punto anterior, la razón de muerte materna también es elevada. Diariamente, según la OMS, 1600 mujeres y más de 10 000 recién nacidos mueren por complicaciones prevenibles del embarazo y del parto. Al igual que la tasa de embarazo en adolescentes, casi la totalidad de la mortalidad materna (99 %) ocurre en países en desarrollo.
8. Los mosquiteros tratados con insecticida reducen los casos de paludismo en las embarazadas y sus hijos. Esto podría ser una medida importante también para la prevención de otras enfermedades como dengue, chikungunya y zika. Sin embargo, el uso de los mosquiteros está relacionado con pautas de sueño que a veces impiden su uso a las mujeres.
9. En la mayoría de los países la cocina suele ser una ocupación femenina. Cuando cocinan en fuego o en cocinas tradicionales, respiran una mezcla de contaminantes que son causas de 500 mil a más de un millón de muertes anuales por neumopatías obstructivas. Solo 12 % de las muertes en hombres por neumopatías obstructivas, está relacionado con esta causa.
10. El riesgo de discapacidad visual es significativamente más alto en la mujer que en el hombre, a todas las edades y en todo el mundo. A pesar de ello, las mujeres no tienen el mismo acceso al tratamiento de las enfermedades oculares que los hombres.
En conclusión, la discriminación sexual genera muchos peligros para la salud de las mujeres, tales como la violencia física y sexual, las infecciones de transmisión sexual, el VIH/SIDA, el paludismo o la neumopatía obstructiva crónica. El consumo de tabaco representa una amenaza cada vez más importante para la salud de la mujer, y las tasas de mortalidad durante el embarazo y el parto siguen siendo elevadas en los países en desarrollo.
Organización Mundial de la Salud. 10 datos sobre la salud de la mujer. [Actualizado febrero 2009, revisado febrero 2017] Disponible en http://www.who.int/features/factfiles/women/es/
Organización Mundial de la Salud. 10 datos sobre la salud de la mujer. Datos y cifras. [Actualizado febrero 2009, revisado febrero 2017] Disponible en http://www.who.int/features/factfiles/women_health/es/
^rND^sFernández^nM^rND^sMolina-Vilchez^nR^rND^sMuñoz^nL^rND^sBajares^nM^rND^sRossouw^nJE^rND^sAnderson^nGL^rND^sPrentice^nRL^rND^sLa Croix^nAZ^rND^sKooperberg^nC^rND^sStefanick^nML^rND^sBaber^nRJ^rND^sPanay^nN^rND^sFenton^nA^rND^sHodis^nHN^rND^sMack^nWJ^rND^sShoupe^nD^rND^sAzen^nSP^rND^sStanczyk^nFZ^rND^sHwang-Levine^nJ^rND^sBoardman^nHM^rND^sHartley^nL^rND^sEisinga^nA^rND^sMain^nC^rND^sRoquéi Figuls^nM^rND^sBonfill Cosp^nX^rND^sStambury^nG^rND^sSegnini^nI^rND^sPérez^nL^rND^sNazari^nM^rND^sFarmani^nS^rND^sKaveh^nMH^rND^sGhaem^nH^rND^sXi^nS^rND^sMao^nL^rND^sChen^nX^rND^sBai^nW^rND^sSternfeld^nB^rND^sWang^nH^rND^sQuesenberry^nCP Jr^rND^sAbrams^nB^rND^sEverson-Rose^nSA^rND^sGreendale^nGA^rND^sMaruthur^nNM^rND^sWang^nNY^rND^sAppel^nLJ^rND^1A01^nMarianela^sRivas^rND^1A01^nXiomara^sGonzález^rND^1A02^nHarold^sGuevara^rND^1A01^nMarianela^sRivas^rND^1A01^nXiomara^sGonzález^rND^1A02^nHarold^sGuevara^rND^1A01^nMarianela^sRivas^rND^1A01^nXiomara^sGonzález^rND^1A02^nHarold^sGuevaraValores de referencia del índice de pulsatilidad de la arteria uterina durante el embarazo
Drs. Marianela Rivas1, Xiomara González2, Harold Guevara3.
1 Doctorado en Ciencias Médicas, 2 Unidad de Perinatología. Facultad de Ciencias de la Salud, Universidad de Carabobo, Departamento de Obstetricia, Ginecología y Perinatología, Hospital Dr. Adolfo Prince Lara. 3 Departamento de Salud Pública, sede Carabobo. Universidad de Carabobo.
RESUMEN
Objetivo: Establecer los valores de referencia del índice de pulsatilidad promedio de la arteria uterina entre las 11 y 40 semanas de gestación.
Métodos: Se realizó un estudio prospectivo, transversal y no experimental. Se evaluaron con ultrasonido doppler las arterias uterinas de 559 gestantes con fetos únicos y con crecimiento normal entre las semanas 11 a 40 de gestación. Se calculó el índice de pulsatilidad promedio (índice de pulsatilidad promedio de las uterinas igual al índice de pulsatilidad de la uterina derecha más el índice de pulsatilidad de la izquierda dividido entre dos), y se identificó la prevalencia de muesca protodiastólica en cada semana de gestación. Para la obtención de los valores normales del índice de pulsatilidad promedio se calculó la mediana como medida de tendencia central y los percentiles como medidas de posición. El estudio se realizó en el Hospital Dr. Adolfo Prince Lara.
Resultados: Los valores de índice de pulsatilidad de ambas arterias uterinas evidenciaron correlación inversa con la edad gestacional. La prevalencia unilateral y bilateral de la muesca protodiastólica durante la gestación fue de 19,6 % y 17,45 % respectivamente.
Conclusión: El índice de pulsatilidad promedio de las uterinas muestra una disminución progresiva hasta las últimas etapas del embarazo.
Palabras clave: Arteria uterina, Índice de pulsatilidad, Embarazo.
SUMMARY
Objective: To establish the normal reference values of the mean pulsatility index of the uterine artery between 11 and 40 gestation weeks.
Methods: A prospective type, cross-sectional and non-experimental study was performed. Doppler ultrasound was used to evaluate uterine arteries of 559 pregnant women with singleton fetuses with normal growth between weeks 11-40 of gestation. Average pulsatility index (Average pulsatility index = pulsatility index of right uterine artery plus pulsatility index of left uterine artery/2) was calculated and the prevalence of early diastolic notch in each week of gestation was identified. To obtain normal values of average pulsatility index, the median was calculated as a measure of central tendency and percentiles as measures of position. Seting: Hospital Dr. Adolfo Prince Lara.
Results: The pulsatility index values of both uterine arteries showed inverse correlation with gestational age. The prevalence of unilateral and bilateral early diastolic notch during pregnancy was 19.6% and 17.45% respectively.
Conclusions: The Average Pulsatility index of the uterine arteries shows a progressive decline until the late stages of pregnancy.
Keywords: Uterine artery, Pulsatility index, Pregnancy.
INTRODUCCIÓN
Las arterias uterinas son dos vasos maternos simétricos que transportan sangre oxigenada hacia la placenta. Por medio del estudio doppler en las mujeres no gestantes, estos vasos exponen una onda de velocidad de flujo (OVF) con flujo diastólico muy pequeño y una gran muesca protodiastólica, no obstante, durante el embarazo se origina un descenso relevante en el primero y segundo trimestre producido básicamente por invasión de células trofoblásticas a las arterias espirales (1).
Dos de las principales causas de morbimortalidad perinatal alrededor del mundo son la preeclampsia/eclampsia (P/E) y el crecimiento fetal restringido (CFR). En Venezuela, la P/E constituye una de las primeras causas de mortalidad materna (2-5). La detección de estas patologías en su fase inicial tiene importancia, porque permite coordinar medidas de prevención y vigilancia, las cuales se traducirían en mejor pronóstico para la madre y el feto (6-11).
En Venezuela, Ortega y col. (12) y Sosa-Olavarría (13), pioneros en el estudio de la velocimetría doppler materno fetal, evaluaron el corazón fetal y las características de las OVF de las arterias uterinas durante el embarazo normal y patológico coincidiendo con lo reportado a nivel internacional (1, 8, 9-11, 14).
Ante la presencia de preeclampsia o restricción del crecimiento intrauterino, la valoración doppler del flujo sanguíneo en las arterias uterinas exhibirá resistencias elevadas. Numerosos estudios se basan en este hecho, evalúan la utilidad del estudio doppler de las arterias uterinas, en el primer trimestre (11-14 semanas) y en el segundo trimestre (21-24 semanas) como predictores de complicaciones obstétricas, como la P/E y el CFR, cuyo origen está en una placentación inadecuada o anómala (14-21).
El uso clínico de la imagen del ultrasonido doppler de la arteria uterina (ArUt) necesita de la existencia de valores de referencia, encontrándose a nivel internacional pocos de ellos publicados (8, 22-24), pero no existe en Venezuela este tipo de valores a pesar del uso común del examen doppler de la ArUt durante el embarazo. El índice de pulsatilidad (IP) es actualmente el índice más comúnmente utilizado para la evaluación de los patrones de forma de onda doppler de la ArUt. Sin embargo, los estudios publicados anteriormente sobre la evaluación doppler de la ArUt durante el embarazo han utilizado una variedad de índices doppler o sistemas de puntuación. (23, 25-27).
Los valores de referencia para la media del IP de la ArUt a lo largo de la gestación no se han reportado en el país. Es por ello que el propósito del presente estudio fue obtener los valores de referencias de la media del IP de las arterias uterinas entre 11-40 semanas de gestación en una población seleccionada apropiadamente.
MÉTODOS
Se realizó un estudio prospectivo, longitudinal y no experimental. La población estuvo constituida por gestantes consultantes al Servicio de Perinatología del Hospital Dr. Adolfo Prince Lara de Puerto Cabello, en el lapso comprendido entre 1 de enero 2009 y 31 de diciembre 2013.
La muestra para la construcción del nomograma del IP de la ArUt, estuvo conformada inicialmente por 630 embarazadas, 71 de los casos (11,27 %) fueron excluidos por no tener seguimiento y desconocer el resultado perinatal, quedando finalmente la muestra constituida por 559 embarazadas, con edades gestacionales entre las 11 y 40 semanas que cumplían los siguientes requisitos: historia clínica perinatal completa, embarazos simples, con edad gestacional conocida, estimada por la fecha de la última menstruación normal y confirmada o corregida a partir de los datos obtenidos en una exploración ecográfica realizada durante el primer trimestre de gestación, exploración ecográfica de la anatomía fetal normal, resultado neonatal conocido, sin malformaciones ni alteraciones del peso fetal. Se excluyeron embarazadas fumadoras o alcohólicas, o con embarazos complicados por preeclampsia, hipertensión, parto pretérmino, enfermedades autoinmunes, diabéticas y sangrados vaginales durante el embarazo.
Previo a la evaluación doppler, se realizó a cada paciente evaluación ultrasonográfica a fin de excluir gestación múltiple, determinar datos anatómicos y biométricos fetales, perfil biofísico modificado (28), estimación del peso fetal (29) y, finalmente, determinación del grado placentario y del índice de líquido amniótico (30).
Para el estudio ecosonográfico y mediciones dopple
en ambas arterias uterinas se utilizaron dos equipos de ultrasonido: My Lab 60, de la casa Esoate, y Nemio 20 de la casa Toshiba, con transductores transvaginales, de 5 a 7 MHz, y abdominales convex, de 3,5-5 MHz, respectivamente. Se utilizó un filtro de pared de 73 Hz, velocidad de repetición de pulsos de 4,9 KHz e intensidad de 68 dB. Las mediciones fueron efectuadas en ausencia de movimientos corporales y respiratorios tanto de la madre como del feto, y con frecuencia cardiaca fetal que osciló entre 120 y 160 latidos por minuto.
A las pacientes seleccionadas se les realizó la medición del IP de la Ar Ut a través de la técnica habitual seguida en el servicio, usando la ecografía doppler, la rama principal de la arteria uterina se localizó fácilmente en la unión cérvico-corporal del útero, con la ayuda de doppler color. Las mediciones de velocimetría doppler se realizaron, por lo general, cerca de esta ubicación, ya fuera por vía transabdominal o transvaginal; para la evaluación de las ondas de velocidad de las arterias uterinas, se utilizó la valoración semicuantitativa de las mismas (23,31).
Previo a la realización del cálculo del IP de la Ar Ut, se confirmó que la altura de la onda ocupara aproximadamente el 75 % del área de análisis y se ajustaron convenientemente las ganancias. Posterior a estos ajustes, el IP (velocidad sistólica – velocidad diastólica final / velocidad promedio del ciclo) se logró por análisis automático de la onda vascular de flujo en tres ciclos cardíacos uniformes. El IP promedio (IP Prom-Ute) fue calculado de los valores obtenidos de las arterias uterinas derecha e izquierda. También fue documentada la presencia de muesca unilateral o bilateral (31).
Análisis estadístico:
Para los cálculos fue utilizado el paquete estadístico PAST versión 2,09. Para el análisis descriptivo del índice de pulsatilidad IP(X) de la arteria uterina en cada edad gestacional se utilizó la mediana y los percentiles 5, 50 y 95, en vista que la variable no siguió una distribución normal según el resultado de la prueba de Kolmogorov-Smirnov. Para evaluar la relación entre variables cuantitativas, se empleó el coeficiente de correlación de Spearman (ρ) y el análisis de regresión lineal simple, construyéndose la curva del IP Prom-Ute dependiente de la edad gestacional. Un valor de P < 0,05 fue considerado significativo.
Esta investigación contó con consentimiento escrito informado de la población estudio y aval de la Comisión Científica de la institución.
RESULTADOS
En un total de 559 pacientes embarazadas, que reunieron los requisitos para la elaboración del nomograma de la arteria uterina, con edad gestacional comprendida entre las 11 y 40 semanas de gestación, se obtuvieron los valores del IP promedio de la Ar Ut, luego de realizar la medición del IP de ambas arterias uterinas: derecha e izquierda y sacar el promedio aritmético.
La edad materna promedio fue 23,6 años (mediana de 25, rango 12-44 años), con edad gestacional entre 11 y 40 semanas. De las pacientes estudiadas 38,99 % fueron nulíparas y 23,07 % primíparas (Tabla 1)
El nomograma del IP Prom-Ute, se presenta en dos cuadros: uno que presenta la distribución por percentiles de este índice diámetro en relación a la edad gestacional (Tabla 2), y otro que muestra la distribución por percentiles en el primer trimestre (11-14 semanas) y segundo trimestre (21-24 semanas), siendo el percentil 95 de 2,44 para el primer trimestre y de 1,71 para el segundo trimestre (Tabla 3).
La Ar Ut mostró correlación inversa con la edad gestacional, según la ecuación de regresión: IP Prom-Ute = 1,589 + (-0,023) x semana de gestación, con un índice de correlación de Sperman ρ = -0,364 P < 0,001 (r2=0,132) (Figura 1).
La prevalencia de muesca bilateral o unilateral en el primer trimestre 11-14 semanas (92 casos) fue del 58,69 % y 28,26 %, respectivamente, y para el segundo trimestre entre las 20-24 semanas (139 casos) fue del 12,23 % y del 26,61 % respectivamente. (Tabla 4)
DISCUSIÓN
Las ondas de velocidad de flujo fueron obtenidas exitosamente en ambas arterias uterinas en todos los casos. El análisis de este estudio demuestra la factibilidad de evaluar la circulación uteroplacentaria por ultrasonografía transabdominal en todos los trimestres y transvaginal en el segundo trimestre coincidiendo con la evaluación de la cervicometría de rutina, y confirma la posibilidad de incorporar el doppler de la arteria uterina en el despistaje del primer y segundo trimestre (11-14 semanas y 20-24 semanas). La aplicación de este método en combinación con otros marcadores como: la historia materna, la presión arterial media y marcadores bioquímicos, podría ser de utilidad para identificar pacientes de alto riesgo para complicaciones, y una mejor supervisión de estos embarazos posiblemente repercutiría en mejorar los resultados perinatales (19, 21, 24).
Los resultados presentados señalan que, durante la gestación normal, el IP Prom-Ute disminuye en relación inversa con la edad gestacional desde las 11 hasta las 40 semanas. Estos hallazgos sugieren que la invasión trofoblástica tal vez sea la responsable de la disminución de la resistencia observada en los vasos uterinos, hallazgo que sería indicativo de una adecuada placentación y de buen pronóstico para la gestación (6, 7, 16, 17, 19, 24).
Medina y col. (8) son pioneros en la publicación de curvas de referencia del IP de la Ar Ut con tablas por percentiles a partir de la semana 20 de gestación. Más adelante Cafici (23) y Gómez y col. (22), publicaron los valores de referencia del IP Prom-Ute desde la semana 20 a 40 y desde la semana 11 a la semana 41 respectivamente, por su parte Gurgel y col. (24) publicaron sus valores de referencia en las semanas 11 y 14. Todos coinciden en la disminución de la resistencia del flujo en la arteria uterina a medida que avanza el embarazo, similar a los hallazgos encontrados en el presente trabajo. Algunos estudios incluyen diversos sistemas de puntuación (32) y han sido descritos para la evaluación de las ondas de velocidad OVF de la Ar Ut durante el embarazo. El índice de resistencia y el IP, solos o en combinación con la presencia de escotadura diastólica temprana, han sido los índices más comúnmente usados (22-26, 33-37).
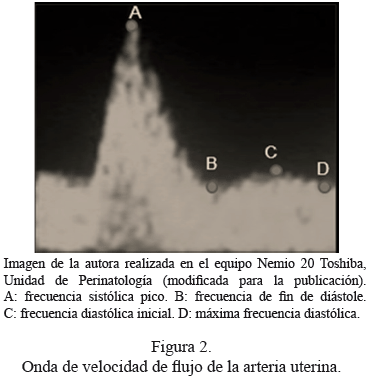
Farrel y Chien, citados por Tekay y col. (27), estudiaron la confiabilidad de la detección de una muesca temprana, evaluando la capacidad para detectar una muesca en 1371 OVF de Ar Ut en dos investigaciones independientes por medio de las estadísticas kappa, evidenciando un buen grado de concordancia entre los observadores (valores kappa de 0,75 y 0,66 respectivamente). Estos autores, para superar los inconvenientes del análisis subjetivo, introdujeron varios índices (Figura 2): A/C, (D-C)/B, (D-C)/(A-C), D-C, donde A: frecuencia sistólica pico, B: frecuencia de fin de diástole, C: frecuencia diastólica inicial, D: máxima frecuencia diastólica; los autores reportaron que el índice que consiguió mayor concordancia con la observación fue D/C-B (kappa: 0,81)
Algunos autores prefieren el índice A/B (I A/B) y el índice de resistencia (IR) para el análisis de la OVF de la Ar Ut porque ofrecen dos ventajas: su cálculo es más sencillo, y se cuenta con referencias bibliográficas que coinciden en los puntos de corte. No obstante, recientes investigaciones sobre las OVF de las arterias uterinas durante el embarazo han usado de manera sistemática el IP; y esto es debido a que, tal como señalan Gómez y col. (22) y Cafici (23), la distribución de las medidas del IP de las arterias uterinas en lugar del índice de resistencia, describe mejor la forma de la OVF e incluye el área debajo de la curva en la fórmula. Por esta razón el IP indirectamente informa sobre la presencia o ausencia de la escotadura protodiastólica.
La prevalencia de muesca bilateral o unilateral en el primer trimestre 11-14 semanas (92 casos), fue de 58,69 % y 28,26 %, valores similares a los reportados por Gurgel y col. (24) y superior a lo informado por Gómez y col. (22).
Este estudio presenta los valores de referencia del IP Prom-Ute entre 11 y 40 semanas de gestación en una población adecuada y proporciona información importante sobre el proceso de transformación de las arterias espirales en las arterias uteroplacentarias; reflejando el proceso subyacente de la placentación. Los índices de resistencia de la arteria uterina disminuyen durante la primera mitad del embarazo. Este estudio muestra una disminución significativa y progresiva del IP con la gestación. Los datos presentes también demuestran que, junto con el descenso progresivo de la media del IP Prom-Ute, la prevalencia de muescas bilateral disminuye al aumentar la edad gestacional.
Se han presentado los nuevos valores de medias IP Prom-Ute derivados de un estudio longitudinal en una población de 559 mujeres de entre 11 y 40 semanas de gestación. Estos rangos de referencia pueden ser clínicamente útiles en dos circunstancias relevantes diferentes: para la detección de la P/E y/o restricción del crecimiento fetal en las primeras etapas del embarazo y para evaluar pacientes con hipertensión inducida por el embarazo y/o CFR. Se requieren otros estudios en este segundo grupo de embarazos complicados para confirmar el valor clínico de un patrón anormal de las OVF y el valor de IP de la arteria uterina como una herramienta de pronóstico.
Los autores expresan su agradecimiento al Consejo de Desarrollo Científico y Humanístico de la Universidad de Carabobo, por el financiamiento otorgado; a la Lic. Lorena Bethancourt de la Biblioteca Dr. Manuel Antonio Sánchez Carvajal por su incansable apoyo en la búsqueda de la bibliografía; a las doctoras Gladys Chirino, Josmery Faneite, María Luisa García y residentes de la Especialización de Perinatología Medicina Materno Fetal. Sede Hospital Dr. Adolfo Prince Lara por su colaboración en la recolección de la información y a la Sra. Leomaris Manrique, secretaria del Servicio de Perinatología del Hospital Dr. Adolfo Prince Lara, por su apoyo en la búsqueda de las historias clínicas de las pacientes.
REFERENCIAS
1. Gallo M, Gallo J, Espinosa A, Zapara J. Doppler en la preeclampsia. En: Gallo M, Vigil de Gracía P. Trastornos Hipertensivos del embarazo. Colección de Medicina Fetal y Perinatal. Caracas: Editorial Almoca, 2013; pp. 83–113. [ Links ]
2. Rivas M, López-Gómez J, Silva D, Capretta D, Colmenares B, Rojas J. Severe induced hypertension in pregnancy at the Maternity Unit of Dr Adolfo Prince Lara Hospital 1998-1999. J Perinatal Med 2001; Supplement I 29: 607-8. [ Links ]
3. Guariglia D. Epidemiología. En: Guariglia D. Hipertensión en el embarazo. Preeclampsia/ Eclampsia y otros estados hipertensivos. Caracas: Disinlimed. 2006. p 25-45. [ Links ]
4. Faneite P, Rivas M. Mortalidad materna: tragedia prevenible ¿Hemos avanzado? Rev Obstet Ginecol Venez 2010; 70(1):24-30. [ Links ]
5. Rivas M, Faneite P, Salazar G. Eclampsia. Repercusión materna y perinatal. Rev Obstet Ginecol Venez 2012; 72(1):34-41. [ Links ]
6. Sosa-Olavarría A, Zurita J, Larrázabal N, Huamán M. Flujometría Doppler de las arterias uterinas durante el embarazo. Ultrasonografía Embrio-Fetal 2005; 1:1-6. [ Links ]
7. Sosa-Olavarría A. Avances en el Doppler en Obstetricia. Rev Per Ginecol Obstet 2009; 55:163-66. [ Links ]
8. Medina N, Figueroa H, Guzmán M, Hernández E. Valores de referencia de la arteria uterina y umbilical durante el embarazo. Ginecol Obstet Mex 2006; 74:509-15. [ Links ]
9. Sáez N, Carvajal J. Tamizaje y Prevención de preeclampsia guiado por Doppler de arterias uterinas: una revisión sistemática de la literatura. Rev Chil Obstet Ginecol. 2012; 77(3):235-42. [ Links ]
10. Whotherboer E, Koster M, Kuc S, EijKemans M, Bilardo C, Schielen P, Visser G. Ultrasound longitudinal trends in fetoplacental biochemical markers, uterine artery pulsatility index and maternal blood pressure during the first trimester of pregnancy. Ultrasound Obstet Gynecol 2011; 38:383-8. [ Links ]
11. Tuuli M, Odibo A. The role of serum markers and uterine artery Doppler in identifying at risk pregnancies. Clin Perinatol 2011; 38(1):1–19. [ Links ]
12. Ortega R, Clarembaux J, Guevara F, Briceño R, Ortega JP, Weisinger K. Circulación materno fetal en gestaciones de alto riesgo. Rev Obstet Ginecol Venez 1992; 52:27-33. [ Links ]
13. Sosa-Olavarría A. Velocimetría Doppler en la gestación. En: Exploración Doppler en Obstetricia. Valencia. 1995: Editorial Tatum; pp. 35-55. [ Links ]
14. Parreti E, Mealli F, Magrini A, Cioni R, Mecacci F, La Torre P, et al. Cross-sectional and longitudinal evaluation of uterine Doppler velocimetry for the prediction of preeclampsia in normotensive women with specific risk factors. Ultrasound Obstet Gynecol 2003; 22:160-5. [ Links ]
15. Mohamed M, Nodarse A, Pérez J, Pouymiró M, Guzmán R, Nápoles M, et al. Valor de la Flujometría Doppler de las arterias uterinas para la predicción de algunas complicaciones en gestantes con hipertensión arterial crónica. Rev Cubana Obstet Ginecol 2007; 33(2):7-16. [ Links ]
16. McLeod L. How useful is uterine artery Doppler Ultrasonography in predicting pre-eclampsia and intrauterine growth restriction? CMAJ 2008; 178(6):727-9. [ Links ]
17. Cortés Y. Doppler de arterias uterinas en el primer trimestre del embarazo para detección de los trastornos hipertensivos asociados con el embarazo: Estudio de cohorte. Bogotá (Colombia) 2007-2008. Rev Colomb Obstet Ginecol 2009; 60:328-33. [ Links ]
18. Maged AM, ElNassery N, Fouad M, Abdelhafiz A, Al Mostafa W. Third-trimester uterine artery Doppler measurement and maternal postpartum outcome among patients with severe pre-eclampsia. Int J Gynecol Obstet 2015; 131(1):49-53. Disponible en: http://dx.doi.org/10.1016/j.ijgo.2015.03.045 [ Links ]
19. Tayyar A, Guerra L, Wright A, Wright D, Nicolaides K. Uterine Artery Pulsatility index in the three trimesters of pregnancy: effects of maternal characteristics and medical history. Ultrasound Obstet Gynecol 2015; 45:689-97. [ Links ]
20. Márquez G, Oliveira M, Naves W. Using Ultrasound and Doppler ultrasound to asses vascular changes un pre-eclampsia and eclampsia: a systematic review. Repro Clim. 2015; 30(1):33-41. [ Links ]
21. Gorman N, Tampakoudis G, Wright A, Wright D, Nicolaides K. Uterine artery pulsatility index at 12, 22, 32 and 36 weeks gestation in screening for preeclampsia. Ultrasound Obstet Gynecol 2016; 47:565– 72. [ Links ]
22. Gómez O, Figueras F, Fernández M, Benassar M, Martinez J, Puerto B, Gratacós E. Reference ranges for uterine artery mean opulsatility index at 11 – 41 weeks of gestation. Ultrasound Obstet Gynecol 2008; 32:128- 32. [ Links ]
23. Cafici D. Evaluación de las arterias uterinas mediante Doppler. En Cafici D. Ultrasonografía Doppler en Obstetricia Buenos Aires Journal 2008; pp. 59-84. [ Links ]
24. Gurgel J, Costa B, Praciano P, Bezerra S, Silva F. Reference range of uterine artery Doppler parameters between the 11th and 14th pregnancy weeks in a population simple from Northeast Brazil. Rev Bras Ginecol Obstet 2013; 35(8):357-62. [ Links ]
25. Kubirlay A, Alper H, Schmidt W. Ecografía Doppler en Obstetricia. En: Kurjak A, Chevernak F: Donald School Ecografía en Obstetricia y Ginecología. Buenos Aires Panamericana 2009; pp. 518-37. [ Links ]
26. Espinosa A, Gallo M. Doppler en vasos maternos uterinos. En: Palermo M, Espinosa A: Doppler Materno Fetal. Colección de Medicina Fetal y Perinatal Caracas Amolca 2011; pp. 37-53. [ Links ]
27. Tekay A, Campbell S. Ecografía Doppler en Obstetricia. En; Callen P: Ecografía en Obstetricia y Ginecología Buenos Aires, Panamericana 2002; pp. 651-95. [ Links ]
28. Faneite P. Perfil Biofísico Fetal. En: Zighelboim I, Guariglia D. Clínica Obstétrica. Editorial Disinlimed. Caracas 2001; pp. 241-55. [ Links ]
29. Hadlock FP, Harrist RB, Sharman RS, Deter RL, Park SK. Estimation of fetal weight with the use of head, body and femur measurements-a prospective study. Am J Obstet Gynecol 1985; 151:333-7. [ Links ]
30. González de Chirivella X, Faneite P, Salazar G. Índice de líquido amniótico I. Valores durante el embarazo normal. Rev Obstet Ginecol Venez. 1999; 59:87-90. [ Links ]
31. Bhide A, Acharya G, Bilardo CM, Brezinka C, Cafici D, Hernández Andrade E, et al. ISUOG Practice Guidelines: use of Doppler ultrasonography in obstetrics. Ultrasound Obstet Gynecol 2013; 41 (2): 233–239. [ Links ]
32. Hernández E, Brodszki J, Lingman G, Gudmundsson S, Molin J, Marsal K. Uterine artery score and perinatal outcome. Ultrasound Obstet Gynecol. 2002; 19 (5): 438-442. [ Links ]
33. Park YW, Cho JS, Choi HM, Kim TY, Lee SH, Yu JK, Kim JW. Clinical significance of early diastolic notch depth: uterine artery Doppler velocimetry in the third trimester. Am J Obstet Gynecol. 2000; 182 (5): 1204- 1209. [ Links ]
34. Peña H, Camacho M, Escobedo F. Velocimetría Doppler de las arterias uterinas en el embarazo. Rev Esp Méd Quir. 2008; 13 (4): 177-180. [ Links ]
35. Ertan AK1, Hendrik HJ, Tanriverdi HA, Bechtold M, Schmidt W. Fetomaternal Doppler sonography nomograms. Clin Exp Obstet Gynecol. 2003; 30 (4): 211-216. [ Links ]
36. Martin A, Bindra R, Curcio P, Cicero S, Nicolaides K. Screening for preeclampsia and fetal growth restriction by uterine artery Doppler at 11-14 weeks of gestation. Ultrasound Obstet Gynecol. 2001; 18 (6): 583-586. [ Links ]
37. Gómez O, Martínez J, Figueras F, Del Rio M, Borobio V, Puerto B, et al. Uterine artery Doppler at 11-14 weeks of gestation to screen for hypertensive disorders and associate complications in an unselected population. Ultrasound Obstet Gynecol. 2005; 26 (5): 490-494. [ Links ]^rND^sGallo^nM^rND^sGallo^nJ^rND^sEspinosa^nA^rND^sZapara^nJ^rND^sRivas^nM^rND^sLópez-Gómez^nJ^rND^sSilva^nD^rND^sCapretta^nD^rND^sColmenares^nB^rND^sRojas^nJ^rND^sGuariglia^nD^rND^sFaneite^nP^rND^sRivas^nM^rND^sRivas^nM^rND^sFaneite^nP^rND^sSalazar^nG^rND^sSosa-Olavarría^nA^rND^sZurita^nJ^rND^sLarrázabal^nN^rND^sHuamán^nM^rND^sSosa-Olavarría^nA^rND^sMedina^nN^rND^sFigueroa^nH^rND^sGuzmán^nM^rND^sHernández^nE^rND^sSáez^nN^rND^sCarvajal^nJ^rND^sWhotherboer^nE^rND^sKoster^nM^rND^sKuc^nS^rND^sEijKemans^nM^rND^sBilardo^nC^rND^sSchielen^nP^rND^sVisser^nG^rND^sTuuli^nM^rND^sOdibo^nA^rND^sOrtega^nR^rND^sClarembaux^nJ^rND^sGuevara^nF^rND^sBriceño^nR^rND^sOrtega^nJP^rND^sWeisinger^nK^rND^sSosa-Olavarría^nA^rND^sParreti^nE^rND^sMealli^nF^rND^sMagrini^nA^rND^sCioni^nR^rND^sMecacci^nF^rND^sLa Torre^nP^rND^sMohamed^nM^rND^sNodarse^nA^rND^sPérez^nJ^rND^sPouymiró^nM^rND^sGuzmán^nR^rND^sNápoles^nM^rND^sMcLeod^nL^rND^sCortés^nY^rND^sMaged^nAM^rND^sElNassery^nN^rND^sFouad^nM^rND^sAbdelhafiz^nA^rND^sAl Mostafa^nW^rND^sTayyar^nA^rND^sGuerra^nL^rND^sWright^nA^rND^sWright^nD^rND^sNicolaides^nK^rND^sMárquez^nG^rND^sOliveira^nM^rND^sNaves^nW^rND^sGorman^nN^rND^sTampakoudis^nG^rND^sWright^nA^rND^sWright^nD^rND^sNicolaides^nK^rND^sGómez^nO^rND^sFigueras^nF^rND^sFernández^nM^rND^sBenassar^nM^rND^sMartinez^nJ^rND^sPuerto^nB^rND^sGratacós^nE^rND^sCafici^nD^rND^sGurgel^nJ^rND^sCosta^nB^rND^sPraciano^nP^rND^sBezerra^nS^rND^sSilva^nF^rND^sKubirlay^nA^rND^sAlper^nH^rND^sSchmidt^nW^rND^sEspinosa^nA^rND^sGallo^nM^rND^sTekay^nA^rND^sCampbell^nS^rND^sFaneite^nP^rND^sHadlock^nFP^rND^sHarrist^nRB^rND^sSharman^nRS^rND^sDeter^nRL^rND^sPark^nSK^rND^sGonzález de Chirivella^nX^rND^sFaneite^nP^rND^sSalazar^nG^rND^sBhide^nA^rND^sAcharya^nG^rND^sBilardo^nCM^rND^sBrezinka^nC^rND^sCafici^nD^rND^sHernández Andrade^nE^rND^sHernández^nE^rND^sBrodszki^nJ^rND^sLingman^nG^rND^sGudmundsson^nS^rND^sMolin^nJ^rND^sMarsal^nK^rND^sPark^nYW^rND^sCho^nJS^rND^sChoi^nHM^rND^sKim^nTY^rND^sLee^nSH^rND^sYu^nJK^rND^sKim^nJW^rND^sPeña^nH^rND^sCamacho^nM^rND^sEscobedo^nF^rND^sErtan^nAK1^rND^sHendrik^nHJ^rND^sTanriverdi^nHA^rND^sBechtold^nM^rND^sSchmidt^nW^rND^sMartin^nA^rND^sBindra^nR^rND^sCurcio^nP^rND^sCicero^nS^rND^sNicolaides^nK^rND^sGómez^nO^rND^sMartínez^nJ^rND^sFigueras^nF^rND^sDel Rio^nM^rND^sBorobio^nV^rND^sPuerto^nB^rND^1A01^nMariangela^sCarta Peña^rND^1A01^nMireya^sGonzález Blanco^rND^1A01^nMariangela^sCarta Peña^rND^1A01^nMireya^sGonzález Blanco^rND^1A01^nMariangela^sCarta Peña^rND^1A01^nMireya^sGonzález Blanco
Función y patrón sexual: características y evolución durante el embarazo
Mariangela Carta Peña 1, Mireya González Blanco 2
1 Médico Especialista en Obstetricia y Ginecología, egresada de la Universidad Central de Venezuela, sede Maternidad Concepción Palacios. 2 Médico Especialista, Jefa del Servicio de Ginecología y Directora del Programa de Especialización en Obstetricia y Ginecología de la Universidad Central de Venezuela, con sede en Maternidad Concepción Palacios.
RESUMEN
Objetivo: Evaluar la función y el patrón sexual en embarazadas que acuden al Servicio Prenatal de la Maternidad Concepción Palacios.
Métodos: Estudio prospectivo, descriptivo, comparativo, transversal, incluyó 345 gestantes, se utilizaron 2 instrumentos: ficha de patrón sexual e Índice de Función Sexual Femenina.
Resultados: La frecuencia global de disfunción sexual fue 63,5 %, en el primer trimestre fue 62,9 %, en el segundo fue 55,9 % y en el tercero fue 75 %. La fase más afectada fue el deseo (67 %), la menos afectada fue la lubricación (33 %), todos los dominios se modificaron con la edad gestacional (P<0,05), menos el dolor P=0,068). La frecuencia de actividad sexual fue 2-3 veces por semana en 34,2 %, el coito fue la actividad sexual predominante (78 %), la orientación sexual que prevaleció fue heterosexual (88,1 %), la posición más practicada es mujer arriba–hombre abajo (46,9 %), la actividad sexual se vio limitada por dificultad de las posiciones sexuales (35,9 %), temor a hacer daño al bebe (25,5 %) y miedo al aborto (15,3 %), la fuente de información sobre la sexualidad durante el embarazo proviene del personal médico (31,9 %) pero 30,1 % refirió no haber recibido ninguna información.
Conclusión: Existe una elevada frecuencia de disfunción sexual durante la gestación, que es mayor en el primer y tercer trimestre. La fase más afectada fue el deseo. El coito es la actividad sexual más practicada. La frecuencia fue 2-3 veces por semana. Entre las gestantes hay una elevada desinformación sobre el tema.
Palabras clave: Función Sexual, Patrón Sexual, Embarazo.
SUMMARY
Objective: to evaluate evolution of the function and sexual pattern in pregnant women attending the Prenatal Service Concepción Palacios Maternity.
Methods: prospective, descriptive, comparative, cross-sectional study, included 345 pregnant women, 2 instruments were used: the sexual pattern and the Female Sexual Function Index.
Results: The global frequency of sexual dysfunction was 63.5%, in the first trimester of pregnancy was 62.9%, in the second was 55.9 % and the third was 75%. The most affected phase was the desire (67%), the lubrication was less affected (33%), all to evaluate criteria were modified with gestational age (P <0.05), except for pain P = 0.068). The frequency of sexual activity was 2-3 times per week in 34.2 %, intercourse was the predominant sexual activity (78%), sexual orientation prevailed that was heterosexual (88.1 %), the most practiced sexual position was women up top – down man (46.9%), sexual activity was limited product difficult sexual positions (35.9%), fear of hurting the baby (25.5%) and fear of abortion (15,3%), the source of information about sexuality during pregnancy comes from the personal physician (31.9%), and women who did not receive any information at all 30.1 %.
Conclusion: There is a high incidence of sexual dysfunction during pregnancy, which is mayor in the first and third trimesters. The most affected phase desire phase. Intercourse is practiced more sexual activity. The frequency was 2-3 times per week. There is high misinformation about this topic among pregnant.
Key words: Sexual function, Sexual pattern, pregnancy.
INTRODUCCIÓN
La sexualidad es uno de los componentes más complejos pero básico del comportamiento humano. El ser humano a lo largo de la vida experimenta su sexualidad a través de diferentes comportamientos; teniendo en cuenta que el impulso sexual es biológico pero su expresión es definida por diversos aspectos psicológicos, sociales y culturales. Las relaciones sexuales satisfactorias contribuyen a una vivencia saludable de la sexualidad en su sentido más amplio, ayudando a mantener el equilibrio psicofísico del individuo y, por tanto, su estado general de salud (1).
La consulta ginecológica es un ámbito propicio para que las mujeres expresen sus dudas o problemas con respecto a la sexualidad. Con el pasar de los años, existe más conciencia y conocimiento de la importancia de la salud sexual para el bienestar personal y social, sin embargo, es posible darse cuenta que, como profesionales en esta área, se acostumbra tratar temas de anticoncepción, enfermedades de transmisión sexual e infertilidad y se deja de lado lo que respecta a la satisfacción y placer sexual, y esto se debe a diferentes razones, tales como tabúes, pudor y desconocimiento del tema (2). Durante el embarazo, tanto el deseo sexual como la frecuencia del coito disminuyen, y existe cierta preferencia por algunas prácticas sexuales; estos cambios son generados por ciertos mitos sobre la afectación del embarazo durante el acto sexual, el cansancio físico y el hecho de sentirse menos atractiva por parte de la pareja (1).
La sexualidad es una parte integral de la personalidad de todo ser humano. Su desarrollo pleno depende de la satisfacción de las necesidades humanas básicas como el deseo de contacto, intimidad, expresión emocional, placer y amor. Los derechos sexuales son derechos humanos universales. La salud sexual debe ser un derecho humano básico para alcanzar una sexualidad saludable. La atención médica especializada de la salud sexual, tiene como objetivo prevenir y tratar todos los problemas, preocupaciones y trastornos sexuales (3).
La disfunción sexual es un trastorno que afecta la sexualidad en su sentido más pleno, tanto de hombres como mujeres, por tanto, constituye un problema de salud que, si bien no pone en peligro la vida de las personas, afecta de forma directa la salud física, mental y distorsiona el equilibrio familiar, laboral y social. Sus determinantes pueden encontrarse en la naturaleza humana, desde la constitución biológica, con las consecuencias que sobre la misma producen muchas enfermedades; la naturaleza psicológica, que reclama integración armónica de las potencialidades eróticas dentro de la totalidad del ser; la naturaleza del vínculo de pareja, el ambiente social y cultural ante el erotismo, los aprendizajes, las vivencias de la sexualidad y la afectividad desde los inicios de la vida de las personas (4).
El desarrollo alcanzado por la sexología ha permitido tener más elementos para enfrentar la disfunción sexual de hombres y mujeres (5). Hoy día, son abundantes las publicaciones que hacen referencia a la sexualidad, sin embargo, siguen existiendo determinados aspectos en los que la información de la que se dispone aún es escasa y la concepción generalizada en estos casos resulta preocupante y difusa. Un claro ejemplo de ello tiene que ver con la sexualidad durante el periodo gestacional. El embarazo sigue siendo una etapa en la que la sexualidad parece que no existiera, no se habla ni se informa, y ello genera muchas veces incertidumbre y ansiedad, también por no saber dónde preguntar e informarse (6,7).
El periodo que abarca el embarazo resulta una de las etapas más importantes para toda mujer, durante el que se produce una serie de cambios que repercutirán en su vida y, por lo tanto, en su sexualidad. El embarazo es una etapa en la que aparecen conflictos personales y de pareja porque emergen nuevos sentimientos y emociones, a veces ambivalentes, tras la espera y llegada de un nuevo miembro a la familia. Supone una situación crítica para la mujer desde el punto de vista físico, psíquico y afectivo (8,9).
Los cambios en el comportamiento sexual son frecuentes y comienzan poco después de la concepción. La dirección e intensidad de estos cambios están sujetas a grandes variaciones individuales más que a una regularidad determinada. Es probable que dichas variaciones se encuentren relacionadas con factores tales como el desarrollo psicosexual de la mujer, su personalidad, los antecedentes personales, el impacto del embarazo en su salud y el tipo de relación con su pareja (10).
Durante el embarazo, el deseo sexual de la pareja puede aumentar, disminuir y, a veces, permanecer impasible. A lo largo del tiempo, se ha visto que en la mujer embarazada existen ciertos tabúes en cuanto a la actividad sexual durante el embarazo, y las embarazadas suelen decir que no están complacidas con la información que reciben de parte del personal de salud, quienes juegan un papel importante en el desempeño de estas funciones.
Masters y col. (11), fueron pioneros en realizar estudios con una observación sistematizada y directa de la conducta sexual de las parejas. Así generaron el modelo de la respuesta sexual humana, que dividieron en cinco fases: deseo, excitación, meseta, orgasmo y resolución. La definición de estas fases, llevó a delimitar, describir y estudiar las disfunciones sexuales, de lo cual derivó su clasificación. Para el estudio de la función sexual femenina, Blumel y col. (12) realizaron un estudio con el fin de aplicar y validar el cuestionario del Índice de Función Sexual Femenino, llegaron a la conclusión de que este es un instrumento sencillo de aplicar, con propiedades psicométricas adecuadas, que permite evaluar la sexualidad en diferentes etapas de la vida y que es adecuado para estudios epidemiológicos y clínicos.
En su investigación, Brtnicka y col. (13), determinaron que existen disfunciones sexuales durante el embarazo, las cuales son a menudo guiadas por el miedo de hacer daño al feto. Los hombres también reportan miedo de herir a la mujer durante el embarazo y las mujeres tienen miedo a la insuficiente satisfacción por parte de su pareja. Estos autores describen que existe desinterés de los encargados de atención prenatal y postnatal en los temas de la sexualidad. Serati y col. (14), realizaron un metanálisis con el fin de evaluar la evidencia disponible y definir los conocimientos actuales sobre la función sexual femenina durante el embarazo y después del parto; encontraron que existe una falta de información adecuada sobre la función sexual durante el embarazo. El factor más relevante, responsable de evitar la actividad sexual durante el embarazo, era la preocupación acerca de los posibles resultados obstétricos adversos. Debido a esto, concluyeron que las parejas deben recibir información sobre sexualidad.
Por otro lado, Lee y col. (15), en Taiwan, realizaron una investigación donde demostraron que existía una disminución de la frecuencia del coito entre el primer y tercer trimestre, la posición sexual más común para la mujer embarazada fue el hombre en la parte superior cara a cara y estas posiciones no cambiaron significativamente durante los diferentes trimestres. Así mismo Corbacioglu y col. (16), en 2012, a través de unos cuestionarios, pudieron explicar cómo la función sexual femenina se ve altamente influenciada por los cambios físicos y emocionales; aunque se ve mayormente afectada durante el tercer trimestre, se ha demostrado un descenso de la frecuencia del coito y del deseo sexual en el primer trimestre dado por la conciencia del embarazo más que por factores obstétricos o sociodemográficos. Estos autores, en 2013, demostraron que el tercer trimestre es una variable independiente donde disminuyó la frecuencia de la actividad sexual durante el embarazo, además se dieron cuenta que el asesoramiento sobre la salud sexual durante el embarazo no es frecuente en la práctica clínica y recomiendan que este tipo de asesoramiento ocurra durante el control prenatal (17). Otro estudio a cargo de Aribi y col (18), describió que las tres principales causas de la disminución del interés y la actividad sexual fueron: los síntomas físicos (83 %), el miedo a hacer daño al feto (66,7 %) y el deseo sexual hipoactivo (33,4 %).
Por su parte, Prado y col. (19) encontraron que en el embarazo disminuye la satisfacción sexual de la mujer durante el primer trimestre del embarazo y esto se debe a procesos de adaptación que se manifiestan por cambios en el humor, pero esto cambia en el segundo trimestre, cuando la mujer embarazada comienza a sentirse mejor, experimentando así un aumento en la satisfacción sexual. Rodríguez y col. (9) demostraron que el interés sexual en la embarazada se ve disminuido con el embarazo. En general, la frecuencia de coitos a la semana también se encuentra disminuida. Más de la mitad de las encuestadas encontraban su vida sexual satisfactoria, sin olvidar que una pequeña parte de ellas aumenta su interés y mejora su vida sexual. Prácticamente todas las encuestadas tenían frecuentes encuentros sexuales no genitales, y estos eran muy deseados.
Hanafy y col. (20) concluyeron que la disfunción sexual se presenta durante todo el embarazo, 68 % en el primer trimestre, disminuye a 51 % en el segundo trimestre y aumenta al 72 % en el tercer trimestre. En esa serie, el deseo sexual se redujo en el primer trimestre, fue variable en el segundo trimestre y disminuyó al final del tercer trimestre. La satisfacción sexual disminuyó significativamente en el primer trimestre, en comparación con el segundo y el tercero. Las puntuaciones de los dominios de excitación, lubricación y orgasmo se redujeron significativamente en el tercer trimestre y el dolor se incrementó en el segundo trimestre en comparación con el primer y tercer trimestres. En relación a la frecuencia, Balestena y col. (21) obtuvieron una mediana de 2, 3 y 2 coitos semanales según los trimestres del embarazo; en cuanto al deseo sexual, la excitación sexual, el orgasmo y la satisfacción sexual tuvieron una relación altamente significativa con el primero y tercer trimestre de la gestación. Concluyeron que el embarazo es un proceso que lleva aparejado un trastorno en la sexualidad de la mujer.
Por ultimo Gałązka y col. (22) se dieron cuenta de que los cambios fisiológicos durante cada trimestre del embarazo, tienen un importante impacto sobre el comportamiento sexual femenino, los parámetros estudiados fueron: deseo, excitación, lubricación, orgasmo, dolor y satisfacción, los cuales disminuyeron considerablemente durante el embarazo. A medida que progresaba el embarazo, la función y actividad sexual disminuyeron. Otro de los aspectos que influyó notablemente la calidad de la vida sexual durante el embarazo, fue la insatisfacción por parte de la pareja.
La sexualidad es una dimensión humana esencial. De acuerdo con la Organización Mundial de la Salud (OMS), la sexualidad constituye un aspecto central del ser humano, presente a lo largo de toda su vida. Abarca el sexo, el erotismo, el placer, la intimidad, la reproducción y la orientación sexual. La salud sexual es definida por la OMS como un estado de bienestar físico, emocional, mental y social relacionado con la sexualidad y no es solamente la ausencia de enfermedad, disfunción o incapacidad. Entraña la capacidad de disfrutar de una vida sexual satisfactoria y segura y de procrear, de igual forma, la libertad para decidir hacerlo o no hacerlo, cuándo y con qué frecuencia (23, 24). El sexo se define como la condición orgánica que diferencia al varón de la hembra (23). El patrón sexual, se refiere al conjunto de características y manifestaciones que, en los últimos 5 años, ha presentado regularmente un individuo, que debe tener veinticinco años o más, en relación con su sexo y su función sexual. Este va a estar integrado por el sexo y su función. La función sexual está definida por las actividades propias del sexo, se refiere al conjunto de fases que excitan a una acción simultánea, cuando se sitúan cambios en el ambiente interno o externo del organismo, el cual conlleva a una ejecución de una actividad sexual accesible a la observación y al control e implica un proceso de activación (25). La función sexual durante el embarazo implica cambios en los factores físicos, hormonales, psicológicos, emocionales y culturales, que guardan una estrecha relación con el estado de salud y con la calidad de vida de la pareja.
El término respuesta sexual (RS) designa al conjunto de cambios biológicos, psicológicos, afectivos y socioculturales que acompañan al ejercicio de la función sexual. Los factores biológicos de la respuesta sexual actúan a nivel del sistema nervioso central y periférico, el aparato cardiovascular y el sistema neuromuscular. Se producen cambios en los tejidos y en los órganos genitales y extragenitales (26). Los cambios psicológicos incluyen alteraciones del estado de conciencia y percepciones sensoriales generalmente muy placenteras, lo que suele reforzar poderosamente la motivación para repetir la experiencia (27), no obstante, los cambios más visibles y específicos tienen lugar en los genitales (26).
La RS se describe como una secuencia cíclica de etapas o fases características: deseo, excitación, meseta, orgasmo y resolución. Se facilitan, refuerzan o inhiben entre sí. La presentación de una determinada fase no requiere necesariamente la precedente (8, 26).
Se define deseo, libido o apetito sexual, al estado mental de atención a estímulos eróticos y motivación para responder a ellos y gratificarse, puede o no preceder al ejercicio de la función sexual (26). Como se ha dicho anteriormente, durante la gestación el apetito sexual puede aumentar, disminuir y, a veces, permanecer impasible.
Durante la excitación se producen cambios físicos por un considerable aumento del aporte sanguíneo a los órganos genitales, debido a su vasodilatación. Ello se traduce en la erección y crecimiento del clítoris, la vasocongestión de la vagina y el conjunto de la pirámide vulvar (clítoris, bulbos vestibulares, labios menores y porciones distales de la vagina y la uretra). Ello determina el aumento de tamaño y dilatación de la vulva, así como la lubricación vaginal, para facilitar la penetración y los movimientos del pene dentro de la vagina, así como neutralizar el pH vaginal, lo que facilitaría la supervivencia de los espermatozoides que allí se depositasen (26). Otro fenómeno es el de la elevación del útero y el estiramiento hacia arriba de la pared posterior de la vagina, que se observa tanto si hay penetración como si la excitación se produce por estimulación del clítoris. Esto ocurre para dejar el espacio necesario al pene (26, 27). La principal diferencia en esta etapa entre la mujer embarazada y la no gestante, es que la vasocongestión de la porción externa de la vagina resulta francamente más pronunciada durante el embarazo. La reducción de la abertura vaginal se vuelve cada vez más pronunciada a medida que avanza la gestación, hasta tal punto que algunas parejas refieren imposibilidad para la penetración por falta de espacio o porque la vagina se encuentra demasiado cerrada durante el coito. En la gestación existe una congestión venosa mamaria aumentada debida probablemente a cambios hormonales, que provoca en las mamas cierta irritación y dolor, sobre todo en el primer trimestre y en las mujeres que cursan su primera gestación. Algo similar sucede con la lubricación vaginal, que también es al principio incómoda y se encuentra aumentada durante la gestación (26).
Los cambios físicos que ocurren durante la meseta son una continuación e intensificación de los de la fase de excitación. Las mamas aumentan su tamaño, así como las areolas. El tercio externo de la vagina muestra una congestión sanguínea marcada que produce disminución en su diámetro, formándose así lo que Masters y Johnson (28) denominan plataforma orgásmica. El clítoris se retrae, los músculos de todo el cuerpo se tensan, las pupilas se dilatan y se produce una sensación de vacío a medida que el orgasmo se avecina (8).
El orgasmo se logra a través de la estimulación directa o indirecta del clítoris. Durante el orgasmo, la parte más externa y congestiva de la vagina se contrae fuertemente y a intervalos regulares de 0,8 segundos. El número de contracciones de la plataforma orgásmica varía de mujer a mujer y en cada experiencia individual. El útero también se contrae a intervalos regulares y durante pocos segundos. Se observa también una mayor retracción del clítoris, el cierre del esfínter anal, la retracción de los dedos y un aumento de la frecuencia cardíaca y respiratoria. La duración del orgasmo suele ser de 10-15 segundos y durante el mismo no es infrecuente la pérdida de orina de la embarazada, como la eyección láctea en la puérpera que amamanta (8). Masters y Johnson (28) observaron una diferencia muy importante en el orgasmo de la mujer embarazada en el último trimestre y, sobre todo, en las últimas cuatro semanas: en lugar de las contracciones orgásmicas normales, el músculo uterino se contrae de manera espástica y continúa sin relajarse. La duración de estas contracciones es de 1 minuto y se pueden observar hasta 30 minutos después del orgasmo. También constataron un enlentecimiento de la frecuencia cardiaca fetal sin signos de sufrimiento (8). Otros autores han registrado cambio en la frecuencia cardiaca fetal y observaron modificaciones compatibles con una alteración de la salud fetal (26).
La contractilidad uterina postcoital o postorgásmica suele producir en las mujeres miedo a un parto prematuro o a la rotura de las membranas, en tal grado que esta sensación suele ser causa de disminución de la frecuencia coital (26). Está comprobado que el semen contiene prostaglandinas que favorecen la contractilidad del miometrio, el borramiento del cuello uterino y la dilatación cervical. Esto no significa que el ejercicio de la función sexual vaya a desencadenar el parto, pero si puede llegar a acelerarlo cuando la embarazada está cerca de la fecha posible de parto (29).
Después del orgasmo, se observa un momento de calma y relajación. La fase de resolución consiste en el retorno a los valores basales iniciales, con reducción de la vasocongestión pélvica y relajación muscular. Se acompaña de un periodo refractario, durante el que es difícil inducir una nueva RS. Dura varios minutos y se alarga progresivamente con la edad (27). Esta etapa, en la mujer embarazada, es molesta dado que la congestión pelviana disminuye de manera muy lenta. En algunas mujeres, la congestión y la vascularización son tan marcadas que les impide lograr el orgasmo, aumentando así la tensión sexual y la frustración. La congestión pelviana podría justificar el dolor y la falta de confort durante las relaciones sexuales, constituyendo la causa más importante de disminución de la frecuencia coital. Por otro lado, sin embargo, la gran cantidad de hormonas sintetizadas por la placenta, probablemente aumente el flujo y la lubricación vaginal. Estos cambios, sin duda favorables, facilitan la función sexual de la pareja (26).
No se puede olvidar que estos no son los únicos cambios que se dan en la RS, sino que ocurren reacciones tanto genitales como extragenitales a lo largo de las diversas fases. La función sexual se acompaña también de cambios somáticos generales y psíquicos, a veces, muy intensos. Durante la excitación se produce un aumento progresivo de la presión arterial, la frecuencia cardíaca y la ventilación pulmonar, hasta alcanzar su máximo en el orgasmo y decae rápidamente después de este. También suele producirse una reacción de sudoración de intensidad variable. La utilidad fisiológica consiste en aumentar el aporte de sangre y oxígeno a los órganos genitales o disipar calor (27).
Hay importantes cambios psíquicos y sensaciones usualmente muy placenteras, de gran variabilidad entre los distintos individuos y según las situaciones. Se producen alteraciones de la percepción sensorial, y es característica la elevación de los umbrales de percepción dolorosa en diversas partes del cuerpo que ocurre durante la excitación sexual intensa y, especialmente, en el orgasmo. Durante el mismo, se altera también la percepción temporal: los sujetos suelen describir su percepción subjetiva de la duración del orgasmo como bastante inferior (a veces, la mitad) a la registrada simultáneamente. La experiencia orgásmica conlleva, pues, una alteración característica del estado de conciencia, descrita como una desconexión temporal con la realidad externa inmediata, que puede llegar, en casos extremos, hasta la pérdida de conciencia (26).
En resumen, los principales cambios que ocurren con frecuencia durante el embarazo e influyen de alguna manera en el comportamiento sexual, se pueden agrupar y diferenciar en los tres trimestres de gestación. (8, 26)
En los primeros tres meses de gestación comienza una etapa de adaptación a los cambios que se sucederán a lo largo del embarazo y a asumir el nuevo rol de padres. Los cambios hormonales, intensos y rápidos, provocan un estado de labilidad emocional en la gestante, por lo que demandarán mayor atención y demostración de afecto por parte de su pareja. Debe tenerse presente que muchas mujeres requerirán realizar un mayor esfuerzo para mantener el ritmo sexual usual, como consecuencia de la aparición de náuseas, vómitos, cansancio y otras molestias. El deseo sexual presenta variabilidad para cada caso. No hay uniformidad de criterios entre los diferentes autores; el primer trimestre del embarazo puede acompañarse de una disminución de la actividad sexual y una disminución del deseo sexual por parte de la gestante, o puede ocurrir todo lo contrario. Como se señaló anteriormente, un síntoma característico es el aumento en la sensibilidad de las mamas, con aumento de su tamaño y tumefacción de las areolas y pezones. Este aumento en la sensibilidad, muchas veces hace que un estímulo que antes resultaba placentero, ahora sea una molestia. Para evitar esto, es recomendable mayor suavidad en las caricias durante esta etapa del embarazo. Muchas mujeres manifiestan que con el tiempo la sensibilidad continúa, no así el dolor, por lo que la excitación es mayor. Con respecto al orgasmo, en la mayoría de las mujeres, la frecuencia y la intensidad se mantienen sin grandes cambios (30).
En el segundo trimestre suele aumentar el deseo sexual y la respuesta física, porque existe un mayor bienestar por la disminución o desaparición de las molestias físicas, y la pareja se ha adaptado al embarazo, desapareciendo muchos de los temores iniciales. Algunas mujeres, anteriormente anorgásmicas, tienen por primera vez un orgasmo durante este periodo. Para el último trimestre, la mayoría de las mujeres experimenta una disminución o ausencia del deseo sexual, y una marcada disminución en la actividad coital debido a la incomodidad producida por la gestación avanzada, y otras muchas veces, por miedo a desencadenar el parto (30).
La excitación comienza a disminuir progresivamente a medida que progresa el embarazo, debido a la disminución de las sensaciones placenteras que son provocadas por las congestiones de la vagina, vulva y clítoris a raíz del aumento de tamaño del feto y la posición de encaje para el parto. La frecuencia y la intensidad del orgasmo también disminuyen a medida que transcurre el embarazo. Si bien aumentan la necesidad de mimos, caricias y cuidados, al sentirse más inseguras y frágiles (31).
El DSM-IV (Diagnostic and Statistical Manual of Mental Disorders) definió, en 1994, a las disfunciones sexuales (DS) como las alteraciones en el deseo sexual, así como cambios en la psicofisiología, que caracterizan el ciclo de respuesta sexual y que causan disturbios y dificultades interpersonales. En 1992, la OMS incluyó en la clasificación de enfermedades ICD-10 (International Consensus Development), la definición de las DS, se trata de la dificultad o imposibilidad del individuo de participar en las relaciones sexuales tal como lo desea (32). Las disfunciones sexuales pueden clasificarse como trastornos relacionados con cada fase particular del ciclo de respuesta sexual y trastornos dolorosos. Las disfunciones sexuales pueden ser síntoma de problemas biológicos o de conflictos intrapsíquicos o interpersonales o una combinación de estos factores. Pueden verse afectadas por cualquier tipo de estrés, por trastornos emocionales, o por desinformación sobre la función y fisiología sexual. La disfunción sexual puede ser de toda la vida o adquirida, generalizada o situacional (limitada a una pareja o situación) y progresiva. Se clasifican como: trastornos del apetito sexual, trastorno de la excitación sexual, trastornos orgásmicos y trastornos por dolores sexuales (32). Cada una de estas alteraciones puede estar presente en el ser humano por múltiples factores, etapas y situaciones a lo largo de la vida, siendo el embarazo una etapa de gran importancia en la mujer y con ciertas repercusiones en su sexualidad.
Para evaluar la función sexual en la mujer se utiliza un instrumento que cumple la clasificación del International Consensus Development Conference of Female Sexual Dysfunction, el cual es autoadministrado, simple, y confiable para evaluar la función sexual femenina en un amplio rango de edad. Consta de 19 preguntas de selección múltiple y se agrupa en seis dominios: deseo, excitación, lubricación, orgasmo, satisfacción y dolor; cada pregunta tiene 5 o 6 opciones, asignándoles un puntaje que va de 0 a 5. El puntaje de cada dominio se multiplica por un factor y el resultado final es la suma aritmética de los dominios. A mayor puntaje, mejor sexualidad. El punto de corte para definir la disfunción sexual es un puntaje menor de 26,55 y para definir alteración en algún dominio se considera un puntaje menor a 3,66 (12, 33).
El ser biológico tiene una condición, su variante fisiológica del sexo y su función y una capacidad: la de aprender a discriminar. El patrón sexual está caracterizado por: el sexo del individuo, la función sexual del individuo: con cuál sexo se funciona, con qué métodos, con cuánta frecuencia, tipo de ciclo de respuesta sexual, tiempo de funcionamiento. La conjunción de estas dos características, su interacción e integración, serán claves para el establecimiento del patrón sexual; para la adquisición del mismo se propusieron dos postulados fundamentales: 1) Postulado del desarrollo sexual funcional, el cual consta de 3 periodos, el periodo indiferenciado que abarca desde el momento del nacimiento, hasta los 8 a 12 años aproximadamente, donde se establecen diferencias morfológicas entre el hombre y la mujer, hay similitud del funcionamiento de la unidad situación/estímulo sexual, respuesta sexual, funcionamiento de la unidad de acuerdo a la generación de estímulos y el individuo responde ante estímulos sexuales procedentes de diferentes fuentes. Aparece el comportamiento del individuo a través de eventos erectivos, lubricación vaginal, masturbación, estadios placenteros provenientes de diferentes fuentes: madre, padre, hermanos, amigos. Después de los dos años existe curiosidad sexual, se inicia la identidad sexual. A partir de los 3 años se adquiere la identidad de género, a través del aprendizaje social y la norma sociocultural. De 4 a 5 años, curiosidad sexual, se aprende el aseo ano genital. De 6 a 7 años, el individuo evidencia diferencias anatómicas, observación de genitales, juegos sexuales y eróticos. A partir de los 7 años inicia la escolarización (25).
El periodo de transición abarca aproximadamente, desde los 08 a 12 años hasta los 18 a 21 años. Se caracteriza porque el ser biológico emite, en lo referente a la esfera sexual, respuestas que reflejan los requerimientos e impactos del entorno sociocultural, se reflejan conductas de influencia condicionada por el ambiente y la norma sociocultural, sociedad o grupo donde se desenvuelve, se inician los procesos de discriminación de estímulos y el individuo se ve obligado a aprender el patrón sexual por ensayo y error (25).
Así puede responder a situaciones/estímulos sexuales de naturaleza heterosexual, homosexual, autoerótica, fetichista, zoofílica, voyeurista, etc.; en consecuencia, la masturbación, experiencias homosexuales, heterosexuales, fetichistas, zoofílicas, etc, observadas durante este periodo de transición, son expresión del método de ensayo y error que es requerido por todo proceso discriminativo. Ello intenta llenar las exigencias del entorno sociocultural: la función sexual debe ejecutarse con seres del sexo opuesto; que posea ciertas características; que los aplique con cierta metodología y a una frecuencia dada. Igualmente conduce al aprendizaje de un tiempo de funcionamiento y de un tipo de ciclo de respuesta sexual (25).
El periodo diferenciado abarca desde los 18-21 años en adelante. Se caracteriza porque el ser humano, suele haber completado su patrón sexual ajustándolo, por lo general, a las exigencias del entorno sociocultural. Ello no significa que la variante fisiológica del sexo y su función se hayan extinguido, sino que se ha limitado, a través de la discriminación, en beneficio de la aceptación social y para evitar los conflictos socioculturales. En conclusión, la interacción ser humano – sociocultura, durante los diferentes periodos, explica cuando se adquiere el patrón sexual (25).
El segundo postulado es el de la integración de la función sexual, este explica como el individuo adquiere el patrón de la conducta sexual, considerando el resultado de la variabilidad fisiológica, de procesos de aprendizaje, especialmente de tipo discriminativo y de las normas socioculturales. Los patrones pueden ser socialmente aceptados: heterosexual, homosexual, bisexual, y socialmente rechazados: zoofílico, fetichista, pedofilica, entre otros. La adquisición de cualquier patrón no implica alteración fisiológica, sino violación eventual de las normas socio/culturales establecidas; será responsabilidad de cada individuo evaluar su propia conducta y pesar sus consecuencias (25).
El presente estudio se realizó con el objetivo de evaluar la función y el patrón sexual en las mujeres embarazadas que acudieron al Servicio Prenatal de la Maternidad Concepción Palacios en el periodo marzo 2015 y febrero 2016.
MÉTODOS
Se llevó a cabo un estudio prospectivo, descriptivo, comparativo, de corte transversal. Incluyó una muestra probabilística de 345 gestantes con actividad sexual en las últimas 4 semanas, con pareja estable. Se excluyeron las pacientes con embarazos de alto riesgo, tales como amenaza de parto pretérmino y hemorragias durante la gestación actual y las gestantes analfabetas quienes no podían responder el cuestionario. Todas las participantes firmaron un formulario de consentimiento informado. A continuación, de manera individual y confidencial, se les realizó una entrevista, en la cual se utilizaron dos instrumentos. El primero de ellos fue la ficha de patrón sexual la cual consta de 6 preguntas de selección simple, que incluyen la orientación sexual, el tipo de actividad sexual que se practica durante el embarazo, la frecuencia de actividad sexual, las razones que dificultan la actividad sexual durante el embarazo, las posiciones más utilizadas y la fuente de información sobre el tema. El segundo es el Índice de Función Sexual Femenina (IFSF) (12, 33). Una vez aplicados los instrumentos, se dividieron las pacientes según la edad gestacional, para comparar las variables de estudio por trimestre.
Las comparaciones de las variables continuas entre grupos según semanas de gestación, se basaron en la prueba ANOVA de una vía, en el caso de las variables nominales, se aplicó la prueba chi-cuadrado de Pearson. Se consideró un valor significativo de contraste si p < 0,05. Los datos fueron analizados con JMP-SAS 11.
RESULTADOS
Fueron entrevistadas 345 gestantes, de ellas, 219 tenían disfunción sexual según el Índice de Función Sexual Femenina, lo que representa una frecuencia de 63,5 %. El promedio de puntuación obtenida fue de 23,06 ± 7,58.
Hubo 89 mujeres que cursaban el primer trimestre del embarazo, 152 el segundo y 104 el tercer trimestre. La puntuación obtenida fue de 23,31 ± 7,06 en el primer trimestre, 23,96 ± 8,31 en el segundo trimestre y 21,51 ± 6,65 en el tercero (P=0,002). La frecuencia de disfunción sexual por trimestre fue 62,9 % (56 mujeres), 55,9 % (85 mujeres) y 75 % (78 mujeres) respectivamente.
Las puntuaciones por dominio se aprecian en la tabla 1. En el dominio deseo se obtuvo 3,46 ± 1,25 y en el dominio satisfacción se obtuvo 4,19 ± 1,74. En 231 gestantes (67 %) se vio afectada la fase del deseo; 192 (55,7 %) resultaron con disfunción en la fase de excitación y 154 (44,6 %) tenían disfunción por dolor. La tabla 2 presenta la distribución de las gestantes con disfunción según la fase de la respuesta sexual más afectada. La tabla 3 muestra los promedios de puntuación por dominio según la edad gestacional. Las diferencias entre los tres trimestres fueron significativas en todos los dominios.
Las fases de la función sexual que se afectan según la edad gestacional están representadas en la tabla 4. En los tres trimestres el área más afectada fue el deseo, 71,9 % en el primer trimestre, 55,9 % en el segundo y 78,8 % en el tercero. El área menos afectada en el primer trimestre fue la lubricación (27 % de las pacientes en este trimestre), en el segundo trimestre fueron la satisfacción (25 %) y la lubricación (25,7 %) y en el tercer trimestre el dolor (42,3 %). En cuanto al deseo, excitación, lubricación, orgasmo y satisfacción, la afectación fue menor en el segundo trimestre (P < 0,05), el dolor no mostró diferencias significativas en relación a la edad gestacional (P=0,068).
En relación al patrón sexual, en la tabla 5 se presenta la distribución de las 345 gestantes entrevistadas según la frecuencia de actividad sexual y la edad gestacional. Ciento dieciocho mujeres (34,2 %) refirieron actividad sexual durante la gestación con una frecuencia de 2-3 veces por semana, 110 mujeres (31,8 %) 1 vez por semana, 81 mujeres (23,4 %) menos de 1 vez por semana y 36 (10,4 %) más de 3 veces por semana. Se evidenció un aumento de la frecuencia de actividad sexual durante el segundo trimestre cuando 73 pacientes (48 %) refirieron una frecuencia de 2 a 3 veces por semana, en el 3er trimestre solo 28,8 % reportó esta frecuencia (P=0,001).
Doscientas sesenta y nueve mujeres (78,0 %), seleccionaron el coito como tipo de actividad sexual que desarrolla durante la gestación. La distribución de los otros tipos aparece en la tabla 6. Hubo 304 gestantes heterosexuales (88,1 %), 32 homosexuales (9,3 %) y 9 bisexuales (2,6 %). La actividad sexual que predominó en los tres grupos fue el coito con penetración vaginal, reportado por 245 heterosexuales (80,6 % del grupo), 18 homosexuales (56,3 %) y 6 bisexuales (66,7 %), las diferencias entre los grupos fueron estadísticamente significativas (P= 0,001) (Tabla 7).
Las posiciones adoptadas durante la actividad sexual con más frecuencia fueron mujer arriba–hombre abajo (162 gestantes, 46,9 %), y hombre arriba–mujer abajo (104 mujeres, 30,1 %), 46 gestantes (13,3 %) utilizaron la posición de lado y 33 (9,6 %) refirieron otras posiciones.
Las razones que limitan la actividad sexual se presentan en la tabla 8. Predominaron la dificultad de las posiciones (124 mujeres, 35,9 %) y el temor a hacer daño al bebé (88 mujeres, 25,5 %). Al distribuir las actividades según el trimestre de la gestación, se obtuvo que en el 1er trimestre 29 pacientes (32 %) refirieron miedo al aborto y 17 (19,1 %) dificultad con las posiciones y temor a hacer daño al bebe. Sesenta y seis mujeres en el segundo trimestre (43,3 %) y 41 en el tercero (39,4 %) señalaron dificultad con las posiciones (P=0,001) (Tabla 9).
Ciento diez mujeres (31,9 %) dijeron haber recibido información sobre sexualidad de parte de personal médico, 82 (23,8 %) a través de los medios de comunicación, 23 (6,7 %) obtuvieron información de amigos y 26 (7,5 %) refirieron otras fuentes. Ciento cuatro mujeres (30,1 %) señalaron no haber recibido nunca información sobre sexualidad.
DISCUSIÓN
Durante el embarazo, y a medida que este avanza, la función sexual puede reducirse y la respuesta sexual verse afectada. El embarazo constituye un periodo crucial en la vida de la pareja. Los cambios que se producen en la mujer gestante alteran y modifican todo su ser bio-psico-sexual, lo cual trae cambios en su sexualidad. Durante la gestación es necesario e importante tener en cuenta aspectos que se relacionan con la vida sexual previa de la pareja, como son: fuente de información sobre la sexualidad, presencia de alteraciones en la respuesta sexual, frecuencia del coito, entre otras, porque estos factores pueden redundar en una modificación sustancial de la sexualidad en el embarazo y especialmente en lo que concierne a una adecuada función sexual (31).
Tras los resultados obtenidos en este estudio se puede afirmar que las relaciones sexuales de la mujer durante el embarazo experimentan una alteración, esta es la conclusión a la que llegan múltiples autores (33 - 36). La puntuación media obtenida en el IFSF fue de 23,06±7,58. Según Wiegel y col. (36), se considera disfunción sexual cada vez que se obtenga una puntuación inferior a 26,55. Estas puntuaciones se asociaron a una elevada frecuencia de disfunción sexual.En esta serie un 63,5 % de las gestantes entrevistadas resultó tener disfunción sexual. Estos hallazgos son consistentes con los presentados por Hanafy y col. (20), quienes obtuvieron una frecuencia de disfunción sexual de 51 % y 72 % según el trimestre, con una media de 63,6 %. Gałązka y col. (22), en 2015, señalaron que a medida que progresaba el embarazo, la función y actividad sexual disminuían; en concordancia con lo descrito por estos autores, las puntuaciones obtenidas en esta serie fueron 23,31 ± 7,06 en el primer trimestre, 23,96 ± 8,31 en el segundo y 21,51 ± 6,65 en el tercero, observándose un leve aumento en el segundo trimestre y un deterioro marcado hacia el final del embarazo.
Esta evolución se observa mejor cuando se evalúa la frecuencia de disfunción sexual derivada de estas puntuaciones. De las 219 pacientes con disfunción sexual, el problema se presentó en 62,9 % de las que cursaban el primer trimestre del embarazo, 55,9 % en el segundo trimestre y 75 % durante el tercer trimestre. El predominio de la frecuencia de disfunción sexual en el primer y tercer trimestres puede estar relacionado a los cambios físicos y emocionales de las gestantes que producen malestar general, presencia de náuseas y vómitos, vasocongestión mamaria, hipersensibilidad, miedo a perder la gestación y ansiedad de la mujer y su pareja, lo que limitaría de cierta manera el contacto físico (37). Una vez alcanzado el segundo trimestre la mujer se siente más segura y confiada en relación a la evolución del embarazo, se adapta mejor a los cambios fisiológicos del mismo, lo que mejora su desempeño sexual. Ya en el tercer trimestre, el aumento del tamaño abdominal, que dificulta ciertas posiciones sexuales, la apariencia física, la inseguridad por parte de ambos miembros de la pareja, por temor ante un eventual parto pretérmino, generan nuevamente un aumento de la disfunción sexual en esta etapa. Resultados similares obtuvieron Hanafy y col. (20), quienes concluyeron que la incidencia de la disfunción sexual se ve afectada durante todo el embarazo. Gałązka y col. (22), en 2015, describieron que todas las fases disminuyeron significativamente con la progresión del embarazo. Según estos autores, el deseo sexual cambió en forma estadísticamente significativa en los tres trimestres en comparación a la situación previa al inicio del embarazo.
Para evaluar la fase más afectada se incluyeron las 345 gestantes entrevistadas a pesar que solo 219 tenían disfunción sexual al considerar la puntuación total del IFSF (menor de 26,55 puntos en el IFSF) porque un número importante de gestantes reportaron alteraciones en algunas fases (puntuaciones menores a 3,66) pero con puntuaciones generales mayores de 26,55 puntos.
La fase más afectada fue el deseo (67 %), con una puntuación promedio general de 3,46 ± 1,25, pero hubo una mejoría en el segundo trimestre para luego incrementarse la proporción de gestantes con disfunción sexual en este dominio en el tercer trimestre. Esta evolución se observa en las medias de puntuaciones, las cuales suben en el segundo trimestre y luego caen en el tercero. Similares hallazgos se observaron en los dominios excitación y satisfacción. Estas modificaciones con respecto a la edad gestacional discriminadas por dominio siguen el mismo patrón de la disfunción sexual que se presentó en general y probablemente se puedan relacionar con las mismas razones ya descritas. Los dominios lubricación y orgasmo, se afectaron predominantemente en el tercer trimestre. Se ha descrito que la gran cantidad de hormonas sintetizadas por la placenta probablemente aumente el flujo y la lubricación vaginal. Estos cambios sin duda favorables, facilitan la función sexual de la pareja (26). Probablemente en el tercer trimestre se suman otros factores no hormonales que explican la afectación de este dominio.
En general, Hanafy y col. (20) tuvieron resultados similares y concluyeron que hay cambios significativos en todos los dominios del IFSF, especialmente en el primer y tercer trimestre. Por su parte, Prado y col. (19), en 2013, encontraron que el embarazo disminuye la satisfacción sexual de la mujer durante el primer trimestre del embarazo y lo relacionan con los procesos de adaptación que experimenta la mujer. Esto cambia en el segundo trimestre cuando la mujer embarazada comienza a sentirse mejor y, en consecuencia, experimenta un aumento en la satisfacción sexual. Los resultados de esta serie difieren de los de Prado y col. (19), puesto que se encontró un promedio de 4,23 ± 1,57 en satisfacción, valor por encima del límite para definir disfunción por dominio, y la frecuencia de afectación fue de 39,3 %, lo que si se observó fue una leve mejoría en el segundo trimestre en las puntuaciones medias, sin impacto sobre la frecuencia y, una vez más, el deterioro en el tercer trimestre, con una reducción de las puntuaciones y un aumento de la frecuencia de disfunción. En general, Rodríguez y col. (9) encontraron que, a pesar de que el interés sexual se veía disminuido con el embarazo, más de la mitad de las encuestadas encontraban su vida sexual satisfactoria e incluso, en una pequeña parte de ellas aumentaba su interés y mejoraba su vida sexual.
El dolor estuvo presente en alrededor de la mitad de las gestantes en cada trimestre, la media de puntuación en este dominio se modificó significativamente con el avance del embarazo, cayendo de 4,56 ± 4,02 en el segundo trimestre, a 3,58 en el tercero. A pesar de ello, su frecuencia de aparición no se modificó con la edad gestacional, esto puede ser considerado como que el embarazo no influiría sobre este. Hanafy y col. (20) describieron que el dolor se incrementó en el segundo trimestre comparado con el primero y tercero. Existen múltiples razones para hablar de dispareunia, recordando que los cambios físicos y emocionales que ocurren durante el embarazo pudieran afectar este dominio (38). En algunas mujeres, la congestión y la vascularización son tan marcadas que les impide lograr el orgasmo, aumentando así la tensión sexual y la frustración. La congestión pelviana podría justificar el dolor y la falta de confort durante las relaciones sexuales y, además, se producen alteraciones de la percepción sensorial con la elevación de los umbrales de percepción dolorosa en diversas partes del cuerpo, que ocurre durante la excitación sexual intensa y, especialmente, en el orgasmo (26). La falta de modificaciones en el dominio dolor en relación a la edad gestacional sugiere que, entre las mujeres evaluadas en esta serie, el dolor no necesariamente estaba relacionado con los cambios fisiológicos del embarazo, puesto que los cambios descritos son progresivos lo que se asociaría con una progresión del síntoma.
Los efectos del embarazo sobre las funciones y sensaciones sexuales no son uniformes, para unos, la gestación puede ser un periodo de mayor conciencia y goce sexual, en cambio otras mujeres no notan cambios, o experimentan disminución de su deseo sexual. Es importante tener en cuenta que son muchos los factores, aparte de los biológicos propios de la gestación, que se ponen en juego para determinar tipos de conducta sexual durante el embarazo (39). La actitud de la mujer ante la maternidad, la calidad y/o ausencia de la pareja, el nivel cultural y sus expectativas, así como otras condiciones individuales ejercen considerable presión sobre la conducta sexual. La presencia de complicaciones médicas y la preocupación ante la posible pérdida de la gestación, sin duda influyen en el comportamiento sexual de la mujer.
Al interrogar sobre las razones que dificultan la actividad sexual durante la gestación se obtuvo que, entre las mujeres que estaban en el primer trimestre, la razón más señalada fue el miedo al aborto, seguido de temor a hacer daño al bebe y dificultad en las posiciones. Entre las mujeres que estaban en el segundo y tercer trimestres, la principal razón estuvo relacionada con dificultad de las posiciones sexuales. Los motivos cambian, conforme avanza la gestación en vista de que algunos cambios propios del embarazo se acentúan al transcurrir el mismo. A este respecto, Brtnicka y col. (13) determinaron que los problemas de disfunción sexual durante el embarazo son a menudo producidos por el miedo a hacer daño al feto y destacan que no solo la mujer está temerosa, los hombres tienen temor a herir a la mujer. Serati y col. (14) encontraron que el factor más relevante era la preocupación acerca de los posibles resultados obstétricos adversos. Son muchos los autores que llegan a conclusiones similares, entre ellos, Aribi y col. (18), en 2012, quienes describieron que las tres principales causas de la disminución del interés y de la actividad sexual fueron: los síntomas físicos (83 %), el miedo a hacer daño al feto (66,7 %) y el deseo sexual hipoactivo (33,4 %). Por su parte, Gałązka y col. (22) también describieron una reducción significativa de la actividad sexual, pero señalaron como causa, la reducción del deseo (P=0,00007), el rechazo a la pareja (P=0,002) y los cambios en la apariencia relacionados con el embarazo (P=0,03).
No se encontró un cuestionario estandarizado para evaluar el patrón sexual, sin embargo, dada la importancia del tema se asumió la responsabilidad de diseñar dicho cuestionario, el cual fue validado por un panel de expertos que incluyó un sexólogo y un grupo de especialistas en obstetricia y ginecología.
La mayoría de las gestantes, más del 72 %, reportaron una frecuencia de actividad sexual entre 1 y 3 veces por semana durante el segundo trimestre, evidenciando un descenso de la misma en el 1er (52,7 %) y tercer trimestre (68 %). Estos hallazgos son consistentes con los de Lee y col. (15) quienes demostraron que existía una disminución de la frecuencia del coito entre el primer y tercer trimestre. Así mismo Corbacioglu y col. (16), en 2012, encontraron un descenso de la frecuencia del coito y del deseo sexual en el primer trimestre dado por la conciencia del embarazo más que por factores obstétricos o sociodemográficos.
Se describe como frecuencia habitual en parejas no embarazadas entre 2-4 veces por semana (40), sin embargo, esta frecuencia puede variar por múltiples factores biológicos, psicosociales, culturales entre otros, que pudieran ser los mismos que afecten a la mujer gestante (32). El descenso de la frecuencia en el tercer trimestre puede ser explicado por la presencia de contracciones del músculo uterino de manera continua en la fase del orgasmo, diferentes estas a las contracciones orgásmicas normales, lo que provocaría miedo en la gestante de presentar adelanto del parto como lo mencionan Master y Johnson (28) en su investigación.
A pesar de que algunas prácticas sexuales son cuestionadas por aspectos culturales y religiosos, entre otros, hay que tener en cuenta que existen otras opciones para la expresión de intimidad entre las parejas, formas de contacto no coital que podrían también ser agradables y satisfactorias para ambas partes. Doscientas sesenta y nueve mujeres (78,0 %), seleccionaron el coito como tipo de actividad sexual predominante, hubo porcentajes más bajos de otras prácticas como masturbación a la pareja, automasturbación, penetración anal y prácticas orogenitales. Esto es contrario a lo señalado por Rodríguez y col. (9), en 2013, quienes describen que prácticamente todas las encuestadas tienen frecuentes encuentros no genitales, y estos son muy deseados.
Fuera del embarazo la actividad sexual más frecuente es el coito, pero para considerar el tipo de actividad sexual que se desarrolla es importante conocer la orientación sexual de la gestante; en este caso se encontraron 304 heterosexuales (88,1 %), 32 homosexuales (9,3 %) y 9 bisexuales (2,6 %). El número pequeño que reportó ser homosexuales y bisexuales en relación a la muestra total, dificulta la interpretación de los resultados. Llama la atención que el 56,3 % de las homosexuales señalaron como actividad sexual predominante el coito; esto puede ser por desconocimiento del término coito o porque al interpretar el término penetración lo asociaron al uso de juguetes sexuales o penetración con la mano. Rodríguez y col. (9), encontraron una mayor proporción de mujeres que se auto-estimulan, la frecuencia de esta práctica también se modifica durante la gestación. El número de relaciones oro-genitales sufre un descenso durante el embarazo, sin embargo, no deja de estar presente.
Las posiciones adoptadas durante la actividad sexual fueron las tradicionales, con más frecuencia mujer arriba – hombre abajo, probablemente debido a que, en esta posición, la mujer tiene una mayor capacidad para el control de sus movimientos y de la penetración. La segunda posición en frecuencia fue hombre arriba – mujer abajo, por el contrario, Lee y col. (15), en 2010, describen que la posición sexual más común para la mujer embarazada fue el hombre en la parte superior, cara a cara y estas posiciones no cambiaron significativamente durante los diferentes trimestres.
Se evidenció que 124 pacientes (35,9 %) refirieron entre las razones que le limitan la actividad sexual, la dificultad para las posiciones sexuales. Como se comentó anteriormente, este hallazgo fue marcado durante el segundo y el tercer trimestre, lo que puede relacionarse con el proceso de adaptación por el crecimiento de la circunferencia abdominal. Además, un elevado número de mujeres describieron miedo al aborto, temor a hacer daño al bebe y temor al adelanto del parto. Esto puede estar relacionado con la falta de información sobre este tema.
Ciento diez mujeres (31,9 %) dijeron haber recibido información sobre sexualidad de parte de personal médico. A pesar de estos resultados, llama la atención que 104 (30,1 %) señalaron no haber recibido nunca información sobre sexualidad. Esta falta de información a la gestante por parte del personal médico ha sido señalada por múltiples autores. Brtnicka y col. (13) describen que existe desinterés de los encargados de atención prenatal y postnatal en los temas de la sexualidad y que la falta de información relevante es la razón común para evitar este tema. De hecho, según estos autores, 76 % de las embarazadas recomendarían una discusión sobre la sexualidad durante el embarazo como tema en la consulta prenatal y casi la mitad de las mujeres embarazadas refieren como insuficiente la información recibida por parte de los médicos. En este orden de ideas, Serati y col. (14), en 2010, encontraron que existe una falta de información adecuada sobre el sexo durante el embarazo. Debido a esto concluyeron que las parejas deben ser informadas acerca de la disminución de la libido, el deseo y orgasmo, comúnmente encontradas durante el embarazo y puerperio, en particular en el último trimestre, conduciendo esto a una reducción de la frecuencia de relaciones sexuales. Rodríguez y col. (9) apoyan esta idea, y agregan que una mayor educación sexual durante este periodo, efectuada por profesionales formados en salud sexual, puede mejorar la satisfacción de la gestante y su estado general de salud. También Corbacioglu y col. (17), en 2013, insisten en que el asesoramiento sobre la salud sexual durante el embarazo no es frecuente en la práctica clínica y recomiendan que este tipo de asesoramiento ocurra durante el control prenatal.
Gómez y col. (7), observaron que a pesar de existir información acerca de la sexualidad, en este momento existen altos índices de desconocimiento y errores en mujeres jóvenes y adultas que afectan gravemente el equilibrio emocional y su actitud frente a esta etapa tan importante para la mujer.
Para mejorar esta relación entre paciente y obstetra se propone un esquema para iniciar la discusión de temas sexuales durante la consulta prenatal, realizando una serie de preguntas basadas en la función sexual antes y durante el embarazo, para prevenir, diagnosticar y tratar los diferentes trastornos que puedan presentarse en el embarazo con base en la salud sexual. Algunas de las preguntas son: ¿Usted o su pareja tiene dificultades sexuales en este momento? ¿Está satisfecho con su relación sexual actual? ¿Tiene alguna preocupación sexual que le gustaría hablar? Si las respuestas de la paciente sugieren que ella quiere hablar sobre temas sexuales, las siguientes preguntas podrían ser más específicas, la historia-sexual, la frecuencia con la que se involucra en la actividad sexual, las dificultades que pueda presentar. Las respuestas a estas preguntas deben dar una orientación para incorporar el asesoramiento específico en los cambios esperados en la salud sexual relacionadas con el embarazo (40).
La información proporcionada por profesionales acerca de la sexualidad durante este periodo normalmente es insuficiente o nula, por lo tanto, es necesario promover una atención profesional orientada a aconsejar a las parejas acerca de los cambios biopsicosexuales y ayudarlos a entender las modificaciones normales en la respuesta sexual durante el embarazo, todo ello con el fin de mejorar su calidad de vida y, así también, la salud sexual de la pareja. A través de esto, se conseguiría ver la sexualidad como una parte fundamental de la vida, que afecta de forma considerable al bienestar, también, se daría un giro a las creencias y culturas, dejando de ver la sexualidad como un tema prohibido, lo que supone un lastre para el desarrollo de esta dimensión de la personalidad. Mejoraría la salud de la embarazada y su pareja, existiendo así, menor porcentaje de disfunciones sexuales, miedos, falsas creencias, mitos, etc., por ello, los profesionales de la salud (médicos/y enfermeras) en contacto con la mujer en estas etapas, juegan un papel importante en la resolución de este tipo de problemas (7).
Los resultados del presente estudio permiten concluir que existe una elevada frecuencia de disfunción sexual durante la gestación, que es mayor en el primer y tercer trimestre. La fase mayormente afectada resultó ser el deseo y la menos afectada fue la lubricación. Todos los dominios se modificaron con la edad gestacional menos el dolor.
En cuanto al patrón sexual, la frecuencia de actividad sexual es de 2-3 veces por semana, el coito con penetración vaginal es la actividad más señalada en los diferentes tipos de orientación sexual, siendo la heterosexual la predominante. La posición más practicada es mujer arriba – hombre abajo. Las principales razones que limitan la actividad sexual son, dificultad con las posiciones, temor de hacer daño al bebe y miedo al aborto. La fuente de información sobre la sexualidad durante el embarazo proviene del personal médico, pero un grupo elevado señaló no haber recibido ninguna información.
Se recomienda al médico especialista encargado del control prenatal mantener la promoción en el tema de la sexualidad durante el embarazo para prevenir, diagnosticar y tratar, con ayuda de expertos médicos y sexólogos, los diferentes trastornos que puedan afectar la salud sexual durante el embarazo, ayudando de esta manera a la gestante en su calidad de vida.
Las autoras desean agradecer al Dr. Fernando Torres, médico sexólogo, por las diferentes consultas realizadas para la culminación de este trabajo.
REFERENCIAS
1. Pérez Sanz P, Palacios Gil-Antuñano S. Aspectos de la sexualidad en la embarazada deducidos de un estudio de 100 embarazos. Progr. Obstet. Ginecolog. 1982; 25 (5): 323-331. [ Links ]
2. Alfonso Rodríguez AC, Sarduy Sánchez C. Educación sexual comunitaria, apuntes para un marco referente I Parte. Sexología y Sociedad. 2000; 14: 9-16. [ Links ]
3. World Association for Sexual Health (WAS) [Internet]. Praga: Declaración universal de los derechos sexuales; 2014. [Actualizado marzo 2014; citado noviembre 2015]. WAS Consejo Consultivo. Disponible en: http://www.worldsexology.org/wp-content/uploads/2013/08/declaracion_derechos_sexuales_sep03_2014.pdf [ Links ]
4. Real Cancio RM. Estudio epidemiológico de la disfunción sexual femenina: asociación con otras enfermedades y factores de riesgo [tesis]. La Habana: Hospital Hermanos Ameijeiras; 2012. [Citado octubre 2015]. Disponible en: http://tesis.repo.sld.cu/550/1/RMReal.pdf [ Links ]
5. Pino E, Sepúlveda Parada E. Disfunciones sexuales femeninas. Rev Sex y Soc [revista en internet]. 2014 [citado marzo 2015]; 6(16):10-14. Disponible en: http://revsexologiaysociedad.sld.cu/index.php/sexologiaysociedad/article/view/203 [ Links ]
6. Asociación Española para el estudio de la Menopausia [sede web]. Barcelona: La Sexualidad en el embarazo y puerperio; 2011 [citado 10 de febrero de 2014]. AEEM informa. Disponible en: http://www.aeem.es/informa/9/La-Sexualidad-en-el-embarazo-y-puerperio.html [ Links ]
7. Gómez Cantarino S, Moreno Preciado M. La expresión de la sexualidad durante la gestación y el puerperio. Cultura de los Cuidados [Internet] 2012 [citado 7 de mayo de 2014]; 16 (33): 67-74. Disponible en: http://rua.ua.es/dspace/bitstream/10045/24154/1/CC_33_09.pdf [ Links ]
8. Soria B. Estudio de la actividad sexual de la mujer durante el embarazo y puerperio [Tesis de Grado]. Almería: Universidad de Almería; 2012. [ Links ]
9. Rodríguez M, Ramón E. Características y evolución del patrón sexual de la mujer embarazada. Enferm Glob. 2013; 12(32): 362–370. [ Links ]
10. Piñero Navero S, Alarcos Merinio G, Arenas Orta MT, Jiménez Iglesas V, Ortega Ballesteros EM, Ramiro Figueroa MJ. Características y modificaciones de la sexualidad durante el embarazo. NURE Inv [Internet] 2011 [citado 5 de junio de 2014]; 8 (50): [aprox. 9 pant]. Disponible en: http://www.nureinvestigacion.es/OJS/index.php/nure/article/viewFile/518/507 [ Links ]
11. Masters W, Johnson V, Kolondy R. La Sexualidad Humana. 13a edición. Barcelona: Grijalbo; 1995. [ Links ]
12. Blümel J, Binfa L, Cataldo P, Carrasco A, Izaguirre H, Sarrá Salvador. Índice de función sexual femenina: un test para evaluar la sexualidad de la mujer. Rev chile obst ginecol. 2004; 69(2): 118-125. [ Links ]
13. Brtnicka H, Weiss P, Zverina J. Human sexuality during pregnancy and the postpartum period. Bratisl Lek Listy. 2009; 110 (7): 427-431. [ Links ]
14. Serati M, Salvatore S, Siesto G, Cattoni E, Zanirato M, Khullar V, et al. Female sexual function during pregnancy and after childbirth. J Sex Med. 2010;7(8):2782-2790. [ Links ]
15. Lee JT, Lin CL, Wan GH, Liang CC. Sexual positions and sexual satisfaction of pregnant women. J Sex Marital Ther. 2010; 36 (5): 408-420. [ Links ]
16. Corbacioglu A, Bakir VL, Akbayir O, Cilesiz Goksedef BP, Akca A. The role of pregnancy awareness on female sexual function in early gestation. J Sex Med. 2012; 9 (7): 1897-1903. [ Links ]
17. Corbacioglu A, Akca A, Akbayir O, Goksedef BP, Bakir VL. Female sexual function and associated factors during pregnancy. J Obstet Gynecol Res. 2013; 39 (6): 1165-1172. [ Links ]
18. Aribi L, Ben Houidi A, Masmoudi R, Chaabane K, Guermazi M, Amami O. Female sexuality during pregnancy and postpartum: a study of 80 Tunisian women. Tunis Med. 2012; 90 (12): 873-877. [ Links ]
19. Prado DS, Lima RV, de Lima LM. Impact of pregnancy on female sexual function. Rev Bras Ginecol Obstet. 2013; 35 (5): 205-209. [ Links ]
20. Hanafy S, Srour NE, Mostafa T. Female sexual dysfunction across the three pregnancy trimesters: an Egyptian study. Sex Health. 2014; 11 (3): 240-243. [ Links ]
21. Balestena JM, Fernández B, Sanabria JG. Influencia de la gestación en la sexualidad de la mujer. Rev. Ciencias Médicas. 2014; 18 (5): 811-822. [ Links ]
22. Gałązka I, Drosdzol-Cop A, Naworska B, Czajkowska M, Skrzypulec-Plinta V. Changes in the sexual function during pregnancy. J Sex Med. 2015; 12 (2): 445-454. [ Links ]
23. World Health Organization [sede Web]. Washington: WHO. Sexual and reproductive health. Defining sexual health. [Actualizado 2010, citado octubre 2015]. Disponible en: http://www.who.int/reproductivehealth/topics/sexual_health/sh_definitions/en/ [ Links ]
24. Galdos S. La conferencia de El Cairo y la afirmación de los derechos sexuales y reproductivos, como base para la salud sexual y reproductiva. Rev Peru Med Exp Salud Pública. 2013; 30 (3): 455 – 460. [ Links ]
25. Bianco Colmenares F. Sexología, definición y concepto. Teoría de la variante fisiológica del sexo y su función. Propuesta. Caracas: Editorial CIPV; 1991. [ Links ]
26. Castelo-Branco C. Sexualidad humana: Una aproximación integral. Madrid: Ed. Médica Panamericana; 2005. [ Links ]
27. Mas M. Fisiología de la respuesta sexual femenina: actualización. Revista Internacional de Andrología [Internet] 2007 [Citado noviembre 2015]; 5 (1): 11–21. Disponible en: http://linkinghub.elsevier.com/retrieve/pii/S1698031X07740293 [ Links ]
28. Masters W, Johnson V. Human sexual Response. New York: Ishi Press International; 2010. [ Links ]
29. Sánchez Gila M. Prostaglandinas y función reproductiva. [Internet] Granada: Servicio de Obstetricia y Ginecología Hospital Universitario Virgen de las Nieves; 2008. [Citado noviembre 2015]. Disponible en: http://www.hvn.es/servicios_asistenciales/ ginecologia_y_obstetricia/ficheros/cr08.pg_fn_reproductiva.pdf [ Links ]
30. Rodríguez F. Sexualidad en el embarazo y puerperio. [Internet]. Barcelona: Asociación Española para el Estudio de la Menopausia. [Citado noviembre 2015] Disponible en: http://www.aeem.es/fotos/informam/103.pdf [ Links ]
31. García M. Sexualidad en el periodo gestacional. [Trabajo Fin de Grado]. Algeciras (Andalucía): Universidad de Cadiz; 2014. [ Links ]
32. Althausen M, Varas J. Disfunción Sexual Femenina, un desafío para la Medicina en el siglo XXI. Rev. Obstet. Ginecol. 2006; 1 (2):121-129. [ Links ]
33. Connolly A, Thorp J, Pahel L. Effects of pregnancy and childbirth on postpartum sexual function: a longitudinal prospective study. Int Urogynecol J Pelvic Floor Dysfunct. 2005; 16 (4): 263-267. [ Links ]
34. Leite AP, Campos AA, Dias AR, Amed AM, De Souza E, Camano L. Prevalence of sexual dysfunction during pregnancy. Rev Assoc Med Bras. 2009; 55 (5): 563-568. [ Links ]
35. Trutnovsky G, Haas J, Lang U, Petru E. Womens perception of sexuality during pregnancy and after birth. Aust N Z J Obstet Gynaecol. 2006; 46 (4): 282- 287. [ Links ]
36. Wiegel M, Meston C, Rosen R. The female sexual function index (FSFI): cross-validation and development of clinical cutoff scores. J Sex Marital Ther. 2005; 31 (1): 1-20. [ Links ]
37. González Labrador I, Miyar Pieiga E. Sexualidad femenina durante la gestación. Rev Cubana Med Gen Integr 2001;17(5):497-501. [ Links ]
38. Cuevas A, Cuauhtemoc C, Hernández I, Herrán S, Paradas A, Paredes O, et al. Médicos de las Américas Unidos para la Salud Integral de la Mujer (MASIM). Resultados de una encuesta epidemiológica de hábitos de higiene íntima en mujeres latinoamericanas. Rev Obstet Ginecol Venez 2011; 71 (1): 21-27. [ Links ]
39. Weijmar W, Basson R, Binik Y, Eschenbach D, Wesselmann U, Van Lankveld J. Women`s sexual pain and its management. J Sex Med 2005; 2 (3): 301-316. [ Links ]
40. Skodic Zaksek T. Sexual Activity during Pregnancy in Childbirth and after Childbirth. En: Polona Mivsek A, editor. Sexology in Midwifery. Rijeka, Croatia: InTechOpen; 2015. [ Links ]^rND^sPérez Sanz^nP^rND^sPalacios Gil-Antuñano^nS^rND^sAlfonso Rodríguez^nAC^rND^sSarduy Sánchez^nC^rND^sPino^nE^rND^sSepúlveda Parada^nE^rND^sGómez Cantarino^nS^rND^sMoreno Preciado^nM^rND^sRodríguez^nM^rND^sRamón^nE^rND^sPiñero Navero^nS^rND^sAlarcos Merinio^nG^rND^sArenas Orta^nMT^rND^sJiménez Iglesas^nV^rND^sOrtega Ballesteros^nEM^rND^sRamiro Figueroa^nMJ^rND^sBlümel^nJ^rND^sBinfa^nL^rND^sCataldo^nP^rND^sCarrasco^nA^rND^sIzaguirre^nH^rND^sSarrá^nSalvador^rND^sBrtnicka^nH^rND^sWeiss^nP^rND^sZverina^nJ^rND^sSerati^nM^rND^sSalvatore^nS^rND^sSiesto^nG^rND^sCattoni^nE^rND^sZanirato^nM^rND^sKhullar^nV^rND^sLee^nJT^rND^sLin^nCL^rND^sWan^nGH^rND^sLiang^nCC^rND^sCorbacioglu^nA^rND^sBakir^nVL^rND^sAkbayir^nO^rND^sCilesiz Goksedef^nBP^rND^sAkca^nA^rND^sCorbacioglu^nA^rND^sAkca^nA^rND^sAkbayir^nO^rND^sGoksedef^nBP^rND^sBakir^nVL^rND^sAribi^nL^rND^sBen Houidi^nA^rND^sMasmoudi^nR^rND^sChaabane^nK^rND^sGuermazi^nM^rND^sAmami^nO^rND^sPrado^nDS^rND^sLima^nRV^rND^sde Lima^nLM^rND^sHanafy^nS^rND^sSrour^nNE^rND^sMostafa^nT^rND^sBalestena^nJM^rND^sFernández^nB^rND^sSanabria^nJG^rND^sGazka^nI^rND^sDrosdzol-Cop^nA^rND^sNaworska^nB^rND^sCzajkowska^nM^rND^sSkrzypulec-Plinta^nV^rND^sGaldos^nS^rND^sMas^nM^rND^sAlthausen^nM^rND^sVaras^nJ^rND^sConnolly^nA^rND^sThorp^nJ^rND^sPahel^nL^rND^sLeite^nAP^rND^sCampos^nAA^rND^sDias^nAR^rND^sAmed^nAM^rND^sDe Souza^nE^rND^sCamano^nL^rND^sTrutnovsky^nG^rND^sHaas^nJ^rND^sLang^nU^rND^sPetru^nE^rND^sWiegel^nM^rND^sMeston^nC^rND^sRosen^nR^rND^sGonzález Labrador^nI^rND^sMiyar Pieiga^nE^rND^sCuevas^nA^rND^sCuauhtemoc^nC^rND^sHernández^nI^rND^sHerrán^nS^rND^sParadas^nA^rND^sParedes^nO^rND^sWeijmar^nW^rND^sBasson^nR^rND^sBinik^nY^rND^sEschenbach^nD^rND^sWesselmann^nU^rND^sVan Lankveld^nJ^rND^sSkodic Zaksek^nT^rND^1A01^nTatiana^sHernández Guzmán^rND^1A01^nVanessa^sGonzález Calderón^rND^1A01^nNorma^sOzal Mora^rND^1A01^nMireya^sGonzález Blanco^rND^1A01^nTatiana^sHernández Guzmán^rND^1A01^nVanessa^sGonzález Calderón^rND^1A01^nNorma^sOzal Mora^rND^1A01^nMireya^sGonzález Blanco^rND^1A01^nTatiana^sHernández Guzmán^rND^1A01^nVanessa^sGonzález Calderón^rND^1A01^nNorma^sOzal Mora^rND^1A01^nMireya^sGonzález Blanco
Infección genital por el virus de papiloma humano: Grado de información que poseen las pacientes
Dras. Tatiana Hernández Guzmán1, Vanessa González Calderón1, Norma Ozal Mora2, Mireya González Blanco 3
1 Médicos Especialistas en Obstetricia y Ginecología, egresados de la Universidad Central de Venezuela, sede Maternidad Concepción Palacios.
2 Médico Especialista en Obstetricia y Ginecología, Jefa (E) del Servicio de Ginecología de la Maternidad Concepción Palacios.
3 Médico Especialista, Jefa del Servicio de Ginecología y Directora del Programa de Especialización en Obstetricia y Ginecología de la Universidad Central de Venezuela, con sede en Maternidad Concepción Palacios.
RESUMEN
Objetivo: Determinar el grado de información sobre la infección genital por el virus papiloma humano que poseen pacientes que asistieron al Servicio de Ginecología de la Maternidad Concepción Palacios entre noviembre 2012 y octubre 2013.
Métodos: Estudio prospectivo, descriptivo, transversal. Se incluyó una muestra probabilística de 372 pacientes a quienes se les aplicó una encuesta.
Resultados: 257 pacientes (69,1 %) poseían un grado de información bueno; 18 (4,8 %) regular y 97 (26,1 %) malo. Entre las primeras, la edad promedio fue de 41 ± 12 años y 58,8 % pertenecían al estrato IV mientras que, para las últimas, la edad promedio fue de 47 ± 15 años y 64,9 % pertenecían al estrato socioeconómico IV (P=0,000). Entre las pacientes con mayor nivel de conocimiento, 56,8 % tenían entre 26 y 45 años, 58,8 % tenían primaria aprobada y 58,8 % tenían diagnóstico previo de infección por virus de papiloma humano. Entre aquellas con bajo nivel de conocimiento, 36,1 % tenían entre 26 y 45 años, 77,3 % tenían primaria aprobada y 19,6 tenían diagnóstico previo de la infección. Respecto a la información que poseen, 268 saben que es una infección de trasmisión sexual, 251 que el preservativo protege contra la infección, 222 asocian la infección con el inicio temprano de actividad sexual, 261 con el número de parejas sexuales y 212 con el cáncer de cuello uterino.
Conclusiones: Un alto porcentaje de pacientes presentan un buen grado de información sobre la infección genital por virus de papiloma humano.
Palabras clave: Infección genital, Virus de papiloma humano, Lesiones precancerosas, Cáncer de cuello uterino.
SUMMARY
Objective: To determine the knowledge about the genital infection by the human papillomavirus, of patients attending the gynecology department of the Maternity Concepción Palacios in the period November 2012 - October 2013.
Methods: Prospective, descriptive, cross-sectional study included 372 patients who applied a survey.
Results: 257 patients (69.1%) possessed a good degree of information; 18 (4.8%) regular and 97 (26.1%) bad. The average age was 41 ± 12 years and 58.8% belonged to the socio-economic stratum IV while for those who had good knowledge of Human Papilloma virus (HPV), for the women´s with less information was average age 47 ± 15 years and 64.9% belonged to the socio-economic stratum IV (P = 0,000). Among the patients with higher levels of knowledge, 56.8% had between 26 and 45 years, 58.8% had elementary school approved and 58.8% had previous diagnosis of HPV infection. Among those with a low level of knowledge, 36.1% had between 26 and 45 years, 77.3% had elementary school approved and 19.6 had previous diagnosis of infection. Respect to the information 268 know that is an infection of sexual transmission, 251 knew the condom protects against the infection, 222 associated the infection with the early begin of activity sexual, 261 with the number of sexual couples and 212 with the cancer of neck uterine.
Conclusions: A high percentage of patients have a good knowledge HPV genital infection.
Key words: Genital infection, Human papilloma virus, Precancerous lesions, Cervical cancer.
INTRODUCCIÓN
Las infecciones de transmisión sexual (ITS) constituyen una de las patologías más comunes en el mundo. Según la Organización Mundial de la Salud (OMS), una de cada 100 personas acude a consulta por lo menos una vez al año debido a una infección de transmisión sexual. Uno de los principales problemas de las ITS es que la mayoría de los portadores desconocen su existencia, por lo que una gran parte no se diagnostica. La infección genital por virus de papiloma humano (VPH) se cataloga como una ITS. Se estima que aproximadamente 630 millones de personas están infectadas con el VPH a nivel mundial. Aproximadamente 20 millones de americanos se encuentran infectados por el VPH y al menos 50 % de hombres y mujeres sexualmente activos adquirirán esta infección genital en algún momento de sus vidas (1).
En mujeres adolescentes y adultas jóvenes la frecuencia de infección con el VPH es muy alta hasta un 50 % aproximadamente, quienes adquieren la infección en los primeros 4 - 5 años de tener una vida sexual activa. El inicio de las relaciones sexuales a edades tempranas, entre los 12 y 14 años, es un hecho que se ha venido observando progresivamente en la sociedad (1). El 90 % - 95 % de las infecciones curan espontáneamente después de algún tiempo o progresan en un 5 % a lesiones precancerosas y cáncer de cuello uterino invasor (1).
Actualmente existe evidencia experimental y epidemiológica de que la infección por VPH es la principal causa de cerca del 85 % de las neoplasias cervicales (2). La mayoría de los carcinomas del cuello uterino se inician como alteraciones intraepiteliales, que son provocadas por la expansión clonal de células epiteliales transformadas. Ahora se sabe que en la transformación de las células del cáncer cervical siempre han mediado eventos genéticos previos y se conoce que ellos están asociados a la presencia del VPH en la génesis de esta neoplasia, lo cual ha sido señalado desde hace muchos años y en la actualidad forma parte del proceso de carcinogénesis.
El cáncer de cuello uterino es el segundo tumor más frecuente en mujeres según la Organización Mundial de la Salud (2010), y produce alrededor de 300.000 muertes en mujeres en el mundo, de estas muertes, 80 % ocurre en países en vías de desarrollo (3). Las tasas de incidencia y mortalidad más altas actualmente se registran en regiones de bajos ingresos como África, América Latina y el sur y sudeste asiático, asociado al bajo nivel socio económico y a la deficiente atención de la salud, debido a la falta de acceso en la detección y tratamiento de esta enfermedad. Se ha reportado una prevalencia variable en Latinoamérica. En Panamá es 60 %, en Perú 73 %, en Brasil 35 % y en Venezuela de 75 % (4).
Venezuela es uno de los países en vías de desarrollo con mayor tasa de mortalidad por cáncer de cuello uterino, y esta cifra se ha mantenido así por las últimas cinco décadas (1). Una elevada proporción de la población femenina venezolana presenta lesiones premalignas, hecho que debe causar alerta, en vista de tratarse de pacientes jóvenes, en su mayoría, con lesiones de bajo grado, que tienen posibilidad de evolucionar a lesiones de alto grado, por tanto, la observación y el seguimiento citológico y colposcópico deben ser estrictos y llamar la atención en los servicios de salud, en los que se deben instaurar programas de educación sexual acorde a la realidad del país. Según el Registro Nacional de Cáncer del Programa Nacional de Oncología del Ministerio del Poder Popular para la Salud, para el año 2009 se diagnosticaron 3685 mujeres, de las cuales 1602 fallecieron. La magnitud de estas cifras puede apreciarse, al resumirse en una media de 10 casos y 4 muertes diarias (5).
Globalmente la población presenta déficit importante en cuanto a los conocimientos relacionados con el VPH, cáncer cervical, prevención y vacunación. Esto puede ser debido al bajo nivel educativo, que conlleva a poca comprensión. Se pudiera pensar que el desconocimiento sobre la promoción de la salud en la prevención de las enfermedades de transmisión sexual, sea la causa para la mayor incidencia de las mismas.
La necesidad de mejorar el nivel de información sobre el virus de papiloma humano, así como otras infecciones de transmisión sexual, y la manera de prevenirlas, ha concebido diferentes estudios que ofrecen distintos enfoques y soluciones al problema. En el estudio realizado por Cortés y col. (6), aplicaron una entrevista relacionada con las actividades sexuales de los jóvenes, obtuvieron como resultado, que más de la mitad de los adolescentes no usaban preservativos en sus relaciones sexuales, el 57 % tuvo más de una pareja en el año, 39 % experimentó relaciones con otras personas que no habían tenido protección previamente y 22 % presentó antecedentes de infecciones de transmisión sexual.
Asimismo, Nur (7), realizó una investigación con el objeto de estudiar el nivel de información sexual que poseen las adolescentes en una Unidad Educativa de la Ciudad de Barquisimeto. Los resultados revelaron que las adolescentes tenían un buen nivel de conocimientos en su sexualidad, considerando a sus madres como la fuente más confiable de información.
Tamayo y col. (8) realizó un estudio con el fin de aportar algunos lineamientos para los programas de prevención del cáncer cervicouterino en la región de Antioquia, Colombia. El estudio incluyó una muestra de 1153 mujeres. Entre los resultados destacan que el factor de riesgo más frecuente para VPH fue la edad de inicio de las relaciones sexuales antes de los 17 años (15 %), seguido del uso de anticonceptivos hormonales y dispositivo intrauterino, (23,3 %) y el consumo de cigarrillo (14 %). El condón, como medida preventiva para no adquirir la infección, lo utilizaba el 30,8 % de las mujeres, de las cuales 5,7 % fueron positivas para VPH. Al explorar la relación de los factores de riesgo con la infección por VPH, ninguno fue estadísticamente significativo.
Bueno y col. (9), realizaron un trabajo con la finalidad de diseñar un programa de educación sobre el virus papiloma humano (VPH) genital. Incluyeron 100 usuarias de la consulta. De los resultados se puede inferir que el VPH genital, se propaga en la población femenina como consecuencia de la promiscuidad en que viven muchas parejas, las entrevistadas manifestaron desconocer la forma de transmisión y los métodos de prevención y control de enfermedad.
Colmenares y col. (10) realizaron un estudio sobre un programa de educación para la prevención del virus papiloma humano (VPH). De acuerdo a los resultados, la edad que prevaleció en el grupo de usuarias fue entre 21 a 30 años de edad, las cuales en su mayoría tenían pareja en concubinato, se evidenció en un 60 % que iniciaron su actividad sexual entre los 16 y los 20 años de edad, y que en su mayoría (65 %) mantenían relación estable. Se observó que 60 % de las usuarias cursaban la educación media incompleta y que había déficit de conocimiento acerca del tema y creencias falsas que aumentaban por la falta de educación y conocimientos sobre el mismo.
Melnikow y col. (11), en un metanálisis de 15 estudios, encontraron las siguientes tasas de progresión a lesión intraepitelial de alto grado (LIE-AG) en 24 meses: para células escamosas atípicas de significado incierto (ASCUS) 7,13 %; para lesión intraepitelial de bajo grado (LIE-BG) 20,81 %. La tasa de progresión a carcinoma invasor en 24 meses a su vez fue: para el ASCUS 0,25 %; para LIE-BG 0,15 %; y para LIE-AG 1,44 %. En cuanto a las tasas de regresión se encontró: para el ASCUS 68,19 %; para el LIE-BG 47,39 %; para el LIE-AG 35,03 %.
El VPH es, en realidad, un grupo de virus, de los cuales se han identificado más de 100 tipos, cerca de 40 genotipos son transmitidos sexualmente. El mismo produce infecciones de piel y afecta las mucosas del tracto anogenital, oral y respiratorio (1). Según el Comité internacional de taxonomía de los virus (International Committee on the Taxonomy of Viruses), el virus del papiloma humano (VPH) es un pequeño virus (55 nm) con ADN circular de doble cadena constituido por alrededor de 8 000 pares de bases, de la familia Papillomaviridae, sin envoltura lipídica, pero con cápside proteica, que tiene especial trofismo por el tejido cutáneo y mucoso. Dentro de esta familia, el Papilomavirus humano (VPH) presenta una creciente importancia en salud pública, fundamentalmente, por asociación con el cáncer de cuello uterino (12, 13).
En cuanto al mecanismo de adquisición de la infección, a pesar de la abrumadora evidencia de la transmisión sexual de los tipos genitales del VPH, algunas observaciones epidemiológicas han documentado que también pueden ser transmitidas de otras maneras (fómites, iatrogénica y transmisión vertical). Aunque el riesgo de transmisión perinatal del VPH es real (papilomatosis respiratoria juvenil), su incidencia es baja, menor al 3 %. La transmisión a través de la leche materna no ha sido demostrada.
Una vez dentro de la célula del huésped, el VPH puede utilizar diversos mecanismos para evitar la respuesta inmune, necesaria para aclarar la infección. Si la infección es persistente, la subsiguiente transformación viral resulta en la expresión de ciertas proteínas del VPH. La replicación del genoma se encuentra rigurosamente controlada por mecanismos dentro de la célula basal y parece estar ligada a la replicación celular del huésped, por lo que el ADN viral se replica dentro del genoma del huésped. El número de copias del genoma viral, es de forma circular (episomal) por lo tanto es bajo en los núcleos de las células basales y las proteínas virales codificadas se expresan a niveles muy bajos (12).
Como consecuencia, una célula basal infectada por el VPH no muestra cambios citológicos o histológicos específicos y no puede ser diferenciada de las células no infectadas. Este estadio de la infección por el VPH se conoce con el nombre de infección latente, o clínicamente inaparente, porque la mujer resulta positiva a la identificación para el ADN del VPH, pero no presenta ningún tipo de lesiones, aún bajo análisis microscópico. A medida que las células infectadas se diferencian y migran en el espesor del epitelio, la transcripción viral en la región temprana (ER) del genoma viral se incrementa de manera significativa. Para que esto se lleve a cabo, es fundamental la integración del genoma viral al genoma de la célula huésped mediante el rompimiento de la doble cadena de ADN viral (a nivel de E1/E2) y deleciones de algunas otras fracciones, especialmente E2, E4 y E5, liberando a los genes E6 y E7 del control supresor original ejercido por estos. Una vez ocurrido esto, los genes E6 y E7 son capaces de ejercer libremente su función oncogénica. Las regiones tempranas E6 y E7 de los VPH de alto riesgo son capaces de producir oncoproteínas denominadas: proteína E6 (pE6) y proteína E7 (pE7) que interfieren con el ciclo celular normal de la célula epitelial a través de su interacción con proteínas que normalmente son supresoras de tumores: la proteína de supresión tumoral 53 (p53) y la proteína supresora de tumores del retinoblastoma (pRB) (14).
Posteriormente, la infección subclínica puede ser identificada mediante un método de magnificación (colposcopia) o mediante evaluación visual (ácido acético del 3 % al 5 %) y se manifiesta por cambios microscópicos en el epitelio cervical (coilocitos, displasias) detectados en las citologías o cortes histológicos de los tejidos afectados.
Finalmente, la infección clínica se manifiesta por la aparición de lesiones identificables a simple vista. En cualquiera de estas etapas, el sistema inmune del huésped puede aclarar la infección y evitar el paso al siguiente nivel. Sólo aproximadamente, 1 de cada 10 mujeres desarrolla una infección persistente por el VPH y esto representa el determinante único más importante en la predicción del desarrollo de secuelas por la infección por VPH (13).
Las relaciones que existen entre los más de 118 tipos de VPH identificados actualmente con sus manifestaciones clínicas, permiten clasificarlos en tres grupos de acuerdo con la localización en la infección: epitelio cutáneo, epitelio mucoso del sistema respiratorio y epitelio mucoso del tracto ano-genital (14).
Actualmente se reconoce que la infección por el VPH juega un papel esencial en la patogénesis del cáncer cervical; en más del 99 % de cánceres de cuello uterino se ha podido identificar la presencia ADN del VPH de manera inequívoca. El objetivo inicial del virus son las células inmaduras de la capa basal del epitelio (estrato basal), y se supone que llega a ellas a través de micro abrasiones o grietas en el epitelio. La observación de que ciertos tipos de VPH que infectaban el tracto ano-genital, estaban muy relacionados con el desarrollo de cánceres, como es el caso del carcinoma cervical, dio lugar al establecimiento de una clasificación epidemiológica para los tipos de VPH, siendo considerados de alto o bajo riesgo, con base en su presencia o no, en el carcinoma cervical o en lesiones precursoras. Existe otra clasificación de los VPH, desde el punto de vista filogenético, establecido sobre la base de las secuencias de nucleótidos del genoma (15).
Östor (16) realizó diferentes trabajos donde se clasificaron los tipos de VPH, según datos obtenidos mediante estudios filogenéticos y epidemiológicos. Los genotipos de riesgo oncogénico alto son 14 tipos y son capaces de producir lesiones neoplásicas intraepiteliales cervicales (NIC) potencialmente invasivas, de ellos, ocho tipos: 16, 18, 31, 33, 35, 45, 52 y 58, causan el 95 % de los cánceres de cuello uterino. El tipo 16, el de mayor prevalencia, responde al 50 % a 60 % de los casos de cáncer cervical. El VPH 18, segundo en orden de prevalencia, representa el 10 % a 12 %. Sin embargo, esta prevalencia varía según los países y regiones. En relación a la historia natural de la enfermedad, este autor evaluó la regresión, persistencia y progresión. Para el NIC 1, la regresión es de 57 %, la persistencia de 32 % y la progresión de 11 % (1 % para cáncer invasor). Para el NIC 2 las frecuencias son de 43 %, 35 % y 22 % respectivamente, con una progresión a enfermedad invasiva de 5 %. Finalmente, el NIC 3 regresa en 32 %, persiste en alrededor de 56 % y puede progresar a cáncer en más del 12 % de los casos.
Es de vital importancia destacar que aun cuando la infección por VPH en personas jóvenes es muy frecuente, la mayoría de las mujeres infectadas, alrededor del 90 % resuelven la infección de manera espontánea, persistiendo solo una pequeña fracción de las mujeres con la infección. Debido a esto, el cáncer de cuello uterino se considera una consecuencia de la infección persistente por VPH de alto riesgo, por lo que es esperable que la incidencia de la infección por VPH tenga un pico máximo de incidencia por debajo de los 20 años de edad y decline de manera significativa en mujeres de 30 o más años. De allí que no se recomienda la determinación de ADN de VPH en mujeres menores de 30 años. Adicionalmente, se ha reportado un segundo pico de incidencia en mujeres a partir de los 65 años de edad, que, se supone, tiene relación con la reactivación de infecciones no detectables, adquiridas en etapas más tempranas, por una pérdida gradual de la inmunidad específica secundaria a los cambios hormonales propios de la posmenopausia, o por la adquisición de nuevas infecciones con nuevas parejas sexuales (13).
Se dice que la detección de un VPH de alto riesgo es un factor necesario, pero no suficiente, para desarrollar cáncer cervical. Por lo tanto, es factible pensar en la necesidad de la presencia de otros cofactores que intervengan en el proceso patológico. Estos cofactores pueden esquematizarse en 3 grupos (14):
1. Cofactores medioambientales: son factores exógenos entre los que se mencionan el hábito tabáquico, la coinfección con otros tipos de infecciones de transmisión sexual (Chlamydia trachomatis, Neisseria gonorrhoeae, virus del herpes simple, o Trichomonas vaginalis), y el uso de anticonceptivos hormonales, por más de 10 años.
2. Cofactores del huésped: incluyendo factores genéticos, hormonas endógenas, alta paridad y respuesta inmune (inmunosupresión).
3. Cofactores virales: infección por tipos específicos de VPH (de alto riesgo), coinfecciones con otros tipos de VPH, integración viral y carga viral.
Múltiples datos sugieren que el tiempo transcurrido para la progresión entre una lesión y otra (neoplasia intraepitelial cervical (NIC) 1 a NIC 2, NIC 2 a NIC 3, o NIC 3 a cáncer invasor) es en promedio de 4 años; y que el tiempo para llegar a un carcinoma invasor puede ser de hasta 14 años. Según el Colegio Americano de Obstetricia y Ginecología (ACOG) el progreso de una lesión tipo NIC 3 hasta carcinoma invasor en promedio tarda de 8,1 a 12,6 años (17). Es importante destacar que, como ya se ha señalado, a pesar de la relativamente alta prevalencia de la infección por el VPH, cerca del 70 % de las mujeres con infección por el VPH detectable aclararán de manera espontánea la infección en un lapso de 1 año y esta cifra asciende al 90 % a los 2 años (18).
Se define carcinoma in situ como una condición en la cual las células epiteliales malignas y su progenie se encuentran en, o cerca de, la posición ocupada por sus antecesores antes de que estos fueran a una transformación maligna. No han migrado más allá de la unión del epitelio con el tejido conectivo llamada membrana basal, y tal migración se manifestaría por la entrada de intersticios de tejido conectivo o cualquier parte del sistema vascular sanguíneo o linfático (19). En los últimos tiempos, la incidencia de los casos se ha incrementado, posiblemente debido a diferentes factores como los cambios de hábitos sexuales, la promiscuidad y, de mayor relevancia, la carencia de información para reducir los factores de riesgo a los que están expuestas las personas de ambos sexos.
Se han establecidos como factores predisponentes y significantes para el cáncer, el inicio de relaciones sexuales a temprana edad, que puede estar relacionada con la primo infección por VPH, la edad del primer parto, las infecciones genitales recurrentes, el comportamiento sexual y el número de parejas sexuales (10). Al respecto, se ha señalado que el inicio precoz de las relaciones sexuales es un factor determinante en la adquisición del VPH, asociado al factor inmunológico e inmadurez cervicouterino propio de la adolescencia (20). La promiscuidad en la actualidad aumenta, porque muchas personas mantienen contacto sexual con múltiples parejas, con penetración vaginal, anal y buco genital, lo que aumenta el riesgo de infección por VPH. Los anticonceptivos orales y el hábito de fumar han mostrado un efecto moderado, más no significativo. La paridad y el estado nutricional se han asociado de manera inconsistente en diferentes estudios (18). Moreno y col. (19) señalan que el uso de anticonceptivos orales (ACO) está indirectamente relacionado con la aparición y desarrollo del cáncer de cuello uterino al compararlo con el método de barrera; se ha observado que las pacientes que usan ACO inician coito a menor edad, son más sexualmente activas y tienen múltiples parejas, además de ser pacientes portadoras del VPH.
Las verrugas genitales aparecen, por lo general, como elevaciones o masas suaves y húmedas, rosadas o de color de la piel, usualmente en el área genital. Las verrugas pueden ser planas a elevadas, únicas o múltiples, pequeñas o grandes y en ciertos casos tienen formas de coliflor. Pueden aparecer en la vulva, la vagina o el ano o alrededor de los mismos, en el cuello uterino, en el pene, escroto, en la ingle o los muslos; las verrugas pueden aparecer semanas o meses después del contacto sexual con la persona infectada o puede que no aparezcan (20,21).
Los métodos para la detección de VPH en tejido, se dividen en tradicionales y moleculares. La observación en el microscopio de luz es un método no específico, pero es el más utilizado en el despistaje poblacional. La sensibilidad de la citología, alcanza un 64 % tomando como prueba de oro el estudio histológico (22). El microscopio electrónico y el microscopio de luz no permiten la determinación de los genotipos específicos presentes. La colposcopia es un método indispensable para el diagnóstico de la infección subclínica del cuello uterino, vagina, vulva y pene, pero no permite distinguir con seguridad entre infección por VPH y las NIC, como tampoco distinguir los diferentes genotipos del virus. La biopsia del cuello permite diagnosticar lesiones atípicas o pigmentadas que clínicamente sugieren malignidad (23).
Los métodos de detección molecular comprenden una variedad de técnicas de hibridación del ácido nucleico y nuevos métodos de amplificación. Una de las características comunes de estos métodos es la necesidad de aislar primero el ácido nucleico. La hibridación por Southem Blot, hasta hace poco, servía de estándar de oro para la detección de VPH en tejido. La hibridación Dot/stot blot es una técnica muy similar a la anterior, pero es más fácil de hacer, con mejor reproducibilidad y se realiza en menor tiempo. Sin embargo, no es tan específica y no puede distinguir entre ADN episomal o integrado. El test de captura de híbrido es actualmente una de las técnicas más usadas para la detección de infección por VPH. La hibridación in situ es la única técnica que permite visualizar la distribución topográfica de la secuencia de ADN o ARN viral en preparaciones citológicas o cortes tisulares, esta técnica permite determinar si el ADN viral se encuentra albergado en las células tumorales o en el tejido adyacente normal. El método de replicación de ADN, llamado reacción en cadena de la polimerasa (PCR), se basa en la capacidad de la ADNpolimerasa para copiar una cadena de ADN por elongación de cadenas complementarias, iniciando la síntesis a partir de unos cebadores o iniciadores (24).
No existe tratamiento curativo para la infección por el VPH, aunque en la mayoría de los pacientes desaparece por sí sola, por este motivo se recomienda el tratamiento para este tipo de infecciones solo cuando hay verrugas visibles o lesiones intraepiteliales escamosas de alto grado.
Entre los tratamientos disponibles se encuentran medicamentos tópicos: geles y cremas tópicas (Podofilox, podophyllum, ácido tricloroacético e imiquimod) que se usan para el tratamiento de las verrugas genitales con una efectividad del 30 % - 80 % para disminuir el tamaño de la verruga genital. Se puede usar crioterapia, tratamiento con láser y/o resección quirúrgica (24). La cirugía radical, la radioterapia y la quimioterapia se reservan para el tratamiento del cáncer, según el estadio clínico (10).
Las medidas preventivas son las mismas que se mencionan para todas las enfermedades en los programas preventivos de salud, deben basarse en la información y educación a la población con mayor riesgo como son los adolescentes; el profesional de la salud, a través de los procesos educativos formales e informales, proporciona información necesaria a los usuarios, a fin de que apliquen las medidas preventivas que minimicen la propagación de la infección de transmisión sexual, específicamente el VPH. También se incluye la promoción de campañas, a través de los medios de comunicación masivos, sobre los riesgos de las enfermedades de transmisión sexual. Deben considerarse principalmente tres aspectos, la abstinencia sexual, la forma más segura, aunque poco práctica y difícil de lograr, el uso de métodos anticonceptivos de barrera (condón) y evitar la promiscuidad.
La vacuna contra el VPH representa una necesidad urgente, a la vez que una esperanza, para causar algún impacto significativo en las estadísticas que se han reportado casi inalterables, a pesar de las grandes inversiones en programas de pesquisa (25). El desarrollo de vacunas contra la infección por el VPH es promisorio en la prevención y tal vez, en la limitación o reversión de secuelas de aquellas pacientes ya infectadas. Las vacunas contra el VPH se pueden clasificar en vacunas profilácticas y vacunas terapéuticas. La respuesta local y humoral protege contra la infección inicial y la respuesta inmune mediada por células parece jugar un importante papel en la persistencia de la infección y en la regresión de la misma (14, 24).
Las vacunas profilácticas contra el VPH, desarrolladas mediante tecnología recombinante que clona el gen L1 y las proteínas de la cápside producidas por este, son capaces de autoensamblarse en partículas morfológicamente similares al virus partículas similares al virus (VLP) que no contienen ADN viral, pero son capaces de estimular la respuesta inmune (26). La tetravalente ha demostrado tener una eficacia de 90 % a 100 % de protección para los tipos virales contenidos en la vacuna (altos niveles de anticuerpos neutralizantes) y mantener los niveles de anticuerpos (AC) 5 veces superior al observado como consecuencia de la infección natural, por 5 años. La bivalente mantiene los niveles de AC, 11 veces el nivel de una infección natural hasta por 6,4 años y ha demostrado generar protección cruzada contra la infección por VPH 45 y 31 (26). Recientemente se aprobó una vacuna nonavalente. Ninguna de estas vacunas ha sido aprobada para su uso en Venezuela.
En este estudio se ha previsto determinar el grado de información sobre la infección genital por el virus de papiloma humano que posee un grupo de pacientes. Así mismo relacionar la información con los factores de riesgo para la infección por este virus y el desarrollo de cáncer de cuello uterino. Es de gran importancia determinar los puntos débiles en la información que poseen las pacientes sobre este tema. Se espera que la información obtenida sirva de base para el desarrollo de actividades que acentúen la promoción, educación y divulgación de políticas de salud destinadas a la prevención de la infección por el virus de papiloma humano, evitando de esa manera el cáncer de cuello uterino.
MÉTODOS
Se realizó un estudio prospectivo, descriptivo, transversal que incluyó una muestra probabilística de 372 pacientes que acudieron al Servicio de Ginecología de la Maternidad Concepción Palacios. Se excluyeron pacientes con discapacidad mental, visual, auditiva que dificultaran el llenado de la encuesta. Todas las participantes firmaron un consentimiento informado. Las encuestas se aplicaron, previa validación del instrumento de acuerdo a los criterios de 3 expertos. Posteriormente se acudió al departamento de historias médicas con la finalidad de complementar los datos obtenidos en la encuesta.
Se calculó la media y la desviación estándar de las variables continuas y las frecuencias y porcentajes de las variables nominales. El análisis de las diferencias entre variables continuas, respecto al nivel de conocimiento, se basó en la prueba ANOVA de una vía; en el caso de las variables nominales, se aplicó la prueba chi-cuadrado de tendencias. Se consideró un valor estadísticamente significativo si P < 0,05.
RESULTADOS
De las 372 pacientes a quienes se le realizó la encuesta, 97 (26,1 %) tuvieron de 1 a 4 respuestas correctas, por lo cual se clasificó su grado de información como malo; 18 (4,8 %) tuvieron 5 a 7 respuestas correctas y su gado de información se consideró regular. En 257 mujeres (69,1 %) que tenían 8 o más respuestas correctas, se consideró que poseían un grado de información bueno.
En la tabla 1, se indican los factores de riesgo para cada uno de los grupos; la edad promedio fue de 47 ±15 años en mujees con grado de información malo, 42±16 años con un nivel regular de información y 41±12 años entre aquellas con buena información. (P = 0,000).
En cuanto al número de parejas resultó de 2 a 3 parejas sexuales y la edad de la primera relación sexual fue en promedio a los 18 años de edad; de manera uniforme para los tres grupos. Con respecto al consumo de tabaco, 81 pacientes (22 %), eran fumadoras. La diferencia entre los tres grupos no fue significativa (P=0,860). El tiempo de consumo en promedio fue de 154 ± 103 meses, 116 ± 80 meses y 132 ± 96 meses, respectivamente. En relación al método anticonceptivo utilizado, 158 (42,4 %) usaba anticonceptivo hormonal, de las cuales 120 (46,7 %) tenían un buen conocimiento sobre la infección por este virus (P=0,140). En cuanto al uso de los métodos de barrera como el condón, 120 (32,2 %) manifestaron usarlo, de ellas, 79 (30,7 %) presentaba un conocimiento bueno sobre el tema (P=0,135).
La tabla 2 presenta la distribución de pacientes por grupo de edad, se encontró que, entre las pacientes con buena información, 56,8 % tenían entre 26 y 45 años y en el grupo de bajo grado de conocimiento, 36,1 % pertenecían a esos grupos etarios. (P= 0,000). De las 372 pacientes, 176 (47 %) se encontraban infectadas. Entre las pacientes con buen nivel de conocimiento, 151 (58,8 %) estaban infectadas y 106 (41,2 %) no. Las pacientes infectadas tenían mejor nivel de información (P= 0,001) (Tabla 3).
Al distribuir las pacientes según el nivel socioeconómico, no se encontraron pacientes en el estrato Graffar I y 221 (59 %) se ubicaban en el Graffar IV. Sesenta y tres (64,9 %) de las que tenían poca información y 151 (58,8 %) de las que tenían un buen conocimiento sobre la infección por el VPH pertenecían al estrato IV (P= 0,000) (Tabla 4). De las 176 pacientes infectadas 108 (61 %) se ubicaron en el Graffar IV (Gráfico 1).
En cuanto a la distribución de pacientes según el nivel de instrucción, se encontró que 237 pacientes (64 %) se concentraron en el nivel de primaria, 75 (77,3 %) con bajo nivel de información y 151 (58,8 %) con alto nivel. Entre aquellas que cursaban secundaria, solo tenían bajo nivel de conocimiento 16,5 % mientras que 31,9 % tenían buen nivel (P=0,000) (Tabla 5). De las 176 pacientes infectadas 110 (63 %) poseían un nivel de instrucción primaria o analfabeta (Gráfico 2).
En la Tabla 6 se presentan datos para evaluar la calidad de la información que poseen las pacientes, 279 de las 372 pacientes (75 %) manifestó conocer sobre el VPH. La fuente de información reportada resultó ser la escuela en 25,4 %. Cuando se les preguntó si consideraban el VPH como una ITS, 268 pacientes (96,1 %) respondieron que sí, 262 (93,9 %) respondieron que se trasmite a través de relaciones sexuales y 188 (67,4 %) aseguraron que puede ser transmitido por el hombre y la mujer; 64 mujeres, (22,9 %) respondieron que solo el hombre puede trasmitir la infección; 251 (90 %) de las que dijeron conocer la infección, reportaron el uso del condón como método de protección, 79,6 % cree que el inicio de las relaciones sexuales a temprana edad se relaciona con la infección y 93,5 % respondió que tener varias parejas sexuales predispone a la infección.
Al preguntarle si el virus se relaciona con las verrugas genitales respondieron de manera afirmativa 247 (88,5 %) y 201 (72 %) manifestaron que la opción de tratamiento para control de la enfermedad debía ser aplicado por el ginecólogo, 238 (85,3 %) dijo conocer el método diagnóstico, y 225 (80,64 %) señalaron a la citología. Finalmente, 163 (58,42 %) desconoce la existencia de una vacuna para prevenir esta enfermedad.
DISCUSIÓN
La infección genital por el virus del papiloma humano, afecta un alto porcentaje de las mujeres sexualmente activas en todo el mundo, principalmente en países en vías de desarrollo y población adolescente; es evidente la preocupación existente dentro del gremio médico respecto al terreno que ha ganado el contagio por el VPH en la población femenina venezolana, la presente investigación, basada en encuestas como instrumento para sondear el grado de información sobre el virus, muestra una clara evidencia del fenómeno: 47 % de las pacientes resultó estar infectada con el VPH.
Se evidenció que 8 de cada 10 pacientes encuestadas conocía sobre el tema, de las cuales 7 tenían un grado de información clasificado como bueno de acuerdo al análisis de los resultados. Asimismo manifestaron saber que el VPH era una infección de transmisión sexual, que se transmitía a través de las relaciones sexuales y más aún, la mayoría manifestó conocer sobre cómo protegerse y mencionaron el condón como método de protección.
Esto concuerda con Nur (7) quien reportó que las adolescentes tenían un buen nivel de conocimiento. Según ese estudio, todo pareciera indicar que el tema de la falta de información no representa un factor preponderante como causa del alto porcentaje de contagio, sin embargo, difiere del estudio de Bueno y col. (9), quienes concluyeron que el 62 % de sus entrevistadas no tenía claro lo que es el VPH ni las manifestaciones de la enfermedad, desconocían la forma de transmisión, el método de protección y control de la enfermedad. Probablemente, las características de las pacientes incluidas en ambos estudios sean diferentes.
Respecto a los factores de riesgo como la edad, más de la mitad de las pacientes con buen grado de información se concentraban en edades comprendidas entre 26-45 años de edad; este porcentaje fue menor para las pacientes con bajo nivel de conocimiento entre quienes predomina una edad mayor. En ambos grupos, hay alrededor de un 10 % de mujeres menores de 25 años. Este hecho debe causar alerta en vista de que la población femenina venezolana se trata de pacientes jóvenes, en su mayoría con lesiones de bajo grado, que tienen posibilidad de evolucionar a lesiones de alto grado (25). Por ello se recomienda la difusión con campañas publicitarias a través de medios de comunicación masiva como la televisión y las redes sociales, e incluirlo como tema obligatorio en el pensum escolar, en vista de su relación con el cáncer de cuello uterino, que produce alrededor de 300 000 muertes en mujeres en el mundo (3), y considerando que para el año 2009 en Venezuela fallecieron 1602 mujeres por esa causa (5).
Así mismo, es importante la aprobación y adquisición de la vacuna contra el VPH por el Ministerio del Poder Popular para la Salud y su aplicación en el Plan Nacional de Vacunación como una necesidad urgente y una esperanza, para causar algún impacto significativo en las estadísticas.
Al evaluar la edad en que las pacientes tuvieron su primera relación sexual, el promedio fue de 18 años para todos los grupos de información. Cabría esperar que en el grupo de pacientes que conoce los riesgos, el inicio de la actividad sexual se retrasara, sin embargo la distribución fue independiente del nivel de conocimiento. Es decir, aun manifestando saber y conocer el riesgo, se exponen al mismo.
En relación al consumo de tabaco, se asocia fuertemente a lesiones malignas del cuello uterino por la actividad de la nicotina y cotina para iniciar o actuar como carcinógeno, causar inmunosupresión y disminución de antioxidantes (20), en la presente investigación poco más del 20 % de las pacientes eran fumadoras y el grado de información fue independiente del hábito tabáquico.
Los métodos anticonceptivos recomendados para la protección contra la infección por el VPH son los métodos de barrera, la población estudiada manifestó utilizar en mayor porcentaje el método hormonal y el condón en segundo lugar. La distribución en todos los grupos de información fue uniforme.
Según Colmenares y col. (10), las usuarias presentan deficiencias en el conocimiento sobre el VPH. Globalmente, la población presenta déficit importante en cuanto a los conocimientos relacionados con el VPH, cáncer cervical, prevención y vacunación. Esto puede ser debido al bajo nivel educativo, que conlleva a poca comprensión. Los resultados de esta investigación indican que el mayor número de pacientes se concentra en el nivel de instrucción primaria. Este guarda una estrecha relación con el nivel de conocimiento, siendo mayor el porcentaje de mujeres que tenían bajo conocimiento y cursaron solo la primaria o incluso eran analfabetas, que aquellas con buen nivel, que tenían ese mismo grado de instrucción. Asimismo, en este grupo hubo 22 universitarias. A mayor preparación general de la mujer, mayor es la posibilidad de tener y comprender información médica que puede a su vez ser de gran importancia en la prevención primaria de la infección. Hay que recordar que, como recurso para la prevención primaria, en ausencia de la vacunación, la educación es fundamental para evitar los factores de riesgo. Entre las pacientes que en algún momento han tenido el diagnóstico de infección por VPH, un número elevado estaban en primaria.
Respecto al nivel socioeconómico, casi 60 % de las pacientes se ubicó en el Graffar IV y más del 20 % en el Graffar III. Sin embargo, se observó una diferencia significativa en la distribución, con mayor número de pacientes en Graffar IV y menor en Graffar III en el grupo que manejaba menos información. El bajo nivel socioeconómico probablemente esté relacionado con el abandono de la escuela y por ende con la menor posibilidad de que exista una mayor oportunidad e interés en adquirir información, así como mejor comprensión de la información que se recibe.
Se pudiera pensar que el desconocimiento sobre la promoción de la salud en la prevención de las enfermedades de transmisión sexual, sea la causa para la mayor incidencia de las mismas. En los últimos tiempos, la incidencia de los casos se ha incrementado, posiblemente debido a diferentes factores como los cambios de hábitos sexuales, la promiscuidad y, con mayor relevancia, la carencia de información para reducir los factores de riesgo a los que están expuestas las personas de ambos sexos (13). Sin embargo, en la presente investigación las pacientes demostraron poseer información sobre la infección por este virus, factores de riesgo, medio de transmisión, prevención y tratamiento. Cuando se compara el número de pacientes infectadas en cada grupo, se observó que, entre las pacientes con baja información, la frecuencia de infección fue de casi 20 %, mientras que entre las que tenían mejor nivel de información, cerca del 60 % tenían el antecedente. Ello se explica porque, una vez diagnosticadas, las pacientes tienden a informarse sobre el proceso que les afecta, además, el personal médico involucrado ofrece información al momento de participar el diagnóstico.
De lo anteriormente expuesto, se puede concluir que las pacientes presentan un grado de información clasificado como bueno sobre la infección genital por VPH. El grado de información fue independiente de la presencia de factores de riesgo tales como la primera relación sexual, el nivel socioeconómico y el nivel de instrucción. Las pacientes con mejor información son más jóvenes.
Se recomienda implementar campañas publicitarias a través de medios de comunicación masiva como la televisión y redes sociales, incluir como tema obligatorio en el pensum escolar la infección por el VPH y sus implicaciones, así como extender la investigación a otros centros hospitalarios, para diversificar el nivel socioeconómico de la muestra.
REFERENCIAS
1. Rivera R, Aguilera J, Larraín A. Epidemiología del virus papiloma humano (HPV). Rev Chil Obstet Ginecol. 2002; 67 (6): 501-506. [ Links ]
2. Rocha R, Juárez M, Ruiz M, Ramírez X, Gaytán M, Contreras P. Identificación de factores de riesgo para contraer virus del papiloma humano en sexo servidoras. Rev Cubana Obstet Ginecol. 2012; 38 (2): 244-255. [ Links ]
3. Organización Panamericana de la Salud. [Internet]. Washington DC: Estrategia y plan de acción regional para la prevención y el control del cáncer cervicouterino en América Latina y el Caribe. 2008. [Consultado 1/9/2013]. Disponible en: http://www.paho.org/hq/index.php?option=com_topics & view=article & id=348 & Itemid=40936 & lang=es#mandates [ Links ]
4. Alterio-Ariola G, Pérez-Loyo H. Necesidades sentidas de conocimiento sobre el virus de papiloma humano (VPH) en las pacientes que acuden a la consulta de ginecología. Propuesta de un programa educativo. Sociedad Anticancerosa del Edo. Lara. Bol Med de Postg. 2004; 20 (1): 21-27. [ Links ]
5. Capote L. Perfil epidemiológico y control del cáncer en Venezuela. Gac Méd Caracas. 2013; 121 (1):43-52. [ Links ]
6. Cortés A, García R, Monterrey P, Fuentes J, Pérez D. Encuesta sobre comportamientos sexuales riesgosos y enfermedades de transmisión sexual en estudiantes adolescentes de Ciudad de La Habana, 1996. Rev Cubana Med Trop. 1996; 51 (2): 120-124. [ Links ]
7. Nur F. Nivel de información sexual en adolescentes femeninas de la Unidad Educativa Colegio Los Próceres septiembre 1994-febrero 1995, Barquisimeto, Edo. Lara. Bol méd postgrado. 1997; 13 (1): 20-27. [ Links ]
8. Tamayo L, Valencia M, Escobar S, Pérez L, Villa M, Bedoya A. Tendencia de la infección por el virus papiloma humano (VPH) en usuarias del Servicio de Citología del Laboratorio Docente Asistencial de la Escuela de Bacteriología y Laboratorio Clínico de la Universidad de Antioquia, 1993-1998. Rev Fac Farmacia. 2001; 42: 20-26. [ Links ]
9. Bueno A, Landaeta M, Morly I, Santos F. Programa de Educación para la salud sobre el virus de papiloma humano genital dirigido a las usuarias que asisten a la consulta de ginecología y obstetricia del Ambulatorio Paraparal, Los Guayos, Edo. Carabobo [Trabajo Especial de Grado] Caracas (Distrito Capital): Universidad Central de Venezuela; 2004. [ Links ]
10. Colmenares S, Contreras R, Valera C. Programa de Educación para la Prevención del virus del papiloma humano (VPH) dirigido a las usuarias que asisten a la consulta de ginecología del Hospital General del Oeste Dr. José Gregorio Hernández de los Magallanes de Catia en el tercer trimestre del año 2005. [Trabajo Especial de Grado] Caracas (Distrito Capital): Universidad Central de Venezuela; 2005. [ Links ]
11. Melnikow J, Nuovo J, Willan AR, Chan BK, Howell LP. Natural history of cervical squamous intraepithelial lesions: a meta-analysis. Obstet Gynecol. 1998; 92(4): 727-735. [ Links ]
12. Burd EM. Human papillomavirus and cervical cancer. Clin Microbiol Rev. 2003; 16(1): 1-17. [ Links ]
13. Carreras R, Xercavins J, Checa M. Virus del papiloma humano y cáncer de cuello de útero. Madrid: Editorial Médica Panamericana; 2008. [ Links ]
14. Bosch FX, Qiao YL, Castellsagué X. The epidemiology of human papillomavirus infection and its association with cervical cancer. Int J Gynecol Obstet. 2006; 94(S1): S8-S21. [ Links ]
15. Steben M, Duarte-Franco E. Human papillomavirus infection: epidemiology and pathophysiology. Gynecol Oncol. 2007; 107(2): S2-S5. [ Links ]
16. Östor AG. Natural history of cervical intraepithelial neoplasia: a critical review. Int J Gynecol Pathol. 1993: 12 (2): 186-192. [ Links ]
17. American College of Obstetricians and Gynecologists. ACOG Practice Bulletin No. 99: management of abnormal cervical cytology and histology. Obstet Gynecol. 2008; 112(6): 1419-1444. [ Links ]
18. Huh WK. Human papillomavirus infection: a concise review of natural history. Obstet Gynecol. 2009; 114(1): 139-143. [ Links ]
19. Moreno V, Bosch FX, Muñoz N, Meijer CJ, Shah KV, Walboomers JM, y col. Effect or oral contraceptives on risk of cervical cancer in women with human papillomavirus infection: The IARC multicentric casecontrol study. Lancet. 2002; 359(9312): 1085-1092. [ Links ]
20. Handsfield H. Enfermedades de transmisión sexual. 2ª edición. España: Marban; 2002. [ Links ]
21. Hernández BY, Mc Duffie K, Zhu X, Wilkens LR, Killeen J, Kessel B, y col. Anal human papillomavirus infection in women and its relationship with cervical infection. Cancer Epidemiol Biomarkers Prev. 2005; 14 (11): 2550-2556. [ Links ]
22. Calatroni CJ, Ruiz V. Ginecología. Tercera edición. Buenos Aires: Médica Panamericana. 1994. [ Links ]
23. Franco E, Syrijäen K, de Wolf C, Patnick J, Ferenczy A, McGoogan E y cols. New developments in cervical cancer screening and prevention. Geneva, Switzerland, June 17-19 1996. Workshop. Cancer Epidemiol Biomarkers Prev. 1996; 5 (10): 853-856. [ Links ]
24. Santos-Ortiz C. Virus de papiloma humano y cáncer de cuello uterino en el Perú. Rev Per Ginecol Obstet. 2007; 53 (2): 98-100. [ Links ]
25. Somogyi L, Malpica C, Carrillo D, Rodríguez E. Vacunación VPH. Propuesta bioética y consentimiento informado. Rev Obstet Ginecol Venez. 2009; 69 (1):48- 55. [ Links ]
26. Ma B, Xu Y, Hung CF, Wu TC. HPV and Therapeutic Vaccines: Where are we in 2010? Curr Cancer Ther Rev. 2010; 6 (2): 81-103. [ Links ]^rND^sRivera^nR^rND^sAguilera^nJ^rND^sLarraín^nA^rND^sRocha^nR^rND^sJuárez^nM^rND^sRuiz^nM^rND^sRamírez^nX^rND^sGaytán^nM^rND^sContreras^nP^rND^sAlterio-Ariola^nG^rND^sPérez-Loyo^nH^rND^sCapote^nL^rND^sCortés^nA^rND^sGarcía^nR^rND^sMonterrey^nP^rND^sFuentes^nJ^rND^sPérez^nD^rND^sNur^nF^rND^sTamayo^nL^rND^sValencia^nM^rND^sEscobar^nS^rND^sPérez^nL^rND^sVilla^nM^rND^sBedoya^nA^rND^sMelnikow^nJ^rND^sNuovo^nJ^rND^sWillan^nAR^rND^sChan^nBK^rND^sHowell^nLP^rND^sBurd^nEM^rND^sBosch^nFX^rND^sQiao^nYL^rND^sCastellsagué^nX^rND^sSteben^nM^rND^sDuarte-Franco^nE^rND^sÖstor^nAG^rND^sHuh^nWK^rND^sMoreno^nV^rND^sBosch^nFX^rND^sMuñoz^nN^rND^sMeijer^nCJ^rND^sShah^nKV^rND^sWalboomers^nJM^rND^sHernández^nBY^rND^sMc^nDuffie K^rND^sZhu^nX^rND^sWilkens^nLR^rND^sKilleen^nJ^rND^sKessel^nB^rND^sFranco^nE^rND^sSyrijäen^nK^rND^sde Wolf^nC^rND^sPatnick^nJ^rND^sFerenczy^nA^rND^sMcGoogan^nE^rND^sSantos-Ortiz^nC^rND^sSomogyi^nL^rND^sMalpica^nC^rND^sCarrillo^nD^rND^sRodríguez^nE^rND^sMa^nB^rND^sXu^nY^rND^sHung^nCF^rND^sWu^nTC^rND^1A01^nMarisé^sSolorzano^rND^1A01^nMarco^sBastidas^rND^1A01^nMilitza^sQuintero^rND^1A02^nLisbeth^sRojas^rND^1A02^nDomingo^sStea^rND^1A03^nSaúl^sVillasmil^rND^1A04^nVíctor^sAcosta^rND^1A04^nCarmen^sMarín^rND^1A04^nAna^sRamírez^rND^1A01^nNatasha^sBlanco^rND^1A01^nJhon^sCruz^rND^1A01^nJuan^sPuig^rND^1A01^nMarisé^sSolorzano^rND^1A01^nMarco^sBastidas^rND^1A01^nMilitza^sQuintero^rND^1A02^nLisbeth^sRojas^rND^1A02^nDomingo^sStea^rND^1A03^nSaúl^sVillasmil^rND^1A04^nVíctor^sAcosta^rND^1A04^nCarmen^sMarín^rND^1A04^nAna^sRamírez^rND^1A01^nNatasha^sBlanco^rND^1A01^nJhon^sCruz^rND^1A01^nJuan^sPuig^rND^1A01^nMarisé^sSolorzano^rND^1A01^nMarco^sBastidas^rND^1A01^nMilitza^sQuintero^rND^1A02^nLisbeth^sRojas^rND^1A02^nDomingo^sStea^rND^1A03^nSaúl^sVillasmil^rND^1A04^nVíctor^sAcosta^rND^1A04^nCarmen^sMarín^rND^1A04^nAna^sRamírez^rND^1A01^nNatasha^sBlanco^rND^1A01^nJhon^sCruz^rND^1A01^nJuan^sPuig
Detección y tipificación de virus del papiloma humano en biopsias de carcinoma ductal infiltrante y lesiones benignas de mama en mujeres venezolanas
Mg. Scs. Marisé Solorzano1, Marco Bastidas1, Militza Quintero1, Lisbeth Rojas2, Domingo Stea2, Saúl Villasmil3, Víctor Acosta4, Carmen Marín4, Ana Ramírez4, Lcda. Natasha Blanco1, Drs. Jhon Cruz1, Juan Puig1.
1 Laboratorio de Biología y Medicina Experimental de la Universidad de Los Andes. 2 Laboratorio de Histopatología e Inmunohistoquímica Domingo Stea Mérida – Venezuela. 3 Universidad Central de Venezuela. Caracas – Venezuela. 4 Centro Clínico de Estereotáxia (CECLINES). Caracas – Venezuela.
RESUMEN
Objetivo: Realizar la detección y tipificación del virus del papiloma humano (VPH) en muestras de biopsias de tejido mamario con carcinoma ductal infiltrante.
Métodos: Estudio descriptivo de corte transversal de 57 biopsias de carcinoma ductal infiltrante, y 41 biopsias de lesiones benignas de mama de pacientes venezolanas, estas fueron evaluadas utilizando la técnica PCR-RFLP en busca de la presencia del genoma del virus de papiloma humano. El riesgo OR fue evaluado mediante análisis estadístico con el paquete SPSS 12.0.
Resultados: Treinta y tres (57,9 %) de las muestras de carcinoma ductal infiltrante tuvieron un resultado positivo para virus de papiloma humano, 19 de ellas pudieron ser tipificadas como: VPH-6b 15,15 %; VPH-11 3,03 %; VPH-18 12,12 %; VPH-33 27,27 %; VPH-45 3,03 % y VPH-58 3,03 %; de este grupo el 42,4 % fueron positivas no determinadas para la presencia de ADN del virus. Seis biopsias de lesiones benignas (14,6 %), presentaron infección por virus de papiloma humano, determinándose para ellas los tipos VPH-6b 33,33 %, VPH-11 16,67%, VPH-33 16,67% y 33,33 % positivas no determinadas. Se determinó estadísticamente que la presencia de virus de papiloma humano en tejido mamario aumenta 10,77 veces la posibilidad de desarrollar carcinoma ductal infiltrante.
Conclusiones: Los hallazgos corroboran los resultados de otros investigadores, colocando al virus de papiloma humano como posible agente involucrado en la inmortalización de las células epiteliales de la mama.
Palabras clave: Carcinoma de mama, Carcinoma ductal infiltrante, Virus de papiloma humano, Tipificación de VPH, PCR-RFLP.
SUMMARY
Objective: To perform the detection and typing of human papilloma (HPV) virus in biopsy samples of breast tissue invasive ductal cancer.
Methods: Cross-sectional study of 57 biopsies of invasive ductal carcinoma, and 41 biopsies of benign breast lesions of Venezuelan patients were evaluated using the PCR-RFLP technique for the presence of the human papillomavirus genome. The OR risk was evaluated by statistical analysis using SPSS package.
Results: Thirty-three (57.9%) of invasive ductal carcinoma samples had a positive result for human papillomavirus, 19 of them could be classified as: HPV-6b 15.15%; HPV-11 3.03%; HPV-18 12.12%; HPV-33 27.27%; HPV-45 3.03% and HPV-58 3.03%. This group 42.4% were positive not determined for the presence of virus DNA. Six biopsies of benign lesions (14.6%) had human papillomavirus infection, determining for themselves the types HPV-6b 33.33%, 16.67% HPV-11, HPV-33 16.67% and 33.33% not determined positive. It is statistically determined that the presence of human papillomavirus in breast tissue 10.77 times increases the possibility of developing invasive ductal carcinoma.
Conclusions: These findings corroborate the results of other researchers, placing human papillomavirus as a possible agent involved in the immortalization of epithelial cells of the breast.
Keywords: Breast cancer, Infiltrating ductal carcinoma, HPV, HPV typing, PCR-RFLP.
INTRODUCCIÓN
La asociación de algunos virus con tejidos neoplásicos ha aportado, en las últimas décadas, argumentos decisivos para la identificación de los factores desencadenantes de la transformación celular. Esto ha permitido establecer las bases genéticas del cáncer, válidas también para aquellas neoplasias no inducidas por virus (1). A nivel mundial, el carcinoma de mama presenta una incidencia del 43,1 % siendo la primera causa de muerte por cáncer en mujeres, seguido del carcinoma colorectal (14,3 %) y del carcinoma cervicouterino (14,0 %). En países en vías de desarrollo la incidencia del carcinoma de mama es del 31,3 % seguido del carcinoma cervicouterino con una incidencia del 15,4 %. En países desarrollados el carcinoma de mama presenta una incidencia del 73,4 % mientras que el carcinoma de cuello uterino presenta una incidencia de solo el 9,9 % (2 - 4). Las infecciones con el virus del papiloma humano (VPH) están estrechamente ligadas al desarrollo de carcinoma cervical y representan una de las enfermedades de transmisión sexual más comunes a nivel mundial (5, 6). Desde los reportes iniciales realizados por Harald zür Hausen (7), en los años setenta, sugiriendo la participación del VPH en el desarrollo de carcinoma cervical, han sido numerosos los estudios moleculares, epidemiológicos y clínicos que claramente implican al VPH como uno de los agentes etiológicos en diversos tipos de cáncer tales como: carcinoma anogenital, cervical, de pene, de vejiga y más recientemente, carcinomas mamarios (4, 8, 9). El desarrollo del carcinoma mamario se encuentra asociado a factores tanto ambientales como genéticos. Se ha propuesto recientemente que el VPH puede ser un factor importante en la aparición y desarrollo de carcinoma de mama (10). El VPH representa un problema de salud pública, encontrándose en más del 70 % de la población venezolana (11). Este virus ha sido recientemente identificado en tejido neoplásico de mama en diferentes laboratorios alrededor del mundo, indicando que posiblemente exista un vínculo entre la presencia de VPH y el inicio de la enfermedad. Existen diferentes tipos de cáncer de mama, dentro de las más comunes están: el carcinoma ductal infiltrante, el carcinoma lobulillar infiltrante y sus contrapartes neoplásicas intraepiteliales (12, 13). El carcinoma ductal infiltrante (CDI), representa 80 % de los carcinomas de mama; el carcinoma lobulillar infiltrante el 15 % (10). La vía molecular que relaciona el papiloma virus con el carcinoma de mama es aún incierta, aunque existen varios estudios que han reportado VPH de alto riesgo en más del 50 % de biopsias de carcinoma de mama en diferentes países (14 - 22). Incluso, se ha reportado en una misma paciente, un único tipo de VPH tanto en carcinoma de mama como en carcinoma cervical (23, 24). Cifras del Ministerio del Poder Popular para la Salud, publicadas en el Anuario de Mortalidad de 2010 (25), revelan que, de las 21 185 personas fallecidas por cáncer, 10 269 fueron mujeres con carcinoma de mama, representando la primera causa de muerte por cáncer en la mujer venezolana y el mayor número de muertes se registró en edades comprendidas entre 45 y 64 años. En Venezuela, el 80 % de los casos de carcinoma de mama se detecta en etapa avanzada y el 20 % en etapa temprana, mientras en el mundo la proporción es inversa (25). Debido a esto, el presente trabajo se enfoca en realizar la detección de VPH y su tipificación en biopsias de tejido mamario neoplásico de pacientes venezolanas.
MÉTODOS
Se realizó un estudio de casos y controles, descriptivo, de corte transversal, de 98 biopsias de lesiones de tejido mamario embebido en parafina, colectadas aleatoriamente del Laboratorio de Histopatología e Inmuno-histoquímica Domingo Stea (Mérida- Venezuela) y del Centro Clínico de Estereotaxia (Caracas-Venezuela). Las biopsias incluyeron 57 muestras de carcinoma ductal infiltrante y 41 muestras de lesiones benignas de mama (fibroadenoma y cambios fibroquísticos). Para cada una de ellas se hicieron diez cortes histológicos de 10 μm de espesor a partir del bloque de parafina. La extracción de ADN se inició con el desparafinado mediante el método de Mirshahabi y col. (26). La purificación de ADN se realizó por el método de la precipitación fenólica (27). El pellet de ADN fue resuspendido en 50 μl de buffer TE 10 mM pH 8. La pureza y concentración del ADN obtenido fue determinada por espectrofotometría con el cociente 260/280 nm (27). La integridad del ADN total extraído se comprobó mediante la amplificación por PCR de un fragmento de 268 pb del gen de β-globina humana, utilizando los oligonucleótidos PC04 y GH20 (28). La detección y tipificación se realizó utilizando los oligonucleótidos degenerados MY09 y MY11 y el análisis por RFLP de estos amplificados de 450 pb del gen viral L1, con la enzima HpyCH4V (29). Se realizó una segunda amplificación anidada al primer amplicón de MY09/ MY11 (L1) con los oligonucleótidos GP5+/ GP6+, la cual tiene como propósito la detección de ADN del virus en muestras que fueron negativas para el amplificado MY09/ MY11 (30) Todos los amplicones y productos de digestión fueron separados mediante electroforesis en geles de poliacrilamida horizontal al 6 % (31), y teñidos con bromuro de Etidio (10-3 mg/ml) para su visualización bajo luz ultravioleta. Se realizó análisis genético utilizando el programa estadístico SPSS 12.0.
RESULTADOS
Todas las muestras arrojaron resultados positivos para la amplificación del gen β-globina, indicando que la extracción fue satisfactoria y el ADN conservaba su integridad. Espectrofotométricamente se determinó un promedio de concentración de ADN de 378 ng/μl y una pureza promedio de 1,9. Las muestras fueron sometidas a dos reacciones de PCR (reacción en cadena de polimerasa) específicas para el virus del papiloma humano. La primera de ellas amplifica parte del gen L1 del VPH con oligonucleótidos consenso MY09/MY11, los fragmentos obtenidos fueron sometidos a digestión con la enzima de restricción HpyCH4V resultando en patrones de bandas característicos para cada tipo viral (31). El mayor porcentaje de positividad para ADN de VPH en los grupos en estudio, corresponde a 33 muestras de las 57 con CDI (57,89 %), los tipos virales detectados en las muestras con CDI fueron: VPH-6b 15,15 %; VPH-11 3,03 %; VPH-18 12,12 %; VPH-33 27,27 %; VPH-45 3,03 % y VPH-58 3,03 % (Figura 1). Catorce muestras resultaron positivas no determinadas para el sistema GP5+/GP6+.
De las 41 lesiones benignas de mama, 6 muestras (14,63 %) presentaban infección por VPH, los tipos virales detectados fueron: VPH-6b 33,33 %, VPH-11 16,67 %, VPH-33 16,67 % y 33,33 % positivas no determinadas (Figura 1).
En la tabla 1 se agrupan los resultados de diagnóstico de todas las muestras en estudio, mostrando el porcentaje de biopsias positivas y negativas para ADN viral en cada grupo de estudio. El análisis de Chi-cuadrado arrojó un valor de c2 =26,335 (valor mínimo esperado: 4,29), para evaluar en qué medida se relaciona la presencia del VPH con el desarrollo de carcinoma de mamas. El valor obtenido, es considerablemente mayor al valor mínimo esperado, indicando que la presencia del VPH debe estar vinculada con el desarrollo de tumores mamarios malignos. Además de esto, se obtuvo un OR de 10,77. Esto significa que hay un 91,5 % de probabilidades de desarrollar carcinoma de mamas si se tiene infección por VPH.
DISCUSIÓN
En el presente estudio fue posible la extracción y purificación de ácidos nucleicos de buena calidad a partir de las muestras de tejido embebido en parafina, provenientes de pacientes con lesiones mamarias. Para la tipificación, los amplificados generados en la reacción MY09/MY11, fueron sometidos a RFLP según se mencionó en la metodología. Entre los patrones obtenidos, pudo identificarse claramente los tipos VPH- 6, VHP-11, VPH-18, VPH-33, VPH-45 y VPH-58; el tipo viral encontrado con mayor frecuencia fue VPH- 33 (30,3 %). En otros casos, la identificación fue más complicada debido a la presencia de más de un tipo viral en la misma muestra, por lo que el resultado asignado a estos casos resultó Positivo VPH No Determinado (ND). En ocasiones, en los patrones mezclados pudo identificarse uno o ambos de los tipos virales presentes.
Reportes anteriores, varían ampliamente en el porcentaje de prevalencia de las infecciones por VPH en lesiones mamarias, abarcando desde un 4,4 % (32), hasta un 86,2 % (8). Sin embargo, algunos de ellos fallan en la detección de este virus y generan controversia en relación al papel oncogénico del VPH en la patogénesis del carcinoma de mama (33-35). Esta controversia puede ser explicada, de acuerdo al origen de las muestras, p.ej. punción con aguja fina (35), o debido al método utilizado para la detección viral; como es el caso del método de hibridación con sondas tipo específicas para uno o dos tipos de VPH, lo cual puede excluir otros tipos virales infectantes que, por lo tanto, no son detectados en las muestras en estudio.
Estos resultados confirmaron, que el VPH puede tener algún papel en el desarrollo de la malignidad del tejido mamario, y corrobora lo publicado a nivel mundial, indicando que una infección con VPH de alto riesgo hace a un individuo más propenso al desarrollo de lesiones malignas, en este caso, carcinoma mamario. Es decir, aquellas pacientes infectadas con VPH de alto riesgo son más susceptibles a la inmortalización celular, debido a que las oncoproteínas virales E6 y E7, a diferencia de las de bajo riesgo, modulan vías celulares y por lo tanto regulan la proliferación y supervivencia celular. Sólo el 14,63 % de las lesiones benignas se encontraban infectadas con VPH, en su mayoría, con tipos virales de bajo riesgo y aquellas lesiones malignas positivas para VPH de bajo riesgo, presentaban en ocasiones, infección mixta con tipos virales de alto riesgo (Figura 1). Al agrupar las muestras positivas, de acuerdo al riesgo del tipo de VPH, se obtuvo que en 39,5 % se detectó VPH de alto riesgo. Sin embargo, el alto número de muestras sin tipificar (ND=16), no permite una correcta apreciación de este resultado. Se ha reportado que el VPH-18 de alto riesgo, además de presentar tropismo por epitelio mucoso, también tiene tropismo glandular (36). Esto coincide con reportes que relacionan a este tipo de VPH con carcinomas mamarios. El segundo tipo de VPH encontrado con mayor incidencia en el presente estudio fue VPH-18. Esta observación, concuerda con lo mencionado anteriormente y coincide con previos reportes donde el mismo tipo viral fue encontrado con mayor frecuencia en biopsias de carcinoma de mama (36 - 38).
Al evaluar estadísticamente los resultados obtenidos, con la prueba de Chi-cuadrado, se encontró una diferencia altamente significativa, que indicó un vínculo real entre el desarrollo de carcinoma mamario y la presencia del VPH. Según la razón de las ventajas (OR), la relación entre estas dos variables es de 10,77:1, indicando que es 10,77 veces más probable desarrollar carcinoma si se tiene VPH, a padecer de este mal si el virus no está presente; esto indicó que hay un 91,5 % de probabilidades de desarrollar carcinoma de mamas en presencia de este virus. Así, una posible explicación para la inmortalización de las células de tejido mamario infectado, sería la presencia de las oncoproteínas virales de los VPH de alto riesgo.
Se concluye que en el presente estudio fue posible detectar ADN de VPH en biopsias de tejido mamario. Además, pudo demostrarse que 57,89 % de las muestras de carcinoma de mama presentaban infección por VPH, principalmente del tipo VPH-33 de alto riesgo. Las muestras de CDI presentaron un porcentaje de infección con VPH considerablemente mayor que las muestras de tumores benignos, indicando que posiblemente este virus esté relacionado con la inmortalización de las células mamarias. En algunos casos la carga viral de la muestra se mostró insuficiente para proporcionar un amplificado tipificable, de modo que se realizó la detección de ADN viral con los oligonucleótidos GP5+/GP6+. En estos casos, el diagnóstico final para estas muestras fue ND, es decir, VPH positivo, tipo viral no determinado y se recomienda secuenciación de ADN. De acuerdo a la fisiología del VPH y a reportes previos, en este estudio se considera muy probable que este virus inmortalice células de tejido mamario de la misma manera que lo hace en cérvix.
Este trabajo fue financiado con recursos propios del Laboratorio de Biología y Medicina Experimental de la Universidad de Los Andes (LABIOMEX-ULA).
Los autores expresan su agradecimiento al personal técnico y administrativo de LABIOMEX-ULA por su colaboración en el desarrollo de este proyecto.
REFERENCIAS
1. Butel JS. Viral carcinogenesis: revelation of molecular mechanisms and etiology of human disease. Carcinogenesis. 2000; 21(3): 405-426. [ Links ]
2. Bruni L, Barrionuevo-Rosas L, Albero G, Serrano B, Mena M, Gómez D, et al. ICO Information Centre on HPV and Cancer (HPV Information Centre) [Internet]. Human Papillomavirus and Related Diseases in the World. [15 diciembre de 2016, citado diciembre 2016]. Disponible en: http://www.hpvcentre.net/statistics/reports/XWX.pdf [ Links ]
3. Garland S, Tabrizi S. Methods for HPV detection: Polymerasa Chain Reaction Assay. En: Monsonego J, editor. Emerging Issues on HPV Infections. From Science to Practice. París: Karger Publishers; 2006. p 63-72. [ Links ]
4. de León DC, Montiel DP, Nemcova J, Mykyskova I, Turcios E, Villavicencio V, et al. Human Papillomavirus (HPV) in breast tumors: prevalence in a group of Mexican patients. BMC Cancer. 2009; 9: 26-31. [ Links ]
5. Bosch FX, de Sanjosé S, Castellsagué X. Virus del Papiloma Humano: riesgo oncogénico y nuevas oportunidades para la prevención. An Sist Sanit Navar. 2001; 24: 7-13. [ Links ]
6. Burd EM. Human papillomavirus and cervical cancer. Clin Microbiol Rev. 2003; 16 (1): 1-17. [ Links ]
7. zur Hausen H. Papillomaviruses in the causation of human cancers – a brief historical account. Virology. 2009; 384 (2): 260-265. [ Links ]
8. de Villiers EM, Sandstrom RE, zur Hausen H, Buck CE. Presence of papillomavirus sequences in condylomatous lesions of the mamillae and in invasive carcinoma of the breast. Breast Cancer Res. 2005; 7 (1): R1-R11. [ Links ]
9. Meisels A, Morin C. Morphology of lesions of the uterine cervix related to human papillomavirus (HPV). Arch Anat Cytol Pathol. 1997; 45(5): 261-267. [ Links ]
10. Kan C. Human Papillomavirus in human breast cancer and cellular inmortalization. (Thesis for the degree of Doctor of Philosophy). Sydney – Australia: University of New South Wales; 2007. [ Links ]
11. Quintero M, Cruz J, Bastidas M, Marquez L, Puig J. Detección y tipificación de virus del papiloma humano (VPH) mediante PCR-RFLP. Rev Obstet Ginecol Venez. 2008; 68 (1): 25-31. [ Links ]
12. Perry C, Phillips B. Quick Review: Breast Cancer. IJO. 2002; 1 (2): [about 5 p] Disponible en: https://print.ispub.com/api/0/ispub-article/10174 [ Links ]
13. Lawson JS, Glenn WK, Whitaker NJ. Reply: Breast cancer, human papilloma virus and sexual activities. BJC. 2008; 98 (2): 510-511. [ Links ]
14. Aguayo F, Khan N, Koriyama C, González C, Ampuero S, Padilla O, et al. Human papillomavirus and Epstein- Barr virus infections in breast cancer from Chile. Infect Agent Cancer. 2011; 6 (1): 7-13. [ Links ]
15. Yu Y, Morimoto T, Sasa M, Okazaki K, Harada Y, et al. Human papillomavirus type 33 DNA in breast cancer in Chinese. Breast Cancer. 2000; 7(1): 33-36. [ Links ]
16. Mallia R, Mangion JP, Camenzuli C, Cassar A, Cacciottolo P, Cauchi J, et al. HPV positivity varies with technique and primer set, in formalin-fixed paraffin-embedded benign and malignant breast tissue from Malta. AJMB. 2011; 1(3): 183-188. [ Links ]
17. Lindel K, Forster A, Altermatt HJ, Greiner R, Gruber G. Breast cancer and human papillomavirus (HPV) infection: no evidence of a viral etiology in a group of Swiss women. Breast. 2007; 16 (2): 172-177. [ Links ]
18. Hedau S, Kumar U, Hussain S, Shukla S, Pande S, Jain N, et al. Breast cancer and human papillomavirus infection: no evidence of HPV etiology of breast in Indian women. BMC Cancer. 2011; 11: 27-36. [ Links ]
19. Tsai JH, Tsai CH, Cheng MH, Lin SJ, Xu FL, Yang CC. Association of viral factors with non-familial breast cancer in Taiwan by comparison with non-cancerous, fibroadenoma, and thyroid tumor tissues. J Med Virol. 2005; 75(2): 276-281. [ Links ]
20. Akil N, Yasmeen A, Kassab A, Ghabreau L, Darnel AD, Moustafa AE. High-risk human papillomavirus infections in breast cancer in Syrian women and their association with Id-1 expression: a tissue microarray study. Br J Cancer. 2008; 99(3): 404-407. [ Links ]
21. Choi YL, Cho EY, Kim JH, Nam SJ, Oh YL, Song SY, et al. Detection of human papillomavirus DNA by DNA chip in breast carcinoma of Korean women. Tumour Biol. 2007; 28(6): 327-332. [ Links ]
22. Khan NA, Castillo A, Koriyama C, Kijima Y, Umekita Y, Ohi Y, et al. Human papillomavirus detected in female breast carcinomas in Japan. Br J Cancer. 2008; 99(3): 408-414. [ Links ]
23. Widschwendter A, Brunhuber T, Wiedemair A, Muller-Holzner E, Marth C. Detection of human papillomavirus DNA in breast cancer patients with cervical cancer history. J Clin Virol. 2004; 31(4): 292-297. [ Links ]
24. Choi J, Lim H, Kim W, Lee S, Kim S, Kim S, et al. Detection of human papillomavirus DNA from the breast carcinomas and the cervix: Are they correlated? JCO. 2009; 27(15S): 1544-1544. [ Links ]
25. Ministerio del Poder Popular para la Salud (MPPS). Anuario de Mortalidad – Gobierno Bolivariano de Venezuela. 2010; http://www.mpps.gob.ve. [ Links ]
26. Mirshahabi H, Meshkat Z, Soleimanjahi H, Mohamad-Hassan Z, Meshkat M. Different DNA extraction methods for paraffin-embedded pathological samples. Iran J Pathol. 2007; 2(4): 159-164. [ Links ]
27. Sambrook J, Fritsch E, Maniatis T. Molecular cloning: a laboratory manual. Nueva York: Cold Spring Harbor Laboratory Press. 2003. [ Links ]
28. Saiki R, Scharf S, Faloona F, Mullis K, Horn G, Erlich H, et al. Enzymatic amplification of beta-globin genomic sequences and restriction site analysis for diagnosis of sickle cell anemia. Science. 1985; 230 (4732):1350-1354. [ Links ]
29. Nobre RJ, de Almeida LP, Martins TC. Complete genotyping of mucosal human papillomavirus using a restriction fragment length polymorphism analysis and an original typing algorithm. J Clin Virol. 2008; 42 (1): 13–21. [ Links ]
30. Qu W, Jiang G, Cruz Y, Chang C, Ho G, Klein R, Burk D. PCR detection of human papillomavirus: comparison between MY09/MY11 and GP5+/GP6+ primer systems. J Clin Microbiol. 1997; 35 (6): 1304–1310. [ Links ]
31. Cruz J, Quintero M, Bastidas M, Quintero W, Hernández H, Duque C, et al. Electroforesis horizontal en geles de poliacrilamida en la detección y tipificación del virus de papiloma humano. Rev Obstet Ginecol Venez. 2015; 75 (3):172-176. [ Links ]
32. Mendizabal-Ruiz AP, Morales JA, Ramirez-Jirano LJ, Padilla-Rosas M, Moran-Moquel MC, Montoya-Fuentes H. Low frequency of human papillomavirus DNA in breast cancer tissue. Breast Cancer Res Treat. 2009; 114(1): 189-194. [ Links ]
33. Cerdera V, Puizzi M, Soto S, Acosta P, Cerdera A. Virus Papiloma Humano y su relación con cáncer de mama. Informe preliminar. UNNE. Comunicaciones Científicas y Tecnológicas. 2004; M-082. [ Links ]
34. de Cremoux P, Thiouxl M, Lebigot I, Sigal-Zafrani B, Salmon R, Sastre-Garau X. No evidence of human papillomavirus DNA sequences in invasive breast carcinoma. Breast Cancer Res Treat. 2008; 109(1): 55- 58. [ Links ]
35. Gopalkrishna V, Singh UR, Sodhani P, Sharma JK, Hedau ST, Mandal AK, Das BC. Absence of human papillomavirus DNA in breast cancer as revealed by polymerase chain reaction. Breast Cancer Res Treat. 1996; 39(2): 197-202. [ Links ]
36. Clifford G, Franceschi S. Members of the human papillomavirus type 18 family (alpha-7 species) share a common association with adenocarcinoma of the cervix. Int. J. Cancer. 2008; 122 (7): 1684-1685. [ Links ]
37. Gumus M, Yumuk PF, Salepsi T, Aliustaoglu M, Dane F, Ekenel M, et al. HPV DNA frecuency and subset analysis in human breast cancer patients normal and tumoral tissue samples. J.Exp Clin Cancer Res. 2006; 25 (4): 515-521. [ Links ]
38. Kan CY, Iacopetta BJ, Lawson JS, Whitaker NJ. Identification of human papillomavirus DNA gene sequences in human breast cancer. Br J Cancer. 2005; 93(8): 946-948. [ Links ]^rND^sButel^nJS^rND^sGarland^nS^rND^sTabrizi^nS^rND^sde León^nDC^rND^sMontiel^nDP^rND^sNemcova^nJ^rND^sMykyskova^nI^rND^sTurcios^nE^rND^sVillavicencio^nV^rND^sBosch^nFX^rND^sde Sanjosé^nS^rND^sCastellsagué^nX^rND^sBurd^nEM^rND^szur Hausen^nH^rND^sde Villiers^nEM^rND^sSandstrom^nRE^rND^szur Hausen^nH^rND^sBuck^nCE^rND^sMeisels^nA^rND^sMorin^nC^rND^sQuintero^nM^rND^sCruz^nJ^rND^sBastidas^nM^rND^sMarquez^nL^rND^sPuig^nJ^rND^sPerry^nC^rND^sPhillips^nB^rND^sLawson^nJS^rND^sGlenn^nWK^rND^sWhitaker^nNJ^rND^sAguayo^nF^rND^sKhan^nN^rND^sKoriyama^nC^rND^sGonzález^nC^rND^sAmpuero^nS^rND^sPadilla^nO^rND^sYu^nY^rND^sMorimoto^nT^rND^sSasa^nM^rND^sOkazaki^nK^rND^sHarada^nY^rND^sMallia^nR^rND^sMangion^nJP^rND^sCamenzuli^nC^rND^sCassar^nA^rND^sCacciottolo^nP^rND^sCauchi^nJ^rND^sLindel^nK^rND^sForster^nA^rND^sAltermatt^nHJ^rND^sGreiner^nR^rND^sGruber^nG^rND^sHedau^nS^rND^sKumar^nU^rND^sHussain^nS^rND^sShukla^nS^rND^sPande^nS^rND^sJain^nN^rND^sTsai^nJH^rND^sTsai^nCH^rND^sCheng^nMH^rND^sLin^nSJ^rND^sXu^nFL^rND^sYang^nCC^rND^sAkil^nN^rND^sYasmeen^nA^rND^sKassab^nA^rND^sGhabreau^nL^rND^sDarnel^nAD^rND^sMoustafa^nAE^rND^sChoi^nYL^rND^sCho^nEY^rND^sKim^nJH^rND^sNam^nSJ^rND^sOh^nYL^rND^sSong^nSY^rND^sKhan^nNA^rND^sCastillo^nA^rND^sKoriyama^nC^rND^sKijima^nY^rND^sUmekita^nY^rND^sOhi^nY^rND^sWidschwendter^nA^rND^sBrunhuber^nT^rND^sWiedemair^nA^rND^sMuller-Holzner^nE^rND^sMarth^nC^rND^sChoi^nJ^rND^sLim^nH^rND^sKim^nW^rND^sLee^nS^rND^sKim^nS^rND^sKim^nS^rND^sMirshahabi^nH^rND^sMeshkat^nZ^rND^sSoleimanjahi^nH^rND^sMohamad-Hassan^nZ^rND^sMeshkat^nM^rND^sSaiki^nR^rND^sScharf^nS^rND^sFaloona^nF^rND^sMullis^nK^rND^sHorn^nG^rND^sErlich^nH^rND^sNobre^nRJ^rND^sde Almeida^nLP^rND^sMartins^nTC^rND^sQu^nW^rND^sJiang^nG^rND^sCruz^nY^rND^sChang^nC^rND^sHo^nG^rND^sKlein^nR^rND^sBurk^nD^rND^sCruz^nJ^rND^sQuintero^nM^rND^sBastidas^nM^rND^sQuintero^nW^rND^sHernández^nH^rND^sDuque^nC^rND^sMendizabal-Ruiz^nAP^rND^sMorales^nJA^rND^sRamirez-Jirano^nLJ^rND^sPadilla-Rosas^nM^rND^sMoran-Moquel^nMC^rND^sMontoya-Fuentes^nH^rND^sde Cremoux^nP^rND^sThiouxl^nM^rND^sLebigot^nI^rND^sSigal-Zafrani^nB^rND^sSalmon^nR^rND^sSastre-Garau^nX^rND^sGopalkrishna^nV^rND^sSingh^nUR^rND^sSodhani^nP^rND^sSharma^nJK^rND^sHedau^nST^rND^sMandal^nAK^rND^sDas^nBC^rND^sClifford^nG^rND^sFranceschi^nS^rND^sGumus^nM^rND^sYumuk^nPF^rND^sSalepsi^nT^rND^sAliustaoglu^nM^rND^sDane^nF^rND^sEkenel^nM^rND^sKan^nCY^rND^sIacopetta^nBJ^rND^sLawson^nJS^rND^sWhitaker^nNJ^rND^1A01^nAntonio^sSanoja Breña^rND^1A01^nAntonio^sSanoja Breña^rND^1A01^nAntonio^sSanoja Breña
Doble transferencia embrionaria consecutiva D3/D5-6: una alternativa para mejorar las tasas de embarazo en pacientes sometidas a fertilización in vitro/transferencia embrionaria (FIV/TE)
Dr. Antonio Sanoja Breña1
1 Gineco-Obstetra–Especialista en Medicina Reproductiva. Centro Valenciano de Fertilidad y Esterilidad CEVALFES. Trabajo presentado para ascender a la categoría de Miembro Titular de la Sociedad Venezolana de Obstetricia y Ginecología.
RESUMEN
Objetivo: Evaluar la doble transferencia embrionaria consecutiva D3/D5-6 (DTEC D3/D5-6) como alternativa para mejorar las tasas de embarazo en pacientes sometidas a un programa de fertilización in vitro/transferencia embrionaria (FIV/TE) que obtengan más de dos embriones de día 3 (D3), independientemente del número de intentos previos, de la edad y de los criterios de inclusión al programa.
Métodos: Estudio observacional prospectivo realizado en un centro de fertilidad privado. Se aplicó la técnica de la DTEC D3/D5-6 de acuerdo al protocolo del Centro Valenciano de Fertilidad y Esterilidad (CEVALFES) a 58 pacientes durante el período septiembre 2012-2014 y que obtuvieron dos o más embriones de buena calidad.
Resultados: La tasa de éxito general fue de un 39,65 %. Estos resultados se compararon con las tasas de éxito de la aplicación de la TE de D3 y de D5-6 de un solo embrión y de dos y tres embriones llevadas a cabo en un solo momento. La tasa de éxito general fue superior a las obtenidas con las TE D3 dobles y triples (29,23 % y 31,01 % respectivamente) y a las TE de blastocistos desvitrificados únicas y dobles (15,38 % y 15,15 % respectivamente).
Conclusiones: La doble transferencia embrionaria consecutiva D3/D5-6 se perfila como una técnica eficaz para tomar la decisión de cuántos embriones transferir y el momento de hacerlo cuando la pareja cuenta con dos o más embriones de D3. Ello se traduce en una alternativa que puede mejorar los resultados de las técnicas de reproducción asistida en la actualidad.
Palabras claves: Doble transferencia embrionaria consecutiva, transferencia embrionaria, FIV/TE, embriones D3, blastocistos.
SUMMARY
Objective: The aim of this study was to evaluate a double consecutive embryo transfer day 3/ day 5-6 as an alternative to improve pregnancy rates among patients undergoing an IVF/ET program who obtain more than two day-3 embryos, without taking into account the number of previous attempts, age or IVF/ET program inclusion criteria.
Method: Prospective observational study at a private fertility center. The double consecutive embryo transfer day 3/ day 5-6 approach was performed, according to the protocol outlined at CEVALFES, on 58 patients of our fertility center who obtained two or more good quality embryos between September 2012 and September 2014.
Results: The overall pregnancy rate was 39,65%. These results were compared with single embryo transfers day 3 and day 5-6 and double and triple embryo transfers performed either on day 3 or on day 5-6. This overall pregnancy rate was higher than the rates obtained for double and triple day-3 ET (29,23% and 31,01% respectively) and for single and double thawed blastocyst ET (15,38% and 15,15% respectively).
Conclusions: The double consecutive embryo transfer day 3 and day 5-6 approach presents itself as an effective alternative to inform decision making when two or more day-3 embryos are available: how many day-3 embryos are to be transferred and if ET can be performed consecutively on day 3 and day-5-6. This, in turn, becomes a choice that can improve current pregnancy rates.
Key words: Double consecutive embryo transfer, embryo transfer, IVF/ET, day-3 embryos, blastocysts.
INTRODUCCIÓN
La transferencia embrionaria (TE) luego de una fertilización in vitro (FIV) o una inyección intracitoplasmática (ICSI) usualmente se lleva a cabo en un solo procedimiento: o bien en el estadio de clivaje (D2 o D3) o bien en el estadio de blastocisto (D5-6), independientemente del número de embriones que se transfieran. No obstante, la opción de repetir el procedimiento para llevar a cabo dos o más transferencias sucesivas en el mismo día o al día siguiente fue sugerida por Visser y col. (1), en 1993, para tratar de resolver intentos previos fallidos de TE cuando uno o más embriones permanecían en el catéter, lo cual disminuía las tasas de embarazo. Luego, en 1998, Tur-Kaspa y col. (2) estudiaron la repetición consecutiva en varias modalidades con la intención de asistir al equipo médico y orientar a los pacientes en la toma de decisiones en los casos en los que se presentaban dificultades técnicas durante la TE y concluyeron que la TE sucesiva o repetida no afectaba las tasas de embarazo. Posteriormente, Ashkenazi y col. (3), llevaron a cabo una nueva variación que contemplaba realizar una TE sucesiva, pero para la transferencia de embriones en dos estadios diferentes de desarrollo: en D3 y luego en D5, en pacientes con tres o más de tres ciclos previos fallidos.
El objetivo del presente trabajo es proponer la doble transferencia embrionaria consecutiva D3/D5-6 (DTEC D3/D5-6) como una alternativa para mejorar las tasas de embarazo en pacientes sometidas a FIV/TE que obtengan más de dos embriones de día 3 (D3), independientemente del número de intentos previos, de la edad y de los criterios de inclusión al programa.
La transferencia embrionaria doble: tipos.
La transferencia embrionaria doble (TED) como opción significativa para lograr el embarazo en las técnicas de reproducción asistida (TRA) comenzó a practicarse internacionalmente a partir de 1998, luego de la publicación de los resultados del trabajo de Templeton y col. (4) sobre la reducción del riesgo de los embarazos múltiples de alto orden con la TED en ciclos de FIV, sin que ello afectara las tasas de embarazo (5). A partir de ese momento y hasta el presente, la TED se considera como una de las alternativas más apropiadas en cuanto al número de embriones a transferir en un ciclo determinado para lograr el embarazo, obviamente tomando en cuenta factores tales como edad de la paciente, ciclos previos fallidos, la calidad embrionaria, la condición del endometrio, el deseo de los pacientes y el factor masculino involucrado. Así, la TED se ha establecido como una práctica frecuente, con múltiples variantes en cuanto al estadio de desarrollo del embrión a transferir y al tipo de transferencia. En tal sentido, los términos utilizados para la descripción de todas estas variantes no son comunes en la literatura, lo cual genera confusión al momento de interpretar los estudios publicados al respecto (3, 6 – 14). Con la intención de aclarar las diversas nomenclaturas utilizadas en la literatura y precisar los datos suministrados en el presente trabajo, a continuación, se describirá brevemente cada una de las posibles variaciones de la TED.
Una vez fertilizado el ovocito, es necesario que se cultive en ambientes y medios adecuados, como mínimo, 48 horas (D2) o 72 horas (D3) para que alcance el estadio de desarrollo a partir del cual se puede llevar a cabo la transferencia embrionaria (TE). Cuando esto ocurre, se habla de transferencia embrionaria de día 2 o 3 (TE D2 o TE D3). En los casos en los que se transfiere un solo embrión, se denomina transferencia embrionaria única día 2 o 3 (TEU D2 o TEU D3) y en los que se transfieren 2 embriones en un solo momento se denomina transferencia embrionaria doble día 2 o 3 (TED D2 o TED D3). Por último, cuando se llevan a cabo transferencias de tres embriones D3 en un solo ciclo se habla de transferencias embrionarias triples D3 (TET D3). En tal sentido, existen algunos reportes de estudios recientes en la literatura donde se han llevado a cabo transferencias embrionarias consecutivas D2-D3 dobles y triples (6). Cuando existe un excedente de embriones en este estadio, pero se decide la transferencia de un solo embrión y la criopreservación del excedente, se habla de transferencia embrionaria única electiva (TEUe). Las siglas en inglés para este tipo de transferencia es eSET (elective single embryo transfer).
En los casos en los que se mantiene el desarrollo del embrión hasta alcanzar el estadio de blastocisto, lo que ocurre a las 120 horas (D5) o las 144 horas (D6), así como ocurre con los embriones D2 y D3, la transferencia del embrión en este estadio puede ser única (TEU D5-6) o doble (TED D5-6). Y también, al igual que ocurre con los embriones D2 o D3, cuando existe un excedente de embriones en D5-6 y se decide la transferencia de un solo embrión con la criopreservación del excedente se habla de transferencia embrionaria única electiva (TEUe).
Como se mencionó al inicio de este trabajo, en el año 2000, Ashkenazi y col. (3) describieron por primera vez una variación de la transferencia embrionaria doble que involucró una transferencia sucesiva de tres a cinco embriones en dos estadios diferentes de desarrollo (D3 y D5-6). Los autores la describieron como doble transferencia (consecutiva); sin embargo, trabajos posteriores han descrito a transferencias similares con un número igual o menor de embriones como de intervalo (10), secuencial (15) o de pasos consecutivos (11). Con la intención de aclarar y unificar criterios para la denominación de esta técnica se propone utilizar el término doble transferencia embrionaria consecutiva D3/D5-6 (DTEC D3/D5-6). La propuesta de no utilizar el término transferencia embrionaria doble consecutiva sino el término doble transferencia embrionaria consecutiva se basa en el hecho que se considera que este último término hace énfasis en los dos momentos en los que se llevan a cabo las dos TE y no en el número de embriones a transferir que es con lo que mayormente se asocia el término TED. La cantidad de embriones a transferir reportados en la literatura ha oscilado entre dos y cinco embriones, dependiendo de factores tales como el número de embriones disponibles, la calidad embrionaria, la edad de la paciente, ciclos previos fallidos y el deseo de la pareja (3, 6, 11 - 13, 15). Machtinger y col. (15) reportaron que, de manera excepcional, transfirieron más de cuatro embriones, previa discusión y consentimiento de la pareja, en los casos de múltiples ciclos fallidos o cuando la calidad embrionaria fue baja.
Controversias actuales: transferencia embrionaria doble (TED) vs transferencia embrionaria única (TEU).
En general, hasta los momentos actuales, no ha habido un incremento significativo en los porcentajes de éxito de las TRA (tasas de implantación, de embarazo y de niños nacidos sanos), a pesar de los avances logrados en los medicamentos de estimulación ovárica, en los tipos de ecografía, en la evolución y la calidad de los medios de cultivo y de las incubadoras y en los catéteres de transferencia. El número ideal de embriones a transferir y el momento elegido para realizar la transferencia sigue siendo objeto de debate e internacionalmente existen posiciones encontradas al respecto (5, 16 - 20). No obstante, sí existe un consenso en cuanto a la necesidad de disminuir las probabilidades de obtener embarazos múltiples, sobre todo los de alto orden, por los riesgos que conllevan tanto para la madre como para su descendencia (21).
Al ser objetivo primordial de todo centro de reproducción el asistir a los pacientes para que alcancen su deseo de procreación, las alternativas que se ofrezcan deben estar dirigidas a maximizar las probabilidades de éxito y, a su vez, a disminuir los riesgos derivados de los diferentes tratamientos ofrecidos. Así, podemos ver en la evolución de los estudios reportados en la literatura durante los últimos 15 años (4, 17, 18), que ha habido una tendencia importante hacia la disminución del número de embriones a transferir. Antes de la publicación del estudio de Templeton y col. (4) se consideraba que la alternativa de transferir un mayor número de embriones era lo que aumentaba la probabilidad de lograr el embarazo. Sin embargo, estos autores encontraron que con la TE de dos embriones se lograban tasas de embarazo similares a las obtenidas con la TE de tres embriones o más trayendo como resultado que la TED se considere como un estándar de calidad en las TRA (5). Adicionalmente, y con la intención de reducir aún más las probabilidades de embarazos múltiples, se ha observado una tendencia que ha derivado en la recomendación de la transferencia embrionaria única como el estándar de excelencia de toda TRA (18). Sin embargo, la TEU ha puesto en evidencia que, si bien disminuye de manera significativa las probabilidades de embarazo múltiple, también disminuye las probabilidades de lograrlo (17 - 20). Es por ello que el debate entre los especialistas en fertilidad acerca de la elección de la TEU vs la TED o de un número mayor de embriones, dependiendo de factores tales como la edad de la paciente y la calidad embrionaria, se mantiene vigente en la actualidad. Adicionalmente, estudios recientes han mostrado que la participación de los pacientes en la toma de decisiones ha pasado a ser un componente importante para determinar el número ideal de embriones a transferir (16, 22) puesto que se ha reconocido que es necesario considerar las expectativas de los pacientes ante los posibles resultados de una TE múltiple junto con las consideraciones emanadas de estudios de medicina basada en evidencia, porcentajes y probabilidades de éxito y la experiencia clínica del especialista.
Rol del paciente en la toma de decisiones para la TE.
La relación médico-paciente en la toma de decisiones en cuanto a cuál TRA escoger, cuando esto es posible, y cuántos embriones transferir en un ciclo determinado, puede ser analizada desde múltiples puntos de vista. Por una parte, está la posición descrita como paternalista donde el médico tratante considera que sus conocimientos y formación le permiten tomar decisiones que deben ser ejecutadas a pesar de que puedan estar en contra de los deseos de la pareja (16). Por otro lado, está la interpretación de esta posición, no como una imposición, sino como el producto del ejercicio de un deber que vela por el bienestar, no de la pareja, sino de su descendencia (16). Adicionalmente, se puede encontrar en la literatura autores que clasifican la interrelación médico-paciente de acuerdo a dinámicas alternativas que se establecen en la toma de decisiones. Emanuel y col. (23), en 1992, contrastaron el abordaje paternalista con tres modelos que representan tres posibilidades en el desarrollo de la relación médico-paciente: el modelo informativo, el modelo interpretativo y el modelo deliberativo.
En el modelo informativo el paciente es considerado un consumidor y la relación que se establece entre ambos se circunscribe a suministrar información relevante al caso y el médico se limita a cumplir con los deseos de la pareja, sin que haya intervenciones de su parte que puedan influenciar la toma de decisiones. Por ejemplo, cuando una pareja decide no transferir en D3 y dejar en cultivo hasta blastocistos todos los embriones disponibles, lo cual genera el riesgo de que ningún embrión alcance este estadio (24) y, en consecuencia, se cancele la transferencia, pero el médico acepta dicha decisión sin cuestionarla. Jean y col. (16) consideran que este modelo es particularmente inapropiado en el área de la medicina reproductiva ya que los pacientes de esta área esperan que el médico tratante demuestre empatía, escuche y discuta las características particulares de cada caso.
En el modelo interpretativo el médico asume el rol de orientador e informa a la pareja acerca de los valores e información relevantes para la toma de decisiones. Por ejemplo, cuando la decisión se centra en el número de embriones a transferir, el médico les comunica las posibilidades de éxito del tratamiento y los riesgos para la madre y su descendencia, entre otros. También discute con la pareja las alternativas pertinentes al caso (por ejemplo, otros tipos de TRA). No obstante, no intenta convencerla para la toma decisiones.
En el modelo deliberativo, el médico se comporta como un maestro y trata de persuadir a la pareja de que tome las mejores decisiones, considerando tanto los datos clínicos disponibles como sus valores y necesidades. Así, este modelo favorece la toma de decisiones conjuntas y los acuerdos entre ambos. Por ejemplo, cuando una pareja tiene más de dos embriones de D5-6 y el médico le explica que en muchos países se considera que la TED conlleva riesgos que deben ser evitados (18, 20), la pareja manifiesta su deseo de llevar a cabo la TED aun conociendo estos riesgos y el médico acepta la decisión de la pareja cuando ésta no involucra peligros para la vida y salud ni de la madre ni de su descendencia.
Es importante tomar en cuenta, sin embargo, que tanto en el modelo interpretativo como en el deliberativo, en un momento determinado, el médico puede asumir un rol paternalista (16). Para evitarlo, él debe asegurarse que la pareja sea la que en última instancia tome la decisión final, siempre y cuando dicha decisión no involucre ir en contra de los principios de beneficencia y no maleficencia (9, 25).
Doble transferencia embrionaria consecutiva D3/D5-6 (DTEC D3/D5-6).
La opción de transferir dos o más embriones en dos momentos diferentes de desarrollo embrionario: el D2 o D3 y el D5-6, cuando dichos embriones se encuentran disponibles, fue descrita en la literatura por Ashkenazi y col. (3) para abordar casos de ciclos previos fallidos en número mayor a tres. Posteriormente, la técnica fue utilizada para tratar casos no sólo de fallas repetidas, sino en ciclos de primera vez, por Goto y col. (12). Actualmente, cuando se presentan casos en los que se dispone de dos a cuatro o más embriones en D3, se considera que la posibilidad de transferir uno o dos embriones en el D3, mantener en cultivo prolongado el resto de los embriones para su desarrollo a blastocisto (D5-6) y proponerles a los pacientes una segunda transferencia consecutiva en caso de que el o los embriones alcancen este estadio, es una alternativa que merece ser considerada (6, 11 - 15). Los criterios de inclusión han variado según los autores y encontramos que algunos no toman en cuenta la edad de la paciente sino el número de embriones disponibles (11, 12) o el que haya habido ciclos previos fallidos o no (6, 15), de tal manera que el número de embriones transferidos en esta técnica ha oscilado entre dos y cuatro. En primera instancia, este número de embriones a transferir luce elevado por el aumento de las probabilidades de obtener embarazos múltiples, bien sea gemelares o de alto orden. Sin embargo, los resultados positivos reportados en los estudios mencionados, en cuanto a las tasas de embarazo gemelar obtenidas, aunados al estricto control perinatal de estos embarazos (26), han generado tendencias actuales que consideran que el embarazo gemelar no representa un resultado adverso per se de una TRA (27).
MÉTODOS
El presente trabajo es un estudio observacional prospectivo llevado a cabo en un centro de fertilidad privado. La DTEC D3/D5-6 se aplicó a 58 pacientes que asistieron al Centro Valenciano de Fertilidad y Esterilidad (CEVALFES) durante el período comprendido entre septiembre de 2012 - 2014 y que obtuvieron dos o más embriones D3 de buena calidad. El protocolo desarrollado en esta institución para la aplicación de la DTEC D3/D5-6 incluye esquemas de estimulación ovárica controlada, indicaciones para el procedimiento de recuperación ovocitaria, condiciones indispensables para la fertilización, cultivo y desarrollo embrionario y, por último, esquemas de recepción embrionaria. Adicionalmente, se adaptan criterios actuales en cuanto a la evaluación de la calidad embrionaria para determinar las características mínimas necesarias para seleccionar los embriones de mejor calidad y determinar el número a transferir. Esta experiencia se compara con la aplicación de la TE de D3 y de D5-6 de un solo embrión, de dos y de tres embriones llevadas a cabo en un solo momento con el propósito de evaluar la efectividad de la DTEC D3/D5-6.
A continuación, se describe, en detalle, cada uno de estos esquemas, etapas y criterios.
Estimulación ovárica controlada, recuperación ovocitaria, cultivo y desarrollo embrionario y esquemas de recepción embrionaria.
La estimulación ovárica controlada se inicia mediante el uso de protocolos de análogos de la hormona liberadora de gonadotropinas (GnRH) o de antagonistas de la GnRH, luego se administran dosis de hormona folículo estimulante recombinante (FSH-r) y/o de gonadotropina menopáusica humana (HMG) para estimular la foliculogénesis. La dosis de las gonadotropinas se individualiza dependiendo de la edad de la paciente y de la historia de estimulaciones previas, en aquellos casos donde las haya habido. El proceso se monitorea por mediciones de estradiol sérico y controles ecográficos. Se administran 10.000 UI de gonadotropina coriónica humana (hCG) o 250 UI de gonadotropina coriónica humana recombinante (hCG-r) o 1 mg de análogo de la GnRH (Luprón®), según el caso, al observar folículos mayores de 18 mm de diámetro para culminar la maduración de los ovocitos; 36 horas después se realiza, bajo anestesia general, la aspiración ovocitaria transvaginal, utilizando, bajo guía ecográfica, una aguja de acero (Echotip® Norfolk Ovum Aspiration Needle, gage 17 length 35 cm, marca COOK). En los casos de ovodonación, el esquema de recepción se lleva a cabo administrando valerianato de estradiol, a dosis creciente de 2 mg hasta 6 mg diarios, vía oral, y progesterona micronizada, 800 mg diarios, vía vaginal; en los ciclos naturales se corrobora el día de la ovulación para así planificar la transferencia.
Los ovocitos se fertilizan mediante FIV o mediante ICSI, dependiendo de los casos, 4 horas después de la recuperación ovocitaria, en un ambiente de CO2 6 % y O2 5 % a 37ºC. La fertilización se evalúa 16-18 horas después y se define por la presencia de dos pronúcleos y dos cuerpos polares. Los embriones se cultivan en medios secuenciales comerciales, suplementados con HSA (G-1 PLUS, G-2 PLUS, Vitrolife Sweden AB Göteborg, Sweden). Los embriones se observan a las 48 horas (48h) (D2) y 72 horas (72h) (D3) después de la aspiración folicular.
Calidad embrionaria.
La calidad de los embriones clivados se evalúa de acuerdo a dos criterios: las pautas establecidas por Veeck (28), y el número de blastómeras presentes a las 48h y a las 72h. En cuanto a las primeras, Veeck (28) establece cinco grados posibles que dependen del tamaño y simetría de las blastómeras y la presencia o ausencia de fragmentación citoplasmática. A continuación, se describen estos cinco grados. Grado 1: embrión con blastómeras de igual tamaño y ausencia de fragmentación citoplasmática. Grado 2: embrión con blastómeras de igual tamaño con una fragmentación citoplasmática menor o igual al 10 %. Grado 3: embrión con blastómeras con tamaños evidentemente desiguales y fragmentación variable. Grado 4: embrión con blastómeras de tamaño igual o desigual y fragmentación citoplasmática de moderada a significativa, que abarca más del 10 %. Grado 5: embrión con pocas blastómeras de tamaños variables y fragmentación citoplasmática severa (mayor o igual a 50 %).
En cuanto al segundo criterio, se considera que a las 48 h deben estar presentes cuatro blastómeras y a las 72h deben haberse dividido en ocho o más. Así, la calificación de un embrión como de alta calidad se define por la presencia de cuatro blastómeras de Grado 1 o Grado 2 a las 48h, las cuales evolucionan a ocho o más, manteniendo el Grado 1 o 2 a las 72h.
Por su parte, para evaluar la calidad de los blastocistos, se utiliza una combinación de las escalas propuestas Gardner y col. (29), en 1999, y las propuestas por Veeck y col. (30). Los primeros establecen unos criterios de evaluación provenientes del grado de expansión del blastocele y el estatus de eclosión del blastocisto, que van del 1 al 6, acompañados de una escala de evaluación de la masa celular interna, sólo para los blastocistos expandidos, que va de 3 a 6. La masa celular interna y el trofoectodermo se evalúan con una escala alfabética de A, B o C en donde A representa la calificación para la morfología óptima y C para cuando se observan irregularidades severas.
En el año de 2003, Veeck y col. (30) modificaron las escalas de Gardner y col. (29) al introducir el concepto de mórula cavitada vs blastocisto cuando, al observar embriones compactados con una cavitación temprana y con un blastocele más pequeño que la mitad del volumen del embrión, estos se consideran mórulas cavitadas y no blastocistos. Así, el blastocisto se define como tal cuando el blastocele abarca más del 50 % del volumen del embrión y cuando se observen células que sugieran la formación de la masa celular interna (30).
La escala resultante está compuesta por puntajes alfanuméricos que evalúan tres categorías. La primera evalúa la expansión del blastocisto y oscila entre 1 y 6. El puntaje 3 indica que el blastocisto está completamente expandido y con una zona pelúcida delgada y el puntaje 2 cuando la zona pelúcida está ligeramente más delgada, debido al crecimiento del embrión. En CEVALFES se considera que estas dos calificaciones son las mínimas necesarias para decidir la transferencia embrionaria. El puntaje máximo de 6, considerado como óptimo en la escala de Veeck y col. (30) se asigna al embrión cuando se encuentra iniciando la eclosión. No obstante, lograr que el embrión alcance este estadio de desarrollo aún sigue siendo difícil en la actualidad, a pesar de la disponibilidad de nuevos medios de cultivo secuenciales (24, 31), por lo tanto, la transferencia de blastocistos en este estadio se aplica mayormente en pacientes jóvenes de buena prognosis (31).
La segunda categoría del puntaje es alfabética, oscila entre A y D y evalúa la masa celular interna. Un puntaje de A representa una masa desarrollada, bien diferenciada y sin células degenerativas. Un puntaje de B implica que carece de alguna de estas tres características. La tercera categoría, también alfabética, igualmente oscila entre A y D y evalúa la calidad del trofoectodermo. Un puntaje de A representa un trofoectodermo regular y bien definido. Un puntaje de B indica la carencia de alguna de estas dos características.
En CEVALFES, para tomar la decisión de transferir un blastocisto se califica como buena una evaluación de 3AA, 3AB y 2AA y como aceptable las evaluaciones de 3BB, 3BA y 2BB dado que en la experiencia de este centro, cuando los embriones alcanzan estas morfologías aún conservan su potencial de implantación a pesar de que el blastocisto no esté completamente expandido, su masa celular interna presente pequeñas áreas no definidas y/o el trofoectodermo no esté completamente delimitado. En aquellos casos en los que el blastocisto no ha alcanzado el desarrollo esperado en el día 5, se mantiene en cultivo hasta el día 6. En ese momento se verifica que haya alcanzado la evaluación mínima necesaria descrita anteriormente. En aquellos casos en los que ocurre un arresto, se considera que el embrión no es viable.
Selección y transferencia de embriones:
La TE se lleva a cabo, en un primer paso, el día 3 después de la recuperación ovocitaria. En este paso se escoge el o los dos embriones de mejor calidad, dependiendo del caso, y se transfiere(n) a la cavidad uterina con la ayuda de un catéter (Ultrasoft Frydman set echo with guide, Laboratoire C.C.D., Paris, Francia), bajo visión ecográfica y se deja a 1,0 cm del fondo del útero (Phillips y col., 2003 (13)). El resto de los embriones se cultivan en G-2 PLUS, (Vitrolife Sweden AB Göteborg, Sweden) para su desarrollo a blastocisto. El segundo paso se lleva a cabo el día 5 o 6, dependiendo del día en el cual el/los embriones alcanzan este estadio. En este paso se transfiere un blastocisto a la cavidad uterina de la paciente, dejándolo en esta segunda fase a 2,0 cm del fondo del útero de manera tal de no lastimar al embrión transferido en el D3 (Phillips y col. 2003 (13)). Los blastocistos restantes, en los casos en los que los haya, se criopreservan utilizando la técnica de cryotop (Kitazato®, BioPharma Co., Ltd. Japón).
La paciente recibe soporte de la fase lútea con valerianato de estradiol (Progynova®) entre 6-10 mg vía oral, dependiendo del grosor endometrial y 600 mg (800 mg en los casos de óvulo donado) de progesterona micronizada vía vaginal. En aquellos casos donde la doble transferencia consecutiva D3/D5-6 se lleve a cabo en ciclos naturales, las transferencias embrionarias se realizan en el día +3 y el día +5 /+6 a partir del día de la ovulación. A los 14 días luego de la TE D5-6 se miden los niveles séricos de β-hCG cuantificada y a los 21 días post transferencia D5-6 se practica ecografía transvaginal a los casos con β-hCG positiva, para verificar la presencia del o de los sacos gestacionales.
RESULTADOS
Como se observa en la Tabla 1, en el total de 58 pacientes, la tasa de embarazo clínico septiembre 2012-2014 es de 53,44 % (31/58) y la tasa de embarazo a término es de 64,52 % (20/31).
Los resultados arrojados por la aplicación de la DTEC D3/D5-6 durante el lapso septiembre 2012 - 2014, reflejados en la Tabla 2, indican una tasa de éxito de 39,65 %. En cuanto a los resultados obtenidos en los diferentes tipos de transferencia, se puede observar, en primer lugar, que el porcentaje de éxito obtenido con la DTEC D3/D5-6 (39,65 %) es superior a los obtenidos con las TE D3 dobles y triples (29,23 % y 31,01 % respectivamente).
DISCUSIÓN
En general, las técnicas de reproducción asistida (TRA) actuales todavía reportan tasas de implantación susceptibles de ser mejoradas; sin embargo, a pesar de los avances tecnológicos recientes, no ha sido posible identificar las razones por las cuales no ha habido incrementos significativos en los porcentajes de éxito (32). Algunas alternativas se han implementado para tratar de lograr estos incrementos: variar el día (D2, D3, estadio de clivaje o D5-6, estadio de blastocisto) de la transferencia embrionaria (TE) (6, 17, 33, 34); establecer la posibilidad de hacer una doble TE consecutiva (3, 12) y/o variar el número de embriones a ser transferidos, dependiendo de su estadio de desarrollo (35). El momento en el que se realiza la TE ha sido controversial (7), ya que naturalmente los embriones humanos llegan a la cavidad uterina en el estadio de blastocisto (D5-6) por lo cual se le ha considerado como un abordaje más fisiológico que la TE en el D3. Sin embargo, dejar la totalidad de los embriones en cultivo prolongado a blastocisto para su transferencia, en muchas ocasiones resulta en la cancelación de la TE debido a que los embriones no alcanzan dicho estadio (3, 12, 13, 18, 24). Por otra parte, ello se traduce en consecuencias negativas, tanto psicológicas como económicas, para los pacientes (13). La doble TE consecutiva D3/D5-6, representa una alternativa que ha sido estudiada en los últimos años para tratar de obtener mejores resultados (6, 10 - 13, 15).
El enfoque de la doble TE consecutiva D3/D5-6 propuesta por Ashkenazi y col. (3), en el año 2000, para evaluar los resultados de transferir embriones en etapas tempranas (D3) y en estadio de blastocisto (D5-6) durante un mismo ciclo, cuando hay un número de embriones que oscila entre dos y cinco o más, ha sido casi exclusivamente utilizado para el abordaje de casos con ciclos previos fallidos, generalmente en número de 3 o más de 3 (6, 10, 11, 15, 36). En contraste, en el estudio de Goto y col. (12), los autores investigaron acerca de la efectividad del método de la DTEC D3/D5-6, pero en un grupo de pacientes que no había ingresado a ciclos previos. Los autores afirman que el método es efectivo, sin haber obtenido un aumento significativo de la tasa de embarazos múltiples, lo cual es una de las preocupaciones mayores en la reproducción asistida actual (5, 18, 21, 25, 27, 35, 37). Por otra parte, una de las tendencias favorecidas en estos momentos, es aplicar esquemas de baja estimulación ovárica con el propósito de disminuir el número de embriones obtenidos en cada ciclo, tanto para reducir el número a transferir como el excedente para criopreservar (38).
En este punto, un elemento importante a considerar es que los intentos de disminuir la tasa de embarazos múltiples y los esquemas de baja estimulación ovárica tienden a reducir las probabilidades de lograr el embarazo para muchas pacientes (5). Algunas de estas pacientes se verían desasistidas si no existiesen otras opciones que ofrecerles en sus ciclos. Para otras, estas opciones alternativas les podrían evitar tener que pasar por la traumática experiencia de uno o varios ciclos fallidos (3, 5, 11, 15, 18, 25).
Los argumentos que subyacen a la propuesta de la doble TE consecutiva D3/D5-6 a pacientes con dos o más embriones de buena calidad a las 72 horas de cultivo, aunque fuesen casos de primera vez, son varios.
En primer lugar, se considera que no es ético esperar a que una TRA falle para ofrecerle a este tipo de paciente la oportunidad de acceder a otra TRA que ha dado buenos resultados con otras pacientes, a pesar de que pueda aumentar las posibilidades de un embarazo gemelar. En segundo lugar, se considera que es un deber tomar en cuenta la perspectiva del paciente y su deseo informado de obtener este tipo de embarazo (16, 21, 22) puesto que, aunque el embarazo gemelar ha sido considerado como un resultado adverso dentro de las TRA, un análisis detallado de la data disponible (21, 27) ha permitido incorporar la necesidad de tomar en cuenta en esta toma de decisiones las perspectivas de las parejas (16, 22). Por otra parte, el monitoreo cuidadoso del desarrollo del embarazo gemelar, producto de los diversos tratamientos en los casos de infertilidad, y la atención perinatal disponible en los momentos actuales inclusive han demostrado una morbi-mortalidad perinatal inferior a la de los embarazos gemelares obtenidos de forma natural (26). En tercer lugar, el hecho de transferir uno o dos embriones en día 3 y dejar en cultivo prolongado los embriones excedentes a día 5-6 permite que en los casos de embriones supernumerarios de D3, estos puedan ser vitrificados en el estadio de blastocisto, lo cual aumenta las probabilidades de éxito en caso de su utilización en ciclos posteriores, bien por falla en el logro del embarazo o para la búsqueda de una nueva gestación.
En cuarto lugar, y en cuanto al contexto bioético que debe enmarcar los actos médicos en el área de la reproducción asistida, todo avance científico tiene el compromiso de resaltar el hecho de que los intereses de los seres humanos en particular deben prevalecer siempre sobre los intereses de la sociedad en general y la ciencia. Los beneficios que se obtengan del uso de dichos avances y de las aplicaciones y técnicas de ellos derivadas, tienen como misión ser tanto individuales como colectivos (39). Así pues, el especialista en fertilidad debe ser cauto y prudente en la toma de decisiones sin olvidar ni los preceptos y criterios de actuación provenientes de su formación, ni los nuevos abordajes desarrollados por las investigaciones en las múltiples áreas relacionadas con la fertilidad humana. Siempre se debe integrar la perspectiva técnica con la ética (9). Sin duda, la medicina basada en evidencias y el aporte de la investigación científica contemporánea forman parte indispensable de la biomedicina reproductiva. La base de la ética médica constituye junto con los principios de justicia y de respeto por la autonomía del paciente, las normas básicas indispensables que permiten al especialista en fertilidad compartir un compromiso moral común y básico con los pacientes.
Cuando los pacientes deciden considerar la DTEC D3/D5-6 como una opción válida de tratamiento, se debe llevar a cabo un análisis conjunto de la misma, médico tratante-paciente, incluyendo dentro de la discusión toda la información detallada acerca de los riesgosbeneficios establecidos en la literatura (5, 17, 21, 24, 26, 27, 40).
Las limitaciones encontradas en este estudio son las propias de los estudios observacionales que, obviamente, requieren la realización de estudios aleatorios prospectivos controlados que permitan una mayor generalización de sus resultados. Así, los logros aquí obtenidos apuntan a la aplicación de la DTEC D3/D5-6 en estudios subsecuentes que permitan confirmar el aumento de las tasas de éxito que su aplicación ha generado en estas pacientes.
Conclusiones
Transferir embriones al interior de la cavidad uterina constituye el punto crucial en la fertilización in Vitro con TE porque el éxito o la falla dependen de la manera y el momento como la TE se lleve a cabo, de los materiales utilizados y del número de embriones transferidos. Los resultados obtenidos con la DTEC D3/D5-6 en el presente trabajo superan la tasa general de embarazo clínico en CEVALFES, no reportan un aumento significativo de la tasa de embarazo gemelar, en comparación con las publicadas en la literatura (8) para TED en pacientes respondedoras estándar, y reflejan una tasa de embarazo múltiple baja.
Con base en estos resultados y en los reportados en la literatura con este tipo de transferencia (6), se propone que la DTEC D3/D5-6 se ofrezca, en principio, a todas aquellas pacientes que ingresen a un programa de FIV y tengan dos o más embriones de buena calidad en el D3 de desarrollo embrionario, independientemente del número de intentos. Adicionalmente, también se propone que se ofrezca a pacientes que tengan más de dos óvulos vitrificados y que vayan a ingresar a un programa de reproducción asistida, dado que los resultados positivos han sido similares en estos casos.
La FIV/TE continúa siendo la TRA más utilizada y hasta ahora es la que ofrece una mayor posibilidad de éxito en cuanto al logro del embarazo se refiere. El autor está convencido que la oportunidad que brinda la doble transferencia embrionaria consecutiva constituye una alternativa viable y eficaz para mejorar las tasas de éxito de las TRA en la actualidad.
REFERENCIAS
1. Visser DS, Fourie FL, Kruger HF. Multiple attempts at embryo transfer: effect on pregnancy outcome in an in vitro fertilization and embryo transfer program. J Assist Reprod Genet. 1993; 10(1): 37-43. [ Links ]
2. Tur-Kaspa I, Yuval Y, Bider D, Levron J, Shulman A, Dor J. Difficult or repeated sequential embryo transfers do not adversely affect in-vitro fertilization pregnancy rates or outcomes. Hum Reprod. 1998; 13(9): 2452- 2455. [ Links ]
3. Ashkenazi J, Yoeli R, Ovieto R, Shalev J, Ben-Rafael Z, Bar-Hava I. Double (consecutive) transfer of early embryos and blastocysts: aims and results. Fertil Steril. 2000; 74(5): 936-940. [ Links ]
4. Templeton A, Morris JK. Reducing the risk of multiple births by transfer of two embryos after in vitro fertilization. N Engl J Med. 1998; 339(9): 573-577. [ Links ]
5. Gleicher N, Barad D. The relative myth of elective single embryo transfer. Hum Reprod. 2006; 21(6): 1337-1344. [ Links ]
6. Fang C, Huang R, Li TT, Jia L, Li LL, Liang XY. Day-2 and day-3 sequential transfer improves pregnancy rate in patients with repeated IVF-embryo transfer failure: a retrospective case-control study. Reprod Biomed Online. 2013; 26(1): 30-35. [ Links ]
7. Hayrinen LH, Sills ES, Fogarty AO, Walsh DJ, Lutsyk AD, Walsh AP. First Irish delivery following sequential, two-stage embryo and blastocyst transfer. Ir J Med Sci. 2012; 181(3): 349-351. [ Links ]
8. Jonsdottir I, Lundin K, Bergh C. Double embryo transfer gives good pregnancy and live birth rates in poor responders with a modest increase in multiple birth rates: results from an observational study. Acta Obstet Gynecol Scand. 2011; 90 (7): 761-766. [ Links ]
9. Berin I, McLellan S, Macklin EA, Toth TL, Wright DL. Frozen-thawed embryo transfer cycles: clinical outcomes of single and double blastocyst transfers. J Assist Reprod Genet. 2011; 28 (7): 575-581. [ Links ]
10. Almog B, Levin I, Wagman I, Kapustiansky R, Schwartz T, Mey-Raz N, Amit A, Azem F. Interval double transfer improves treatment success in patients with repeated IVF/ET failures. J Assist Reprod Genet. 2008; 25(8): 353-357. [ Links ]
11. Goto S, Shiotani M, Kitagawa M, Kadowaki T, Noda Y. Effectiveness of two-step (consecutive) embryo transfer in patients who have two embryos on day 2: comparison with cleavage stage embryo transfer. Fertil Steril. 2005; 83(3): 721-723. [ Links ]
12. Goto S, Takebayashi K, Shiotani M, Fujiwara M, Hirose M, Noda Y. Effectiveness of 2-step (consecutive) embryo transfer. Comparison with cleavage-stage transfer. J Reprod Med. 2003; 48(5): 370-374. [ Links ]
13. Phillips SJ, Dean NL, Buckett WM, Tan SL. Consecutive transfer of day 3 embryos and of day 5-6 blastocysts increases overall pregnancy rates associated with blastocyst culture. J Assist Reprod Genet. 2003; 20(11): 461-464. [ Links ]
14. Goto S, Takebayashi K, Shiotani M, Nakanishi K, Takakura K, Noda Y. A novel method of embryo transfer in human IVF-ET based on the concept of embryodependent induction of embryo receptivity: two-step embryo transfer. Fertil Steril. 2001; 76 (3): S113. [ Links ]
15. Machtinger R, Dor J, Margolin M, Levron J, Baum M, Ferber B, et al. Sequential transfer of day 3 embryos and blastocysts after previous IVF failures despite adequate ovarian response. Reprod BioMed Online. 2006; 13(3): 376-379. [ Links ]
16. Jean M, Tessier P, Bonnaud-Antignac A, Freour T, Barriere P, Dabouis G. Is the debate about single or double embryo transfer following in vitro fertilization really an ethical dilemma? Clin Ethics. 2013; 8: 61-69. [ Links ]
17. Glujovsky D, Blake D, Farguhar C, Bardach A. Cleavage stage versus blastocyst stage embryo transfer in assisted reproductive technology. Cochrane Database Syst Rev. 2012; 7(11). [ Links ]
18. Practice Committee of Society for Assisted Reproductive Technology: Practice Committee of American Society for Reproductive Medicine. Elective single-embryo transfer. Fertil Steril. 2012; 97(4): 835-842. [ Links ]
19. Baruffi RL, Mauri AL, Petersen CG, Nicoletti A, Pontes A, Oliveira JB, Franco JG Jr. Single-embryo transfer reduces clinical pregnancy rates and live births in fresh IVF and Intracytoplasmic Sperm Injection (ICSI) cycles: a meta-analysis. Reprod Biol Endocrinol. 2009; 7: 36. [ Links ]
20. Pandian Z, Templeton A, Serour G, Bhattacharya S. Number of embryos for transfer after IVF and ICSI: A Cochrane review. Hum Reprod. 2005; 20(10): 2681- 2687. [ Links ]
21. Gleicher N, Barad D. Twin pregnancy, contrary to consensus, is a desirable outcome in fertility. Fertil Steril. 2009; 91(6):2426-2431. [ Links ]
22. Latar IL, Razali N. The desire for multiple pregnancy among patients with infertility and their partners. Intl J Reprod Med. 2014; (2014): 301-452. [ Links ]
23. Emanuel EJ, Emanuel LL. Four models of the physician-patient relationship. JAMA. 1992; 267: 2221-2226. [ Links ]
24. Practice Committees of the American Society for Reproductive Medicine and the Society for Assisted Reproductive Technology. Blastocyst culture and transfer in clinical-assisted reproduction: a committee opinion. Fertil Steril. 2013; 99 (3): 667-672. [ Links ]
25. Practice Committee of the American Society for Reproductive Medicine and the Society for Assisted Reproductive Technology. Criteria for number of embryos to transfer: a committee opinion. Fertil Steril- 2013; 99(1): 44-46. [ Links ]
26. Helmerhorst FM, Perquin DA, Donker D, Keirse MJ. Perinatal outcome of singletons and twins after assisted conception: a systematic review of controlled studies. BMJ. 2004; 328 (7434): 261. [ Links ]
27. van Wely M, Twisk M, Mol BW, van der Veen F. Is twin pregnancy necessarily an adverse outcome of assisted reproductive technologies? Hum Reprod. 2006; 21(11): 2736-2738. [ Links ]
28. Veeck LL. An atlas of human gametes and conceptuses. An illustrated reference for assisted reproductive technology. The Encyclopedia of Visual Medicine Series. New York and London: The Parthenon Publishing Group, 1999. [ Links ]
29. Gardner DK, Schoolcraft WB. Culture and transfer of human blastocysts. Curr Opin Obstet Gynecol. 1999; 11(3): 307-311. [ Links ]
30. Veeck LL, Zaninović N. An Atlas of Human Blastocysts. The Encyclopedia of Visual Medicine Series. New York and London: The Parthenon Publishing Group, 2003. [ Links ]
31. Chimote NM, Chimote NN, Nath NM, Mehta BN. Transfer of spontaneously hatching or hatched blastocyst yields better pregnancy rates than expanded blastocyst transfer. J Hum Reprod Scien. 2013; 6 (3): 183-188. [ Links ]
32. Edwards RG, Beard HK. Is the success of human IVF a matter of developmental biology? In: Jansen R, Mortimer D, editors. Towards Reproductive Certainty. Fertility and Genetics beyond 1999. New York: Parthenon Publishing Group, 1999; p 414-418. [ Links ]
33. Gardner DK, Vella P, Lane M, Wagley L, Schlenker T, Schoolcraft WB. Culture and transfer of human blastocysts increases implantation rates and reduces the need for multiple embryo transfers. Fertil Steril. 1998; 69(1): 84-88. [ Links ]
34. Papanikolaou EG, Kolibianakis EM, Tournaye H, Venetis CA, Fatemi H, Tarlatzis B, et al. Live birth rates after transfer of equal number of blastocysts or cleavage-stage embryos in IVF. A systematic review and meta-analysis. Hum Reprod. 2008; 23 (1): 91-99. [ Links ]
35. Vlaisavljevic V, Dmitrovic R, Sajko MC. Should the practice of double blastocyst transfer be abandoned? A retrospective analysis. Reprod Biomed Online. 2008; 16(5): 667-683. [ Links ]
36. Loutradis D, Drakakis P, Dallianidis K, Bletsa SR, Milingos S, Doumplis N, et al. A double embryo transfer on days 2 and 4 or 5 improves pregnancy outcomes in patients with good embryos but repeated failures in IVF or ICSI. Clin Exp Obstet Gynecol. 2004; 31(1): 63-66. [ Links ]
37. Kalu E, Thum MY, Abdalla H. Reducing multiple pregnancies in assisted reproduction technology: towards a policy of single blastocyst transfer in younger women. Fertil & asisst reprod. 2008; 115: 1143-1150. [ Links ]
38. Varghese A, Nagy ZP, Agarwal A. Current trends, biological foundations and future prospects of oocyte and embryo cryopreservation. Reprod Biomed Online. 2009; 19(1): 126-140. [ Links ]
39. Oñate N, Sanoja A, Arcay Hands E. Unidad de Biobancos CEVALFES: Conceptualización, desarrollo y funcionamiento. Valencia: CEVALFES, 2011. [ Links ]
40. van Loendersloot LL, van Wely M, Repping S, Bossuyt PM, van der Veen F. Individualized decision-making in IVF: Calculating the chances of pregnancy. Hum Reprod. 2013; 28 (11): 2972-2980. [ Links ]^rND^sVisser^nDS^rND^sFourie^nFL^rND^sKruger^nHF^rND^sTur-Kaspa^nI^rND^sYuval^nY^rND^sBider^nD^rND^sLevron^nJ^rND^sShulman^nA^rND^sDor^nJ^rND^sAshkenazi^nJ^rND^sYoeli^nR^rND^sOvieto^nR^rND^sShalev^nJ^rND^sBen-Rafael^nZ^rND^sBar-Hava^nI^rND^sTempleton^nA^rND^sMorris^nJK^rND^sGleicher^nN^rND^sBarad^nD^rND^sFang^nC^rND^sHuang^nR^rND^sLi^nTT^rND^sJia^nL^rND^sLi^nLL^rND^sLiang^nXY^rND^sHayrinen^nLH^rND^sSills^nES^rND^sFogarty^nAO^rND^sWalsh^nDJ^rND^sLutsyk^nAD^rND^sWalsh^nAP^rND^sJonsdottir^nI^rND^sLundin^nK^rND^sBergh^nC^rND^sBerin^nI^rND^sMcLellan^nS^rND^sMacklin^nEA^rND^sToth^nTL^rND^sWright^nDL^rND^sAlmog^nB^rND^sLevin^nI^rND^sWagman^nI^rND^sKapustiansky^nR^rND^sSchwartz^nT^rND^sMey-Raz^nN^rND^sAmit^nA^rND^sAzem^nF^rND^sGoto^nS^rND^sShiotani^nM^rND^sKitagawa^nM^rND^sKadowaki^nT^rND^sNoda^nY^rND^sGoto^nS^rND^sTakebayashi^nK^rND^sShiotani^nM^rND^sFujiwara^nM^rND^sHirose^nM^rND^sNoda^nY^rND^sPhillips^nSJ^rND^sDean^nNL^rND^sBuckett^nWM^rND^sTan^nSL^rND^sGoto^nS^rND^sTakebayashi^nK^rND^sShiotani^nM^rND^sNakanishi^nK^rND^sTakakura^nK^rND^sNoda^nY^rND^sMachtinger^nR^rND^sDor^nJ^rND^sMargolin^nM^rND^sLevron^nJ^rND^sBaum^nM^rND^sFerber^nB^rND^sJean^nM^rND^sTessier^nP^rND^sBonnaud-Antignac^nA^rND^sFreour^nT^rND^sBarriere^nP^rND^sDabouis^nG^rND^sGlujovsky^nD^rND^sBlake^nD^rND^sFarguhar^nC^rND^sBardach^nA^rND^sBaruffi^nRL^rND^sMauri^nAL^rND^sPetersen^nCG^rND^sNicoletti^nA^rND^sPontes^nA^rND^sOliveira^nJB^rND^sFranco^nJG Jr^rND^sPandian^nZ^rND^sTempleton^nA^rND^sSerour^nG^rND^sBhattacharya^nS^rND^sGleicher^nN^rND^sBarad^nD^rND^sLatar^nIL^rND^sRazali^nN^rND^sEmanuel^nEJ^rND^sEmanuel^nLL^rND^sHelmerhorst^nFM^rND^sPerquin^nDA^rND^sDonker^nD^rND^sKeirse^nMJ^rND^svan Wely^nM^rND^sTwisk^nM^rND^sMol^nBW^rND^svan der Veen^nF^rND^sGardner^nDK^rND^sSchoolcraft^nWB^rND^sChimote^nNM^rND^sChimote^nNN^rND^sNath^nNM^rND^sMehta^nBN^rND^sEdwards^nRG^rND^sBeard^nHK^rND^sGardner^nDK^rND^sVella^nP^rND^sLane^nM^rND^sWagley^nL^rND^sSchlenker^nT^rND^sSchoolcraft^nWB^rND^sPapanikolaou^nEG^rND^sKolibianakis^nEM^rND^sTournaye^nH^rND^sVenetis^nCA^rND^sFatemi^nH^rND^sTarlatzis^nB^rND^sVlaisavljevic^nV^rND^sDmitrovic^nR^rND^sSajko^nMC^rND^sLoutradis^nD^rND^sDrakakis^nP^rND^sDallianidis^nK^rND^sBletsa^nSR^rND^sMilingos^nS^rND^sDoumplis^nN^rND^sKalu^nE^rND^sThum^nMY^rND^sAbdalla^nH^rND^sVarghese^nA^rND^sNagy^nZP^rND^sAgarwal^nA^rND^svan Loendersloot^nLL^rND^svan Wely^nM^rND^sRepping^nS^rND^sBossuyt^nPM^rND^svan der Veen^nF^rND^1A01^nLisbeth^sRojas^rND^1A01^nMilitza^sQuintero^rND^1A01^nJhon^sCruz^rND^1A01^nNatasha^sBlanco^rND^1A01^nMarisé^sSolórzano^rND^1A01^nMarco^sBastidas^rND^1A01^nJuan^sPuig^rND^1A01^nLisbeth^sRojas^rND^1A01^nMilitza^sQuintero^rND^1A01^nJhon^sCruz^rND^1A01^nNatasha^sBlanco^rND^1A01^nMarisé^sSolórzano^rND^1A01^nMarco^sBastidas^rND^1A01^nJuan^sPuig^rND^1A01^nLisbeth^sRojas^rND^1A01^nMilitza^sQuintero^rND^1A01^nJhon^sCruz^rND^1A01^nNatasha^sBlanco^rND^1A01^nMarisé^sSolórzano^rND^1A01^nMarco^sBastidas^rND^1A01^nJuan^sPuig
Estandarización de un sistema pcr multiplex para la determinación molecular de infertilidad masculina idiopática
Licda. Lisbeth Rojas1, Mg Scs. Militza Quintero1, Dr. Jhon Cruz1, Licda. Natasha Blanco1, Mg Scs. Marisé Solórzano1, Mg Scs. Marco Bastidas1, Dr. Juan Puig1.
1 LABIOMEX, Laboratorio de Biología y Medicina Experimental, Departamento de Biología, Facultad de Ciencias, Universidad de Los Andes.
RESUMEN
Objetivo: Diseñar y optimizar sistemas de reacción en cadena de polimerasa individuales y multiplex para la detección de microdeleciones de genes asociados a infertilidad masculina en el cromosoma Y.
Métodos: Se estandarizaron sistemas de reacción en cadena de polimerasa multiplex utilizando oligonucleótidos STS (Sequence Target Site) específicos asociados a infertilidad masculina, con previa estandarización de cada par de oligos en reacciones individuales.
Resultados: Se logró estandarizar 7 sistemas individuales y 2 sistemas multiplex de alta sensibilidad y especificidad que pueden indicar la presencia o ausencia de un gen, en este caso, son utilizados para indicar la mutación por microdeleción de algún fragmento específico de Yq que conlleva a la inactivación de un gen.
Conclusiones: Se pudo realizar la estandarización de dos sistemas multiplex para el análisis de microdeleciones del cromosoma Y asociados a infertilidad masculina como una herramienta molecular para el diagnóstico rápido y preciso de esta patología. El amplificado del marcador RBM1 no pudo ser incluido en ninguna de los dos multiplex estandarizados, no obstante, se sugiere el estudio de otros marcadores de infertilidad masculina que puedan ser incluidos en la estandarización de nuevos multiplex.
Palabras clave: Infertilidad Masculina. Microdeleciones. Cromosoma Y. Reacción en cadena de polimerasa. Sequence Target Site.
SUMMARY
Objective: To design and optimize individual systems and multiplex polymerase chain reaction for detection of microdeletions of male infertility associated genes on the Y chromosome.
Methods: multiplex polymerase chain reaction systems were standardized using oligonucleotides STS (Sequence Target Site) specific to male infertility associated with prior standardization of each pair of oligos in individual reactions.
Results: It was possible to standardize 7 individual systems and two multiplex systems high sensitivity and specificity that may indicate the presence or absence of a gene, in this case, are used to indicate the mutation microdeletion of a specific fragment Yq leading to the inactivation of a gene.
Conclusions: standardization could make two multiplex systems for the analysis of microdeletions of the Y chromosome associated with male infertility as a molecular tool for rapid and accurate diagnosis of this disease. The amplified RBM1 marker could not be included in either standard multiplex, despite the studies of other markers of male infertility is suggested to be included in new in the standardization of new multiplexes.
Keywords: Male Infertility, Microdeletions, Y Chromosome, PCR, STS.
INTRODUCCIÓN
En la actualidad, la infertilidad se ha convertido en un grave problema de salud pública a escala mundial, que ha aumentado de manera alarmante durante las décadas recientes (1). En el pasado, todos los esfuerzos se centraban en el estudio y tratamiento de la mujer, aproximadamente el 25 % de los casos de infertilidad de la pareja se deben exclusivamente a un problema femenino, un 30 % a una combinación de factores masculinos y femeninos y un 45 % al factor masculino (2), destacando que han cobrado gran relevancia los problemas de fertilidad principalmente en hombres. Esta patología está relacionada con la disminución del número de espermatozoides viables por eyaculación, lo cual trae como consecuencia una alteración de la capacidad de fecundación (3).
El cromosoma Y es el cromosoma más pequeño del genoma humano y surge en la evolución con bastante posterioridad (4) gracias a una mutación que provocó la pérdida de uno de los segmentos del cromosoma X que dio lugar a la forma estructural del cromosoma Y (5). Este cromosoma se encuentra constituido básicamente por el centrómero que divide al cromosoma en un brazo corto o brazo p (Yp) y un brazo largo o brazo q (Yq) (6). En el brazo largo (Yq) se encuentran los genes que están asociados a infertilidad masculina en donde ocurren mutaciones por microdeleciones que conducen a alteraciones en los mecanismos de espermatogénesis y por lo tanto a infertilidad. Las microdeleciones en el cromosoma Y suponen la causa genética molecular más importante de infertilidad masculina (7). Los factores genéticos juegan un papel crucial en aproximadamente el 10 % de los casos de infertilidad masculina debido a que el esperma humano es producido a través de un proceso complejo de espermatogénesis que involucran la expresión e interacción de muchos genes (8). El análisis de las secuencias de genes específicos en el cromosoma Y permite establecer los tipos de alteraciones del ADN que conllevan al desarrollo de patologías relacionadas con la infertilidad, para ello es necesario el diseño de técnicas moleculares para la detección de mutaciones en el cromosoma Y (9).
Tiepolo y col. (10), en 1976, fueron los primeros en plantear una correlación entre las deleciones del cromosoma Y y la infertilidad masculina; postularon la existencia de grupos de genes definidos como factores de azoospermia (AZF) en Yq y sugirieron, de esta manera, la existencia de tres regiones no solapantes que podrían ser susceptibles a pérdidas de segmentos o deleciones. Tales loci de espermatogénesis fueron denominados AZFa, AZFb y AZFc (11). En cada una de estas regiones se encuentran genes asociados con infertilidad masculina, por lo que la ausencia o mutación de algunos de ellos, conduce a la manifestación de esta patología. La técnica de referencia para el diagnóstico de microdeleciones en el cromosoma Y consiste en la reacción en cadena de polimerasa (PCR)-Multilplex STS-Específica de alta sensibilidad, especificidad y bajo costo que además permite obtener información de varios loci espermatogénicos en una misma reacción (12). Esta técnica, basada en el uso de marcadores moleculares específicos de tipo STS (Sequence Target Site, por sus siglas en inglés), permite reconocer segmentos de ADN con ubicación identificable en un cromosoma, cuya herencia puede ser rastreada. De hecho, los STS pueden indicar la presencia o ausencia de un gen (13). En este caso, son usados para indicar la microdeleción o ausencia de algún fragmento específico en cualquiera de las regiones AZF y de allí, la importancia de estandarizar métodos de detección de mutaciones por microdeleciones en el brazo largo del cromosoma Y que estén asociados a infertilidad masculina idiopática. Es muy importante destacar que este tipo de estudios ha sido muy bien desarrollado en otros países como China, Tailandia, India, Italia, Colombia, Alemania, Singapur, pero son muy pocos los datos publicados en Venezuela (14), lo que justifica la presente investigación puesto que no existen suficientes datos registrados al respecto.
En el presente estudio se llevó a cabo la estandarización de siete sistemas de reacción en cadena de polimerasa (PCR) individuales que corresponden a siete marcadores STS localizados en Yq. En este caso, se optimizaron las condiciones de reacción y se amplificaron 2 genes por cada región, mediante el uso de oligonucleótidos específicos previamente diseñados por Teng y col. (15). Posteriormente se continuó con la estandarización de dos sistemas multiplex con el fin de permitir la amplificación simultánea de varias regiones en una misma reacción. La estrategia basada en PCR-Multiplex para la determinación de microdeleciones consiste en que un hombre fértil debe presentar la amplificación completa de los marcadores estudiados, mientras que, en un hombre con microdeleciones, se observa la ausencia de uno o varios marcadores (16).
MÉTODOS
Se realizó un estudio de estandarización y optimación de los sistemas PCR para la detección de microdeleciones en el cromosoma Y, asociadas a la infertilidad masculina. Se recolectaron 50 muestras biológicas de voluntarios fértiles para la estandarización de los sistemas de PCR. Se procesaron tres tipos de muestras en ambos casos: cepillado bucal, semen y plasma seminal. Todos los participantes en el estudio dieron su autorización mediante un consentimiento informado, luego de habérseles explicado claramente el motivo y desarrollo de la investigación. Se consideraron como criterios de inclusión, que la edad estuviese comprendida entre los 18 y 50 años y que tuviesen descendencia comprobada. Las muestras fueron codificadas y cifradas para proteger la identidad de los participantes y procesadas en el Laboratorio de Biología y Medicina Experimental (LABIOMEX) perteneciente a la Facultad de Ciencias de la Universidad de Los Andes, Mérida.
Procesamiento de las muestras, extracción de ADN y verificación de calidad. La extracción y purificación de ADN sigue el protocolo descrito por Sambrook y col. (17), ajustados a las condiciones de laboratorio, usando el método de fenol/cloroformo/alcohol isoamílico. Se utilizaron los oligonucleótidos PC04 y GH20 para evaluar la integridad del ADN obtenido y su factibilidad para ser utilizado en posteriores ensayos de PCR mediante la amplificación de un fragmento de 268 pb del gen de β-globina humana (18), tomando como control positivo una muestra ampliamente usada en el laboratorio para afianzar el funcionamiento de la reacción; el control negativo es la misma mezcla de reacción con agua estéril y sin ADN. Para tales fines se realizó la siguiente mezcla de reacción: tampón de amplificación 1X, MgCl2 2mM, dNTPs 0,2 mM, 6,25 ρmoles de oligonucleótidos, 20-100 ηg de ADN molde, 0,5 U de Taq DNA polimerasa y H2O Milli-Q para un volumen final de 10 μl, bajo las siguientes condiciones de amplificación: temperatura inicial de desnaturalización a 94°C por 1 min seguida de 30 ciclos de desnaturalización a 94°C por 1 min, alineamiento a 55°C por 1 min, extensión a 72°C por 1 min y extensión final a 72°C por 1 min.
Estandarización de Sistemas de PCR individuales. Se adaptaron 7 sistemas individuales incluyendo el gen SRY como control interno de cromosoma Y; los genes restantes están directamente relacionados con infertilidad masculina. En este caso, se amplificaron 2 genes por cada región mediante el uso de oligonucleótidos específicos, los oligonucleotidos utilizados se presentan en la tabla 1. La composición de la mezcla de reacción de amplificación final estandarizada para cada amplificado se presenta en la tabla 2. La amplificación se realizó en un termo-ciclador marca Eppendorf modelo Nexus con los programas presentados en la tabla 3.
Estandarización de Sistemas de PCR Multiplex. Luego de verificar el correcto funcionamiento de los STS en sistemas individuales, se diseñaron dos sistemas multiplex (Multi-A y Multi-B) con el fin de permitir la amplificación simultánea de varias regiones en una misma reacción. En cada multiplex están contenidos tres marcadores que fueron ubicados según la longitud del fragmento amplificado y la región a la cual pertenecen (Tabla 1). La mezcla de reacción para cada sistema múltiple se muestra en la tabla 2. El programa de amplificación para los sistemas multiplex se presenta en la tabla 3.
Visualización de amplificados. Los productos de PCR fueron observados por electroforesis horizontal en geles de poliacrilamida 6 % (19). Los geles fueron teñidos con bromuro de etidio durante 15 min, aproximadamente, y visualizados en un trans-iluminador de luz UV acoplado a un procesador de imágenes marca UVP-Photo Doc-it Imaging System y procesados con el programa de imágenes Gene Tools 4.0. Se consideró como positivo la presencia de una banda, de modo contrario, se consideró como resultado negativo la ausencia de amplificado del tamaño esperado, luego de tres PCR consecutivas. Para todos los sistemas estandarizados, se realizaron controles negativos, los cuales no se muestran en las fotografías de los amplificados. En la figura 1 se presenta una composición de las fotografías de los geles de las reacciones individuales, en la figura 2 se presenta una composición de los geles de las dos multiplex estandarizadas.
RESULTADOS
Sistema PCR β-globina: mediante este sistema de amplificación se pudo verificar la calidad del ADN purificado. Para todas las muestras se obtuvo un producto de PCR de 268 pb, lo que indica que dicho ADN es viable e íntegro para ser utilizado en ensayos de PCR posteriores (18).
Optimización de sistemas de PCR individuales: se estandarizaron siete (7) sistemas individuales correspondientes a los marcadores SY84, DBY, BPY2, SY127, SRY, SY254 y RBM1 que a su vez se encuentran en la región AZF del brazo largo del cromosoma Y, asociados directamente con infertilidad masculina. La figura 1 muestra claramente que se amplificaron correctamente cada uno de los marcadores para cada tipo de muestra biológica (cepillados bucales, semen y plasma seminal) bajo las condiciones ya mencionadas. Todas las muestras arrojaron resultados positivos para este ensayo sin inespecíficos que sugirieran artefactos o inhibidores de reacción.
Optimización de sistemas de PCR Multiplex: una vez estandarizadas las reacciones individuales para cada marcador, se procedió a la distribución de todos los STS en dos (2) sistemas multiplex de acuerdo a la ubicación según la región del cromosoma y longitud de los fragmentos, logrando de esta manera la amplificación simultánea de varios marcadores en una misma reacción. En la figura 2 se puede apreciar que ambos sistemas produjeron los amplificados para cada tipo de muestra (cepillados bucales, semen y plasma seminal). Cada sistema multiplex se corresponde exactamente con los productos de amplificación individual, lo que demuestra efectivamente que las reacciones multiplex funcionan en conjunto. El sistema Multi-A contiene los marcadores DBY, BPY2 y SY127. Por su parte, el sistema Multi-B contiene los marcadores SRY, SY254 y SY84. El marcador RBM1 no pudo ser incluido en ninguno de los dos multiplex estandarizados.
DISCUSIÓN
Todas las muestras arrojaron resultados positivos para el ensayo de marcadores individuales sin inespecíficos que sugirieran artefactos o inhibidores de reacción, de esta manera se confirma que cuando se obtengan PCRs con ausencia de bandas durante la detección de mutaciones por microdeleciones, se confirmaría con certeza que es por la ausencia de algún marcador de tipo STS (Sequence Target Site) y no un falso negativo.
En la figura 1 se muestran los resultados de la estandarización y optimización de sistemas de PCR individuales para cada marcador STS. En ellos se puede visualizar que fue posible la modificación y ajuste de las condiciones de reacción y amplificación de los marcadores con el uso de oligonucleótidos específicos adaptados de Teng y col. (15). La finalidad de los sistemas individuales constituye la garantía del funcionamiento de los oligonucleótidos por separado, de modo que se asegure el siguiente paso para la combinación de los mismos en una misma mezcla de reacción. Cabe destacar que se seleccionaron dos STS por cada región (Tabla 1) Todas las pruebas moleculares resultaron positivas para cada tipo de muestra tal y como se esperaba, lo que permitió entonces dar el siguiente paso hacia la estandarización de sistemas multiplex. En la figura 2 se evidencia la estandarización de dos sistemas multiplex STS-específicos cuya distribución se realizó con base en la región AZF en la cual se localiza cada marcador y a la longitud del fragmento amplificado. Estos sistemas múltiples se denominaron Multiplex A y Multiplex B, en ellos se observa el funcionamiento adecuado del método establecido. Es importante resaltar que el marcador RBM1 perteneciente a la región AZFb no pudo ser amplificado en ningún sistema multiplex, se presume que esto ocurrió debido a la secuencia de los oligonucleótidos que determinan la sensibilidad y especificidad de la reacción, razón por la cual se optó por dejar a este marcador como una prueba individual, al menos hasta la incorporación de otros marcadores que también estén relacionados con infertilidad masculina.
Por todo lo anteriormente expuesto, queda demostrado que estos sistemas de PCR pueden ser usados para el diagnóstico molecular de infertilidad masculina idiopática puesto que las microdeleciones en el cromosoma Y suponen la causa genética más importante de esta patología. Adicionalmente, sobre la base del trabajo de Oliva (16), se podrá fácilmente evidenciar que todo hombre fértil mostrará una amplificación completa de todos los marcadores, mientras que en aquel que porte una microdeleción, habrá ausencia de uno o varios amplificados. Esto no quiere decir que esta prueba molecular sea más importante que la valoración inicial de la pareja que acude a consulta por problemas de fertilidad (evaluación física, dedicando especial atención al examen de los genitales, pruebas sanguíneas y hormonales dirigidas a la búsqueda de cualquier alteración), a pesar de esto, el análisis del semen sigue siendo un examen imprescindible en el estudio de la fertilidad masculina. Lo que se quiere proyectar es que este tipo de prueba molecular puede ser complementario y constituye una herramienta muy importante, tanto para el médico tratante como para la pareja afectada, debido a que representa una prueba contundente que demuestra la falla en los genes involucrados y que determinan la razón por la cual se presenta la infertilidad; de esta manera, ya no sería más una patología idiopática sino que se establece una causa verdadera de esta condición. Con todo ello se refleja el cumplimiento cabal de los objetivos propuestos para esta investigación, pues se logró el diseño de un instrumento de gran utilidad en la medicina reproductiva debido a la alta sensibilidad, especificidad, rapidez y rentabilidad de los sistemas de diseñados.
Los autores expresan su agradecimiento a todo el personal de LABIOMEX-ULA, a todos los padres que colaboraron voluntariamente con el suministro de muestras biológicas y a todos los médicos que contribuyeron con esta investigación, en especial al Dr. Jesús Alfonso Osuna y la Licda. Ibis Cruz.
REFERENCIAS
1. World Health Organization, WHO. Manual for the standardized investigation, diagnosis and management of the infertile male. 2000. WHO. Cambridge: University Press. [ Links ]
2. Nap AW, Van Golde RJ, Tuerlings JH, De Sutter P, Pieters MH, Giltay JC, et al. Reproductive decisions of men with microdeletions of the Y chromosome: the role of genetic counseling. Hum Reprod. 1999; 14 (8): 2166- 2169. [ Links ]
3. Solari A. Genética Humana. Fundamentos y aplicaciones en medicina. Buenos Aires: Editorial Panamericana; 2004. [ Links ]
4. Harris P, Boyd E, Young BD, Ferguson-Smith MA. Determination of DNA content of human chromosomes by flow cytometry. Cytogenet Cell Genet. 1986; 41: 14- 21. [ Links ]
5. Ali S, Hasnain SE. Molecular dissection of the human Y-chromosome. Gene. 2002; 283 (1-2): 1-10. [ Links ]
6. Ali S, Hasnain SE. Genomics of the human Y-chromosome. 1. Association with male infertility. Gene. 2003; 321: 25-37. [ Links ]
7. McElreavey K, Krausz C, Bishop CE. The human Y chromosome and male infertility. Results Probl Cell Differ. 2000; 28: 211- 232. [ Links ]
8. Vogt PH, Edelmann A, Kirsch S, Henegariu O, Hirschmann P, Kiesewetter F, et al. Human Y chromosome azoospermia factors (AZF) mappeds to different subregions in Yq11. Hum Mol Genet. 1996; 5 (7): 933- 943. [ Links ]
9. Silber SJ, Repping S. Transmission of male infertility to future generations: lessons from the Y chromosome. Hum Reprod Update. 2002; 8 (3): 217-229. [ Links ]
10. Tiepolo L, Zuffardi O. Localization of factors controlling spermatogenesis in non- fluorescent portion of the human Y chromosome long arm. Human Genet. 1976; 34 (2): 119-124. [ Links ]
11. Vogt PH, Affara N, Davey P, Hammer M, Jobling MA, Lau YF, et al. Report of the Third International Workshop on Y Chromosome Mapping 1997. Heidelberg, Germany, April 13-16, 1997. Cytogenet Cell Genet. 1997; 79 (1-2): 1-20. [ Links ]
12. Kozina V, Cappallo-Obermann H, Gromoll J, Spiess AN. A one-step real-time multiplex PCR for screening Y-chromosomal microdeletions without downstream amplicon size analysis. PLoS One. 2011; 6 (8): e23174. [ Links ]
13. Lledó B, Galán FM, Ten J, Bernabeu R. Microdeleciones en el cromosoma Y e implicaciones en la esterilidad masculina. Rev. Iberoam. Fert Rep Hum. 2004; 21(4): 227-235. [ Links ]
14. Fernández-Salgado E, Álvarez-Nava F, Borjas-Fajardo L, Osuna J, Gómez R, Zabala W, et al. Frecuencia de microdeleciones del cromosoma Y en hombres venezolanos con infertilidad idiopática. Invest Clin. 2006; 47 (4): 395- 403. [ Links ]
15. Teng YN, Lin YH, Tsai YC, Hsu CC, Kuo PL, Lin YM. A simplified gene-specific screen for Y chromosome deletions in infertile men. Fertil Steril. 2007; 87(6): 1291-1300. [ Links ]
16. Oliva R. Genes del cromosoma Y. Significado clínico. [Internet] Barcelona: Sabadell Universitat; 2003. [Citado 2016] Disponible en http://www.sabadelluniversitat.org/SBD%20Universitat%20(Cat)/d/ROliva-S8.pdf [ Links ]
17. Sambrook J, Fritsch E, Maniatis T. Molecular Cloning: a Laboratory Manual. 2da Edición. CSH, NY: Cold Spring Harbor Laboratory Press; 1989. [ Links ]
18. Saiki RK, Scharf S, Faloona F, Mullis KB, Horn G, Elrich HA, et al. Enzymatic amplification of betaglobin genomic sequences and restriction site analysis for diagnosis of sickle cell anemia. Science. 1985; 230 (4732): 1350- 1354. [ Links ]
19. Cruz J, Quintero M, Bastidas M, Quintero W, Hernández D, Duque C, et al. Electroforesis horizontal en geles de poliacrilamida en la detección y tipificación del virus de papiloma humano. Rev Obstet Ginecol Venez. 2015; 75(3):172-176. [ Links ]^rND^sNap^nAW^rND^sVan Golde^nRJ^rND^sTuerlings^nJH^rND^sDe Sutter^nP^rND^sPieters^nMH^rND^sGiltay^nJC^rND^sHarris^nP^rND^sBoyd^nE^rND^sYoung^nBD^rND^sFerguson-Smith^nMA^rND^sAli^nS^rND^sHasnain^nSE^rND^sAli^nS^rND^sHasnain^nSE^rND^sMcElreavey^nK^rND^sKrausz^nC^rND^sBishop^nCE^rND^sVogt^nPH^rND^sEdelmann^nA^rND^sKirsch^nS^rND^sHenegariu^nO^rND^sHirschmann^nP^rND^sKiesewetter^nF^rND^sSilber^nSJ^rND^sRepping^nS^rND^sTiepolo^nL^rND^sZuffardi^nO^rND^sVogt^nPH^rND^sAffara^nN^rND^sDavey^nP^rND^sHammer^nM^rND^sJobling^nMA^rND^sLau^nYF^rND^sKozina^nV^rND^sCappallo-Obermann^nH^rND^sGromoll^nJ^rND^sSpiess^nAN^rND^sLledó^nB^rND^sGalán^nFM^rND^sTen^nJ^rND^sBernabeu^nR^rND^sFernández-Salgado^nE^rND^sÁlvarez-Nava^nF^rND^sBorjas-Fajardo^nL^rND^sOsuna^nJ^rND^sGómez^nR^rND^sZabala^nW^rND^sTeng^nYN^rND^sLin^nYH^rND^sTsai^nYC^rND^sHsu^nCC^rND^sKuo^nPL^rND^sLin^nYM^rND^sSaiki^nRK^rND^sScharf^nS^rND^sFaloona^nF^rND^sMullis^nKB^rND^sHorn^nG^rND^sElrich^nHA^rND^sCruz^nJ^rND^sQuintero^nM^rND^sBastidas^nM^rND^sQuintero^nW^rND^sHernández^nD^rND^sDuque^nC^rND^1A01^nZoraya^sDe Guglielmo^rND^1A02^nArmando^sRodríguez^rND^1A01^nZoraya^sDe Guglielmo^rND^1A02^nArmando^sRodríguez^rND^1A01^nZoraya^sDe Guglielmo^rND^1A02^nArmando^sRodríguez
Marcadores para el cribado del cáncer cervical
Zoraya De Guglielmo 1, Armando Rodríguez 2
1 Instituto de Oncología y Hematología-MPPS.
2 FACES-UCV.
RESUMEN
Los organismos producen sustancias, generalmente proteínas, cuya concentración y nivel de detección varía entre células sanas, células enfermas o afecciones benignas, los cuales son usados como marcadores de una patología dada, incluyendo el cáncer. Justamente, la importancia o valor de un marcador dado va a depender de la precisión de su uso a nivel clínico y de investigación, para el diagnóstico, pronóstico y estadifcación de la enfermedad, a tal punto que su detección puede ser fundamental para el establecimiento de una terapia o tratamiento a un paciente. A continuación, se presenta una revisión actualizada de los distintos marcadores utilizados en el cribado del cáncer uterino, incluyendo proteínas, ARN y cambios en secuencias de ADN, exponiendo sus ventajas y limitaciones.
Palabras clave: Cáncer uterino, cribado, marcadores
SUMMARY
Organisms produce substances, usually proteins, whose concentration and detection level varies between healthy cells, diseased cells or benign conditions, which are used as markers of a given pathology, including cancer. Precisely, the importance or value of a given marker will depend on the accuracy of their clinical and research use for the diagnosis, prognosis and staging of the disease. Thus, a marker detection may be central to the establishment of a therapy or treatment to a patient. Below a review is presented with an updated version of the various markers used in screening for uterine cancer, including proteins, RNA and DNA sequences changes, exposing their advantages and limitations.
Keywords: uterine cancer, screening, markers
INTRODUCCIÓN
El cáncer cervical se ubica dentro de las primeras cuatro malignidades que afectan a mujeres en todo el mundo y es la segunda causa de muerte oncológica en muchos países de escasos recursos (1). En Venezuela, según estadísticas del Ministerio del Poder Popular para la Salud (MPPS), en el año 2011 se produjeron 1331 muertes por esta malignidad, la mayoría en mujeres entre 25-44 años (2). La principal herramienta en salud pública para el cribado de esta patología es la citología vaginal o prueba de Papanicolaou que permite la obtención de células del cuello uterino para su observación con un microscopio y así detectar los cambios precursores del cáncer, por lo que ha contribuido a la reducción de la incidencia y mortalidad por esta enfermedad.
En los últimos años se ha probado la citología en medio líquido, la cual presenta algunas ventajas respecto a la citología convencional, como una menor probabilidad de repetir la prueba de Papanicolaou y la capacidad para realizar pruebas para ADN de virus de papiloma humano (VPH) con el mismo material. Sin embargo, es más costosa y sensible en la detección de cambios celulares no asociados a cáncer, lo que trae como consecuencia la realización de evaluaciones innecesarias para descartar malignidad o lesiones asociadas. Aunque la prueba de Papanicolaou ha tenido más éxito que ninguna otra prueba de detección en la prevención del cáncer, tiene limitaciones que se ponen de manifesto en la ocurrencia de aproximadamente 500 000 nuevos casos de cáncer cervical anualmente en el mundo. Estas incluyen la toma inadecuada de muestras, el error humano, la adhesión insatisfactoria de mujeres a los programas de cribado y la poca reproducibilidad de los resultados (3). A esto se unen poca sensibilidad y bajo valor predictivo negativo en comparación con los de procedimientos moleculares, evidenciados a partir de aproximadamente 40 % de resultados negativos falsos y en al menos 40 % de nuevos casos de cáncer invasivo diagnosticados en mujeres con un Papanicolaou negativo recientemente (4).
Debido a esto, se ha buscado alternativas para mejorar el cribado del cáncer cervical, resaltando el uso de técnicas de biología molecular para la detección del VPH (agente causal de la patología), las cuales tienen alta reproducibilidad, sensibilidad y valor predictivo negativo, así como de biomarcadores que contribuyen en la identifcación de Papanicolaou verdaderos positivos y en la resolución de resultados dudosos o de signifcado incierto. Precisamente, debido al aporte de las pruebas moleculares en la detección viral, diversos investigadores han señalado la detección de ADN de VPH de alto riesgo oncogénico como marcador de predicción para desarrollo de cáncer cervical (5, 6).
Otro factor que debe tomarse en cuenta en relación a la cobertura e impacto de los programas de cribado es la reciente introducción de vacunas preventivas para el VPH, las cuales pudieran tener una infuencia sustancial en la prevalencia de la enfermedad y en la demanda de pruebas con valores predictivos altos para detectar posibles fallas en la vacunación y captar lesiones inducidas por tipos virales que no están incluidos en las vacunas (7, 8).
Con base en estas consideraciones, se realizó la presente revisión para describir el uso, ventajas y desventajas de distintos marcadores usados en el cribado del cáncer cervical.
Biomarcadores para el cribado del cáncer cervical
Desde hace dos décadas diversos estudios se han enfocado en la identifcación de biomarcadores para desarrollar programas de cribado del cáncer cervical más efcientes y costo-efectivos, especialmente en aquellos países con mayor porcentaje de esta patología. Mucho se ha hablado de las ventajas de la detección del ADN de VPH, para lo que se utilizan métodos altamente sensibles, pero su especificidad es relativa al no permitir identificar la infección activa de la latente o aquellas lesiones de bajo grado o significado incierto que progresarán a lesiones de alto grado o cáncer. En tal sentido, son necesarios marcadores que posibiliten detectar eficazmente los casos con riesgo a desarrollar cáncer en un punto que permita la curación exitosa antes del surgimiento de cáncer invasivo (9).
Tomando en cuenta que el riesgo de progresión a cáncer invasivo crece con el grado de la lesión y que esta malignidad es altamente prevenible ya que pueden transcurrir de 5 a 10 años para que una lesión precancerosa evolucione a tumor, estos marcadores deberían permitir el diagnóstico en etapas muy tempranas.
Biomarcadores de la desregulación del ciclo celular por la acción transformadora del VPH y biomarcadores asociados al grado de la lesión
Considerando que el agente etiológico del cáncer cervical es el VPH, muchos biomarcadores han surgido a partir del efecto de los virus de alto riesgo oncogénico en las células hospedadoras, cuyos genes E6 y E7 (así como sus productos), responsables de la actividad transformante del virus, tienen mayor afinidad por los genes supresores de tumor P53 y pRb (retinoblastoma) que los virus de bajo riesgo oncogénico, por lo que al infectar el epitelio e integrarse al genoma celular, expresan las proteínas E6 y E7 que inhiben la función de P53 (detener el ciclo celular en respuesta al daño del ADN, induciendo su reparación o la apoptosis cuando esto no es posible) y Rb (restringir la proliferación celular mediante la inhibición del factor transcripcional E2F en la fase G1 del ciclo), respectivamente. Entonces, la falta de P53 y la inhibición de Rb desencadenan la proliferación celular descontrolada (10). Al usar la expresión de la proteína P53 como marcador del cáncer cervical debe tomarse en cuenta que los resultados en estudios realizados por distintos investigadores son controversiales. En general, se ha señalado que no se expresa en el epitelio cervical normal y no siempre se observa inmunomarcaje en fases avanzadas del cáncer; sin embargo, según algunos autores, la expresión de la proteína es mayor al avanzar el grado de la lesión (11, 12).
Por otra parte, la regulación del ciclo celular resulta esencial tanto en los procesos de proliferación y crecimiento celular como en la división posterior a los daños producidos en el ADN. Esta regulación es realizada a través de complejos proteicos formados por ciclinas y quinasas dependientes de ciclinas (CDKs, de las siglas en inglés) cuyo funcionamiento se relaciona a procesos de fosforilación. Las ciclinas son proteínas sintetizadas durante la interfase y destruidas al final de la mitosis de cada ciclo. Actúan como reguladoras de la actividad enzimática de las CDKs y su concentración varía a lo largo de las diferentes fases del ciclo celular. Se agrupan en dos familias; la familia Cip/kip (incluye a las proteínas p21, p27 y p57, con sus respectivos genes, que interactúan e inhiben la actividad quinasa de los complejos CDK2/ciclina E, CDK4/ciclina D, CDK6/ciclina D, CDK2/ciclina A y CDK1/ciclina B) y la familia INK4 (incluye a las proteínas p15, p16, p18 y p19 que forman complejos con la ciclina D, e inhiben específicamente a CDK4 y CDK6, implicadas en el control de la fase G1). Estas enzimas, y la manera en que interaccionan, han cobrado gran interés en las últimas dos décadas como blancos terapéuticos, no solo por su papel en la regulación del ciclo celular, sino por su acción en la transcripción genética y en la estabilidad genómica (13, 14).
En este grupo resalta p16INK4a, fosfoproteína que participa en la regulación del ciclo celular al inhibir las CDKs. Estas quinasas, a su vez, regulan el efecto de la proteína supresora de tumores pRb sobre el factor de transcripción E2F que estimula ciertos genes en la fase S del ciclo celular. Esta fosfoproteína sintetizada en la fase mitótica es el biomarcador más ampliamente evaluado en relación al cáncer cervical y corresponde a un elemento de la vía p16-ciclinaD-CDK4/6\RB. La expresión de p16 y la actividad de pRb son inversamente proporcionales, por lo que p16 se detecta cuando el supresor está alterado (mutado o inactivo) y se reduce o desaparece cuando el supresor tiene actividad normal. En más detalle, cuando la proteína E7 de VPH interacciona con la proteína pRb, interfere en el control de la transición G1/S del ciclo, el cual se desregula a partir de la liberación del factor E2F (15, 16). Sin embargo, se ha observado positividad en la expresión de p16 en células normales, lo que implica el uso de criterios morfológicos para la mejor interpretación de los resultados; por ello, se ha recomendado la detección simultánea de p16 (como marcador de antiproliferación) y Ki67 (como marcador de proliferación). Así, se ha utilizado en ensayos de inmunotinción citológica junto con el marcador Ki67, para la identificación y confirmación de verdaderos positivos en la citología vaginal, mejorando la eficacia del cribado cervical mediante dicha prueba (17).
Este marcador puede ser medido por inmunohistoquímica y por ELISA, además de técnicas moleculares (16). En tal sentido, Masoudi y col. (18), en 2006, utilizaron la técnica de microarreglos para evaluar su expresión en muestras de cáncer cervical y encontraron que esta disminuía y se perdía en los casos de menor sobrevida, sin estar relacionada con la magnitud de la invasión ni con las metástasis ganglionares. Así, pudiera representar un excelente marcador de progresión neoplásica, fácilmente detectable, que mejora la especificidad diagnóstica al permitir detectar lesiones de bajo grado que progresarán en complejidad.
Por su parte, Ki67 es un marcador nuclear de proliferación celular ampliamente utilizado en el pronóstico de distintas malignidades. Con base en lo expuesto, se ha propuesto la tinción dual de p16INKa/Ki67 en las citologías vaginales, tanto para el cribado como para la resolución de citologías atípicas o de significado incierto; los resultados de varios estudios muestran que esta tinción tiene una sensibilidad comparable, pero una especificidad mayor, a la detección del ADN viral, sugiriendo que puede contribuir en la identificación más certera de los casos que progresarían a cáncer invasor (19).
Otro marcador utilizado para evaluar el epitelio escamoso cervical, es el antígeno para citokeratina 17 (CK17) que, específicamente, permite diferenciar metaplasia escamosa inmadura y neoplasia intraepitelial cervical (NIC) de alto grado (NIC3). Su expresión disminuye hasta desaparecer a medida que el epitelio metaplásico madura. Se ha señalado que, mediante inmunohistoquímica, puede ser positivo en algunas lesiones intraepiteliales y en metaplasia escamosa inmadura, pero no permite diferenciar entre lesiones con o sin displasia por lo que su valor como marcador requiere que se le use en combinación con otro, siendo recomendado p16 (20).
Cabe mencionar que la expresión de p16 en NIC ha sido comparada con las de p27 y p21 sin que puedan hallarse diferencias significativas, pero los resultados son controversiales, por lo que se resalta la necesidad de realizar más evaluaciones al respecto (21).
El ciclo celular también se ve afectado por la ocurrencia de mutaciones en protooncogenes, lo cual da lugar a genes anormales o a la activación de genes llamados oncogenes responsables de la transformación de una célula normal en una maligna. Ha sido muy estudiada la activación del protooncogén Myc (o c-MYC), el cual codifica una proteína del núcleo celular que se une al ADN y facilita su transcripción, regulando así la actividad de otros genes. Su activación lo transforma en un oncogén que actúa sobre la proliferación celular, específicamente sobre el crecimiento y la división de las células en el paso de la fase G0/G1 a S. El oncogén Myc se encuentra frecuentemente sobreexpresado en cáncer cervical y varios estudios han descrito su activación en estadios premalignos, sugiriendo que su detección puede ser usada para evaluar lesiones displásicas; sin embargo, con VPH tipo 16 se ha encontrado que esta correlación entre expresión del gen Myc y progresión de la lesión cervical es débil (22). Ello implica limitaciones en cuanto al uso de este gen como marcador del cáncer cervical, o bien su uso en combinación con otro marcador. Para diferenciar lesiones cervicales de distinta magnitud, algunos investigadores también han señalado al antígeno de membrana MN (detectado mediante inmunohistoquímica en varias neoplasias) como biomarcador complementario ya que su expresión es casi nula en el tejido cervical normal e incrementa a medida que avanza el grado de la lesión (23).
En la búsqueda de nuevos indicadores, recientemente, Garbett y col. (24) identificaron patrones de biomarcadores mediante calorimetría diferencial de barrido y espectrometría de masa en sangre y orina de pacientes con cáncer cervical, así como en distintos grados de lesiones precursoras. Observaron cambios específicos en los termogramas para cada grupo de muestras e identificaron péptidos mediante la espectrometría de masa cuya abundancia estuvo correlacionada con el grado de la lesión, apuntando la utilidad de estas técnicas en el cribado del cáncer cervical como herramientas complementarias diagnósticas.
Otro marcador novedoso descrito en la patología quirúrgica para diferenciar entre lesiones intraepiteliales de distinto grado es la proteína D240, que ha servido como un nuevo marcador selectivo del endotelio linfático y se utiliza en la identificación de la presencia de invasión linfática en diversas neoplasias malignas incluyendo el carcinoma de cuello uterino y la neoplasia cervical; su expresión es fuerte en el epitelio cervical normal y va disminuyendo a medida que avanza el grado de la lesión, destacando que puede ser un marcador útil para distinguir neoplasias intraepiteliales cervicales de bajo grado (NIC 1) de las de alto grado (NIC 2 y NIC 3), cuando se combina con la evaluación inmunohistoquímica de p16 (25).
Integración del ADN de VPH y pérdida de la estabilidad cromosómica de la célula infectada.
El ADN de VPH usualmente se encuentra en forma episomal en lesiones precursoras cervicales benignas. Al integrarse al genoma celular, el genoma viral circular (generalmente de VPH de alto riesgo oncogénico) se rompe o interrumpe en la región E1/E2 haciéndose lineal, ocasionando la pérdida de la región de ruptura, lo que a su vez determina el incremento descontrolado de la expresión de los oncogenes virales E6 y E7, ocurriendo la transformación maligna. Esto se debe a la ausencia del producto del gen E2 que es un regulador transcripcional del promotor p97 ubicado río arriba de la región reguladora viral, del cual depende la activación de los oncogenes virales (el producto del E2 se une a p97 e inhibe su actividad promotora) (26, 27). El genoma viral prácticamente no comparte homología con el genoma celular por lo que se ha señalado que la integración ocurre a través de procesos de recombinación no homóloga empleados frecuentemente por las células durante la reparación de daños genéticos (28). Por otra parte, se ha observado que el porcentaje de formas integradas o mixtas del genoma viral es bajo en lesiones de bajo grado (NIC 1) e incrementa en lesiones de alto grado (NIC 2 y NIC 3). De esta manera, tal integración parece favorecer el crecimiento de las células hospedadoras transformadas siempre que se produzca el rompimiento de E2 y es considerada actualmente como un proceso que caracteriza las displasias malignas, resaltando la potencial utilidad de la detección del ADN viral de alto riesgo oncogénico y de la evaluación de su integración al genoma celular mediante métodos moleculares (por ejemplo, polimorfismo de longitud de fragmento de restricción (RFLP), reacción en cadena de polimerasa (PCR) o hibridación), como herramientas de diagnóstico y determinación del riesgo de progresión de lesiones de bajo grado a lesiones de alto grado y cáncer. Sin embargo, es importante tomar en cuenta la falta de integración de VPH 16 en algunos carcinomas, lo que implica que este fenómeno no siempre es requerido para la transformación maligna y/o que existen otras vías en este proceso, y que la frecuencia de integración varía dependiendo del tipo viral, siendo mayor para los tipos 16, 18 y 45 que para los tipos 31 y 33 (todos de alto riesgo oncogénico). Así mismo, las lesiones precancerosas asociadas a VPH 16, 18 y 45, en general, progresan a cáncer más rápido que aquellas asociadas a VPH 31 o 33 (29, 30).
Por otra parte, tomando en cuenta lo ya expuesto, se puede deducir que en lesiones avanzadas y en cáncer debe haber una mayor expresión de los oncogenes virales E6 y E7. En este sentido, Sathish y col. (31) no detectaron ARNm de dichos oncogenes en muestras de NIC 1 y NIC 2, pero si en todas las muestras que evaluaron de NIC 3 y carcinoma invasivo de cuello, señalando la necesidad e importancia de realizar más estudios de este tipo para evaluar el uso de la determinación de mensajeros de los genes E6 y E7 como marcador de pronóstico y progresión en el cáncer de cuello uterino y lesiones asociadas.
Tradicionalmente se usan protocolos basados en la PCR para evidenciar la integración a partir de la falta de amplificación de fragmentos de E1 y/o E2, pero sus resultados solo son efectivos en ausencia de genoma de VPH en forma episomal. Esto es muy importante si se considera que en muchos cánceres cervicales primarios coexisten genomas virales integrados y episomales en la misma célula. Por otra parte, el ADN viral suele integrarse en secuencias repetitivas del genoma celular que incluyen a los elementos transponibles ALU, a partir de lo cual investigadores desarrollaron una PCR que usa primers o iniciadores específicos para secuencias virales y para dichas secuencias repetitivas (32). También se ha usado la transcripción reversa-PCR (RT-PCR) para la amplificación de transcritos de los oncogenes virales que permite distinguir ARNm de VPH derivados de genomas virales integrados y genomas virales episomales (33) y, en la última década, ha resaltado la PCR en tiempo real o PCR cuantitativa. Esta técnica, así como la PCR múltiple, permite discriminar entre los diferentes estados físicos del genoma viral a partir de la cuantificación de la relación E2/E6 o E2/E7: en formas integradas puras no se observa amplificación de E2, en formas episomales puras la amplificación de E2 y E6 o E7 es equivalente o similar y en formas mixtas la amplificación de E2 es menor que la de E6 o E7. Por otra parte, se ha señalado que los resultados obtenidos por esta técnica concuerdan con los obtenidos mediante FISH (Fluorescence in situ hibridization) y que, como la región viral E1/E2 puede fragmentarse en múltiples sitios durante la integración, debería evaluarse la totalidad de esta región para la correcta interpretación de los resultados (34).
Cabe mencionar que el proceso de integración del genoma viral no solo afecta a ciertos genes del virus, sino también genes celulares interrumpidos durante dicho proceso. Aparte de las secuencias ALU, es conocido que un alto porcentaje de estos sitios corresponde a regiones genómicas repetitivas, altamente susceptibles a la ruptura (CFSs o Common Fragile Sites), las cuales facilitan la inserción de ADN exógeno por ser poco condensadas y transcripcionalmente activas. Sitios muy frecuentes de integración del genoma viral son los cromosomas 3p, 6q, 11q y 17q, por lo que se han relacionado con actividades supresoras de tumor y están siendo muy estudiados en los últimos años. Destaca la región 3p21.3 donde se ubica RASSFIA, gen efector de la familia RAS con propiedades antitumorales asociadas a procesos apoptóticos independientes de p53 (35).
Otros genes involucrados con el desarrollo de tumores donde ocurre integración de fragmentos genómicos virales son MYC, TP63 (de la familia de p53), NR4A2, APM-1, FANCC, TNFAIP2 y hTERT, lo que pudiera favorecer la activación o desregulación de estas secuencias que, en consecuencia, beneficiaría el desarrollo de malignidad (35, 36).
Marcadores de inestabilidad cromosomal
Se ha descrito que la integración del genoma viral está asociada a inestabilidad cromosomal, pudiendo generar grandes deleciones cromosomales y rearreglos en el genoma celular que ocasionan una mayor susceptibilidad para que la célula hospedera sufra transformación maligna. La deleción alélica más frecuente se observa en el brazo corto del cromosoma 3, señalada como un evento precoz en la génesis tumoral cervical uterina (37, 38). Así, la aneuploidía evidenciada a partir de núcleos no diploides, es característica para lesiones cervicales asociadas a VPH, aún en lesiones precancerosas; esta aneuploidía incrementa con la displasia y se ha observado que precede a la integración del genoma de VPH en lesiones displásicas avanzadas, apoyando la noción de que tal integración es consecuencia (no causa) de inestabilidad cromosomal y transformación (39).
Otros estudios han puesto en evidencia que la pérdida de heterocigosidad es muy frecuente en cáncer cervical en los ya mencionados cromosomas 3p, 6q, 11q y 17q. Particularmente, en el cromosoma 3p14.2 se ubica el gen supresor FHIT (Fragile Histidine Triad), que es un sitio de integración frecuente del genoma de VPH; aunque su actividad y relevancia en la carcinogénesis no son muy conocidas, está siendo estudiado para su uso como marcador o blanco terapéutico. Igualmente, RASSFIA, ubicado en la región 3p21.3, gen efector de la familia RAS; se ha observado que a partir de la integración del genoma viral ocurre pérdida de heterocigosidad LOH (siglas del inglés Loss of Heterozygosity) en 3p21 y la hipermetilación de la región promotora de RASSFIA, por lo que se considera que estos son mecanismos implicados en el silenciamiento genético que favorece el desarrollo del cáncer cervical (35).
Algunos investigadores estudiaron la relación entre el número de copias cromosómicas y el estado físico del genoma viral, encontrando tetrasomías y trisomías con las formas episomales, y aneusomías y polisomías con las formas integradas, especialmente en NIC 3 y carcinomas microinvasivos (40, 41). De esta manera, el estudio de la aneuploidía en una muestra dada pudiera incluirse en la evaluación de integración del ADN viral, de interés en la determinación de riesgo, progresión y pronóstico.
La pérdida de heterocigosidad también se ha descrito en microsatélites marcadores del cáncer cervical (como D3S1478, D3S1578 y D3S1076), observándose que pierden su integridad al avanzar el grado de malignidad de la lesión en las células escamosas del cérvix, causando la regulación defciente de genes involucrados en el ciclo celular (27).
Marcadores microsatélites y micro ARN
Los microsatélites (SSR o STR por Simple Sequence Repeat y Short Tandem Repeat) son secuencias de ADN de pequeño tamaño (entre 2 y 6 pares de bases) que se repiten consecutivamente, con gran valor en la identificación de organismos y el diagnóstico molecular de patologías. En el cáncer cervical se han identificado varios marcadores genéticos tipo microsatélite que intervienen en la regulación de genes involucrados en procesos de fosforilación y reparación del ciclo celular, los cuales son estudiados mediante técnicas moleculares como PCR, RFLP e hibridación, observándose pérdida de heterocigosidad en su secuencia que ha sido relacionada con la progresión a neoplasia; los más destacados son D3S1260 (ubicado en 3p22,2), D3S1300 (en 3p14,2), D11S528 (en 11q23,3) (42).
Recientemente, han ganado interés moléculas llamadas micro ARN (miARN o miRNA), involucradas en el mecanismo de ARN interferente (ARNi), para el estudio de lesiones cervicales. Corresponden a productos transcripcionales de la ARN polimerasa II, no codificantes, con una longitud aproximada de 21 nucleótidos cuya expresión diferencial depende de mecanismos de regulación a nivel transcripcional y postranscripcional, que intervienen en procesos de silenciamiento genético y, en consecuencia, poseen un gran valor terapéutico. Mediante secuenciación y microarreglos, se ha observado que VPH de alto riesgo oncogénico induce la expresión aberrante de muchos miARNs celulares y que la infección con VPH 18 no produce miARN viral detectable. Destaca el incremento de las moléculas miR-25, miR-92ª y miR-378 (identificadas como oncogénicas) y la disminución de mi-R22, miR-27ª, miR-29ª y miR-100 (supresoras de tumores) con la progresión de la lesión cervical, en comparación a la expresión en tejido sano; dicha expresión estaría regulada por p53, E2F y c-Myc. Así, los patrones de expresión de estas moléculas pudieran servir para distinguir entre cérvix normal, lesiones NIC y cáncer cervical (43, 44). Eventualmente, pudieran ser usadas como herramientas terapéuticas en este cáncer y lesiones precursoras, considerando la identificación de moléculas con actividad supresora de tumores.
Marcadores epigenéticos
La epigenética es un fenómeno involucrado en distintos procesos biológicos, como el desarrollo embrionario, la carcinogénesis y la respuesta del sistema inmune. Abarca el estudio de la función genómica fuera del contexto del ADN en sí, por medio de la cual se produce alteraciones estables de la expresión genética sin implicar cambios en la secuencia de nucleótidos. Los cambios epigenéticos estudiados más ampliamente son la metilación del ADN (a través de ADN metiltransferasas), la acetilación de histonas y, más recientemente, el fenómeno de ARN interferente ya mencionado, involucrado en procesos de silenciamiento transcripcional a través de pequeñas moléculas de ARN de doble cadena (45).
Particularmente, la metilación del ADN se refere a la incorporación de grupos metilo en residuos de citosina y es un mecanismo que afecta la conformación de la cromatina, pudiendo estimular o reprimir la expresión genética (46, 47). Así, la metilación de sitios CpG (citosina separada de guanina por un fosfato), dentro del promotor de un gen, puede llevar a su silenciamiento, lo cual se observa en genes supresores de tumor durante diversos procesos oncogénicos, incluyendo el cáncer cervical y lesiones precancerosas asociadas; por su parte, la hipometilación del ADN pudiera favorecer la integración del genoma viral en el hospedador y está asociada a la inestabilidad de este material genético y a la activación y sobreexpresión de protooncogenes y oncogenes. Este fenómeno también ha sido estudiado en cáncer de pene, identificándose marcadores de progresión de malignidad y metástasis (48).
Algunos investigadores han observado variación en los patrones de metilación dependiendo del tipo de VPH y qué genomas de VPH tipo 16 metilados in vitro son transcripcionalmente incompetentes después de la transfección en cultivos celulares, lo que plantea la posibilidad de uso de este mecanismo en procedimientos terapéuticos; esta metilación se evidencia en células indiferenciadas, en tanto que en células diferenciadas el ADN viral está demetilado (46).
El nivel de metilación del ADN puede verse afectado por el nivel de folato en las células a partir de la provisión de grupos metilo por la enzima 5-metiltetrahidrofolato, observándose que el nivel de folato y la metilación aberrante del ADN muestran un cambio progresivo a través de los estadios de la patología cervical, desde células normales hasta cáncer, lo que señala al uso de patrones de hiper e hipometilación como biomarcadores predictivos del riesgo de cáncer cervical. En este sentido, se ha descrito asociación de un bajo nivel de folato con la infección con VPH de alto riesgo, lesiones NIC y cáncer cervical invasivo, así como mayor hipometilación global del ADN en mujeres con cáncer invasivo e incremento de metilación de los genes supresores de tumor CDH1, DAPK y H1C1 de manera gradual con el grado de la lesión neoplásica, lo que resalta el potencial de dichos genes como biomarcadores de progresión o riesgo de cáncer cervical.
También se ha identificado el patrón de metilación de los genes JAM3, TERT, EPB41L3 y C130RF18, asociado a la infección con VPH de alto riesgo y al riesgo de progresión de lesiones de bajo grado a cáncer, en muestras de lavados cervico-vaginales, reportándose concordancia de estos resultados con los de detección de ADN de VPH de alto riesgo por biología molecular y de neoplasia cervical por citomorfología en las mismas pacientes. Estos patrones de hipermetilación e hipometilación, así como el estado de folato pueden ser evaluados mediante kits o estuches comerciales.
Por otra parte, existe evidencia de que la metilación del ADN de VPH pudiera ser igualmente importante a la metilación del ADN celular en el desarrollo de carcinogénesis cervical, pudiendo aportar nuevos biomarcadores para el cribado y pronóstico de esta patología; este mecanismo sería utilizado por el virus para alcanzar la infección persistente y evadir la defensa inmunitaria del hospedador mediante el silenciamiento de algunos genes propios, especialmente en la región L1 (49 - 54).
La metilación también afecta genes involucrados en la apoptosis, incluyendo receptores decoy (señuelo), los cuales reconocen y se unen a factores de crecimiento o citoquinas específicas, induciendo su silenciamiento al bloquear o inhibir la unión con su receptor habitual. En un estudio de muestras cervicales de pacientes con cáncer cervical, se observó un patrón de metilación anormal de los receptores decoy TNFRSF10C, TNFRSF10D, DcR1 y DcR2 (miembros de la superfamilia de receptores del factor de necrosis tumoral) que conduce a su silenciamiento, sugiriendo que las células de esta malignidad obtienen ventajas de crecimiento por la inhibición de la expresión de los receptores como consecuencia de la metilación (55, 56).
Marcadores de estrés celular
Las proteínas de choque térmico (HSP por Heat Shock Proteins), como su nombre lo indica, son inducidas por estrés térmico, aunque también pueden reaccionar frente a estrés físico y químico en un amplio rango de especies. Se les considera chaperones moleculares, proteínas que tienen la propiedad común de modificar la estructura y las interacciones de otras proteínas. Están sobreexpresadas en un amplio rango de cánceres humanos y se encuentran implicadas en la proliferación, diferenciación, invasión, metástasis, muerte y reconocimiento de las células tumorales por parte del sistema inmune. La transcripción de estas proteínas requiere la activación del factor 1 de transcripción de proteínas de choque, el cual está sobreexpresado en cáncer y juega un papel importante en la invasión y metástasis. Aunque no tiene mucho peso en el diagnóstico, su sobreexpresión es indicativa de un mal pronóstico en términos de sobrevivencia y respuesta a la terapia en distintas malignidades (57, 58).
En las lesiones precedentes al cáncer cervical se ha detectado la sobreexpresión de las proteínas de choque térmico HSP40, HSP60, HSP70 y gp96, cuyo nivel incrementa con el grado de la lesión. Actualmente, se estudia el uso de las proteínas HSP70 y gp96 para la elaboración de vacunas terapéuticas del cáncer cervical (59); en el año 2000, Liu y col. (60) ensamblaron y evaluaron una vacuna basada en ADN del péptido de E7 de VPH tipo 16 fusionado con ADN correspondiente a HSP70 como adyuvante, resaltando, con base en los resultados, la seguridad de la vacuna y su potencial uso en la terapia de esta malignidad. Igualmente, el antígeno de la anhidrasa carbónica 9 (CA9), proteína transmembrana activada por la baja tensión de oxígeno, se expresa en todas las lesiones intraepiteliales previas al cáncer y, además, se ha detectado en lesiones de significado incierto que progresan a lesión intraepitelial, lo que la señala como biomarcador de selección en este tipo de lesiones y como biomarcador diagnóstico de displasia y neoplasia cervical (61, 62).
Lamininas y cáncer cervical
Las lamininas constituyen una familia de macromoléculas que desempeñan un importante papel en el desarrollo y diferenciación celular. Son capaces tanto de estimular la adhesión y migración celular como de influir en la expresión génica. Esta influencia en el comportamiento celular depende en gran medida de su unión con una proteína de la membrana celular conocida como receptor de laminina (RL). El receptor de superficie para la laminina facilitaría la adhesión de las células a la membrana basal como paso previo a la invasión (63).
Como resultado de alteraciones en la estructura de la membrana basal en procesos tumorales el RL sufriría modificaciones tanto en su número como en el grado de ocupación en diferentes carcinomas humanos. Así, la expresión de RL se ha relacionado con la capacidad de invasión y metástasis de diferentes tumores (63, 64). Particularmente en el cáncer cervical, se ha observado sobreexpresión de la laminina 5 y que anticuerpos dirigidos contra la cadena γ2 de esta proteína de la matriz extracelular pueden identificar lesiones cervicales con capacidad invasiva sirviendo, en consecuencia, como marcador sensible de invasión temprana (65, 66, 67). Similarmente, otros estudios han puesto en evidencia que, fibroblastos asociados a tumores cervicales sintetizan elevadas cantidades de laminina 1, favoreciendo la invasión de células sanas, la remodelación del estroma intersticial y la disminución y reemplazo de fibronectina y colágeno por una matriz rica en laminina (64).
CONCLUSIÓN
El uso de biomarcadores complementa y mejora la interpretación de las citologías, resaltando su utilidad para definir aquellos resultados de significado incierto; además, aporta información sobre el estado y características de la enfermedad, influyendo en el diagnóstico, selección de tratamiento, pronóstico y seguimiento clínico. Su efecto o papel en la génesis tumoral se observa a distintos niveles, incluyendo regulación, proliferación, síntesis de ácidos nucleicos y expresión genética. Pueden utilizarse individualmente, pero en algunos casos es recomendable usarlos en combinación con otro para afinar su aporte en la evaluación del proceso patológico, dependiendo también de la disponibilidad y las necesidades del médico o del investigador. Muchos de estos marcadores no solo tienen utilidad diagnóstica, sino también potencial terapéutico frente al cáncer uterino, de gran interés para aquellos casos donde las vacunas profilácticas son ineficientes. Se considera que la característica más importante de un buen marcador de selección es que permita detectar la patología en etapas tempranas, de allí que distintos estudios sobre el papel de la inestabilidad cromosomal en el cáncer uterino resalten la inclusión de técnicas de citogenética molecular para el diagnóstico temprano y la determinación de la predisposición genética en esta patología. También se ha resaltado la detección del ADN viral y la determinación del estado de dicho ADN mediante técnicas moleculares como marcador de predicción de cáncer uterino. Sobre esta base, el estudio, conocimiento e implementación de marcadores es fundamental en el abordaje del paciente con esta enfermedad así como en la identificación de individuos proclives a padecerla. Su uso adecuado contribuiría a la optimización de recursos para combatirla y reduciría sus efectos a nivel de población.
REFERENCIAS
1. Jemal A, Bray F, Center M, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011; 61 (2): 69-90. [ Links ]
2. Ministerio del Poder Popular para la Salud. Caracas: Anuario de mortalidad 2011. [Consulta noviembre 2015]. Disponible en: http://www.bvs.gob.ve/anuario/Anuario2011.pdf [ Links ]
3. American Cancer Society. Prevención y detección temprana del cáncer de cuello uterino. 2014. [Consulta noviembre 2015]. Disponible en: https://www.cancer.org/es/cancer/cancer-de-cuello-uterino/prevencion-ydeteccion-temprana.html [ Links ]
4. Subramaniam A, Fauci J, Schneider K, Whitworth J, Erickson B, Kim K, et al. Invasive Cervical Cancer and screening: what are the rates of unscreened and underscreened women in the modern era? J Low Genit Tract Dis. 2011; 15 (2): 110-113. [ Links ]
5. Ferris D, Wright T Jr, Litaker M, Richart R, Lorincz A, Sun X, et al. Comparison of two tests for detecting carcinogenic HPV in women with Papanicolaou smear reports of ASCUS and LSIL. J Fam Prac. 1998; 46(2): 136-141. [ Links ]
6. Salmerón J, Lazcano-Ponce E, Lorincz A, Hernández M, Hernández P, Leyva A, et al. Comparison of HPVbased assays with Papanicolaou smears for cervical cancer screening in Morelos State, Mexico. Cancer Causes Control. 2003; 14 (6): 505–512. [ Links ]
7. Franco E, Cuzick J, Hildesheim A, de Sanjose S. Issues in planning cervical cancer screening in the era of HPV vaccination. Vaccine. 2006; 24 (S3): 171-177. [ Links ]
8. Bosch F, Castellsagué X, de Sanjosé S. HPV and cervical cancer: screening or vaccination? Br J Cancer. 2008; 98(1): 15–21. [ Links ]
9. Wentzensen N, von Knebel M. Biomarkers in cervical cancer screening. Dis Markers. 2007; 23: 315-330. [ Links ]
10. Bahnassy AA, Zekri AR, Saleh M, Lotayef M, Moneir M, Shawki O. The possible role of cell cycle regulators in multistep process of HPV associated cervical carcinoma. BMC Clin Pathol. 2007; 7(4): 1-11. [ Links ]
11. Alameda F, Baro T, Mariñoso M, Manresa J, Costa C, Espinet B, et al. Carcinoma escamoso invasor del cérvix uterino. Estudio de la expresión de p53, BCL-2, Ki 67, C-MYC y ciclina D1. Rev Mex Patol Clin. 2007; 54(4): 150-158. [ Links ]
12. Ngan HY, Tsao SW, Liu SS, Stanley M. Abnormal expression and mutation of p53 in cervical cancer. A study at protein, RNA and DNA levels. Genitourin Med. 1997; 73 (1): 54-58. [ Links ]
13. Sgambato A, Cittadini A, Faraglia B, Weinstein I. Multiple functions of p27 (Kip1) and its alterations in tumor cells: a review. J Cell Physiol. 2000; 183 (1): 18-27. [ Links ]
14. Shapiro G. Cyclin-dependent kinase pathways as targets for cancer treatment. J Clin Oncol. 2006; 24(11): 1770- 1783. [ Links ]
15. Funk J, Waga S, Harry J, Espling E, Stillman B, Galloway D. Inhibition of CDK activity and PCNA-dependent DNA replication by p21 is blocked by interaction with the HPV-16 E7 oncoprotein. Genes Dev. 1997; 11 (16): 2090-2100. [ Links ]
16. Sahasrabuddhe V, Luhn P, Wentzensen N. Human papillomavirus and cervical cáncer: biomarkers for improved prevention efforts. Future Microbiol. 2011; 6(9): 1083-1098. [ Links ]
17. Gupta N, Srinivasan R, Rajwanshi A. Funtional biomarkers in cervical precancer: an overview. Diagn Cytopathol. 2010; 38 (8): 618-623. [ Links ]
18. Masoudi H, Van Nieker D, Gilks C, Cheang M, Bilek K, Fisher U, et al. Loss of p16INK4 expression in invasive squamous cell carcinoma of the uterine cervix is an adverse prognostic marker. Histopathology. 2006; 49 (5): 542-545. [ Links ]
19. Donà M, Vocaturo A, Giuliani M, Ronchetti L, Rollo F, Pescarmona E, et al. P16/Ki67 dual staining in cervicovaginal citology: correlation with histology, Human Papillomavirus detection and genotyping in women undergoing colposcopy. Gynecol Oncol. 2012; 126 (2): 198-202. [ Links ]
20. Sari Aslani F, Safaei A, Pourjabali M, Momtahan M. Evaluation of Ki67, p16 and CK17 Markers in Differentiating Cervical Intraepithelial Neoplasia and Benign Lesions. Iran J Med Sci. 2013; 38 (1): 15-21. [ Links ]
21. Lin J, Albers AE, Qin J, Kaufmann AM. Prognostic significance of overexpressed p16INK4a in patients with cervical cancer: A meta-analysis. PLoS One. 2014; 9(9): e106384. [ Links ]
22. Abba MC, Laguens RM, Dulout FN, Golijow CD. The c-myc activation in cervical carcinomas and HPV 16 infections. Mutat Res. 2004; 557(2): 151-158. [ Links ]
23. Liao S, Brewer C, Závada J, Pastorek J, Pastorekova S, Manetta A, et al. Identification of the MN antigen as a diagnostic biomarker of cervical intraepithelial squamous and glandular neoplasia and cervical carcinomas. Am J Pathol. 1994; 145(3): 598-609. [ Links ]
24. Garbett NC, Merchant ML, Helm CW, Jenson AB, Klein JB, Chaires JB. Detection of cervical cancer biomarker patterns in blood plasma and urine by differential scanning calorimetry and mass spectrometry. PLoS One. 2014; 9(1): e84710. [ Links ]
25. Han H, Yang Y, Lu Z, He Q, Lin Z. Decreased D2-40 and increased p16INK4A immunoreactivities correlate with higher grade of cervical intraepithelial neoplasia. Diagnos Pathol. 2011; 6:59. [ Links ]
26. Doorvar J, Ely S, Sterlyng J, Mc Lean C, Crawford L. Specific interaction between HPV16 E1-E4 and cytokeratins results in colapse of the epitelial cell intermediate filament network. Nature. 1991; 352 (6338): 824-827. [ Links ]
27. González-Ramírez E, Alarcón-Morales L, Martínez-Martínez A. Una nueva síntesis para el diagnóstico de cáncer cervicouterino. Acta Universitaria. 2012; 22 (8): 19-25. [ Links ]
28. Einstein MH, Cruz Y, El-Awady MK, Popescu NC, Di- Paolo JA, van Ranst M, et al. Utilization of the human genome sequence localizes human papillomavirus type 16 ADN integrated into the TNFAIP2 gene in a fatal cervical cancer from a 39-year-old woman. Clin Cancer Res 2002; 8 (2): 549- 554. [ Links ]
29. Corden SA, Sant-Cassia LJ, Easton AJ, Morris AG. The integration of HPV 18 DNA in cervical carcinoma. Mol Pathol. 1999; 52 (5): 275-282. [ Links ]
30. Vinokurova S, Wentzensen N, Kraus I, Klaes R, Driesch C, Melsheimer P, et al. Type-dependent integration frequency of human papillomavirus genomes in cervical lesions. Cancer Res. 2008; 68 (1): 307-313. [ Links ]
31. Sathish N, Abraham P, Peedicayil A, Sridharan G, John S, Chandy G. Human papillomavirus 16 E6/E7 transcript and E2 gene status in patients with cervical neoplasia. Mol Diagn. 2004; 8 (1): 57- 64. [ Links ]
32. Carmody M, Jones M, Tarraza H, Vary C. Use of the polymerase chain reaction to specifically amplify integrated HPV-16 DNA by virtue of its linkage to interspersed repetitive DNA. Mol Cell Probes. 1996; 10 (2): 107-116. [ Links ]
33. Klaes R, Woerner S, Ridder R, Wentzensen N, Duerst M, Schneider A. Detection of high risk cervical intraepithelial neoplasia and cervical cáncer by amplification of transcripts derived from integrated papillomavirus oncogenes. Cancer Res. 1999; 59 (24): 6132-6136. [ Links ]
34. Fuji T, Masumoto N, Saito M, Hirao N, Niimi S, Mukai M, et al. Comparison between in situ hybridization and real-time PCR technique as a means of detecting the integrated form of human papillomavirus 16 in cervical neoplasia. Diagn Mol Pathol. 2005; 14 (2): 103- 108. [ Links ]
35. Yu MY, Tong JH, Chan PK, Lee TL, Chan MW, Chan AW, et al. Hypermethylation of the tumor suppressor gene RASSFIA and frequent concomitant loss of heterozygosity at 3p21 in cervical cancers. Int J Cancer. 2003; 105 (2): 204–209. [ Links ]
36. Ferber MJ, Thorland EC, Brink AA, Rapp AK, Phillips LA, McGovern R, et al. Preferential integration of human papillomavirus type 18 near the c-myc locus incervical carcinoma. Oncogen. 2003; 22 (46): 7233-7242. [ Links ]
37. Yu T, Ferber MJ, Cheung TH, Chung TK, Wong YF, Smith DI. The role of viral integration in the development of cervical cancer. Cancer Genet Cytogenet. 2005; 158(1): 27-34. [ Links ]
38. Roa J, Martínez R, Montenegro S, Roa I, Capurro I, Ibacache G, et al. Inestabilidad microsatelital en lesiones preneoplásicas y neoplásicas del cuello uterino. Correlación con el genotipo del virus papiloma humano. Rev Méd Chile. 2007; 135 (1): 37-44. [ Links ]
39. Melsheimer P, Vinokurova S, Wentzensen N, Bastert G, von Knebel Doeberitz M. DNA aneuploidy and integration of human papillomavirus type 16 e6/e7 oncogenes in intraepithelial neoplasia and invasive squamous cell carcinoma of the cervix uterine. Clin Cancer Res. 2004; 10(9): 3059-3063. [ Links ]
40. Hopman AH, Smedts F, Dignef W, Ummelen M, Sonke G, Mravunac M, et al. Transition of high-grade cervical intraepithelial neoplasia to micro-invasive carcinoma is characterized by integration of HPV 16/18 and numerical chromosome abnormalities. J Pathol. 2004; 202 (1): 23-33. [ Links ]
41. Pett MR, Alazawi WO, Roberts I, Dowen S, Smith DI, Stanley MA, et al. Acquisition of high-level chromosomal instability is associated with integration of human papillomavirus type 16 in cervical keratinocytes. Cancer Res. 2004; 64 (4):1359-1368. [ Links ]
42. Elhamidi A, Hamoudi R, Kocjan G, Du M. Cervical Intraepithelial neoplasia:prognosis by combined LOH analysis of multiple loci. Gynecol Oncol. 2004; 94 (3): 671-679. [ Links ]
43. Hua Y, Larsen N, Kalyana-Sundaram S, Kjems J, Chinnaiyan A, Peter M. miRConnect 2.0: identification of oncogenic, antagonistic miRNA families in three human cancers. BMC Genomics. 2013; 14:179-197. [ Links ]
44. Wang X, Wang HK, Li Y, Hafner M, Banerjee NS, Tang S, et al. microRNAs arebiomarkers of oncogenic human papillomavirus infections. Proc Natl Acad Sci USA. 2014; 111(11): 4262-4267. [ Links ]
45. Egger G, Liang G, Aparicio A, Jones P. Epigenetics in human disease and prospects for epigenetic therapy. Nature. 2004; 429 (6990): 457-463. [ Links ]
46. Kalantari M, Osann K, Calleja-Macías I, Kim S, Yan B, Jordan S, et al. Methylation of human papillomavirus 16, 18, 31, and 45 L2 and L1 genes and the cellular DAPK gene: Considerations for use as biomarkers of the progression of cervical neoplasia. Virology. 2014; 448: 314–321. [ Links ]
47. Sartor M, Dolinoy D, Jones T, Colacino J, Prince M, Carey T, et al. Genome-wide methylation and expression differences in HPV (+) and HPV (-) squamous cell carcinoma cell lines are consistent with divergent mechanisms of carcinogenesis. Epigenetics. 2011; 6 (6): 777-787. [ Links ]
48. Feber A, Arya M, de Winter P, Saqib M, Nigam R, Malone P, et al. Epigenetics markers of metastasis and HPV-induced tumorigenesis in penile cancer. Clin Cancer Res. 2015; 21 (5):1196-1206. [ Links ]
49. Flatley J, McNeir K, Balasubramani L, Tidy J, Stuart E, Young T, et al. Folate status and aberrant DNA methylation are associated with HPV infection and cervical pathgenesis. Cancer Epidemiol Biomarkers Prev. 2009; 18 (10): 2782-2789. [ Links ]
50. Yang N, Nijhuis E, Volders H, Eijsink J, Lendvai A, Zhang B, et al. Gene promoter methylation patterns throughout the process of cervical carcinogenesis. Cell Oncol. 2010; 32 (1-2): 131-143. [ Links ]
51. Eijsink J, Yang N, Lendvai A, Klip H, Volders H, Buikema H, et al. Detection of cervical neoplasia by DNA methylation analysis in cervico-vaginal lavages, a feasibility study. Gynecol Oncol. 2011; 120 (2): 280-283. [ Links ]
52. Kalantari M, Calleja-Macías I, Tewari D, Hagmar B, Lie K, Barrera-Saldana H, et al. Conserved methylation patterns of human papillomavirus type 16 DNA in asymptomatic infection and cervical neoplasia. J Virol. 2004; 78 (23): 12762-12772. [ Links ]
53. Clarke M, Wentzensen N, Mirabello L, Ghosh A, Wacholder S, Harari A, et al. Human papillomavirus DNA methylation as a potential biomarker for cervical cancer. Cancer Epidemiol Biomarkers Prev. 2012; 21(12): 2125–2137. [ Links ]
54. Jiménez-Wences H, Peralta-Zaragoza O, Fernández-Tilapa G. Human papilloma virus, DNA methylation and microRNA expression in cervical cancer. Oncol Rep. 2014; 31 (6): 2467-2476. [ Links ]
55. Shivapurkar N, Toyooka S, Toyooka K, Reddy J, Miyajima K, Suzuki M, et al. Aberrant methylation of trail decoy receptor genes is frequent in multiple tumor types. Int J Cancer. 2004; 109 (5): 786-792. [ Links ]
56. Narayan G, Xie D, Ishdorj G, Scotto L, Mansukhani M, Pothuri B, et al. Epigenetic inactivation of TRAIL decoy receptors at 8p12-21.3 commonly deleted region confers sensitivity to Apo2L/trail-Cisplatin combination therapy in cervical cancer. Genes Chromosomes Cancer. 2015; 55 (2): 178-189. [ Links ]
57. Ciocca D, Calderwood S. Heat shock proteins in cancer: diagnostic, prognostic, predictive and treatment implications. Cell Stress and Chaperones. 2005; 10 (2): 86–103. [ Links ]
58. Vallespi M, García I. Las proteínas de estrés térmico en la inflamación y el cáncer. Biotecnología Aplicada. 2008; 25: 199-207. [ Links ]
59. Instituto Nacional del Cáncer. Bethesda: Diccionario de cáncer. [2015, consulta noviembre 2015]. Disponible en: http://www.cancer.gov/espanol/publicaciones/diccionario?cdrid=471775. [ Links ]
60. Liu D, Tsao Y, Kung J, Ding Y, Sytwu H, Xiao X, et al. Recombinant adeno-associated virus expressing human papillomavirus type 16 E7 peptide DNA fused with heat shock protein DNA as a potential vaccine for cervical cancer. J Virol. 2000; 74 (6): 2888-2894. [ Links ]
61. Kim K, Jang T, Kim J. HSP70 and ER expression in cervical intraepithelial neoplasia and cervical cancer. J Korean Med Sci. 1998; 13(4):383-388. [ Links ]
62. Hwang Y, Lee S, Kim S, Choi Y, Kim M, Lee C. Expression of heat shock protein 60 kDa is upregulated in cervical cancer. Yonsei Med J. 2009; 50(3): 399–406. [ Links ]
63. Fresno M. Moléculas de adhesión en carcinoma de colon. [Internet] Oviedo: ICVHAP 1997. [Consultado noviembre 2015] Disponible en: http://www.conganat.org/icongreso/conferencias/009/index.html [ Links ]
64. Fullár A, Dudás J, Oláh L, Hollósi P, Papp Z, Sobel G, et al. Remodeling of extracellular matrix by normal and tumor-associated fibroblasts promotes cervical cancer progression. BMC Cancer. 2015; 15: 256. [ Links ]
65. Skyldberg B, Salo S, Eriksson E, Aspenblad U, Moberger B, Tryggvason K, et al. Laminin-5 as a marker of invasiveness in cervical lesions. J Natl Cancer Inst. 1999; 91 (21): 1882–1887. [ Links ]
66. Giannelli G, Antonaci S. Biological and clinical relevance of Laminin-5 in cancer. Clin Exp Metastasis. 2000; 18(6): 439-443. [ Links ]
67. Andersson S, Hellström A, Angström T, Stendahl U, Auer G, Wallin K. The clinicopathologic significance of laminin-5 gamma2 chain expression in cervical squamous carcinoma and adenocarcinoma. Int J Gynecol Cancer. 2005; 15 (6): 1065-1072. [ Links ]^rND^sJemal^nA^rND^sBray^nF^rND^sCenter^nM^rND^sFerlay^nJ^rND^sWard^nE^rND^sForman^nD^rND^sSubramaniam^nA^rND^sFauci^nJ^rND^sSchneider^nK^rND^sWhitworth^nJ^rND^sErickson^nB^rND^sKim^nK^rND^sFerris^nD^rND^sWright^nT Jr^rND^sLitaker^nM^rND^sRichart^nR^rND^sLorincz^nA^rND^sSun^nX^rND^sSalmerón^nJ^rND^sLazcano-Ponce^nE^rND^sLorincz^nA^rND^sHernández^nM^rND^sHernández^nP^rND^sLeyva^nA^rND^sFranco^nE^rND^sCuzick^nJ^rND^sHildesheim^nA^rND^sde Sanjose^nS^rND^sBosch^nF^rND^sCastellsagué^nX^rND^sde Sanjosé^nS^rND^sWentzensen^nN^rND^svon Knebel^nM^rND^sBahnassy^nAA^rND^sZekri^nAR^rND^sSaleh^nM^rND^sLotayef^nM^rND^sMoneir^nM^rND^sShawki^nO^rND^sAlameda^nF^rND^sBaro^nT^rND^sMariñoso^nM^rND^sManresa^nJ^rND^sCosta^nC^rND^sEspinet^nB^rND^sNgan^nHY^rND^sTsao^nSW^rND^sLiu^nSS^rND^sStanley^nM^rND^sSgambato^nA^rND^sCittadini^nA^rND^sFaraglia^nB^rND^sWeinstein^nI^rND^sShapiro^nG^rND^sFunk^nJ^rND^sWaga^nS^rND^sHarry^nJ^rND^sEspling^nE^rND^sStillman^nB^rND^sGalloway^nD^rND^sSahasrabuddhe^nV^rND^sLuhn^nP^rND^sWentzensen^nN^rND^sGupta^nN^rND^sSrinivasan^nR^rND^sRajwanshi^nA^rND^sMasoudi^nH^rND^sVan Nieker^nD^rND^sGilks^nC^rND^sCheang^nM^rND^sBilek^nK^rND^sFisher^nU^rND^sDonà^nM^rND^sVocaturo^nA^rND^sGiuliani^nM^rND^sRonchetti^nL^rND^sRollo^nF^rND^sPescarmona^nE^rND^sSari Aslani^nF^rND^sSafaei^nA^rND^sPourjabali^nM^rND^sMomtahan^nM^rND^sLin^nJ^rND^sAlbers^nAE^rND^sQin^nJ^rND^sKaufmann^nAM^rND^sAbba^nMC^rND^sLaguens^nRM^rND^sDulout^nFN^rND^sGolijow^nCD^rND^sLiao^nS^rND^sBrewer^nC^rND^sZávada^nJ^rND^sPastorek^nJ^rND^sPastorekova^nS^rND^sManetta^nA^rND^sGarbett^nNC^rND^sMerchant^nML^rND^sHelm^nCW^rND^sJenson^nAB^rND^sKlein^nJB^rND^sChaires^nJB^rND^sHan^nH^rND^sYang^nY^rND^sLu^nZ^rND^sHe^nQ^rND^sLin^nZ^rND^sDoorvar^nJ^rND^sEly^nS^rND^sSterlyng^nJ^rND^sMc Lean^nC^rND^sCrawford^nL^rND^sGonzález-Ramírez^nE^rND^sAlarcón-Morales^nL^rND^sMartínez-Martínez^nA^rND^sEinstein^nMH^rND^sCruz^nY^rND^sEl-Awady^nMK^rND^sPopescu^nNC^rND^sDi- Paolo^nJA^rND^svan Ranst^nM^rND^sCorden^nSA^rND^sSant-Cassia^nLJ^rND^sEaston^nAJ^rND^sMorris^nAG^rND^sVinokurova^nS^rND^sWentzensen^nN^rND^sKraus^nI^rND^sKlaes^nR^rND^sDriesch^nC^rND^sMelsheimer^nP^rND^sSathish^nN^rND^sAbraham^nP^rND^sPeedicayil^nA^rND^sSridharan^nG^rND^sJohn^nS^rND^sChandy^nG^rND^sCarmody^nM^rND^sJones^nM^rND^sTarraza^nH^rND^sVary^nC^rND^sKlaes^nR^rND^sWoerner^nS^rND^sRidder^nR^rND^sWentzensen^nN^rND^sDuerst^nM^rND^sSchneider^nA^rND^sFuji^nT^rND^sMasumoto^nN^rND^sSaito^nM^rND^sHirao^nN^rND^sNiimi^nS^rND^sMukai^nM^rND^sYu^nMY^rND^sTong^nJH^rND^sChan^nPK^rND^sLee^nTL^rND^sChan^nMW^rND^sChan^nAW^rND^sFerber^nMJ^rND^sThorland^nEC^rND^sBrink^nAA^rND^sRapp^nAK^rND^sPhillips^nLA^rND^sMcGovern^nR^rND^sYu^nT^rND^sFerber^nMJ^rND^sCheung^nTH^rND^sChung^nTK^rND^sWong^nYF^rND^sSmith^nDI^rND^sRoa^nJ^rND^sMartínez^nR^rND^sMontenegro^nS^rND^sRoa^nI^rND^sCapurro^nI^rND^sIbacache^nG^rND^sMelsheimer^nP^rND^sVinokurova^nS^rND^sWentzensen^nN^rND^sBastert^nG^rND^svon Knebel Doeberitz^nM^rND^sHopman^nAH^rND^sSmedts^nF^rND^sDignef^nW^rND^sUmmelen^nM^rND^sSonke^nG^rND^sMravunac^nM^rND^sPett^nMR^rND^sAlazawi^nWO^rND^sRoberts^nI^rND^sDowen^nS^rND^sSmith^nDI^rND^sStanley^nMA^rND^sElhamidi^nA^rND^sHamoudi^nR^rND^sKocjan^nG^rND^sDu^nM^rND^sHua^nY^rND^sLarsen^nN^rND^sKalyana-Sundaram^nS^rND^sKjems^nJ^rND^sChinnaiyan^nA^rND^sPeter^nM^rND^sWang^nX^rND^sWang^nHK^rND^sLi^nY^rND^sHafner^nM^rND^sBanerjee^nNS^rND^sTang^nS^rND^sEgger^nG^rND^sLiang^nG^rND^sAparicio^nA^rND^sJones^nP^rND^sKalantari^nM^rND^sOsann^nK^rND^sCalleja-Macías^nI^rND^sKim^nS^rND^sYan^nB^rND^sJordan^nS^rND^sSartor^nM^rND^sDolinoy^nD^rND^sJones^nT^rND^sColacino^nJ^rND^sPrince^nM^rND^sCarey^nT^rND^sFeber^nA^rND^sArya^nM^rND^sde Winter^nP^rND^sSaqib^nM^rND^sNigam^nR^rND^sMalone^nP^rND^sFlatley^nJ^rND^sMcNeir^nK^rND^sBalasubramani^nL^rND^sTidy^nJ^rND^sStuart^nE^rND^sYoung^nT^rND^sYang^nN^rND^sNijhuis^nE^rND^sVolders^nH^rND^sEijsink^nJ^rND^sLendvai^nA^rND^sZhang^nB^rND^sEijsink^nJ^rND^sYang^nN^rND^sLendvai^nA^rND^sKlip^nH^rND^sVolders^nH^rND^sBuikema^nH^rND^sKalantari^nM^rND^sCalleja-Macías^nI^rND^sTewari^nD^rND^sHagmar^nB^rND^sLie^nK^rND^sBarrera-Saldana^nH^rND^sClarke^nM^rND^sWentzensen^nN^rND^sMirabello^nL^rND^sGhosh^nA^rND^sWacholder^nS^rND^sHarari^nA^rND^sJiménez-Wences^nH^rND^sPeralta-Zaragoza^nO^rND^sFernández-Tilapa^nG^rND^sShivapurkar^nN^rND^sToyooka^nS^rND^sToyooka^nK^rND^sReddy^nJ^rND^sMiyajima^nK^rND^sSuzuki^nM^rND^sNarayan^nG^rND^sXie^nD^rND^sIshdorj^nG^rND^sScotto^nL^rND^sMansukhani^nM^rND^sPothuri^nB^rND^sCiocca^nD^rND^sCalderwood^nS^rND^sVallespi^nM^rND^sGarcía^nI^rND^sLiu^nD^rND^sTsao^nY^rND^sKung^nJ^rND^sDing^nY^rND^sSytwu^nH^rND^sXiao^nX^rND^sKim^nK^rND^sJang^nT^rND^sKim^nJ^rND^sHwang^nY^rND^sLee^nS^rND^sKim^nS^rND^sChoi^nY^rND^sKim^nM^rND^sLee^nC^rND^sFullár^nA^rND^sDudás^nJ^rND^sOláh^nL^rND^sHollósi^nP^rND^sPapp^nZ^rND^sSobel^nG^rND^sSkyldberg^nB^rND^sSalo^nS^rND^sEriksson^nE^rND^sAspenblad^nU^rND^sMoberger^nB^rND^sTryggvason^nK^rND^sGiannelli^nG^rND^sAntonaci^nS^rND^sAndersson^nS^rND^sHellström^nA^rND^sAngström^nT^rND^sStendahl^nU^rND^sAuer^nG^rND^sWallin^nK^rND^1A01^nAline^sSá de Oliveira^rND^1A01^nAndrea^sGarcía^rND^1A01^nDubraska^sSilva^rND^1A01^nAline^sSá de Oliveira^rND^1A01^nAndrea^sGarcía^rND^1A01^nDubraska^sSilva^rND^1A01^nAline^sSá de Oliveira^rND^1A01^nAndrea^sGarcía^rND^1A01^nDubraska^sSilva
Embarazo ectópico abdominal. Dificultad en el diagnóstico. A propósito de un caso.
Dras. Aline Sá de Oliveira1, Andrea García1, Dubraska Silva1.
1 Departamento de Ginecología y Obstetricia. Hospital Central de Maracay.
RESUMEN
El embarazo abdominal, es una variante rara de embarazo ectópico, el cual se desarrolla en la cavidad abdominal y generalmente se asocia con una alta tasa de morbimortalidad materna y fetal. Sus complicaciones pueden ser devastadoras e incluyen la hemorragia masiva secundaria a coagulación intravascular diseminada y muerte fetal asociada con desprendimiento de la placenta o la infección con formación de un absceso. El riesgo de muerte materna por embarazo abdominales es 7,7 veces mayor en relación al embarazo ectópico tubárico y 90 veces mayor que en un embarazo normal. Se trata de una paciente de 31 años de edad quien desarrolla un embarazo ectópico abdominal secundario asintomático hasta las 17 semanas, cuando se manifiesta como una patología digestiva y/o de origen abdominal, lo que retrasa el diagnóstico. La ecografía transvaginal es el estudio de elección para un diagnóstico diferencial.
Palabras clave: Embarazo Ectópico, Abdomen, Ecografía.
SUMMARY
Abdominal pregnancy is a rare variant of ectopic pregnancy (EE), which develops in the abdominal cavity and is usually associated with a high rate of maternal and fetal morbidity and mortality. Its complications can be devastating and include massive hemorrhage secondary to disseminated intravascular coagulation (DIC) and fetal death associated with placental abruption or infection with intraabdominal abscess formation. The risk of maternal death from abdominal pregnancy is 7.7 times greater in relation to tubal ectopic pregnancy and 90 times higher than in a normal pregnancy. A patient 31-year-old woman develops an asymptomatic secondary abdominal ectopic pregnancy until 17 weeks, when it manifests as a digestive and / or abdominal pathology, which delays the diagnosis. Transvaginal ultrasound is the study of choice for a differential diagnosis.
Key words: Ectopic Pregnancy, Abdomen, Ultrasound.
INTRODUCCIÓN
El óvulo fecundado viaja a través de la trompa de Falopio y se implanta en el endometrio de la cavidad uterina aproximadamente al octavo día posterior a la fecundación. Esta es su localización normal, conocida como embarazo eutópico (1,2). El término ectópico proviene de la palabra griega ektopos, que significa fuera de lugar. Por ende, se define embarazo ectópico como aquel embarazo donde el ovocito fecundado se implanta en un lugar distinto al endometrio de la cavidad uterina (3).
El embarazo ectópico (EE) es el resultado de una imperfección en la fisiología reproductiva humana que permite que el embrión se implante y madure fuera de la cavidad endometrial. Sin un diagnóstico y tratamiento oportuno, un embarazo ectópico puede convertirse en una situación que amenaza la vida (4).
El EE fue descrito por primera vez en el siglo XI, y fue considerada una patología fatal hasta mediados del siglo XVIII. En USA, John Bard, en New York (1759), y William Baynham, en Virginia (1791), fueron los primeros en realizar cirugía abdominal por un embarazo ectópico (5, 6).
En 1987, Agüero (7) reporta las primeras publicaciones sobre EE diagnosticados y tratados en Venezuela y atribuye la primera descripción al médico zuliano Nicanor Guardias en 1867. En el siglo XIX también publicaron sobre el tema, Toledo (1885) y Soto (1892), en Maracaibo, y Hermoso (1898), en Caracas. En el siglo XX, hasta 1930, los primeros en operar EE, fueron Bustamante en Maracaibo, en 1905; Lobo en Caracas, en junio de 1907, y Acosta Ortiz, en julio de 1907.
A medida que la gestación aumenta de tamaño, se crea la posibilidad de ruptura de órganos, porque sólo la cavidad uterina está diseñada para expandirse y permitir el desarrollo fetal. La implantación anormal se produce debido a un defecto en la anatomía o la función normal de cualquiera de las trompas de Falopio, los ovarios o del útero.
Como reflejo de esto, la mayoría de los embarazos ectópicos se encuentran en la trompa de Falopio; el embarazo ectópico tubárico corresponde al 95 % a 98 % de los casos (Figura 1), y pueden ser (8):
Ampular, ocurre en 85 % de los casos y pueden evolucionar a una resolución espontánea, aborto tubárico, o permitir el crecimiento del embrión y terminar en ruptura de la trompa.
Itsmico, corresponde a 13 % de los casos y, por deberse a la porción más estrecha de la trompa, se evidencia la ruptura temprana de esta.
Intersticial, también conocido como intramural, constituye el 2 % de los casos.
Infundibular, cuando se ubica cercano a las fimbrias, su frecuencia es de 5 % de los casos.
Los embarazos ováricos corresponden al 0,15 % - 3 % de todos los embarazos ectópicos, con una incidencia de hasta 1/7000 partos; hasta un 72 % de los casos se diagnostican como hallazgos intraoperatorios (9). Para el diagnóstico se requiere la presencia de tejido ovárico en la pared del tejido trofoblástico del saco gestacional.
La incidencia de EE cervical es muy baja. La implantación del cigoto en el endocérvix es muy rara. En Venezuela, hasta 1990, según Agüero (10), sólo se habían reportado 4 casos. Posteriormente Briceño (11) agregó un embarazo ítsmico-cervical (EIC) con invasión a la región vésico-uterina. Puede confundirse con un aborto; sin embargo, actualmente el ultrasonido ha permitido el diagnóstico temprano y por ende el tratamiento conservador. Las causas del ectópico ístmico-cervical no son exactamente conocidas. El factor predisponente más común es el curetaje y dilatación cervical anterior, presente en el 68, 6 %. En el 33,3 %, se recoge el antecedente de cesárea. Su implantación en cicatrices de cesárea, es peligrosa por la posibilidad de penetración de la pared cervical e invasión trofoblástica a la vejiga urinaria. Otros factores como síndrome de Asherman, infertilidad, fertilización in vitro (FIV), uso de dispositivo intrauterino (DIU), embarazos ectópicos anteriores, transporte rápido del cigoto por el útero y anomalías embrionarias, no parecen jugar un papel importante; el 11,8 % son idiopáticos. Probablemente se origine debido a una combinación de estos agentes (11). Existe el riesgo de sangrado importante, si no se logra una hemostasia adecuada, puede requerirse histerectomía abdominal total, ligadura de arterias hipogástricas o embolización.
El embarazo abdominal, es una variante rara del EE, el cual se desarrolla en la cavidad abdominal y generalmente se asocia con una alta tasa de morbimortalidad materna y fetal (12). Sus complicaciones pueden ser devastadoras e incluyen la hemorragia masiva secundaria a coagulación intravascular diseminada (CID) y muerte fetal asociada con desprendimiento de la placenta o la infección con formación de un absceso (13). El riesgo de muerte materna por embarazo abdominal es 7,7 veces mayor en relación al embarazo ectópico tubárico y 90 veces mayor que en un embarazo normal, y la mortalidad neonatal se reporta de un 75 % a 95 % (14).
Han sido publicados casos raros de gestación ectópica abdominal: gemelar abdominal asociados con mola parcial, embarazos heterotópicos con ambos recién nacidos vivos, ocurrencia en paciente con antecedente de histerectomía, implantación en colon, estómago, diafragma, bazo e hígado (14,15).
Puede clasificarse, según el origen, en primarios, cuando ambas trompas y ovarios son normales, no existen fístulas útero peritoneales y el embarazo está asociado exclusivamente a la superficie peritoneal, sin relación con la fimbria tubárica. El fondo de saco de Douglas y la pared posterior uterina constituyen los sitios más comunes de implantación primaria. Esta forma de embarazo es la que con mayor frecuencia se asocia con fetos viables o a término en cavidad abdominal (2). La mayoría de los embarazos ectópicos abdominales son secundarios a ruptura de un embarazo tubárico u ovárico, para que el desarrollo del embarazo, en estos casos, continúe estos acontecimientos deben ser precoces, de tal forma que el embrión asegure su nidación secundaria o bien, el flujo sanguíneo placentario se mantenga mediante la unión con la trompa (15).
Algunos de los factores predisponentes del embarazo abdominal son la multiparidad, la edad mayor a 30 años, la historia de infertilidad, el embarazo tubárico previo, la cirugía pélvica, la raza afrodescendiente, la historia de abortos previos, el uso de dispositivos intrauterinos, la endometriosis y las anomalías congénitas; también se ha implicado a la salpingitis, a las enfermedades de transmisión sexual y a las secuelas de la cirugía tubárica.
Stovall y col. (16) sugieren que el diagnóstico clínico tiene una efectividad de 76,25 %, el diagnóstico ecográfico, 91,91 % y a través de la culdocentesis 85,39 % de los casos. Otros autores sugieren que la historia clínica y la exploración física ofrecen información diagnóstica de utilidad, con menos del 50 % de precisión (17).
Clínicamente es muy variable la presentación del caso, las pacientes, en general, consultan con dolor abdominal, sangrado genital y malestar digestivo (15). Algunos casos son asintomáticos y puede dar origen a un litopedio o litopedium que es el nombre que se le da a un embarazo extrauterino que implica un feto muerto y calcificado con el paso de los años. Es un fenómeno raro (se calcula que ocurre una vez en cerca de 20.000 embarazos), consecuencia de un embarazo abdominal. Después de la muerte fetal ocurre la deshidratación de los tejidos, la infiltración de calcio y se inicia el proceso de petrificación (18).
La condición de litopedio fue descrita por primera vez en un tratado de cirugía (Kitab al Tasrif) del médico árabe Abul-Qasim Khakaf ibn al Abbas al Zahravi, más conocido como Albucasis (913 – 1013 DC) en el siglo XI. La primera descripción detallada fue en 1557, realizada por Spach. En el siglo XVIII se operó por primera vez a una mujer para extraer el litopedio, y en la actualidad hay documentados varios casos. Schosfftall y Facler refirieron que existían 262 casos descritos en la literatura, para 1965. Actualmente se mencionan 300 casos en 400 años de documentación médica (19, 20).
El diagnóstico del embarazo ectópico (EE) abdominal requiere un alto grado de sospecha, porque la historia clínica, el examen físico, los exámenes de laboratorio y la ultrasonografía suelen ser inespecíficos. Sin embargo, esta última puede hacer plantear el diagnóstico, al encontrar un feto y su placenta fuera de la cavidad uterina, aunque en ocasiones el diagnóstico no es realizado y en su mayoría corresponde a hallazgos intraoperatorios. Solo del 10 % al 30 % llega a cirugía con diagnóstico preoperatorio de embarazo abdominal, debido básicamente a la falta de familiaridad del ginecobstetra con este tipo de casos, por la baja frecuencia de los mismos.
HISTORIA CLÍNICA
MYGV, de 31 años de edad, II gesta I para, fecha de ultima regla incierta, quien refiere el inicio de la enfermedad actual el día previo a su ingreso cuando, posterior a ingesta de comida copiosa, empieza a presentar dolor en epigastrio de moderada intensidad, urente, concomitantemente náuseas, dispepsia y emesis. Acude al hospital del Instituto Venezolano de los Seguros Sociales (IVSS) quienes valoran y deciden el ingreso de la paciente, quien permanece en dicha institución por 2 días; en vista de persistir sintomatología y presentar descenso de cifras de hemoglobina, deciden referir al Hospital Central de Maracay.
Ingresa con los diagnósticos de:
1. Embarazo de 17 semanas más 3 días por biometría fetal.
2. Síndrome ictérico en estudio.
3. Anemia 7,2 g/dL
4. Enfermedad periodontal: caries.
5. Periodo intergenésico prolongado.
Se recibe, a las 12 horas de hospitalizada, un control de hematología que reporta 6,2 g/dL, por lo cual es reevaluada por el equipo de guardia.
Al examen físico se describe paciente femenino en regulares condiciones generales, con palidez cutáneo mucosa, taquicárdica, hipotensa, con dolor difuso a la palpación de abdomen, útero aumentado de tamaño extrapélvico, al espéculo, vagina de paredes rugosas, cérvix macroscópicamente sano, escaso sangrado oscuro, no fétido. Al tacto vaginal, vagina normotérmica, normotónica, cuello central, corto, cerrado, útero indiferente aumentado de tamaño ± 18 cm, fondos de sacos dolorosos a la exploración, abombados y con la palpación de una masa sólida.
Al ultrasonido transvaginal institucional se evidencia feto vivo extrauterino, se realiza ecografía pélvica informada previamente, corroborándose dicho hallazgo, debido a que la cavidad uterina estaba vacía (Figura 2).
Se prepara la paciente para ingresar a quirófano. Se realiza, bajo anestesia general, laparotomía ginecológica, cuyos hallazgos fueron: hemoperitoneo de 200 cc, útero aumentado de tamaño, aproximadamente 18 cm, hiperémico, con pérdida de la arquitectura en su porción lateral izquierda, debido a masa asimétrica friable, sangrante de aproximadamente 22 cm x 18 cm, adherida al fondo de saco de Douglas y al recto (Figura 3). Trompa izquierda de superficie irregular, engrosada, hiperémica. Ovario izquierdo adherido a masa anteriormente descrita, no friable. Feto vivo masculino de 15 cm (Figura 4), líquido amniótico muy escaso, tejido placentario a nivel de cara posterior de útero y fondo de saco de Douglas.
Se realizó extracción del feto y hemostasia compresiva; extracción placentaria incompleta, por su relación con órganos vecinos y para evitar sangrado masivo.
Durante el acto operatorio, el servicio de cirugía constató la indemnidad del colon y del recto. La paciente evolucionó satisfactoriamente en el post operatorio, recibió tratamiento con hemoderivados, antibioticoterapia y metotrexate, según esquema de dosis única. Se realizaron controles de los niveles de gonadotropina coriónica (βHCG) y se indicó evaluación y seguimiento por consulta externa.
CONCLUSIÓN
El embarazo ectópico sigue siendo una patología ginecológica, considerada como una emergencia médica. El EE abdominal, por su poca frecuencia, hace que a veces el diagnóstico sea retardado y requiere un alto grado de sospecha e experiencia clínica.
La ecografía es la técnica y/o modalidad de imagen accesible y de bajo costo que juega un papel fundamental en el diagnóstico del embarazo ectópico; permite detectar la localización del embarazo en más del 90 % de los casos.
La presentación clínica del embarazo abdominal no cumple con la tríada clásica del EE. Pudiendo ir desde lo asintomático a manifestaciones diversas de la esfera abdominal. El dolor es la constante o signo de alarma. Las pacientes deben ser evaluadas de manera integral para prevenir la mortalidad materna.
En este caso, la presentación de la masa parauterina izquierda y el deterioro de la trompa izquierda sugiere que se trata de embarazo abdominal secundario. El tratamiento es laparotomía y extracción del feto, lo cual puede no presentar problemas. Cuando la placenta se encuentra insertada en un órgano no vital (epiplón, trompa), no se debe intentar desprenderla por el sangrado que produce y es necesario proceder a extirpar el órgano con la placenta in situ. Cuando la placenta está implantada en el colon, el intestino delgado u otro órgano vital, se debe seccionar el cordón umbilical lo más próximo a la placenta y dejarla en el sitio de implantación. Posteriormente se hace seguimiento con determinaciones seriadas semanales de βHCG y, ante la evidencia de persistencia de tejido trofoblástico activo, se debe iniciar tratamiento con metotrexate.
Referencias
1. Moore K, Persaud T. Inicio del desarrollo humano. En: Moore K, Persaud T, editores. Embriología clínica. 6ª edición. México: Mc Graw Hill – Interamericana; 1999.p.17-48. [ Links ]
2. Cunninghan FG, Leveno K, Bloom S, Haut J, Gilstrap L, Wenstrom K. Obstetricia de Williams. 22 ed. México, DF: Mc Graw Hill-Interamericana; 2006. [ Links ]
3. Ruiz AI, Rodríguez LM. Embarazo ectópico. En: Parra Pineda MO, Ángel Müller E. Obstetricia integral del siglo XXI. Tomo II. Colombia: Universidad Nacional de Colombia; 2009. p 13 - 32. [ Links ]
4. Farquhar CM. Ectopic pregnancy. Lancet. 2005; 366 (9485): 583-591. [ Links ]
5. Duffy J. From Humors to Medical Science: A History of American Medicine. Chicago: University of Illinois Press; 1993. [ Links ]
6. Speroff L, Glass R, Kase N. Ectopic pregnancy. Clinical Gynecologic Endocrinology and Infertility. 7ª edición. Baltimore: Williams & Wilkins; 2005.p.1275-1302. [ Links ]
7. Agüero O. Las primeras publicaciones sobre embarazos ectópicos diagnosticados y tratados en Venezuela. Gac Méd Caracas. 1987; 95: 529-539. [ Links ]
8. Sepilian V, Wood E, Casey F, Rivlin M. Ectopic Pregnancy [Internet]. New York: Medscape; 2016. (cited 2016, nov 02) Available from emedicine.medscape.com/article/2041923-overview [ Links ]
9. Nwanodi O, Khulpateea T. The preoperative diagnosis of primary ovarian pregnancy. J Natl Med Assoc. 2006; 98 (5): 796-798. [ Links ]
10. Agüero O. Publicaciones Obstétrico – Ginecológicas - Perinatológicas Venezolanas. Volúmenes I y II. 1ª edición. Caracas: Editorial Ateproca; 1993. [ Links ]
11. Briceño-Pérez C. Embarazo cervical. Rev Obstet Ginecol Venez. 2002; 62(4): 261-267. [ Links ]
12. Ricci P, Perucca E, Cuellar J, Leiva R, Blanch J, Álvarez D, et al. Embarazo abdominal complicado del primer trimestre. Rev Chil Obstet Ginecol. 2003; 68 (3): 238-241. [ Links ]
13. Kupesic S, Aksamija A, Kurjak A. Embarazo ectópico. En: Kurjak A, Chervena F. Ecografia en Obstetricia y Ginecología. 2ª edición. Editorial Medica Panamericana: Buenos Aires. 2009. P 230-240. [ Links ]
14. Bouyer J, Coste J, Fernández H, Pouly JL, Job-Spira N. Sites of ectopic pregnancy: a 10-year population-based study of 1800 cases. Hum Reprod. 2002; 17 (12): 3224-30. [ Links ]
15. León Cid I, Rodríguez Iglesias G, Segura Fernández A, Atienza Barzaga AM. Embarazo ectópico abdominal con implantación en el hígado. Rev Cub Med Mil. 2011; 40 (3-4): 302-310. [ Links ]
16. Stovall T, McCord M. Pérdida temprana del embarazo y embarazo ectópico. En: Berek J. Ginecología de Novak. México: Interamericana Mc Graw Hill; 2000. p 490– 523. [ Links ]
17. Faneite P, García L, Repilloza M, Landa M. Embarazo ectópico: frecuencia. Hospital Dr Adolfo Prince Lara 1969 – 1996. Rev Obstet Ginecol Venez. 1997; 57 (4): 243 -247. [ Links ]
18. Aguilar M. Litopedio: calcificación abdominal. Reporte de un caso clínico. Revista de diagnóstico por imágenes. 2006; 1 (1): 33- 35. [ Links ]
19. Frayer CA, Hibbert ML. Abdominal Pregnancy in 67-year-old woman undetected for 37 years. A case report. J Reprod Med. 1999; 44 (7): 633-635. [ Links ]
20. Spirtos NM, Eisenkop SM, Mishell DR. Lithokelyphos. A case report and literature review. J Reprod Med. 1987; 32 (1): 43-46. [ Links ]^rND^sMoore^nK^rND^sPersaud^nT^rND^sRuiz^nAI^rND^sRodríguez^nLM^rND^sFarquhar^nCM^rND^sAgüero^nO^rND^sNwanodi^nO^rND^sKhulpateea^nT^rND^sBriceño-Pérez^nC^rND^sRicci^nP^rND^sPerucca^nE^rND^sCuellar^nJ^rND^sLeiva^nR^rND^sBlanch^nJ^rND^sÁlvarez^nD^rND^sKupesic^nS^rND^sAksamija^nA^rND^sKurjak^nA^rND^sBouyer^nJ^rND^sCoste^nJ^rND^sFernández^nH^rND^sPouly^nJL^rND^sJob-Spira^nN^rND^sLeón Cid^nI^rND^sRodríguez Iglesias^nG^rND^sSegura Fernández^nA^rND^sAtienza Barzaga^nAM^rND^sStovall^nT^rND^sMcCord^nM^rND^sFaneite^nP^rND^sGarcía^nL^rND^sRepilloza^nM^rND^sLanda^nM^rND^sAguilar^nM^rND^sFrayer^nCA^rND^sHibbert^nML^rND^sSpirtos^nNM^rND^sEisenkop^nSM^rND^sMishell^nDR^rND^1A01^nMarco^sLópez Tovar^rND^1A01^nAdriana^sPesci Feltri^rND^1A01^nIsabel^sGarcía Fleury^rND^1A01^nVincent^sGuida^rND^1A01^nMarco^sLópez Tovar^rND^1A01^nAdriana^sPesci Feltri^rND^1A01^nIsabel^sGarcía Fleury^rND^1A01^nVincent^sGuida^rND^1A01^nMarco^sLópez Tovar^rND^1A01^nAdriana^sPesci Feltri^rND^1A01^nIsabel^sGarcía Fleury^rND^1A01^nVincent^sGuida
Hipertrofia mamaria juvenil. Revisión de la literatura. A propósito de un caso clínico
Drs. Marco López Tovar1, Adriana Pesci Feltri2, Isabel García Fleury3, Vincent Guida4.
1 Cirujano General – Mastólogo. Consulta Patología Mamaria, Servicio de Ginecología, Hospital Universitario de Caracas. 2 Cirujano Mastólogo. Coordinadora de Curso de Ampliación en Patología Mamaria. Servicio de Ginecología, Hospital Universitario de Caracas. 3 Especialista en Obstetricia y Ginecología. Mastólogo. Consulta Patología Mamaria, Servicio de Ginecología Hospital Universitario de Caracas. 4 Cirujano General – Mastólogo. Consulta Patología Mamaria, Servicio de Ginecología Hospital Universitario de Caracas.
RESUMEN
Se presenta el caso de una paciente de 22 años con hipertrofia mamaria bilateral, de gran tamaño. No presentaba tumor ni alteraciones hormonales. Fue intervenida quirúrgicamente y la evolución fue satisfactoria.
Palabras clave: Hipertrofia Mamaria, Gigantomastia, Hipertrofia Juvenil de la Mama, Hipertrofia Virginal Mamaria.
SUMMARY
We report a case of a 22-year-old patient with massive Juvenile Breast Hypertrophy. No tumor or hormonal changes cause the disease. Was successfully treated with a breast reduction.
Key words: Breast Hypertrophy, Gigantomastia, Juvenile Breast Hypertrophy, Virginal Breast Hypertrophy.
INTRODUCCIÓN
La hipertrofia mamaria es una enfermedad benigna, poco frecuente y de etiología desconocida, caracterizada por un crecimiento excesivo, difuso y rápido de la glándula mamaria durante la adolescencia (1), en algunos casos ocurre antes de este periodo, siendo extremadamente raro (2). Fue descrita en 1910, por Henry Albert, quien menciona esta patología como gigantomastia, hipertrofia juvenil o hipertrofia virginal mamaria (3). Generalmente es bilateral, pero puede presentarse en una sola mama (4).
El mecanismo subyacente que causa la hipertrofia de las mamas aún no se ha dilucidado. Una teoría propuesta es una hipersensibilidad de los órganos diana a los niveles normales de hormonas gonadales (5). En la literatura se ha documentado que algunos casos responden a terapia farmacológica con base en tamoxifeno, danazol o bromocriptina (6); esto justificado en la hipótesis que trata de explicar que el aumento de la actividad hormonal tiene un rol importante en la evolución de esta entidad clínica; sin embargo, otros estudios han encontrado niveles normales de estrógeno, progesterona, gonadotropinas y la hormona del crecimiento durante esta fase de crecimiento rápido (7).
Esta entidad, más allá de la cervicalgia y alteración de la postura, tiene un gran impacto físico y psicológico, lográndose con cirugía reductora mejoría en cada uno de estos aspectos (8); sin embargo, una cirugía realizada en una época precoz, antes de la estabilización de las hormonas puberales puede traer un nuevo crecimiento mamario del tejido remanente (9).
CASO CLÍNICO
El siguiente caso trata de una paciente de 22 años de edad, sexo femenino, sin antecedentes personales ni familiares que contribuyan al diagnóstico; quien refiere aumento de volumen progresivo en ambas mamas, de aproximadamente un año de evolución, acompañado de mastalgia no cíclica, eritema local, cambios tróficos en la piel de ambas mamas, además de limitación para la bipedestación y deambulación que se fue acentuando progresivamente, razón por la cual acudió a consulta de mastología. Antecedentes ginecobstétricos: menarquia 11 años. I gesta, I cesárea. Primera gesta: 17 años. Anticonceptivos orales (ACO): Nordette® durante 1 año. Ciclos menstruales regulares. Examen físico: mamas de gran tamaño, ptósicas, simétricas, que sobrepasan el tercio superior de ambos muslos, con eritema difuso y cambios tróficos en todos los cuadrantes de ambas mamas, red venosa colateral bilateral, sin nódulos palpables. Ambas axilas y fosas supraclaviculares libres (Figura 1). Ecosonograma mamario: mamas voluminosas, simétricas, con abundante cantidad de tejido fibroglandular, no se observaron imágenes quísticas ni sólidas. Llama la atención aumento de ecogenicidad y espesor de la piel y tejido celular subcutáneo bilateral. Regiones axilares libres de adenopatías. Perfil hormonal: T3 0,7 ng/ml, T4 5,3 ng/ml, TSH 1,3 mui/ml, prolactina 11,3 ng/ml, estradiol 167,9 pg/ml, progesterona 1,5 ng/ml, LH 0,6 UI/ml, FSH 1,4 UI/ml. Evaluación por Endocrinología Médica y Endocrinología Ginecológica: no hay evidencia de alteraciones hormonales que se relacionen con la gigantomastia de la paciente.
Se realizó, en conjunto con el servicio de Cirugía Plástica, mamoplastia reductora por técnica de Thorek, se obtuvo de mama derecha material con un peso de 6450 gramos y de mama izquierda 5170 gramos; se injertó el complejo areola pezón, la evolución fue satisfactoria (Figura 2).
CONCLUSIONES
La hipertrofia mamaria es una entidad benigna poco frecuente, que se presenta en mujeres cerca del inicio de su pubertad, en ausencia de gestación y sin finalidad funcional lactante, con niveles hormonales normales; generalmente se debe a una respuesta exagerada del parénquima mamario a los estrógenos (2, 10).
El diagnóstico diferencial debe realizarse con la pseudoginecomastia asociada con obesidad, hipertrofia gravídica o las secundarias a endocrinopatía, patologías neoplásicas como linfomas, sarcomas y con tumores fibroepiteliades como el tumor filodes o fibroadenoma juvenil, aunque en estos casos generalmente es unilateral (8).
En la literatura se han reportado distintos tipos de tratamientos para esta entidad, desde tratamiento médico con antiestrógenos para intentar la regresión del crecimiento del tejido glandular, lográndose en algunos casos resultados pobres, además con algunas desventajas debido a los distintos efectos secundarios por su uso a temprana edad; hasta tratamiento quirúrgico con resultados satisfactorios e inmediatos, tanto clínicos como psicológicos (11).
REFERENCIAS
1. Gözü A, Yoğun FN, Özsoy Z, Özdemir A, Özgürhan, G, Tuzlalı S. Juvenile breast hypertrophy. J Breast Health. 2010; 6 (3): 122-124. [ Links ]
2. Gabilondo Zubizarreta FJ, Madariaga Romero N, Meléndez Baltanas J, Ayestarán Soto J, Caramés EJ. Hipertrofia mamaria virginal: caso clínico. Cir Plást Iberolatinoam. 2007; 33(4):215-220. [ Links ]
3. Albert H. Diffuse idiopathic hypertrophy of the mammary glands of the female. JAMA. 1910; 55 (16):1339-1343. [ Links ]
4. Hernández G, Gómez A, Paredes R. Lesiones benignas de la mama. Caracas: Médica Panamericana; 2012. [ Links ]
5. Morimoto T, Komaki K, Mori T, Sasa M, Miki H, Inoue H, et al. Juvenile gigantomastia: report of a case. Surg Today. 1993; 23 (3): 260–264. [ Links ]
6. Sperling RL, Gold JJ. Use of an anti-estrogen after a reduction mammaplasty to prevent recurrence of virginal hypertrophy of breasts. Case report. Plast Reconstr Surg. 1973; 52 (4): 439–442. [ Links ]
7. Kupfer D, Dingman D, Broadbent R. Juvenile breast hypertrophy: report of a familial pattern and review of the literature. Plast Reconstr Surg. 1992; 90 (2): 303– 309. [ Links ]
8. Güneş D, Mutafoğlu-Uysal K, Canda T, Saydam S, Cemeroğlu AP, Olgun N. Unilateral juvenile (virginal) hypertrophy of the breast. Turk J Pediatr. 2008; 50 (3): 278-281. [ Links ]
9. Sánchez de la Cruz B. Ginecología Infantojuvenil. Buenos Aires: Médica Panamericana; 2011. [ Links ]
10. Koltz PF, Sbitany H, Myers RP, Shaw RB, Patel N, Girotto JA. Reduction mammaplasty in the adolescent female: the URMC experience. Int J Surg. 2011; 9 (3): 229-232. [ Links ]
11. Figueroa Ángel S, Romero Flores V. Hipertrofia virginal mamaria en niños y manejo quirúrgico. Rev Peru Ginecol Obstet. 2012; 58 (2): 127-132. [ Links ]^rND^sGözü^nA^rND^sYoun^nFN^rND^sÖzsoy^nZ^rND^sÖzdemir^nA^rND^sÖzgürhan,^nG^rND^sTuzlal^nS^rND^sGabilondo Zubizarreta^nFJ^rND^sMadariaga Romero^nN^rND^sMeléndez Baltanas^nJ^rND^sAyestarán Soto^nJ^rND^sCaramés^nEJ^rND^sAlbert^nH^rND^sMorimoto^nT^rND^sKomaki^nK^rND^sMori^nT^rND^sSasa^nM^rND^sMiki^nH^rND^sInoue^nH^rND^sSperling^nRL^rND^sGold^nJJ^rND^sKupfer^nD^rND^sDingman^nD^rND^sBroadbent^nR^rND^sGüne^nD^rND^sMutafolu-Uysal^nK^rND^sCanda^nT^rND^sSaydam^nS^rND^sCemerolu^nAP^rND^sOlgun^nN^rND^sKoltz^nPF^rND^sSbitany^nH^rND^sMyers^nRP^rND^sShaw^nRB^rND^sPatel^nN^rND^sGirotto^nJA^rND^sFigueroa Ángel^nS^rND^sRomero Flores^nV^rND^nMariella^sBajares de Lilue^rND^nRita^sPizzi^rND^nElsy^sVelázquez Maldonado^rND^nMariella^sBajares de Lilue^rND^nRita^sPizzi^rND^nElsy^sVelázquez Maldonado^rND^nMariella^sBajares de Lilue^rND^nRita^sPizzi^rND^nElsy^sVelázquez Maldonado
Prefacio
Dras. Mariella Bajares de Lilue, Rita Pizzi, Elsy Velázquez Maldonado
El síndrome de ovario poliquístico (SOP) es la endocrinopatía más frecuente en la edad reproductiva, con una prevalencia estimada de un 4 %-10 %. Desde su descripción original en 1935 por Stein y Leventhal (oligomenorrea, infertilidad y ovarios aumentados de volumen), hemos visto un gran avance en el conocimiento de los mecanismos intrínsecos que explican la fisiopatología de este desorden, particularmente importante ha sido el reconocimiento de un estado de resistencia a la insulina e hiperinsulinismo compensatorio secundario como uno de los mecanismos subyacentes de la disfunción ovulatoria, hiperandrogenismo, infertilidad y anormalidades metabólicas como la dislipidemia y trastornos de la tolerancia a la glucosa. Recientemente se han realizado grandes aportes en la tipificación genética, la programación intrauterina y nuevas vías en la señalización metabólica.
El SOP está asociado a un mayor riesgo para desarrollar diabetes mellitus tipo 2 (DM2), hipertensión, enfermedad cardiovascular arterioesclerótica y carcinoma de endometrio. Más recientemente, también se considera que el SOP podría ser una expresión temprana del síndrome metabólico, el cual se asocia con un mayor riesgo para el desarrollo de DM2 y enfermedad cardiovascular. Por lo expuesto anteriormente, se hace necesario establecer un diagnóstico apropiado que permita identificar tempranamente esta patología para iniciar las medidas preventivas y terapéuticas que permitan garantizar a la mujer un estado de salud en todas las etapas de su vida. Para lograr este objetivo, en el año 2004 se publica el primer consenso internacional sobre los criterios clínicos del SOP, el cual fue realizado en Rotterdam (Holanda) y auspiciado por la Sociedad Europea de Reproducción Humana y Embriología y la Asociación Americana de Medicina Reproductiva. Estos consensos aún son vigentes, aunque con especificaciones adicionales de diferentes fenotipos, lo cual es importante para la selección terapéutica. En condiciones especiales como adolescencia, posmenopausia o bajo tratamiento con anticonceptivos orales, aún existe controversia en su definición.
El objetivo de la presente edición es actualizar los avances en la fisiopatología, diagnóstico y tratamiento de esta compleja condición.
Esperamos que la información científica presentada sea de ayuda para conseguir el objetivo, el cual no es otro que una atención médica mucho más efectiva de estas mujeres, lo cual se traduce en una mejor condición de salud y por ende, una mejor calidad de vida.
^rND^1A01^nRafael^sMolina Vílchez^rND^1A01^nRafael^sMolina Vílchez^rND^1A01^nRafael^sMolina VílchezDe la diabética barbuda al síndrome metabólico
Dr. Rafael Molina Vílchez
Gineco-Obstetra. Especialista en Gineco – Obstetricia del Hospital Manuel Noriega Trigo, San Francisco y Policlínica San Luis, Maracaibo, Estado Zulia. Ex Presidente de la Sociedad de Obstetricia y Ginecología de Venezuela
La publicación que en 1935 hicieron Irving Stein y Michael Leventhal (1), hoy hito histórico de la Endocrinología Ginecológica, destapó una verdadera caja de Pandora. Como sucede con muchas nuevas contribuciones a la ciencia, sus inicios tocaron solo una parte del tema en cuestión, en explicable desconocimiento de la respuesta en cadena que generarían. Irving Stein fue cirujano y ginecólogo con especial dedicación a la Fertilidad, y pionero de la Ginecografía; por cierto, miembro de la Sociedad de Obstetricia y Ginecología de Venezuela. En 1929 llegó a ser Profesor Emérito de la Northwestern University (2). En el Hosp. Michael Reese, Michael Leventhal comenzó a trabajar con Stein el año 1926 (3). Con el impacto del trabajo impreso en el American Journal of Obstetric and Gynecology y con una Ginecología que entonces era casi totalmente quirúrgica, se difundió la denominación síndrome de Stein y Leventhal (SSL) o síndrome de ovarios poliquísticos (SOP), aunque ya en 1721, el italiano Antonio Vallisnery había reportado la existencia de mujeres infértiles y obesas con ovarios agrandados, blanquecinos y brillantes como huevos de paloma (4).
Por otro lado,Achard y Thiers (5) habían registrado la diabetes de la mujer con barba en una paciente de 71 años con hirsutismo y glucosuria intermitente, en cuya autopsia se encontró aumento de tamaño de las suprarrenales y cambios menores en tiroides y páncreas, lo que calificaron como síndrome pluriglandular. Se presentaba ya la confusión onomástica porque pronto la diabetes de la mujer hirsuta, aunque con pocos pacientes, pasó a ser llamada así (6). Greenblatt y col. revisaron el tema en 1963 y en las referencias colocaron a Kraus, 1913, y a Tuffer, 1914, quienes habían reportado casos parecidos a esta condición a la cual los clínicos clasificaban además de síndrome suprarrenogenital, virilismo suprarrenal, síndrome córtico-suprarrenal, y hasta de síndrome de Cushing. Presentaron seis casos nuevos, dos de los cuales tenían ovarios grandes, similares a los que se ven en el síndrome de Stein y Leventhal (7). El conjunto de estas observaciones sumó datos importantes como para promover la investigación sobre ese tipo de ovarios y su coexistencia con algunas disfunciones endocrino-metabólicas, vista desde dos lados: el de los ginecólogos: casi todos cirujanos, y el de los internistas-endocrinólogos.
Para los primeros el tema es la anovulación y sus consecuencias, como infertilidad, hemorragia uterina disfuncional, hiperplasia y carcinoma endometrial; una condición a diagnosticar con la visualización: antes a través de neumopelvigrafía, ginecografía y laparoscopia, después con una ultrasonografía de rápidos avances en su capacidad de definición. Se confirmó que aquella asociación con obesidad e hirsutismo en las pacientes con SSL no es casual, aunque los síntomas y signos no aparecen en todos los casos. Además, la investigación básica planteaba problemas para permitir reconocerla como eventos con una sola base fisiopatológica. El uso amplio de la ultrasonografía sorprendió al enseñar que aquella imagen descrita como propia de los ovarios poliquísticos (OP) se encuentra en mujeres con eumenorrea. Se habló entonces de la diferencia entre el verdadero ovario poliquístico – el tema será específicamente tratado adelante – y el ovario multifolicular.
Entremos un poco en lo idiomático para juzgar cierta nomenclatura y la incomprensión a la cual llevan. La palabra quiste, del griego kýstises Vejiga membranosa que se desarrolla anormalmente en diferentes regiones del cuerpo y que contiene líquido o materias alteradas (8). Un folículo es un saquito, una glándula en forma de pequeño saco. Siempre ha existido la discusión en torno a cuándo un folículo no roto pasa a ser llamado quiste; es cuestión de tamaño. Porque multifoliculares son los ovarios desde la vida fetal. Con buena ultrasonografía, solo carecen de pequeñas imágenes ecolúcidas o líquidas los ovarios de la posmenopausia y las disgenesias gonadales. Desde que el folículo tiene una buena cantidad de líquido, un ultrasonografista general podría, como suele ocurrir, etiquetarlo de pequeño quiste el tema será tratado más adelante en esta publicación. Hoy, la sonografía de la infertilidad deja ver cuán grande puede ser el tamaño del folículo preovulatorio. Parece más lógico que la nomenclatura para estos ovarios agrandados se base en el volumen total, el estromal, la relación entre ellos u otros signos. El rosario de folículos se encuentra hasta en hipogonadismo hipogonadotropo; estos llegan a mostrar una fase líquida central por un desarrollo inicial independiente de la hormona hipofisaria estimulante (FSH). Imagen es una cosa, otra es la serie de cambios biomoleculares de la teca, la granulosa, los receptores a hormona luteinizante (LH), insulina, factor de crecimiento insulínico o insulinoide (IGF-1), la proteína que lo fija (IGF-1-BP) y otras biomoléculas. Entonces: ¿Qué es y qué no es SOP? ¿Cuál diagnóstico pondríamos hoy a las pacientes de SSL? Rogerio Lobo (9) catalogó una vez esta condición como desorden sin identidad, algo entre anovulación crónica hiperandrogénica, ovarios poliquísticos, Stein-Leventhal, síndrome o enfermedad, titulando su publicación con una frase que parece propia de la franciscana resignación del Papa al responder una pregunta que se le hiciera sobre los homosexuales con otra: ¿Qué somos nosotros para llamarlo?. En un artículo que entonces hablaba de caos para calificar el status del problema, se afirmaba que no se sabía qué era, que faltaban muchas piezas para completar el rompecabezas, y que se le llamaba de esa manera sabiéndose que no era lo mejor (10). Y el caos se hizo más visible con las conclusiones de la reunión de un Instituto Nacional de Salud estadounidense en 1990 (11), respaldadas con los conocidos criterios de Rotterdam (12). Con base en ese acuerdo se requiere para el diagnóstico un mínimo de dos de tres criterios: los datos clínicos y bioquímicos de hiperandrogenismo, sumados a la disfunción menstrual, oligo o anovulación, permiten el diagnóstico una vez descartada la hiperplasia suprarrenal congénita no clásica, los tumores secretores de andrógenos, el síndrome de Cushing, la disfunción tiroidea y la hiperprolactinemia, aunque falte el tercer criterio, que es precisamente la imagen de OP. Pero la calificación clínica de OP que, bien vistos, no son tales, reconocida como errada, en inglés un misnomer (13), sigue en vigencia. Esto sí que ha sido una bofetada al idioma, al discurso médico, ante la cual se hubieran levantado Bello y Baralt. Porque la imagen multifolicular puede acompañar cualquier tipo de anovulación crónica y estar presente aun en mujeres eumenorreicas, y a la inversa, puede faltar aun con disfunción menstrual y signos clínicos de hiperandrogenismo.
En intento de conciliar la evolución de estos conceptos con la lógica y el idioma surgió una propuesta de Homburg (14), para quien: aunque cambiar el nombre de un síndrome clasificado ya por décadas se presta a la confusión, ignorar la morfología o la imagen de los ovarios sería una decisión extraña, por lo que hay que separar el signo y el síndrome. Con la observación de la gónada multifolicular, sin cambios clínicos ni bioquímicos, sin hiperandrogenismo ovárico, pudiera hablarse de OP como signo. Cuando se añaden los últimos, la calificación sería de síndrome o SOP.
Más aun, en 2012, un panel de expertos convocado por uno de los Institutos Nacionales de Salud, en Estados Unidos, recomendó eliminar la denominación SOP, que para ellos resulta en una confusión causante de impedimentos al progreso en la comunicación entre los clínicos, los investigadores y el público. Proponían sustituirla por algo más representativo del complejo metabólico (15). Pero se ha mantenido, a pesar de reconocerse que el problema sobrepasa su nombre, que se trata de algo heterogéneo y complejo, no solo con manifestaciones gineco-obstétricas, sino también metabólicas; que los casos con hiperandrogenismo se asocian con un fenotipo más severo, y que la fisiopatología agrupa disfunciones hipotálamo- hipofisarias con respuesta disminuida a los esteroides sexuales, alteraciones morfofuncionales de los ovarios y respuesta anormal a la insulina en diversos tipos celulares, incluyendo los del ovario (16).
En 2015, una declaración conjunta de varias sociedades médico-científicas mantiene la denominación y la definición, en coincidencia con los criterios ya citados del NIH, los de Rotterdam 2004 y aquellos de los estudiosos del hiperandrogenismo: con dos de los tres hallazgos ya citados, se diagnostica SOP (17). Se mantiene el SOP aunque en una segunda parte de esta declaración hacen énfasis en el rol intrínseco de la resistencia a la insulina (RI) – prueba de la pinza hiperinsulinémica-euglucémica - en la patogenia, trátese de mujeres obesas o no; y que las pacientes deben ser examinadas para descartar el síndrome metabólico (SM) en cada uno de sus componentes. Explica además los diferentes mecanismos por los cuales la RI lleva al SOP: estímulo de la síntesis de andrógenos por la LH, aumento de la amplitud y frecuencia de los pulsos de esta inducidos por la hormona liberadora de gonadotrofinas - GnRH-, disminución de la producción de la Globulina fijadora de Esteroides Sexuales (SHBG), disminución de la IGF1-BP con la consecuente elevación en la formación de andrógenos y estímulo a la hormona antimülleriana (AMH): factor negativo o inhibidor para el crecimiento folicular (18).
Entonces, se da creciente importancia a la presencia del SM en los mecanismos de enfermedad pero continúa su inexplicable ausencia en las definiciones y nomenclatura, cuando todo no se limita al desarrollo folicular per se, sino que se dispersa a alteraciones moleculares que llevan en estos al ambiente androgénico y a serios efectos negativos en otros importantes sistemas. Pero una definición y un nombre de enfermedad son tanto mejores cuando evitan malentendidos y, por el contrario, llevan en sí datos necesarios para entender algo de pronóstico y orientar la terapia; seleccionar, en vez de dejar fuera, las pacientes que se beneficiarían del tratamiento adecuado; separarlas de aquellas sobre las cuales más bien pende la posibilidad de sobre diagnóstico, con una innecesaria futura medicalización de la vida. La clave es considerar el SOP como parte del SM; y tener en cuenta el rol de este en patología cardiovascular, diabetes tipo II, hígado graso no alcohólico y más. Es totalmente racional la propuesta de incorporarlo a la definición y separar los pacientes con OP más SM de aquellas con OP por cualquier otro mecanismo. A las primeras se les indicarían medidas preventivas, cambios en su estilo de vida, fármacos, o el necesario tratamiento de su condición actual. Para clasificarlas, en vez de SOP pudiera hablarse de ovarios con SM (OSM), de síndrome ovárico-metabólico (SOM) o síndrome metabólico-reproductivo (SMR), idea esta última cuya originalidad se atribuye a la Dra. Sheila Laredo, de la Universidad de Toronto (19,20), que se ofrece en la literatura médica como un buen paso adelante contra el lío de la onomástica. Pero sobre todo, facilitaría a los médicos de familia y a muchos ginecólogos a entender cuáles pacientes puede tratar él y cuáles debería remitir a alguien con más conocimiento en el tema. Las pacientes del segundo grupo, quedarían como OP de causa a investigar.
REFERENCIAS
1. Stein IF, Leventhal ML. Amenorrhoea associated with bilateral polycystic ovaries. Am J Obstet Gynecol. 1935;29:181-191. [ Links ]
2. Young RH. Quarterly Bulletin N.U.M.S. En: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3803354/pdf/QBullNorthwestUnivMedSch [ Links ]
3. Dastur A, Tank P., Stein Irving, Leventhal Michael. and a slice of endocrine history. J Obstet Gynaecol. India. 2010;60:121-122. [ Links ]
4. Citado en Zisser HC. Polycystic Ovary Syndrome and Pregnancy: Is Metformin the Magic Bullet? Diabetes Spectrum. 2007;20:85-89. [ Links ]
5. Achard C, Theirs J. Le Virilisme pilaire et son association a linsuffisance glycolytique (diabete des femme a barbe). Bull. Acad de Méd. Paris. 1927;86:51. [ Links ]
6. Brown WH. A case of pluriglandular síndrome: Diabetes of bearded women. Lancet. 1928;2:1022. [ Links ]
7. Grennblatt RB, Domínguez CJ, Mahesh V. Achard Thiers syndrome. En: Greenblatt R, editor. The Hirsute Female. Springfield, Illinois: Charles Thomas Pub. 1963.p.251-268. [ Links ]
8. Diccionario de la Real Academia Española. RAE. 3a. edic. Madrid. 2014. [ Links ]
9. Lobo RA. Adisorder without identity: HCA, PCO, PCOD, PCOS, SLS. What are we to call it? Fertil Steril. 1995;63:1158-1160. [ Links ]
10. Hacıhanefioglu B. Polycystic ovary syndrome nomenclature: chaos? Fertil Steril. 2000;73:1261- 1262. [ Links ]
11. Dunaif A. Insulin resistance and the polycystic ovary syndrome: Mechanism and implications for pathogenesis. Endocr Rev. 1997;18:774-800. [ Links ]
12. Rotterdam ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome. Fertil Steril. 2004;81:19-25. [ Links ]
13. Legro R. Diagnosis and treatment of polycystic ovary syndrome (PCOS): An interview with Richard Legro. BMC Medicine. 2015;13:64. [ Links ]
14. Homburg R. ¿What is polycystic ovarian syndrome? A proposal for a consensus on the definition and diagnosis of polycystic ovarian syndrome. Human Reprod. 2002;17:2495-2499. [ Links ]
15. Johnson T, Kaplan LK, Duyang P, Rizza R. National Institutes of Health Evidence-based Methodology Workshop on Polycystic Ovary Syndrome. December 3-5, 2012. [ Links ]
16. Daniel A, Dumesic DA, Sharon E, Oberfield SE, Stener-Victorin, Marshal J. Scientific Statement on the Diagnostic Criteria, Epidemiology, Pathophysiology, and Molecular Genetics of Polycystic Ovary Syndrome. Endocrine Rev. 2015;36:487-525. [ Links ]
17. Goodman NF, Cobin RH, Futterweit W, Glueck JS, Legro RS, Carmina E. American Association of Clinical Endocrinologists, American College of Endocrinology, and Androgen Excess and PCOS Society Disease State Clinical Review: Guide to the best practices in the evaluation and treatment of Polycystic Ovary Syndrome – Part 1. Endocr Pract 2015;21:1291-1300. [ Links ]
18. Goodman NF, Cobin RH, Futterweit W, Glueck JS, Legro RS, Carmina E. American Association of Clinical Endocrinologists, American College of Endocrinology, And Androgen Excess and PCOS Society Disease State Clinical Review: Guide to the best practices in the evaluation and treatment of Polycystic Ovary Syndrome – Part 2. Endocr Pract 2015;21:1415-1426. [ Links ]
19. Dunaif A, Fauser BC. Renaming PCOS: A two state solution. J Clin Endocrinol Metab. 2013;98:4325- 4328. [ Links ]
20. Idiculla J. Comment on trends in onomastics - the case of PCOS. Carta al editor. Indian J Endocrinol Metab. 2015;18:245. [ Links ]^rND^sStein^nIF^rND^sLeventhal^nML^rND^sDastur^nA^rND^sTank^nP.^rND^sStein^nIrving^rND^sLeventhal^nMichael^rND^sZisser^nHC^rND^sAchard^nC^rND^sTheirs^nJ^rND^sBrown^nWH^rND^sGrennblatt^nRB^rND^sDomínguez^nCJ^rND^sMahesh^nV^rND^sLobo^nRA^rND^sHachaneoglu^nB^rND^sDunaif^nA^rND^sLegro^nR^rND^sHomburg^nR^rND^sDaniel^nA^rND^sDumesic^nDA^rND^sSharon^nE^rND^sOberfield^nSE^rND^sStener-Victorin^rND^sMarshal^nJ^rND^sGoodman^nNF^rND^sCobin^nRH^rND^sFutterweit^nW^rND^sGlueck^nJS^rND^sLegro^nRS^rND^sCarmina^nE^rND^sGoodman^nNF^rND^sCobin^nRH^rND^sFutterweit^nW^rND^sGlueck^nJS^rND^sLegro^nRS^rND^sCarmina^nE^rND^sDunaif^nA^rND^sFauser^nBC^rND^sIdiculla^nJ^rND^1A01^nFreddy^sFebres Balestrini^rND^1A01^nFreddy^sFebres Balestrini^rND^1A01^nFreddy^sFebres Balestrini
Etiología del síndrome de ovario poliquístico
Dr. Freddy Febres Balestrini
Médico Internista – Endocrinólogo. Biólogo de la Reproducción. Profesor de la Maestría de Reproducción del IVIC
El síndrome de ovario poliquístico (SOP) es causado por un exceso de andrógenos ováricos. La etiología no está clara, sin embargo, el defecto fundamental se debe a un desorden intrínseco en la regulación intraovárica de la esterodogénesis en respuesta a la hormona LH. Con frecuencia se asocia además un defecto en la regulación esteroidogénica de las glándulas suprarrenales en respuesta a la ACTH. Adicionalmente está asociada la resistencia a la insulina, principalmente a nivel muscular, mientras los ovarios, la glándula suprarrenal y el tejido adiposo, permanecen relativamente sensibles a la acción de la insulina, promoviendo la producción de andrógenos y obesidad.
El SOP es un trastorno multifactorial que surge de la interacción entre factores genéticos, epigenéticos, intrauterinos y ambientales después del nacimiento (1-5). Niños con restricción del crecimiento intrauterino (RCIU) y hermanos e hijos de madres con SOP, son blancos posnatales para desarrollar una esterodogénesis exagerada, caracterizada por una producción excesiva de andrógenos intraováricos y suprarrenales. La exposición a un exceso de glucocorticoides y andrógenos en el embarazo durante la organogénesis fetal puede inducir cambios de tipo epigenéticos con modificación de la expresión de genes, que estarían relacionados con alteraciones reproductivas y metabólicas tipo SOP en la vida posnatal.
La ganancia de peso rápida en los primeros años de la niñez y la vida sedentaria de estas niñas de alto riesgo, se acompaña de disfunción adipocitaria, resistencia a la insulina, obesidad abdominal, y con cierta frecuencia adrenarquia y pubarquia precoz.
Después de la cuarta década de la vida, las mujeres con SOP tienen riesgo aumentado para diabetes, dislipidemia, hipertensión arterial, enfermedad cardiovascular y cáncer de endometrio. Sin embargo, el SOP también aparece en mujeres que nacieron con peso normal o de madres sin SOP, lo cual sugiere que las variaciones genéticas y los factores ambientales tienen un papel preponderante en la expresión y mantenimiento del cuadro clínico.
Los estudios de asociación genómica amplia (6-9) han mostrado una alta frecuencia de polimorfismos genéticos (LHCGR, THADA, DENND1A) en mujeres con SOP. Los estudios genéticos han encontrado cambios estructurales en los cromosomas, basados en la longitud del telómero, con resultados controversiales.
Posiblemente el SOP tiene su origen en la vida intrauterina donde se programarían el exceso de producción de esteroides ováricos y suprarrenales, y factores de interacción genético-ambientales determinantes, para luego bajo condiciones posnatales de agresividad ambiental, expresarse con intensidad variable dependiendo de la magnitud de la interacción genético ambiental. El aumento de LH encontrado en el SOP parece que también es programado en la vida prenatal (10).
El SOP se caracteriza por un exceso de andrógenos intra ováricos que estimulan el crecimiento de pequeños folículos (11,12); al arresto de este exceso de folículos en los ovarios se le dió el nombre de síndrome de ovario poliquístico (13-15).
Estudios realizados en gemelos sugieren que la influencia genética explica el 70 % de la patogénesis (16-19), rasgos heredados han sido identificados en el SOP. Estudios sugieren que los ovarios poliquísticos son heredados en forma autosómica dominante (20). La mayoría tiene madres con ovarios poliquísticos asintomáticas o padres con síndrome metabólico (21). Madres y hermanas de mujeres con SOP, han mostrado hiperandrogenismo, anovulación y oligomenorrea. Cerca de la mitad de mujeres asintomáticas con ovarios poliquísticos (OP) no tiene evidencia bioquímica del cuadro y representan variables normales (22). Por otra parte, una minoría de mujeres asintomáticas con ovarios poliquísticos tiene evidencia de disfunción androgénica (23,24).
En mujeres jóvenes con amenorrea hipotalámica funcional la presencia de OP con niveles elevados de hormona antimülleriana (HAM) indica hiperandrogenismo y SOP asintomático, que emergerá al asociarse la ganancia de peso (25,26).
Se ha observado que cerca de la mitad de las hermanas de los casos de OP, tienen testosterona elevada (27), sin embargo, solo la mitad tiene irregularidades menstruales, sugiriendo la necesidad de factores precipitantes para que se exprese el cuadro clínico completo del SOP.
Las hijas de mujeres chilenas con SOP, tienen niveles de HAM elevados en la niñez e infancia y respuesta elevada de insulina (28,29). En todos los estadios puberales en niñas americanas hay niveles altos de DHEA-S, 17 Hidroxiprogesterona (17OHP) y testosterona basal (30).
Se ha encontrado un aumento de síndrome metabólico en los padres de niñas con SOP (88), el 84 % de padres y el 66 % de madres tenían sobrepeso u obesidad y la mitad diabetes (31).
Se han hecho múltiples intentos para identificar los genes responsables del SOP. Los estudios reportan una amplia variedad de polimorfismos en genes que codifican enzimas esteroidogénicas, globulinas ligadoras de hormonas, receptores de andrógenos y gonadotropinas. También se han encontrado polimorfismos en locus genéticos asociados con sensibilidad a la insulina y susceptibilidad a la obesidad y mutaciones heterocigotas en genes que causan hiperplasia adrenal congénita (32-43). Se ha reportado desregulación de genes envueltos en crecimiento celular como proto-oncogenes del endometrio (44) y acortadores de telómeros en estudios de leucocitos (45). La gran variedad de vías involucradas responden a la naturaleza multifactorial y a la heterogeneidad del SOP. Se ha encontrado en el citoplasma y núcleo de las células de la teca, sobreexpresión que aumenta la producción de andrógenos vía citocromo P450c17. Parece que diferentes vías relacionadas con los factores de transcripción y otros procesos celulares intrínsecos son responsables de las diferentes manifestaciones del SOP.
Es evidente que las agresiones durante el desarrollo intrauterino producen cambios persistentes en el genoma vía epigenética, que conducen a alteraciones de la expresión de genes en la vida adulta (46).
Varios cambios intrauterinos se han estudiado como factores de riesgo para la expresión del SOP, como la virilización congénita. El SOP es común en mujeres con virilización congénita donde la hiperplasia adrenal congénita (HAC) es frecuente, pero no la única (47). La androgenización congénita que lleva al SOP, ha sido establecida en animales de experimentación. Estudios en monos Rhesus expuestos a andrógenos en la gestación temprana desarrollan trastornos hormonales y metabólicos, tales como: hiperandrogenismo ovárico y suprarrenal, oligomenorrea, ovarios multifoliculares, LH elevada, resistencia a la insulina, inhibición de la retroalimentación a la liberación de LH por la progesterona, obesidad abdominal, intolerancia a la glucosa y dislipidemia. Estos cambios evidencian la potencial programación epigenética in utero del desarrollo posnatal (48).
Las alteraciones nutricionales in útero tienen una importante influencia. Hay evidencias que la resistencia a la insulina del adulto es programada en la vida intrauterina, el bajo peso al nacer es un marcador para esta programación metabólica. Se ha demostrado que niñas con pubarquia prematura están asociadas a disminución del crecimiento intrauterino y resistencia a la insulina (49). Además, el SOP se ha relacionado con bajo peso al nacer (50-52) y macrosomia fetal (53,54). Estudios realizados en Europa del Norte no han encontrado relación entre peso al nacer y SOP (55). En la Figura 1, podemos apreciar en resumen, las alteraciones producidas por el exceso de andrógenos fetales (56).
La resistencia a la insulina está íntimamente relacionada al SOP. La hiperinsulinemia compensadora se asocia a anovulación, se ha encontrado que las pacientes ovulatorias con SOP son menos resistentes a la insulina que las anovulatorias (57). No hay ninguna duda de que cualquier tratamiento que reduzca la resistencia a la insulina mejorará la disfunción ovárica en el SOP (57-61). Generalmente la obesidad es la causa más común de resistencia a la insulina (62), lo que puede explicar el aumento constante del SOP en adolescentes con sobrepeso u obesidad. También es bien conocido el efecto beneficioso de la reducción de peso en la restauración de la ciclicidad menstrual y ovulación en mujeres con SOP (63-68).
Otro dato importante es que niñas con adrenarquia prematura presentarán SOP,entre el 15 % a 20 % (1,5). El uso de ácido valproico como antiepiléptico en niñas aumenta la transcripción del citocromo P450c17 y otras enzimas esteroidogénicas facilitando Hiperandrogenismo y SOP (69,70).
REFERENCIAS
1. Rosenfield RL. Ovarian and adrenal function in polycystic ovary syndrome. Endocrinol Metab Clin North Am. 1999;28:265-293. [ Links ]
2. Carmina E, Rosato F, Janni A, Rizzo M, Longo A. Extensive clinical experience: relative prevalence of different androgen excess disorders in 950 women referred because of clinical hyperandrogenism. J Clin Endocrinol Metab. 2006;91:2-6. [ Links ]
3. Goodarzi MO, Dumesic DA, Chazenbalk G, Azziz R. Polycystic ovary syndrome: Etiology, pathogenesis and diagnosis. Nat Rev Endocrinol. 2011;7:219-231. [ Links ]
4. Lawson MA, Jain S, Sun S, Patel K, Malcom PJ, Chang RJ. Evidence for insulin suppression of baseline luteinizing hormone in women with polycystic ovarian syndrome and normal women. J Clin Endocrinol Metab. 2008;93:2089-2096. [ Links ]
5. Rosenfield RL. Clinical review: Identifying children at risk for polycystic ovary syndrome. J Clin Endocrinol Metab. 2007;92:787-796. [ Links ]
6. Vink JM, Sadrzadeh S, Lambalk CB, Boomsma DI. Heritability of polycystic ovary syndrome in a Dutch twin-family study. J Clin Endocrinol Metab. 2006;91:2100-2104. [ Links ]
7. Carey AH, Chan KL, Short F, White D, Williamson R, Frank S. Evidence for a single gene effect causing polycystic ovaries and male pattern baldness. Clin Endocrinol (Oxf). 1993;38:653-658. [ Links ]
8. Govind A, Obhrai MS, Clayton RN. Polycystic ovaries are inherited as an autosomal dominant trait: Analysis of 29 polycystic ovary syndrome and 10 control families. J Clin Endocrinol Metab. 1999;84:38-43. [ Links ]
9. Welt CK, Styrkarsdottir U, Ehrmann DA, Thorleifsson G, Arason G, Gudmundsson JA, et al. Variants in DENND1A are associated with polycystic ovary syndrome in women of European ancestry. J Clin Endocrinol Metab. 2012;97:E1342-7. [ Links ]
10. Taylor AE, McCourt B, Martin KA, Anderson EJ, Adams JM, Schoenfeld D, Hall JE. Determinants of abnormal gonadotropin secretion in clinically defined women with polycystic ovary syndrome. J Clin Endocrinol Metab. 1997;82:2248-2256. [ Links ]
11. Barnes RB, Namnoum AB, Rosenfield RL, Layman LC. The role of LH and FSH in ovarian androgen secretion and ovarian follicular development: Clinical studies in a patient with isolated FSH deficiency and multicystic ovaries. Hum Reprod. 2002;17:88-91. [ Links ]
12. Gilling-Smith C, Willis DS, Beard RW, Franks S. Hypersecretion of androstenedione by isolated thecal cells from polycystic ovaries. J Clin Endocrinol Metab. 1994;79:1158-1165. [ Links ]
13. Willis DS, Watson H, Mason HD, Galea R, Brincat M, Franks S. Premature response to luteinizing hormone of granulosa cells from anovulatory women with polycystic ovary syndrome: Relevance to mechanism of anovulation. J Clin Endocrinol Metab. 1998;83:3984-3991. [ Links ]
14. Weil S, Vendola K, Zhou J, Bondy CA. Androgen and follicle-stimulating hormone interactions in primate ovarian follicle development. J Clin Endocrinol Metab. 1999;84:2951-2956. [ Links ]
15. Webber LJ, Stubbs SA, Stark J, Margara RA, Trew GH, Lavery SA, et al. Prolonged survival in culture of preantral follicles from polycystic ovaries. J Clin Endocrinol Metab 2007;92:1975-1978. [ Links ]
16. Goodarzi MO, Dumesic DA, Chazenbalk G, Azziz R. Polycystic ovary syndrome: Etiology, pathogenesis and diagnosis. Nat Rev Endocrinol. 2011;7:219-231. [ Links ]
17. Ehrmann DA. Polycystic ovary syndrome. N Engl J Med. 2005;352:1223-1236. [ Links ]
18. Vink JM, Sadrzadeh S, Lambalk CB, Boomsma DI. Heritability of polycystic ovary syndrome in a Dutch twin-family study. J Clin Endocrinol Metab 2006;91:21004. [ Links ]
19. Carey AH, Chan KL, Shoort F, White D, Williamson R, Franks S. Evidence for a single gene effect causing polycystic ovaries and male pattern baldness. Clin Endocrinol (Oxf). 1993;38:653-658. [ Links ]
20. Govind A, Obhrai MS, Clayton RN. Polycystic ovaries are inherited as an autosomal dominant trait: Analysis of 29 polycystic ovary syndrome and 10 control families. J Clin Endocrinol Metab. 1999;84:38-43. [ Links ]
21. Leibel NI, Baumann EE, Kocherginsky M, Rosenfield RL. Relationship of adolescent polycystic ovary syndrome to parental metabolic syndrome. J Clin Endocrinol Metab. 2006;91:1275-1283. [ Links ]
22. Franks S, Webber LJ, Goh M, Valentine A, White DM, Conway GS, et al. Ovarian morphology is a marker of heritable biochemical traits in sisters with polycystic ovaries. J Clin Endocrinol Metab. 2008;93:3396- 3302. [ Links ]
23. Mortensen M, Rosenfield RL, Littlejohn E. Functional significance of polycystic-size ovaries in healthy adolescents. J Clin Endocrinol Metab. 2006;91:3786- 3790. [ Links ]
24. Wang JG, Lobo RA. The complex relationship between hypothalamic amenorrhea and polycystic ovary syndrome. J Clin Endocrinol Metab. 2008;93:1394- 1397. [ Links ]
25. Carlsson IB, Scott JE, Visser JA, Ritvos O, Themmen AP, Hovatta O. Anti-Müllerian hormone inhibits initiation of growth of human primordial ovarian follicles in vitro. Hum Reprod. 2006;21:2223-2227. [ Links ]
26. Eldar-Geva T, Margalioth EJ, Gal M, Ben-Chetrit A. Serum anti-Mullerian hormone levels during controlled ovarian hyperstimulation in women with polycystic ovaries with and without hyperandrogenism. Hum Reprod. 2005;20:1814-1819. [ Links ]
27. Franks S, Webber LJ, Goh M, Valentine A, White DM, Conway GS, et al. Ovarian morphology is a marker of heritable biochemical traits in sisters with polycystic ovaries. J Clin Endocrinol Metab. 2008;93:3396- 3402. [ Links ]
28. Sir-Petermann T, Codner E, Maliqueo M, Echiburú B, Hitschfeld C, Crisosto N, et al. Increased anti-Müllerian hormone serum concentrations in prepubertal daughters of women with polycystic ovary syndrome. J Clin Endocrinol Metab. 2006;91:3105- 3109. [ Links ]
29. Vanky E, Carlsen SM. Androgens and antimüllerian hormone in mothers with polycystic ovary syndrome and their newborns. Fertil Steril. 2012;97:509-515. [ Links ]
30. Kent SC, Gnatuk CL, Kunselman AR, Demer LM, Lee PA, Legro RS. Hyperandrogenism and hyperinsulinism in children of women with polycystic ovary syndrome: A controlled study. J Clin Endocrinol Metab. 2008;93:1662-1669. [ Links ]
31. Coviello AD, Sam S, Legro RS, Dunaif A. High prevalence of metabolic syndrome in first-degree male relatives of women with polycystic ovary syndrome is related to high rates of obesity. J Clin Endocrinol Metab. 2009;94:4361-4366. [ Links ]
32. Ehrmann DA. Polycystic ovary syndrome. N Engl J Med. 2005;352:1223-1236. [ Links ]
33. Kosova G, Urbanek M. Genetics of the polycystic ovary syndrome. Mol Cell Endocrinol. 2013;373:29- 38. [ Links ]
34. Urbanek M, Sam S, Legro RS, Dunaif A. Identification of a polycystic ovary syndrome susceptibility variant in fibrillin-3 and association with a metabolic phenotype. J Clin Endocrinol Metab. 2007;92:4191-4198. [ Links ]
35. Escobar-Morreale HF, Luque-Ramírez M, San Millán JL. The molecular-genetic basis of functional hyperandrogenism and the polycystic ovary syndrome. Endocr Rev. 2005;26:25182. [ Links ]
36. Witchel SF, Lee PA, Suda-Hartman M, Hoffman EP. Hyperandrogenism and manifesting heterozygotes for 21-hydroxylase deficiency. Biochem Mol Med. 1997;62:151-158. [ Links ]
37. Li M, Youngren JF, Dunaif A, Goldfine ID, Maddux BA, Zhang BB, et al. Decreased insulin receptor (IR) autophosphorylation in fibroblasts from patients with PCOS: Effects of serine kinase inhibitors and IR activators. J Clin Endocrinol Metab. 2002;87:4088- 4093. [ Links ]
38. Serafini PC, Catalino J, Lobo RA. The effect of spironolactone on genital skin 5 alpha-reductase activity. J Steroid Biochem. 1985;23:191-194. [ Links ]
39. Jones MR, Chazenbalk G, Xu N, Chua AK, Eigler T, Mengesha E, et al. Steroidogenic regulatory factor FOS is underexpressed in polycystic ovary syndrome (PCOS) adipose tissue and genetically associated with PCOS susceptibility. J Clin Endocrinol Metab. 2012;97(9):E1750-7. [ Links ]
40. Boqun X, Xiaonan D, Yugui C, Lingling G, Xue D, Gao C, et al. Expression of SET Protein in the Ovaries of Patients with Polycystic Ovary Syndrome. Int J Endocrinol. 2013;2013:367956. [ Links ]
41. Zhang T, Liang W, Fang M, Lingling G, Xue D, Gao C, et al. Association of the CAG repeat polymorphisms in androgen receptor gene with polycystic ovary syndrome: A systemic review and meta-analysis. Gene. 2013;524:161-167. [ Links ]
42. Ewens KG, Stewart DR, Ankener W, Urbanek M, McAllister JM, Chen C, et al. Family-based analysis of candidate genes for polycystic ovary syndrome. J Clin Endocrinol Metab. 2010;95:2306-2315. [ Links ]
43. Louwers YV, Stolk L, Uitterlinden AG, Laven JS. Cross-ethnic meta-analysis of genetic variants for polycystic ovary syndrome. J Clin Endocrinol Metab. 2013;98:E2006-12. [ Links ]
44. Piltonen TT, Chen J, Erikson DW, Spitzer TL, Barragan F, Rabban JT, et al. Mesenchymal stem/progenitors and other endometrial cell types from women with polycystic ovary syndrome (PCOS) display inflammatory and oncogenic potential. J Clin Endocrinol Metab. 2013;98:3765-3775. [ Links ]
45. Li Q, Du J, Feng R, Xu Y, Wang H, Sang Q, et al. A possible new mechanism in the pathophysiology of polycystic ovary syndrome (PCOS): The discovery that leukocyte telomere length is strongly associated with PCOS. J Clin Endocrinol Metab. 2014;99:E234- 40. [ Links ]
46. Amanabhan V, Veiga-Lopez A. Developmental origin of reproductive and metabolic dysfunctions: Androgenic versus estrogenic reprogramming. Semin Reprod Med. 2011;29:173-186. [ Links ]
47. Maliqueo M, Sir-Petermann T, Pérez V, Echiburu B, de Guevara AL, Galvez C, et al. Adrenal function during childhood and puberty in daughters of women with polycystic ovary syndrome. J Clin Endocrinol Metab. 2009;94:3282-3288. [ Links ]
48. Nicol LE, O'Brien TD, Dumesic DA, Grogan T, Tarantal AF, Abbott DH. Abnormal infant islet morphology precedes insulin resistance in PCOS-like monkeys. PLoS One 2014;9:e106527. [ Links ]
49. Abbott DH, Bacha F. Ontogeny of polycystic ovary syndrome and insulin resistance in utero and early childhood. Fertil Steril. 2013;100:2-11. [ Links ]
50. Ibáñez L, Potau N, Francois I, de Zegher F. Precocious pubarche, hyperinsulinism, and ovarian hyperandrogenism in girls: relation to reduced fetal growth. J Clin Endocrinol Metab 1998; 83:3558-62. [ Links ]
51. Pandolfi C, Zugaro A, Lattanzio F, Necozione S, Barbonetti A, Colangeli MS, et al. Low birth weight and later development of insulin resistance and biochemical/clinical features of polycystic ovary syndrome. Metabolism. 2008;57:999-1004. [ Links ]
52. Cresswell JL, Barker DJ, Osmond C, Egger P, Phillips DI, Fraser RB. Fetal growth, length of gestation, and polycystic ovaries in adult life. Lancet. 1997;350:1131-1135. [ Links ]
53. Michelmore K, Ong K, Mason S, Bennett S, Perry L, Vessey M, et al. Clinical features in women with polycystic ovaries: Relationships to insulin sensitivity, insulin gene VNTR and birth weight. Clin Endocrinol (Oxf). 2001;55:439-446. [ Links ]
54. Sadrzadeh S, Klip WA, Broekmans FJ, Schats R, Willemsen WN, Burger CW, et al. Birth weight and age at menarche in patients with polycystic ovary syndrome or diminished ovarian reserve, in a retrospective cohort. Hum Reprod. 2003;18:2225- 2230. [ Links ]
55. Laitinen J, Taponen S, Martikainen H, Pouta A, Millwood I, Hartikainen AL, et al. Body size from birth to adulthood as a predictor of self-reported polycystic ovary syndrome symptoms. Int J Obes Relat Metab Disord. 2003;27(6):710-715. [ Links ]
56. Gur EB, Karadeniz M, Turan GA. Fetal programming of polycystic ovary syndrome. World J Diabetes. 2015;6:936-942. [ Links ]
57. Legro RS, Roller RL, Dodson WC, Stetter CM, Kunselman AR, Dunaif A et al. Associations of birthweight and gestational age with reproductive and metabolic phenotypes in women with polycystic ovarian syndrome and their first-degree relatives. J Clin Endocrinol Metab. 2010;95:789-799. [ Links ]
58. Franks S. Controversy in clinical endocrinology: diagnosis of polycystic ovarian syndrome: In defense of the Rotterdam criteria. J Clin Endocrinol Metab. 2006;91:786-789. [ Links ]
59. Buggs C, Rosenfield RL. Polycystic ovary syndrome in adolescence. Endocrinol Metab Clin North Am. 2005;34:677-705. [ Links ]
60. Nestler JE, Jakubowicz DJ, Evans WS, Pasquali R. Effects of metformin on spontaneous and clomipheneinduced ovulation in the polycystic ovary syndrome. N Engl J Med. 1998;338:1876-1880. [ Links ]
61. Lord JM, Flight IH, Norman RJ. Insulin-sensitising drugs (metformin, troglitazone, rosiglitazone, pioglitazone, D-chiro-inositol) for polycystic ovary syndrome. Cochrane Database Syst Rev. 2003;CD003053. [ Links ]
62. Ehrmann DA, Schneider DJ, Sobel BE, Cavaghan MK, Imperial J, Rosenfield RL, et al. Troglitazone improves defects in insulin action, insulin secretion, ovarian steroidogenesis, and fibrinolysis in women with polycystic ovary syndrome. J Clin Endocrinol Metab. 1997;82:2108-2116. [ Links ]
63. James WP. WHO recognition of the global obesity epidemic. Int J Obes (Lond). 2008;32(Suppl 7):S120. [ Links ]
64. Kiddy DS, Hamilton-Fairley D, Bush A, Short F, Anyaoku V, Reed MJ, et al. Improvement in endocrine and ovarian function during dietary treatment of obese women with polycystic ovary syndrome. Clin Endocrinol (Oxf). 1992;36:105-111. [ Links ]
65. Huber-Buchholz MM, Carey DG, Norman RJ. Restoration of reproductive potential by lifestyle modification in obese polycystic ovary syndrome: Role of insulin sensitivity and luteinizing hormone. J Clin Endocrinol Metab. 1999;84:1470-1474. [ Links ]
66. Escobar-Morreale HF, Botella-Carretero JI, Alvarez-Blasco F, Sancho J, San Millán JL. The polycystic ovary syndrome associated with morbid obesity may resolve after weight loss induced by bariatric surgery. J Clin Endocrinol Metab. 2005;90:6364-6369. [ Links ]
67. Rosenfield RL. Clinical review: Adolescent anovulation: maturational mechanisms and implications. J Clin Endocrinol Metab. 2013;98:3572- 3583. [ Links ]
68. Bloch CA, Clemons P, Sperling MA. Puberty decreases insulin sensitivity. J Pediatr. 1987;110:481-487. [ Links ]
69. Nelson-DeGrave VL, Wickenheisser JK, Cockrell JE, Wood JR, Legro RS, Strauss JF, et al. Valproate potentiates androgen biosynthesis in human ovarian theca cells. Endocrinology. 2004;145:799-808. [ Links ]
70. Herzog AG. Menstrual disorders in women with epilepsy. Neurology. 2006;66:S23-26. [ Links ]^rND^sRosenfield^nRL^rND^sCarmina^nE^rND^sRosato^nF^rND^sJanni^nA^rND^sRizzo^nM^rND^sLongo^nA^rND^sGoodarzi^nMO^rND^sDumesic^nDA^rND^sChazenbalk^nG^rND^sAzziz^nR^rND^sLawson^nMA^rND^sJain^nS^rND^sSun^nS^rND^sPatel^nK^rND^sMalcom^nPJ^rND^sChang^nRJ^rND^sRosenfield^nRL^rND^sVink^nJM^rND^sSadrzadeh^nS^rND^sLambalk^nCB^rND^sBoomsma^nDI^rND^sCarey^nAH^rND^sChan^nKL^rND^sShort^nF^rND^sWhite^nD^rND^sWilliamson^nR^rND^sFrank^nS^rND^sGovind^nA^rND^sObhrai^nMS^rND^sClayton^nRN^rND^sWelt^nCK^rND^sStyrkarsdottir^nU^rND^sEhrmann^nDA^rND^sThorleifsson^nG^rND^sArason^nG^rND^sGudmundsson^nJA^rND^sTaylor^nAE^rND^sMcCourt^nB^rND^sMartin^nKA^rND^sAnderson^nEJ^rND^sAdams^nJM^rND^sSchoenfeld^nD^rND^sHall^nJE^rND^sBarnes^nRB^rND^sNamnoum^nAB^rND^sRosenfield^nRL^rND^sLayman^nLC^rND^sGilling-Smith^nC^rND^sWillis^nDS^rND^sBeard^nRW^rND^sFranks^nS^rND^sWillis^nDS^rND^sWatson^nH^rND^sMason^nHD^rND^sGalea^nR^rND^sBrincat^nM^rND^sFranks^nS^rND^sWeil^nS^rND^sVendola^nK^rND^sZhou^nJ^rND^sBondy^nCA^rND^sWebber^nLJ^rND^sStubbs^nSA^rND^sStark^nJ^rND^sMargara^nRA^rND^sTrew^nGH^rND^sLavery^nSA^rND^sGoodarzi^nMO^rND^sDumesic^nDA^rND^sChazenbalk^nG^rND^sAzziz^nR^rND^sEhrmann^nDA^rND^sVink^nJM^rND^sSadrzadeh^nS^rND^sLambalk^nCB^rND^sBoomsma^nDI^rND^sCarey^nAH^rND^sChan^nKL^rND^sShoort^nF^rND^sWhite^nD^rND^sWilliamson^nR^rND^sFranks^nS^rND^sGovind^nA^rND^sObhrai^nMS^rND^sClayton^nRN^rND^sLeibel^nNI^rND^sBaumann^nEE^rND^sKocherginsky^nM^rND^sRosenfield^nRL^rND^sFranks^nS^rND^sWebber^nLJ^rND^sGoh^nM^rND^sValentine^nA^rND^sWhite^nDM^rND^sConway^nGS^rND^sMortensen^nM^rND^sRosenfield^nRL^rND^sLittlejohn^nE^rND^sWang^nJG^rND^sLobo^nRA^rND^sCarlsson^nIB^rND^sScott^nJE^rND^sVisser^nJA^rND^sRitvos^nO^rND^sThemmen^nAP^rND^sHovatta^nO^rND^sEldar-Geva^nT^rND^sMargalioth^nEJ^rND^sGal^nM^rND^sBen-Chetrit^nA^rND^sFranks^nS^rND^sWebber^nLJ^rND^sGoh^nM^rND^sValentine^nA^rND^sWhite^nDM^rND^sConway^nGS^rND^sSir-Petermann^nT^rND^sCodner^nE^rND^sMaliqueo^nM^rND^sEchiburú^nB^rND^sHitschfeld^nC^rND^sCrisosto^nN^rND^sVanky^nE^rND^sCarlsen^nSM^rND^sKent^nSC^rND^sGnatuk^nCL^rND^sKunselman^nAR^rND^sDemer^nLM^rND^sLee^nPA^rND^sLegro^nRS^rND^sCoviello^nAD^rND^sSam^nS^rND^sLegro^nRS^rND^sDunaif^nA^rND^sEhrmann^nDA^rND^sKosova^nG^rND^sUrbanek^nM^rND^sUrbanek^nM^rND^sSam^nS^rND^sLegro^nRS^rND^sDunaif^nA^rND^sEscobar-Morreale^nHF^rND^sLuque-Ramírez^nM^rND^sSan Millán^nJL^rND^sWitchel^nSF^rND^sLee^nPA^rND^sSuda-Hartman^nM^rND^sHoffman^nEP^rND^sLi^nM^rND^sYoungren^nJF^rND^sDunaif^nA^rND^sGoldfine^nID^rND^sMaddux^nBA^rND^sZhang^nBB^rND^sSerafini^nPC^rND^sCatalino^nJ^rND^sLobo^nRA^rND^sJones^nMR^rND^sChazenbalk^nG^rND^sXu^nN^rND^sChua^nAK^rND^sEigler^nT^rND^sMengesha^nE^rND^sBoqun^nX^rND^sXiaonan^nD^rND^sYugui^nC^rND^sLingling^nG^rND^sXue^nD^rND^sGao^nC^rND^sZhang^nT^rND^sLiang^nW^rND^sFang^nM^rND^sLingling^nG^rND^sXue^nD^rND^sGao^nC^rND^sEwens^nKG^rND^sStewart^nDR^rND^sAnkener^nW^rND^sUrbanek^nM^rND^sMcAllister^nJM^rND^sChen^nC^rND^sLouwers^nYV^rND^sStolk^nL^rND^sUitterlinden^nAG^rND^sLaven^nJS^rND^sPiltonen^nTT^rND^sChen^nJ^rND^sErikson^nDW^rND^sSpitzer^nTL^rND^sBarragan^nF^rND^sRabban^nJT^rND^sLi^nQ^rND^sDu^nJ^rND^sFeng^nR^rND^sXu^nY^rND^sWang^nH^rND^sSang^nQ^rND^sAmanabhan^nV^rND^sVeiga-Lopez^nA^rND^sMaliqueo^nM^rND^sSir-Petermann^nT^rND^sPérez^nV^rND^sEchiburu^nB^rND^sde Guevara^nAL^rND^sGalvez^nC^rND^sNicol^nLE^rND^sO'Brien^nTD^rND^sDumesic^nDA^rND^sGrogan^nT^rND^sTarantal^nAF^rND^sAbbott^nDH^rND^sAbbott^nDH^rND^sBacha^nF^rND^sIbáñez^nL^rND^sPotau^nN^rND^sFrancois^nI^rND^sde Zegher^nF^rND^sPandolfi^nC^rND^sZugaro^nA^rND^sLattanzio^nF^rND^sNecozione^nS^rND^sBarbonetti^nA^rND^sColangeli^nMS^rND^sCresswell^nJL^rND^sBarker^nDJ^rND^sOsmond^nC^rND^sEgger^nP^rND^sPhillips^nDI^rND^sFraser^nRB^rND^sMichelmore^nK^rND^sOng^nK^rND^sMason^nS^rND^sBennett^nS^rND^sPerry^nL^rND^sVessey^nM^rND^sSadrzadeh^nS^rND^sKlip^nWA^rND^sBroekmans^nFJ^rND^sSchats^nR^rND^sWillemsen^nWN^rND^sBurger^nCW^rND^sLaitinen^nJ^rND^sTaponen^nS^rND^sMartikainen^nH^rND^sPouta^nA^rND^sMillwood^nI^rND^sHartikainen^nAL^rND^sGur^nEB^rND^sKaradeniz^nM^rND^sTuran^nGA^rND^sLegro^nRS^rND^sRoller^nRL^rND^sDodson^nWC^rND^sStetter^nCM^rND^sKunselman^nAR^rND^sDunaif^nA^rND^sFranks^nS^rND^sBuggs^nC^rND^sRosenfield^nRL^rND^sNestler^nJE^rND^sJakubowicz^nDJ^rND^sEvans^nWS^rND^sPasquali^nR^rND^sLord^nJM^rND^sFlight^nIH^rND^sNorman^nRJ^rND^sEhrmann^nDA^rND^sSchneider^nDJ^rND^sSobel^nBE^rND^sCavaghan^nMK^rND^sImperial^nJ^rND^sRosenfield^nRL^rND^sJames^nWP^rND^sKiddy^nDS^rND^sHamilton-Fairley^nD^rND^sBush^nA^rND^sShort^nF^rND^sAnyaoku^nV^rND^sReed^nMJ^rND^sHuber-Buchholz^nMM^rND^sCarey^nDG^rND^sNorman^nRJ^rND^sEscobar-Morreale^nHF^rND^sBotella-Carretero^nJI^rND^sAlvarez-Blasco^nF^rND^sSancho^nJ^rND^sSan Millán^nJL^rND^sRosenfield^nRL^rND^sBloch^nCA^rND^sClemons^nP^rND^sSperling^nMA^rND^sNelson-DeGrave^nVL^rND^sWickenheisser^nJK^rND^sCockrell^nJE^rND^sWood^nJR^rND^sLegro^nRS^rND^sStrauss^nJF^rND^sHerzog^nAG^rND^1A01^nEvelyn^sHernández^rND^1A01^nEvelyn^sHernández^rND^1A01^nEvelyn^sHernández
Genética del síndrome de ovario poliquístico
Dra. Evelyn Hernández
Médico Endocrinóloga. Profesora del posgrado de Endocrinología HUC-UCV. Directora del Curso de Endocrinología Ginecológica HUC- UCV. Profesora de la Cátedra de Anatomía Patológica
La genética molecular del síndrome de ovario poliquístico (SOP), así como sus aspectos clínicos, ponen en evidencia que es una enfermedad compleja. Los primeros estudios en búsqueda de las bases genéticas de este síndrome eran consistentes en plantear un patrón de herencia autosómico dominante en familias con SOP, resultado de las observaciones de características fenotípicas en estas familias, donde el hiperandrogenismo clínico y bioquímico se describen como un fenómeno presente en varios miembros de familiares con SOP. Estos primeros estudios también aportaron datos que sugerían factores genéticos involucrados en la síntesis de andrógenos, disfunción metabólica y otros, responsables de la patogénesis (1).
Sin embargo, los estudios prospectivos han evidenciado que la participación de la transmisión parental es menos influyente en la etiología del SOP, y que el patrón de herencia es mucho más complejo (2-4). La búsqueda de las bases genéticas en el pasado y en el presente, son un reto con muchas dificultades, inherentes al descubrimiento de múltiples genes y a otros factores que incluyen: diferentes criterios diagnósticos, heterogeneidad clínica, grupo etario (adolescente, edad reproductiva y menopausia) y la ausencia de un fenotipo masculino lo cual limita el estudio genético basado en familias (5-8).
En la actualidad, los esfuerzos en aclarar las bases genéticas del SOP están centrados en el estudio de genes candidatos elegidos de vías lógicas en la patogénesis de esta enfermedad, tales como la síntesis de hormonas esteroideas gonadales o la señalización de la insulina. Considerando que varios resultados positivos han sido reportados, todavía no hay genes universalmente aceptados como factor clave o fundamental en la patogénesis del SOP, en gran parte debido a la falta de replicación de estos resultados positivos y factores inherentes a diseños metodológicos y las propias limitaciones con respecto al conocimiento incompleto de la fisiopatología del SOP (9,10).
Con base a todo lo expuesto, en este capítulo presentaremos un resumen de las evidencias extraídas de los estudios genéticos, basados en los lineamientos o instrucciones para Mejorar la Comunicación de Estudios Observacionales en Epidemiología Molecular (STROBE-ME) (11).
1. Estudios Citogenéticos
En este tipo de estudios no se han identificado mayores alteraciones cromosómicas (12). Algunas observaciones sugieren que la infertilidad asociada al SOP no es atribuible a aberraciones cromosómicas o inmadurez de ovocitos (13). Las tasas de aneuploidia de ovocitos en mujeres con SOP no difieren de los ovocitos de mujeres con infertilidad por factor tubárico (13).
Los estudios que reportan inestabilidad genética por alteraciones cromosómicas, han sido analizados principalmente en muestras de linfocitos de sangre periférica, demostrando menor índice mitótico, aumento de la frecuencia de micronúcleos como signo de inestabilidad (14). Sin embargo, estos estudios no han sido reproducidos y analizados en tejidos específicos como ovarios y cultivos de células de modelos con SOP.
2. Teoría de SOP como enfermedad poligénica
Esta teoría se fundamenta en los Estudios de Asociación del Genoma Ampliado (GWAS) de genes candidatos, que han sido los estudios principales en la búsqueda genética del SOP, los cuales han identificado variantes de riesgo:
a. Fibrilina-3 (FBN3):
Gen localizado en el cromosoma 19p13.2, muy cercano (1Mb) al gen del receptor de insulina, está asociado al fenotipo reproductivo y metabólico en SOP (15-17). Se encuentra especialmente asociado a resistencia a la insulina en mujeres con SOP y disfunción betapancreática en sus hermanos.
FBN3 codifica la proteína fibrillina, cuyo dominio de unión al factor de crecimiento transformante βeta (TGFβ), controla importantes funciones como la foliculogénesis (18-20) y el desarrollo de islotes pancreáticos (17,21). También este gen ha sido relacionado con la prevalencia de enfermedad tiroidea autoinmune (ETA) en pacientes con SOP, en vista de la participación de TGFβ en el control de la tolerancia inmunológica (22).
b. Genes involucrados en el metabolismo y señalización de la insulina:
El polimorfismo rs1801278G> en el gen del sustrato del receptor de insulina tipo 1 (IRS1), ha sido ampliamente estudiado en el SOP (23). El exón 17 del gen del receptor de insulina (INSR) y el polimorfismo de nuecleótido simple (SNP) C1085T se reconocen como posibles mecanismos responsables de defectos en la señalización de insulina (24).
La regulación de la secreción de la insulina por acetilcolina (ACh) es una vía biológica importantemente asociada a SOP (25). La variación en esta vía biológica puede ocasionar los trastornos en el metabolismo de la glucosa observados en fenotipo metabólico (26).
La regulación de la secreción de insulina (INS) por ácidos grasos libres (AGL), también ha sido mencionada en las bases genéticas del SOP (26).
Por otro lado, polimorfismos en el gen citocromo P450 17α (CYP17A1), tales como -34T/C juega un papel fundamental en el hiperandrogenismo y resistencia a la insulina en SOP por su asociación a la fosforilación de residuos de serina del receptor de insulina (INSR) (27).
c. Factor de transcripción 7 Tipo 2 (TCF7L2):
Es un gen localizado en el cromosoma 10q25.3 cuyo producto es un factor de transcripción muy importante en la regulación de varios genes que incluyen la vía de señalización de Wnt y diabetes mellitus tipo 2 (DM2) (28-30). El mecanismo por el cual este factor de transcripción afecta la susceptibilidad a DM2 no está dilucidado.
Uno de los genes que el factor de transcripción TCF7L2 activa, es el gen pro-glucagon el cual codifica a la hormona insulinotrópica péptido similar al glucagon-1 (GLP-1), fundamental para la regulación del metabolismo de la glucosa. Se plantea que variantes de este factor alteran indirectamente los niveles de GLP-1 aumentando la susceptibilidad para la DM2 (31,32).
d. Calpaína 10:
Es un gen localizado en 2q37.3, que se encarga de codificar una proteasa cisteina intracelular que desempeñaña un papel fisiológico en el metabolismo de la glucosa mediado por la insulina y la secreción de insulina en las células beta pancreáticas (33,34).
Otros investigadores lograron reproducir la contribución del SNP UCSNP-43 de Calpaina-10 en enfermedad cardiovascular (ECV) y metabólica en mujeres jóvenes con SOP asociándolo también a hiperandrogenismo, los resultados sugieren que este SNP puede ser un marcador genético útil para identificar ECV en este grupo (35).
e. Gen relacionado al tejido adiposo (FTO):
Este gen está localizado en el cromosoma 16q12.2, SNP rs9939609, especialmente el alelo A y otras variantes se han asociado a obesidad e inclusive DM2 en varios grupos étnicos (36-38).
Diversos estudios y meta análisis han planteado al gen FTO rs9939609 como factor genético importante en presencia de obesidad y síndrome metabólico en mujeres con SOP (39,40).
f. Gen de globulina transportadora de hormona sexual (SHBG):
El gen SHBG está localizado en el cromosoma 17p13-1p12, codifica un polipéptido de 373 aminoácidos que regula la biodisponibilidad de los esteroides sexuales en particular andrógenos (testosterona) y estrógeno (41). Los niveles de SHBG en mujeres con SOP se encuentran disminuidos, lo cual se ha atribuido a un efecto inhibidor de la hiperinsulinemia en la producción hepática (41). Además de factores metabólicos y nutricionales, los niveles circulantes de SHBG se determinan en parte por la variación genética (46). Los estudios sugieren que las variaciones genéticas de SHBG contribuyen tanto a la biodisponibiliad de andrógenos como a su impacto en el ámbito metabólico, teniendo relación con insulinoresistencia y DM2 (41).
Los genotipos rs727429 se relaciona a niveles bajos de SHBG, mientras que rs1799941 se sugiere como marcador de niveles de SHBG independiente en pacientes con SOP, mientras que su participación como gen candidato para la etiología del SOP muestra resultados no concluyentes (41).
g. Gen del receptor de la hormona folículo estimulante (FSHR):
La FSH desempeña un papel importante en el crecimiento folicular y la esteroidogénesis ovárica. Las mutaciones o polimorfismos en el gen FSHR pueden afectar a la capacidad reproductiva (42). Hasta la fecha, varios estudios genéticos han examinado la asociación entre polimorfismos FSHR y SOP (42). Los estudios de metanálisis en varias poblaciones otorgan mayor influencia del SNP del codón 680 en comparación a otros polimorfismos para hablar de susceptibilidad o riesgo de SOP (42).
h. Nuevos locus genéticos de interés para SOP:
Los dos estudios más importantes del GWAS han identificado 15 SNPs de interés para SOP. El estudio llevado a cabo en la población de China identificó 11 (THADA, LHCGR, FSHR, C9orf3, DENND1A, YAP1, RAB5B, INSR, TOX3, SUMO1P1 y HMGA2)
(43). Seis de estos locus de riesgo (THADA, LHCGR, FSHR, DENND1A,YAP1, INSR) han sido replicados en población caucásica (43).
La mayoría de estas variantes están en regiones que pueden influir en el desarrollo del SOP (43).
El locus del receptor de la hormona luteinizante/ coriogonadotrópica (LH/HCGR), está aumentado en las células de la granulosa de las mujeres con SOP, así como en el tejido adiposo de mujeres delgadas con SOP (44). Este hallazgo confirmado en varios estudios, concuerda con los datos de que las mujeres delgadas con SOP tienen niveles más elevados de LH, así como un aumento en la actividad de esta hormona (44), y mayor producción de andrógenos ováricos en respuesta a LH (44).
Otra de las variantes genéticas estudiadas en relación al SOP es, DENN/MAD con dominio 1A (DENND1A), cuya variante de transcripción 2 (DENND1Av2) se ha visto sobreexpresada in vitro en las células de la teca de mujeres con SOP, demostrando su capacidad para aumentar la biosíntesis de andrógenos (44).
Una variante en el gen de adenoma tiroideo (THADA), estando previamente relacionado con la DM2, ha sido replicado en mujeres europeas con SOP y sugiere su asociación a factores que predisponen a la DM2 en pacientes con SOP (45).
La variante de riesgo localizada en el cromosoma 11, corresponde al intronYAP1, el cual se ha reportado participa en el ciclo ovárico, específicamente en el crecimiento folicular (45).
3. Fenotipos y variantes de riesgo genético
Además del mapeo de locus para identificar una variante causal, la asociación al fenotipo puede dar una idea de la fisiopatología conferida por este.
Por ejemplo, la variante DENND1A se asocia a hiperandrogenismo y trastornos menstruales, ya que este se expresa en las células de la teca y testículos (50). Sin embargo, no hay una asociación con niveles altos de testosterona o androstenediona, cuando se utiliza un modelo genético aditivo para los rasgos fenotípicos. Se necesitan estudios más amplios para relacionar esta variante con los niveles de gonadotropinas, partiendo de la hipótesis de que interviene en la exocitosis de estas hormonas (45).
Otros rasgos fenotípicos se han estudiado para identificar su asociación a variantes en SOP. Así, los locus que se relacionan con desequilibrio en FSHR se asocia con niveles altos de triglicéridos (45). Paradójicamente variantes en el gen THADA se asocian a bajos valores de testosterona (45).
Son indispensables los estudios que vinculen los hallazgos genéticos con las manifestaciones fenotípicas de este síndrome, para contribuir al conocimiento de la fisiopatología del mismo y establecer el impacto de estas variantes genéticas en pacientes con SOP.
4. MicroRNA en SOP
Los MicroRNA son pequeñas moléculas de ARN de cadena simple no codificante, compuesto por 20-24 nucleótidos, procesados de los precursores de transcripción más grandes. Estos pueden modular la expresión génica pos-transcripcionalmente mediante la unión a la región no traducida 3 (UTR) de unARNm objetivo, inhibiendo así la traducción del ARNm (46).
Poco se sabe acerca de MicroRNA durante el desarrollo folicular, la esteroidogénesis y pacientes con SOP. Varios estudios sobre la expresión de los genes MicroRNA se han realizado sobre ovarios intactos de modelos de animales, diferentes componentes del ovario como las células de la granulosa, células de la teca, fluidos foliculares y cúmulos de ovocitos (47).
El posible mecanismo de acción de los MicroRNA en la fisiopatología del SOP ha sido escasamente investigada, y hasta el momento, solo existen algunos estudios de MicroRNA en SOP (Cuadro 1) (47).
Aplicación clínica de MicroRNA en SOP:
- Los MicroRNA pueden ser utilizados como biomarcadores plasmáticos o séricos, en vista de su abundancia en el plasma, representando un biomarcador no invasivo para SOP, con buena estabilidad sérica y características que los hacen de fácil detección (47). Podría ser una herramienta útil en el diagnóstico y tratamiento del SOP, sin embargo, perfiles en el suero, no necesariamente reflejan los cambios locales en el tejido ovárico, así como la función e importancia de estos, está por establecerse.
- Determinaciones en el líquido folicular y ovocitos, han sido poco reproducibles o comparables con los resultados en plasma, solo los MicroRNA (miR-146, miR-222 y miR-24) han coincidido en la sobreexpresión en ambos fluidos (47). Se requieren más estudios para profundizar en este aspecto.
- MicroRNA en el área de fertilidad han contribuido a establecer nuevos factores en especial relacionados al envejecimiento materno, que se asocia a un perfil de MicroRNA alterado.
5. Influencia epigenética
Es necesario examinar las modificaciones epigenéticas, para desentrañar algunos factores cuya evidencia en el GWAS genera confusión.
Los estudios de la metilación global del ADN de leucocitos, no muestra diferencias significativas en comparación a controles, de tal manera que la metilación global puede no ser tan sensible, como los enfoques dirigidos a genes específicos (17). Por otro lado, también los perfiles de metilación en ADN de leucocitos, pueden no detectar importantes diferencias que pudieran existir entre diferentes tejidos. Así que los patrones de metilación del ADN tejido específico y en genes objetivos son necesarios y pueden ser utilizados como biomarcadores epigenéticos en la detección temprana del SOP y la comprensión de los mecanismos epigenéticos involucrados en el SOP, lo cual puede proporcionar nuevos horizontes en el diagnóstico y tratamiento de esta enfermedad (17).
Conclusiones y perspectivas
Los primeros datos que apoyan la influencia de un solo gen en la etiología del SOP han sido refutados a son coherentes en plantear al SOP como un trastorno genético muy complejo con múltiples alelos asociados a un pequeño grado de riesgo para este síndrome. Hasta ahora, 17 loci genéticos han sido reproducidos para SOP, uno por estudio de asociación basado en familias, que corresponde al gen fibrilina-3 (FBN3) y 16 loci obtenidos por GWAS. Se observa que el gen LHCGR y FSHR modulan la acción de las gonadotropinas y el FSHB controla la secreción de FSH. Característicamente en el SOP predomina la secreción de LH por un aumento de la pulsatilidad de GnRH y su acción en las células de la teca para la producción de Testosterona (T); esta ejerce su efecto sobre la regulación del eje hipotálamo-hipófisis al disminuir la sensibilidad a la acción de los esteroides gonadales en estos tejidos (ver Figura 1).
El FBN3 y DENND1A regulan la esteroidogénesis ovárica, a través de una insuficiente aromatización de los andrógenos. El RAD50 está involucrado en el envejecimiento ovárico; los genes de susceptibilidad para DM2, THADA e INRS inducen resistencia a la insulina e hiperinsulinismo compensador, hallazgo común asociado al SOP; lo cual amplifica los trastornos reproductivos en este síndrome. La participación de varios genes en la fisiopatología del SOP es aún incierta (48).
La heterogeneidad de los criterios diagnósticos empleados para identificar el SOP, así como la variabilidad en el diseño de los estudios, la elección de los controles y las estrategias de replicación, dificulta la interpretación de estos estudios. Además, muchos estudios sobre el GWAS están aún en desarrollo.
Estudios de genómica funcional son necesarios para explicar la importancia fisiopatológica de las variantes genéticas identificadas y contribuir a la comprensión de la fisiopatología del SOP.
REFERENCIAS
1. Govind A, Obhrai MS, Clayton RN. Polycystic ovaries are inherited as an autosomal dominant trait: Analysis of 29 polycystic ovary syndrome and 10 control families. J Clin Endocrinol Metab. 1999;84:38-43. [ Links ]
2. Legro RS, Kunselman AR, Demers L, Wang SC, Bentley-Lewis R, Dunaif A. Elevated dehydroepiandrosterone sulfate levels as the reproductive phenotype in the brothers of women with polycystic ovary syndrome. J Clin Endocrinol Metab. 2002;87:2134-2138. [ Links ]
3. Carey AH, Chan KL, Short F, White D, Williamson R, Franks S. Evidence for a single gene effect causing polycystic ovaries and male pattern baldness. Clin Endocrinol(Oxf). 1993;38:653-658. [ Links ]
4. Sam S, Coviello AD, Sung YA, Legro RS, Dunaif A. Metabolic phenotype in the brothers of women with polycystic ovary syndrome. Diabetes Care. 2008;31:1237-1241. [ Links ]
5. Goodarzi MO. Looking for polycystic ovary síndrome genes: Rational and best strategy. Semin Reprod Med. 2008;26:5-13. [ Links ]
6. Kosova G, Urbanek M. Genetics of the polycystic ovary syndrome. Mol Cell Endocrinol. 2013;373:29- 38. [ Links ]
7. Vink JM, Sadrzadeh S, Lambalk CB, Boomsma DI. Heritability of polycystic ovary syndrome in a Dutch twinfamily study. J Clin Endocrinol Metab. 2006;91:2100-2104. [ Links ]
8. Kahsar-Miller MD, Nixon C, Boots LR, Go RC, Azziz R. Prevalence of polycystic ovary syndrome (PCOS) in firstdegree relatives of patients with PCOS. Fertil Steril. 2001;75:53-58. [ Links ]
9. Urbanek M, Woodroffe A, Ewens KG, Diamanti-Kandarakis E, Legro RS, Strauss JF 3rd, et al. Candidate gene region for polycystic ovary syndrome on chromosome 19p13.2. J Clin Endocrinol Metab. 2005;90:6623-6629. [ Links ]
10. Unluturk U, Harmanci A, Kocaefe C, Yildiz BO. The genetic basis of the polycystic ovary syndrome: A literatura review including discussion of PPAR-_. PPAR Res. 2007;2007:49109. [ Links ]
11. Gallo V, Egger M, McCormack V, Farmer P, Loannidis J, Kirsch-Volders M, et al. Strengthening the Reporting of Observational studies in Epidemiology–Molecular Epidemiology (STROBE-ME): An extension of the STROBE Statement. PLoS Med. 2011;8:e1001117. [ Links ]
12. Parker R, Ming PM, Rajan R, Goodner DM, Remé G. Clinical and cytogenetic studies of patients with polycystic ovary disease. Am J Obstet Gynecol. 1980;137:656-660. [ Links ]
13. Sengoku K, Tamate K, Takuma N, Yoshida T, Goishi K, Ishikawa M. The chromosomal normality of unfertilized oocytes from patients with polycystic ovarian syndrome. Hum Reprod. 1997;12:474-477. [ Links ]
14. Sekar N, Nair M, Francis G, Kongath PR, Babu S, Raja S, Gopalakrishnan AV. Multi-Parameter Approach for Evaluation of Genomic Inestability in th Polycystic Ovary Syndrome. Asian Pac J Cancer Prev. 2015;16(16):7129-7138. [ Links ]
15. Kahn CR, Flier JS, Bar RS, Archer JA, Gorden P, Martin MM, et al. The syndromes of insulin resistance and acanthosis nigricans. Insulin-receptor disorders in man. N Engl J Med. 1976;294:739-745. [ Links ]
16. Semple RK, Savage DB, Cochran EK, Gorden P, ORahilly S. Genetic syndromes of severe insulin resistance. Endocr Rev. 2011;32:498-514. [ Links ]
17. Diamanti-Kandarakis E, Dunaif A. Insulin Resistance and the Polycystic Ovary Syndrome Revisited: An Update on Mechanisms and Implications. Endocr Rev. 2012;33:981-1030. [ Links ]
18. Findlay JK, Drummond AE, Dyson ML, Baillie AJ, Robertson DM, Ethier JF. Recruitment and development of the follicle; the roles of the transforming growth factor- superfamily. Mol Cell Endocrinol. 2002;191:35-43. [ Links ]
19. Guo Q, Kumar TR, Woodruff T, Hadsell LA, DeMayo FJ, Matzuk MM. Overexpression of mouse follistatin causes reproductive defects in transgenic mice. Mol Endocrinol. 1998;12:96-106. [ Links ]
20. Erickson GF, Chung DG, Sit A, DePaolo LV, Shimasaki S, Ling N. Follistatin concentrations in follicular fluid of normal and polycystic ovaries. Hum Reprod. 1995;10:2120-2124. [ Links ]
21. Miralles F, Czernichow P, Scharfmann R. Follistatin regulates the relative proportions of endocrine versus exocrine tissue during pancreatic development. Development. 1998;125:1017-1024. [ Links ]
22. Gabers S, Zaletel K, Schwetz V, Pieber T, Obermayer-Pietsch B, Lerchbaum E. Mechanism in Endocrinology: Thyroid and Polycystic Ovary Syndrome. Eur Soc Endocrinol. 2015;172:9-21. [ Links ]
23. Tang W, Wang Y, Jiang H, Liu CH, Dong CH, Chen S, et al. Insulin receptor substrate-1 (IRS-1) rs1801278G>A polymorphism is associated with polycystic ovary syndrome susceptibility: A meta-analysis. Int J Clin Exp Med. 2015;8:17451-17460. [ Links ]
24. Gangopadhyay S, Agrawal N, Batra A, Kabi BC, Gupta A. Single-Nucleotide Polymorphism on Exon 17 of Insulin Receptor Gene Influences Insulin Resistance in PCOS: A Pilot Study on North Indian Women. Biochem Genet. 2016;54:158-168. [ Links ]
25. Selway JL, Moore CE, Mistry R, John Challiss RA, Herbert TP. Molecular mechanisms of muscarinic acetylcholine receptor-stimulated increase in cytosolic free Ca(2+) concentration and ERK1/2 activation in the MIN6 pancreatic beta-cell line. Acta Diabetol. 2012;49:277-289. [ Links ]
26. Shim U, Kim HN, Lee H, Oh JY, Sung YA, Kim HL. Pathway Analysis Based on a Genome-Wide Association Study of Polycystic Ovary Syndrome. PLoS ONE. 2015;10:e0136609. [ Links ]
27. Li L, Gu ZP, Bo QM, Wnag D, Yang XS, Cai GH. Association of CYP17A1 gene -34T/C polymorphism with polycystic ovary syndrome in Han Chinese population. Gynecol Endocrinol. 2015;31:40-43. [ Links ]
28. Duval A, Busson-Leconiat M, Berger R, Hamelin R. Assignment of the TCF-4 gene (TCF7L2) to human chromosome band 10q25.3. Cytogenet Cell Genet. 2000;88:264-265. [ Links ]
29. Helgason A, Palsson S, Thorleifsson G, Grant SF, Emilsson V, Gunnarsdottir S, et al. Refining the impact of TCF7L2 gene variants on type 2 diabetes and adaptive evolution. Nat Genet. 2007;39:218-225. [ Links ]
30. Yi F, Brubaker PL, Jin T. TCF-4 mediates cell typespecific regulation of proglucagon gene expression by beta-catenin and glycogen synthase kinase-3beta. J Biol Chem. 2005;280:1457-1464. [ Links ]
31. Sale MM, Smith SG, Mychaleckyj JC, Keene KL, Langefeld CD, Leak TS, et al. Variants of the transcription factor 7-like 2 (TCF7L2) gene are associated with type 2 diabetes in an African-American population enriched for nephropathy. Diabetes. 2007;56:2638-2642. [ Links ]
32. Saxena R, Gianniny L, Burtt NP, Lyssenko V, Giuducci C, Sjogren M, et al. Common single nucleotide polymorphisms in TCF7L2 are reproducibly associated with type 2 diabetes and reduce the insulin response to glucose in nondiabetic individuals. Diabetes. 2006;55:2890-2895. [ Links ]
33. Tong Y, Lin Y, Zhang Y, Yang J, Zhang Y, Liu H, et al. Association between TCF7L2 gene polymorphisms and susceptibility to Type 2 diabetes mellitus: A large Human Genome Epidemiology (HuGE) review and meta-analysis. BMC Med Genetic. 2009;10:15. [ Links ]
34. Ramos RB, Fabris VC, Brondani LA, Spritzer PM. Association between rs7903146 and rs12255372 polymorphisms of transcription factor 7-like 2 gene and polycystic ovary syndrome: A systematic review and meta-analysis. Endocrine. 2015;49:635-642. [ Links ]
35. Horikawa Y1, Oda N, Cox NJ, Li X, Orho-Melander M, Hara M, et al. Genetic variation in the gene encoding calpain-10 is associated with type 2 diabetes mellitus. Nat Genet. 2000;26:163-175. [ Links ]
36. Harris F, Biswas S, Singh J, Dennison S, Phoenix DA. Calpains and their multiple roles in diabetes mellitus. Ann N Y Acad Sci. 2006;1084:452-480. [ Links ]
37. Plengvidhya N, Chanprasert K, Tangjittipokin N, Thongnoppakhun W, Yenchitsomanus P. Detection of CAPN10 copy number variation in Thai patients with type 2 diabetes by denaturing high performance liquid chromatography and real-time quantitative polymerase chain reaction. J Diabetes Investig. 2015;6:632-639. [ Links ]
38. Frayling TM, Timpson NJ, Weedon MN, Zeggini E, Freathy RM, Lindgren CM, et al. A common variant in the FTO gene is associated with body mass index and predisposes to childhood and adult obesity. Science. 2007;316:889-894. [ Links ]
39. Li H, Kilpeläinen A, Liu C, Zhu J, Liu Y, Hu C, et al. Association of genetic variation in FTO with risk of obesity and type 2 diabetes with data rom 96,551 East and South Asians. Diabetologia. 2012;55:981-995. [ Links ]
40. Wojciechowski P, Lipowska A, Rys P, Ewens KG, Franks S, Tan S, et al. Impact of FTO genotypes on BMI and weight in polycystic ovary syndrome: A systematic review and meta-analysis. Diabetologia. 2012;55:2636-2645. [ Links ]
41. Wickham EP, Ewens KG, Richard S., Legro RS, et al. Polymorphisms in the SHBG Gene Influence Serum SHBG Levels in Women with Polycystic Ovary Syndrome. J Clin Endocrinol Metab. 2011;96:E719-E727. [ Links ]
42. Singhasena W, Pantasri T, Piromlertamorn W, Samchimchom S, Vutyavanich T. Follicle-stimulating hormone receptor gene polymorphism in chronic anovulatory women, with or without polycystic ovary syndrome: A cross-sectional study. Reproduc Biol Endocrinol. 2014;12:86. [ Links ]
43. Geoffrey Hayes M, Urbanek M, Ehrmann D, Armstrong L, Lee JY, Sisk R, et al. Genome-wide association of polycystic ovary syndrome implicates alterations in gonadotropin secretion in European ancestry populations. Nature communications. 2015;6:7502. [ Links ]
44. Jones MR, Brower MA, Xu N, Cui J, Mengesha E, Chen YD, et al. Systems Genetics Reveals the Functional Context of PCOS Loci and Identifies Genetic and Molecular Mechanisms of Disease Heterogeneity. PLoS Genet. 2015; 25(11):e1005455. [ Links ]
45. Welt CK, Duran JM. The Genetics of Polycystic Ovary Syndrome. Semin Reprod Med. 2014;32:177-182. [ Links ]
46. Ambros V. MicroRNAs: Tiny regulators with great potential. Cell. 2001;107:823-826. [ Links ]
47. Sorensen A, Wissing ML, Salö S, Mikkelsen AL, Dalgaard LT. MicroRNAs Related to Polycystic Ovary Syndrome (PCOS). Genes. 2014;5:684-708. [ Links ]
48. Dunaif A. Perspectives in Polycystic Ovary Syndrome: From Hair to Eternity. J Clin Endocrinol Metab. 2016;101:759-768. [ Links ]^rND^sGovind^nA^rND^sObhrai^nMS^rND^sClayton^nRN^rND^sLegro^nRS^rND^sKunselman^nAR^rND^sDemers^nL^rND^sWang^nSC^rND^sBentley-Lewis^nR^rND^sDunaif^nA^rND^sCarey^nAH^rND^sChan^nKL^rND^sShort^nF^rND^sWhite^nD^rND^sWilliamson^nR^rND^sFranks^nS^rND^sSam^nS^rND^sCoviello^nAD^rND^sSung^nYA^rND^sLegro^nRS^rND^sDunaif^nA^rND^sGoodarzi^nMO^rND^sKosova^nG^rND^sUrbanek^nM^rND^sVink^nJM^rND^sSadrzadeh^nS^rND^sLambalk^nCB^rND^sBoomsma^nDI^rND^sKahsar-Miller^nMD^rND^sNixon^nC^rND^sBoots^nLR^rND^sGo^nRC^rND^sAzziz^nR^rND^sUrbanek^nM^rND^sWoodroffe^nA^rND^sEwens^nKG^rND^sDiamanti-Kandarakis^nE^rND^sLegro^nRS^rND^sStrauss^nJF 3rd^rND^sUnluturk^nU^rND^sHarmanci^nA^rND^sKocaefe^nC^rND^sYildiz^nBO^rND^sGallo^nV^rND^sEgger^nM^rND^sMcCormack^nV^rND^sFarmer^nP^rND^sLoannidis^nJ^rND^sKirsch-Volders^nM^rND^sParker^nR^rND^sMing^nPM^rND^sRajan^nR^rND^sGoodner^nDM^rND^sRemé^nG^rND^sSengoku^nK^rND^sTamate^nK^rND^sTakuma^nN^rND^sYoshida^nT^rND^sGoishi^nK^rND^sIshikawa^nM^rND^sSekar^nN^rND^sNair^nM^rND^sFrancis^nG^rND^sKongath^nPR^rND^sBabu^nS^rND^sRaja^nS^rND^sGopalakrishnan^nAV^rND^sKahn^nCR^rND^sFlier^nJS^rND^sBar^nRS^rND^sArcher^nJA^rND^sGorden^nP^rND^sMartin^nMM^rND^sSemple^nRK^rND^sSavage^nDB^rND^sCochran^nEK^rND^sGorden^nP^rND^sORahilly^nS^rND^sDiamanti-Kandarakis^nE^rND^sDunaif^nA^rND^sFindlay^nJK^rND^sDrummond^nAE^rND^sDyson^nML^rND^sBaillie^nAJ^rND^sRobertson^nDM^rND^sEthier^nJF^rND^sGuo^nQ^rND^sKumar^nTR^rND^sWoodruff^nT^rND^sHadsell^nLA^rND^sDeMayo^nFJ^rND^sMatzuk^nMM^rND^sErickson^nGF^rND^sChung^nDG^rND^sSit^nA^rND^sDePaolo^nLV^rND^sShimasaki^nS^rND^sLing^nN^rND^sMiralles^nF^rND^sCzernichow^nP^rND^sScharfmann^nR^rND^sGabers^nS^rND^sZaletel^nK^rND^sSchwetz^nV^rND^sPieber^nT^rND^sObermayer-Pietsch^nB^rND^sLerchbaum^nE^rND^sTang^nW^rND^sWang^nY^rND^sJiang^nH^rND^sLiu^nCH^rND^sDong^nCH^rND^sChen^nS^rND^sGangopadhyay^nS^rND^sAgrawal^nN^rND^sBatra^nA^rND^sKabi^nBC^rND^sGupta^nA^rND^sSelway^nJL^rND^sMoore^nCE^rND^sMistry^nR^rND^sJohn Challiss^nRA^rND^sHerbert^nTP^rND^sShim^nU^rND^sKim^nHN^rND^sLee^nH^rND^sOh^nJY^rND^sSung^nYA^rND^sKim^nHL^rND^sLi^nL^rND^sGu^nZP^rND^sBo^nQM^rND^sWnag^nD^rND^sYang^nXS^rND^sCai^nGH^rND^sDuval^nA^rND^sBusson-Leconiat^nM^rND^sBerger^nR^rND^sHamelin^nR^rND^sHelgason^nA^rND^sPalsson^nS^rND^sThorleifsson^nG^rND^sGrant^nSF^rND^sEmilsson^nV^rND^sGunnarsdottir^nS^rND^sYi^nF^rND^sBrubaker^nPL^rND^sJin^nT^rND^sSale^nMM^rND^sSmith^nSG^rND^sMychaleckyj^nJC^rND^sKeene^nKL^rND^sLangefeld^nCD^rND^sLeak^nTS^rND^sSaxena^nR^rND^sGianniny^nL^rND^sBurtt^nNP^rND^sLyssenko^nV^rND^sGiuducci^nC^rND^sSjogren^nM^rND^sTong^nY^rND^sLin^nY^rND^sZhang^nY^rND^sYang^nJ^rND^sZhang^nY^rND^sLiu^nH^rND^sRamos^nRB^rND^sFabris^nVC^rND^sBrondani^nLA^rND^sSpritzer^nPM^rND^sHorikawa^nY1^rND^sOda^nN^rND^sCox^nNJ^rND^sLi^nX^rND^sOrho-Melander^nM^rND^sHara^nM^rND^sHarris^nF^rND^sBiswas^nS^rND^sSingh^nJ^rND^sDennison^nS^rND^sPhoenix^nDA^rND^sPlengvidhya^nN^rND^sChanprasert^nK^rND^sTangjittipokin^nN^rND^sThongnoppakhun^nW^rND^sYenchitsomanus^nP^rND^sFrayling^nTM^rND^sTimpson^nNJ^rND^sWeedon^nMN^rND^sZeggini^nE^rND^sFreathy^nRM^rND^sLindgren^nCM^rND^sLi^nH^rND^sKilpeläinen^nA^rND^sLiu^nC^rND^sZhu^nJ^rND^sLiu^nY^rND^sHu^nC^rND^sWojciechowski^nP^rND^sLipowska^nA^rND^sRys^nP^rND^sEwens^nKG^rND^sFranks^nS^rND^sTan^nS^rND^sWickham^nEP^rND^sEwens^nKG^rND^sRichard^nS.^rND^sLegro^nRS^rND^sSinghasena^nW^rND^sPantasri^nT^rND^sPiromlertamorn^nW^rND^sSamchimchom^nS^rND^sVutyavanich^nT^rND^sGeoffrey Hayes^nM^rND^sUrbanek^nM^rND^sEhrmann^nD^rND^sArmstrong^nL^rND^sLee^nJY^rND^sSisk^nR^rND^sJones^nMR^rND^sBrower^nMA^rND^sXu^nN^rND^sCui^nJ^rND^sMengesha^nE^rND^sChen^nYD^rND^sWelt^nCK^rND^sDuran^nJM^rND^sAmbros^nV^rND^sSorensen^nA^rND^sWissing^nML^rND^sSalö^nS^rND^sMikkelsen^nAL^rND^sDalgaard^nLT^rND^sDunaif^nA^rND^1A01^nFranklin^sAblan Candia^rND^1A01^nFranklin^sAblan Candia^rND^1A01^nFranklin^sAblan Candia
Fisiopatología del síndrome de ovario poliquístico
Dr. Franklin Ablan Candia
Endocrinólogo. Consultor Honorario y Docente del Posgrado de Endocrinología y Metabolismo. Servicio de Endocrinología, Hospital Vargas de Caracas. Ex Presidente de la Sociedad Venezolana de Endocrinología y Metabolismo (2004-2006; 2006-2008)
La fisiopatología del síndrome de ovario poliquístico (SOP) es heterogénea y compleja, refleja la interacción entre factores genéticos, metabólicos, fetales y ambientales. La importancia de estos factores puede variar en las mujeres afectadas.
Entre los principales factores implicados se describen: trastornos de la secreción de las gonadotropinas, hiperandrogenismo, resistencia a la insulina e hiperinsulinemia, disfunción ovárica y detención de la maduración folicular (1).
1. Función pituitaria anormal.
El aumento de la hormona luteinizante (LH) en relación con la hormona estimulante del folículo (FSH) fue la primera anormalidad identificada en el SOP clásico. Esta alteración ocurre en aproximadamente la mitad de los paciente con SOP (2,3). La LH se piensa que tiene un rol en la patogénesis al aumentar la producción y secreción de andrógenos por las células de la teca (4). Al mismo tiempo hay un aumento en la frecuencia y amplitud de los pulsos secretorios. El incremento en la LH parece resultar de una retroalimentación anormal de los esteroides sexuales (estrógeno y testosterona) más que a causa del exceso de andrógenos. El incremento modesto de los andrógenos en las mujeres con SOP paradójicamente estimula la pulsatilidad de la LH (5). Esto es así porque las pacientes con SOP son menos sensibles a la supresión de LH por las hormonas de la fase lútea al compararse con un grupo control.
2. Esteroidogénesis anormal.
2.1 Categorización funcional-fisiopatológica
2.1.1 Hiperandrogenismo ovárico funcional (HOF)
Las evidencias de los estudios clínicos concuerdan que el defecto fundamental en la mayoría del SOP es una disfunción intrínseca de los andrógenos producidos en el ovario. Este defecto se le ha designado como hiperandrogenismo primario funcional ovárico (HOF) (4,6,7). Una alta concentración de andrógenos intraováricos resulta en un excesivo crecimiento de pequeños folículos y al mismo tiempo se inhibe la maduración folicular y el desarrollo del folículo dominante. Además estimula la luteinización prematura en la teca, el estroma y la hiperplasia cortical. Esto conduce a anovulación y presencia de ovarios poliquísticos. La hipersecreción de andrógenos es dependiente de LH y por tanto es de carácter funcional, por lo que cualquier intervención que suprima el nivel de LH resulta en una supresión de andrógenos ováricos (8,9).
Los estudios muestran que el HOF subyace en la mayoría de los pacientes con SOP (2,7). Esta forma de hiperandrogenismo está caracterizada por una respuesta aumentada de 17 OH progesterona a la estimulación por las gonadotropinas, en ausencia de un evidente bloqueo de la esteroidogénesis.
Tanto las adolescentes como las mujeres adultas presentan las mismas características de disfunción ovárica (10-12); un tercio de mujeres no tienen esta alteración de la 17OH progesterona (2).
Estudios realizados en pre-adipocitos y adipocitos maduros provenientes de tejido adiposo subcutáneo abdominal en mujeres ovulatorias, con índice masa corporal (IMC) < 35 kg m2 mostraron el potencial para la síntesis de andrógenos de novo y a partir de progesterona. Se encontraron diferentes sistemas enzimáticos necesarios para la producción de andrógenos, de mencionar en particular la 17 hidroxilasa, cuando estos elementos celulares son expuestos a dosis de insulina, los niveles de androstenediona in vitro se incrementaron. De manera que esta observación tiene relevancia clínica por el impacto de la obesidad y la insulina en la esteroidogénesis en la mujer (13).
Una minoría de los pacientes con SOP sin HFO, tenían hiperandrogenismo funcional adrenal (HFA) y en la mayoría de ellas se atribuyó a un tejido adiposo excesivo (14).
2.1.2 Hiperandrogenismo adrenal funcional HAF:
En pacientes con SOP, una disfunción adrenal caracterizada por una respuesta aumentada e hipersensibilidad a la estimulación con hormona corticotropa (ACTH) a dosis muy bajas en comparación con grupos controles, ha sido reportada (15).
El patrón de HAF coexiste con el HOF. La estimulación con ACTH se caracteriza por una hiper respuesta de los andrógenos débiles y sus precursores, en particular la dehidroepiandrosterona y la 17 didroxipregnenolona, pero sin evidencia de bloqueo enzimático. Se manifiesta por un incremento de sulfato de dehidroepiandrosteorna (S-DHEA) en la evaluación habitual de laboratorio. Esta alteración parece ser debida a una variante genética de 11 beta hidroxiesteroide deshidrogenasa en las pacientes de peso normal con SOP (16).
Las niñas con pubarquia prematura se asocian con un hiperandrogenismo funcional adrenal (HAF) pero no ovárico (15).
2.2 Factores contribuyentes a la esteroidogénesis disregulada.
2.2.1 Factores intrínsecos
La disregulación de la esteroidogénesis contribuye a las alteraciones de las secreciones de hormonas ováricas y adrenales.
El SOP, como entidad clínica tiene concentraciones de testosterona total, testosterona libre, androstenediona y DHEA-S que están elevadas significativamente comparadas con mujeres ovulatorias no hirsutas. Hay sin embargo importantes variaciones individuales, y algunas mujeres con SOP pueden tener concentraciones normales de andrógenos cuando son medidas en una sola toma de sangre (17).
En el SOP, la testosterona y la androstenediona son producidas principalmente por la glándula adrenal y los ovarios, pero también por conversión de andrógenos débiles en la periferia. En la mujer con SOP la testosterona y la androstenediona son secretadas principalmente por los ovarios y en menor grado por las adrenales; este patrón difiere de la mujer normal en premenopausia, quien tienen igual producción de testosterona y androstenediona ovárica y adrenal (17).
La concentración de testosterona está determinada por la cantidad de la globulina transportadora de esteroides sexuales (SHBG, por sus siglas en inglés) y a su vez esta concentración está regulada por andrógenos, estrógenos e insulina. Por tanto, la mujer con SOP tiende a tener niveles bajos de SHBG y esto enmascara la magnitud del exceso de testosterona cuando se mide la testosterona total. El IMC se correlaciona positivamente con el nivel de testosterona total e inversamente con las concentraciones de SHBG en todos los rangos etarios (18,19).
En el SOP, la LH estimula las células de la teca e incrementa la secreción de androstenediona, además de sensibilizarlas a la estimulación por la LH (20). En la mujer con SOP la secreción de andrógenos puede estar aumentada por:
- Aumento del volumen de células de la teca
- Aumento de la estimulación de LH a las células de la teca
- Aumento de la sensibilidad de las células de la teca a la LH
- Potenciación de la acción de la LH por la hiperinsulinemia.
- Producción de sub-unidad beta de LH con diferente actividad biológica debido a un polimorfismo genético (21)
- Aumento de la actividad de enzimas ováricas, CYP11 A CYP 17 en las células foliculares en comparación con sujetos controles (20)
La DHEA y DHEA-S son marcadores de producción por las adrenales, los cuales tienen poca actividad androgénica intrínseca
Se han descrito factores intra-ováricos que tienen efecto modulador inhibitorio, entre ellos tenemos la insulina, e IGF1; otros factores involucrados son retinoides, citoquinas (TNF alfa, TGB beta) , factores de crecimiento y diferenciación (22).
La disregulación adrenal tiene una base intrínseca similar a la de las células de la teca ovárica. Los factores involucrados en esta modulación, son la respuesta de los 17 cetoesteroides a la ACTH, y la interleuquina- 6 la cual tiene una expresión muy importante en la zona reticular de la corteza adrenal y estimula selectivamente la secreción de DHEA (23).
2.2.2 Factores extrínsecos
Los estudios clínicos muestran evidencias suficientes de la acción directa de la insulina sobre el ovario. La hiperandrogenemia y los trastornos ovulatorios se encuentran en los síndromes de resistencia a la insulina en mujeres pre-menopáusicas (24,25). La correlación positiva entre insulino resistencia e hiperandrogenismo en el SOP señala tal asociación. Los estudios muestran una acción directa de la insulina y la vía de señalización sobre la esteroidogénesis en el ovario y el control de la ovulación (26). Los receptores de insulina están presentes en los ovarios de mujeres normales y con SOP. El receptor de IGF-I es una tirosina quinasa que comparte considerable homología estructural y funcional con el receptor de insulina. El receptor IGF-I también esta presente en el ovario y su ligando IGF-I es sintetizado en el ovario (27-29).
La resistencia a la insulina asociada a la obesidad en el SOP está estrechamente relacionada; la prevalencia de obesidad en mujeres con SOP es mayor que en mujeres sanas. La obesidad per se, no es necesariamente un defecto intrínseco en el SOP. El grado de resistencia a la insulina en el SOP es mayor, y no es totalmente dependiente del IMC. El grado de adiposidad visceral por sí solo tampoco explica las diferencias en la sensibilidad a la insulina entre las mujeres con SOP y aquellas que no lo presentan (30).
El tejido adiposo es muy activo, secreta aproximadamente 100 factores que regulan diversas funciones metabólicas, que inducen complejas interacciones paracrinas, disregulación de la producción adipoquinas (por ejemplo adiponectina), citoquinas (factor de necrosis tumoral alfa) los cuales favorecen la insulino resistencia (30).
2.2.3. Disfunción de las células de la granulosa y foliculogénesis alterada.
La histología del ovario poliquístico muestra folículos pre-antrales en crecimiento con apariencia similar a los ovarios normales; también la formación del folículo antral puede parecer normal. Sin embargo, el desarrollo más allá del estadio del antro no se observa y este exhibe cambios de detención del crecimiento y degeneración. Hay una progresiva acumulación de líquido folicular y expansión del antro. En la medida que el folículo aumenta de tamaño, en la capa de células de la granulosa ocurre apoptosis y atresia (31).
2.2.3.1 Aumento de los folículos:
De forma característica el ovario poliquístico (OP) presenta un número aumentado de folículos por lo que la población de folículos preantrales y antrales exceden 2 a 3 veces lo observado en el ovario normal (ON) (32,33) . Esto podría ser la consecuencia de: 1. Aumento de la activación de folículos aumentados, 2. Enlentecimiento del desarrollo del folículo antral, 3. Aumento de la sobrevida y/o a atresia disminuida o bien a una combinación de estos factores (34).
2.2.3.2 Población de folículos pre-antrales:
El número de folículos primordiales en el OP y en los ON son similares, pero hay un predominio de folículos pre-antrales en el OP (34).
2.2.3.3 Folículos con sobrevida prolongada:
Los estudios demuestran que el desarrollo de los folículos está enlentecido en el estadio primario, y junto a un patrón de sobrevida prolongada conduce a la acumulación de folículos preantrales, por tanto mayor número de folículos en crecimiento (33,34).
2.2.3.4 Rol de factor de crecimiento y diferenciación FCD -9:
El enlentecimiento del estadio primario a secundario fue descrito por Webber (33). El estudio de Texeira – Fhilo (35) reportó que la expresión del factor de crecimiento y diferenciación 9 (FCD-9), un miembro de la familia de factores de transformación y crecimiento beta (FTC β), el cual es específico para los oocitos juega un papel crítico en la foliculogénesis. La expresión de este factor está significativamente disminuida en los folículos primarios de OP comparados con ovarios normales, por tanto la detención de la maduración ocurre en estadios tempranamente.
2.2.3.5. Hormona anti-mülleriana (HAM):
Este es un producto de la células granulosas ubicadas en los folículos en crecimiento y parece regular el crecimiento y desarrollo, al ejercer una retroalimentación negativa de tipo paracrina en el reclutamiento de los folículos primordiales. En el OP el nivel sérico de HAM está elevado por el aumento del número de folículos en crecimiento, sin embargo, la HAM en los folículos en fases iniciales de desarrollo puede estar disminuida, y los valores séricos aumentados pudiesen expresar una resistencia al efecto inhibitorio de este factor en el reclutamiento folicular (36-39).
2.2.3.6. Andrógenos:
Entre los factores locales que podrían acelerar el crecimiento folicular se ha descrito el aumento de los andrógenos, lo cual también se puede apreciar en otras patologías que cursan con hiperandrogenismo (40) Vendola y col. (41) reportaron que los andrógenos inducen un aumento del receptor de FSH en las células de la granulosa.
2.2.3.7 Detención del desarrollo folicular:
Es reconocido que en SOP el desarrollo folicular falla en proseguir más allá del estadio antral medio, esto corresponde a diámetro de 5 a 8 mm. La causa de este fenómeno no se conoce. Se sugiere que existe una diferenciación prematura de los folículos e insuficiente producción de FSH (31).
2.2.3.8 Luteinización prematura:
Los folículos en el SOP adquieren receptores de LH en estadio temprano del desarrollo, por lo cual la secreción de progesterona estimulada por LH en estos pequeños folículos (4 mm), es mayor que la producción de progesterona por folículos de mayor tamaño procedentes de ovarios normales (20). La insulina promueve la acción de LH en las células de la granulosa y contribuye a la atresia folicular (42).
2.2.3.9 Inadecuada secreción de FSH:
Se ha descrito que la supresión relativa de la secreción de FSH, como el incremento de la LH puede ser consecuencia de un aumento de la actividad del generador de pulsos a nivel hipotalámico (43).
2.2.3.10. Esteroidogénesis en células granulosas:
La integridad funcional de las células granulosa en los folículos del SOP se mantiene y en gran parte su capacidad de respuesta es aún mayor que lo encontrado aquellas provenientes de ovarios normales.
La mujeres con SOP estimuladas con FSH en forma aguda, tuvieron una respuesta aumentada 6 a 10 veces de lo que se ven en mujeres con ovarios normales. Sin embargo, al estimularlas en forma creciente con FSH, la respuesta incrementaba progresivamente pero en el tiempo no se sostenía, en cambio en las pacientes con ovarios normales la respuesta se mantuvo hasta 24 horas de estimulación. Los factores relacionados con esta característica son hiperandrogenismo, los estrógenos y la insulina (44).
2.2.3.11. Defecto primario de las células de la teca:
La evidencia de los estudios clínicos, soporta el concepto de disregulación de la CYP17en las células tecales del OP, que conduce a una producción aumentada de andrógenos en respuesta a la estimulación de gonadotropinas sobre el ovario (45). Se ha reportado una mayor actividad de la vía 5 - delta de la esteroidogénesis de las células de la teca (46).
2.2.3.12 Interacciones de factores intracrinos intrafoliculares:
La estimulación mediante FSH sobre las células tecales muestra una respuesta aumentada, la cual señala la posibilidad de factores paracrinos derivados de las células de la granulosa que estimulan la producción de andrógenos por las células de la teca. Entre los factores paracrinos tenemos la inhibina, la proteína ósea morfogenética y los factores insulino similares IGF-1 (46).
3. Anormalidades metabólicas
3.1 Resistencia insulínica e hiperinsulinemia.
La resistencia a la insulina y la hiperinsulinemia compensatoria son elementos característicos del SOP y por esa razón las mujeres con SOP presentan un riesgo aumentado de intolerancia a la glucosa y diabetes mellitus tipo 2 (DM 2). Los estudios en general han demostrado que entre 30 % a 40 % de las mujeres con SOP tiene intolerancia a la glucosa (ITG) y hasta un 10% desarrollan DM a la edad de 40 años. Es de hacer notar que podría haber diferencias étnicas en el riesgo de desarrollar intolerancia a la glucosa (47-51).
La obesidad incrementa la resistencia a la insulina, las mujeres delgadas con SOP tienen el mismo nivel de sensibilidad a la insulina que los controles con obesidad (52-54), o en algunos casos con los controles delgados (55,56). La razón para no detectar diferencias en la sensibilidad a la insulina en mujeres delgadas con SOP podría ser explicada por diferencias raciales o étnicas (57,58).
De manera importante, la insulina tiene un rol directo e indirecto en la patogénesis del exceso de andrógenos, estimulando la producción de andrógenos ováricos y reduciendo la síntesis hepática de la globulina transportadora de esteroides sexuales, teniendo como resultado niveles aumentados de andrógenos biodisponibles (59,60); la insulina además actúa de manera sinérgica con la LH aumentado la producción de andrógenos por la células de la teca (61).
3.2 Vitamina D y SOP
Se ha descrito una posible relación entre la deficiencia de vitamina D y el fenotipo SOP (62). En primer lugar, varios estudios han demostrado que la deficiencia de vitamina D es más común en mujeres con SOP comparadas con las mujeres de grupos control (63).
En segundo lugar, la deficiencia de vitamina D puede ser un factor que contribuye a RI, obesidad y síndrome metabólico, todos los cuales son observados comúnmente en SOP (63).
Se ha relacionado el déficit de vitamina D con disfunción ovulatoria, la suplementación de dicha vitamina puede mejorar la irregularidad menstrual, el desarrollo folicular y la tasa de embarazo en mujeres con SOP (62,64).
Los productos finales de glicación avanzada (AGE, por sus siglas en inglés) son los productos de la modificación no enzimática de proteínas, lípidos, y los ácidos nucleicos por la glucosa; los AGE son moléculas proinflamatorias que pueden desempeñar un papel en el desarrollo folicular anormal (65).
Los AGE se ha demostrado están involucrados en la patogénesis del SOP, y sus niveles séricos son elevados en mujeres con el síndrome; ellos se acumulan en las capas de la teca y de la granulosa del ovario y detienen el crecimiento folicular (66). Curiosamente, un estudio reciente realizado por Irani y col. (67) demostró en 16 mujeres deficientes en vitamina D con SOP, quienes fueron tratadas con 1,25-dihidroxivitamina D3, un aumento significativo del ligando de AGER, generalmente beneficioso porque disminuye AGE circulante e inhibe el efecto inflamatorio perjudicial.
También se ha reportado que la vitamina D altera las vías intracelulares implicadas en la regulación tanto del receptor de hormona antimülleriana (AMHR) como del receptor de FSH (62).
4. Programación fetal del síndrome de ovario poliquístico (68)
El SOP es un trastorno muy complejo y heterogéneo que se ve influenciado significativamente por factores genéticos y ambientales.
Los factores ambientales pueden desempeñar un papel en las primeras etapas del desarrollo humano, ayudando a convertir una predisposición genética en la expresión fenotípica del síndrome de ovario poliquístico, conllevando a diveras manifestaciones clíncas, así como complicaciones a lo largo de toda la vida de la mujer (Figura 1).
Estudios en animales de experimentación sugieren que el hiperandrogenismo materno, en una etapa crítica del desarrollo fetal, puede causar cambios permanentes en la fisiología fetal que pueden desencadenar SOP en la vida adulta. En los seres humanos, no es posible llevar a cabo estudios para observar las consecuencias de los andrógenos maternos en el feto; sin embargo, se han realizado observaciones en seres humanos para apoyar la validez de esta hipótesis.
Además del incremento de los niveles de andrógenos durante el embarazo, también un insuficiente ambiente nutricional intrauterino puede afectar el metabolismo celular en los tejidos diana o causar alteraciones epigenéticas de genes específicos que conlleven al desarrollo del SOP en la edad adulta.
Los mecanismos de activación del SOP pudieran eliminarse al mejorar el ambiente hormonal materno y el ambiente nutricional intrauterino.
Son necesarios estudios futuros para determinar si el tratamiento sensibilizante a la insulina durante el embarazo en mujeres con SOP lo evitará en su descendencia.
5. Conclusiones
La Figura 2 (69) muestra la fisiopatología tan compleja del SOP:
- El aumento de la frecuencia de la liberación pulsátil de GnRH aumenta selectivamente la secreción de LH, la cual estimula la producción de testosterona por las células de la teca del ovario.
- Debido a la deficiencia relativa de FSH, la testosterona es aromatizada de forma incompleta por las células de la granulosa.
- El aumento en la actividad de enzimas esteroidogénicas y los factores locales que modulan la esteroidogénesis en el SOP contribuyen al aumento de la producción de andrógenos.
- El aumento de la producción de andrógenos suprarrenales también puede estar presente en el SOP.
- El desarrollo anormal del folículo es la característica cardinal de la mujer con SOP, sin embargo, los mecanismos responsables de esta alteración aún no están completamente dilucidados.
REFERENCIAS
1. Dumesic D, Oberfield S, Steiner-Victorin E, Marshal J. Scientific Statement on the Diagnostic Criteria, Epidemiology, Pathophysiology, and Molecular Diagnosis in Polycystic Ovary Syndrome. Endocrine Reviews. 2015;36:487-525. [ Links ]
2. Mortensen M, Ehrmann D, Littlejohn E, Rosenfield R. Asymptomatic volunteers with a polycystic ovary are a functionally distinct but heterogeneous population. J Clin Endocrinol Metab. 2009;9:1579-1586. [ Links ]
3. Taylor A, McCourt B, Martin K, Anderson E, Adams J SD, Schoenfeld DA, et al. Determinants of abnormal gonadotropin secretion in clinically defined women with polycystic ovary syndrome. J Clin Endocrinol Metab. 1997;82:2248. [ Links ]
4. Rosenfield R. Ovarian and adrenal function in polycystic ovary syndrome. Endocrinol Metab Clin North Am. 1999;28:265-293. [ Links ]
5. Rosenfield R, Bordini B. Evidence that obesity and androgens have independent and opposing effects on gonadotropin production from puberty to maturity. Brain Research. 2010;1364:186-197. [ Links ]
6. Jonard S, Dewailly D. The follicular excess in polycystic ovaries, due to intra-ovarian hyperandrogenism, may be the main culprit for the follicular arrest. Human Reprod Update. 2004;10:107-117. [ Links ]
7. Ehrmann D, Barnes R, Rosenfield R. Polycystic ovary syndrome as a form of functional ovarian hyperandrogenism due to dysregulation of androgen secretion. Endocr Rev. 1995;160:322-353. [ Links ]
8. Futterweit W, Deligdisch L. Histopathological effects of exogenously administered testosterone in 19 female to male transsexuals. J Clin Endocrinol Metab. 1986;62:16-21. [ Links ]
9. Pache T, Chadha S, Gooren L, Hop W, Jaarsma K, Dommerholt H, et al. Ovarian morphology in longterm androgen-treated female to male transsexuals. A human model for the study of polycystic ovarian syndrome? Histopathology. 1991;19:445-452. [ Links ]
10. Rosenfield R. Clinical review: Adolescent anovulation: maturational mechanisms and implications. J Clin Endocrinol Metab. 2013;98:3572-3583. [ Links ]
11. Legro R, Arslanian S, Ehrmann D. Diagnosis and treatment of polycystic ovary syndrome: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2013;98:4565-4592. [ Links ]
12. Rosenfield RL, Ghai K, Ehrmann DA, Barnes RB. Diagnosis of the polycystic ovary syndrome in adolescence: Comparison of adolescent and adult hyperandrogenism. J Pediatr Endocrinol Metab. 2000;13:1285-1289. [ Links ]
13. Cadagan R, Khan R SA. Female adipocyte androgens synthesis and effects of insulin. Molecular Genetics and Metabolism Reports. 2014;1:254-263. [ Links ]
14. Rosenfield R. Ovarian and adrenal function in polycystic ovary syndrome. Endocrinol Metab North Am. 1999;28:265-293. [ Links ]
15. Mathew R, Najjar J, Lorenz R, Mayes D, Russell W. Premature pubarche in girls is associated with functional adrenal but not ovarian hyperandrogenism. Pediatrics. 2002;141:91-98. [ Links ]
16. Gambineri A, Vicennati V, Genghini S. Genetic variation in 11beta-hydroxysteroid dehydrogenase type 1 predicts adrenal hyperandrogenism among lean women with polycystic ovary syndrome. J Clin Endocrinol Metab. 2006;91:2295-2302. [ Links ]
17. De Vane G, Czekala N, Judd H, Yen S. Circulating gonadotropins, estrogens and androgens in polycystic ovarian disease. Am J Obstet Gynecol. 1975;121:496- 500. [ Links ]
18. Nestler J, Jakubowics D. Decreases in ovarian cytochrome P450c 17 alpha activity and free testosterone after reduction on finsulin secretion in polycystic ovary syndrome. N Engl J Med. 1996;335:617-623. [ Links ]
19. Nestler J, Powers L, Matt D. A direct effect of hyperinsulinemia on serum sex hormone -binding globulin levels in obese women with the polycystic ovary syndrome. J Clin Endocrinol Metab. 2003;88:1516-1522. [ Links ]
20. Jakimiu A. Luteinizing hormone receptor, steroidogenesis acute regulatory protein, and steroidogenicc enzyme messenger ribonucleic acids are overexpressed in tecal and granulose cells from polycystic ovaries. J Clin Endocrinol Metab. 2001;86:1318-1323. [ Links ]
21. Taipanen J. A new contributing factor for polycystic ovary syndrome: the genetic variant of luteinizing hormone. J Clin Endocrinol Metab. 1999; 84:1711-5. [ Links ]
22. Wickenheisser J, Nelson-DeGrave V, Hendricks K, Legro R, Strauss J, McAllister J, et al. Retinoids and retinol differentially regulate steroid biosynthesis in ovarian theca cells isolated from normal cycling women and women with polycystic ovary syndrome. J Clin Endocrinol Metab. 2005;90:4858-4865. [ Links ]
23. Ehrhart-Bornstein M, Hinson J, Bornstein S. Intraadrenal interactions in the regulation of adrenocortical steroidogenesis. Endocr Rev. 1998;19:101-143. [ Links ]
24. Semple R, Savage D, Cochran E, Gorden P, ORahilly S. Genetic syndromes of severe insulin resistance. Endoc Rev. 2011;32:498-532. [ Links ]
25. Dunaif A. Insulin resistance and the polycystic ovary syndrome: Mechanism and implications for pathogenesis. Endocr Rev. 1997;18:774-800. [ Links ]
26. Burghen GGJ, Kitabchi A. Correlation of hyperandrogenism with hyperinsulinism in polycystic ovarian disease. J Clin Endocrinol Metab. 1980;50:113-116. [ Links ]
27. Poretsky L, Smith D, Seibe l, Pazianos A, Moses A, Flier J. Specific insulin binding sites in human ovary. J Clin Endocrinol Metab. 1984;59:809-811. [ Links ]
28. el-Roeiy A, Chen M, Roberts V, LeRoith D, Roberts C, Yen S. Expression of insulin-like growth factor-I (IGF-I) and IGF-II, and insulin receptor gene products in human ovary. J Clin Endocrinol Metab. 1993;77:1411-1418. [ Links ]
29. el-Roeiy A, Chen X, Roberts V, Shimasakai S, Ling N LD, et al. Expression of the genes encoding the insulin-like growth factors (IGF-I and II), the IGF and insulin receptors, and IGF-binding proteins-1–6 and the localization of their gene products in normal and polycystic ovary syndrome. J. Clin Endocrinol Metab. 1994;78: 1488-1496. [ Links ]
30. Goodarzi M, Chazembalk G, Azziz R. Polycystic ovary syndrome: Etiology, pathogenesis and diagnosis. Nat Rev Endocrinol. 2011;7:219-231. [ Links ]
31. Chang R, Cook-Andersen H. Disordered follicle development. Mol Cell Endocrinol. 2013;373:51-60. [ Links ]
32. Webber L, Stubb S, Strark J, Trew GH, Margara R, Hardy K, et al. Formation and early development of follicles in the polycystic ovary. Lancet. 2003;362:1017-1021. [ Links ]
33. Maciel G, Baracat E, Benda J, Markham S, Hensinger K, Chang R, et al. Stockpiling of transitional and classic primary follicles in ovaries of women with polycystic ovary syndrome. J Clin Endocrinol Metab. 2004;89:5321-5327. [ Links ]
34. Webber L, Stubbs S, Stark J, Margara R, Trew G, et al. Prolonged survival in culture of preantral follicles from polycystic ovaries. J Clin Endocrinol Metab. 2007;92:1975-1978. [ Links ]
35. Teixeira-Filho F, Baracat E, Lee T, Suh C, Matsui M, Chang RJ, et al. Aberrant expression of growth differentiation factor -9 in oocytes with polycystic ovary syndrome. J Clin Endocrinol Met. 2002;87:1337-1344. [ Links ]
36. Weenen C, Laven J, Von Bergh A, Cranfield M, Groome N, Visser JA, et al. Anti-Mullerian hormone expression pattern in the human ovary: Potential implications for initial and cyclic follicle recruitment. Mol Hum Reprod. 2004;10:77-83. [ Links ]
37. Stubbs S, Hardy K, Da Silva-Buttkus P, Webber L, Flanagan AM , Themmen AP, et al. Anti-mullerian hormone protein expression is reduced during the initial stages of follicle development in human polycystic ovaries. J Clin Endocrinol Metab. 2005;90:5536-5543. [ Links ]
38. Pellatt L, Hanna L, Brincat M, Galea R, Brain H, Whitehead S, et al. Granulosa cell production of anti-Mullerian hormone is increased in polycystic ovaries. J Clin Endocrinol Metab. 2007;92:240-245. [ Links ]
39. Rosenfield R. Antimüllerian hormone levels are independently related to ovarian hyperandrogenism and polycystic ovaries. Fertility and Sterility. 2012;98:242. [ Links ]
40. Dunaif A. The effects of continuous androgen secretion on the hypothalamic-pituitary axis in women: Evidence from a luteinized thecoma of ovary. J Clin Endocrinol Metab. 1984;59:389-393. [ Links ]
41. Vendola K, Zhou J, Adesanya O, Weil S, Bondy C. Androgens stimulate early stages of follicular growth in the primate ovary. J Clin Invest. 1998;101:2622– 2629. [ Links ]
42. Franks S, Stark J, Hardy K. Follicle dynamics and anovulation in polycystic ovary syndrome. Hum Reprod Update. 2008;14:376-378. [ Links ]
43. Kaiser U, Sabbagh E, Katzenellenbogen R, Conn P, Chin W. A mechanism for the differential regulation of gonadotropin subunit gene expression by gonadotropin -releasing hormone. Proc Natl Acad Sci USA. 1995;92:12280-12284. [ Links ]
44. Coffler M, Patel K, Dahan M, Malcom P, Kawashima T, Deutsch RC. Evidence for abnormal granulosa cell responsiveness to follicle stimulatin hormone FSH in women with polycystic ovary syndrome. J Clin Endocrinol Metab. 2003;88:1742-1747. [ Links ]
45. Nelson V, Legro R, Strauss J, McAllister J. Augmented androgen production is a stable sterodoigenic phenotype of propagated theca cells from polycystic ovaries. Mol Endocrinol. 1999;13:946-957. [ Links ]
46. Wachs D, Coffler M, Malcom P, Chang R. Comparison of follicle-stimulating-hormonestimulated inhibin and estradiol responses as indicators of granulosa cell function in polycystic ovary syndrome and normal women. J Clin Endocrinol Metab. 2006;91:2920- 2925. [ Links ]
47. Ehrman D, Barnes R, Rosenfield R, Cavaghan M, Imperial J. Prevalence of impaired glucose tolerance and diabetes in polycystic ovary syndrome. Diabetes. 1999;22:141-146. [ Links ]
48. Legro R, Kunselman A, Dodson W, Dunaif A. Prevalence and predictors of risk for type 2 diabetes mellitus and impaired glucosa tolerance in polycystic ovary syndrome. J Clin Endocrinol Metab. 1999;84:165-169. [ Links ]
49. Moran L, Misso M, Wild R, Norman R. Impaired glucose tolerance, type 2 diabetes and metabolic syndrome in polycystic ovary syndrome: A sistematic review and meta-analysis. Human Reprod Update. 2010;16:347-363. [ Links ]
50. Chang R, Nakamura R, Judd H, Kaplan S. Insulin resistance in non-obese patientes with polycystic ovarian disease. J Clin Endocrinol Metab. 1983;57:356-359. [ Links ]
51. Gambineri A, Patton L, Altieri P. Polydystic ovary syndrome is a risk factor for type 2 diabetes: Results from a long -term prospective study. Diabetes. 2012;61:2369-2374. [ Links ]
52. Dunaif A, Segal K, Futterweit W, Dobriansky A. Profound peripheral insulin resistance, independent of obesity in polycystic ovary syndrome. Diabetes. 1989;38:1164-1174. [ Links ]
53. Good C TM, Mauger D, Demers L, Legro R. Bone mineral density and body composition in lean women with polycystic ovary syndrome. Fertil Steril. 1999;72:21-25. [ Links ]
54. Stepto NK, Cassar S, Joham AE, Hutchison SK, Harrison CL, Goldstein RF, et al. Women with polycystic ovary syndrome have intrinsic insulin resistance on euglycemic hiperinsulinemic clamp. Human Reprod. 2013;28:777-784. [ Links ]
55. Holte J, Bergh T, Berne C, Berglund L, Lithell H. Enhanced early insulin response to glucose in relation to insulin resistance in women with polycystic ovary syndrome and normal glucose tolerance. J Clin Endocrinol Metab. 1994;78:1052-1058. [ Links ]
56. Gennarell G, Rovei V, Novi R. Preserved insulin sensitivity and beta cell activity, but decreased glucose effectiveness in normal -weight women with the polycystic ovary syndrome. J Clin Endocrinol Metab. 2005;90:3381-3386. [ Links ]
57. Owen P, Mollwe J, Ingersley H. Normal basal and insulin-stimulated fuel metabolism in lean women with the polycystic ovary syndrome. J Clin Endocrinol Metab. 1993;77:1636-1640. [ Links ]
58. Vrbiková J, Cibula D, Dvoráková K. Insulin sensitivity in women with polycystic ovary syndrome. J Clin Endocrinol Metab. 2004;89:2942-2945. [ Links ]
59. Baillargeon J, Carpentier A. Role of insulin in the hyperandrogenemia of lean women with polycystic ovary syndrome and normal insulin sensitivity. Fertil Steril. 2007;88:886-893. [ Links ]
60. Nestler J, Powers L, Matt D. A direct effect of hyperinsulinemia on serum hormone-binding globulin levels in obese women with the polycystic ovary syndrome. J Clin Endocrinol Metab. 1991;72:83-89. [ Links ]
61. Duleba A, Spaczynski R, Olive D. Insulin and insulin-like growth factor I stimulate the proliferation of ovarian theca -intersticial cells. Fertility Steril. 1998;69:335-340. [ Links ]
62. Irani M, Merhi Z. Role of vitamin D in ovarian physiology and its implication in reproduction: A systematic review. Fertil Steril. 2014;102:460-468. [ Links ]
63. Li HW, Brereton RE, Anderson RA, Wallace AM, Ho CK. Vitamin D deficiency is common and associated with metabolic risk factors in patients with polycystic ovary syndrome. Metabolism. 2011;60:1475-1481. [ Links ]
64. Wehr E, Pieber TR, Obermayer-Pietsch B. Effect of vitamin D3 treatment on glucose metabolism and menstrual frequency in polycystic ovary syndrome women: A pilot study. J Endocrinol Invest. 2011;4:757-763. [ Links ]
65. Merhi Z. Advanced glycation end products and their relevance in female reproduction. Hum Reprod. 2013;29:135-145. [ Links ]
66. Diamanti-Kandarakis E, Katsikis I, Piperi C, Kandaraki E, Piouka A, Papavassiliou AG, et al. Increased serum advanced glycation end-products is a distinct finding in lean women with polycystic ovary syndrome (PCOS). Clin Endocrinol (Oxf). 2008;69:634-641. [ Links ]
67. Irani M, Minkoff H, Seifer DB, Merhi Z. Vitamin D increases serum levels of the soluble receptor for advanced glycation end products in women with PCOS. J Clin Endocrinol Metab. 2014;99:E886-90. [ Links ]
68. Bahar E, Karadeniz M, Turan G. Fetal programming of polycystic ovary syndrome. World J Diabetes. 2015;6:936-942. [ Links ]
69. Diamanti-Kandarakis E, Dunaif A. Insulin Resistance and the Polycystic Ovary Syndrome Revisited: An Update on Mechanisms and Implications. Endocrine Reviews, December. 2012;33:981-1030. [ Links ]^rND^sDumesic^nD^rND^sOberfield^nS^rND^sSteiner-Victorin^nE^rND^sMarshal^nJ^rND^sMortensen^nM^rND^sEhrmann^nD^rND^sLittlejohn^nE^rND^sRosenfield^nR^rND^sTaylor^nA^rND^sMcCourt^nB^rND^sMartin^nK^rND^sAnderson^nE^rND^sAdams J^nSD^rND^sSchoenfeld^nDA^rND^sRosenfield^nR^rND^sRosenfield^nR^rND^sBordini^nB^rND^sJonard^nS^rND^sDewailly^nD^rND^sEhrmann^nD^rND^sBarnes^nR^rND^sRosenfield^nR^rND^sFutterweit^nW^rND^sDeligdisch^nL^rND^sPache^nT^rND^sChadha^nS^rND^sGooren^nL^rND^sHop^nW^rND^sJaarsma^nK^rND^sDommerholt^nH^rND^sRosenfield^nR^rND^sLegro^nR^rND^sArslanian^nS^rND^sEhrmann^nD^rND^sRosenfield^nRL^rND^sGhai^nK^rND^sEhrmann^nDA^rND^sBarnes^nRB^rND^sCadagan^nR^rND^sKhan R^nSA^rND^sRosenfield^nR^rND^sMathew^nR^rND^sNajjar^nJ^rND^sLorenz^nR^rND^sMayes^nD^rND^sRussell^nW^rND^sGambineri^nA^rND^sVicennati^nV^rND^sGenghini^nS^rND^sDe Vane^nG^rND^sCzekala^nN^rND^sJudd^nH^rND^sYen^nS^rND^sNestler^nJ^rND^sJakubowics^nD^rND^sNestler^nJ^rND^sPowers^nL^rND^sMatt^nD^rND^sJakimiu^nA^rND^sTaipanen^nJ^rND^sWickenheisser^nJ^rND^sNelson-DeGrave^nV^rND^sHendricks^nK^rND^sLegro^nR^rND^sStrauss^nJ^rND^sMcAllister^nJ^rND^sEhrhart-Bornstein^nM^rND^sHinson^nJ^rND^sBornstein^nS^rND^sSemple^nR^rND^sSavage^nD^rND^sCochran^nE^rND^sGorden^nP^rND^sORahilly^nS^rND^sDunaif^nA^rND^sBurghen^nGGJ^rND^sKitabchi^nA^rND^sPoretsky^nL^rND^sSmith^nD^rND^sSeibe^nl^rND^sPazianos^nA^rND^sMoses^nA^rND^sFlier^nJ^rND^sel-Roeiy^nA^rND^sChen^nM^rND^sRoberts^nV^rND^sLeRoith^nD^rND^sRoberts^nC^rND^sYen^nS^rND^sel-Roeiy^nA^rND^sChen^nX^rND^sRoberts^nV^rND^sShimasakai^nS^rND^sLing N^nLD^rND^sGoodarzi^nM^rND^sChazembalk^nG^rND^sAzziz^nR^rND^sChang^nR^rND^sCook-Andersen^nH^rND^sWebber^nL^rND^sStubb^nS^rND^sStrark^nJ^rND^sTrew^nGH^rND^sMargara^nR^rND^sHardy^nK^rND^sMaciel^nG^rND^sBaracat^nE^rND^sBenda^nJ^rND^sMarkham^nS^rND^sHensinger^nK^rND^sChang^nR^rND^sWebber^nL^rND^sStubbs^nS^rND^sStark^nJ^rND^sMargara^nR^rND^sTrew^nG^rND^sTeixeira-Filho^nF^rND^sBaracat^nE^rND^sLee^nT^rND^sSuh^nC^rND^sMatsui^nM^rND^sChang^nRJ^rND^sWeenen^nC^rND^sLaven^nJ^rND^sVon Bergh^nA^rND^sCranfield^nM^rND^sGroome^nN^rND^sVisser^nJA^rND^sStubbs^nS^rND^sHardy^nK^rND^sDa Silva-Buttkus^nP^rND^sWebber^nL^rND^sFlanagan^nAM^rND^sThemmen^nAP^rND^sPellatt^nL^rND^sHanna^nL^rND^sBrincat^nM^rND^sGalea^nR^rND^sBrain^nH^rND^sWhitehead^nS^rND^sRosenfield^nR^rND^sDunaif^nA^rND^sVendola^nK^rND^sZhou^nJ^rND^sAdesanya^nO^rND^sWeil^nS^rND^sBondy^nC^rND^sFranks^nS^rND^sStark^nJ^rND^sHardy^nK^rND^sKaiser^nU^rND^sSabbagh^nE^rND^sKatzenellenbogen^nR^rND^sConn^nP^rND^sChin^nW^rND^sCoffler^nM^rND^sPatel^nK^rND^sDahan^nM^rND^sMalcom^nP^rND^sKawashima^nT^rND^sDeutsch^nRC^rND^sNelson^nV^rND^sLegro^nR^rND^sStrauss^nJ^rND^sMcAllister^nJ^rND^sWachs^nD^rND^sCoffler^nM^rND^sMalcom^nP^rND^sChang^nR^rND^sEhrman^nD^rND^sBarnes^nR^rND^sRosenfield^nR^rND^sCavaghan^nM^rND^sImperial^nJ^rND^sLegro^nR^rND^sKunselman^nA^rND^sDodson^nW^rND^sDunaif^nA^rND^sMoran^nL^rND^sMisso^nM^rND^sWild^nR^rND^sNorman^nR^rND^sChang^nR^rND^sNakamura^nR^rND^sJudd^nH^rND^sKaplan^nS^rND^sGambineri^nA^rND^sPatton^nL^rND^sAltieri^nP^rND^sDunaif^nA^rND^sSegal^nK^rND^sFutterweit^nW^rND^sDobriansky^nA^rND^sGood C^nTM^rND^sMauger^nD^rND^sDemers^nL^rND^sLegro^nR^rND^sStepto^nNK^rND^sCassar^nS^rND^sJoham^nAE^rND^sHutchison^nSK^rND^sHarrison^nCL^rND^sGoldstein^nRF^rND^sHolte^nJ^rND^sBergh^nT^rND^sBerne^nC^rND^sBerglund^nL^rND^sLithell^nH^rND^sGennarell^nG^rND^sRovei^nV^rND^sNovi^nR^rND^sOwen^nP^rND^sMollwe^nJ^rND^sIngersley^nH^rND^sVrbiková^nJ^rND^sCibula^nD^rND^sDvoráková^nK^rND^sBaillargeon^nJ^rND^sCarpentier^nA^rND^sNestler^nJ^rND^sPowers^nL^rND^sMatt^nD^rND^sDuleba^nA^rND^sSpaczynski^nR^rND^sOlive^nD^rND^sIrani^nM^rND^sMerhi^nZ^rND^sLi^nHW^rND^sBrereton^nRE^rND^sAnderson^nRA^rND^sWallace^nAM^rND^sHo^nCK^rND^sWehr^nE^rND^sPieber^nTR^rND^sObermayer-Pietsch^nB^rND^sMerhi^nZ^rND^sDiamanti-Kandarakis^nE^rND^sKatsikis^nI^rND^sPiperi^nC^rND^sKandaraki^nE^rND^sPiouka^nA^rND^sPapavassiliou^nAG^rND^sIrani^nM^rND^sMinkoff^nH^rND^sSeifer^nDB^rND^sMerhi^nZ^rND^sBahar^nE^rND^sKaradeniz^nM^rND^sTuran^nG^rND^sDiamanti-Kandarakis^nE^rND^sDunaif^nA^rND^1A01^nLiliana^sFung^rND^1A01^nLiliana^sFung^rND^1A01^nLiliana^sFung
Diagnóstico clínico y bioquímico del síndrome de ovario poliquístico
Dra. Liliana Fung
Médico Internista – Endocrinóloga. Directora del Posgrado de Endocrinología HUC-UCV. Jefe del Servicio de Endocrinología HUC
El síndrome de ovario poliquístico (SOP) se ha definido utilizando diversos criterios (1-4), en el Cuadro 1 se comparan los criterios de diferentes sociedades científicas. No obstante, hay un acuerdo general en que el diagnóstico de SOP debe basarse en la presencia de al menos dos de los tres criterios siguientes: hiperandrogenismo clínico (síntomas y signos del exceso de andrógenos) o bioquímico (hiperandrogenemia), anovulación crónica y morfología de ovarios poliquísticos (5-6). Todos los consensos indican que para diagnosticar correctamente SOP, se deben descartar otras endocrinopatías que imitan SOP (1).
En base a los criterios del NIH (National Health Institute), Rotterdam y AES/PCOS (Androgen Exceso and PCO Society), se describen una gran variedad de posibles fenotipos de este síndrome (A hasta la J) (6) (Cuadro 2). El tercer Consenso de SOP patrocinado por ESHRE/ASMR (European Society of Human Reproduction and Embryology/ American Society for Reproductive Medicine) (7) realizado en Ámsterdam, recomienda que los principales trastornos metabólicos deben ser abordados en la evaluación diagnóstica, definiendo el fenotipo de SOP en cada paciente.
El NIH en el año 2012 (6), propone asignar una nomenclatura que refleje la compleja interacción metabólica, hipotalámica, hipofisaria, ovárica y adrenal que caracteriza al síndrome y sus implicaciones reproductivas.
En este consenso se recomienda mantener los criterios diagnósticos de Rotterdam (que incluyen el clásico del NIH y los criterios de la AES/PCOS), establecen los siguientes cuatro fenotipos de SOP:
1. Hiperandrogenismo (clínico y/o bioquímico) + disfunción ovulatoria.
2. Hiperandrogenismo (clínico y/o bioquímico) + morfología de ovario poliquístico.
3. Disfunción ovulatoria + morfología de ovario poliquístico.
4. Hiperandrogenismo (clínico y/o bioquímico) + disfunción ovulatoria + morfología de ovario poliquístico.
La presentación clínica del síndrome varía ampliamente y también depende de la etapa de la vida de la mujer en la que se presente. Las mujeres adultas con SOP buscan atención médica principalmente por los trastornos menstruales, manifestaciones clínicas del hiperandrogenismo, infertilidad, aumento de peso y alteraciones psicológicas (6,8). Este síndrome también se asocia con trastornos metabólicos, incluyendo diabetes mellitus tipo 2 (DM tipo 2).
Se debe realizar una historia clínica detallada que incluya: 1.Interrogatorio: Inicio y progresión de las manifestaciones clínicas, estilo de vida, peso, historia reproductiva, antecedentes de pubarquia prematura, síndrome metabólico (SM), uso de fármacos 2. Antecedentes familiares: SOP, hirsutismo, infertilidad, DM tipo 2, obesidad, SM 3. Examen físico: presión arterial (PA), índice de masa corporal (IMC), circunferencia de cintura (CC), signos de hiperandrogenismo, acantosis nigricans.
Se recomienda evaluación exhaustiva de la presencia de los criterios diagnósticos excluyendo otras causas de hiperandrogenismo y/o anovulación, estas incluyen: hiperplasia adrenal congénita no clásica, síndrome de Cushing, tumor productor de andrógenos (ovárico o suprarrenal), exceso de andrógenos inducido por fármacos; además, se debe evaluar disfunción ovulatoria por otras causas, como: disfunción tiroidea, hiperprolactinemia, así como embarazo en las mujeres en edad reproductiva (1).
EVALUACIÓN CLÍNICA Y BIOQUÍMICA DEL SOP
1. HIPERANDROGENISMO
1.1 MANIFESTACIONES CLÍNICAS:
En las mujeres adultas el hirsutismo, la alopecia y el acné son buenos sustitutos del hiperandrogenismo bioquímico y deben considerarse como indicativos de una condición de exceso de producción de andrógenos (5). El hirsutismo es el signo clínico más importante de hiperandrogenismo (5) y está presente en aproximadamente 70 % de las pacientes con SOP (7). El hirsutismo se define como el crecimiento excesivo de pelo terminal (vello largo, grueso, pigmentado) en la mujer siguiendo un patrón masculino de distribución, en zonas andrógeno- dependientes (9-11). El hirsutismo debe distinguirse de la hipertricosis (12), que es un crecimiento excesivo del vello en cualquier parte del cuerpo (independiente del estímulo androgénico) en relación con la cantidad esperada para una persona de la misma edad, raza y sexo. Típicamente, la aparición de hirsutismo en el SOP ocurre después de la menarquía, se desarrolla en forma gradual y aumenta con el incremento de peso (5).
La raza y etnia afectan la densidad inicial de unidades pilosebáceas y su capacidad de respuesta a los andrógenos y otras hormonas lo que da lugar a diferencias en la distribución y densidad del pelo terminal en mujeres con SOP (13). Las diferencias étnicas son las principales determinantes de la presencia de hirsutismo, así como del acné y la alopecia (14). De tal forma que hay pacientes sin hirsutismo o hirsutismo leve que tienen aumentado los niveles de testosterona, mientras que otras con hirsutismo significativo pueden tener niveles normales o solo ligeramente aumentados.
El estándar de oro para la evaluación del hirsutismo es la escala modificada de Ferriman- Gallwey (FGm) (15). Sin embargo, su valor está limitado por su naturaleza subjetiva y la variabilidad entre observadores no puede ser eliminada por completo (9,16). Las sugerencias para disminuir la variabilidad incluyen solicitar a las pacientes no utilizar láser o electrólisis durante al menos 3 meses, no depilarse durante al menos 4 semanas y evitar el afeitado durante al menos 5 días antes del examen (15). Por medio de esta escala se asignan puntuaciones que van del 0 al 4 en 9 áreas del cuerpo: labio superior, mentón, tórax, espalda superior e inferior, abdomen superior e inferior, brazos y muslos (9). Una puntuación de 0 se da en ausencia de crecimiento de pelo terminal y un valor de 4 puntos para el crecimiento extensivo. El punto de corte diagnóstico según FGm varía en función de la raza y etnia (9,17). Si este punto de corte no está disponible, se ha sugerido que un valor de FGm ≥ 8 puede aplicarse a mujeres blancas y negras, mientras que para las mujeres del lejano oriente y del sudeste asiático el punto de corte se reduce a ≥ 3 (9). El hirsutismo se clasifica como leve hasta una puntuación de 15, moderado de 16 a 25, y severo por encima de 25.
El acné también puede ser un marcador de hiperandrogenismo, pero es menos frecuente en el SOP y menos específico que el hirsutismo (8). Cuando el acné persiste después de la adolescencia o se exacerba a mediados de los 20 o 30 años, la hiperandrogenemia es común, y el acné puede ser considerado como un signo clínico de hiperandrogenismo (5). Aproximadamente 15 % -30 % de las mujeres adultas con SOP presentan acné (18,19). La diferencia en la prevalencia de hirsutismo y acné puede ser atribuido a la diferencia en la expresión de 5α-reductasa en la glándula sebácea y el folículo piloso, dando como resultado mayor dihidrotestosterona (DHT) en el folículo piloso (20). Las mujeres que presentan acné severo, acné de inicio tardío o acné persistente y resistente a las terapias convencionales tienen más probabilidad de tener SOP (21).
El patrón de alopecia en mujeres con hiperandrogenismo es variable. En el ciclo normal del pelo, la fase anágena o de crecimiento tiene una duración de 2 a 3 años y representa el 85 %-90 % de los pelos del cuero cabelludo. En el contexto de exceso de andrógenos, los folículos pilosos sensibles a los andrógenos tienen acortamiento de la fase anágena (5). En mujeres con hiperandrogenemia la alopecia afecta fundamentalmente el vértex y las regiones fronto-temporales, siendo más difusa que la del varón (22). Las pacientes con hiperandrogenemia más grave pueden experimentar pérdida de cabello bitemporal y de la línea de implantación frontal (23). La alopecia puede ser calificada por métodos subjetivos bien conocidos, tales como la escala de Ludwig (24).
En pacientes que se presentan con hiper- androgenismo de aparición súbita, rápidamente progresivo o con signos de virilización (hirsutismo severo, patrón masculino de la disposición del cabello, hipotrofia mamaria, aumento de la masa muscular, voz ronca y clitoromegalia), se debe evaluar la presencia de una fuente androgénica tumoral (25).
El aumento de sudoración y la seborrea, aunque aumentan con el exceso de andrógenos, son difíciles de valorar y no se usan como signos de hiperandrogenismo (22).
1.2 LABORATORIO
La pregunta de cuál o cuáles andrógenos deben determinarse para el diagnóstico de SOP sigue siendo controversial (5). La testosterona es el principal andrógeno activo circulante, y la concentración total de testosterona sérica es la recomendación de primera línea para evaluar el exceso de andrógenos en la mujer (26). La concentración de testosterona también puede ser crucial en la identificación de los tumores productores de andrógenos, aunque la historia clínica de una rápida progresión y aparición de signos de virilización es generalmente útil para sugerir una fuente tumoral de exceso de andrógenos o hipertecosis (25).
Idealmente la evaluación de la concentración de testosterona libre (TL) es más sensible que la medición de TT para establecer la existencia de exceso de andrógenos (4). Sin embargo, las mediciones de TL requieren técnicas de diálisis en equilibrio, muchos laboratorios comerciales utilizan radioinmunoensayo (RIA), que es notoriamente inexacto (27,28). En consecuencia, si la calidad del ensayo de TL no es la adecuada, puede ser preferible calcular la TL a través de la fórmula de Vermeulen (29) a partir de los valores de TT, globulina transportadora de hormonas sexuales (SHBG), utilizando una concentración de albúmina estándar de 43 g/L. La TL calculada tiene una buena concordancia y correlación con la TL, medida por diálisis en equilibrio (29).
Un parámetro indirecto de la TL (30), el índice de andrógenos libres (IAL), calculado por la relación entre la TT y SHBG es posiblemente la medida más sensible y sencilla para la evaluación de la hiperandrogenemia en el SOP (4) y se prefiere en gran medida. El IAL se calcula por la siguiente fórmula: 100 x [TT] / [SHBG] (el resultado se expresa en nmol/L) (31); para convertir [TT] de ng/mL a nmol/L se debe multiplicar el valor de TT x 0,003467.
Una concentración baja de SHBG ha demostrado tener excelente precisión para el diagnóstico de SOP en los estudios epidemiológicos, incluso superior a las mediciones de las concentraciones séricas de andrógenos (32), y además es un marcador sustituto de la resistencia a la insulina (RI) y el exceso de andrógenos que predice la susceptibilidad a desarrollar SM y diabetes gestacional en pacientes con SOP (32-36). Se ha encontrado que polimorfismos en el gen que codifica la SHBG pueden estar asociados con la reducción de sus niveles en el SOP, independientemente de los efectos de la RI y la obesidad (37,38).
El valor de la determinación de otros andrógenos en pacientes con SOP es relativamente bajo (5). Aunque los niveles de dehidroepiandrosterona sulfato (DHEAS) se incrementan en aproximadamente 30 %
-35 % de las pacientes con SOP (39), su medición no contribuye significativamente al diagnóstico, y en la mayoría de los pacientes los valores de TL y TT también se incrementan (39,40). De hecho, se ha estimado que solo el 5 % de las pacientes con SOP tienen exclusivamente aumento de DHEAS (39). Existe cierta evidencia de que la androstenediona también es un marcador sensible y específico de hiperandrogenismo en estas pacientes (41), sin embargo, la mayor disponibilidad de métodos más sensibles y específicos para testosterona ha dado lugar a una mayor utilización de la misma en el diagnóstico del SOP. La medición de androstenediona no se requiere en la práctica clínica (5).
1.2.1 MÉTODO QUE DEBE SER UTILIZADO
Se recomienda el uso de espectrometría de masas (MS) acoplada a cromatografía líquida (LC) (LC/MS) ya que tiene alta sensibilidad y especificidad (42). MS es el método de referencia en centros como el Instituto Nacional de Estándares y Tecnología y se considera que es el "estándar de oro" para la medición de una variedad de compuestos (5). Es importante mencionar que en el SOP, métodos de RIA que incorporan purificación proporcionan resultados similares (43). La medición de TL requiere técnica de diálisis en equilibrio. Si estas técnicas no están disponibles, como se comentó previamente la determinación del IAL puede ser preferible en la práctica clínica (5). En conclusión, el médico debe estar consciente de los métodos utilizados por los laboratorios y debe hacer uso de los que cuenten con LC/MS o RIA con purificación.
1.2.2 VALORES DE REFERENCIA
Usando métodos de RIA convencionales con etapas de purificación, los valores normales de testosterona son generalmente < 60 ng/dL. Aunque no hay valores de referencia disponibles de testosterona en mujeres utilizando la tecnología LC/MS, la mayor especificidad de los métodos de MS podría anticipar niveles de TT inferiores (por ejemplo <50 ng/dL). Aunque los valores normales con RIA son hasta 70 a 80 ng/dL y en algunos casos 100 ng/dL; estos deben ser evitados, ya que se hace muy difícil distinguir las mujeres normales de las hiperandrogénicas (5).
2. DISFUNCIÓN OVULATORIA
2.1 MANIFESTACIONES CLÍNICAS
Todas las clasificaciones principales de SOP incluyen la disfunción ovulatoria como un componente y representa un problema clínico importante para la mayoría de las pacientes. Según reporte de AES/ SOP hasta un 85 % de las mujeres con SOP tienen evidencia clínica de irregularidades menstruales (4).
Según la nueva clasificación de la Federación Internacional de Ginecología y Obstetricia (FIGO) (44), la frecuencia normal del ciclo menstrual es de 24-38 días. Si el intervalo es >38 días (1-2 episodios en un período de 90 días) la terminología actual es sangrado menstrual infrecuente (antes conocida como oligomenorrea) y si no hay sangrado menstrual en un período de 90 días se sigue utilizando el término de amenorrea. Aproximadamente 85 %-90 % de las pacientes con sangrado menstrual infrecuente y 30 %-40 % de las mujeres con amenorrea pueden tener SOP (45).
Si los ciclos son mayores de 38 días se puede asumir que hay anovulación crónica y no se requieren pruebas especiales. Sin embargo, si la duración del ciclo es sólo ligeramente más de lo normal, o si los ciclos son ligeramente irregulares, la ovulación se debe evaluar (5). Además, cuando las pacientes son hiperandrogénicas, la posibilidad de que los ciclos aparentemente normales sean anovulatorios debe descartarse. Varios estudios han demostrado que 10 % - 15 % de las mujeres hiperandrogénicas con ciclos aparentemente normales no ovulan (46,47). Por el contrario, el hallazgo de anovulación es muy poco frecuente en mujeres normo-androgénicas con menstruaciones normales (5).
El sangrado menstrual frecuente (intervalo < 24 días, más de 4 episodios durante un período de 90 días; antes conocido como polimenorrea) y/o el sangrado menstrual abundante (antes hipermenorrea) son relativamente poco comunes en pacientes con SOP, pero cuando están presentes, pueden inducir anemia por deficiencia de hierro (5).
2.2 LABORATORIO
La determinación de progesterona sérica durante la fase lútea media (días 21 a 22) es la mejor forma de evaluar la ovulación. Mientras que las concentraciones de progesterona > 2,5 ng/mL pueden indicar ovulación, los valores ≥7 ng/mL son generalmente necesarios para una adecuada función lútea (48). Algunos investigadores han propuesto la utilización de 3 determinaciones consecutivas en la fase lútea con un valor total ≥15 ng/mL para
indicar función lútea normal (49). Alternativas a la medición de la progesterona (por ejemplo, gráficos de la temperatura basal del cuerpo, estuches comerciales para determinar hormona luteinizante (LH) urinaria o biopsia endometrial) se pueden usar, pero no dan suficiente información acerca de la fase lútea (5).
No se recomienda el uso de la relación LH y hormona foliculoestimulante (FSH) como criterio diagnóstico del SOP (25).
¿QUÉ OTROS ESTUDIOS DEBEN REALIZARSE EN LA EVALUACIÓN DEL SÍNDROME DE OVARIO POLIQUÍSTICO?
El SOP es un diagnóstico de exclusión por lo cual se deben descartar otras causas de hiperandrogenismo y/o disfunción ovulatoria. Además del SOP (que constituye la principal etiología), dentro de las causas de hiperandrogenismo en mujeres en edad reproductiva se encuentran (12,22,50):
1. Origen ovárico:
Hipertecosis
Tumor ovárico
2. Origen adrenal:
Hiperplasia adrenal congénita no clásica
Síndrome de Cushing
Síndrome de resistencia a glucocorticoides
Tumor adrenal (adenoma o carcinoma)
3. Condiciones específicas del embarazo:
Luteoma del embarazo
Hiperreactio luteinalis
Deficiencia de aromatasa en el feto
4. Otras:
Hipotiroidismo
Hiperprolactinemia
Fármacos: Danazol, testosterona y anabolizantes, ácido valproico, ciclosporina
Síndrome de HAIRAN (Hiperandrogenismo, RI, acantosis nigricans)
Hirsutismo idiopático
Las pacientes con hiperplasia adrenal congénita no clásica o tardía por déficit de 21 hidroxilasa pueden presentarse con manifestaciones del SOP (hiperandrogenismo, anovulación y morfología de ovario poliquístico) (51), por tanto la determinación de 17-hidroxiprogesterona (17OHP) debe ser siempre incluida en el estudio diagnóstico. Valores de 17OHP >10 ng/mL indican la existencia de un déficit de 21-hidroxilasa, mientras que valores entre 2 y 10 ng/mL sugieren la necesidad de realizar la prueba de estimulación con la hormona adrenocorticotrópica (ACTH) (51).
Para la toma de la muestra tanto para el cálculo del IAL (TT y SHBG), así como de la 17OHP se recomienda que sea en ayunas, en la fase folicular temprana (si tiene menstruaciones regulares) o en cualquier momento (si tiene oligo-anovulación). Si la paciente está tomando anticonceptivos hormonales, se deben suspender 3 meses antes de la toma de muestra.
El síndrome de Cushing debe ser considerado como causa de exceso de andrógenos, sin embargo, las pacientes presentan además del hiperandrogenismo y alteraciones menstruales otras manifestaciones clínicas características como: facies de luna llena, obesidad central, acumulación de grasa cervical y supraclavicular, estrías purpúreas, adelgazamiento de la piel, equimosis, debilidad muscular proximal, hipertensión arterial, alteraciones metabólicas, psiquiátricas y osteoporosis (52).
Si la historia clínica sugiere la presencia de un tumor productor de andrógenos (ovárico o suprarrenal), se debe solicitar estudios imaginológicos (ecosonograma, TAC o RMN).
La prevalencia de disfunción tiroidea en pacientes con SOP sigue siendo materia de debate. Varios estudios han demostrado una relación entre el SOP y la presencia de hipotiroidismo y anticuerpos antitiroideos (53,54). Se recomienda en todas las pacientes realizar TSH, T4L, y anticuerpos anti- tiroperoxidasa (Anti-TPO) (55).
A pesar de que la demostración de RI no es requerida para hacer el diagnóstico de SOP, está claro que la RI e hiperinsulinemia desempeñan un papel importante en la fisiopatología de este síndrome. Las pacientes con SOP tienen una alta prevalencia de sobrepeso u obesidad. La prevalencia de RI en el SOP oscila entre 50 % -70 % (56,57) y se produce independientemente de la obesidad (58).
La CC es un marcador de RI. El Grupo Latinoamericano para el estudio del síndrome metabólico (GLESMO), el cual es un grupo de trabajo de la Asociación Latinoamericana de diabetes (ALAD) determinó el punto de corte de CC a través de las curvas ROC; estableció el valor de 88 cm para las mujeres (se obtuvo un valor cercano a 90 cm pero por consenso se homologó con el de 88 cm utilizado por ATPIII) (59). Es importante evaluar la presencia de signos asociados a RI como acantosis nigricans (lesión cutánea caracterizada por la presencia de hiperqueratosis e hiperpigmentación por lo general en las superficies intertriginosas y cuello) y acrocordones (formaciones tipo fibromas blandos en las regiones antes mencionadas) (60).
Aunque marcadores de RI, tales como la relación de glucosa e insulina en ayunas y el modelo homeostático de resistencia a la insulina (HOMA-IR), han demostrado una alta sensibilidad y especificidad en algunos estudios, informes más extensos han demostrado que estas medidas carecen de precisión para la definición de RI (61).
Los componentes del SM están asociados con RI, en vista de que actualmente no existe consenso para evaluar la RI en el SOPy que los marcadores no definen con exactitud la misma, la guía de la Asociación Americana de Endocrinólogos clínicos (AACE), el Colegio Americano de Endocrinología (ACE) y AES/PCOS (62) recomiendan en todas las pacientes con SOP evaluar la presencia de los componentes del SM: CC, hipertensión arterial, lípidos (HDL- colesterol y triglicéridos) alteraciones de la glucosa (prediabetes o diabetes mellitus tipo 2), así como también enfermedad hepática grasa no alcohólica. Se debe realizar prueba de tolerancia a la glucosa oral (PTGO: Glucemia basal y 2 horas pos-carga 75 g de glucosa oral) en todas las pacientes con SOP.
Los datos disponibles sugieren que la apnea obstructiva del sueño (AOS) es más común en las mujeres obesas con SOP en comparación con la población general (63). En caso de sospecha clínica, las pacientes deben ser referidas para evaluación y estudios.
Por otra parte, la prevalencia de depresión y ansiedad es mayor en las pacientes con SOP que en la población general (64). También se describen trastorno bipolar y alteraciones de la conducta alimentaria (8). Además del hirsutismo, acné, alteraciones menstruales, infertilidad y aumento de peso, los trastornos psicológicos pueden tener un vínculo específico con el SOP, por tanto, es importante que la función psicológica y la calidad de vida deban ser evaluadas en todas las pacientes con SOPa través de cuestionarios apropiadamente validados y entrevistas estructuradas (25).
Por último, la hormona antimülleriana (HAM) ha surgido como un posible marcador sustituto del SOP, esta hormona es producida en el ovario por las células de la granulosa de los folículos preantrales y pequeños folículos antrales. Concentraciones elevadas de HAM en mujeres con SOPestán relacionadas con el aumento del número de folículos y la hipersecreción de células de la granulosa. Valores de HAM > 5 ng/mL pueden ser útiles como indicador de la morfología ovárica (65). A pesar de que las diferencias en los niveles circulantes de HAM según el fenotipo de SOP reflejan la heterogeneidad del síndrome, los puntos de corte para discriminar los diferentes fenotipos SOP siguen sin estar claros. En un estudio realizado por Pizzi R y col. (66) en 30 pacientes con SOP se encontró que las concentraciones de HAM se encuentran elevadas en este síndrome, en especial en pacientes con ciclos anovulatorios. En consecuencia, si bien parece prometedor el uso de HAM en el diagnóstico y pronóstico del SOP, actualmente no se recomienda su uso rutinario en la práctica clínica (62).
CONCLUSIONES
Para el diagnóstico de SOP, se recomienda el uso de los criterios de Rotterdam, con la específicación del fenotipo (NIH 2012). Se deben excluir otras causas de hiperandrogenismo y/o disfunción ovulatoria.
Existe la necesidad de una evaluación exhaustiva tanto clínica como de laboratorio, con especial énfasis en la precisión y validez de la metodología utilizada para las determinaciones bioquímicas.
Las mujeres con SOP generalmente acuden a evaluación debido a los trastornos menstruales, manifestaciones clínicas del hiperandrogenismo, infertilidad, aumento de peso y alteraciones psicológicas.
Se debe realizar una historia clínica detallada que incluya: 1.Interrogatorio: Inicio y progresión de las manifestaciones clínicas, estilo de vida, peso, historia reproductiva, antecedentes de pubarquia prematura, SM, uso de fármacos 2. Antecedentes familiares: SOP, hirsutismo, infertilidad, DM2, obesidad, SM 3. Examen físico: PA, IMC, CC, signos de hiperandrogenismo, acantosis nigricans, acrocordones. La presencia o ausencia de: galactorrea, signos de virilización y características cushingoides deben tenerse en cuenta.
La pregunta de cuál andrógeno debe determinarse para el diagnóstico de SOP sigue siendo controversial. La determinación de TT debe realizarse utilizando LC/MS. La TL es más sensible que la medición de TT para establecer la existencia de exceso de andrógenos, sin embargo, requiere técnica de diálisis en equilibrio que no está disponible en muchos laboratorios. En consecuencia, si la calidad del ensayo de TL no es la adecuada, se recomienda el uso del IAL. El valor diagnóstico de otros andrógenos (DHEAS, androstenediona) en pacientes con SOP es relativamente bajo.
Además de la determinación androgénica, como parte de la evaluación del SOP se debe solicitar: 17OHP, TSH, T4L, Anti-TPO, prolactina. La realización de otros estudios dependerá de la historia clínica.
La determinación de insulina o medidas para estimar RI no son requeridas en la práctica clínica.
Se debe evaluar la presencia de los componentes del SM en todas las pacientes con SOP: CC, hipertensión arterial, lípidos (HDL-colesterol y triglicéridos) alteraciones de la glucosa (PTGO: Glucemia basal y 2 horas pos-carga 75 g de glucosa oral), así como también enfermedad hepática grasa no alcohólica.
Se recomienda evaluar la función psicológica y calidad de vida de estas pacientes a través de cuestionarios apropiadamente validados y entrevistas estructuradas.
La HAM ha surgido como un posible marcador diagnóstico del SOP, sin embargo, actualmente no se recomienda su uso rutinario en la práctica clínica.
REFERENCIAS
1. Zawadski JK, Dunaif A. Diagnostic criteria for polycystic ovary syndrome; towards a rational approach. En: Dunaif A, Givens JR, Haseltine F, editores. Polycystic Ovary Syndrome. Boston: Blackwell Scientific; 1992.p.377-384. [ Links ]
2. The Rotterdam ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome (PCOS). Hum Reprod. 2004;19:41-47. [ Links ]
3. Azziz R, Carmina E, Dewailly D, Diamanti-Kandarakis E, Escobar-Morreale HF, Futterweit W, et al. Positions statement: Criteria for defining polycystic ovary syndrome as a predominantly hyperandrogenic syndrome: An Androgen Excess Society guideline. J Clin Endocrinol Metab. 2006;91:4237-4245. [ Links ]
4. Azziz R, Carmina E, Dewailly D, Diamanti-Kandarakis E, Escobar-Morreale HF, Futterweit W, et al. The Androgen Excess and PCOS Society criteria for the polycystic ovary syndrome: The complete task force report. Fertil Steril. 2009;91:456-488. [ Links ]
5. Goodman NF, Cobin RH, Futterweit W, Glueck JS, Legro RS, Carmina E. American Association of Clinical Endocrinologists, American College of Endocrinology, and Androgen Excess and PCOS Society Disease State Clinical Review: Guide to the best practices in the evaluation and treatment of Polycystic Ovary Syndrome – Part 1. Endocr Pract 2015;21:1291-1300. [ Links ]
6. Final Report National Institute of Health. Evidencebased Methodology Workshop on Polycystic Ovary Syndrome. 2012 Expert Panel Guidelines on PCOS. https://prevention.nih.gov/docs/programs/pcos/ FinalReport.pdf. Accessed December 3-5, 2012. [ Links ]
7. Fauser BC, Tarlatzis BC, Rebar RW, Legro RS, Balen AH, Lobo R, et al. Consensus on womens health aspects of polycystic ovary syndrome (PCOS): The Amsterdam ESHRE/ASRM-Sponsored 3rd PCOS Consensus Workshop Group. Fertil Steril 2012;97:28- 38. [ Links ]
8. Sirmans SM, Pate KA. Epidemiology, diagnosis, and management of polycystic ovary syndrome. Clin Epidemiol. 2013;6:1-13. [ Links ]
9. Escobar-Morreale HF, Carmina E, Dewailly D, Gambineri A, Kelestimur F, Moghetti P, et al. Epidemiology, diagnosis and management of hirsutism: a consensus statement by the Androgen Excess and Polycystic Ovary Syndrome Society. Hum Reprod Update. 2012;18:146-170. [ Links ]
10. Hatch R, Rosenfield RL, Kim MH, Tredway D. Hirsutism: Implications, etiology, and management. Am J Obstet Gynecol. 1981;140:815-830. [ Links ]
11. Sanchez LA, Perez M, Azziz R. Laser hair reduction in the hirsute patient: A critical assessment. Hum Reprod Update. 2002;8:169-181. [ Links ]
12. Unluhizarci K, Kaltsas G, Kelestimur F. Non polycystic ovary syndrome-related endocrine disorders associated with hirsutism. Eur J Clin Invest. 2012;42:86-94. [ Links ]
13. Dumesic DA, Oberfield SE, Stener-Victorin E, Marshall JC, Laven JS, Legro RS. Scientific Statement on the Diagnostic Criteria, Epidemiology, Pathophysiology, and Molecular Genetics of Polycystic Ovary Syndrome. Endocr Rev. 2015;36:487-525. [ Links ]
14. Rosenfield RL, Deplewski D. Role of androgens in the developmental biology of the pilosebaceous unit. Am J Med. 1995;98:80S-88S. [ Links ]
15. Yildiz BO, Bolour S, Woods K, Moore A, Azziz R. Visually scoring hirsutism. Hum Reprod Update 2010;16:51-64. [ Links ]
16. Hatch R, Rosenfield RL, Kim MH, Tredway D. Hirsutism: Implications, etiology, and management. Am J Obstet Gynecol 1981;140:815-830. [ Links ]
17. Zhao X, Ni R, Li L, Mo Y, Huang J, Huang M, et al. Defining hirsutism in Chinese women: A crosssectional study. Fertil Steril. 2011;96:792-796. [ Links ]
18. Azziz R, Sanchez LA, Knochenhauer ES, Moran C, Lazenby J, Stephens KC, et al. Androgen excess in women: experience with over 1000 consecutive patients. J Clin Endocrinol Metab. 2004;89:453-462. [ Links ]
19. Wijeyaratne CN, Balen AH, Barth JH, Belchetz PE. Clinical manifestations and insulin resistance (IR) in polycystic ovary syndrome (PCOS) among south Asians and Caucasians: Is there a difference? Clin Endocrinol (Oxf). 2002;57:343-350. [ Links ]
20. Lowenstein E. Diagnosis and management of the dermatologic manifestations of the polycystic ovary syndrome. Dermatol Ther. 2006;19:210-223. [ Links ]
21. Zouboulis CC. Acne as a chronic systemic disease. Clin Dermatol. 2014;32:389-396. [ Links ]
22. Escobar-Morreale HF, Alpañés Buesa M, Álvarez Blasco F, Luque Ramírez M. Hiperandrogenismo y síndrome de ovario poliquístico. Medicine. 2012;11:895-903. [ Links ]
23. Goodman NF, Bledsoe MB, Cobin RH, Futterweit W, Goldzieher JW, Petak SM, et al. American Association of Clinical Endocrinologists medical guidelines for the clinical practice for the diagnosis and treatment of hyperandrogenic disorders. Endocr Pract. 2001;7:120-134. [ Links ]
24. Ludwig E. Classification of the types of androgenetic alopecia (common baldness) occurring in the female sex. Br J Dermatol. 1977;97:247-254. [ Links ]
25. Conway G, Dewailly D, Diamanti-Kandarakis E, Escobar-Morreale HF, Franks S, Gambineri A, et al. The polycystic ovary syndrome: A position statement from the European Society of Endocrinology. Eur J Endocrinol. 2014;171:p1-29. [ Links ]
26. Stanczyk FZ. Diagnosis of hyperandrogenism: Biochemical criteria. Best Pract Res Clin Endocrinol Metab. 2006;20:177-191. [ Links ]
27. Rosner W. Errors in the measurement of plasma free testosterone. J Clin Endocrinol Metab. 1997;82:2014- 2015. [ Links ]
28. Rosner W. An extraordinarily inaccurate assay for free testosterone is still with us. J Clin Endocrinol Metab. 2001;86:2903. [ Links ]
29. Vermeulen A, Verdonck L, Kaufman JM. A critical evaluation of simple methods for the estimation of free testosterone in serum. J Clin Endocrinol Metab. 1999;84:3666-3672. [ Links ]
30. Mathur RS, Moody LO, Landgrebbe S, Williamson HO. Plasma androgens and sex hormone binding globulin in the evaluation of hirsute patients. Fertil Steril. 1981;35:29-37. [ Links ]
31. Bui HN, Sluss PM, Hayes FJ, Blincko S, Knol DL, Blankenstein MA, et al. Testosterone, free testosterone, and free androgen index in women: Reference intervals, biological variation, and diagnostic value in polycystic ovary syndrome. Clin Chim Acta. 2015;450:227-232. [ Links ]
32. Bhasin S, Jasjua GK, Pencina M, DAgostino R Sr, Coviello AD, Vasan RS, et al. Sex hormonebinding globulin, but not testosterone, is associated prospectively and independently with incident metabolic syndrome in men: The Framingham Heart Study. Diabetes Care. 2011;34:2464-2470. [ Links ]
33. Glueck CJ, Morrison JA, Daniels S, Wang P, Stroop D. Sex hormone binding globulin, oligomenorrhea, polycystic ovary syndrome, and childhood insulin at age 14 years predict metabolic syndrome and class III obesity at age 24 years. J Pediatr. 2011;159:308-313. [ Links ]
34. Moran LJ, Teede HJ, Noakes M, Clifton PM, Norman RJ, Wittert GA. Sex hormone binding globulin, but not testosterone, is associated with the metabolic syndrome in overweight and obese women with polycystic ovary syndrome. J Endocrinol Invest. 2013;36:1004-1010. [ Links ]
35. Veltman-Verhulst SM, van Haeften TW, Eijkemans MJ, de Valk HW, Fauser BC, Goverde AJ. Sex hormone-binding globulin concentrations before conception as a predictor for gestational diabetes in women with polycystic ovary syndrome. Hum Reprod. 2010;25:3123-3128. [ Links ]
36. Pasquali R. Obesity and androgens: Facts and perspectives. Fertil Steril. 2006;85:1319-1340. [ Links ]
37. Hacihanefioglu B, Aybey B, Hakan Ozon Y, Berkil H, Karsidag K. Association of anthropometric, androgenic and insulin-related features with polymorphisms in exon 8 of SHBG gene in women with polycystic ovary syndrome. Gynecol Endocrinol. 2013;29:361-364. [ Links ]
38. Wickham EP III, Ewens KG, Legro RS, Dunaif A, Nestler JE, Strauss JF III. Polymorphisms in the SHBG gene influence serum SHBG levels in women with polycystic ovary syndrome. J Clin Endocrinol Metab. 2011;96:E719-27. [ Links ]
39. Carmina E. Ovarian and adrenal hyperandrogenism. Ann N Y Acad Sci. 2006;1092:130-137. [ Links ]
40. Carmina E, Lobo RA. Prevalence and metabolic characteristics of adrenal androgen excess in hyperandrogenic women with different phenotypes. J Endocrinol Invest. 2007;30:111-116. [ Links ]
41. O'Reilly MW, Taylor AE, Crabtree NJ, Hughes BA, Capper F, Crowley RK, et al. Hyperandrogenemia predicts metabolic phenotype in polycystic ovary syndrome: The utility of serum androstenedione. J Clin Endocrinol Metab. 2014;99:1027-1036. [ Links ]
42. Vesper HW, Bhasin S, Wang C, Tai SS, Dodge LA, Singh RJ, et al. Interlaboratory comparison study of serum total testosterone [corrected] measurements performed by mass spectrometry methods. Steroids. 2009;74:498-503. [ Links ]
43. Janse F, Eijkemans MJ, Goverde AJ, Lentjes EG, Hoek A, Lambalk CB, et al. Assessment of androgen concentration in women: Liquid chromatographytandem mass spectrometry and extraction RIA show comparable results. Eur J Endocrinol. 2011;165:925- 933. [ Links ]
44. Singh S, Best C, Dunn S, Leyland N, Wolfman WL; Clinical Practice - Gynaecology Committee, et al. Abnormal uterine bleeding in pre-menopausal women. J Obstet Gynaecol Can. 2013;35:473-479. [ Links ]
45. Hart R. Definitions, prevalence and symptoms of polycystic ovaries and the polycystic ovary syndrome. En: Allahbadia GN, Agrawal R, editores. Polycystic Ovary Syndrome. Kent, UK: Anshan, Ltd; 2007.p.15- 26. [ Links ]
46. Azziz R, Waggoner WT, Ochoa T, Knochenhauer ES, Boots LR. Idiopathic hirsutism: An uncommon cause of hirsutism in Alabama. Fertil Steril. 1998;70:274- 278. [ Links ]
47. Carmina E, Lobo RA. Do hyperandrogenic women with normal menses have polycystic ovary syndrome? Fertil Steril. 1999;71:319-322. [ Links ]
48. Hull MG, Savage PE, Bromham DR, Ismail AA, Morris AF. The value of a single serum progesterone measurement in the midluteal phase as a criterion of a potentially fertile cycle (ovulation) derived from treated and untreated conception cycles. Fertil Steril. 1982;37:355-360. [ Links ]
49. Abraham GE, Maroulis GB, Marshall JR. Evaluation of ovulation and corpus luteum function using measurements of plasma progesterone. Obstet Gynecol. 1974;44:522-525. [ Links ]
50. Bajares de Lilue M, Pizzi R, Velázquez Maldonado E. Consenso Venezolano de Síndrome de Ovario Poliquístico. Rev Venez Endocrinol Metab. 2007;5:1- 76. [ Links ]
51. Carmina E. Hirsutism: Investigation and management. Expert Rev Endocrinol Metab. 2010;5:189-195. [ Links ]
52. Nieman LK, Biller BM, Findling JW, Newell-Price J, Savage MO, Stewart PM, et al. The diagnosis of Cushings syndrome: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2008;93:1526-1540. [ Links ]
53. Janssen OE, Mehlmauer N, Hahn S, Offner AH, Gärtner R. High prevalence of autoimmune thyroiditis in patients with polycystic ovary syndrome. Eur J Endocrinol. 2004;150:363-369. [ Links ]
54. Morgante G, Musacchio MC, Orvieto R, Massaro MG, De Leo V. Alterations in thyroid function among the different polycystic ovary syndrome phenotypes. Gynecol Endocrinol. 2013;29:967-969. [ Links ]
55. Calvar CE, Bengolea SV, Deutsch SI, Hermes R, Ramos G, Loyato M. High frequency of thyroid abnormalities in polycystic ovary syndrome. Medicina (B Aires). 2015;75:213-217. [ Links ]
56. Legro RS, Castracane VD, Kauffman RP. Detecting insulin resistance in polycystic ovary syndrome: Purposes and pitfalls. Obstet Gynecol Surv. 2004;59:141-154. [ Links ]
57. DeUgarte CM, Bartolucci AA, Azziz R. Prevalence of insulin resistance in the polycystic ovary syndrome using the homeostasis model assessment. Fertil Steril. 2005;83:1454-1460. [ Links ]
58. Dunaif A, Sega KR, Futterweit W, Dobrjansky A. Profound peripheral insulin resistance, independent of obesity, in polycystic ovary syndrome. Diabetes. 1989;38:1165-1174. [ Links ]
59. Rosas Guzmán J, González Chávez A, Aschner P, Bastarrachea R. Consenso Lationamericano de la Asociación Latinoamericana de Diabetes (ALAD). Epidemiología, Diagnóstico, Control, Prevención y Tratamiento del Síndrome Metabólico en Adultos. Rev ALAD 2010;18:25-44. [ Links ]
60. Fung L, Pizzi R, Centeno I, Hernández E. Resistencia a la insulina en la mujer: ¿cómo y cuándo evaluarla? Rev Obstet Ginecol Venez. 2015;75:200-211. [ Links ]
61. Diamanti-Kandarakis E, Kouli C, Alexandraki K, Spina G. Failure of mathematical indices to accurately assess insulin resistance in lean, overweight, or obese women with polycystic ovary syndrome. J Clin Endocrinol Metab. 2004;89:1273-1276. [ Links ]
62. Goodman NF, Cobin RH, Futterweit W, Glueck JS, Legro RS, Carmina E. American Association of Clinical Endocrinologists, American College of Endocrinology, and Androgen Excess and PCOS Society Disease State Clinical Review: Guide to the best practices in the evaluation and treatment of Polycystic Ovary Syndrome – Part 2. Endocr Pract 2015;21:1415-1426. [ Links ]
63. Fogel RB, Malhotra A, Pillar G, Pittman SD, Dunaif A, White DP. Increased prevalence of obstructive sleep apnea syndrome in obese women with polycystic ovary syndrome. J Clin Endocrinol Metab. 2001;86:1175- 1180. [ Links ]
64. Dokras A. Mood and anxiety disorders in women with PCOS. Steroids. 2012;77:338-341. [ Links ]
65. Dewailly D, Gronier H, Poncelet E, Robin G, Leroy M, Pigny P, et al. Diagnosis of polycystic ovary syndrome (PCOS): Revisiting the threshold values of follicle count on ultrasound and of the serum AMH level for the definition of polycystic ovaries. Hum Reprod. 2011;26:3123-3129. [ Links ]
66. Pizzi R, Centeno I, Fung L, Pérez Y, Toro F, González Y, et al. Niveles de hormona antimülleriana en pacientes con síndrome de ovario poliquístico. Rev Obstet Ginecol Venez. 2015;75:250-259. [ Links ]^rND^sZawadski^nJK^rND^sDunaif^nA^rND^sAzziz^nR^rND^sCarmina^nE^rND^sDewailly^nD^rND^sDiamanti-Kandarakis^nE^rND^sEscobar-Morreale^nHF^rND^sFutterweit^nW^rND^sAzziz^nR^rND^sCarmina^nE^rND^sDewailly^nD^rND^sDiamanti-Kandarakis^nE^rND^sEscobar-Morreale^nHF^rND^sFutterweit^nW^rND^sGoodman^nNF^rND^sCobin^nRH^rND^sFutterweit^nW^rND^sGlueck^nJS^rND^sLegro^nRS^rND^sCarmina^nE^rND^sFauser^nBC^rND^sTarlatzis^nBC^rND^sRebar^nRW^rND^sLegro^nRS^rND^sBalen^nAH^rND^sLobo^nR^rND^sSirmans^nSM^rND^sPate^nKA^rND^sEscobar-Morreale^nHF^rND^sCarmina^nE^rND^sDewailly^nD^rND^sGambineri^nA^rND^sKelestimur^nF^rND^sMoghetti^nP^rND^sHatch^nR^rND^sRosenfield^nRL^rND^sKim^nMH^rND^sTredway^nD^rND^sSanchez^nLA^rND^sPerez^nM^rND^sAzziz^nR^rND^sUnluhizarci^nK^rND^sKaltsas^nG^rND^sKelestimur^nF^rND^sDumesic^nDA^rND^sOberfield^nSE^rND^sStener-Victorin^nE^rND^sMarshall^nJC^rND^sLaven^nJS^rND^sLegro^nRS^rND^sRosenfield^nRL^rND^sDeplewski^nD^rND^sYildiz^nBO^rND^sBolour^nS^rND^sWoods^nK^rND^sMoore^nA^rND^sAzziz^nR^rND^sHatch^nR^rND^sRosenfield^nRL^rND^sKim^nMH^rND^sTredway^nD^rND^sZhao^nX^rND^sNi^nR^rND^sLi^nL^rND^sMo^nY^rND^sHuang^nJ^rND^sHuang^nM^rND^sAzziz^nR^rND^sSanchez^nLA^rND^sKnochenhauer^nES^rND^sMoran^nC^rND^sLazenby^nJ^rND^sStephens^nKC^rND^sWijeyaratne^nCN^rND^sBalen^nAH^rND^sBarth^nJH^rND^sBelchetz^nPE^rND^sLowenstein^nE^rND^sZouboulis^nCC^rND^sEscobar-Morreale^nHF^rND^sAlpañés Buesa^nM^rND^sÁlvarez Blasco^nF^rND^sLuque Ramírez^nM^rND^sGoodman^nNF^rND^sBledsoe^nMB^rND^sCobin^nRH^rND^sFutterweit^nW^rND^sGoldzieher^nJW^rND^sPetak^nSM^rND^sLudwig^nE^rND^sConway^nG^rND^sDewailly^nD^rND^sDiamanti-Kandarakis^nE^rND^sEscobar-Morreale^nHF^rND^sFranks^nS^rND^sGambineri^nA^rND^sStanczyk^nFZ^rND^sRosner^nW^rND^sRosner^nW^rND^sVermeulen^nA^rND^sVerdonck^nL^rND^sKaufman^nJM^rND^sMathur^nRS^rND^sMoody^nLO^rND^sLandgrebbe^nS^rND^sWilliamson^nHO^rND^sBui^nHN^rND^sSluss^nPM^rND^sHayes^nFJ^rND^sBlincko^nS^rND^sKnol^nDL^rND^sBlankenstein^nMA^rND^sBhasin^nS^rND^sJasjua^nGK^rND^sPencina^nM^rND^sDAgostino^nR Sr^rND^sCoviello^nAD^rND^sVasan^nRS^rND^sGlueck^nCJ^rND^sMorrison^nJA^rND^sDaniels^nS^rND^sWang^nP^rND^sStroop^nD^rND^sMoran^nLJ^rND^sTeede^nHJ^rND^sNoakes^nM^rND^sClifton^nPM^rND^sNorman^nRJ^rND^sWittert^nGA^rND^sVeltman-Verhulst^nSM^rND^svan Haeften^nTW^rND^sEijkemans^nMJ^rND^sde Valk^nHW^rND^sFauser^nBC^rND^sGoverde^nAJ^rND^sPasquali^nR^rND^sHacihanefioglu^nB^rND^sAybey^nB^rND^sHakan Ozon^nY^rND^sBerkil^nH^rND^sKarsidag^nK^rND^sWickham^nEP III^rND^sEwens^nKG^rND^sLegro^nRS^rND^sDunaif^nA^rND^sNestler^nJE^rND^sStrauss^nJF III^rND^sCarmina^nE^rND^sCarmina^nE^rND^sLobo^nRA^rND^sO'Reilly^nMW^rND^sTaylor^nAE^rND^sCrabtree^nNJ^rND^sHughes^nBA^rND^sCapper^nF^rND^sCrowley^nRK^rND^sVesper^nHW^rND^sBhasin^nS^rND^sWang^nC^rND^sTai^nSS^rND^sDodge^nLA^rND^sSingh^nRJ^rND^sJanse^nF^rND^sEijkemans^nMJ^rND^sGoverde^nAJ^rND^sLentjes^nEG^rND^sHoek^nA^rND^sLambalk^nCB^rND^sSingh^nS^rND^sBest^nC^rND^sDunn^nS^rND^sLeyland^nN^rND^sWolfman^nWL^rND^sHart^nR^rND^sAzziz^nR^rND^sWaggoner^nWT^rND^sOchoa^nT^rND^sKnochenhauer^nES^rND^sBoots^nLR^rND^sCarmina^nE^rND^sLobo^nRA^rND^sHull^nMG^rND^sSavage^nPE^rND^sBromham^nDR^rND^sIsmail^nAA^rND^sMorris^nAF^rND^sAbraham^nGE^rND^sMaroulis^nGB^rND^sMarshall^nJR^rND^sBajares de Lilue^nM^rND^sPizzi^nR^rND^sVelázquez Maldonado^nE^rND^sCarmina^nE^rND^sNieman^nLK^rND^sBiller^nBM^rND^sFindling^nJW^rND^sNewell-Price^nJ^rND^sSavage^nMO^rND^sStewart^nPM^rND^sJanssen^nOE^rND^sMehlmauer^nN^rND^sHahn^nS^rND^sOffner^nAH^rND^sGärtner^nR^rND^sMorgante^nG^rND^sMusacchio^nMC^rND^sOrvieto^nR^rND^sMassaro^nMG^rND^sDe Leo^nV^rND^sCalvar^nCE^rND^sBengolea^nSV^rND^sDeutsch^nSI^rND^sHermes^nR^rND^sRamos^nG^rND^sLoyato^nM^rND^sLegro^nRS^rND^sCastracane^nVD^rND^sKauffman^nRP^rND^sDeUgarte^nCM^rND^sBartolucci^nAA^rND^sAzziz^nR^rND^sDunaif^nA^rND^sSega^nKR^rND^sFutterweit^nW^rND^sDobrjansky^nA^rND^sRosas Guzmán^nJ^rND^sGonzález Chávez^nA^rND^sAschner^nP^rND^sBastarrachea^nR^rND^sFung^nL^rND^sPizzi^nR^rND^sCenteno^nI^rND^sHernández^nE^rND^sDiamanti-Kandarakis^nE^rND^sKouli^nC^rND^sAlexandraki^nK^rND^sSpina^nG^rND^sGoodman^nNF^rND^sCobin^nRH^rND^sFutterweit^nW^rND^sGlueck^nJS^rND^sLegro^nRS^rND^sCarmina^nE^rND^sFogel^nRB^rND^sMalhotra^nA^rND^sPillar^nG^rND^sPittman^nSD^rND^sDunaif^nA^rND^sWhite^nDP^rND^sDokras^nA^rND^sDewailly^nD^rND^sGronier^nH^rND^sPoncelet^nE^rND^sRobin^nG^rND^sLeroy^nM^rND^sPigny^nP^rND^sPizzi^nR^rND^sCenteno^nI^rND^sFung^nL^rND^sPérez^nY^rND^sToro^nF^rND^sGonzález^nY^rND^1A01^nAlexander O^sMendoza Rivas^rND^1A01^nAlexander O^sMendoza Rivas^rND^1A01^nAlexander O^sMendoza Rivas
Diagnóstico ecográfico del síndrome de ovario poliquístico
Dr. Alexander O. Mendoza Rivas
Médico Especialista en Obstetricia y Ginecología. Especialista en Endocrinología Ginecológica y Mastología UCV. Profesor del Curso de Endocrinología Ginecológica HUC-UCV
INTRODUCCIÓN
El síndrome de ovarios poliquístico (SOP) es reconocido como el desorden endocrinológico más común en mujeres en edad reproductiva alrededor del mundo, alcanzando una prevalencia en la población general desde un 6% hasta un 8%, pudiendo alcanzar hasta un 10% cuando se toma en cuenta la inclusión de los distintos fenotipos basados en los criterios del Consenso de Rotterdam (1).
Diferentes comités de expertos como el Consenso de Rotterdam, la Asociación Americana de Endocrinología Clínica, la Sociedad de Exceso de Andrógenos- SOP, se han abocado al estudio y manejo del SOP con la finalidad de tratar de establecer criterios unificados y guías prácticas en el manejo de los diferentes aspectos de este síndrome (2).
EVALUACIÓN ECOGRÁFICA DE LA PACIENTE CON SOP
Es importante establecer que a pesar de las controversias creadas en las múltiples reuniones de consenso de las diferentes sociedades en relación con los criterios diagnósticos del SOP en la actualidad seguimos tomando en cuenta los Criterios de Rotterdam los cuales contemplan: 1. Hiperandrogenismo clínico o bioquímico. 2. Oligo o anovulación. 3. Ovarios de aspecto poliquísticos. La presencia de solo dos de los tres criterios es suficiente para hacer el diagnóstico, estableciéndose además una variedad de fenotipos según se combinen dichos criterios (1).
La morfología poliquística se presenta hasta el 23.% de las mujeres en edad reproductiva en la población general, dicha morfología no es por sí sola suficiente para hacer el diagnóstico y su ausencia tampoco lo descarta (2).
Existen algunas condiciones que debemos tener en cuenta a la hora de evaluar ecográficamente a una paciente con sospecha clínica de SOP (2):
Se debe contar con equipos de ultrasonido adecuados y las distintas sondas necesarias para la evaluación, sondas convex para evaluación transabdominal con frecuencias entre 3,5 mHz y 5 mHz. La vía transvaginal con sondas endocavitarias con frecuencias entre 6,5 mHz y 8 mHz en las nuevas tecnologías es la que permite mayor resolución a la evaluación.
El médico examinador o ecografista debe contar con el entrenamiento y la experiencia necesaria para realizar dicha exploración.
La exploración se debe realizar en la fase folicular temprana de preferencia entre los días 3-5 de la menstruación o en cualquier momento si la paciente se encuentra en amenorrea. No es necesario realizar descamación endometrial con progestágenos para realizar el estudio.
El estudio no debe ser realizado bajo el uso de anticoncepción hormonal, ya que la misma modifica la morfología ovárica y de ser así se debe esperar un mínimo de 3 meses sin anticoncepción para realizarlo.
La vía de preferencia debe ser la transvaginal ya que es la que permite una mejor resolución, sobre todo en pacientes obesas, sin embargo, se pueden usar otras vías como la transabdominal, transperineal, transintroital o transrectal en pacientes núbiles o en aquellas que por alguna razón anatómica o cultural no se pueda utilizar la vía transvaginal, requiriendo para el uso de estas vías el entrenamiento y la experiencia del médico examinador.
CRITERIOS AL REALIZAR EL ESTUDIO ECOGRÁFICO
Los criterios de Rotterdam establecen que la morfología del ovario poliquístico se corresponde con la presencia de al menos 12 folículos cuya medida debe ser entre 2-9 mm y/o un volumen ovárico incrementado ≥ 10 mL, destacando que la presencia de estos criterios en un solo ovario es suficiente para establecer el diagnóstico (1).
Es importante establecer algunas consideraciones al realizar la evaluación (2):
Si existe un folículo dominante de ≥ 10 mm o la presencia de un cuerpo lúteo se debe repetir la exploración en el próximo ciclo entre los días 3-5.
No se tomarán en cuenta la distribución folicular ni la ecogenicidad del estroma ovárico para el diagnóstico.
El contaje folicular se realiza mediante la sumatoria folicular establecida tanto en los barridos longitudinales así como en los anteroposteriores, y el tamaño de los folículos debe ser expresado como el promedio de los diámetros medidos en las dos secciones.
El volumen ovárico se calcula de forma automática en aquellos equipos con el software apropiado, también se puede calcular de manera manual utilizando la fórmula de volumen de la elipse: (longitud x ancho x profundidad) x 0,5, cuidando durante la identificación de los planos que estos sean ortogonales entre sí.
Debemos realizar diagnóstico diferencial con el ovario multifolicular (OMF), en este el tamaño es normal o ligeramente aumentado y contiene 6 o más folículos mayores a 2 mm. El OMF se puede encontrar de manera fisiológica en la fase folicular temprana de una mujer en edad reproductiva, anovulación hipotalámica, hiperprolactinemia y uso de anticonceptivos orales de solo progestágenos.
El grosor y morfología endometrial deben ser cuidadosamente evaluados, ya que en este grupo de pacientes es frecuente encontrar patología endometrial debido a la estimulación sostenida de los estrógenos y andrógenos sin oposición progestagénica. Otros factores como la insulina podrían llevar a hiperplasia endometrial y cáncer.
NUEVAS EVIDENCIAS EN EL DIAGNÓSTICO ECOSONOGRÁFICO DE SOP.
Las nuevas directrices de la Sociedad de Exceso de Andrógenos y de estudios más recientes sugieren que los equipos de ultrasonografía deberían tener un software automatizado para el adecuado contaje de los folículos y tener transductores con una frecuencia de al menos 8 mHz para poder evaluar de una manera más óptima la morfología ovárica (3-5).
Los criterios de Rotterdam estaban basados en una tecnología ecográfica distinta, es por esto que ante el incremento injustificado del diagnóstico en conjunción con la clínica La Sociedad de Exceso de Andrógenos en sus nuevas directrices y basándose en una revisión de la data en base a las nuevas tecnologías para la ecosonografía, propone elevar el límite del contaje de los folículos a 25 (3-5).
Cuando usamos las nuevas tecnologías es posible detectar en las pacientes hasta 25 folículos entre 2-9 mm en todo el ovario; el límite del volumen ovárico de 10 mL no parece verse afectado por el uso de estas nuevas tecnologías, y 10 mL parece ser el límite entre un volumen normal y uno aumentado. Probablemente se necesiten límites diferentes de volumen ovárico durante la adolescencia y la vida adulta (3-5).
En los actuales momentos es indispensable que el clínico conozca que tecnología se ha usado para la evaluación de la morfología ovárica, de no conocerla el diagnóstico ecográfico no debe basarse en el contaje del número de folículos, sino solo en la medición del volumen ovárico (3-5).
El volumen ovárico se modifica a lo largo de la vida, alcanza sus valores máximos en la adolescencia aproximadamente entre 1,3 y 3,8 años posteriores a la menarquía, con un descenso progresivo durante la etapa adulta y disminución rápida después de la menopausia; disminuye desde un 10 % entre la 2da y 4ta década de la vida hasta un 50 % al final de la 5ta década (6).
El diagnóstico de SOP en la adolescencia continúa siendo un reto por muchas razones, la imposibilidad en la mayoría de los casos de usar la vía transvaginal constituye un gran obstáculo ya que la vía transabdominal dificulta la evaluación sobre todo en pacientes obesas (7). Existen además algunas características particulares de este grupo que crean confusión a la hora de hacer el diagnóstico: se ha reportado que 54 % de adolescentes sanas, con edad ginecológica entre 1,3 y 3,8 años presentan morfología de ovarios poliquísticos al ultrasonido transabdominal&(8). Por otra parte el 25 % de un grupo de adolescentes sanas, presentaba ovarios multifoliculares, definidos como 6 a 10 folículos de 4 a 10 mm de diámetro sin aumento del estroma (8).
Muchos autores han argumentado que se necesitan umbrales específicos de volumen ovárico a ser usados en la adolescencia para el diagnóstico de SOP (8). Un consenso que reunió a endocrinólogos pediatras y expertos en medicina del adolescente (9) recomiendan como límite superior y hasta que no se establezcan criterios definitivos, un volumen ovárico > 12,0 mL y que el conteo de folículos no debería ser utilizados para definir morfología ovárica en las adolescentes.
CORRELACIÓN ENTRE NIVELES DE HORMONA ANTIMÜLLERIANA Y OP
La hormona antimülleriana (HAM) es un péptido producido en las células granulosas de los folículos ováricos y se relaciona directamente con el número de folículos y volumen ovárico (7).
USO DE LA TECNOLOGÍA 3D EN EL ESTUDIO DE LA MORFOLOGÍA OVÁRICA
VOLUMEN OVÁRICO
El ultrasonido 3D en la actualidad ocupa un papel fundamental en el estudio del volumen ovárico, ya que proporciona una herramienta objetiva en su medición. En varios estudios utilizando la medición 3D de volumen ovárico se sugieren valores entre 10,6 - 16,7 mL para mujeres con SOP y de 5,2 - 8,7 mL en mujeres sanas en edad reproductiva. Diversos estudios han comparado las mediciones hechas con tecnologías 2D y 3D encontrando una fuerte correlación entre ambas tecnologías, sin embargo, existen diferencias en relación con las medidas del volumen ovárico reportadas en los diferentes estudios sugiriendo variabilidades técnicas e interobservador (7).
MEDICIÓN DE VOLUMEN ESTROMAL
Con el uso de las tecnologías 3D se han tratado de incluir otros parámetros para ser más precisos en el diagnóstico de SOP, como la medición del estroma ovárico (volumen estromal), este volumen puede ser medido mediante la sustracción del total del volumen folicular del volumen ovárico. Hay estudios que reportan diferencias entre distintas poblaciones como por ejemplo, las mujeres chinas tienen un menor volumen estromal que las caucásicas, y las mujeres con SOP tienen mayor volumen estromal que las sanas. Igualmente se ha encontrado una relación entre mayor volumen estromal e hiperandrogenemia, a pesar de estas evidencias en la actualidad existen pocos estudios que corroboren el potencial del valor clínico de esta variable (7,10).
FLUJOMETRÍA DOPPLER EN SOP
El incremento del volumen ovárico no solo se ha relacionado con cambios en la ecogenicidad del estroma sino también con aumento de la vascularidad, aunque la introducción de las tecnologías 3D ha mejorado la medición tanto del volumen ovárico como de la vascularización, los estudios al respecto aún tienen resultados conflictivos. Algunos estudios han reportado un incremento en la perfusión del estroma ovárico y una disminución en la perfusión uterina, mientra que otros estudios con tecnología tanto 2D como 3D no reportan estos hallazgos (7,11).
SOP EN LA TRANSICIÓN MENOPÁUSICA Y EN LA POSMENOPAUSIA
Durante la transición menopáusica suele haber una mejoría de los signos clínicos que caracterizan al SOP, incluso existe la tendencia a presentarse menstruaciones regulares e incluso mejoría del hirsutismo con la edad. Desde el punto de vista de morfología ecográfica durante la transición menopáusica se produce una disminución del volúmen ovárico y del número de folículos, por lo que el diagnóstico de SOP durante esta etapa se dificulta y los criterios conocidos dejan de ser útiles. Es por esto que el diagnóstico durante la transición y menopausia se establece en base a los antecedentes de oligo-anovulación e hiperandrogenismo antes de este período, sin embargo, la aparición de signos clínicos de hiperandrogenismo durante esta etapa debe ser investigada con la finalidad de descartar tumores productores de andrógenos (12).
CONCLUSIONES
Los ovarios de aspecto poliquísticos pueden ser detectados por vía transvaginal en el 75 % de las pacientes con algún signo clínico de SOP.
Con los criterios ecográficos propuestos en el Consenso de Rotterdam de ≥ 12 folículos de 2-9 mm y/o volúmen ovárico ≥ 10 mL en uno o ambos ovarios se puede sobre diagnosticar SOP. Se ha demostrado que el diagnóstico es altamente subjetivo debido a la gran disparidad en cuanto a las técnicas y criterios usados para cuantificar el número de folículos las cuáles no han podido ser reproducibles al realizar el análisis de los mismos.
La Sociedad de Exceso de Andrógenos y los más recientes estudios relacionados con la morfología ovárica proponen elevar a 25 el contaje del número de folículos entre 2-9 mm, siempre y cuando se estén usando equipos de nueva tecnología con máxima resolución y transductores transvaginales de al menos 8 Mhz, de no ser posible, usar el volúmen ovárico como parámetro más exacto, estableciendo 10 mL como límite.
La vía transabdominal no es la más adecuada para realizar el contaje del número de folículos ováricos, de no ser posible usar otra vía se debe tomar el volumen ovárico ≥ 10 mL como único parámetro.
En relación al diagnóstico ecográfico de SOP en la adolescencia, para el momento actual no existe consenso en relación al límite superior de la medida del volumen ovárico, sin embargo, podríamos considerar un valor ≥ 12 mL, no siendo adecuado usar el contaje de los folículos como parámetro.
REFERENCIAS
1. The Rotterdan ESHRE/ASRM-sponsored PCOS consensus Workshop Group. Revised 2003 Consensus on diagnostic criteria for polycystic ovary syndrome. Fertil Steril. 2004;81:19-25. [ Links ]
2. Bajares M, Pizzi R, Velázquez E. Consenso venezolano de síndrome de ovario poliquístico. Rev Venez Endocrinol Metab. 2007;5:67-71. [ Links ]
3. Azzis R, Carmina E, Dewaily D, Diamanti-Kandarakis E, Escobar-Morreale HF, Futterwiet W, et al. The androgen excess and PCOS Society Criteria for the polycystic ovaria syndrome: The complete task force report. Fertil Steril. 2009;91:456-488. [ Links ]
4. Spritzer P. Polycystic Ovary Syndrome: Reviewing diagnosis and management of metabolic disturbances. Arq Bras Endocrinol Metab. 2014;58:182-187. [ Links ]
5. Goodman N, Cobin R, Walter F, Futterweit W, Glueck J, Legro R, et al. American Association of Clinical Endocrinologist, American College of Endocrinologist, Androgen Excess and PCOS Society Disease State Clinical Review. Guide to The Best Practices in the evaluation and treatment of polycystic ovary syndrome. Endocrine Practice –Part 1. 2015;1:1291-1300. [ Links ]
6. Dewaily D, Lujan M, Carmina E, Cedars M, Laven J, Norman R, Escobar H. Definition and significance of polycystic ovarian morphology: A task force report from Androgen Excess and Polycystic Ovaria Syndrome Society. Human Reproducction Update. 2014;20:334-352. [ Links ]
7. Agapova S, Cameo T, Sopher A, Overfield S. Diagnosis and Challenges of Polycystic Ovary Syndrome in adolescence. Semin Reprod Med. 2014;32:194-201. [ Links ]
8. Witchel SF, Oberfield S, Rosenfield RL, Codner E, Bonny A, Ibáñez L, et al. The Diagnosis of Polycystic Ovary Syndrome during Adolescence. Horm Res Paediatr. 2015;83:376-389. [ Links ]
9. Chris J, Willis A, Brooks E, Vanden Brink H, Jarrett B, Pierson R, et al. Follicle number and not assements of de ovarian stroma, representes de best ultrasonographyc marker of polycystic ovary syndrome. Fertil Steril. 2014;102:280-287. [ Links ]
10. Ozdemir O, Erkan S, Kalkan D, Koc E, Ozdemir S, Atalay C. Comprasion of ovarian stromal blood flow measured by color Dopler ultrasonography in polycystic ovary syndrome patiens and healthy women with ultrasonographic evidence of polycystic. Gynecol Endocrinol. 2015;31:322-326. [ Links ]
11. Lenart-Lipinska M, Matyjaszek-Matuszek B. Polycystic Ovary Syndrome: Clinical Implication in perimenopause. Prz Menopauzalny. 2014;13:348- 251. [ Links ]^rND^sBajares^nM^rND^sPizzi^nR^rND^sVelázquez^nE^rND^sAzzis^nR^rND^sCarmina^nE^rND^sDewaily^nD^rND^sDiamanti-Kandarakis^nE^rND^sEscobar-Morreale^nHF^rND^sFutterwiet^nW^rND^sSpritzer^nP^rND^sGoodman^nN^rND^sCobin^nR^rND^sWalter^nF^rND^sFutterweit^nW^rND^sGlueck^nJ^rND^sLegro^nR^rND^sDewaily^nD^rND^sLujan^nM^rND^sCarmina^nE^rND^sCedars^nM^rND^sLaven^nJ^rND^sNorman^nR^rND^sEscobar^nH^rND^sAgapova^nS^rND^sCameo^nT^rND^sSopher^nA^rND^sOverfield^nS^rND^sWitchel^nSF^rND^sOberfield^nS^rND^sRosenfield^nRL^rND^sCodner^nE^rND^sBonny^nA^rND^sIbáñez^nL^rND^sChris^nJ^rND^sWillis^nA^rND^sBrooks^nE^rND^sVanden Brink^nH^rND^sJarrett^nB^rND^sPierson^nR^rND^sOzdemir^nO^rND^sErkan^nS^rND^sKalkan^nD^rND^sKoc^nE^rND^sOzdemir^nS^rND^sAtalay^nC^rND^sLenart-Lipinska^nM^rND^sMatyjaszek-Matuszek^nB^rND^nNora^sMaulino^rND^nNora^sMaulino^rND^nNora^sMaulino
Síndrome de ovario poliquístico en la adolescencia
Dra. Nora Maulino
Pediatra – Endocrinólogo de Niños y Adolescentes. Ex Jefe del Servicio de Endocrinología del Hospital de Niños (J.M. de los Ríos) Caracas
INTRODUCCIÓN
La adolescencia per se es una etapa difícil de la vida, que se complica aún más ante la presencia del síndrome de ovario poliquístico (SOP). El SOP es un problema endocrinológico muy complejo, lo que dificulta su diagnóstico en la adolescencia. En las jóvenes el hirsutismo y el acné son visibles y pudiesen tener un efecto perturbador sobre los aspectos psicosociales, las alteraciones menstruales y las dudas sobre el potencial de fertilidad también les pueden generar preocupación, por el contrario no se interesan o desconocen las secuelas que a largo plazo pudieran presentar (1).
Las manifestaciones clínicas del SOP a menudo surgen durante la infancia o en la etapa peripuberal (2). Los síntomas del SOP varían con la edad, la raza, el peso, y los medicamentos, lo cual constituye un desafío para un diagnóstico preciso (3).
PROBLEMAS DIAGNÓSTICOS EN ADOLESCENTES
El diagnóstico del SOP en la adolescencia representa un reto, ya que los criterios diagnósticos utilizados para las adultas, no puede extrapolarse a las adolescentes. Por otra parte se superponen los signos y síntomas clínicos del SOP, con los hallazgos fisiológicos durante la progresión de la pubertad normal. Determinar los criterios diagnósticos mínimos para este grupo etario es aún un tema de controversia, y actualmente no existen criterios diagnósticos universalmente aceptados (4).
Irregularidades menstruales
El promedio del ciclo menstrual es 28 días con un rango de 24 a 38 días (5). Las irregularidades menstruales se presentan alrededor de dos tercios de las adolescentes con SOP. Pueden presentar oligomenorrea (intervalos menstruales mayores de 40 días o menos de 9 períodos al año) amenorrea primaria (ausencia de menarquía a los 16 años de edad), amenorrea secundaria (ausencia de menstruación por al menos 3 meses, o sangrado uterino disfuncional (sangrado vaginal excesivo e irregular) (5). Incluso ante la presencia de ciclos menstruales regulares, estos pueden ser anovulatorios, lo cual puede sospecharse por la ausencia de dolor menstrual y de síntomas premenstruales (molestia mamaria, inflamación abdominal, cambios de humor), o por la presencia de menorragia (6). Rara vez, una adolescente con SOP se presenta con amenorrea primaria como primera manifestación (7).
Si bien los trastornos menstruales son la manifestación clínica más temprana en la adolescencia (8), en los dos primeros años pos menarca más del 50 % de los ciclos son anovulatorios (9-11). El porcentaje de ciclos ovulatorios se incrementa con la edad, alcanzando el 80 % a los 4 a 4,5 años de edad ginecológica (11). En un estudio longitudinal de 112 adolescentes, 65 % habían establecido un patrón de más de 10 menstruaciones por año, después de un año posmenarquía y más del 90 % presentaban más de 10 menstruaciones por año a los 3 años posmenarca (12). También con frecuencia es difícil distinguir la anovulación fisiológica de una adolescente, de los trastornos menstruales relacionados con el SOP (13).
Debería tomarse en cuenta a la disfunción ovulatoria, ante la ausencia de períodos menstruales por más de 90 días, o a la persistencia de ciclos con una duración mayor de 40 días (14). Se ha sugerido también la evaluación de las adolescentes que presenten trastornos menstruales por al menos 1 año o si está asociada con otros signos o síntomas clínicos (13).
La edad del inicio de la menstruación determina la edad a la cual se establecen los ciclos ovulatorios; en niñas que inician la menstruación antes de los 12 años, entre los 12 y los 13 y después de los 13 años, los ciclos son ovulatorios al año, a los tres años y a los cuatro años y medio respectivamente (15).
En base a un estudio de cohorte de adolescentes en la población general, establecieron que la presencia de oligomenorrea a los 15 años fue el mejor predictor de oligomenorrea tres años más tarde, 51 % permanecían con oligomenorrea. Solo 2 % de las adolescentes con ciclos regulares y 12 % de las que presentaban irregularidades leves (ciclos entre 22 y 41 días) desarrollaban oligomenorrea posteriormente (16).
En otro estudio de cohorte realizado en adolescentes finlandesas, concluyen que las alteraciones menstruales en la adolescencia son un buen marcador de hiperandrogenemia y puede ser un factor de riesgo temprano para el desarrollo de SOP en la adultez. La asociación entre obesidad, hiperandrogenismo y riesgo metabólico, es ya evidente en la adolescencia, lo cual refuerza la importancia de la detección de las irregularidades menstruales tempranamente (17).
La oligomenorrea persistente ha sido sugerida como un requerimiento para el diagnóstico de SOP por la Endocrine Society (18). Sin embargo, la definición de oligomenorrea persistente es incierta. Carmina y col. (19) plantean que la oligomenorrea persistente debe ser definida como la que dura al menos 2 años previos al diagnóstico. Por otra parte, Rosenfield (13) concluye que el diagnóstico de SOP debe considerarse cuando los trastornos menstruales persisten un año o más.
Morfología ovárica
La evaluación de la morfología ovárica se dificulta un poco en las adolescentes, por varias razones: la primera de ellas es que, es más utilizada la ecografía transabdominal en contraposición con las adultas, grupo en el cual se recomienda la realización de ecografía transvaginal (20). La incidencia de ovarios con morfología poliquística (OMP) es menor en adolescentes que en adultas, pero no se ha logrado establecer si esta incidencia es realmente menor o si pudiera ser ocasionada por la diferencia de los métodos usados (transabdominal vs transvaginal) (6). El ultrasonido abdominal particularmente en adolescentes con obesidad puede conllevar a informaciones erradas (21).
En segundo lugar, la apariencia y el volumen ovárico pueden variar durante la adolescencia; entre los dos y los nueve años, el tamaño y la morfología del ovario son relativamente estables con un volumen de cada uno menor de 2 cm3, sin embargo, alrededor de los 9 años experimenta un incremento progresivo en tamaño (22), número de folículos antrales y tamaño ovárico alcanzan su máximo alrededor de la menarquía (23).
Se ha reportado que ovarios con morfología políquística que aparecen en la pubertad pueden normalizarse posteriormente (24). Del 10 % al 48 % de adolescentes que no presentan SOPpueden manifestar ovarios con apariencia poliquística (23,25,26).
En una serie de 23 adolescentes con hiper- androgenismo al compararlas con adultas, la presencia de ovarios con morfología poliquística fue significativamente menor (55 % vs 75 %) (27).
Se ha reportado que 54 % de adolescentes sanas, con edad ginecológica entre 1,3 y 3,8 años presentan morfología de ovarios poliquísticos al ultrasonido transabdominal (23). Por otra parte el 25 % de un grupo de adolescentes sanas, presentaba ovarios multifoliculares, definidos como 6 a 10 folículos de 4 a 10 mm de diámetro sin aumento del estroma (19,28-30).
Un consenso que reunió endocrinólogos pediatras y expertos en medicina del adolescente (21) recomienda que hasta que no se establezcan criterios definitivos, se debe considerar un volumen ovárico > 12,0 cm3 (calculado en base a la fórmula de la elipse ovalada) como criterio de morfología ovárica. El conteo de folículos no debería ser utilizado para definir OMP en las adolescentes.
Hiperandrogenismo
Clínico
En la adolescencia, la evidencia clínica de un exceso de andrógenos, como el acné severo o el hirsutismo, puede inducir a la evaluación para el descarte de SOP. Sin embargo, aunque el acné puede ser el síntoma de presentación de un hiperandrogenismo subyacente (31), es demasiado común en esta población para ser usado como único criterio para el diagnóstico de hiperandrogenismo clínico. Más del 90 % de las mujeres de 18 años de edad tienen algún tipo de acné, y el 23 % tiene acné que requiere tratamiento farmacológico, su prevalencia declina en la adultez (32).
Si bien el acné comedónico es común en las adolescentes, el acné comedónico moderado o grave en la etapa puberal temprana o acné inflamatorio moderado durante la perimenarquía es infrecuente (prevalencia <5 %) (33,34).
El hirsutismo es un marcador más fiable de hiperandrogenismo en adolescentes (28). La ausencia de hirsutismo en algunas mujeres hiperandrogénicas puede ser causada por la variabilidad individual existente en la sensibilidad de la unidad pilosebácea a los andrógenos. Además algunas adolescentes jóvenes en las que el hiperandrogenismo no se ha desarrollado completamente pudiesen no ser hirsutas (6). Existen trabajos que reportan una incidencia de hirsutismo del 50 % a 65 % (35,36) en adolescentes con niveles elevados de andrógenos.
La hipertricosis debe distinguirse del hirsutismo. La hipertricosis se define como la presencia de pelo (lanugo, velloso o terminal) excesivo y anormal para la edad, raza o sexo, y que aparece en sitios no dependientes de la estimulación androgénica (37). La hipertricosis se distribuye en un patrón no sexual (por ejemplo, en una distribución generalizada o más prominente en la frente o los hombros) y no es causada por el exceso de andrógenos, si bien esto último en ocasiones la exacerba. Su incidencia se sustenta sobre un basamento étnico o familiar. Puede ser causada por fármacos como glucocorticoides, fenitoína, ciclosporina (6).
El hirsutismo leve aislado no debe ser considerado como una evidencia clínica de hiperandrogenismo en la posmenarquía temprana, cuando puede ser una fase del desarrollo. El hirsutismo moderado a severo constituye una evidencia clínica de hiperandrogenismo. Las niñas con acné persistente y poco sensible a la terapia dermatológica tópica, deberían ser evaluadas para descartar la presencia de hiperandrogenemia antes de la iniciación de cualquier tratamiento médico (21).
Bioquímico
La determinación de andrógenos es una medida más objetiva para valorar el hiperandrogenismo, lo cual se realiza utilizando una diversidad de ensayos para evaluar los niveles de testosterona sérica total (TT), testosterona libre (TL), androstenediona (Δ4) y sulfato de dehidroepiandrosterona (DHEA-S) (4). La testosterona es el principal andrógeno circulante, la medición de TT o TL han sido las más recomendadas para determinar hiperandrogenemia, sin embargo, realizar mediciones precisas de estos andrógenos es problemático. El ritmo diurno, las etapas de la pubertad y del ciclo menstrual, y las concentraciones de la globulina trasportadora de hormonas sexuales (SHBG) son variables biológicas que influyen en las concentraciones de testosterona (21).
Además de los problemas metodológicos relacionados con las determinaciones de testosterona, no contamos con puntos de corte relativos a los diferentes estadios puberales. La medición más recomendada por el panel de expertos en endocrinología pediátrica y medicina de la adolescencia (21), para documentar la presencia de hiperandrogenismo en una adolescente con síntomas de SOP, es la elevación persistente de los niveles de TT y/o TL determinada en un laboratorio de referencia confiable. Por otra parte, la Sociedad Europea de Endocrinología (38) plantea, que los ensayos para testosterona libre no deberían utilizarse debido a su inexactitud. El índice de andrógenos libres (IAL) calculado como la razón entre la testosterona total y SHGB, es probablemente la medida más sensible para determinar el hiperandrogenismo. Valores bajos de SHGB son un marcador de hiperandrogenismo.
Diagnóstico
El diagnóstico de SOP se confirma por exclusión de otras enfermedades, por lo que se deberá descartar la hiperprolactinemia, la hiperplasia suprarrenal congénita, el síndrome de Cushing, el hipotiroidismo y aunque poco frecuentes en adolescentes es necesario descartar también, la presencia de tumores productores de andrógenos. Actualmente existe mucha controversia sobre los criterios, que debieran ser utilizados para el diagnóstico durante la adolescencia (39).
Si bien, los criterios diagnósticos no están claros en las adolescentes, el diagnóstico puede conducir al reconocimiento de factores de riesgo para diabetes y enfermedad cardiovascular, con la subsecuente intervención temprana para prevenir estas secuelas (36,40).
Sultan y Paris (41) plantean que para la realización del diagnóstico deben cumplirse al menos 4 de los siguientes criterios (Cuadro 1):
Oligomenorrea o amenorrea 2 años después de la menarquía
Hiperandrogenismo clínico (hirsutismo, acné y/o alopecia)
Hiperandrogenismo biológico (concentración elevada de testosterona)
Resistencia insulínica/hiperinsulinemia (acantosis nigricans, obesidad abdominal y/o intolerancia a la glucosa)
Ovarios Poliquísticos al ultrasonido
Exclusión de otras etiologías.
Carmina y col. (19) Sugieren aplicar los criterios de Rotterdam (Oligo o anovulación, signos clínicos y/o bioquímicos de hiperandrogenismo, ovarios poliquísticos por ecografía) pero limitar el diagnóstico a la adolescente que cumple con los tres criterios. (Cuadro 1).
Ibáñez y Marcos (42) plantean para el diagnóstico usar criterios del NIH (Hiperandrogenismo y anovulación crónica), que no toman en cuenta la imagen ecográfica de ovarios poliquísticos, ya que los consideran como los más adecuados para definir la entidad en este grupo de edad. (Cuadro1).
La Endocrine Society (18) sugiere para la realización del diagnóstico la presencia de hiperandrogenismo clínico y/o bioquímico (después de la exclusión de otras patologías) en presencia de oligomenorrea persistente. Consideran que los síntomas anovulatorios y morfología de OP no son suficientes para el diagnóstico, pueden ser normales en la maduración reproductiva (Cuadro 1).
Spritzer (43) propone para el diagnóstico de SOP en adolescentes considerar: (Cuadro 1):
Oligo/amenorrea al menos 2 años posmenarquía o amenorrea a los 16 años
OMP + volumen ovárico > 10 mL
Hiperandrogenismo bioquímico y no solo hiperandrogenismo clínico
El comité de expertos en endocrinología pediátrica no establece criterios diagnósticos, pero recomiendan ciertos aspectos a tomar en cuenta (Cuadro 1). Además plantea que: aun ante la ausencia de un diagnóstico definitivo y un tratamiento probado, se recomienda tratar los síntomas y disminuir el riesgo de comorbilidades asociadas. Aunque la obesidad, la insulinorresistencia y la hiperinsulinemia son hallazgos comunes en adolescentes con hiperandrogenismo, estos hallazgos no deben utilizarse para el diagnóstico (21).
FACTORES DE RIESGO PREPUBERALES IMPLICADOS EN EL DESARROLLO DEL SOP
Aunque el SOP es un trastorno que afecta a las mujeres tradicionalmente consideradas en edad reproductiva, de hecho afecta toda la vida de la mujer, iniciándose durante el desarrollo intrauterino y pasando por la menopausia y más allá en su vida posterior. Las manifestaciones clínicas pueden iniciarse alrededor de la menarquía; sin embargo, hay signos que nos pueden alertar en etapas más tempranas (20).
La pubarquia (aparición de vello púbico antes de los 8 años) o la menarquía precoz, el nacimiento con un peso bajo para la edad gestacional, la obesidad y el síndrome metabólico son factores de riesgo independientes para el desarrollo de SOP. La hiperplasia suprarrenal congénita y otros problemas virilizantes son factores de riesgo fuertes (44).
RIESGO METABÓLICO EN ADOLESCENTES CON SOP
Una vez establecido el diagnóstico de SOP en una adolescente, debe realizarse un tamizaje para el descarte de alteraciones metabólicas, si bien la disfunción metabólica no forma parte de la definición del SOP, constituye un factor de riesgo asociado a esta patología, y puede manifestarse en etapas tempranas (3).
Rosenfield y col. (45) han planteado dudas sobre la exactitud del diagnóstico de SOP en adolescentes, en base a que las irregularidades menstruales y los niveles de testosterona son superiores a la media en la adolescencia, pero persisten solo en una minoría. Además los ciclos anovulatorios prolongados en adolescentes normales se asocian con un aumento de los niveles de testosterona. Estos autores realizaron un estudio del seguimiento de un grupo de adolescentes con hiperandrogenismo con características de SOP, para poner a prueba la hipótesis de que en las adolescentes el hiperandrogenismo ovárico funcional (FOH) persiste en la edad adulta. Valoraron 22 adultas con diagnóstico de SOP en la adolescencia, encontraron que el hiperandrogenismo persistió y la tolerancia a la glucosa tendió a deteriorarse. Seis de ocho pacientes habían desarrollado tolerancia anormal a la glucosa , dos con diabetes mellitus tipo 2 (45).
La presencia de acantosis nigricans y obesidad troncular son indicios clínicos para insulinorresistencia. Un tercio de las adolescentes con SOP presentan criterios para síndrome metabólico, en comparación con aproximadamente el 5 % de las adolescentes de la población general (46,47).
Independientemente del índice de masa corporal, se ha reportado una asociación entre el SOP y síndrome metabólico; las adolescentes con obesidad y SOP tenían una mayor prevalencia de síndrome metabólico que las adolescentes con obesidad sin SOP (46). Otros (48) reportan que adolescentes con SOP en el sur de China, presentan más alteraciones metabólicas que las pareadas por edad e IMC sin SOP.
Rossi y col. (49) no encontraron que la presencia de SOP, añada más riesgo para el desarrollo de SM. Si hallaron que el SOP se asocia con una mayor incidencia de intolerancia a la glucosa y al aumento del PAI-1. Concluyen que sus resultados refuerzan la importancia de la obesidad en las adolescentes con SOP, para reconocer el posible riesgo de futura enfermedad.
En adolescentes la obesidad abdominal es común en el SOP y está asociada a un mayor grado de disfunción metabólica (50).
En un grupo de adolescentes con diagnóstico de SOP, las que presentaban un fenotipo hiperandrogénico mostraban mayor grado de resistencia a la insulina e inflamación (47). También las alteraciones lipídicas (triglicéridos y LDL) son mayores en los fenotipos hiperandrogénicos al compararlas con los otros subgrupos (51).
Otros autores (52) hallaron que la hemoglobina, la gamma-glutamil transferasa (g-gt), el colesterol total, la LDLy los niveles de insulina a las 2 horas posteriores a una carga de glucosa, fueron significativamente más elevados en el grupo de adolescentes delgadas con SOP que en el grupo de control delgadas. En el grupo de SOP con sobrepeso/obesidad, los niveles de hemoglobina y de g-gt fueron significativamente más elevados que en el grupo control con sobrepeso / obesidad.
Está bien reconocida la prevalencia elevada de la insulinorresistencia y la hiperinsulinemia entre adolescentes con SOP, independientemente de que sean delgadas o con obesidad. Se considera que la hiperinsulinemia exacerba el hiperandrogenismo y las manifestaciones reproductivas y metabólicas del SOP en adolescentes (21).
El aumento de la prevalencia del síndrome metabólico a una edad tan temprana subraya la importancia de la revisión periódica de la población de SOP, para disminuir el riesgo futuro de diabetes y enfermedad coronaria. La obesidad abdominal es común en el SOPy se asocia con una mayor disfunción metabólica en adolescentes con PCOS (50).
La Endocrine Society recomienda que las adolescentes y las mujeres con SOP deben ser tamizadas para los siguientes factores de riesgo cardiovascular: antecedentes familiares de enfermedad cardiovascular temprana, el tabaquismo, la intolerancia a la glucosa/ diabetes tipo 2, hipertensión, dislipidemia, apnea obstructiva del sueño, y obesidad (especialmente aumento en la adiposidad abdominal (18).
Las pruebas para las comorbilidades deben incluir, glicemia e insulina en ayunas, perfil lipídico. Para las jóvenes con poliuria, polidipsia, acantosis nigricans u obesidad considerar la realización de una prueba de tolerancia a la glucosa. Si presentan signos sugestivos de depresión referir para evaluación (21).
TRATAMIENTO
El tratamiento va dirigido a las manifestaciones clínicas y debe ser individualizado. Todas las adolescentes con SOP deben ser tratadas con modificaciones en el estilo de vida y reducción de peso de ser necesario. Lo cual ha demostrado que disminuyen el efecto de los andrógenos, incrementan la ovulación y mejoran la sensibilidad a la insulina. Se recomienda además realizar un seguimiento a largo plazo de estas pacientes (53).
El abordaje de las adolescentes con SOP, como en el caso de las adultas, tiene dos objetivos principales: controlar los síntomas del exceso de andrógenos y/o la anovulación e intentar reducir la posibilidad de complicaciones a largo plazo principalmente la diabetes tipo 2 (54).
El pilar en el manejo de las irregularidades menstruales oligomenorrea o amenorrea, es el tratamiento cíclico con progestágenos o anticonceptivos orales (a menudo la mejor opción, incluso en adolescentes), debido al riesgo de hiperplasia endometrial si no se trata. En las niñas con sobrepeso u obesidad, es importante ofrecer consejos prácticos acerca de la dieta y el ejercicio, tanto para mejoría de los síntomas menstruales como la de las complicaciones a largo plazo (18).
Los síntomas de exceso de andrógenos causan gran angustia en las adolescentes, el hirsutismo, debe ser tratado mediante una combinación de medidas cosméticas (el asesoramiento con expertos en métodos de eliminación del vello es importante), anticonceptivos orales y, si es necesario tratamiento con antiandrógenos. Se ha sugerido a la metformina como un posible tratamiento si el objetivo es tratar el síndrome metabólico o intolerancia a la glucosa. La duración óptima de los ACO o el uso de metformina aún no ha sido determinada. Para las niñas premenárquicas con evidencia clínica y bioquímica de hiperandrogenismo en presencia de un desarrollo puberal avanzado (es decir, estadio de Tanner IV), sugieren empezar con contraceptivos (21).
REFERENCIAS
1. Homburg R, Lambalk CB. Polycystic ovary syndrome in adolescence a therapeutic conundrum. Hum Reprod. 2004;19:1039-1042. [ Links ]
2. Bremer AA. Polycystic ovary syndrome in the pediatric population. Metab Syndr Relat Disord. 2010;8(5):375-394. [ Links ]
3. Roe AH, Dokras A. The diagnosis of polycystic ovary syndrome in adolescents. Rev Obstet Gynecol. 2011; 4:45-51. [ Links ]
4. Agapova SE, Cameo T, Sopher AB, Oberfield SE. Diagnosis and Challenges of Polycystic Ovary Syndrome in Adolescence. Semin Reprod Med. 2014; 32:194-201. [ Links ]
5. Treloar A, Boynton R, Benn B, Brown BW. Variation of human menstrual cycle through reproductive life. Int J Fertil. 1967;12:77-126. Citado por Evidencebased guideline for the assessment and management of polycystic ovary syndrome. Jean Hailes Foundation for Womens Health on behalf of the PCOS Australian Alliance; Melbourne, 2011. [ Links ]
6. Buggs C, Rosenfield RL. Polycystic ovary syndrome in adolescence. Endocrinol Metab Clin North Am. 2005;34:677-705. [ Links ]
7. Pfeifer SM, Kives S. Síndrome de ovario poliquístico en la adolescente. Obstet Gynecol Clin N Am. 2009;36:129-152. [ Links ]
8. Avvad CK, Holeuwerger R, Silva VC, Bordallod MA, Breitenbache MM. Menstrual irregularity in the first postmenarchal years: An early clinical sign of polycystic ovary syndrome in adolescence. Gynecol Endocrinol. 2001;15:170-177. [ Links ]
9. Dewailly D, Catteau-Jonard S, Reyss AC, Leroy M, Pigny P. Oligoanovulation with polycystic ovaries but not overt hyperandrogenism. J Clin Endocrinol Metab. 2006;91:3922-3927. [ Links ]
10. Diaz A, Laufer MR, Breech LL. Menstruation in girls and adolescents: Using the menstrual cycle as a vital sign. Pediatrics. 2006;118:2245-2250. [ Links ]
11. Apter D, Vihko R. Serum pregnenolone, progesterone, 17-hydrox-yprogesterone, testosterone and 5 alphadihydrotestosterone during female puberty. J Clin Endocrinol Metab 1977; 45(5):1039-1048. [ Links ]
12. Legro RS, Lin HM, Demers LM, Lloyd T. Rapid maturation of the reproductive axis during perimenarche independent of body composition. J Clin Endocrinol Metab. 2000;85:1021-1025. [ Links ]
13. Rosenfield RL. Clinical review: Adolescent anovulation: Maturational mechanisms and implications. J Clin Endocrinol Metab. 2013;98:3572- 3583. [ Links ]
14. Merino PM, Codner E, Cassorla F. A rational approach to the diagnosis of polycystic ovarian syndrome during adolescence. Arq Bras Endocrinol Metabol. 2011;55:590-598. [ Links ]
15. Apter D, Vihko R. Early menarche, a risk factor for breast cancer, indicates early onset of ovulatory cycles. J Clin Endocrinol Metab. 1983;57:82-86. [ Links ]
16. van Hooff MH, Voorhorst FJ, Kaptein MB, Hirasing RA, Koppenaal C, Schoemaker J. Predictive value of menstrual cycle pattern, body mass index, hormone levels and polycystic ovaries at age 15 years for oligo-amenorrhoea at age 18 years. Hum Reprod. 2004;19:383-392. [ Links ]
17. Pinola P, Lashen H, Bloigu A, Puukka K, Ulmanen M, Ruokonen A, et al. Menstrual disorders in adolescence: A marker for hyperandrogenaemia and increased metabolic risks in later life? Finnish general population-based birth cohort study. Hum Reprod. 2012;27:3279-3286. [ Links ]
18. Legro RS, Arslanian SA, Ehrmann DA, Hoeger KM, Murad MH, Pasquali R, et al. Endocrine Society. Diagnosis and treatment of polycystic ovary syndrome: An Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2013;98:4565-4592. [ Links ]
19. Carmina E, Oberfield SE, Lobo RA. The diagnosis of polycystic ovary syndrome in adolescents. Am J Obstet Gynecol. 2010;203:e201-e205. [ Links ]
20. Tsikouras P, Spyros L, Manav B, Zervoudis S, Poiana C, Nikolaos T, et al. Features of Polycystic Ovary Syndrome in adolescence. J Med Life. 2015;8:291- 296. [ Links ]
21. Witchel SF, Oberfield S, Rosenfield RL, Codner E, Bonny A, Ibáñez L, et al. The Diagnosis of Polycystic Ovary Syndrome during Adolescence. Horm Res Paediatr. 2015;83:376-389. [ Links ]
22. Hart R, Sloboda DM, Doherty DA, Norman RJ, Atkinson HC, Newnham JP, et al. Prenatal determinants of uterine volume and ovarian reserve in adolescence. J Clin Endocrinol Metab. 2009;94:4931- 4937. [ Links ]
23. Mortensen M, Rosenfield R, Littlejohn E. Functional Significance of Polycystic-Size Ovaries in Healthy Adolescents. J Clin Endocrinol Metab. 2006;91:3786- 3790. [ Links ]
24. Venturoli S, Porcu E, Fabbri R, Pluchinotta V, Ruggeri S, Macrelli S, et al. Longitudinal change of sonographic ovarian aspects and endocrine parameters in irregular cycles of adolescence. Pediatr Res. 1995;38:974-980. [ Links ]
25. Bridges NA, Cooke A, Healy MJ, Hindmarsh PC, Brook CG. Standards for ovarian volume in childhood and puberty. Fertil Steril. 1993;60:456-460. [ Links ]
26. Blank SK, Helm KD, McCartney CR, Marshall JC. Polycystic ovary syndrome in adolescence. Ann N Y Acad Sc. 2008;1135:76-84. [ Links ]
27. Rosenfield RL, Ghai K, Ehrmann DA, Barnes RB. Diagnosis of polycystic ovary syndrome in adolescence. Comparison of adolescent and adult hyperandrogenism. J Pediatr Endocrinol Metab. 2000;13(Suppl 5):S1285-S1289. [ Links ]
28. Azziz R, Carmina E, Dewailly D, Diamanti-Kandarakis E, Escobar-Morreale HF, Futterweit W, et al. Androgen Excess Society, et al. Positions statement: Criteria for defining polycystic ovary syndrome as a predominantly hyperandrogenic syndrome: An Androgen Excess Society guideline. J Clin Endocrinol Metab. 2006;91:4237-4245. [ Links ]
29. Hickey M, Doherty DA, Atkinson H, Sloboda DM, Franks S, Norman RJ, et al. Clinical, ultrasound and biochemical features of polycystic ovary syndrome in adolescents: Implications for diagnosis. Hum Reprod. 2011;26:1469-1477. [ Links ]
30. Adams J, Franks Sl, Polson DW, Mason HD, Abdulwahid N, Tucker M, et al. Multifollicular ovaries: Clinical and endocrine features and response to pulsatile gonadotropin releasing hormone. Lancet. 1985;2:1375-1379. [ Links ]
31. Slayden SM, Moran C, Sams WM Jr, Boots LR, Azziz R. Fertil Steril. 2001;75:889-892. [ Links ]
32. Cunliffe WJ, Gould DJ. Prevalence of facial acne vulgaris in late adolescence and in adults. Br Med J. 1979;1:1109-1110. [ Links ]
33. Lucky AW, Biro FM, Simbartl LA, Morrison JA, Sorg NW. Predictors of severity of acne vulgaris in young adolescent girls: Results of a five-year longitudinal study. J Pediatr. 1997;130:30-39. [ Links ]
34. Eichenfield LF, Krakowski AC, Piggott C, Del Rosso J, Baldwin H, Friedlander SF, et al. American Acne and Rosacea Society. Evidence-based recommendations for the diagnosis and treatment of pediatric acne. Pediatrics. 2013;131:S163-S186. [ Links ]
35. Bekx MT, Connor EC, Allen DB. Characteristics of adolescents presenting to a multidisciplinary clinic for polycystic ovarian syndrome. J Pediatr Adolesc Gynecol. 2010; 23(1):7-10. [ Links ]
36. Roe AH, Prochaska E, Smith M, Sammel M, Dokras A. Using the androgen excess-PCOS society criteria to diagnose polycystic ovary syndrome and the risk of metabolic syndrome in adolescents. J Pediatr. 2013;162(5):937-941. [ Links ]
37. Asz Sigall D, Salas Alanís JC, Beirana A, Arenas R. Hipertricosis: sus causas, formas clínicas y manejo. Dermatología CMQ. 2011;9(1):33-42. [ Links ]
38. Conway G, Dewailly D, Diamanti-Kandarakis E, Escobar-Morreale HF, Franks S, Gambineri A, et al.; ESE PCOS Special Interest Group. The polycystic ovary syndrome: A position statement from the European Society of Endocrinology. Eur J Endocrinol. 2014;171(4):1-29. [ Links ]
39. Gómez Díaz RA, Torres Tamayo M, Barrón Uribe C, Nishimura Meguro E, Pérez Pasten Lucio E, Cárdenas Tirado HM, et al. Síndrome de ovario poliquístico en la adolescencia. Posición de la Sociedad Mexicana de Nutrición y Endocrinología. Rev Endocrinol Nutric. 2006;14(1):13-19. [ Links ]
40. Carreau AM, Baillargeon JP. PCOS in adolescence and type 2 diabetes. Curr Diab Rep 2015;15(1):564. [ Links ]
41. Sultan C, Paris F. Clinical expression of polycystic ovary syndrome in adolescent girls. Fertil Steril. 2006;86(Suppl 1):S6. [ Links ]
42. Ibáñez L, Marcos MV. Hiperandrogenismo. Protoc Diagn Ter Pediatr. 2011;1:76-86. [ Links ]
43. Spritzer PM. Polycystic ovary syndrome: Reviewing diagnosis and management of metabolic disturbances. Arq Bras Endocrinol Metab. 2014;58:182-187. [ Links ]
44. Rosenfield RL. Clinical Review: Identifying Children at Risk for Polycystic Ovary Syndrome. J Clin Endocrinol Metab. 2007;92:787-796. [ Links ]
45. Rosenfield RL, Ehrmann DA, Littlejohn EE. Adolescent polycystic ovary syndrome due to functional ovarian hyperandrogenism persists into adulthood. J Clin Endocrinol Metab 2015;100:1537- 1543. [ Links ]
46. Coviello AD, Legro RS, Dunaif A. Adolescent girls with polycystic ovary syndrome have an increased risk of the metabolic syndrome associated with increasing androgen levels independent of obesity and insulin resistance. J Clin Endocrinol Metab. 2006;91:492- 497. [ Links ]
47. Alemzadeh R, Kichler J, Calhoun M. Spectrum of metabolic dysfunction in relationship with hyperandrogenemia in obese adolescent girls with polycystic ovary syndrome. Eur J Endocrinol. 2010;162:1093-1099. [ Links ]
48. Huang J, Ni R, Chen X, Huang L, Mo Y, Yang D. Metabolic abnormalities in adolescents with polycystic ovary syndrome in south china. Reprod Biol Endocrin. 2010;8:142-149. [ Links ]
49. Rossi B, Sukalich S, Droz J, Griffin A, Cook S, Blumkin A, et al. Prevalence of Metabolic Syndrome and Related Characteristics in Obese Adolescents with and without Polycystic Ovary Syndrome. J Clin Endocrinol Metab. 2006;91:492-497. [ Links ]
50. Bruni V, Dei M, Nannini S, Balzi D, Nuvolone D. Polycystic ovary syndrome in adolescence. Ann N Y Acad Sci. 2010;1205:175-184. [ Links ]
51. Fruzzetti F, Perini D, Lazzarini V, Parrini D, Genazzani AR. Adolescent girls with polycystic ovary syndrome showing different phenotypes have a different metabolic profile associated with increasing androgen levels. Fertil Steril. 2009;92:626-634. [ Links ]
52. Han Y, Soon Kim H, Lee HJ, Oh JY, Sung YA. Metabolic effects of polycystic ovary syndrome in adolescents. Ann Pediatr Endocrinol Metab. 2015;20:136-142. [ Links ]
53. National Institutes of Health. Evidence-based Methodology Workshop on Polycystic Ovary Syndrome December 3-5, 2012. Executive Summary. [ Links ]
54. Franks S. Polycystic ovary syndrome in adolescents. Int J Obes. 2008;32:1035-1041. [ Links ]^rND^sHomburg^nR^rND^sLambalk^nCB^rND^sBremer^nAA^rND^sRoe^nAH^rND^sDokras^nA^rND^sAgapova^nSE^rND^sCameo^nT^rND^sSopher^nAB^rND^sOberfield^nSE^rND^sTreloar^nA^rND^sBoynton^nR^rND^sBenn^nB^rND^sBrown^nBW^rND^sBuggs^nC^rND^sRosenfield^nRL^rND^sPfeifer^nSM^rND^sKives^nS^rND^sAvvad^nCK^rND^sHoleuwerger^nR^rND^sSilva^nVC^rND^sBordallod^nMA^rND^sBreitenbache^nMM^rND^sDewailly^nD^rND^sCatteau-Jonard^nS^rND^sReyss^nAC^rND^sLeroy^nM^rND^sPigny^nP^rND^sDiaz^nA^rND^sLaufer^nMR^rND^sBreech^nLL^rND^sApter^nD^rND^sVihko^nR^rND^sLegro^nRS^rND^sLin^nHM^rND^sDemers^nLM^rND^sLloyd^nT^rND^sRosenfield^nRL^rND^sMerino^nPM^rND^sCodner^nE^rND^sCassorla^nF^rND^sApter^nD^rND^sVihko^nR^rND^svan Hooff^nMH^rND^sVoorhorst^nFJ^rND^sKaptein^nMB^rND^sHirasing^nRA^rND^sKoppenaal^nC^rND^sSchoemaker^nJ^rND^sPinola^nP^rND^sLashen^nH^rND^sBloigu^nA^rND^sPuukka^nK^rND^sUlmanen^nM^rND^sRuokonen^nA^rND^sLegro^nRS^rND^sArslanian^nSA^rND^sEhrmann^nDA^rND^sHoeger^nKM^rND^sMurad^nMH^rND^sPasquali^nR^rND^sCarmina^nE^rND^sOberfield^nSE^rND^sLobo^nRA^rND^sTsikouras^nP^rND^sSpyros^nL^rND^sManav^nB^rND^sZervoudis^nS^rND^sPoiana^nC^rND^sNikolaos^nT^rND^sWitchel^nSF^rND^sOberfield^nS^rND^sRosenfield^nRL^rND^sCodner^nE^rND^sBonny^nA^rND^sIbáñez^nL^rND^sHart^nR^rND^sSloboda^nDM^rND^sDoherty^nDA^rND^sNorman^nRJ^rND^sAtkinson^nHC^rND^sNewnham^nJP^rND^sMortensen^nM^rND^sRosenfield^nR^rND^sLittlejohn^nE^rND^sVenturoli^nS^rND^sPorcu^nE^rND^sFabbri^nR^rND^sPluchinotta^nV^rND^sRuggeri^nS^rND^sMacrelli^nS^rND^sBridges^nNA^rND^sCooke^nA^rND^sHealy^nMJ^rND^sHindmarsh^nPC^rND^sBrook^nCG^rND^sBlank^nSK^rND^sHelm^nKD^rND^sMcCartney^nCR^rND^sMarshall^nJC^rND^sRosenfield^nRL^rND^sGhai^nK^rND^sEhrmann^nDA^rND^sBarnes^nRB^rND^sAzziz^nR^rND^sCarmina^nE^rND^sDewailly^nD^rND^sDiamanti-Kandarakis^nE^rND^sEscobar-Morreale^nHF^rND^sFutterweit^nW^rND^sHickey^nM^rND^sDoherty^nDA^rND^sAtkinson^nH^rND^sSloboda^nDM^rND^sFranks^nS^rND^sNorman^nRJ^rND^sAdams^nJ^rND^sFranks^nSl^rND^sPolson^nDW^rND^sMason^nHD^rND^sAbdulwahid^nN^rND^sTucker^nM^rND^sSlayden^nSM^rND^sMoran^nC^rND^sSams^nWM Jr^rND^sBoots^nLR^rND^sAzziz^nR^rND^sCunliffe^nWJ^rND^sGould^nDJ^rND^sLucky^nAW^rND^sBiro^nFM^rND^sSimbartl^nLA^rND^sMorrison^nJA^rND^sSorg^nNW^rND^sEichenfield^nLF^rND^sKrakowski^nAC^rND^sPiggott^nC^rND^sDel Rosso^nJ^rND^sBaldwin^nH^rND^sFriedlander^nSF^rND^sBekx^nMT^rND^sConnor^nEC^rND^sAllen^nDB^rND^sRoe^nAH^rND^sProchaska^nE^rND^sSmith^nM^rND^sSammel^nM^rND^sDokras^nA^rND^sAsz Sigall^nD^rND^sSalas Alanís^nJC^rND^sBeirana^nA^rND^sArenas^nR^rND^sConway^nG^rND^sDewailly^nD^rND^sDiamanti-Kandarakis^nE^rND^sEscobar-Morreale^nHF^rND^sFranks^nS^rND^sGambineri^nA^rND^sGómez Díaz^nRA^rND^sTorres Tamayo^nM^rND^sBarrón Uribe^nC^rND^sNishimura Meguro^nE^rND^sPérez Pasten^nLucio E^rND^sCárdenas Tirado^nHM^rND^sCarreau^nAM^rND^sBaillargeon^nJP^rND^sSultan^nC^rND^sParis^nF^rND^sIbáñez^nL^rND^sMarcos^nMV^rND^sSpritzer^nPM^rND^sRosenfield^nRL^rND^sRosenfield^nRL^rND^sEhrmann^nDA^rND^sLittlejohn^nEE^rND^sCoviello^nAD^rND^sLegro^nRS^rND^sDunaif^nA^rND^sAlemzadeh^nR^rND^sKichler^nJ^rND^sCalhoun^nM^rND^sHuang^nJ^rND^sNi^nR^rND^sChen^nX^rND^sHuang^nL^rND^sMo^nY^rND^sYang^nD^rND^sRossi^nB^rND^sSukalich^nS^rND^sDroz^nJ^rND^sGriffin^nA^rND^sCook^nS^rND^sBlumkin^nA^rND^sBruni^nV^rND^sDei^nM^rND^sNannini^nS^rND^sBalzi^nD^rND^sNuvolone^nD^rND^sFruzzetti^nF^rND^sPerini^nD^rND^sLazzarini^nV^rND^sParrini^nD^rND^sGenazzani^nAR^rND^sHan^nY^rND^sSoon Kim^nH^rND^sLee^nHJ^rND^sOh^nJY^rND^sSung^nYA^rND^sFranks^nS^rND^1A01^nIndira^sCenteno^rND^1A01^nIndira^sCenteno^rND^1A01^nIndira^sCenteno
Infertilidad y del síndrome de ovario poliquístico
Dra. Indira Centeno
Ginecóloga. Magíster Scientarium en Biología de la Reproducción Humana. Profesora Asociado Servicio de Ginecología UCV
El síndrome de ovario poliquístico (SOP) es la alteración endocrina más frecuente en la mujer durante su etapa reproductiva (4 % - 8 %) (1); se encuentra en más del 30 % de las mujeres con amenorrea secundaria, 75 % con oligomenorrea (2) y adicionalmente el 75 % de las mujeres con SOP sufren de infertilidad (3).
Esta entidad, catalogada por la OMS como anovulación normogonadotrópica, presenta una amplia variedad fenotípica con distintas expresiones y repercusiones metabólicas y reproductivas; siendo la anovulación la principal causa de infertilidad.
El SOP se caracteriza por una insuficiencia en la maduración folicular, ya sea por el desbalance gonadotrófico o por efectos de sustancias locales; así como una disminución de la actividad aromatasa en las células de la granulosa, pudiendo ser consecuencia de la baja concentración de FSH. Esta disminución de la actividad aromatasa lleva a un hiperandrogenismo circulante y, sobre todo, un microambiente ovárico de dominio androgénico que constituye un factor más para el mantenimiento de la inhibición de la actividad aromatasa y de la detención de la maduración folicular (4).
Asimismo, se ha sugerido como explicación a la falta de maduración folicular una elevación del umbral de respuesta de las células de la granulosa a la FSH debido a factores paracrinos contrarreguladores (esteroideos y no esteroideos) (5). Los factores no esteroideos, entre ellos, los factores de crecimiento, la insulina, el IGF-1 y el TGF-β (factor de crecimiento beta) aumentarían la producción de estradiol de las células de la granulosa, mientras que el EGF factor de crecimiento epidérmico (EGF), el TGF-α (Factor de crecimiento alfa), la hormona antimülleriana (HAM) y la inhibina B, inhibirían la acción de la FSH.
Las células de la granulosa poseen receptores para estos péptidos y se ha demostrado que la producción intraovárica de algunos está controlada por las gonadotropinas y los esteroides gonadales (6).
La inhibina B es una glicoproteína segregada por las céulas de la granulosa de los folículos antrales y preantrales, la cual en unión al estradiol ejerce un efecto inhibitorio en la secreción de FSH y una función paracrina ovárica. Este péptido se encuentra incrementado en el SOP, sus alteraciones se han relacionado con anovulación y atresia folicular (7).
La hormona antimülleriana, segregada por las células de la granulosa, se correlaciona positivamente con el número de folículos antrales y con los niveles de andrógenos (8). Sus altas concentraciones están vinculadas con una inhibición en la transformación de folículos pre antrales a folículos antrales, debido a una disminución de la sensibilidad folicular a la FSH. De esta manera, la HAM puede plantearse como un predictor de la respuesta ovárica a la estimulación ovárica controlada (9). Sin embargo, hay controversias en relación con esta hormona, ya que algunos autores plantean que los niveles incrementados de HAM impactan negativamente la maduración final y calidad ovocitaria (10). Otros reportan que los niveles séricos de HAM pueden ser usados como un marcador positivo para predecir tasa de fecundación, embarazo clínico e implantación, proponiendo como punto de corte estimado niveles séricos de 3 ng/ mL (11). En los momentos actuales el valor de HAM, el día 3 de un ciclo de estimulación ovárica es un buen predictor de respuesta ovárica y nos permite además prevenir el síndrome de hiperestimulación ovárica (12).
En este mismo orden de idea, surge el papel de la vitamina D en la esteroidogenesis ovárica en conjunto con la HAM, así como una asociación entre deficiencia de vitamina D y los factores responsables de la disfunción ovulatoria, tales como insulino resistencia, hiperandrogenismo, obesidad y síndrome metabólico en pacientes con síndrome de ovario poliquístico (13).
Adicionalmente, existe evidencia de un círculo vicioso entre insulino resistencia y exceso de andrógenos, que puede perpetuar las anormalidades metabólicas, endocrinas y reproductivas de estas pacientes (14,15).
Durante el proceso de fecundación, implantación y gestación, se evidencia la influencia de lo antes expuesto, lo cual es claramente expresado a través de la pirámide invertida graficada por Legro (Figura 1) (16).
Todo lo antes expuesto, nos lleva a un abordaje terapéutico multidisciplinario del SOP, en el contexto reproductivo que debe incluir (17-22):
- Modificaciones de estilo de vida: dieta, ejercicio, cese de hábito tabáquico.
- Agentes sensibilizadores a la insulina: Metformina
- Inductores de la ovulación:
* Citrato de clomifeno
* Inhibidores de aromatasa
* Gonadotropinas
- Multipunción ovárica laparoscópica (MOL)
- Fecundación in vitro (FIV)
Modificaciones de estilo de vida
La pérdida de peso es terapia de primera línea en pacientes con SOP obesas; una disminución entre el 5 % al 10 % podría ser clínicamente significativa. La mejor dieta y regímenes de ejercicio son desconocidos, se han planteados dietas de 1 200 -1 400 kcal/ día (21). La dieta hipocalórica (reducción de 500-1 000 kcal/d;
< 30% calorías en grasa, <10 % calorías de grasa saturada; incremento consumo de fibras) con carga glicémica reducida y una mayor actividad física (30 minutos/diario) son recomendados (14,22).
En aquel grupo de paciente donde la reducción de peso después de 6 meses de cambio de estilo de vida, se hace inalcanzable, así como aquellas con IMC >35 kg/m2, la cirugía bariátrica debe ser considerada como parte del tratamiento; especialmente si adicionalmente presentan síndrome metabólico. Con la consideración, de evitar embarazos dentro de los 12 a 18 meses siguientes a la cirugía (23).
Metformina
Dada la importancia del hiperinsulinismo y la resistencia a la insulina en la etiopatogenia del SOP, se propuso el uso de fármacos insulino sensibilizantes en su tratamiento.
El posible mecanismo de acción de la metformina incluye la mejoría de la sensibilidad a la insulina en el hígado, tejidos periféricos y un efecto directo sobre la esteroidogénesis ovárica. En vista de ello múltiples reportes revelan que este sensibilizador de insulina parece conferir un beneficio terapéutico global, no solo en área cardiometabólica, sino en la reproductiva (24).
En un reciente informe se afirma que la asociación de metformina al CC ha demostrado una mejor tasa de ovulación y de gestación, sobre todo en las pacientes obesas y resistentes al CC, pero no mejoran la tasa de niños nacidos vivos. Este metanálisis ha puesto en duda la utilidad de la metformina en el SOP. Otros autores justifican el uso de metformina ya que disminuye los casos de síndrome de hiperestimulación ovárica (SHO) en FIV, describiéndose además una menor tasa de gestación múltiple y abortos con su uso (25-27).
Podríamos resumir diciendo que en casos seleccionados: pacientes obesas, resistentes al CC, con resistencia a la insulina y cuando se va a realizar FIV/ICSI, estaría bien indicada la asociación de metformina al tratamiento.
Inductores de ovulación
El gran problema de la utilización de fármacos inductores de la ovulación es el incremento de las gestaciones múltiples y el riesgo de aparición del síndrome de hiperestimulación ovárica, por lo cual los objetivos del tratamiento son:
Inducir la ovulación que concluya en embarazo evolutivo
Minimizar la incidencia de abortos
Prevenir las gestaciones múltiples
Minimizar el riesgo de SHEO
Citrato de Clomifeno (CC)
Es el tratamiento de primera línea o de elección en la paciente con SOP (17-19,28). El CC es un modulador de los receptores estrogénicos con efecto antiestrogénico a nivel hipotalámico, lo que estimula la secreción de hormona liberadora de gonadotropinas (GnRH), con el consiguiente aumento de la liberación de FSH y LH por la hipófisis, este mismo efecto antiestrogénico se ve a nivel endometrial y de glándulas endocervicales (28).
La ovulación se restablece aproximadamente en el 80 % de los casos, sin embargo, solamente se consigue embarazo en el 30 % - 40 % de las mujeres tratadas con CC (29). La discrepancia entre tasas de ovulación y de embarazo parece estar justificada por el mismo mecanismo de acción antiestrogénica del CC, que implica la depleción de receptores estrogénicos. En base a lo antes expuesto, surgen dos conceptos: Resistencia al CC y Falla al CC. El primero se refiere a la incapacidad de ovular en la paciente tratada con CC, sin respuesta al tratamiento y el segundo término expresa aquel grupo de pacientes que logran ovular más no concebir (30,31).
Aproximadamente el 52 % de las mujeres ovulan con 50 mg de CC, en las que no ovulan con esta dosis, puede usarse un protocolo ascendente incrementando 50 mg por cada ciclo anovulatorio (22 % ovulan con 100 mg, 12 % con 150 mg; 7 % con 200 mg, y 5 % con 250 mg) (33). De igual manera, en este grupo de pacientes que logran la ovulación con dosis de 50 mg/día, 100 mg/ día, o 150 mg/ día, se han descrito tasas de embarazos a los 6 meses de tratamiento de 62 %, 66 % y 38 % respectivamente (20,30). De esto, se concluye que el tratamiento debe ser limitado a 6 ciclos de estimulación.
La dosis efectiva de CC oscila entre 50 a 250 mg/ día; aunque dosis por encima de 100 mg/ día no han sido aprobadas por la Administración de Drogas y Alimentos de Estados Unidos (FDA) (28).
Las opciones terapéuticas para las pacientes que son resistentes a clomifeno, incluyen el uso de esquemas de estimulación con gonadotropinas o la multipunción ovárica por laparoscopia (MOL) (31).
El esquema terapéutico de CC vía oral, se administra durante 5 días (Figura 2), posterior a una menstruación espontánea o inducida con progesterona, comenzando entre el tercer y quinto día del ciclo. La tasa de embarazo, concepción y embarazo a término son similares si se inicia día 2, 3, 4 o 5 del ciclo (32).
Adicionalmente debe incorporarse el uso de estrógenos vía oral o transdérmicos por el efecto antiestrogénico a nivel endometrial. Ej.: Valerato de estradiol oral 2 gramos diarios desde el inicio del CC, que puede mantenerse o incrementarse a 4 g/día.
Se debe realizar monitoreo ecográfico basal, antes del inicio y durante la estimulación. El tamaño folicular idóneo para hacer disparo ovulatorio oscila entre 20 a 24 mm (31,34,35).
El estudio controlado, aleatorizado de Legro y col. (36,37), redimensionó el valor del citrato de clomifeno como droga de elección para inducir la ovulación al compararlo con la metformina. En ese mismo grupo de pacientes se evaluaron los factores predictivos para obtener una alta tasa de nacidos vivos con el uso del CC, utilizando cuatro parámetros clínicos (índice de masa corporal, edad, duración de la infertilidad, puntaje de hirsutismo), de esta manera lograron diseñar una tabla que puede ayudar al médico a seleccionar y aconsejar el tratamiento ideal para cada fenotipo de paciente con SOP, utilizando como punto de corte el 20 % (Figura 3) (36).
Inhibidores de la aromatasa (IA)
Actualmente constituyen una alternativa, como inductor de la ovulación; aun cuando la FDA no lo ha aprobado para tal fin.
Su mecanismo de acción consiste en disminuir la conversión de la androstenediona a estrógenos a nivel ovárico, por lo que el estado de hipoestrogenismo resultante ejerce una retroalimentación positiva sobre el eje hipotálamo-hipófisis aumentando la secreción de gonadotropinas. No ejerce efecto antiestrogénico a nivel de endometrio ni glándulas endocervicales. Tiene una vida media corta y una tasa de aclaramiento rápida, lo cual minimiza la acumulación de la droga en ciclos repetidos. La literatura reporta diversidad en cuanto a la tasa de ovulación, así como tasa de embarazo y posible efecto teratogénico (38,39).
En los momentos actuales, el letrozol ha reportado mayor eficacia en el manejo de la inducción de ovulación en aquellas pacientes con SOP que son resistente al citrato de clomifeno, o en las que presentan falla al CC (aquellas con grosor de línea endometrial < 6 mm) (39). En ese mismo orden de ideas, los estudios multicéntricos del Instituto Nacional de salud (NICHD) demostraron alta seguridad y eficacia, así como una baja incidencia del síndrome de hiperestimulación ovárica (40-42).
El esquema a seguir en los ciclos estimulados con Letrozol es similar al de CC:
- Se realiza ultrasonido basal, entre los días 1 y 3 del ciclo; se debe encontrar una línea endometrial < 5 mm y ovarios con folículos < 10 mm.
- Dosis de inhibidor de aromatasa: 5 a 7,5 mg; desde el día 3 al 7
- Duración: 5 días.
- Monitoreo interdiario a partir del día 11 del ciclo hasta obtener un folículo entre 20 a 24 mm, cuando se indica hCG (recombinante 250 o Urinaria 5 000 a 10 000 UI).
Gonadotropinas
La estimulación ovárica con gonadotropinas exógenas es el tratamiento más aceptado para las pacientes anovulatorias tipo II de la OMS que son resistentes al tratamiento con CC.
Las gonadotropinas existentes en el mercado son HMG y HMG-HP (75 UI FSH +75 UI LH), FSH urinaria (0,1 % de LH) y FSH recombinante (sin acción LH). Durante mucho tiempo se demonizó el uso de HMG en el tratamiento del SOP, basándose en que desde el punto de vista fisiopatológico el SOP se acompaña frecuentemente de hipersecreción de LH en fase folicular inicial, lo que supondría que el añadir más LH exógena podría tener efectos deletéreos sobre la maduración folicular, provocando luteinizaciones prematuras, ovulaciones no controladas, más defectos de fase lútea, así como mayores tasas de abortos (43).
Por otro lado, surgieron trabajos que describieron una eficacia superior de la FSHr frente a la urinaria en la inducción de la ovulación en casos de SOP, lo que hacía a la FSHr la gonadotropina ideal en estos casos (44). Trabajos posteriores han demostrado que no existen diferencias en cuanto a la tasa de ovulación y embarazo entre las distintas gonadotropinas existentes en el mercado (45-47).
Incluso se ha publicado la hipótesis que el tratamiento mediante un fármaco con acción LH es beneficioso en el SOP, ya que la LH aportada favorecería la atresia de los folículos más pequeños, evitando el desarrollo multifolicular tan frecuente en este tipo de mujeres (48).
De la misma forma se han definido los estudios de medicina basada en la evidencia o las distintas guías clínicas existentes sobre el tema (49-51), lo que nos lleva a afirmar que cualquier gonadotropina es útil en el tratamiento del SOP, debiéndonos guiar por aspectos de costo-beneficio para elegir el fármaco a usar. Sin embargo, es de preferencia esquemas con FSH recombinante.
Los protocolos a seguir en estas pacientes, dependerá si serán sometidas a baja o alta complejidad.
Protocolos de estimulación ovárica en pacientes con SOP
Existen diversidad de protocolos; entre ellos (52-55):
a- Protocolo de pauta ascendente:
Incremento paulatino de dosis de gonadotropina
b- Protocolo de pauta descendente:
Descenso de dosis de gonadotropina según respuesta
c- Protocolo de dosis fija o sostenida:
Mantenimiento de dosis de gonadotropina de forma sostenida según respuesta
D-Protocolo crónico de baja dosis:
Incremento paulatino en muy baja dosis de gonadotropinas y a tiempo espaciado
A continuación describiré los 2 protocolos más utilizados en el SOP (53,55):
Protocolo de pauta ascendente (Figura 4)
Realizar ecosonograma día 2 a 3 del ciclo: LE: < 5 mm y ovarios con folículos < 10 mm.
Inicio con baja dosis de gonadotropinas día 2 a 3 del ciclo (50 -75 UI)
Mantener dosis durante 5 a 7 días.
Incrementar dosis (50 -75UI) después de 7 días y luego cada 3 a 5 días según respuesta.
Monitoreo ecosonográfico entre día 6 a 8.
Colocación de hCG; siempre y cuando no existan más de 3 folículos entre 17 a 20 mm Protocolo crónico de baja dosis (Figura 5).
Realizar ecosonograma día 2 a 3 del ciclo: LE: < 5 mm y ovarios con folículos < 10 mm.
Inicio con baja dosis de gonadotropinas día 2 a 3 del ciclo (37,5-75 UI)
Monitoreo ecosonográfico entre día 6 a 8.
Mantener dosis durante 14 días (primer ciclo) o 7 días en ciclos subsiguientes
Incrementar dosis (25 -37,5UI) cada 7 días.
Colocación de hCG; siempre y cuando no existan más de 3 folículos entre 17 a 20 mm
El tiempo usual de duración del tratamiento oscila entre 14 y 21 días.
Es importante considerar la cancelación del ciclo en aquellos casos donde:
El estradiol plasmático sea > a 2500 pg/mL Presencia de 3 folículos >16 mm y/o >10 folículos de 10 a 15 mm.
Multipunción ovárica laparoscópica (MOL)
Se basa en la idea clásica y demostrada de que la destrucción de tejido ovárico contribuye a mejorar las tasas de ovulación y de embarazo. Se han descrito 80 % -90 % de ovulación y 60 % -70 % de gestaciones, evitando los embarazos múltiples y las hiperestimulaciones ováricas que producen los tratamientos con gonadotropinas (56).
La MOL por diatermia láser consiste en realizar 4 – 10 punciones en cada ovario con una profundidad de 4 -10 mm; es la versión laparoscópica de la ya abandonada resección cuneiforme ovárica. Diversos grupos analizan factores predictores de éxito tras la MOL y, mientras que unos no encuentran ningún parámetro que prediga el éxito de tratamiento (57), otros plantean que la obesidad marcada, niveles elevados de LH, la hiperandrogenemia y la duración de la infertilidad son factores desfavorables de éxito (58).
En contra de su uso está el riesgo quirúrgico de la laparoscopia, aumento de adherencias peritubáricas y el hecho de que una acción excesiva sobre el ovario puede provocar la aparición de fallo ovárico prematuro.
En general, los metanálisis recomiendan la MOL en casos de resistencia al CC, o en pacientes sometidas a laparoscopia por otra causa (56-59).
Alta Complejidad. Estimulación Multifolicular.
La estimulación ovárica controlada para un ciclo de FIV en pacientes con SOP, es uno de los casos más difíciles a los que debe enfrentarse un especialista en reproducción debido a su peculiar respuesta a la estimulación, a la dificultad en ocasiones de hallar la dosis adecuada y al mayor riesgo de hiperestimulación ovárica que presentan.
Existen diferentes protocolos de uso de gonadotropinas y análogos de la hormona liberadora de gonadotropinas (GnRH).
Estos tratamientos ofrecen la oportunidad de corregir in vivo las anomalías endocrinas características de las pacientes con SOP, mediante el empleo de análogos agonistas de GnRH que normalizan los niveles séricos de LH, lo que permite obtener una calidad ovocitaria, tasas de fecundación y un desarrollo embrionario correcto; así como una disminución de las tasas de abortos. Dentro de los protocolos existentes sobre la utilización de los análogos de la GnRH, el protocolo largo es el más eficaz (60).
Protocolos largos: pueden ser de inicio en fase folicular o lútea del ciclo previo al del estímulo. El más utilizado es el de inicio en fase lútea del ciclo previo (día 21 del ciclo o día +7). A partir de los 10 días de uso se evalúa la supresión ovárica por medio de ecografía (ausencia de quistes foliculares residuales) y estradiol sérico (< 50 pg/mL). Una vez confirmada dicha supresión, se puede disminuir la dosis del análogo a la mitad y comenzar con la aplicación de las gonadotropinas de acuerdo al protocolo elegido. En este grupo de paciente la dosis ideal oscila entre 75 a 150 UI; y se decide mantener, incrementar o bajar dosis, según respuesta, hasta alcanzar los criterios para la administración de la hCG (61,62).
Aplicación de la gonadotropina coriónica humana
El momento de la aplicación de la hCG, 10 000 UI (de hCG urinaria, IM o SC) o 250 µg (de hCG recombinante, por vía SC), se decidirá frente a la observación ecográfica de por lo menos 2 folículos mayores o iguales a 18 mm, con un nivel de estradiol equivalente a 150 a 250 pg/mL por folículo maduro. La aplicación será programada 34-36 horas antes de la aspiración folicular (63).
Protocolo de antagonista de GnRH
Tras la reciente introducción de los antagonistas de GnRH (antGnRH), disponemos de un fármaco capaz de producir una inmediata inhibición de la secreción hipofisaria de gonadotropinas, mediante el bloqueo competitivo de los receptores de la GnRH, sin producir el efecto de estimulación ( flare up) de los agonistas, lo que permite su uso en la prevención de los picos precoces de LH, junto con una reducción en la duración del tratamiento; además disminuye el riesgo del síndrome de hiperestimulación ovárica (64).
La dosis terapéutica mínima ha sido fijada en 0,25 mg/día. Según el modo en que se inicie su administración, se clasifica en rígido (siempre se inicia en día 6 de la estimulación) o flexible. En este último caso, su aplicación comienza cuando se alcanzan folículos ≥ 14 mm.
Con el uso de antagonista, el disparo ovulatorio puede realizarse con hCG (igual esquema que en los protocolos con agonistas), o con agonista de la GnRH, como el acetato de leuprolide a una dosis única de 0,2 cm3 SC (65).
En los protocolos que utilizan antagonistas de GnRh, los pasos son similares a los descritos para agonistas:
- Las dosis de gonadotropinas oscilan entre 75 a 150 UI/ día
- Inicio entre el segundo o tercer día del ciclo menstrual
- El incremento de la dosis dependerá de la respuesta
En algunas oportunidades, los ciclos deben ser cancelados debido a una respuesta excesiva por el riesgo de hiperestimulación ovárica.
Criterios de cancelación
- Número mayor a 18 folículos ≥ 14 mm.
- El día de la administración de hCG con nivel de estradiol ≥ 5 000 pg/mL.
En estos casos de respuesta exagerada, se podrán considerar medidas de rescate (66):
- Diferir o llamado Coasting: consiste en la suspensión de gonadotropinas y en el retraso de la aplicación de la hCG, pero manteniendo los aGnRH hasta que los valores de E2 desciendan a valores seguros.
- Hacer el disparo ovulatorio con agonista en ciclos manejados con antagonistas
- Aplicar hCG, aspiración de ovocitos y criopreservación de embriones, para posterior transferencia en otro ciclo.
- Cancelar ciclo y no aplicar hCG.
MADURACIÓN IN VITRO
Más recientemente se ha planteado la maduración in vitro (MIV), técnica de FIV realizada con ovocitos previamente madurados in vitro sin previa estimulación ovárica. En mujeres con SOP las ventajas de la MIV frente al FIV convencional, fundamentalmente es la ausencia de riesgo de SHO. Los estudios reportan tasas de embarazo y tasa de nacidos vivos similares a los obtenidos en FIV convencional, y le dan valor a parámetros, tales como contaje de folículos antrales, testosterona total y niveles de HAM, como predictivos de éxito en MIV (67).
La Figura 6 muestra de manera resumida, las tres líneas terapéuticas principales recomendadas en pacientes con SOP e infertilidad.
Conclusiones
Individualizar a la paciente con SOP y definir su fenotipo para diagnosticar y tratar las comorbilidades y decidir los protocolos de inducción de ovulación.
HAM es un marcador subrogado para éxito de fertilidad, sin embargo, su uso rutinario aún es controversial.
La primera línea de tratamiento consiste en las modificaciones del estilo de vida.
La metformina está indicada en pacientes con resistencia insulínica, obesas, resistentes al CC y aquellas sometidas a técnicas de reproducción asistida de alta complejidad.
El citrato de clomifeno es el inductor de ovulación de primera línea.
Los inhibidores de aromatasa son una nueva alternativa como inductor de ovulación.
Las gonadotropinas con pauta de administración lenta ascendente o protocolos crónicos de baja dosis, son los de elección.
La multipunción ovárica vía laparoscópica, está indicada en pacientes resistentes al tratamiento médico.
FIV es una opción para el tratamiento de pacientes con SOP, cuando no hay respuesta a las otras alternativas o en caso de que la pareja tenga otras indicaciones para técnicas de alta complejidad.
REFERENCIAS
1. Chang R. A practical approach to the diagnosis of polycystic ovary síndrome. Am J Obstet Gynecol. 2004;191:713-717. [ Links ]
2. Adams J, Polson DW, Franks S. Prevalence of polycystic ovaries in women with anovulation and idiopathic hirsutism. Br Med J (Clin Res Ed). 1986;293:355-359. [ Links ]
3. Homburg R. The management of infertility associated with polycystic ovary síndrome. Reprod Biol Endocrinol. 2003;1:109. [ Links ]
4. Erickson GF, Hsueh AJ, Quigley ME, Rebar R, Yenn S. Functional studies of aromatase activity in human granulose cells from normal and polycystic ovaries. J Clin Endocrinol Metab. 1979;49:54-59. [ Links ]
5. Frank S, Mason HD, Polson DW, Winston RM, Margara R, Reeed MJ. Mechanism and management of ovulatory failure in women with polycystic ovary syndrome. Hum Reprod. 1988;3:531-534. [ Links ]
6. Mason HD, Margara R, Winston RM, Beard RW, Reed MJ, Frank S. Inhibition of estradiol production by epidermal growth factoring human granulose cells of normal and poycystic ovaries. Clin Enddocrinol. 1990;33:511-517. [ Links ]
7. Welt CK, Taylor AE, Martin KA, Hall JE. Serum inhibin b in polycystc ovary syndrome: Regulation by insulin and luteinizing hormone. J Clin Endocrinol Metab. 2002;87:5559-5565. [ Links ]
8. Pellatt L, Hanna L, Brincat M, Galea R, Brain H, Whitehead S, et al. Granulosa cell production of anti-mullerian hormone is increased in polycystic ovaries. J Clin Endocrinol Metab. 2007;92:240-245. [ Links ]
9. La Marca A, Giulini S, Tirelli A, Bertucci E, Marsella T, Xella S, et al. Anti- mullerian hormone measurement on any day of the menstrual cycle strongly predicts ovarian response in assisted reproductive technology. Hum Reprod 2007; 22:766–71. [ Links ]
10. Desforges-Bullet V, Gallo C, Lefebvre C, Pigny P, Dewailly D, Catteau Jonard S. Increased antimullerian hormone and decreased FSH levels in follicular fluid obtained in women with polycysticovaries at the time of follicle puncture for in vitro fertilization. Fertil Steril. 2010;94:198-204. [ Links ]
11. Kaya C, Pabuccu R, Satıroglu H. Serum antimullerian hormone concentrations on day 3 of the in vitro fertilization stimulation cycle are predictive of the fertilization, implantation, and pregnancy in polycystic ovary syndrome patients undergoing assisted reproduction. Fertil Steril. 2010;94:2202-2207. [ Links ]
12. Tal R, Seifer DB, Khanimov M, Malter HE, Grazi RV, Leader B. Characterization of women with elevated antimullerian hormone levels (AMH): Correlation of AMH with polycystic ovarian syndrome phenotypes and assisted reproductive technology outcomes. Am J Obstet Gynecol. 2014;211:1-8. [ Links ]
13. Irani M, Merhi Z. Role of vitamin D in ovarian physiology and its implication in reproduction: A systematic review. Fertil Steril. 2014;102:460-468. [ Links ]
14. Wild R, Carmina E, Diamanti Kandarakis E, Dokras A, Escobar Morreale H, Futterweit W, et al. Assessment of Cardiovascular Risk and Prevention of Cardiovascular Women with the Polycystic Ovary Syndrome. J Clin Endocrinol Metab. 2010;95:2038-2049. [ Links ]
15. Harborne L, Fleming R, Lyall H, Norman J, Sattar N. Descriptive review of the evidence for the use of metformin in polycystic ovary syndrome. Lancet. 2003;361:1894-1901. [ Links ]
16. Legro R, Myers E. Surrogate end-points or primary outcomes in clinical trials in women with polycystic ovary syndrome? Hum Reprod. 2004;19:1697-1704. [ Links ]
17. The Rotterdam ESHRE/ASRM-sponsored PCOS Consensus Workshop Group. Fertil Steril. 2004;81:19. [ Links ]
18. Bajares M, Pizzi R, Velázquez E. Consenso venezolano de síndrome de ovario poliquístico. Rev Venez Endocrinol Metab. 2007;5:67-71. [ Links ]
19. Forty Fourth Annual Postgraduate Program. PCOS: A comprehensive Update on Fertility Management. 2011. [ Links ]
20. The Thessaloniki ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group. Consensus on infertility treatment related to polycystic ovary syndrome. Fertil Steril. 2008;89:505-522. [ Links ]
21. Conway G, Dewailly D, Diamanti-Kandarakis E, Escobar-Morreale HF, Franks S, Gambineri A, et al. ESE PCOS Special Interest Group. The polycystic ovary syndrome: A position statement from the European Society of Endocrinology. Eur J Endocrinol. 2014 ;171:1-29. [ Links ]
22. Moran LJ, Pasquali R, Teede HJ, Hoeger KM, Norman RJ. Treatment of obesity in polycystic ovary syndrome: A position statement of the Androgen Excess and Polycystic Ovary Syndrome Society. Fertil Steril. 2009;92:1966-1982. [ Links ]
23. Teede HJ, Misso ML, Deeks AA, Moran LJ, Stuckey BG, Wong JL, et al; Guideline Development Groups. Assessment and management of polycystic ovary syndrome: Summary of an evidence-based guideline. Med J Aust. 2011;195:S65-112. [ Links ]
24. Velázquez EM, Mendoza S, Hamer T, Sosa F, Glueck CJ. Metformin therapy in polycystic ovary syndrome reduces hyperinsulinemia, insulin resistance, hyperandrogenemia, and systolic blood pressure, while facilitating normal menses and pregnancy. Metabolism. 1994;43:647-654. [ Links ]
25. Palomba S, Falbo A, La Sala GB. Metformin and gonadotropins for ovulation induction in patients with polycystic ovary syndrome: A systematic review with meta-analysis of randomized controlled trials. Reprod Biol Endocrinol. 2014;3:12-13. [ Links ]
26. Palomba S, Falbo A, Orio F Jr, Manguso F, Russo T, Tolino A, et al. A randomized controlled trial evaluating metformin pre-treatment and co-administration in nonobese insulin-resistant women with polycycstic ovary syndrome treated with controlled ovarian stimulation plus timed intercourse or intrauterine insemination. Hum Reprod. 2005;20:2879-2886. [ Links ]
27. Tang T, Glanville J, Orsi N, Barth JH, Balen AH. The use of metformin for women with PCOS undergoing IVF treatment. Human Reprod. 2006;21:1416-1425. [ Links ]
28. The practice committee of the American Society for Reproductive Medicine. Use of clomiphene citrate in infertile women: A committee opinion. Fertil Steril. 2013;100:341-348. [ Links ]
29. Imani B, Eijkemans MJ, te Velde ER. A nomogram to predict the probability of live birth after clomifene citrate induction of ovulation in normogonadotropic oligomenorrheic infertility. Fertil Steril. 2002;77:91- 97. [ Links ]
30. Imani B, Eijkemans MJ, te Velde ER, Habbema JD, Fauser BC. Predictors of chances to conceive in ovulatory patients during clomiphene citrate induction of ovulation in normogonadotropic oligoamenorrheic infertility. J Clin Endocrinol Metab. 1999;84:1617- 1622. [ Links ]
31. Balen A, Conway G, Homburg R, Legro R. Polycystic ovary syndrome. A Guide to clinical management. Taylor & Francis; 2005.p.169-192. [ Links ]
32. Wu CH, Winkel CA. The effect of initiation day on clomiphene citrate therapy. Fertil Steril. 1989;52:564- 568. [ Links ]
33. Gysler M, March CM, Mishell DR Jr, Bailey EJ. A decades experience with an individualized clomiphene treatment regime including its effect on the postcoital test. Fertil Steril. 1982;37:161-167. [ Links ]
34. Rosen MP, Shen S, Dobson AT, Rinaudo PF, McCulloch CE, Cedars MI. A quantitative assesment of follicle size on oocyte developmental competence. Fertil Steril. 2008;90:684-690. [ Links ]
35. Palatnik A, Strawn E, Szabo A, Robb P. What is the optimal follicular size before triggering ovulation in intrauterine insemination cycles with clomiphene citrate or letrozole? An analysis of 988 cycles. Fertil Steril. 2012;97:1089-1094. [ Links ]
36. Legro RS, Barnhart HX, Schlaff WD, Carr BR, Diamond MP, Carson SA, et al. Cooperative multicentre Reproductive Medicine Network. Clomiphene, metformin, or both for infertility in the polycystic ovary syndrome. N Engl J Med. 2007;8;356:551-566. [ Links ]
37. Rausch ME, Legro RS, Barnhart HX, Schlaff WD, Carr BR, Diamond MP, et al. Cooperative multicentre Reproductive Medicine Network. Predictors of pregnancy in women with polycystic ovary syndrome. J Clin Endocrinol Metab. 2009;94:3458-3466. [ Links ]
38. Requena A, Herrero J, Landeras J, Navarro E, Nevro JL, Salvador C, et al. Reproductive Endocrinology Interest Group of Spanish Society of Fertility. Use of letrozole in assisted reproduction: A systematic review and meta-analysis. Human Reprod Update. 2008;14:571-582. [ Links ]
39. Casper RF, Mitwally MF. A historical perspective of aromatase inhibitors for ovulation induction. Fertil Steril. 2012;98:1352-1355. [ Links ]
40. Franik S, Kremer JA, Nelen WL, Farquhar C, Marjoribanks J. Aromatase inhibitors for subfertile women with polycystic ovary syndrome: Summary of a Cochrane review. Fertil Steril. 2015;103:353-355. [ Links ]
41. Diamond MP, Legro RS, Coutifaris C, Alvero R, Robinson RD, Casson P, et al. National Institute of Child Health and Human Development (NICHD), Reproductive Medicine Network. Assessment of multiple intrauterine gestations from ovarian stimulation (AMIGOS) trial: baseline characteristics. Fertil Steril. 2015;103:962-973. [ Links ]
42. Diamond MP, Legro RS, Coutifaris C, Alvelo R, Robison RD, Casson P, et al. for the National Institute of Child Health and Human Development (NICHD) Reproductive Medicine Network. Letrozole, Gonadotropin, or clomiphene for Unexplained Infertility. N Engl J Med. 2015;373:1230-1240. [ Links ]
43. Teissier MP, Chable H, Paulhac S, Aubard Y. Comparison of follicle steroidogenesis from normal and polycystic ovaries in women undergoing IVF: Relationship between steroid concentrations, follicle size, oocyte quality and fecundability. Human Reprod. 2000;15:2471-2477. [ Links ]
44. Revelli A, Poso F, Gennarelli G, Grassi F, Moffa F, Gracci G, et al. Recombinant versus highly-purified, urinary follicle-stimulatin hormone (r-FSH vs. HP-uFSH) in ovulation induction: A prospective, randomized study with cost-minimization analysis. Reprod Biol Endocrinol. 2006;4:38. [ Links ]
45. Platteau P, Andersen N, Balen A, Devroey P, Sorensen P, Helmgaard L, et al. Similar ovulation rates, but different follicular development with highly purified menotrophin compared with recombinant FSH in WHO Group II anovulatoy infertility a randomized controlled study. Human Reprod. 2006;1:1798-1804. [ Links ]
46. Van Wely M, Andersen CY, Bayram N, van der Veen F. Urofollitropin and ovulation induction. Treat Endocrinol. 2005; 4:155-165. [ Links ]
47. Gerli S, Casini ML, Unfer V, Costabile L, Mignosa M, Di Renzo GC. Ovulation induction with urinary FSH or recombinant FSH in polycystic ovary syndrome patients: A prospective randomized analysis of costeffectiveness. Reprod Biomed Online. 2004;9:494- 499. [ Links ]
48. Loumaye E, Engrand P, Shoham Z, Hillier SG, Baird DT. Clinical evidence for an LH Ceiling effect induced by administration of recombinant human LH during the late follicular phase of stimulated cycles in world Health Organization type I and type II anovulation. Hum Reprod. 2003;18:314-322. [ Links ]
49. Bayram N, van Wely M, van Der Veen F. Recombinant FSH versus urinary gonadotrophins or recombinant FSH for ovulation induction in subfertility associated with polycystic ovary syndrome. Cochrane Database Syst Rev. 2001:CD002121. [ Links ]
50. Nugent D, Vandekerckhove P, Hughes E, Arnot M, Lilford R. Gonadotrophin therapy for ovulation induction in subfertility associated with polycystic ovary syndrome. Cochrane Database Syst Rev. 2000:CD000410. [ Links ]
51. Tanbo T, Dale PO, Kjekshus E, Haug E, Abyholm T. Stimulation with menopausal gonadotropin versus follicle-stimulating hormone after pituitary suppression in polycystic ovarian syndrome. Fertil Steril. 1990;53:798-803. [ Links ]
52. Wang CHF, Gemzell C. The use of human gonadotropins for the induction of ovulation in women with polycystic ovary disease. Fertil Steril. 1980;33:479-486. [ Links ]
53. Polson DW, Mason HD, Saldahna MBY, Frank S. Ovulation of a single dominant follicle during treatment with low-dose pulsatile follicle stimulating hormone in women with polycystic ovary syndrome. Clin Endocrinol. 1987;26:205-212. [ Links ]
54. Hamilton-Fairy D, Kiddy D, Watson H, Sangle M, Frank S. Low dose gonadotrophin therapy for induction of ovulation in 100 women with PCOS. Human Reprod. 1991;6:1095-1099. [ Links ]
55. Homburg R, Levy T, Ben-Rafael Z. A comparative prospective study of conventional regimen with chronic low-dose administration of follicle-stimulating hormone for anovulation associated with polyscystic ovary syndrome. Fertil Steril. 1995;63:729-733. [ Links ]
56. Farquhar C, Lilford RJ, Marjoribanks J, Vandekerckhove P. Laparoscopic drilling by diathermy of laser for ovulation induction in anovulatory polycystic ovary syndrome. Cochrane Database Syst Rev. 2007:CD001122. [ Links ]
57. Van Wely M, Bayram N, Van der Veen F, Bossuyt PM. Predictors for treatment ailure after laparoscopic electrocautery of the ovaries in women with clomiphne citrate resistant polycystic ovary syndrome. Hum Reprod. 2005;20:900-905. [ Links ]
58. Amer SAK, Li TC, Ledger WL. Ovulation induction using laparoscopic ovarian drilling in women with polycystic ovarian syndrome: Predictors of success. Hum Reprod. 2004;19:1719-1724. [ Links ]
59. Farquhar C, Brown J, Marjoribanks J. Laparoscopic drilling by diathermy or laser for ovulation induction in anovulatory polycystic ovary syndrome. Cochrane Database Syst Rev. 2012:CD001122. [ Links ]
60. Frank S, Roberts R, Hurdy K. Gonadotropin regimens and oocyte quality in women with polycystic ovaries. Reprod Biomed Online. 2002;6:181-184. [ Links ]
61. De Ziegler D, Cedars ML, Randle D, Lu KJ, Judd HL, Meldrum DR. Supression of the ovary using a gonadotropin releasing-hormone agonist prior to stimulation for oocyte retrieval. Fertil Steril. 1987;48:807-810. [ Links ]
62. Seifer DB, Thornton KL, De Cherney AH, Lavy G. Early pituitary desensitization and ovarian suppression with leuprolide acetate is associated with in vitro fertilization - embryo transfer success. Fertil Steril. 1991;56:500-504. [ Links ]
63. Kolibianakis EM, Papanikolaou EG, Tournaye H, Camus M, Van Steirteghem AC, Devroey P. Triggering final oocyte maturation using different doses of human chorionic gonadotropin: A randomized pilot study in patients with polycystic ovary syndrome treated with gonadotropin-releasing hormone antagonists and recombinant follicle-stimulating hormone. Fertil Steril. 2007;88:1382-1388. [ Links ]
64. Lin H, Li Y, Li L, Wang W, Yang D, Zhang Q. Is a GnRH Antagonist Protocol Better in PCOS Patients? A Meta-Analysis of RCTs. PLoS ONE 2014; 9: e91796. [ Links ]
65. Humaidan P, Papanikolaou E.G, Tarlatzis B.C. GnRHa to trigger final oocyte maturation: A time to reconsider. Human Reprod. 2009;24:2389-2394. [ Links ]
66. Peter Humaidan P, Quartarolo J, Papanikolaou EG. Preventing ovarian hyperstimulation syndrome: Guidance for the clinician. Fertil Steril. 2010;94:389- 400. [ Links ]
67. Siristatidis C, Sergentanis TN, Vogiatzi P, Kanavidis P, Chrelias C, Papantoniou N, et al. In Vitro Maturation in Women with vs. without Polycystic Ovarian Syndrome: A Systematic Review and Meta-Analysis. PLoS ONE. 2015;10:e013469. [ Links ]^rND^sChang^nR^rND^sAdams^nJ^rND^sPolson^nDW^rND^sFranks^nS^rND^sHomburg^nR^rND^sErickson^nGF^rND^sHsueh^nAJ^rND^sQuigley^nME^rND^sRebar^nR^rND^sYenn^nS^rND^sFrank^nS^rND^sMason^nHD^rND^sPolson^nDW^rND^sWinston^nRM^rND^sMargara^nR^rND^sReeed^nMJ^rND^sMason^nHD^rND^sMargara^nR^rND^sWinston^nRM^rND^sBeard^nRW^rND^sReed^nMJ^rND^sFrank^nS^rND^sWelt^nCK^rND^sTaylor^nAE^rND^sMartin^nKA^rND^sHall^nJE^rND^sPellatt^nL^rND^sHanna^nL^rND^sBrincat^nM^rND^sGalea^nR^rND^sBrain^nH^rND^sWhitehead^nS^rND^sLa Marca^nA^rND^sGiulini^nS^rND^sTirelli^nA^rND^sBertucci^nE^rND^sMarsella^nT^rND^sXella^nS^rND^sDesforges-Bullet^nV^rND^sGallo^nC^rND^sLefebvre^nC^rND^sPigny^nP^rND^sDewailly^nD^rND^sCatteau Jonard^nS^rND^sKaya^nC^rND^sPabuccu^nR^rND^sSatroglu^nH^rND^sTal^nR^rND^sSeifer^nDB^rND^sKhanimov^nM^rND^sMalter^nHE^rND^sGrazi^nRV^rND^sLeader^nB^rND^sIrani^nM^rND^sMerhi^nZ^rND^sWild^nR^rND^sCarmina^nE^rND^sDiamanti Kandarakis^nE^rND^sDokras^nA^rND^sEscobar Morreale^nH^rND^sFutterweit^nW^rND^sHarborne^nL^rND^sFleming^nR^rND^sLyall^nH^rND^sNorman^nJ^rND^sSattar^nN^rND^sLegro^nR^rND^sMyers^nE^rND^sBajares^nM^rND^sPizzi^nR^rND^sVelázquez^nE^rND^sConway^nG^rND^sDewailly^nD^rND^sDiamanti-Kandarakis^nE^rND^sEscobar-Morreale^nHF^rND^sFranks^nS^rND^sGambineri^nA^rND^sMoran^nLJ^rND^sPasquali^nR^rND^sTeede^nHJ^rND^sHoeger^nKM^rND^sNorman^nRJ^rND^sTeede^nHJ^rND^sMisso^nML^rND^sDeeks^nAA^rND^sMoran^nLJ^rND^sStuckey^nBG^rND^sWong^nJL^rND^sVelázquez^nEM^rND^sMendoza^nS^rND^sHamer^nT^rND^sSosa^nF^rND^sGlueck^nCJ^rND^sPalomba^nS^rND^sFalbo^nA^rND^sLa Sala^nGB^rND^sPalomba^nS^rND^sFalbo^nA^rND^sOrio^nF Jr^rND^sManguso^nF^rND^sRusso^nT^rND^sTolino^nA^rND^sTang^nT^rND^sGlanville^nJ^rND^sOrsi^nN^rND^sBarth^nJH^rND^sBalen^nAH^rND^sImani^nB^rND^sEijkemans^nMJ^rND^ste Velde^nER^rND^sImani^nB^rND^sEijkemans^nMJ^rND^ste Velde^nER^rND^sHabbema^nJD^rND^sFauser^nBC^rND^sWu^nCH^rND^sWinkel^nCA^rND^sGysler^nM^rND^sMarch^nCM^rND^sMishell^nDR Jr^rND^sBailey^nEJ^rND^sRosen^nMP^rND^sShen^nS^rND^sDobson^nAT^rND^sRinaudo^nPF^rND^sMcCulloch^nCE^rND^sCedars^nMI^rND^sPalatnik^nA^rND^sStrawn^nE^rND^sSzabo^nA^rND^sRobb^nP^rND^sLegro^nRS^rND^sBarnhart^nHX^rND^sSchlaff^nWD^rND^sCarr^nBR^rND^sDiamond^nMP^rND^sCarson^nSA^rND^sRausch^nME^rND^sLegro^nRS^rND^sBarnhart^nHX^rND^sSchlaff^nWD^rND^sCarr^nBR^rND^sDiamond^nMP^rND^sRequena^nA^rND^sHerrero^nJ^rND^sLanderas^nJ^rND^sNavarro^nE^rND^sNevro^nJL^rND^sSalvador^nC^rND^sCasper^nRF^rND^sMitwally^nMF^rND^sFranik^nS^rND^sKremer^nJA^rND^sNelen^nWL^rND^sFarquhar^nC^rND^sMarjoribanks^nJ^rND^sDiamond^nMP^rND^sLegro^nRS^rND^sCoutifaris^nC^rND^sAlvero^nR^rND^sRobinson^nRD^rND^sCasson^nP^rND^sDiamond^nMP^rND^sLegro^nRS^rND^sCoutifaris^nC^rND^sAlvelo^nR^rND^sRobison^nRD^rND^sCasson^nP^rND^sTeissier^nMP^rND^sChable^nH^rND^sPaulhac^nS^rND^sAubard^nY^rND^sRevelli^nA^rND^sPoso^nF^rND^sGennarelli^nG^rND^sGrassi^nF^rND^sMoffa^nF^rND^sGracci^nG^rND^sPlatteau^nP^rND^sAndersen^nN^rND^sBalen^nA^rND^sDevroey^nP^rND^sSorensen^nP^rND^sHelmgaard^nL^rND^sVan Wely^nM^rND^sAndersen^nCY^rND^sBayram^nN^rND^svan der Veen^nF^rND^sGerli^nS^rND^sCasini^nML^rND^sUnfer^nV^rND^sCostabile^nL^rND^sMignosa^nM^rND^sDi Renzo^nGC^rND^sLoumaye^nE^rND^sEngrand^nP^rND^sShoham^nZ^rND^sHillier^nSG^rND^sBaird^nDT^rND^sBayram^nN^rND^svan Wely^nM^rND^svan Der Veen^nF^rND^sNugent^nD^rND^sVandekerckhove^nP^rND^sHughes^nE^rND^sArnot^nM^rND^sLilford^nR^rND^sTanbo^nT^rND^sDale^nPO^rND^sKjekshus^nE^rND^sHaug^nE^rND^sAbyholm^nT^rND^sWang^nCHF^rND^sGemzell^nC^rND^sPolson^nDW^rND^sMason^nHD^rND^sSaldahna^nMBY^rND^sFrank^nS^rND^sHamilton-Fairy^nD^rND^sKiddy^nD^rND^sWatson^nH^rND^sSangle^nM^rND^sFrank^nS^rND^sHomburg^nR^rND^sLevy^nT^rND^sBen-Rafael^nZ^rND^sFarquhar^nC^rND^sLilford^nRJ^rND^sMarjoribanks^nJ^rND^sVandekerckhove^nP^rND^sVan Wely^nM^rND^sBayram^nN^rND^sVan der Veen^nF^rND^sBossuyt^nPM^rND^sAmer^nSAK^rND^sLi^nTC^rND^sLedger^nWL^rND^sFarquhar^nC^rND^sBrown^nJ^rND^sMarjoribanks^nJ^rND^sFrank^nS^rND^sRoberts^nR^rND^sHurdy^nK^rND^sDe Ziegler^nD^rND^sCedars^nML^rND^sRandle^nD^rND^sLu^nKJ^rND^sJudd^nHL^rND^sMeldrum^nDR^rND^sSeifer^nDB^rND^sThornton^nKL^rND^sDe Cherney^nAH^rND^sLavy^nG^rND^sKolibianakis^nEM^rND^sPapanikolaou^nEG^rND^sTournaye^nH^rND^sCamus^nM^rND^sVan Steirteghem^nAC^rND^sDevroey^nP^rND^sLin^nH^rND^sLi^nY^rND^sLi^nL^rND^sWang^nW^rND^sYang^nD^rND^sZhang^nQ^rND^sHumaidan^nP^rND^sPapanikolaou^nE.G^rND^sTarlatzis^nB.C^rND^sPeterHumaidan^nP^rND^sQuartarolo^nJ^rND^sPapanikolaou^nEG^rND^sSiristatidis^nC^rND^sSergentanis^nTN^rND^sVogiatzi^nP^rND^sKanavidis^nP^rND^sChrelias^nC^rND^sPapantoniou^nN^rND^1A01^nRita^sPizzi^rND^1A01^nRita^sPizzi^rND^1A01^nRita^sPizzi
Complicaciones obstétricas y ginecológicas del síndrome de ovario poliquístico
Dra. Rita Pizzi
Médico Especialista en Obstetricia y Ginecología. Adjunto docente del Servicio de Endocrinología H.U.C. Coordinadora del Curso Universitario de Endocrinología Ginecológica H.U.C.
Complicaciones obstétricas
El síndrome de ovario poliquístico (SOP), es una disfunción endocrino-metabólica heterogénea de alta prevalencia (5 % -10 %) (1). Históricamente se ha definido como un síndrome relacionado con infertilidad. Hoy en día, la atención se ha desplazado a problemas reproductivos, incluyendo también las complicaciones obstétricas. Por otra parte, el riesgo obstétrico puede ser exacerbado por las comorbilidades, como la obesidad y la resistencia insulínica (RI) típica del síndrome (2).
En el embarazo normal, se producen modificaciones del metabolismo lipídico y de los carbohidratos que tienen como objetivo asegurar una entrega continua de nutrientes al feto, independiente de la ingesta de alimentos por la madre.
Estudios longitudinales durante la gestación, muestran una mayor respuesta insulínica a los nutrientes a pesar de un mínimo deterioro en la tolerancia a la glucosa, lo que es consistente con un aumento progresivo de la resistencia insulínica (3). Simultáneamente, se presenta un aumento progresivo del colesterol total, colesterol-LDL, colesterol-HDL y de los triglicéridos (4).
Desde un punto de vista patogénico, el aumento de la incidencia de complicaciones en el embarazo en mujeres con síndrome de ovario poliquístico puede ser el resultado de varios factores, como las características del SOP, los tratamientos de infertilidad, embarazos múltiples, obesidad, IR, disfunción metabólica, inflamación y alteraciones de la placenta (5).
Muchos estudios sugieren un aumento en el riesgo de patologías obstétricas: pérdida gestacional, hipertensión gestacional, diabetes gestacional (DG), prematuridad, bajo peso al nacer o macrosomía, incremento de cesáreas y complicaciones neonatales (6).
Pérdida gestacional
El incremento del riesgo de aborto en pacientes con SOP, todavía se debate. Se ha reportado entre 30 % hasta 50 %, representando una incidencia tres veces más alta que para las mujeres sanas (7). Ensayos prospectivos aleatorizados reportan que el aborto en pacientes con SOP ocurre solo en el 15 %-25 % de los casos, lo cual es un porcentaje comparable con la frecuencia de aborto en la población en general (8). En el consenso SOP 2012 (9), se sugiere que las tasas de aborto son comparables entre las mujeres con y sin síndrome de ovario poliquístico, aunque los datos muestran resultados contradictorios.
Algunos autores sugieren que existe una relación entre el aumento de la concentración de LH en el suero y el aborto recurrente. En pacientes con concentraciones normales de LH la frecuencia de aborto es 12 %, en mujeres con niveles elevados de LH la frecuencia es 65 %. La elevada concentración de LH en fase folicular puede conducir a un desarrollo prematuro del ovocito, mientras que la alta concentración de LH en la fase lútea puede causar anomalías en las funciones de endometrio durante la implantación (10).
También se han reportado alteraciones de los biomarcadores de receptividad endometrial a la implantación del embrión en las pacientes con SOP: la α β3 integrinas y glicodelina, están disminuidos; la expresión del REα persiste anormalmente en la ventana de la implantación en el endometrio (10). Alteraciones de la actividad del inhibidor del activador del plasminógeno (PAI-1) y la placentación anormal fue reportada por Glueck y col. (11).
Un meta-análisis de estudios (12) en mujeres con y sin síndrome de ovario poliquístico sometidas a FIV, demostró que no había diferencia en las tasas de aborto espontáneo, este resultado fue confirmado en un reciente estudio de cohorte (13).
Hipertensión gestacional y preeclampsia
Diversos estudios han reportado que del 2 %-5 % de las mujeres sanas embarazadas son diagnosticadas con trastornos hipertensivos del embarazo. En un tercio de las mujeres en este grupo, el problema se convierte en forma más grave, la preeclampsia (14).
Sin duda, hay muchos factores de riesgo para el desarrollo de hipertensión durante el embarazo, uno de estos factores es la coexistencia de síndrome de ovario poliquístico.
Se ha reportado que en las mujeres embarazadas con SOP, la presión sistólica, diastólica y media son estadísticamente más altas, y se ha observado un aumento de la rigidez arterial (15).
Se ha de destacar que el riesgo de desarrollar preeclampsia es aún mayor por la coexistencia de riesgo adicional por factores asociados con el SOP, en particular la obesidad y la DG. También la donación de ovocitos y la inseminación con semen de donante son factores de riesgo independiente para preeclampsia (16,17). Por tanto, las pacientes afectadas por SOP y factores de riesgo adicionales deben estar bajo el control especial para evitar esta complicación.
Todos los meta-análisis sobre las complicaciones del embarazo han reportado un aumento del riesgo de hipertensión inducida por embarazo y preeclampsia en mujeres con SOP de al menos tres veces (5). Específicamente, el riesgo de hipertensión gestacional y preeclampsia es de 12,7 % y 8 %, respectivamente, significativamente más altas que las observadas en los controles sanos (5,3 % y 2 %, respectivamente) (17-19).
Diabetes gestacional
El embarazo es un estado fisiológico de resistencia insulínica (RI), siendo probable que en aquellas pacientes con SOP y RI, el embarazo constituya un factor agravante de la insulinorresistencia pre- existente, pudiendo desencadenar una diabetes gestacional (20).
La diabetes gestacional (DG) es la complicación más comúnmente descrita mujeres con SOPy embarazo, reportado entre 6 % y un 15 %, significando un riesgo tres veces mayor que en la embarazada sana (5,17-19). Estudios prospectivos recientes reportan un aumento de la incidencia de la DG de 14,7 % - 22 % en mujeres con SOP (21,22).
El SOP ha sido descrito como un factor de riesgo para DG, por tanto es importante la realización de una consulta preconcepcional tres meses antes de la búsqueda del embarazo con la finalidad de las complicaciones metabólicas del embarazo y su producto (23).
En la primera valoración prenatal se debe determinar glucemia basal, hemoglobina A1c o una glucemia casual, para detectar tempranamente las diabéticas no reconocidas previamente, usando los criterios estándar de la American Diabetes Association (ADA) del 2015 (24). Si no se confirma una diabetes manifiesta, una glucemia basal igual o mayor de 92 mg/dL pero menor de 125 mg/dL, hace el diagnóstico de diabetes gestacional. Si la glucemia basal es menor de 92 mg/dL, se debe realizar una prueba de tolerancia oral a la glucosa con 75 g de glucosa, entre las semanas 24 y 28 de gestación, los valores diagnósticos se muestran en el Cuadro 1 (24-26).
La terapia nutricional en pacientes con DG, es la primera línea en el manejo de estas pacientes, consiste en suministrar una adecuada ingesta de calorías y nutrientes para una apropiada ganancia de peso gestacional, registrar cifras normales de glucemia con ausencia de cetosis (27). El ejercicio mejora la sensibilidad a la insulina, es especialmente importante durante el embarazo cuando está asociado a una ganancia excesiva de peso gestacional, principalmente durante el primer trimestre, y en obesidad (28).
Cuando los objetivos del control glucémico (24-26):
glicemia pre-prandial ≤ 95 mg/dL, 1 hora pos-prandial ≤ 140 mg/dL y 2 horas pos-prandial ≤ 120 mg/dL, no se logran con 1-2 semanas de dieta y ejercicios, se recomienda el tratamiento farmacológico.
Diversos estudios han demostrado la seguridad de la metformina (29), se ha planteado mantener la metformina en las pacientes con SOP durante todo el embarazo para disminuir la tasa de abortos espontáneos, prevenir el desarrollo de diabetes gestacional, el síndrome hipertensivo del embarazo y la androgenización prenatal del hijo de madre con SOP (20).
Hasta el momento, no se ha descrito un efecto deletéreo de la metformina sobre el peso corporal, talla y cambios en el desarrollo psicomotor de los recién nacidos (30).
La metformina puede considerarse como el medicamento de primera elección para iniciar el tratamiento de la paciente con DM gestacional (31,32). El estudio de Sir Peterman y col. (20) incluyó 150 pacientes con SOP que deseaban embarazo, los resultados reportaron que las mujeres quienes recibieron metformina durante el embarazo, la prevalencia de diabetes gestacional disminuyó significativamente de 36 % a 14 %.
La eficacia y seguridad de la insulina ha hecho que sea considerada el tratamiento estándar de la diabetes en el embarazo (33). El tratamiento con insulina puede ser inconveniente por la necesidad de múltiples dosis, costo, dolor por las inyecciones, auto monitoreo, refrigeración, condiciones que dificultan la adherencia al tratamiento. Estas consideraciones han llevado a buscar alternativas a la insulina en el tratamiento de la DM gestacional, como son los hipoglucemiantes orales (34).
Peso fetal
Entre los eventos deletéreos que se producen durante la vida intrauterina en mujeres con SOP, cabe mencionar la restricción del crecimiento intrauterino que dará origen a niños pequeños para la edad gestacional (PEG). La causa principal del bajo peso al nacer es la resistencia a la insulina y trastorno del crecimiento dependiente de la insulina (20,35). Ibañez y col. (36) en 1998 y Benitez y col. (37) en 2001, documentaron la correlación anterior, así como el aumento de aparición riesgo de síndrome de ovario poliquístico en las mujeres que nacen con bajo peso al nacer.
Por otra parte, los estudios de Laitinen y col. (38) en 2003 no han demostrado ninguna correlación entre SOP y PEG.
La situación contraria, la macrosomía fetal, es insignificante en pacientes con SOP (6).
Se debe enfatizar que todos los tres grupos de complicaciones, es decir, la DG, los trastornos hipertensivos del embarazo y los trastornos del crecimiento del feto, tienen un fondo etiológico común. Se cree que el mecanismo que subyace a estos trastornos puede ser la obesidad, la alteración de glucosa y el trastorno del flujo sanguíneo uterino (39).
Complicaciones en el parto
Los datos sobre las complicaciones del parto, así como aquellos en el riesgo de resultados adversos en el feto, en las mujeres con SOP son controversiales.
El riesgo de parto prematuro se duplica en pacientes con SOP con OR: 2,20 (IC del 95 %: 1,59 a 3,04) (5).
Los recién nacidos tenían el doble de riesgo de ingreso en la unidad de cuidados intensivos neonatales y su mortalidad se incrementó el triple (8).
El riesgo de cesárea ha sido reportado en metaanálisis (40) OR: 1,41 (IC del 95 %: 0,96-2,07), sin embargo, otros autores no reportan contraindicación al parto vaginal instrumental en pacientes con SOP (6).
Conclusiones
Las mujeres con síndrome de ovario poliquístico tienen un riesgo mayor de eventos adversos durante el embarazo y complicaciones neonatales. Esta información puede ser vital en la práctica clínica para el manejo del embarazo en estas pacientes, deben tener una vigilancia más intensa y se les debe realizar la detección temprana de estas complicaciones y proporcionar la atención adecuada durante el embarazo y el parto.
En la mujer con SOP es fundamental el despistaje de DG y control de la glicemia, siendo las modificaciones del estilo de vida fundamentales y la terapia farmacológica cuando esté indicada.
Complicaciones ginecológicas
El SOP es considerado como una entidad multisistémica, de múltiples facetas y que persiste a lo largo de toda la vida. Las alteraciones reproductivas y metabólicas que caracterizan el síndrome pueden también estar asociados con un mayor riesgo de desarrollo de cáncer, como el de endometrio, ovario, y mama, que tiene mecanismos patogénicos hormonales y / o metabólicas.
Cáncer de endometrio
Las mujeres con SOP tienen múltiples factores de riesgo de cáncer endometrio que incluyen la obesidad, alteraciones metabólicas (como la diabetes y la hipertensión), y una historia de oligomenorrea con la exposición prolongada a estrógenos sin la oposición de progesterona.
Los primeros documentos que presentaron una asociación entre el síndrome de ovario poliquístico y cáncer endometrial datan de los años cuarenta y cincuenta, pero, hasta la fecha, aún faltan pruebas de la relación causa – efecto, entre el síndrome y tumores malignos ginecológicos (41).
Los estudios recientes han reportado un incremento de 2,7 veces riesgo de desarrollar cáncer de endometrio comparado con la población en general (42,43). El metanálisis de Barry y col. (44) en 2014 reportó que mujeres con SOP tenían un aumento significativo del riesgo de cáncer de endometrio (OR: 2,79; 95 % intervalo de confianza 1,31-5,95, P = 0,008), el cual se incrementa con la edad (OR: 4,05; IC del 95 %, 2,42-6,76, P: 0,00001).
La obesidad es un factor de riesgo reconocido para el cáncer de endometrio y la mayoría de los autores considera que el aumento del riesgo de este cáncer podría atribuirse, al menos en parte, al aumento de la prevalencia de la obesidad en mujeres con SOP. El mismo problema se aplica a la diabetes tipo 2, otro posible factor de confusión que es el más representativo en las mujeres con SOPy se asocia con un mayor riesgo de cáncer de endometrio, posiblemente secundaria a la hiperinsulinemia, hiperglucemia e inflamación. Por tanto, existe incertidumbre en cuanto a si el aumento de riesgo de cáncer de endometrio se debe a diferentes factores de riesgo metabólico o síndrome de ovario poliquístico en sí, que se caracteriza por muchas complicaciones metabólicas y reproductivas que podrían ser responsables de un aumento del riesgo oncológico (2).
No obstante, en general se acepta que mujeres con SOPen amenorrea están en mayor riesgo de hiperplasia endometrial y cáncer; por tanto, el grupo de consenso de ESHRE / ASRM (9) ha recomendado realizar la vigilancia del endometrio con ultrasonido y / o biopsia para evaluar el engrosamiento del endometrio en estas pacientes, así como la descamación endometrial con progestágenos periódica, al menos cuatro episodios por año.
Los agentes que inducen la ovulación posiblemente disminuyen el riesgo de hiperplasia endometrial y cáncer (2).
La metformina, ha demostrado que ejerce un efecto quimioprotector y antiproliferativo en numerosos tipos de cáncer, y se ha sugerido que tienen un efecto antitumoral en cáncer endometrial, sin embargo, los datos son escasos para apoyar el uso de metformina en mujeres con SOP para la prevención del cáncer de endometrio en la práctica clínica (45,46).
Cáncer de ovario
Los estudios de SOP y riesgo de cáncer de ovario son contradictorios. Un estudio a largo plazo de mujeres diagnosticadas en base a los registros de los hospitales no reportó incremento de la mortalidad de cáncer de ovario comparadas con la población general (47). Por el contrario, un estudio de casos y controles de mujeres con cáncer de ovario epitelial confirmado histológicamente mostró un aumento, ajustado por edad, de 2,5 veces en mujeres con SOP (48). En el estudio de Barry y col. (44) el riesgo de cánceres de ovario no se incrementó significativamente (OR: 1,41; IC del 95 %, 0,93-2,15, P: 0,11), sin embargo, cuando se incluyeron mujeres mayores de 54 años si reportaron incremento del riesgo (OR: 2,52; IC del 95 %, 1,08-5,89, P: 0,03).
La evidencia es limitada y contradictoria con respecto al riesgo de cáncer de ovario y SOP, por tanto grupo de consenso ESHRE / ASRM no recomienda estrategias de vigilancia de rutina para detectar el cáncer de ovario en mujeres con el síndrome (9).
Cáncer de Mama
No existe ninguna asociación aparente del síndrome de ovario poliquístico con cáncer de mama. El metanálisis de Barry y col. (44), no reportó incremento del riesgo en ningún grupo etario (OR: 0,95; IC del 95 %, 0,64-1,39, P = 0,78)
Otras neoplasias
La evidencia es insuficiente para evaluar la asociación de SOP con leiomiomatosis uterina, neoplasias de vulva, vagina y cáncer cervical (9,42).
Conclusiones
- Las mujeres con SOP tienen un riesgo incrementado de desarrollar hiperplasia endometrial y cáncer de endometrio, por tanto se recomienda realizar la vigilancia del endometrio con ultrasonido y / o biopsia y la descamación periódica endometrial con progestágenos.
- La relación de SOP y cáncer de ovario es controversial. En mujeres mayores de 54 años se ha reportado un incremento del riesgo.
- No hay evidencia suficiente en relación con el riesgo de otras neoplasias ginecológicas y SOP.
REFERENCIAS
1. Knochenhauer ES, Key TJ, Kashsar-Miller M, Waggoner W, Boots LR, Azziz R. Prevalence of polycystic ovary syndrome in unselected black and white women of the southeastern United States: A prospective study. J Clin Endocrinol Metab. 1998;71: 3078-3082. [ Links ]
2. Palomba S, Santagni S, Falbo A, La Sala GB. Complications and challenges associated with polycystic ovary syndrome: Current perspectives. Int J Womens Health. 2015:746-763. [ Links ]
3. Catalano PM, Tyzbir ED, Roman NM, Amini SB, Sims EA. Longitudinal changes in insulin release and insulin resistance in nonobese pregnant women. Am J Obstet Gynecol. 1991;165:1667-1672. [ Links ]
4. Butte NF. Carbohydrate and lipid metabolism in pregnancy: Normal compared with gestational diabetes mellitus. Am J Clin Nutr. 2000;71:1256S-1261S. [ Links ]
5. Palomba S, de Wilde MA, Falbo A, Koster MPH, La Sala GB, Fauser CJM. Pregnancy complications in women with polycystic ovary syndrome: New clinical and pathophysiological insights. Hum Reprod Update. 2015;21:572-592. [ Links ]
6. Katulski K, Czyzyk A, Podfigurna-Stopa A, Genazzani A, Meczekalski B. Pregnancy complications in polycystic ovary syndrome patients. Gynecol Endocrinol. 2015;31:87-91. [ Links ]
7. Homburg R. Pregnancy complications in PCOS. Best Pract Res Clin Endocrinol Metab. 2006;20:281-292. [ Links ]
8. Boomsma CM, Fauser BC, Macklon NS. Pregnancy complications in women with polycystic ovary syndrome. Semin Reprod Med. 2008;1:72-84. [ Links ]
9. Fauser BC, Tarlatzis BC, Rebar RW, Legro RS, Balen AH, Lobo R, et al. Consensus on womens health aspects of polycystic ovary syndrome (PCOS): The Amsterdam ESHRE/ASRM-Sponsored 3rd PCOS Consensus Workshop Group. Fertil Steril 2012;97:28- 38. [ Links ]
10. Giudice LC. Endometrium in PCOS: Implantation and predisposition to endocrine CA. Best Pract Res Clin Endocrinol Metab. 2006;20:235-244. [ Links ]
11. Glueck CJ, Wang P, Fontaine RN, Sieve-Smith L, Tracy T, Moore SK. Plasminogen activator inhibitor activity: An independent risk factor for the high miscarriage rate during pregnancy in women with polycystic ovary syndrome. Metabolism. 1999;48:1589-159. [ Links ]
12. Heijnen EM, Eijkemans MJ, Hughes EG, Laven JS, Macklon NS, Fauser BC. A meta-analysis of outcomes of conventional IVF in women with polycystic ovary syndrome. Hum Reprod Update. 2006;12:13-21. [ Links ]
13. Liu L, Tong X, Jiang L, Li TC, Zhou F, Zhang S. A comparison of the miscarriage rate between women with and without polycystic ovarian syndrome undergoing IVF treatment. Eur J Obstet Gynecol Reprod Biol. 2014;176:178-182. [ Links ]
14. ACOG. Committee on Practice Bulletins-Obstetrics. Diagnosis and management of preeclampsia and eclampsia. Obstet Gynecol. 2011;98:159-167. [ Links ]
15. Hu S, Leonard A, Seifalian A, Hardiman P. Vascular dysfunction during pregnancy in women with polycystic ovary syndrome. Hum Reprod. 2007;22:1532-1539. [ Links ]
16. de Vries MI, Dekker GA, Schoemaker J. Higher risk of preeclampsia in the polycystic ovary syndrome. A case control study. Eur J Obstet Gynecol Reprod Biol. 2008;76:91-95. [ Links ]
17. Kashyap S, Claman P. Polycystic ovary disease and the risk of pregnancy-induced hypertension. J Reprod Med. 2009;45:991-994. [ Links ]
18. Kjerulff LE, Sanchez-Ramos L, Duffy D. Pregnancy outcomes in women with polycystic ovary syndrome: A metaanalysis. Am J Obstet Gynecol. 2011;204:558. e1–558.e6. [ Links ]
19. Qin JZ, Pang LH, Li MJ, Fan XJ, Huang RD, Chen HY. Obstetric complications in women with polycystic ovary syndrome: A systematic review and metaanalysis. Reprod Biol Endocrinol. 2013;26:11-56. [ Links ]
20. Sir-Petermann T, Ladrón de Guevara A, Villarroel AC, Preisler J, Echiburú B, Recabarren S. Polycystic ovary syndrome and pregnancy. Rev Med Chil. 2012;140:919-925. [ Links ]
21. de Wilde MA, Veltman-Verhulst SM, Goverde AJ, Lambalk CB, Laven JS, Franx A, et al. Preconception predictors of gestational diabetes: A multicentre prospective cohort study on the predominant complication of pregnancy in polycystic ovary syndrome. Hum Reprod. 2014;29:1327-1236. [ Links ]
22. Sawada M, Masuyama H, Hayata K, Kamada Y, Nakamura K , Hiramatsu Y. Pregnancy complications and glucose intolerance in women with polycystic ovary syndrome. Endocr J. 2015;62:1017-1023. [ Links ]
23. Febres F, Palacios A, Colán J, Arias E. Nueva pesquisa de consenso de la diabetes gestacional, en función del futuro inmediato y a largo plazo del recién nacido. Rev Obstet Ginecol Venez. 2014;74:138-142. [ Links ]
24. American Diabetes Association. Standards of medical care in diabetes. Diabetes Care. 2015;38:S1-S93. [ Links ]
25. Blumer I, Hadar E, Hadden DR, Jovanovič L, Mestman JH, Murad MH, et al. Diabetes and Pregnancy: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2013;98:4227-4249. [ Links ]
26. National Collaborating Centre for Women's and Children's Health (UK). Diabetes in Pregnancy: Management of diabetes and its complications from NICE Guidelines 2015. Preconception to the postnatal period. nice.org.uk/guidance/ng [ Links ]
27. Reader D, Splett P, Gunderson P. Impact of Gestational Diabetes Mellitus Nutrition Practice Guidelines Implemented by Registered Dietitians on Pregnancy Outcomes. J Am Diet Assoc. 2006;106:1426-1433. [ Links ]
28. Artal R, O'Toole M. Guidelines of the American College of Obstetricians and Gynecologists for exercise during pregnancy and the postpartum period. Br J Sports Med. 2003;37:6-12. [ Links ]
29. Cassina M, Dona M, Di Gianantonio E, Litta P, Clementi M. First-trimester exposure to metformin and risk of birth defects: A systematic review and meta-analysis. Hum Reprod Update. 2014;20:656- 669. [ Links ]
30. Glueck CJ, Goldenberg N, Pranikoff J, Loftspring M, Sieve L, Wang P. Height, weight, and motor-social development during the first 18 months of life in 126 infants born to 109 mothers with polycystic ovary syndrome who conceived on and continued metformin through pregnancy. Hum Reprod. 2004;19:1323- 1330. [ Links ]
31. Glueck CJ, Wang P, Kobayashi S, Phillips H, Sieve-Smith L. Metformin therapy throughout pregnancy reduces de development of Gestational Diabetes in women with Polycystic Ovarian Syndrome. Fertil Steril. 2002;77(34):255-274. [ Links ]
32. Bertoldo M, Faure M, Dupont J, Froment P. Impact of metformin on reproductive tissues: An overview from gametogenesis to gestation. Ann Transl Med. 2014;2:55-68. [ Links ]
33. Sapienza A, Vieira R, Coutheux T, Zubaib M. Factors predicting the need for insulin therapy in patients with gestational diabetes mellitus. Diabetes Res Clin Pract. 2010;88:81-86. [ Links ]
34. Reece EA, Homko C, Miodovnik M, Langer O. A consensus report of the diabetes in pregnancy study group of North America Conference. Little Rock, Arkansas. J Matern Fetal Neonatal Med. 2002;12:362- 364. [ Links ]
35. Sir-Petermann T, Hitchsfeld C, Maliqueo M, Codner E, Echiburú B, Gacitúa R, et al. Birth weight in offspring of mothers with polycystic ovary syndrome. Hum Reprod. 2005;20:2122-2126. [ Links ]
36. Ibanez L, Potau N, Francois L, de Zegher F. Precocious pubarche, hyperinsulinism, and ovarian hyperandrogenism in girls: Relation to reduced fetal growth. J Clin Endocrinol Metab. 2008;83:3558- 3562. [ Links ]
37. Benítez R, Sir-Petermann T, Palomino A, Angel B, Maliqueo M, Pérez F, et al. Prevalence of metabolic disorders among family members of patients with polycystic ovary syndrome. Rev Med Chil. 2011;129:707-712. [ Links ]
38. Laitinen J, Taponen S, Martikainen H, Pouta A, Millwood I, Hartikainen AL, et al. Body size from birth to adulthood as a predictor of self-reported polycystic ovary syndrome symptoms. lnt J Obes Relat Metab Disord. 2003;27:710-715. [ Links ]
39. Palomba S, Falbo A, Russo T, Battista L, Tolino A, Orio F, et al. Uterine blood flow in pregnant patients with polycystic ovary syndrome: Relationships with clinical outcomes. BJOG 2010;117:711-721. [ Links ]
40. Qin J, Pang L, Li M, Fan X, Huang R, Chen H. Obstetric complications in women with polycystic ovary syndrome: A systematic review and metaanalysis. Reprod Biol Endocrinol. 2013;11:56-70. [ Links ]
41. Hardiman P, Pillay OC, Atiomo W. Polycystic ovary syndrome and endometrial carcinoma. Lancet. 2003;361:1810-1812. [ Links ]
42. Chittenden BG, Fullerton G, Maheshwari A, Bhattacharya S. Polycystic ovary syndrome and the risk of gynaecological cancer: A systematic review. Reprod Biomed Online. 2009;19:398-405. [ Links ]
43. Haoula Z, Salman M, Atiomo W. Evaluating the association between endometrial cancer and polycystic ovary syndrome. Hum Reprod. 2012;27:1327-1331. [ Links ]
44. Barry J, Azizia M, Hardiman P. Risk of endometrial, ovarian and breast cancer in women with polycystic ovary syndrome: A systematic review and metaanalysis. Hum Reprod Update. 2014;20:748-758. [ Links ]
45. Dowling RJ, Goodwin PJ, Stambolic V. Understanding the benefit of metformin use in cancer treatment. MBC Med. 2011;9:33. [ Links ]
46. Legro RS, Zaino RJ, Demers LM, Kunselman AR, Gnatuk CL, Williams NI, et al. The effects of metformin and rosiglitazone, alone and in combination, on the ovary and endometrium in polycystic ovary syndrome. Am J Obstet Gynecol. 2007;196:402. [ Links ]
47. Pierpoint T, McKeigue PM, Isaacs AJ, Wild SH, Jacobs HS. Mortality of women with polycystic ovary syndrome at long-term follow-up. J Clin Epidemiol. 1998;51:581-586. [ Links ]
48. Schildkraut JM, Schwingl PJ, Bastos E, Evanoff A, Hughes C. Epithelial ovarian cancer risk among women with polycystic ovary syndrome. Obstet Gynecol. 1996;88:554-559. [ Links ]^rND^sKnochenhauer^nES^rND^sKey^nTJ^rND^sKashsar-Miller^nM^rND^sWaggoner^nW^rND^sBoots^nLR^rND^sAzziz^nR^rND^sPalomba^nS^rND^sSantagni^nS^rND^sFalbo^nA^rND^sLa Sala^nGB^rND^sCatalano^nPM^rND^sTyzbir^nED^rND^sRoman^nNM^rND^sAmini^nSB^rND^sSims^nEA^rND^sButte^nNF^rND^sPalomba^nS^rND^sde Wilde^nMA^rND^sFalbo^nA^rND^sKoster^nMPH^rND^sLa Sala^nGB^rND^sFauser^nCJM^rND^sKatulski^nK^rND^sCzyzyk^nA^rND^sPodfigurna-Stopa^nA^rND^sGenazzani^nA^rND^sMeczekalski^nB^rND^sHomburg^nR^rND^sBoomsma^nCM^rND^sFauser^nBC^rND^sMacklon^nNS^rND^sFauser^nBC^rND^sTarlatzis^nBC^rND^sRebar^nRW^rND^sLegro^nRS^rND^sBalen^nAH^rND^sLobo^nR^rND^sGiudice^nLC^rND^sGlueck^nCJ^rND^sWang^nP^rND^sFontaine^nRN^rND^sSieve-Smith^nL^rND^sTracy^nT^rND^sMoore^nSK^rND^sHeijnen^nEM^rND^sEijkemans^nMJ^rND^sHughes^nEG^rND^sLaven^nJS^rND^sMacklon^nNS^rND^sFauser^nBC^rND^sLiu^nL^rND^sTong^nX^rND^sJiang^nL^rND^sLi^nTC^rND^sZhou^nF^rND^sZhang^nS^rND^sHu^nS^rND^sLeonard^nA^rND^sSeifalian^nA^rND^sHardiman^nP^rND^sde Vries^nMI^rND^sDekker^nGA^rND^sSchoemaker^nJ^rND^sKashyap^nS^rND^sClaman^nP^rND^sKjerulff^nLE^rND^sSanchez-Ramos^nL^rND^sDuffy^nD^rND^sQin^nJZ^rND^sPang^nLH^rND^sLi^nMJ^rND^sFan^nXJ^rND^sHuang^nRD^rND^sChen^nHY^rND^sSir-Petermann^nT^rND^sLadrón de Guevara^nA^rND^sVillarroel^nAC^rND^sPreisler^nJ^rND^sEchiburú^nB^rND^sRecabarren^nS^rND^sde Wilde^nMA^rND^sVeltman-Verhulst^nSM^rND^sGoverde^nAJ^rND^sLambalk^nCB^rND^sLaven^nJS^rND^sFranx^nA^rND^sSawada^nM^rND^sMasuyama^nH^rND^sHayata^nK^rND^sKamada^nY^rND^sNakamura^nK^rND^sHiramatsu^nY^rND^sFebres^nF^rND^sPalacios^nA^rND^sColán^nJ^rND^sArias^nE^rND^sBlumer^nI^rND^sHadar^nE^rND^sHadden^nDR^rND^sJovanovi^nL^rND^sMestman^nJH^rND^sMurad^nMH^rND^sReader^nD^rND^sSplett^nP^rND^sGunderson^nP^rND^sArtal^nR^rND^sO'Toole^nM^rND^sCassina^nM^rND^sDona^nM^rND^sDi Gianantonio^nE^rND^sLitta^nP^rND^sClementi^nM^rND^sGlueck^nCJ^rND^sGoldenberg^nN^rND^sPranikoff^nJ^rND^sLoftspring^nM^rND^sSieve^nL^rND^sWang^nP^rND^sGlueck^nCJ^rND^sWang^nP^rND^sKobayashi^nS^rND^sPhillips^nH^rND^sSieve-Smith^nL^rND^sBertoldo^nM^rND^sFaure^nM^rND^sDupont^nJ^rND^sFroment^nP^rND^sSapienza^nA^rND^sVieira^nR^rND^sCoutheux^nT^rND^sZubaib^nM^rND^sReece^nEA^rND^sHomko^nC^rND^sMiodovnik^nM^rND^sLanger^nO^rND^sSir-Petermann^nT^rND^sHitchsfeld^nC^rND^sMaliqueo^nM^rND^sCodner^nE^rND^sEchiburú^nB^rND^sGacitúa^nR^rND^sIbanez^nL^rND^sPotau^nN^rND^sFrancois^nL^rND^sde Zegher^nF^rND^sBenítez^nR^rND^sSir-Petermann^nT^rND^sPalomino^nA^rND^sAngel^nB^rND^sMaliqueo^nM^rND^sPérez^nF^rND^sLaitinen^nJ^rND^sTaponen^nS^rND^sMartikainen^nH^rND^sPouta^nA^rND^sMillwood^nI^rND^sHartikainen^nAL^rND^sPalomba^nS^rND^sFalbo^nA^rND^sRusso^nT^rND^sBattista^nL^rND^sTolino^nA^rND^sOrio^nF^rND^sQin^nJ^rND^sPang^nL^rND^sLi^nM^rND^sFan^nX^rND^sHuang^nR^rND^sChen^nH^rND^sHardiman^nP^rND^sPillay^nOC^rND^sAtiomo^nW^rND^sChittenden^nBG^rND^sFullerton^nG^rND^sMaheshwari^nA^rND^sBhattacharya^nS^rND^sHaoula^nZ^rND^sSalman^nM^rND^sAtiomo^nW^rND^sBarry^nJ^rND^sAzizia^nM^rND^sHardiman^nP^rND^sDowling^nRJ^rND^sGoodwin^nPJ^rND^sStambolic^nV^rND^sLegro^nRS^rND^sZaino^nRJ^rND^sDemers^nLM^rND^sKunselman^nAR^rND^sGnatuk^nCL^rND^sWilliams^nNI^rND^sPierpoint^nT^rND^sMcKeigue^nPM^rND^sIsaacs^nAJ^rND^sWild^nSH^rND^sJacobs^nHS^rND^sSchildkraut^nJM^rND^sSchwingl^nPJ^rND^sBastos^nE^rND^sEvanoff^nA^rND^sHughes^nC^rND^1A01^nImperia^sBrajkovich^rND^1A02^nArmando^sPérez Monteverde^rND^1A01^nImperia^sBrajkovich^rND^1A02^nArmando^sPérez Monteverde^rND^1A01^nImperia^sBrajkovich^rND^1A02^nArmando^sPérez Monteverde
Complicaciones metabólicas y cardiovasculares del síndrome de ovario poliquístico
Drs. Imperia Brajkovich*, Armando Pérez Monteverde**
* Médico Internista – Endocrinóloga. Profesora Titular – Escuela Luis Razetti, Facultad de Medicina, UCV. Presidente de la Sociedad Venezolana de Endocrinología y Metabolismo. ** Médico Internista – Endocrinólogo – FACP. Servicio de Endocrinología del Centro Médico Docente La Trinidad. Ex Presidente de la Sociedad Venezolana de Menopausia y Osteoporosis
El síndrome de ovario poliquísticos (SOP) es la endocrinopatía más frecuente en la mujer en edad reproductiva y afecta a otros órganos como son el páncreas, el cerebro, hígado, músculo, sistema cardiovascular y la grasa corporal, especialmente la visceral o abdominal (1).
Las mujeres con este síndrome presentan un riesgo aumentado de desarrollar enfermedad cardiovascular y diabetes, por tanto, una vez diagnosticado el SOP, debemos investigar los trastornos metabólicos y factores de riesgo cardiovascular (2-5).
Obesidad y tejido adiposo
La obesidad y sobrepeso se ha ido incrementando en los últimos años, siendo su prevalencia variable entre los diferentes países, en Italia (10 %), en Kuwait (37 %) y la mayor prevalencia de obesidad es en Estados Unidos de América (61 %) y Australia (76 %) (6). Recientemente en un metaanálisis la prevalencia estimada global reportada fue de 49 % (7).
Estudios publicados han demostrado que la obesidad per se no confiere riesgo de tener SOP en la población en general (8). Sin embargo, está establecido en las pacientes con SOP tiene mayor prevalencia de sobrepeso/obesidad. Es posible que el aumento de la obesidad mundial promueva el desarrollo de SOP en persona con cierta susceptibilidad (9,10).
Mujeres con SOP tiene una mayor distribución de grasa visceral comparada con sus controles. Esto a su vez está asociado a una insulino-resistencia (11) y síndrome metabólico que puede exacerbar las anormalidades metabólicas y de fertilidad, teniendo esta población más riesgo de presentar prediabetes y posteriormente diabetes mellitus tipo 2 (DM2) (12). El riesgo es tres veces mayor comparado con sus controles y este difiere según las regiones geográficas (13). Cuanto más severo sea el fenotipo mayor asociación tendrá con estos riesgos sean o no obesa (14,15).
La obesidad está asociada a disfunción ovárica; en un grupo de mujeres con IMC > 27 kg/m2 se reportó un riesgo mayor de ciclos anovulatorios (RR: 3.1) comparado con grupo control, y ameritan mayores dosis de fármacos inductores de ovulación (16).
Los estudios de intervención con cambios de estilo de vida han demostrado que la pérdida de peso reduce los andrógenos circulantes, mejora los ciclos menstruales y la fertilidad (17) y aumenta los niveles de globulina transportadora de hormonas sexuales (SHBG), reduce el volumen ovárico y el contaje folicular (18), mejorando la sensibilidad de la insulina (19-21).
Las células adiposas viscerales producen un número importante de sustancias llamadas adipoquinas como la leptina, adiponectina y grelina. En el SOP se elevan los niveles de leptina y resistina, con disminución de adiponectina y grelina. Ellas controlan el apetito, influencian la insulino sensibilidad, modulan el número y tamaño de las células adiposas, y la angiogénesis, este mecanismo por vía paracrina ejercen un rol en la regulación de la masa del adipocito. Además, altos niveles de interleuquina 6 (IL-6) y factor de necrosis tumoral, disminución de los niveles del activador del plasminógeno, conllevan a trastornos metabólicos e incremento de los factores de riesgo cardiovascular (22-26). En la Figura 1 podemos apreciar los mecanismos descritos (27).
La insulino-resistencia
La acción de la insulina está disminuida en el músculo esquelético por defectos en la señalización, siendo la insulino-resistencia hepática más importante en la mujer obesa con SOP. Hay un efecto negativo sinérgico al tener SOP y obesidad en la acción de la insulina. La disfunción de la célula beta pancreática está presente, pero más relacionada cuando hay factores de riesgo para DM2, especialmente cuando hay antecedentes familiares de DM2 de primera línea (28,29).
El riesgo de prediabetes es mayor en las mujeres que presentan oligoovulación /anovulación e hiperandrogenismo (30). Comenzando desde la adolescencia la prediabetes y la DM2 es más prevalente 4:1 y ocurre en un 40 % a nivel de la 4ª década de la vida relacionándose más con el aumento de peso y la edad (31).
Las pacientes con SOP tienen riesgo aumentado de intolerancia a la glucosa (31 % a 35 %) y diabetes tipo 2 (7,5 % a 10 %). La tasa de progresión de tolerancia de glucosa normal a intolerancia, y a diabetes tipo 2, es de 5 % a 15 % en 3 años (32,33).
El estándar de oro para la evaluación de la resistencia metabólica a la insulina in vivo es la técnica del clamp euglucémico hiperinsulinémico (34), sin embargo, es un procedimiento que requiere personal altamente entrenado y equipo especializado, por lo cual es muy costoso (34,35). Debido a la complejidad y el costo del clamp y la FSIGT (prueba de tolerancia a la glucosa endovenosa) se han utilizado métodos indirectos más simples para cuantificar la RI (36-38). El modelo homeostático (HOMA-IR) = [Insulina en ayunas (μIU/mL) x Glucosa en ayunas]/ 22,5] a pesar de sus limitaciones, ha sido reconocido como el método más sensible para estimar la sensibilidad a la insulina y riesgo de DM tipo 2. En estudios epidemiológicos el HOMA-IR es aceptado como el método estándar para determinar la resistencia a la insulina (34).
Actualmente no hay consenso para evaluar la RI en pacientes con SOP (39). La determinación de insulina plasmática y estimación de RI no son requeridos en la práctica clínica diaria (40-42). Acorde con las guías de la Sociedad de Exceso de Andrógenos-SOP y la Sociedad Americana de Endocrinología (43), así como otras Sociedades Internacionales Colegio Americano de Obstetras y Ginecólogos, Sociedad Americana de Medicina Reproductiva (44), se debe realizar despistaje en todas las mujeres con SOP independientemente de su índice de masa corporal, adolescentes y adultas, mediante el uso de la prueba de tolerancia oral glucosada (PTOG) con 75 g de glucosa para determinar glucosa en ayunas y 2 horas pos-carga (45-47).
La PTGO debe repetirse cada dos años, si la paciente presenta otros factores de riesgo para diabetes, o cada año si los valores de glucosa obtenidos por PTOG indican intolerancia a la glucosa o prediabetes. La prueba debe realizarse en pacientes adultas de cualquier edad con sobrepeso u obesidad (IMC > 25 kg/m2 o 23 kg/m2 en americanas asiáticas) quienes tienen uno o más factores de riesgo para diabetes (47) que son:
- Sedentarismo
- Familiares de primer grado con diabetes
- Raza/etnia de alto riesgo (latinas)
- Mujeres con antecedentes de recién nacido que pesaron >4,5 kg o quienes fueron diagnosticadas con diabetes gestacional.
- Hipertensión arterial
- Colesterol HDL < 35 mg/dL
- Hipertrigliceridemia > 250 mg/dL
- Mujeres con SOP
- HbA1c = 5,7 %
- Intolerancia a la glucosa o glucosa alterada en ayunas en exámenes previos
- Antecedentes de enfermedad cardiovascular
- Otras condiciones asociadas con resistencia a la insulina (RI) como obesidad severa y acantosis nigricans
Los puntos de corte para el diagnóstico de los trastornos del metabolismo de la glucosa utilizando la PTGO o HbA1C son (47,48):

Síndrome metabólico
Definido como el conjunto de factores de riesgo para enfermedad cardiovascular y DM2, muy usado por los clínicos para identificar poblaciones a riesgo. Su prevalencia en mujeres de Latinoamérica es de 25,3 % (49).
En los últimos años se han descrito diversos criterios, el de la Organización Mundial de la Salud (OMS), ATPIII, Federación Internacional de Diabetes (IDF). En el último consenso que incluyó a todas estas sociedades, se recomendó que el diagnóstico de síndrome metabólico se realice si la mujer tiene 3 de los 5 los criterios mencionados a continuación (50):
- Aumento del perímetro de la cintura (para cada población en particular)
- Presión arterial > 130/85 mmHg (o bajo tratamiento)
- Triglicéridos > 150 mg/mL
- HDLc < 50 mg/mL
- Glicemia en ayunas > 100 mg/mL (o bajo tratamiento)
En 2011 el grupo latinoamericano de estudio de síndrome metabólico y obesidad (GLESMO), determinó el perímetro de la cintura en una población latinoamericana, utilizando como patrón de oro para la medición de la grasa visceral la tomografía axial computarizada de abdomen, y establecieron un punto de corte de 90 cm para la mujer con una sensibilidad de 78,9 % y especificidad de 67,6 % (51).
El estudio IDEA fue elaborado en 12 países latinoamericanos, incluyó 18 526 mujeres, 60 % de dicha población tenían sobrepeso/ obesidad. La frecuencia de sobrepeso (IMC: 25–29,9 kg / m2) en mujeres fue (35,0 %; 95 % CI: 34,3–35,7). En contraste la frecuencia de obesidad (IMC > 30 kg / m2) fue 29,4 %, de las cuales 76 % tenían obesidad visceral coincidiendo con la medida de cintura abdominal propuesta por GLESMO. Las mujeres de peso normal, con obesidad visceral, 9 % tenían diabetes y 7 % ECV. Con este trabajo se demostró que la obesidad visceral en población latinoamericana y del Caribe está fuertemente asociada con ECV y DM2, concluyendo que la medición de la cintura es un método clínico sencillo y que la determinación de los criterios de síndrome metabólico pueden identificar aquellos individuos con riesgo aumentado de DM2 y ECV (52,53).
Otro concepto que se ha estudiado es la identificación de dos poblaciones como son SOP-metabólicamente sano (MS-SOP) y SOPmetabólicamente no sano (MNS-SOP), este último grupo presenta los criterios de síndrome metabólico, siendo los más importantes el perímetro de la cintura como expresión de la obesidad visceral, los niveles de triglicéridos y HDL, lo cual les confieren un riesgo aumentado de ECV (54).
Aumento de la actividad del sistema nervioso simpático
La enfermedad cardiovascular está relacionada con la disfunción autonómica. Las condiciones clínicas asociadas a SOP como son: hiperandrogenismo, hiperinsulinemia / insulinorresistencia, hipertensión arterial, síndrome de apnea obstructiva del sueño, y depresión (55,56), se relacionan con un aumento de la actividad del sistema simpático. La insulina aumenta la actividad simpática muscular por el incremento del metabolismo de la glucosa en las neuronas hipotalámicas. Esto suprime las señales inhibitorias entre el hipotálamo y centros nerviosos cerebrales (57,58). Sin embargo, la relación entre hiperinsulinemia y la activación del sistema simpático es compleja y está afectada en la obesidad. La obesidad, particularmente, la visceral está asociada a una actividad simpática aumentada (59). Por tanto, esta alteración del sistema simpático y una disminución de la actividad parasimpática pueden estar involucradas en el SOP (60-62).
Dislipidemia y otros factores de riesgo cardiovascular
Las alteraciones de los niveles de triglicéridos, lipoproteína de baja densidad (LDL-colesterol), lipoproteína de alta densidad (HDL-colesterol), y la relación apolipoproteína B (Apo B)/Apo A, son frecuentes en pacientes con SOP. Hay una inflamación sistémica asociada a una disfunción endotelial y marcadores de trombosis que están presentes y relacionados con la insulino-resistencia (63).
Un engrosamiento de la carótida-intima media, calcificación de la arteria coronaria y en menor cuantía la calcificación aórtica está presente en mujeres con SOP comparadas a sus controles independientemente de la edad y del IMC (64-67).
Hay estudios aleatorizados de intervención para bajar de peso, con cambios de estilo de vida logrando beneficios metabólicos y reproductivos (68).
Un metaanálisis demostró que mujeres con SOP tiene niveles altos de triglicéridos, elevado LDL-colesterol y colesterol total, con un bajo HDLcolesterol, comparado al grupo control, no relacionado con su IMC (69).
El manejo terapéutico de la dislipidemia, debe incluir (70):
Modificación de estilo de vida: esencial para la disminución de peso corporal y la grasa visceral. La reducción de grasas saturadas, grasas trans y de alimentos ricos en colesterol, el incremento de la ingesta de ácidos grasos Omega-3, fibras viscosas, vegetales y frutas, todos ellos efectivos para mejorar el perfil lipídico. El ejercicio regular durante 150 minutos por semana, reduce el peso corporal y mejora la resistencia cardiovascular.
En caso de hipertrigliceridemia se debe optimizar el control glucémico, reducir la ingesta de carbohidratos y alcohol y aumentar el ejercicio
En individuos con triglicéridos en ayunas ≥ 500 mg/dL deben evaluarse causas secundarias de hipertrigliceridemia y considerar tratamiento para reducir pancreatitis.
La terapia intensiva con estatinas se recomienda para mujeres de todas las edades, con diabetes y enfermedad cardiovascular. No hay estudios a larga data sobre el efecto de estatinas y la disminución de eventos clínicos cardíacos en mujeres con SOP.
La adición de ezetimibe a dosis moderadas de estatinas reduce beneficios cardiovasculares.
La combinación de estatinas y fibratos no ha demostrado mejoría en la placa aterosclerótica ni en enfermedad cardiovascular, por lo cual no se recomienda.
La combinación de estatinas y niacina no ha demostrado beneficio adicional al adquirido por estatinas.
Las estatinas están contraindicadas durante el embarazo.
La hipertensión arterial
De acuerdo con la Organización Mundial de la Salud, se define como hipertensión arterial (HTA), cifras de presión arterial sistólica (PAS)>140 mmHg y presión arterial diastólica (PAD) > 90, y / o el uso de fármacos antihipertensivos (71).
Un estudio realizado en el noreste de Brasil (72) en mujeres con y sin síndrome de ovario poliquísticos, reportó la asociación entre HTA y esta enfermedad endocrina, revelando una prevalencia 2 veces superior de HTA en el grupo con síndrome de ovario poliquístico (18,6 vs 9,9, P <0,05).
La RI e hiperinsulinemia pueden explicar la patogénesis de la hipertensión en pacientes con SOP: se alteran las células musculares lisas vasculares, ocasionando hipertrofia del músculo liso vascular, alteración del mecanismo de vasodilatación endotelio dependiente, activación del sistema renina angiotensina aldosterona y retención de sodio (71).
Incluso teniendo en cuenta los pacientes con SOP sin hipertensión franca, un estudio realizado en Suecia (73), demostró que las mujeres con SOP tenían PAS más alta durante el día (P< 0,05), la media de los valores arteriales de la presión arterial (P< 0,06) y un aumento en el pulso (P<0,05) comparado con los controles. Sin embargo, los grupos no diferían en PAD (P = 0,05). Por otra parte, las mujeres con SOP tenían valores altos de la presión arterial durante el día también después de ajustar el IMC, la distribución de la grasa corporal y la resistencia a la insulina, por lo que estos resultados pueden sugerir una susceptibilidad de la presión arterial o estado pre-hipertensivos en pacientes con SOP (71).
En las pacientes con SOP, diabetes, resistencia a la insulina, obesidad y síndrome metabólico, se recomienda (70):
- La meta de PAS debe ser < 140 mmHg. Metas sistólicas más bajas como < 130 mmHg para ciertas mujeres jóvenes.
- Pacientes con diabetes, incluyendo mujeres con SOP, deben ser tratadas con meta de presión diastólica ≤ 90 mmHg. Es deseable un valor ≤ 80 mmHg en mujeres jóvenes con albuminuria, HTA y factores de riesgo cardiovascular.
- En pacientes con PA ≥140/90 durante la evaluación en el consultorio, adicional a cambios de estilo de vida deben iniciar tratamiento farmacológico. En adultos mayores, la meta de valores de PA ≤ 130/70 no es recomendable por el riesgo a hipotensión y no reducir el riesgo de enfermedad cardiovascular.
- Si la paciente tiene sobrepeso u obesidad y padece de hipertensión arterial, se recomienda el patrón de dieta DASH (Dietary Approaches to Stop Hypertension) lo cual incluye reducción de sodio (1.500 a 2 300 mg/día), ingesta de potasio, consumo de frutas y vegetales (8 a 10 porciones diarias), ingesta de lácteos descremados, moderación de alcohol y aumento de actividad física (74).
- La terapia farmacológica de PA en diabéticos e hipertensos, incluyen inhibidores de enzima convertidora de angiotensina (IECA) o bloqueadores de receptores de angiotensina II (ARB). No se recomienda la combinación de IECA + ARB, por riesgo de hipotensión y síncope.
- La terapia con drogas múltiples incluyendo tiazidas y /o antagonistas de calcio como amlodipina, son efectivas.
Otras alteraciones cardiovasculares en SOP
En el SOP se ha descrito una inflamación sistémica asociada a disfunción endotelial e incremento de marcadores de trombogénesis (PAI-1), relacionados con la insulino-resistencia (71).
El engrosamiento de la carótida-intima media, calcificación de la arteria coronaria y en menor cuantía calcificación aórtica, han sido reportados en estas pacientes comparadas a controles sanos, independientemente de la edad y del IMC (74).
Christian y col. (75) demostraron calcificaciones coronarias significativas cerca de 40 % en mujeres con SOP de 38 años, comparado con 20 % de los controles. Otro estudio de seguimiento por 10 años reportó mayor prevalencia de calcificaciones coronarias, en mujeres con SOP en edad media (76). Las calcificaciones coronarias estaban relacionadas con RI y síndrome metabólico.
Talbot y col. (76) en un estudio prospectivo de 10 años, reportaron una incidencia elevada de calcificaciones aórticas en mujeres con SOP comparado con controles, asociados únicamente con niveles de testosterona. Otro estudio realizado en mujeres jóvenes con SOP (media de 24 años) se demostró que engrosamiento endotelial se realacionó principalmente con el hiperandrogenismo (77). En el estudio Dallas Hearth Study no se reportó aumento de placa aórtica en mujeres entre 35 y 49 años con SOP (78).
Enfermedad hepática por hígado graso no alcohólico
Estudios transversales y de caso control han demostrado la relación entre SOP e hígado graso no alcohólico, esteatosis no alcohólica, fibrosis avanzada y cirrosis en mujeres jóvenes con esta endocrinopatía, independientemente de la presencia o no de obesidad y coexistencia de otros componentes de SM. Por ello tienen más riesgo de un daño hepático progresivo que se ha relacionado con factores de riesgo cardiovascular&(79), por tanto, se recomienda la determinación de las enzimas hepáticas y ultrasonido hepático para la detección temprana de esta patología. La elastografía combinada con el uso de un sistema de puntaje de fibrosis no invasiva, puede ayudar a decidir la biopsia hepática (80).
Síndrome de apnea obstructiva del sueño (SAOS)
Hay pocos datos acerca de esta complicación en pacientes con SOP. Existe una relación entre la insulino-resistencia, los trastornos de la glucosa y la obesidad como factores de riesgo para presentar apnea obstructiva del sueño (81). El exceso de andrógenos puede estar asociada a esta patología en la presencia de obesidad. Se sugiere hacer interrogatorio y pruebas pertinentes como la polisomnografía en el caso de sospecha de SAOS para hacer un correcto diagnóstico por ser un predictor de isquemia (82).
Conclusiones
- La obesidad tiene una prevalencia mayor en pacientes con SOP
- El SOP es un factor de riesgo para desarrollar prediabetes, DM2 y ECV.
- El incremento de la obesidad en esta población conlleva a un incremento de DM2 en años subsiguientes
- Se debe realizar el despistaje con PTGO en todas las pacientes con SOP, especialmente en aquellas con otros factores de riesgo.
- Debe evaluarse los criterios de síndrome metabólico en todas las pacientes con SOP.
- La dislipidemia, hipertensión arterial y ateroesclerosis son frecuentes en este síndrome y deben recibir la terapia adecuada.
- Los marcadores subrogados de ECV están alterados en SOP, por la disfunción endotelial.
- Los cambios de estilo de vida deben promoverse desde etapas tempranas, ya que disminuyen el riesgo de DM2 y ECV.
REFERENCIAS
1. Fauser BC, Tarlatzis BC, Rebar RW, Legro RS, Balen AH, Lobo R, et al. Consensus on womens health aspects of polycystic ovary syndrome (PCOS): The Amsterdam ESHRE/ ASRM-Sponsored 3rd PCOS Consensus Workshop Group Fertil Steril. 2012;97:28- 38. [ Links ]
2. Cobin R, Futterweit W, Nestler J, Reaven G, Jellinger P, Handelsman Y, et al. American Association of Clinical Endocrinologists Position Statement on Metabolic and Cardiovascular Consequences of Polycystic Ovary Syndrome. Endocrine Practice. 2005;11:125-134. [ Links ]
3. Azziz R, Woods KS, Reyna R, Key TJ, Knochonhaver ES, Yildiz BO. The prevalence and features of the Polycystic Ovary Syndrome in an unselected population. J Clin Endocrinol Metab. 2004;89:2745- 2749. [ Links ]
4. Hart R, Hickey M, Frank S. Definitions, prevalence and symptoms of Polycystic Ovaries and Polycystic Ovary Syndrome. Best Pract Res Clin Obstet Gynecol. 2004;18:671-683. [ Links ]
5. Legro RS. Polycystic Ovary Syndrome and Cardiovascular disease. A premature Association? Endocr Rev. 2003;24:302-312. [ Links ]
6. Dahlgren E, Johansson S, Lindstedt G, Knutsson F, Oden A, Janson PO, et al. Women with polycystic ovary syndrome wedge resected in 1956 to 1965: A long-term follow-up focusing on natural history and circulating hormones. Fertil Steril. 1992;57:505-513. [ Links ]
7. Lim SS, Davies MJ, Norman RJ, Moran LJ. Overweight, obesity and central obesity in women with polycystic ovary syndrome: A systematic review and meta-analysis. Hum Reprod Update. 2012;18:618- 637. [ Links ]
8. Lunger F, Wildt L, Seeber B. Accurate screening for insulin resistance in PCOS using fasting insulin concentrations. Ginecol Endocrinol. 2013;29:541- 544. [ Links ]
9. Lim SS, Norman RJ, Davies MJ, Moran LJ. The effect of obesity on polycystic ovary syndrome: A systematic review and meta-analysis. Obes Rev. 2013;14:95-109. [ Links ]
10. Lunger F, Wildt L, Seeber B. Accurate screening for insulin resistance in PCOS using fasting insulin concentrations. Ginecol Endocrinol. 2013;29:541- 544. [ Links ]
11. Legro RS, Chiu P, Kunselman AR, Bentley CM, Dodson WC, Dunaif A. Polycystic ovaries are common in women with hyperandrogenic chronic anovulation but do not predict metabolic or reproductive phenotype. J Clin Endocrin Metab. 2005;90:2571-2579. [ Links ]
12. Moran LJ, Misso ML, Wild RA, Norman RJ. Impaired glucose tolerance, type 2 diabetes and metabolic syndrome in polycystic ovary syndrome: A systematic review and meta-analysis. Hum Reprod Update. 2010;16:347-363. [ Links ]
13. La Marca A, Orvieto R, Giulini S, Jasonni VM, Volpe A, De Leo V. Mullerian-inhibiting substance in women withpolycystic ovary syndrome: Relationship with hormonal and metabolic characteristics. Fertil Steril. 2004;82: 970-972. [ Links ]
14. Cook CL, Siow Y, Brenner AG, Fallat ME. Relationship between serum Müllerian-inhibiting substance and other reproductive hormones in untreated women with polycystic ovary syndrome and normal women. Fertil Steril. 2002;77:141-146. [ Links ]
15. Azziz R, Ehrmann DA, Legro RS, Fereshetian AG, OKeefe M, Ghazzi MN. Troglitazone decreases adrenal androgen levels in women with polycystic ovary syndrome. Fertil Steril. 2003;79:932-937. [ Links ]
16. American Society for Reproductive Medicine. Obesity and reproduction: A committee opinion Practice Committee of the American Society for Reproductive Medicine. Fertil Steril. 2015;104:0015-0282. [ Links ]
17. Gambineri A, Patton L, Vaccina A, Cacciari M, Morselli-Labate AM, Cavazza C, et al. Treatment with flutamide, metformin, and their combination added to a hypocaloric diet in overweight-obese women with polycystic ovary syndrome: A randomized, 12-month, placebo controlled study. J Clin Endocrinol Metab. 2006;91:3970-3980. [ Links ]
18. Crosignani PG, Colombo M, Vegetti W, Somigliana E, Gessati A, Ragni G. Overweight and obese anovulatory patients with polycystic ovaries: Parallel improvements in anthropometric indices, ovarian physiology and fertility rate induced by diet. Hum Reprod. 2003;18:1928-1932. [ Links ]
19. Kiddy DS, Hamilton-Fairley D, Bush A, Short F, Anyaoku V, Reed MJ, et al. Improvement in endocrine and ovarian function during dietary treatment of obese women with polycystic ovary syndrome. Clin Endocrinol (Oxf). 1992;36:105-111. [ Links ]
20. Huber-Buchholz MM, Carey DG, Norman RJ. Restoration of reproductive potential by lifestyle modification in obese polycystic ovary syndrome: Role of insulin sensitivity and luteinizing hormone. J Clin Endocrinol Metab. 1999;84:1470-1474. [ Links ]
21. Holte J, Bergh T, Berne C, Wide L, Lithell H. Restored insulin sensitivity but persistently increased early insulin secretion after weight loss in obese women with polycystic ovary syndrome. J Clin Endocrinol Metab. 1995;80:2586-2593. [ Links ]
22. Dewailly D, Lujan ME, Carmina E, Cedars MI, Laven J, Norman RJ, et al. Definition and significance of polycystic ovarian morphology: A task force report from the Androgen Excess and Polycystic Ovary Syndrome Society. Hum Reprod Update. 2014;20:334-352. [ Links ]
23. Chedraui P, Pérez-López FR, Escobar GS, Palla G4, Montt-Guevara M, Cecchi E, et al. Research Group for the Omega Women's Health Project Circulating leptin, resistin, adiponectin, visfatin, adipsin and ghrelin levels and insulin resistance in postmenopausal women with and without the metabolic syndrome. Maturitas. 2014;79:86-90. [ Links ]
24. Waki H, Tontonoz P. Endocrine functions of adipose tissue. Annu Rev Pathol. 2007;2:31-56. [ Links ]
25. Reaven G, Abbasi F, Mc Laughlin T. Obesity, insulin resistance, and cardiovascular disease. Recent Prog Horm Res. 2004;59:207-223. [ Links ]
26. Matsuzawa Y. Therapy insight: adipocytokines in metabolic syndrome and related cardiovascular disease. Nat Clin Pract Cardiovasc Med 2006; 3: 35-42. [ Links ]
27. Spritzer PM, Lacke SB, Satler F, Mersch D. Adipose tissue dysfunction, adipokines, and low-grade chronic inflammation in polycystic ovary syndrome. Reproduction. 2015; 149:219-227. [ Links ]
28. Carmina E, Lobo RA. Use of fasting blood to assess the prevalence of insulin resistance in women with polycystic ovary syndrome. Fertil Steril. 2004;82:661- 665. [ Links ]
29. De Ugarte CM, Bartolucci AA, Azziz R. Prevalence of insulin resistance in the polycystic ovary syndrome using the homeostasis model assessment. Fertil Steril. 2005; 83: 1454-1460. [ Links ]
30. Moguetti P, Tosi F, Bonin C, Di Sarra D, Fiers T, Marc Kaufman J, et al. Divergences in insulin resistance between the different phenotypes of the polycystic ovary syndrome. J Clin Endocrinol Metab. 2013;98:E628-E637. [ Links ]
31. Ovalle F, Azziz R. Insulin resistance, polycystic ovary syndrome and type 2 diabetes mellitus. Fertil Steril. 2002;77:1095-105. [ Links ]
32. Dumesic DA, Oberfield SE, Stener-Victorin E, Marshall JC, Laven JS, Legro R. Scientific Statement on the diagnostic criteria, epidemiology, pathophysiology, and genetics of Polycystic Ovary Syndrome. Endocrine Reviews. 2015;36:487-525. [ Links ]
33. Goodman NF, Cobin RH, Futterweit W, Glueck JS, Legro RS, Carmina E. American Association of Clinical Endocrinologists, American College of Endocrinology, and Androgen Excess and PCOS Society Disease State Clinical Review: Guide to the best practices in the evaluation and treatment of Polycystic Ovary Syndrome – Part 2. Endocr Pract. 2015;21:1415-1426. [ Links ]
34. Bergman RN, Finegood DT, Ader M. Assessment of insulin sensitivity in vivo. Endocr Rev. 1985;6:45-86. [ Links ]
35. De Fronzo RA, Tobin JD, Andres R. Glucose clamp technique: A method for quantifying insulin secretion and resistance. Am J Physiol. 1979;237:E214-E223. [ Links ]
36. Matthews DR, Hosker JP, Rudenski AS, Naylor BA, Treacher DF, Turner RC. Homeostasis model assessment: Insulin resistance and -cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia. 1985;28:412-419. [ Links ]
37. Hrebícek J, Janout V, Malincíková J, Horáková D, Cízek L. Detection of insulin resistance by simple quantitative insulin sensitivity check index QUICKI for epidemiological assessment and prevention. J Clin Endocrinol Metab. 2002;87:144-147. [ Links ]
38. Wallace TM, Matthews DR. The assessment of insulin resistance in man. Diabet Med. 2002;19:527-534. [ Links ]
39. Legro RS, Finegood D, Dunaif A. A fasting glucose to insulin ratio is a useful measure of insulin sensitivity in women with polycystic ovary syndrome. J Clin Endocrinol Metab. 1998;83:2694-2698. [ Links ]
40. Diamanti-Kandarakis E, Kouli C, Alexandraki K, Spina G. Failure in mathematical indices to accurately assess insulin resistance in lean, overweight, or obese women with polycystic ovary syndrome. J Clin Endocrinol Metab. 2004;83:1273-1276. [ Links ]
41. Fung L, Pizzi R, Centeno I, Hernández E. Resistencia a la insulina en la mujer: ¿cómo y cuándo evaluarla? Rev Obstet Ginecol Venez. 2015;75:200-211. [ Links ]
42. Gayoso P, Otero A, Rodríguez MX, Gude1 F, García F, De Francisco A, et al. Insulin resistance (HOMAIR) cut-off values and the metabolic syndrome in a generaladult population: Effect of gender and age: EPIRCE cross-sectional study. BMC Endocrine Disorders. 2013;13:47:1-10. [ Links ]
43. Conway G, Dewailly D, Diamanti-Kandarakis E, Escobar-Morreale HF, Franks S, Gambineri A, on behalf of the ESE PCOS Special Interest Group. The polycystic ovary syndrome: A position statement from the European Society of Endocrinology. Eur J Endocrinol. 2014;171:1-29. [ Links ]
44. Practice Committee of the American Society for Reproductive Medicine Obesity and reproduction: A committee opinion. Fertil Steril. 2015;104:0015-0282. [ Links ]
45. Salley KE, Wickham EP, Cheang KI, Essah PA, Karjane NW, Nestler JE. Glucose intolerance inpolycystic ovary syndrome – a position statement of the Androgen Excess Society. J Clin Endocrinol Metab. 2007;92:4546-4556. [ Links ]
46. Legro RS, Arslanian SA, Ehrmann DA, Hoeger KM, Murad MH, Pasquali R, et al. Diagnosis and Treatment of Polycystic Ovary Syndrome: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2013;98:4565-4592. [ Links ]
47. Cefalu WT. American Diabetes Association: Standards of Medical Care in Diabetes-2015. Diabetes Care. 2015;38:S9-S10. [ Links ]
48. American Diabetes Association. Standards of medical care in diabetes. Diabetes Care. 2015;38:S1-S93. [ Links ]
49. Marquez-Sandoval G, Macedo-Ojeda D, Viramontes-Horner JD, Fernandez Ballart J, Salas S, Vizmanos B. The prevalence of metabolic syndrome in Latin America: A systematic review. F, Public Health Nutrition: 14:1702-1713. [ Links ]
50. lberti KG, Eckel RH, Grundy SM, Zimmet PZ, Cleeman JI, Donato KA, et al. Harmonizing the Metabolic Syndrome A Joint Interim Statement of the International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity. Circulation; 2009;120:1640-1645. [ Links ]
51. Aschner P, Buendıa R, Brajkovich I, Gonzalez A, Figueredo R , Juarez X, et al. Determination of the cutoff point for waist circumference that establishes the presence of abdominal obesity in Latin American men and women. Diabetes Res Clin Pract. 2011;93:243- 247. [ Links ]
52. Aschner P, MD, Ruiz A, Balkau B, Massien C, Haffner S, on behalf of the Latin America and the Caribbean International Day for Evaluation of Abdominal Adiposity (IDEA) National Coordinators and Investigators. Association of Abdominal Adiposity With Diabetes and Cardiovascular Disease.Latin America J Clin Hypertens. 2009;11:769-774. [ Links ]
53. Lorenzo C, Williams K, Hunt K., Haffner S. The National Cholesterol Education Program–Adult Treatment Panel III, International Diabetes Federation, and World Health Organization. Definitions of the Metabolic Syndrome as Predictors of Incident Cardiovascular Disease and Diabetes. Diabetes Care. 2007;30:8-13. [ Links ]
54. Amato MC, Guarnotta V, Forti, Donatelli D, Dolcimascolo S, Giordano C. Metabolically healthy polycystic ovary syndrome (MH-PCOS) and metabolically unhealthy polycystic ovary syndrome (MU-PCOS): A comparative analysis of four simple methods useful for metabolic assessment. Hum Reprod. 2013;28:1919-1928. [ Links ]
55. Adler GK, Bonyhay I, Failing H, Waring E, Dotson S, Freeman R. Antecedent hypoglycemia impairs autonomic cardiovascular function: Implications for rigorous glycemic control. Diabetes. 2009;58:360- 366. [ Links ]
56. Fagius J. Sympathetic nerve activity in metabolic control–some basic concepts. Acta Physiol Scand. 2003;177:337-343. [ Links ]
57. Landsberg L. Insulin-mediated sympathetic stimulation: Role in the pathogenesis of obesity-related hypertension (or, how insulin affects blood pressure, and why). J Hypertens. 2001;19:523-528. [ Links ]
58. Alvarez GE, Beske SD, Ballard TP, Davy KP. Sympathetic neural activation in visceral obesity. Circulation. 2002;106:2533-2536. [ Links ]
59. Grassi G, DellOro R, Facchini A, Quarti Trevano F, Bolla GB, Mancia G. Effect of central and peripheral body fat distribution on sympathetic and baroreflex function in obese normotensives. J Hypertens. 2004;22:2363-2369. [ Links ]
60. Tekin G, Tekin A, Kiliçarslan EB, Haydardedeoğlu B, Katircibaşi T, Koçum T, et al. Altered autonomic neural control of the cardiovascular system in patients with polycystic ovary syndrome. Int J Cardiol. 2008;130:49-55. [ Links ]
61. Armando I, Levin G, Escobar ME, Barontini M. Peripheral catecholamine alterations in adolescents with polycystic ovary syndrome. Clin Endocrinol (Oxf). 1998;49:221-228. [ Links ]
62. Barria A, Leyton V, Ojeda SR, Lara HE. Ovarian steroidal response to gonadotropins and -adrenergic stimulation is enhanced in polycystic ovary syndrome: Role of sympathetic innervation. Endocrinology. 1993;133:2696–2703. [ Links ]
63. Kim JJ, Choi YM. V Dyslipidemia in women with polycystic ovary síndrome. Obstet Gynecol Sci. 2013;56:137-142. [ Links ]
64. Sprung VS, Atkinson G, Cuthbertson DJ, Pugh CJ, Aziz N, Cable NT, et al. Endothelial function measured using flow-mediated dilation in polycystic ovary syndrome: A meta-analysis of the observational studies. Clin Endocrinol 2012;78:438-446. [ Links ]
65. Studen B, Sever J, Pfeifer M. Cardiovascular risk and subclinical cardiovascular disease in polycystic ovary syndrome. Fron Horm Res. 2013;40:64-82. [ Links ]
66. Ketel IJ, Stehouwer CD, Henry RM, Serne EH, Hompes P, Homburg R, et al. Greater arterial stiffness in polycystic ovary syndrome (PCOS) is an obesity – but not a PCOS-associated phenomenon. J Clin Endocrinol Metab. 2010;95:4566-4575. [ Links ]
67. Ketel IJ, Serne EH, Ijzerman RG, Korsen TJ, Twisk JW, Hompes PG, et al. Insulin-induced capillary recruitment is impaired in both lean and obese women with PCOS. Hum Reprod. 2011;26:3130-3137. [ Links ]
68. Dumesic DA, Oberfield SE, Stener-Victorin E, Marshall JC, Laven JS, Legro R. Scientific Statement on the Diagnostic Criteria, Epidemiology, Pathophysiology, and Molecular Genetics of Polycystic Ovary Syndrome. Endocrine Reviews 2015; 36: 487–525. [ Links ]
69. Wild RA, Rizzo M, Clifton S, Carmina E. Lipid levels in polycystic ovary syndrome: Systematic review and meta-analysis. Fertil Steril. 2011;95:1073-1079. [ Links ]
70. American Diabetes Association. Cardiovascular Disease and Risk Management. Diabetes Care. 2015;39:60-71. [ Links ]
71. Scicchitano P, Dentamaro I, Carbonara R, Bulzis G, Dachille A, Caputo, et al. Cardiovascular Risk in Women With PCOS. Int J Endocrinol Metab. 2012;10:611-618. [ Links ]
72. Martins W, Soares GM, Vieira CS, Reis R, Sá M, Ferriani RA. Insulin resistance in women with polycystic ovary syndrome modifies the cardiovascular risk factors. Rev Brasileira Ginecol Obstet. 2009;31:111-116. [ Links ]
73. Holte J, Gennarelli G, Berne C, Bergh T, Lithell H. Elevated ambulatory day-time blood pressure in women with polycystic ovary syndrome: A sign of a prehypertensive state? Hum Reprod. 1996;11:23-28. [ Links ]
74. Sacks FM, Svetkey LP, Vollmer WM, Appel LJ, Bray GA, Harsha D, et al. DASH/Sodium Collaborative Research Group. Effect on blood pressure of reduced dietary sodium and the dietary approaches to stop hypertension (DASH) diet. N Engl J Med. 2001;344:3- 10. [ Links ]
75. Christian RC, Dumesic DR, Bebrabeck T, Oberg AL, Sheedy PF II, Fitzpatrick LA. Prevalence and predictors of coronary artery calcifications in women with polycystic ovary syndrome. J Clin Endocrinol Metab. 2003;88:2562-2568. [ Links ]
76. Talbott EG, Zborowski JV, Roger JR, Boudreaux MY, Edmundowiez DA, Gusik DS. Evidence for an association between metabolic cardiovascular syndrome and coronary and aortic calcification among women with polycystic ovary syndrome. J Clin Endocrinol Metab. 2004;89:5954-5961. [ Links ]
77. Luque-Ramírez M, Mendieta-Azcona C, Alvarez-Blanco F, Escobar-Morreale HF. Androgen excess is associated with the increased carotid intima-media thickness observed in Young women with polycystic ovary syndrome. Hum Reprod. 2007;22:3197-3203. [ Links ]
78. Victor RG, Haley RW, Willett DL, Peshock RM, Vaeth PC, Leonard D, et al. The Dallas Heart Study: A population-based probability sample for the multidisciplinary study of ethnic differences in cardiovascular health. Am J Cardiol. 2004;93:1473- 1480. [ Links ]
79. Ramezani-Binabaj M, Motalebi M , Karimi-sari H, Saeid Rezaee-Zavareh M, Moayed Alavian S. Are Women With Polycystic Ovarian Syndrome at a High Risk of NonAlcoholic Fatty Liver Disease: A Meta- Analysis. Hepat Mon. 2014;14:e23235. [ Links ]
80. Targher G, Rossini M, Lonardo A. Evidence that non-alcoholic fatty liver disease and polycystic ovary syndrome are associated by necessity rather than chance: A novel hepato-ovarian axis? Endocrine. 2016;51:211-221. [ Links ]
81. Tasali E, Van Cauter E, Hoffman L, Ehrmann DA. Impact of obstructive sleep apnea on insulin resistance and glucose tolerance in women with polycystic ovary syndrome. J Clin Endocrinol Metab. 2008;93:3878- 3884. [ Links ]
82. Tasali E, Chapotot F, Leproult R, Whitmore H, Ehrmann DA. Treatment of obstructive sleep apnea improves cardiometabolic function in young obese women with polycystic ovary syndrome. J Clin Endocrinol Metab. 2011;96:365-374. [ Links ]