Kasmera
versión impresa ISSN 0075-5222
Kasmera v.34 n.1 Maracaibo ene. 2006
Células Epiteliales en la inmunidad del pulmón
Rivas-Santiago, Bruno1; Vieyra-Reyes, Patricia2; Fernández de Larrea, Carlos3 y Araujo, Zaida4
1Instituto Nacional de Enfermedades Respiratorias. Departamento de Investigación en Microbiología, México. 2Instituto de Fisiología Celular. Universidad Nacional Autónoma de México. México. 3Hospital Vargas de Caracas, Universidad Central de Venezuela, Caracas. 4Laboratorio de Enfermedades Infecciosas, Instituto de Biomedicina, Universidad Central de Venezuela, Caracas. E-mail: zaraujo@telcel.net.ve
Resumen
El sistema respiratorio se encuentra en contacto con patógenos, sin embargo, gracias a la respuesta inmune innata de este, solo en raras ocasiones se establece la enfermedad. Las células epiteliales del tracto respiratorio juegan un papel importante para evitar la colonización del pulmón por agentes infecciosos, identificando a los microorganismos a través de receptores especializados, como los Toll-like,. Las células epiteliales son capaces de secretar citocinas, péptidos antimicrobianos y otras moléculas proinflamatorias las cuales evitan el establecimiento de patógenos.
Palabras clave:
Células epiteliales, péptidos antimicrobianos, defensinas, inmunidad innata.
Immunological Role of Lung Epithelial Cells
Abstract
The respiratory tract is one of the main apparatus which is in daily contact with a wide variety of microorganisms, however, only on a few occasions is infection establish because of its innate immune response. Respiratory tract epithelial cells play a very important role in avoiding infectious agent colonization of the lungs, since this kind of cell can recognize microbial molecules through very specialized receptors such as Toll-like. Moreover these cells posses a broad variety of molecules which are related to local immunity. Respiratory tract epithelial cells are capable of producing several chemokines, antimicrobial peptides and other pro-inflammatory molecules.
Key words:
Epithelial cells, antimicrobial peptides, defensins, innate immunity.
Recibido: 01-12-05 / Aceptado: 12-05-06
Introducción
El pulmón es uno de los órganos que más contacto tiene con los microorganismos. El pulmón inhala aproximadamente 10,000 litros de aire al día, por lo tanto está expuesto a una enorme cantidad de microorganismos, que la mayoría de las veces son incapaces de colonizar el pulmón debido a una efectiva respuesta inmune innata (1). La respuesta inmune innata en pulmón está dada principalmente por barreras físicas así como por células de defensa como son neutrófilos, macrófagos, células cebadas, basófilos, eosinófilos y células asesinas (NK).
Se pensaba que las células epiteliales solo actuaban como barrera física y secretando moco y algunas enzimas. Recientemente se describió que las células epiteliales contribuyen activamente con el sistema inmune secretando varias moléculas relacionadas con la respuesta inmunitaria como son las quimiocinas, Citocinas y defensinas, entre otras (2). El objetivo de esta revisión es resaltar el papel de las células epiteliales del tracto respiratorio en la inmunidad de pulmón.
Reconocimiento de moléculas propias de patógenos por las células epiteliales
Los microorganismos una vez que son inhalados establecen contacto primeramente con las células epiteliales. Estas, aparte de tener una función estructural, tienen un papel dentro de la respuesta inmunitaria primaria en contra de microorganismos, ya que pueden reconocer al microorganismo e iniciar una respuesta inmunitaria. Se sabe que los microorganismos tienen ciertos patrones dentro de sus moléculas propias, los cuales pueden ser reconocidas por el sistema inmune. Estos son llamados por sus siglas en ingles PAM´s (Patrones Moleculares Asociadas a Patógenos) y que son reconocidos por receptores localizados sobre la membrana de las células huésped. Estos receptores son conocidos por sus siglas en inglés como PRR´s (Receptores de Reconocimiento de Patógenos), de los cuales podemos mencionar las léctinas de unión a manosa (MBL), Receptores Tipo Toll (Toll-like Receptors) y CD14 entre otros. (3) No obstante que las células de defensa clásicas como los macrófagos, neutrófilos y células dendríticas tienen una gran cantidad y variabilidad de estos tipos de receptores (4). Las células epiteliales del tracto respiratorio también poseen estos tipos de receptores (5). Los ligandos para este tipo de receptores son muy variados, pudiendo ser moléculas constituyentes de la membrana de bacterias u hongos o bien material genético tanto de bacterias como de virus (7- 13). A la fecha se han reconocido varios PRR´s en la superficie de las células epiteliales de pulmón (3, 4, 5). Los PRR´s se pueden presentar de manera soluble en secreciones o en la circulación, tal es el caso de MBL; o bien este tipo de receptores pueden estar presentes en la superficie de la célula con una porción intracelular y una extracelular, dentro de esta clase en las células epiteliales destacan los receptores parecidos a Toll, los cuales se han estudiado mucho a lo largo de estos últimos diez años y se han podido identificar 13 TLR´s hasta el momento (14). La unión de los TLRs con su ligando induce la activación de una gran variedad de genes en las células epiteliales que regulan la expresión de IL-6, TNF, receptores de quimiocinas y péptidos antimicrobianos (4, 6, 7).
Algunos componentes propios de la respuesta inmunitaria pueden servir de ligandos para los TLR´s de las células epiteliales del tracto respiratorio (Figura 1), tal es el caso de la proteína surfactante tipo A (SP-A), la cual es capaz de activar macrófagos alveolares vía TLR4 e inducir la producción de IL-8 en las células epiteliales (15, 16). Los péptidos antimicrobianos b-defensina-2 murida (mBD-2) y LL-37 son otro ejemplo claro de activación vía TLR´s. Este tipo de péptido antimicrobiano puede activar a células dendríticas inmaduras vía TLR4, dando como resultado un aumento de moléculas coestimulatorias y la maduración de la célula dendrítica (17, 18).
Respuesta de las células epiteliales de tracto respiratorio a patógenos
Como se menciono anteriormente, las células epiteliales, primero tienen que reconocer las moléculas propias del patógeno o moléculas mediadoras de inflamación. Esto lo logran principalmente a través de receptores como los TLR´s y CD14 (4, 6, 7). Existe una gran variedad de moléculas que pueden ser secretadas por las células epiteliales en respuesta a PAM´s, de las cuales podemos resaltar a los péptidos antimicrobianos por su gran versatilidad (Tabla 1). Los Péptidos antimicrobianos tienen la capacidad de eliminar directamente al microorganismo, sirven como quimioatrayentes, opsonizan y son un puente entre la inmunidad innata y la inmunidad adaptativa, al inducir la maduración de células dendríticas inmaduras; además de esto, participan en la reparación de tejido afectado promoviendo la angiogénesis y proliferación celular (19, 20).
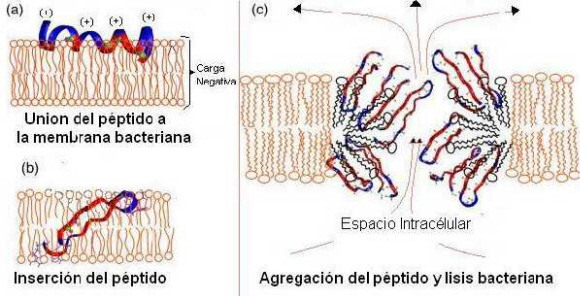
Las moléculas que tienen un efecto antimicrobicida directo son principalmente los péptidos antimicrobianos, los cuales son péptidos de bajo peso molecular (3-4.5kD) y que son principalmente catiónicos (21, 22, 23). Estos péptidos tienen un amplio espectro en contra de bacterias Gram positivas, Gram negativas, hongos y virus envueltos (23, 24). Los péptidos por su carga positiva, son atraídos por la membrana del microorganismo que regularmente tiene carga negativa. La unión de estos péptidos a la membrana ocasiona que estos se aglutinen formando poros en la membrana del microorganismo llevando así a su lísis (Figura 2). Los péptidos antimicrobianos son sinérgicos con moléculas de defensa tales como la lisosima y la lactoferrina (22, 23, 24). De acuerdo a su estructura existen varias clasificaciones de este tipo de péptidos antimicrobianos (24). Sin embargo, hay dos tipos muy importantes en el tracto respiratorio las catelicidinas y las defensinas. Estos péptidos son producidos principalmente por las células epiteliales aunque también pueden ser producidos por algunas células fagocíticas (19, 24, 25). Estos péptidos en su mayoría son inducibles; el estímulo puede ser por citocinas proinflamatorias como TNFa e IL-1, PAM´s o bien otro tipo de péptidos antimicrobianos como catelicidinas (26, 27). También existen aquellos que son sintetizados constitutivamente como es el caso de la b-defensina-1. Se ha observado que en algunas enfermedades de pulmón como en la fibrosis quística, neumonía, bronquitis crónica, sarcoidosis, fibrosis pulmonar idiopática, los niveles de defensinas se ven claramente aumentados lo que ha indicado que son inducibles y que además están involucradas dentro de la inmunopatogénesis de varias enfermedades. En el caso de neumonía causada por Pseudomonas aeruginosa se ha observado que además de que en el lavado bronquiolo alveolar la cantidad de b-defensina-2 está incrementa, este tipo de bacteria es susceptible a la acción bactericida de este tipo de defensina (26) Por otra parte, en el caso de pacientes con fibrosis quística, la alta cantidad de NaCl en pulmón de estos pacientes inactiva las defensinas del pulmón, por lo que la infección por Pseudomonas se torna muy difícil de controlar, a pesar de que exista una gran cantidad de anticuerpos circulantes en contra de la misma, progresando hasta sus últimas consecuencias (28).
Figura 1. Muestra los diferentes tipos de TLR a si como sus ligandos.
Moléculas secretadas por células epiteliales que actúan en la respuesta inmune innata contra agentes patógenos.
Mediadores Inflamatorios
Mediadores quimiotáctico
Antimicrobianos
Citocinas:
IL-8, IL-1, IL-4, IL-13.
Quimiocinas:
L-8, CCL20/MIP3a,
MCP-4/CCL13.b-defensinas
LL37/CAP18
SP-A
SP-DQuimiocinas:
IL-8, CCL20/MIP3a, MCP-4/CCL13.
Péptidos Antimicrobianos:
b-Defensinas, Catelicidinas,
Péptidos aniónicos.Lisosima
Lactoferrina
Péptidos
aniónicosLeucotrienos:
Hidrolasa A4,
Fosfolipasa A2,
LTB4, LD4.Leucotrienos:
Hidrolasa A4,
Fosfolipasa A2,
LTB4, LD4.
Figura 2. La membrana cationica de los microorganismos atrae a los péptidos antimicrobianos, Los cuales son regularmente catiónicos (A).Los péptidos antimicrobianos se unen a la membrana (B) insertándose (C) formando poros, los cuales llevan a la lisis de la bacteria.
En estudios con Mycobacterium tuberculosis (MTb) se ha observado que la micobacteria puede invadir a las células epiteliales de pulmón y quedar ahí de forma latente (35, 36). Por otra parte estudios recientes han demostrado que las células epiteliales son capaces de producir oxido nítrico en respuesta a la invasión de MTb y de esta forma eliminar a la micobacteria (37).
En trabajos realizados en nuestro laboratorio hemos demostrado que, MTb induce la expresión de b-defensina-2 en células epiteliales de pulmón y que este péptido es capaz de eliminar a MTb. Igualmente hemos demostrado que ratones que producen una mayor cantidad de b-defensina-3 murida son menos susceptibles a desarrollar una tuberculosis pulmonar progresiva, que los que la producen en menor escala (datos no publicados). Estos datos revelan que los péptidos antimicrobianos producidos por las células epiteliales de pulmón colaboran en la respuesta inmune innata teniendo una actividad antimicrobiana directa hacia MTb. En otros estudios se ha visto, que ratones knock out para el gen de b-defensina-1 sucumben a la infección por Haemophilus influenzae (29). La sobre expresión causada por tranfección viral de la proteína antimicrobiana-18 relacionada a cetelina, la cual es el homologo de LL-37 dio como resultado el aumento de la respuesta inmune innata mediada por péptidos antimicrobianos en neumonía y choque séptico, observándose una gran diferencia significativa entre los animales no transfectado y los tranfectados (30, 31). Otro estudio puso en evidencia la importancia contundente que tiene los péptidos antimicrobianos secretados por las células epiteliales, cuando demostró que los portadores nasales de Staphylococcus aureus tenían una pobre actividad antimicrobiana en los fluidos nasales (32).
.Las células epiteliales además de producir defensinas y LL-37, los cuales tienen actividad antimicrobiana directa y efecto quimiotáctico, sirven como puente entre la inmunidad innata y la adaptativa, ya que tienen efecto quimiotáctico sobre células dendríticas inmaduras además de que promueven angiogénesis y proliferación para la cicatrización de tejido dañado. Las células epiteliales también secretan citocinas, quimiocinas, proteínas surfactantes y algunos factores del complemento como C3 (33, 34).
Conclusiones
Es evidente que en el los últimos diez años se ha puesto mucho énfasis en conocer la respuesta inmune innata en pulmón y se ha llegado a la conclusión de que las células epiteliales del tracto respiratorio juegan un papel muy importante en este tipo de inmunidad, siendo en algunos casos crucial para la evolución o control de algunas enfermedades. Las células epiteliales cuentan con una amplia variedad de moléculas que colaboran en la respuesta inmunitaria del hospedero. Estas moléculas cuentan con una actividad muy variada desde ser antibióticos endógenos, hasta ser un puente con la inmunidad adquirida. Se ha visto también que el sistema de reconocimiento de las células epiteliales es muy amplio y pueden reconocer una amplia gamma de moléculas potencialmente dañinas para el hospedero. Se ha empezado a estudiar con más énfasis el papel de las células epiteliales en las diferentes inmunopatogénesis de las enfermedades infecciosas. Sin embargo, hace falta todavía mucho por explorar; por ejemplo, la existencia de posibles polimorfismos presentes en genes relacionados con la repuesta inmune de las células epiteliales de pulmón, y como estos polimorfismos pueden o no hacer que los individuos sean más susceptible a ciertos tipos de enfermedades.
Actualmente el estudio de las células involucradas en la respuesta inmune innata en pulmón está basado en usar inmunomoduladores que actúen sobre el comportamiento inmunológico de estos tipos de células. De la misma manera, se está usando el conocimiento actual acerca de péptidos antimicrobianos con el objeto de crear nuevos tipos de antibióticos, con fines terapéuticos y de esta forma poder hacer frente a la nueva generación de microorganismos resistentes a fármacos.
Referencias Bibliográficas
(1).Medzhitov, R.; Janeway, C.A. Jr. Innate immunity impact on the adaptative immune response. Curr Opin Immunol 1997; 9: 4-9. [ Links ]
(2).Diamond, G.; Legarda, D.; Ryan, L.K. The innate immune response of the respiratory epithelium. Immunol. Rev 2000; 173: 27-38. [ Links ]
(3).Netea, M.G.; Van der Meer, J.W.; Kullberg, B.J. Toll-like receptors as an escape mechanism from the host defense. Trends Microbiol. 2004; 11:484-488. [ Links ]
(4).Cook, D.N.; Pisetsky, D.S.; Schwartz, D.A. Toll-like receptors in the pathogenesis of human disease. Nat Immunol 2004; 10:975-979. [ Links ]
(5)Hogg, J.C. Pathophisiology of airflow limitation in chronic obstructive pulmonary disease. Lancet. 2004; 364: 709-721. [ Links ]
(6).Takii, T.; Abe, C.; Tamura, A.; Ramayah, S.; Belisle, J.T.; Brennan, P.J.; Onozaki, K. Interleukin-1 or tumor necrosis factor-alpha augmented the cytotoxic effect of mycobacteria on human fibroblasts: application to evaluation of pathogenesis of clinical isolates of Mycobacterium tuberculosis and M. avium complex.J Interferon Cytokine Res. 2001; 3:187-196. [ Links ]
(7).Haslett, C. Granulocyte apoptosis and its role in resolution and control of lung inflammation. Am j. Respir Crit. Care Med 2001; 160:50-11. [ Links ]
(8).Hiemstra, P.S.; Van Wetering, S.; Stolk, J. Neutrophil serine proteinases and defensins in chronic obstructive pulmonary disease: effects on pulmonary epithelium. Eur. Resp. J. 2000; 12: 1200-1208. [ Links ]
(9).Agerberth, B.; Charo, J.; Werr, J.; Olsson, B.; Idali, F.; Lindbom, L.; Kiessling, R.; Jornvall, H.; Wigzell, H., Gudmundsson GH., The human antimicrobial and chemotactic peptides LL-37 and a-defensins are expressed by specific lymphocytes and monocytes populations. Blood. 2001; 96:3086-3093. [ Links ]
(10).Zhang, H.; Porro, G.; Orzech, N.; Mullen, B.; Liu, M.; Slutsky, A.S. Neutrophil defensins mediate acute inflammatory response and lung dysfunction in dose-related fashion.Am J Physiol Lung Cell Mol Physiol. 2001; 280:L947-954. [ Links ]
(11).Cunliffe, R.N.; Mahida, Y.R. Expression and regulation of antimicrobial peptides in the gastrointestinal tract.J Leukoc Biol. 2004; 75(1):49-58. [ Links ]
(12).Quayle, A.J.; Porter, E.M.; Nussbaum, A.A.; Wang Y.M.; Brabec C.; Yip, K.P.; Mok, S.C. Immunolocalization, and secretion of human defensin-5 in human female reproductive tract.Am J Pathol. 1998; 152:1247-1258. [ Links ]
(13).Schutte, B.C.; Mitros, J.P.; Bartlett, J.A.; Walters, J.D.; Jia, H.P.; Welsh, M.J.; Casavant, T.L.; McCray, P.B. Jr. Discovery of five conserved beta -defensin gene clusters using a computational search strategy. Proc Natl Acad Sci 2002; 22:14611-14614. [ Links ]
(14).Terence, M. TB or not TB: That is the question- does TLR signaling hold the answer?. Journal Clin. Invest. 2004; 24:114-118. [ Links ]
(15).Alcorn, J.F.; Wright, J.R. Surfactant protein A inhibits alveolar macrophage cytokine production by CD14-independent pathway.Am J Physiol Lung Cell Mol Physiol. 2004; 286:129-136. [ Links ]
(16).Schutte, B.C.; McCray, P.B. Jr. b-defensins in lung host defense. Annu Rev Physiol. 2002; 64:709-748. [ Links ]
(17).Biragyn, A.; Ruffini, P.A.; Leifer, C.A.; Klyushnenkova, E.; Shakhov, A.; Chertov, O.; Shirakawa, AK.; Farber, JM.; Segal, DM.; Oppenheim, JJ.; Kwak, LW. Toll-like receptor 4-dependent activation of dendritic cells by beta-defensin 2. Science. 2002; 5595:1025-1029. [ Links ]
(18).Davidson, D.J.; Currie, A.J.; Reid, G.S.; Bowdish, D.M.; MacDonald, K.L.; Hancock, R.E.; Speert, D.P. The cationic antimicrobial peptide LL-37 modulates dendritic cell differentiation and dendritic cell-induced T cell polarization.J Immunol. 2004; 172:1146-1156.
(19).Van Wetering, S.; Tjabringa, S.; Hiemstra, P. Interactions between neutrophil-derived antimicrobial peptides and airway epithelial cells. J Leukoc Biol. 2005; 4:444-4450. [ Links ]
(20).Bals, R.; Hiemstra, P.S. Innate immunity in the lung: how epithelial cells fight against respiratory pathogens. Eur Respir J. 2004; 23:327-333. [ Links ]
(21).Frantz, S.; Vincent, K.A.; Feron, O.; Kelly, R.A. Innate immunity and angiogenesis.Circ Res. 2005; 96:15-26. [ Links ]
(22).Reddy, K.V.; Yedery, R.D.; Aranha, C. Antimicrobial peptides: premises and promises.Int J Antimicrob Agents. 2004 ; 6:536-547. [ Links ]
(23).Ganz, T. Defensins: antimicrobial peptides of vertebrates. C R Biol. 2004; 6:539-549. [ Links ]
(24).Koczulla, A.R.; Bals, R. Antimicrobial peptides: current status and therapeutic potential. Drugs. 2003; 63: 389-406. [ Links ]
(25).Wilson, C.L.; Ouellette, A.J.; Satchell, D.P.; Ayabe, T.; Lopez-Boado, Y.S.; Stratman, J.L.; Hultgren S.J.; Matrisian, L.M.; Parks, W.C. Regulation of intestinal alpha-defensin activation by the metalloproteinase matrilysin in innate host defense. Science. 1999; 286:113-117. [ Links ]
(26).Harder, J.; Meyer-Hoffert, U.; Teran, L.M.; Schwichtenberg, L.; Bartels, J.; Maune, S.; Schroder, J.M. Mucoid Pseudomonas aeruginosa, TNF-alpha, and IL-1beta, but not IL-6, induce human beta-defensin-2 in respiratory epithelia.Am J Respir Cell Mol Biol. 2000; 22:714-721. [ Links ]
(27).Duits, L.A.; Ravensbergen, B.; Rademaker, M.; Hiemstra, P.S.; Nibbering, P.H. Expression of beta-defensin 1 and 2 mRNA by human monocytes, macrophages and dendritic cells. Immunology. 2002; 106:517-525. [ Links ]
(28).Bals, R.; Weiner, D.J.; Meegalla, R.L.; Accurso F.; Wilson, J.M. Salt-independent abnormality of antimicrobial activity in cystic fibrosis airway surface fluid. Am J Respir Cell Mol Biol. 2001; 25:21-25. [ Links ]
(29).Moser, C.; Weiner, D.J.; Lysenko, E.; Bals, R.; Weiser, J.N.; Wilson, J.M. beta-Defensin 1 contributes to pulmonary innate immunity in mice.Infect Immun. 2002; 70:3068-3072. [ Links ]
(30).Bals, R.; Weiner, D.J.; Meegalla, R.L.; Wilson, J.M. Transfer of a cathelicidin peptide antibiotic gene restores bacterial killing in a cystic fibrosis xenograft model. J Clin Invest. 1999;103:1113-1117. [ Links ]
(31).Cole, A.M.; Waring, A.J. The role of defensins in lung biology and therapy. Am J Respir Med. 2002; 4:249-259. [ Links ]
(32).Cole, A.M.; Tahk, S.; Oren, A.; Yoshioka, D.; Kim, Y.H.; Park, A.; Ganz, T. Determinants of Staphylococcus aureus nasal carriage. Clin Diagn Lab Immunol. 2001; 8:1064-1069. [ Links ]
(33).Cao, Y.; Tao, J.Q.; Bates, S.R.; Beers, M.F.; Haczku, A. IL-4 induces production of the lung collectin surfactant protein-D.J Allergy Clin Immunol. 2004; 113:439-444. [ Links ]
(34)De Astorza, B.; Cortes, G.; Crespi, C.; Saus, C.; Rojo, J.M.; Alberti, S. C3 promotes clearance of Klebsiella pneumoniae by A549 epithelial cells. Infect Immun. 2004; 72:1767-1774. [ Links ]
(35).Castro-Garza, J.; King, C.H.; Swords, W.E.; Quinn, FD. Demonstration of spread by Mycobacterium tuberculosis bacilli in A549 epithelial cell monolayers.FEMS Microbiol Lett. 2002; 2212:145-149. [ Links ]
(36).Bermudez, L.E.; Goodman, J. Mycobacterium tuberculosis invades and replicates within type II alveolar cells.Infect Immun. 1996; 64:1400-1406. [ Links ]
(37).Roy, S.; Sharma, S.; Sharma, M.; Aggarwal, R.; Bose, M. Induction of nitric oxide release from the human alveolar epithelial cell line A549: an in vitro correlate of innate immune response to Mycobacterium tuberculosis. Immunology. 2004; 112:471-480. [ Links ]












 uBio
uBio