Kasmera
versión impresa ISSN 0075-5222
Kasmera v.37 n.1 Maracaibo jun. 2009
Efectos de la ingestión de una dieta con alto contenido en grasas en ratas Wistar crónicamente infectadas con Trypanosoma cruzi
The Effects of Ingesting a High-fat Diet on Wistar Rats Chronically Infected with Trypanosoma cruzi
1Paredes, José Leonardo; 1Moreno, Elio A; 2Premoli, Gloria; 1Alarcón, Maritza; 1Lugo de Yarbuh, Ana; 1Villarreal, Juana; 1Araujo, Sonia y 3Borges, Rafael
1Laboratorio de Parasitología Experimental (LAPEX), Departamento de Biología Facultad de Ciencia. 2Centro de Investigaciones Odontológica, Facultad de Odontología. 3Departamento de Estadística, Facultad de Economía: Universidad de Los Andes. Mérida 5101, Venezuela. E-mail: emorenob@ula.ve
Resumen
Se investigan los efectos de la ingestión de una dieta con alto contenido en grasas en ratas albinas (R. norvegicus) crónicamente infectadas con Trypanosoma cruzi Planalto, mediante pruebas de diagnóstico sero-parasitológicas, cuantificación del Índice de Masa Corporal (IMC), detección de la Proteína C Reactiva (PCR), evaluación de los niveles de lípidos plasmáticos (colesterol total, lipoproteínas de alta densidad - HDL y triglicéridos) y presencia de depósitos lipídicos en la arteria aorta. Durante el curso de la infección chagásica, se detectaron parasitemias patentes entre los 10 y 35 días pi, con un máximo promedio de 36,68±2 trips./mm3 de sangre a los 25 días. A los 90 días pi, se evidenció ausencia de parasitemias y presencia de anticuerpos IgG anti- T. cruzi. Las ratas chagásicas (A) y las sanas (C) sometidas a la dieta rica en grasas, mostraron: diferencias significativas (p<0,05) en el IMC, en comparación con los grupos de ratas sometidas a la dieta normal (B: infectadas y D: sanas); discreta reacción de la PCR en los sueros de las ratas infectadas B; aumento significativo en los niveles de colesterol total, colesterol - HDL y triglicéridos en los grupos A y C en comparación con los grupos controles B y D (p<0,05). El estudio histológico de las arterias de ratas del grupo A, reveló importantes depósitos lipídicos ubicados en la capa muscular próximos a las capas íntima y adventicia. Estos resultados sugieren que el incremento en los niveles de lípidos plasmáticos estimulado por el proceso infeccioso, son los principales mecanismos por el cual T. cruzi podría estar influyendo en la iniciación o progresión de placas ateromatosas.
Palabras clave: Trypanosoma cruzi, dieta rica en grasas, rata Wistar infección chagásica crónica.
Abstract
The effects of ingesting a high fat diet on albino rats (R. norvegicus) chronically infected with Trypanosome cruzi Planalto were researched using serological and parasitological diagnostic tests, body mass index (BMI) quantification, detection of C-Protein Reactive (CPR), evaluation of the plasmatic lipid levels (total cholesterol, high density lipoproteins HDL and triglycerides) and the presence of lipidic deposits in the aorta artery. During the course of the chagasic infection, patent parasitemias were detected between the ages of 10 and 35 days post-infection (pi) with a maximum average of 36.68 ± 2 tryps/mm3 of blood at 25 days. At 90 days pi, the absence of parasitemias and the presence of IgG anti T. cruzi antibodies were in evidence. The chagasic rats in chronic phase (A) and the healthy controls (C) submitted to a high fat diet showed: 1. Significant variations (p0.05) in the BMI, in comparison with the rat groups receiving a normal diet (B: infected and D: healthy rats); 2. A discrete CRP reaction in the serum of infected rats B; 3. A significant increase was shown in the total cholesterol levels, HDL cholesterol and triglycerides for groups A and C in comparison with control groups B and D (p0.05). The histological study of rat arteries in group A revealed important lipid deposits located in the muscular layer near the intimal and adventitial layer. These results suggest that the increase in plasmatic lipid levels stimulated by the infectious process are the main mechanisms through which T. cruzi could be influencing the initiation or the progression of atheromatous plaque.
Key words: Trypanosoma cruzi, high fat diet, Wistar rats, chronic chagasic infection.
Recibido: 21-10-08 / Aceptado: 09-03-09
Introducción
La enfermedad de Chagas o tripanosomiasis americana y las enfermedades cardiovasculares son problemas de salud pública importantes en América Latina (1). La primera es una parasitosis cuyo agente etiológico es el protozoario flagelado denominado Trypanosoma cruzi (2), perteneciente al Orden Kinetoplastida, Familia Trypanosomatidae, y transmitido al hombre y a otros mamíferos susceptibles en el 80% de los casos por contaminación con las deyecciones infectivas de numerosas especies de insectos hemípteros de la familia Reduviidae, subfamilia Triatominae (3). La infección chagásica se inicia con una fase aguda con la presencia de parasitemias patentes, elevados niveles de IgM y otros signos y síntomas no específicos. Con el progreso de la misma, se elevan los niveles de IgA e IgG y se producen severas lesiones en los tejidos muscular cardíaco y esquelético, digestivo y nervioso. La infección evoluciona hacia una fase latente o indeterminada asintomática, con serología positiva y parasitemias subpatentes seguida por una fase crónica caracterizada por una miocardiopatía progresiva con alteraciones digestivas irreversibles (4,5).
A diferencia de la enfermedad de Chagas, la Aterosclerosis es la causa principal de un grupo de enfermedades denominadas enfermedades cardiovasculares, caracterizada por la acumulación de grasa llamada placas ateroscleróticas en el interior de la pared de las arterias (6). Esta lesión está formada por una zona central compuesta por material lipídico desorganizado, restos celulares, fibrina, proteínas plasmáticas, una capa fibrosa constituida por colágeno y fibras musculares lisas. En su formación intervienen distintos tipos de células tales como: células del endotelio vascular, monocitos, macrófagos, linfocitos, plaquetas y células musculares lisas (7). Por otro lado, se ha observado que aproximadamente entre el 40 y 50% de los pacientes con enfermedad cardiovascular que han sufrido un infarto agudo al miocardio o accidente cerebro-vascular, carecen de los factores de riesgo tradicionales (cigarrillo, hipertensión arterial, diabetes mellitus, síndromes metabólicos, genéticos, inmunológicos y obesidad), tales factores no explican claramente las diferencias en la prevalencia y severidad de la enfermedad arterial coronaria lo que induce a explorar otros factores como son los procesos infecciosos, los cuales demuestran una asociación epidemiológica fuerte e independiente con incidencia en la aterosclerosis (8).
En la actualidad, en Venezuela según el Ministerio del Poder Popular para la Salud, el porcentaje de mortalidad para el año 2006 fue de 20,63% para las enfermedades del corazón y 7,76% para las enfermedades cerebrovasculares, ocupando la primera y cuarta causa de muerte respectivamente. En humanos, la infección crónica por T. cruzi y su relación con la aterosclerosis ha sido sugerida por diferentes investigadores (9-12). Recientemente, Berrisbetia y col. (13) evaluando en pacientes cursantes de las fases indeterminada y crónica de la enfermedad de Chagas los niveles triglicéridos, colesterol y lipoproteínas (HDL, LDL y VLDL), encontraron niveles significativamente mayores (p<0,05) de colesterol, LDL y VLDL en pacientes en fase crónica con respecto a los casos en fase indeterminada y los controles sanos. Los autores sugieren que la condición clínica propia de la miocardiopatía chagásica podría agravase a causa de posibles compromisos ateroscleróticos generados por niveles elevados de colesterol y HDL en estos pacientes en fase crónica de la enfermedad.
Tanto en humanos como en animales experimentales, se ha demostrado que las grasas como constituyente de la dieta pueden producir modificaciones en los lípidos plasmáticos y en la función plaquetaria, parámetros que afectan directamente el desarrollo de lesiones ateroscleróticas (14). El transporte y metabolismo de los lípidos en el plasma es similar en todos los mamíferos, la manera en la cual estas lipoproteínas se metabolizan es mediante una vía exógena, que transporta lípidos desde el intestino hasta el hígado y una vía endógena, que transporta los lípidos desde el hígado hacia los tejidos y viceversa. Por otro lado, la tasa metabólica en los mamíferos aumenta en la medida que disminuye el peso y el tamaño. La diferencia metabólica entre los humanos y las ratas, radica en que las ratas presentan un índice metabólico mucho mayor; por ejemplo, se ha estimado que en una semana, una rata consume alrededor de seis veces su peso corporal para cubrir sus necesidades energéticas, mientras que el humano consume sólo una tercera parte de su peso, por lo que la ingestión de grasas es mucho mayor aumentando de esta manera el riesgo cardiovascular (15).
Estudios experimentales, señalaron que la combinación de la infección aguda por T. cruzi y una dieta rica en colesterol, produce un proceso aterogénico temprano en ratones CBA/J (16). Igualmente, conejos infectados con T. cruzi Y, a los cuales se les administró una dosis diaria de colesterol, mostraron una disminución en los niveles de colesterol total, colesterol HDL y LDL. Esta disminución del nivel de colesterol y de sus fracciones sugiere una menor capacidad del hígado infectado para liberar lipoproteínas y/o una mayor oxidación de LDL por efecto de la infección por T. cruzi, con el consecuente incremento en la eliminación biliar de colesterol. Así mismo, el daño endotelial debido a la presencia de parásitos podría favorecer el depósito de colesterol en la microvasculatura y al mismo tiempo los bajos niveles de HDL, incrementaría la aterogenicidad de la dieta alta en colesterol (17).
Tomando en consideración la existencia de ciertos factores o evidencias experimentales que aportan información sobre la compleja relación entre la infección por T. cruzi y las enfermedades cardiovasculares, en este sentido nos hemos propuesto a investigar en ratas Wistar machos con infección chagásica crónica los efectos directos o indirectos de la ingestión de una dieta con alto contenido en grasas, mediante el estudio de parámetros que evalúan el riesgo cardiovascular.
Materiales y Métodos
Cepa de Trypanosoma cruzi
Utilizamos parásitos de la cepa I/PAN/ Ve/00/Planalto, aislada a partir de un triatomino (Panstrongylus geniculatus), capturado en la ciudad de Caracas. Los parásitos fueron mantenidos mediante pasajes sucesivos en el medio NNN-USAMRU (18), adicionado con solución salina como fase líquida; con algunos pasajes intermedios entre ratones NMRI y ninfas de Rhodnius prolixus nacidas en el Insectario de cría Dr. Herman Lent del Departamento de Biología de la Facultad de Ciencias.
Inoculación de las ratas
Un total de 28 ratas albinas (Rattus norvegicus), cepa Wistar, machos juveniles de 15 a 20 días de nacidos, obtenidas en el Bioterio de cría de la Universidad de Los Andes (BIOULA), fueron utilizadas. Un lote de 14 ratas fueron inoculadas por vía intraperitoneal (IP) con aproximadamente 5x104 tripomastigotes metacíclicos de T. cruzi, obtenidos de las deyecciones postprandiales de ninfas del V estadio de R. prolixus con 30 días de infectadas siguiendo los procedimientos descritos por Moreno y col. (19). El otro lote de 14 ratas sanas con las mismas características antes señaladas se utilizaron como controles. Las ratas fueron mantenidas en jaulas separadas en el Bioterio experimental con alimento comercial ratarinaR y agua ad libitum.
Evaluación del curso de la infección
La parasitemia fue estimada en las 14 ratas infectadas mediante el examen directo de 5 µL de sangre recién extraída de la vena caudal de cada animal a los 10, 14, 25, 35, y 90 días post-infección (pi), cuantificando el número de tripomastigotes sanguícolas (20).
A partir de los 90 días pi, a las ratas infectadas que superaron la fase aguda de la infección chagásica, se les extrajo una muestra de sangre con capilares heparinizados del plexo retro-orbital estando los animales ligeramente anestesiados con éter dietílico. La sangre se utilizó para la detección de parasitemias subpatentes empleando el microhematocrito como método de concentración (21). Otra parte de la sangre colectada en viales de plástico, se dejo reposar durante 45 minutos (min) para su coagulación, los sueros se separaron por centrifugación y fueron empleados en la detección de los anticuerpos (Ac) específicos IgG anti-T. cruzi, utilizando las pruebas de Inmunofluorescencia Indirecta (IFI) y el ensayo Inmunoenzimático (ELISA). En la prueba de IFI se utilizó como antígeno las formas epimastigotes de cultivo de T. cruzi y suero anti-IgG de rata conjugado con isotiocianato de fluoresceina (Sigma). En la ELISA, un extracto soluble de epimastigotes de T. cruzi fue utilizado como antígeno y anti-IgG conjugado a peroxidasa (Sigma) (22,23).
Preparación y administración de la dieta con alto contenido en grasas
La dieta rica en grasa fue preparada impregnando completamente 1 Kg de ratarina comercial en 400 g de manteca vegetal derretida, cuya composición según especificación del fabricante era de: Grasa total 14 g, ácidos grasos saturados 2,5 g, ácidos grasos monoinsaturados 4,0 g, ácidos grasos poli-insaturados 7,5 g. Luego de su preparación, la dieta grasa fue almacenada en un envase herméticamente cerrado.
Las 14 ratas en la fase crónica de la infección chagásica, fueron divididas en dos grupos. Un grupo A (n=7) se alimentó durante tres meses con la dieta con alto contenido en grasas y el grupo B (n=7) recibió dieta normal de ratarina comercial. Las 14 ratas restantes mantenidas como controles sanos se dividieron en dos grupos de 7 ratas cada uno. El grupo C (n=7) se alimentó durante tres meses con la dieta rica en grasas y el grupo D (n=7) recibió dieta normal de ratarina. Los animales fueron mantenidos en el Bioterio experimental con las dietas suministradas y agua ad libitum.
Estimación del Índice de Masa Corporal (IMC)
Las medidas del peso y talla para calcular el IMC o Índice de Quetelet en las ratas, se efectuaron antes de administrar la dieta y cada quince días después de iniciada la misma. El IMC fue utilizado como un indicador de obesidad o acumulación de tejido graso en las ratas infectadas (A) y sanas (C) en comparación con los grupos controles B y D. Las variables talla y masa se relacionaron mediante la siguiente ecuación (24,25).
IMC = Masa (g)/Talla (cm2)
Detección de la Proteína C Reactiva (PCR)
Antes de someter las ratas a la dieta rica en grasas y a los quince días después de iniciada la misma, se extrajo una muestra de sangre en los grupos de ratas infectadas (A) y sanas (C), para la separación de los sueros, los cuales fueron usados en la detección y cuantificación de los niveles de PCR por la técnica de aglutinación directa siguiendo las indicaciones de la casa comercial (Teco-Diagnostics, Ca. USA).
Determinación del perfil de lípidos plasmáticos
Con el objeto de evaluar el efecto de la dieta con alto contenido en grasas, se determinó un perfil lipídico (incluyendo niveles de colesterol total, lipoproteínas de alta densidad HDL y triglicéridos) utilizando el método microenzimático colorimétrico (QUALITEST), a todas las ratas de los grupos experimentales: antes de administrarles la dieta a los grupos A y C, y las restantes determinaciones a los 30, 60, y 90 días después de iniciada la misma. Las ratas de los grupos B y D se usaron como controles.
Evaluación de la arteria aorta y detección de depósitos lipídicos
Pasado seis meses de la infección inicial con T. cruzi y tres meses de haber iniciado la dieta rica en grasas, todos los animales fueron sacrificados. Después de la necropsia, se extrajo un fragmento de la arteria aorta, la cual fue dividida en sus tres porciones anatómicas: aorta ascendente, cayado y aorta descendente. Las muestras se sumergieron en solución salina al 0,85%, lavadas y fijadas en formalina neutra al 10% durante 48 horas (h) y se incluyeron de manera orientada en el medio OCT-CRYO form en viales de 2 mL para ser conservadas a -70°C en nitrógeno líquido.
Las muestras congeladas de la arteria, se cortaron en un Criostato (Leyca NC 1900) en secciones de 5 µm de espesor, se colocaron sobre un portaobjeto con Poly-L-lisina al 0,001% y se dejaron a temperatura ambiente protegidas de la humedad por espacio de 48 h. Las secciones arteriales se sumergieron en agua destilada durante 5 minutos (min) para hidratar los tejidos; se colocaron en propilenglicol absoluto durante 4 min y se sumergieron en la solución colorante de Aceite Rojo O durante 16 h. Los tejidos se diferenciaron en una solución de propilenglicol al 85% durante 5 min sumergidos en dos cambios de agua destilada y contracoloreados con Hematoxilina de Mayer durante 10 min, enjuagados con agua destilada dos veces durante 1 min y una vez secos, se montaron con jalea de glicerina y cubiertos con un cubreobjeto 24x50 para su observación al microscopio de luz (26).
Análisis estadístico
Los valores obtenidos del IMC y perfil de lípidos plasmáticos, se sometieron a un análisis de variancia (ANOVA) de dos vías para la comparación entre los diferentes grupos experimentales. Los análisis estadísticos se efectuaron mediante el Lenguaje R (27).
Resultados
Las ratas infectadas con T. cruzi mostraron parasitemias patentes entre los 14 y 35 días pi, registrándose el valor más alto a los 25 días pi, con niveles promedios de 36,68 ± 2 trips./mm3 de sangre. A partir de este momento, la parasitemia fue disminuyendo progresivamente hasta los 60 y 90 días pi, cuando no se observaron formas flageladas en la sangre periférica de las ratas (Fig. 1). Durante la fase experimental, no se detectó mortalidad en las ratas infectadas.
Evaluación de la infección chagásica crónica
Los exámenes parasitológicos efectuados no evidenciaron parasitemias patentes. Las pruebas de IFI y ELISA, revelaron la presencia de anticuerpos del isotipo IgG específicos anti-T. cruzi en el 100% de los sueros de las ratas crónicamente infectadas, con títulos de anticuerpos que oscilaron entre 1:256 y 1:1024 y valores de DO entre 0,160 y 0,261.
Cuantificación del IMC
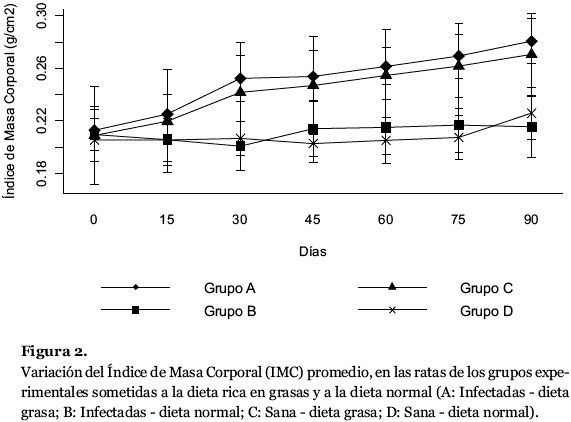
En las ratas del grupo A, el IMC promedio antes de iniciar la dieta fue de 0,213 g/cm2, el cual se incrementó progresivamente durante los tres meses que fueron sometidas a la dieta grasa, alcanzando el máximo valor de 0,281 g/cm2. En las ratas del grupo C, el IMC promedio antes de iniciar la dieta, fue de 0,209 g/cm2 y un valor máximo de 0,271 g/cm2 al finalizar el experimento. En las ratas de los grupos controles B y D, el IMC promedio inicial fue de 0,209 g/cm2 y 0,205 g/cm2 y el final fue de 0,216 g/cm2 y 0,225 g/cm2 respectivamente (Tabla 1; Fig. 2).
Tabla 1. Valores promedio de peso (g) y talla (cm) en ratas Wistar de los diferentes grupos experimentales.
| Día | Grupo A | Grupo B | Grupo C | Grupo D | ||||
|
| Peso | Talla | Peso | Talla | Peso | Talla | Peso | Talla |
| 0 | 343,85 | 40,12 | 317,14 | 38,80 | 338,58 | 40,38 | 334,28 | 40,31 |
| 15 | 385,00 | 41,31 | 318,57 | 38,80 | 375,08 | 41,43 | 346,10 | 41,02 |
| 30 | 435,28 | 41,94 | 317,14 | 39,97 | 426,08 | 42,08 | 365,71 | 42,00 |
| 45 | 441,42 | 42,17 | 344,35 | 40,02 | 444,75 | 42,50 | 363,21 | 42,27 |
| 60 | 468,28 | 42,28 | 347,57 | 40,14 | 458,41 | 42,50 | 370,00 | 42,42 |
| 75 | 484,71 | 42,35 | 351,92 | 40,21 | 471,41 | 42,50 | 382,92 | 42,92 |
| 90 | 505,00 | 42,35 | 357,85 | 40,71 | 487,41 | 42,50 | 423,57 | 43,28 |
El análisis estadístico efectuado a los valores promedios del IMC de ambos grupos de ratas A y C, así como el B y D, no revelaron diferencias estadísticamente significativa (p> 0,05), mientras que el análisis estadístico aplicado a los valores de IMC entre los grupos A y B; A y D; B y C; D y C, mostró diferencias significativas (p<0,05). El análisis de la interacción grupo-tiempo, así como las variables grupo y tiempo por separado, revelaron diferencias estadísticamente significativas. Esta interacción indica que no existe paralelismo entre las curvas de cada una de las variables representadas en función del tiempo, es decir, la diferencia de la media aritmética entre los grupos no es la misma en todos los tiempos.
Detección de Proteína C Reactiva (PCR)
En relación con los valores de PCR, no se evidenciaron resultados positivos en los sueros de las ratas de los grupos A, C y D, ni antes ni después de iniciada la dieta rica en grasas. El análisis de los sueros concentrados de las ratas del grupo B, reveló una discreta reacción positiva en cuatro muestras de sueros, sin embargo, la reacción no fue evidenciada en las diluciones sucesivas.
Detección de lípidos plasmáticos
La concentración de colesterol total mostró un aumento progresivo en los sueros de los animales de los grupos A y C, durante el primer mes de iniciada la dieta rica con alto contenido en grasas, en comparación con los grupos controles B y D, los cuales recibieron la dieta normal compuesta de ratarina y agua ad libitum. Los niveles de colesterol total se modificaron con los cambios en la dieta. A partir del primer mes, los niveles mostraron una disminución progresiva en ambos grupos hasta el tercer mes cuando finalizó el experimento, permaneciendo en niveles mayores a los registrados para los grupos controles B y D (Fig. 3). El análisis de variancia reveló que la interacción entre las variables grupo-tiempo fue estadísticamente significativa (p<0,05), lo que indica que la dieta rica en grasa produjo un aumento significativo en los niveles de colesterol total en los grupos A y C.
En relación con los niveles de colesterol HDL (lipoproteína de alta densidad colesterol bueno), igualmente, se detectó un incremento progresivo en los grupos A y C durante el primer y tercer mes de iniciada la dieta con alto contenido en grasas. Los niveles de C-HDL fueron discretamente superiores en el grupo de ratas sanas sometidas a la dieta rica en grasas (C) en comparación con las ratas infectadas (A) que recibieron la misma dieta. Los niveles de C-HDL en las ratas de los grupos controles B y D permanecieron por debajo a los niveles de los grupos A y C, con una discreta disminución a partir del día 30 (Fig. 4). El análisis estadístico reveló que la interacción entre las variables grupo-tiempo fue estadísticamente significativa (p<0,05). El promedio de los niveles de esta lipoproteína de alta densidad resultó significativamente diferente entre los grupos A y B, A y C, A y D, B y C, D y C, lo que indica que la dieta rica en grasas produjo un aumento significativo en los niveles de C-HDL en los grupos A y C.
La concentración de los niveles de triglicéridos en el suero de las ratas sometidas a la dieta rica en grasas (A y C), reveló un aumento progresivo durante el primer mes de iniciada la misma, en comparación con los grupos controles (B y D). A partir de este tiempo, los niveles de triglicéridos disminuyeron progresivamente, esta disminución fue más acentuada y sostenida en el grupo A. Los niveles de triglicéridos registrados en las ratas de los grupos controles B y D permanecieron inferiores y sin fluctuaciones durante el experimento (Fig. 5). El análisis estadístico de los valores promedio de triglicéridos entre los grupos A y B, A y D, B y C, D y C, mostraron diferencias significativas (P<0,05), lo que revela el incremento en los niveles de triglicéridos en los grupos sometidos a la dieta rica en grasas (A y C). La interacción entre las variables grupo-tiempo, mostró diferencias estadísticamente significativas.
Detección de depósitos lipídicos
El estudio histológico realizado a las secciones de arteria aorta, reveló la presencia de abundantes depósitos lipídicos en la porción ascendente y en el cayado aórtico de las ratas infectadas sometidas a la dieta rica en grasas (A); estos depósitos se encontraron ubicados en la capa muscular de la pared arterial próximos a las capas íntima y adventicia (Fig. 6b). En los cortes de las arterias de las ratas de los grupos C (sana dieta grasa), B (infectada dieta normal) y D (sana dieta normal), no se evidenciaron tales depósitos lipídicos con la técnica empleada (Fig. 6a).
Discusión
El interés fundamental en este estudio ha sido demostrar en un modelo experimental con infección chagásica crónica, las variaciones en la concentración de lípidos plasmáticos y a nivel de las arterias, cuando fue sometido a la ingestión de una dieta con alto contenido en grasas. En este sentido, la rata albina (R. norvegicus), cepa Wistar, considerada por diversos investigadores como un animal susceptible a las infecciones naturales y experimentales con diferentes cepas de T. cruzi, incorpora un mínimo de atributos que fueron originalmente precisados para un modelo animal, tales como variación en las respuesta humoral y celular y cambios patológicos importantes que semejan, en parte, a lo que ocurre en la enfermedad de Chagas humana (28-33).
Los resultados del presente estudio, revelaron que después de la inoculación con formas metacíclicas de T. cruzi, las ratas juveniles, desarrollaron una fase aguda típica, con parasitemias patentes entre los 14 y 35 días pi. Todas las ratas superaron la fase aguda, pasando a una fase indeterminada y/o crónica de la infección, caracterizada por la ausencia de parásitos en la sangre periférica y por la presencia de títulos de anticuerpos específicos anti-T. cruzi del isotipo IgG detectados por las técnicas serológicas empleadas. Las variables parasitemias observadas durante la fase aguda y los títulos de anticuerpos detectados en la fase crónica, fueron similares a los reportados por Moreno y col. (31,32) y Alarcón y col. (33) usando el mismo modelo animal infectado con diferentes cepas del parásito.
Se ha señalado que la administración de dietas con alto contenido en grasas inducen obesidad en animales genéticamente susceptibles, tal aseveración fue confirmada en el modelo experimental rata Wistar sometidas a una dieta rica en grasas. Los resultados obtenidos utilizando el IMC, revelaron, un sobrepeso en las ratas de los grupos A (infectadas con T. cruzi) y C (sanas) las cuales recibieron la dieta rica en grasas. El análisis estadístico no mostró diferencias significativas entre ambos grupos, lo que indica que la infección chagásica en el grupo A, no provocó ningún efecto aparente sobre el IMC. El aumento de sobrepeso fue cualitativamente corroborado durante la necropsia de los animales por la presencia de abundante tejido graso a nivel abdominal y del retro-esternón observado en los grupos sometidos a la dieta rica en grasa (A y C) en comparación con los grupos controles de la dieta B y D. No obstante, Sunnemark y col. (16), observaron que la infección aguda con T. cruzi produce una disminución estadísticamente significativa (p<0,001) en el peso de ratones CBA/J sometidos a una dieta rica en grasas y a una dieta normal con ratarina, lo que pudo deberse a las altas parasitemias detectadas y al modelo animal utilizado en el estudio de la interacción aterosclerosis - infección chagásica. Es importante señalar que estos autores no determinaron el IMC sino que consideraron solamente el peso, parámetro que está condicionado en parte por el tamaño de los animales.
La otra forma de evaluar el efecto de la dieta rica en grasas y el riesgo aterogénico fue la realización cada mes de un perfil lipídico, el cual reveló un aumento progresivo en los niveles de colesterol total en los grupos A y C durante el primer mes, seguido de una disminución sostenida hasta los noventa días post-dieta, en comparación con los grupos controles B y D, cuyos valores permanecieron inferiores, aumentando de esta manera el riesgo cardiovascular en los grupos sometidos a la dieta rica en grasas. Este resultado concuerda con lo reportados por Sunnemark y col. (16), quienes encontraron en ratones infectados con T. cruzi alimentados con una dieta grasa, niveles de colesterol inferiores a los detectados en ratones sanos sometidos a la misma dieta al finalizar su experimento. Igualmente, observaron un discreto aumento en los niveles de colesterol en ratones infectados sometidos a una dieta normal, en comparación con el grupo sano-dieta normal, este hecho contradice el posible efecto que pudiese tener la infección con T. cruzi sobre la disminución en los niveles de este lípido. Alarcón y col. (17) trabajando con conejos infectados con T. cruzi, sometidos a una dosis diaria de 60 mg/mL de colesterol, registraron niveles promedios de colesterol total inferiores a los obtenidos en los conejos sanos, quienes recibieron la misma dosis. La explicación a esta progresiva disminución podría estar asociada a una capacidad disminuida del hígado infectado en producir dichos lípidos, a una mayor peroxidación de las lipoproteínas de baja densidad (LDL), seguida de una mayor eliminación biliar de colesterol y por otra parte, se estarían generando células espumosas aterogénicas. La disminución en los niveles séricos de colesterol total, también ha sido reportado en infecciones concomitantes con otros protozoarios parásitos, tal como Toxoplasma gondii (34). En este mismo orden de ideas, las deslipoproteínemias han sido también asociadas con procesos inflamatorios sistémicos (35).
Los niveles de lipoproteína HDL también mostraron un progresivo aumento durante el primer mes de haberse iniciado la dieta en los grupos A y C, lo que indica que esta dieta no fue del todo aterogénicamente efectiva y/o vascularmente riesgosa posiblemente por el papel protector de la lipoproteína en el desarrollo de la estría grasa, evento histológico inicial en la generación de la lesión aterosclerótica. Eckardstein y Assmann (36), señalaron que el C-HDL cumple un rol crítico en la vía endógena de transporte de lípidos, dado que esta vía se encarga de captar el colesterol remanente desde los distintos tejidos, incluida la pared arterial y los transporta al hígado para su posterior reutilización o eliminación a través de la bilis (transporte reverso de colesterol), evitando su acumulación a nivel tisular, reduciéndose de esta manera los niveles de colesterol plasmáticos, como el colesterol-LDL, el cual cumple una función contraria al HDL, es decir, transportar colesterol hacia los tejidos periféricos incluyendo la pared arterial, evento inicial en la aterogénesis. En este estudio fue importante encontrar niveles promedios de C-HDL significativamente inferiores (p<0,05) en las ratas del grupo A en comparación con las del grupo C, y una asociación estadísticamente significativa entre la infección con T. cruzi y la disminución de dichos valores, contribuyendo con la dislipidemia. La disminución en los niveles de HDL también ha sido reportado en conejos infectados con T. cruzi (17), así como en ratones infectados con T. gondii (34) y con otros procesos inflamatorios sistémicos como las enfermedades autoinmunes, entre ellas el lupus eritematoso sistémico (37), la artritis reumatoidea (38) y el síndrome antifosfolipídico (39).
En este estudio no fue encontrada una asociación estadísticamente significativa entre la infección con T. cruzi y la disminución a partir del primer mes en los niveles de triglicéridos en los dos grupos sometidos a la dieta rica en grasas, lo que indica el posible papel que pudo jugar la dieta en esta disminución. Como ya ha sido descrito, la dieta rica en grasa suministrada a los animales de los grupos A y C fue a base de ratarina suplementada con manteca vegetal, la cual está constituida por aceites vegetales hidrogenados y no hidrogenados, siendo estos últimos los que se encuentran en mayor proporción en este tipo de grasa, los cuales tiene efectos cardiovasculares positivos o favorables, ya que los mismos producen un aumento en los niveles de colesterol HDL y una disminución en la concentración de triglicéridos (40-42), efectos claramente evidenciados en este estudio. El incremento de triglicéridos durante el primer mes de haber iniciado la dieta, puede tener su explicación en el cambio que sufrieron los animales en cuanto a la composición del alimento, considerando que no solamente la calidad de los ácidos grasos que integran la dieta (hidrogenados o no) son importantes, sino que tiene igual importancia la cantidad ingerida (42).
El hallazgo más relevante de nuestro estudio, es el haber encontrado en la pared de la arteria aorta de ratas del grupo A abundantes depósitos lipídicos asociados a la capa media o muscular, estos depósitos lipídicos son los que constituyen la llamada estría grasa, lesión incipiente precedente a la formación de las placas ateroscleróticas, lo que explicaría que este panorama histológico produciría alteraciones microvasculares, lo cual podría jugar un papel significativo en la patogénesis de la cardiopatía chagásica crónica, tal como lo proponen Figuereido y col.(43) y Rossi y Carobrez (44). No obstante, en las ratas del grupo C sometidas a la misma dieta rica en grasas, ni en las ratas del grupo B infectadas con T. Cruzi, se evidenciaron tales depósitos lipídicos. La combinación o interacción infección chagásica-dieta rica en grasa, son factores que predisponen y/o aumentan el riesgo de aterosclerosis y de enfermedades cardiovasculares en general (1).
Al evaluar las concentraciones plasmáticas de PCR en las ratas infectadas alimentadas con la dieta rica en grasas (A) y en los controles infectados (B), se pudo evidenciar una discreta reactividad positiva en las ratas del grupo B, sin embargo, no descartamos el papel que pudo jugar esta proteína en la aterogénesis durante el curso de la infección chagásica. La presencia de la PCR en las ratas infectadas confirma la cronicidad de la infección chagásica. En humanos con enfermedad de Chagas crónica, las concentraciones séricas de PCR no muestran valores elevados (45). Por otro lado, diversos estudios experimentales han demostrado que la PCR es un buen biomarcador sérico del proceso de la aterosclerosis, en función de que la misma ha sido detectada en el interior de la placa del ateroma desde las etapas iniciales de su desarrollo. Esta PCR media sus efectos induciendo disfunción endotelial, participando en el reclutamiento de monocitos, facilitando la captación de las LDL oxidadas por los macrófagos activados, entre otros. Otra posibilidad, es que la elevación de esta proteína sea el reflejo de una inflamación aguda extravascular que pueda inducir o potenciar el desarrollo de la placa (46).
Conclusiones
Los resultados obtenidos en el presente estudio, permiten confirmar que la administración de una dieta con alto contenido en grasas produjo: incremento progresivo del IMC hasta valores que indicaban un sobrepeso; aumento en los niveles de colesterol total, C-HDL y triglicéridos, variables que fueron afectadas significativamente por la infección chagásica crónica, mecanismo por el cual el parásito induce la aterogénesis; marcada disminución en los niveles de triglicéridos a partir del primer mes de iniciada la dieta. Estas alteraciones en los niveles de estas proteínas plasmáticas, nos permite concluir que la dieta con alto contenido en grasas no fue aterogénicamente efectiva.
El estado inflamatorio producido por la infección crónica con T. cruzi tanto a nivel sistémico como en las arterias, en combinación con la dieta grasa, induce la acumulación de lípidos en la pared arterial y el desarrollo de placas ateromatosas, aun cuando la dieta no haya producido un perfil lipídico vascularmente desfavorable.
Los resultados obtenidos podrían ser extrapolados a la población humana, debido a que la infección crónica por T. cruzi presenta efectos sistémicos de riesgo aterogénico, lo que podría incidir en la morbilidad y mortalidad de personas con enfermedad de Chagas crónica.
Agradecimientos
Al Consejo de Desarrollo Científico, Humanístico y Tecnológico por el financiamiento a través del Proyecto CDCHT-C-1184-03-03-A. A la Comisión de Estudio del Pregrado (CODEPRE) de la Universidad de Los Andes por el apoyo a los estudiantes del Pregrado.
Referencias Bibliográficas
1. World Health Organization. The world health report 1997. [ Links ]
2. Chagas C. Nova trypanosomiasis humana: estudo sobre a morfologia e o ciclo evolutivo de Schizotrypanum cruzi, N. Gen. Mem Inst Oswaldo Cruz 1909; 1: 159-218. [ Links ]
3. Kollien AH, Schaub GA. The development of Trypanosoma cruzi in Triatominae. Parasitol Today 2000; 16: 381-387. [ Links ]
4. Lorca M, Veloso C, Sporrong L, Engstrom A, Orn A. Synthetic peptides of Trypanosoma cruzi in the diagnosis of congenital Chagasdisease. Res Rev parasitol 1995; 58: 43-47. [ Links ]
5. Brener Z. Recent developments in the field of Chagas disease. Bull Health Org 1982; 60: 463-472. [ Links ]
6. Ross R. Atherosclerosis: a defence mechanism gone awry. Am J Pathol. 1993; 143: 987-1002. [ Links ]
7. Sierra Y. Metabolismo de los lípidos y su importancia clínica. Bogotá: Ed Autor 1995; p.51-105. [ Links ]
8. CDCP. Centers for Diseases Control and Prevention. Departament of health and human services, centers for disease control and prevention 1999; 649-56. [ Links ]
9. Torres M. Arteriolosclerose das finas ramificaçoes arteriais do miocárdio (coronarite chagásica) e miocitolise focal do miocárdio na cardiopatia chagásica cronica. O Hospital 1958; 54: 19-34. [ Links ]
10. Palacios E, Carrasco H, Scorza C, Espinoza R. Ultraestructura miocárdica en la enfermedad miocárdica de Chagas. Diagnóstico diferencial con la miocardiopatía dilatada o congestiva y con las miocardiopatías arritmicas. Rev Lat Cardiol 1982; 3: 115-137. [ Links ]
11. Bestetti R, Arion M. Clinical characteristics of acute myocardial infection in patients with Chagas disease. Int J Cardiol 1992; 35: 371-376. [ Links ]
12. Reis L, Mesquita P, Mesquita L, Chapadeiro E, Uberaba, M. Aterosclerose coronarian e infarto do miocardio em chagasicos cronicos. Arq Bra Cardiol 1995; 65:143-145. [ Links ]
13. Berrisbetia M, Mota ME, Jonquera A, Blanco A, Pozo A, Geraldino O. Niveles de lipoproteínas, colesterol y triglicéridos en individuos en la fase indeterminada y crónica de la enfermedad de Chagas. Bol Malariol Sal Amb 2007; 47 (Supl. 1): 155. [ Links ]
14. Ofusu FA. The relationships of platelets to arterial thrombosis and atherosclerosis. Rec Adv in Blood Coagulac 1997; 7: 33-48. [ Links ]
15. Hill R, Wyse G, Anderson M. Alimentos, energía y temperatura. Fisiología animal. Ed Madrid: Panamericana edit 2006; p.106. [ Links ]
16. Sunnemark D, Harris R, Frotegard J, Orn A. Induction of early atherosclerosis in CBA/J mice by combination of Trypanosoma cruzi infection and a high cholesterol diet. Atheros 2000; 153: 273-282. [ Links ]
17. Alarcón M, Añez N, Calderón L, Matousek A. Evaluación de la ingesta de colesterol en conejos infectados con Trypanosoma cruzi. Kasmera 2004; 32: 117-126. [ Links ]
18. Walton B, Brooks W, Arjona L. Serodiagnosis of american leishmaniasis dy indirect fluorescent antibody test. Am J Trop Med Hyg 1972; 21: 296-299. [ Links ]
19. Moreno E, Rivera I, Moreno S, Alarcón M, Lugo de Yarbuh A. Transmisión vertical de Trypanosoma cruzi en ratas Wistar durante la fase aguda de la infección. Invest Clín 2003; 44: 241-254. [ Links ]
20. Brener Z. Observações sobre a imunidade a superinfeções em camundongos experimentalmente inoculados com Trypanosoma cruzi e submetidos a tratamento. Rev Inst Med Trop 1962; 4: 119 -123. [ Links ]
21. Freilij H, Müller L, Gonzáles C. Direct micromethod for diagnosis of acute and congenital Chagas disease. J Clin Microbiol 1983; 18: 327-330. [ Links ]
22. Camargo M. Fluorescent antiboby test for serodiagnosis. Technical modification employing preserved culture forms of Trypanosoma cruzi in slide test. Rev Inst Med Trop 1966; 8: 227-234. [ Links ]
23. Voller A, Draper C, Bidwell D, Brtleti A. Microplata enzyme-linked-immunosorbent assay for Chaga´s disease. The Lancet 1975; 1: 426-428. [ Links ]
24. Novelli EL, Diniz YS, Galhardi CM, Ebail GM, Rodrigues HG, Mani F, Fernandes AA, Cicogna AC, Novelli Filho JH. Anthropometrical parameters and markers of obesity in rats. Lab Anim 2007; 41: 111-119. [ Links ]
25. Diniz YSA, Cicogna AC, Padovani CR, Santana LA. Diets rich in saturated and polyunsaturated fatty acids: metabolic shifting and cardiac heath. Nutrition 2000; 20: 230-234. [ Links ]
26. Prophet E, Mills B, Arrington J, Sobin L. Métodos Histotecnológicos. Instituto de Patología de las Fuerzas Armadas de los Estados Unidos de América (AFIP). Washington, D.C. 1991. [ Links ]
27. R. Development Core Team. A language and environment for statistical computing. Viena, Austria: R Foundation for Statistical Computing 2007. [ Links ]
28. Scorza C, 1982. La rata Wistar como modelo experimental para el estudio de la miocarditis chagásica: aspectos histopatológicos, histoquímicos, inmunológicos y electrocardiográficos en diferentes etapas de la infección. [Trabajo de Ascenso] Mérida: Univ. de los Andes. [ Links ]
29. Moreno E, Añez N, Scorza C, Lugo de Yarbuh A, Borges R. Efecto de inóculos bajos en la infección experimental por Trypanosoma cruzi. Bol Dir Malariol y San Amb. 1999; 38: 1-8. [ Links ]
30. Moreno E, González N, Rivera I, Guillén de P, Lugo de Yarbuh A, Añez N. Caracterización biológica e isoenzimática de aislados de Trypanosoma cruzi. Bol Malariol y San Amb 2002; 42: 17-28. [ Links ]
31. Moreno E, Quintero A, Alarcón M, Lugo Yarbuh A, Moreno S, Araujo S. Investigaciones sobre la transmisión vertical de Trypanosoma cruzi en ratas Wistar crónicamente infectadas. Bol Malariol y Sal Amb 2006; 46: 149-160. [ Links ]
32. Moreno E, Quintero A, Alarcón M, Lugo Yarbuh A, Moreno S, Araujo S. Investigaciones sobre la transmisión vertical de Trypanosoma cruzi en ratas Wistar crónicamente infectadas. Bol Malariol y Sal Amb 2006; 46: 149-160. [ Links ]
33. Alarcón M, Lugo de Yarbuh A, Moreno E, Payares G, Araújo S, Colmenares M. Presencia de Trypanosoma cruzi en tejidos de ratas Wistar infectadas experimentalmente y sus fetos. Bol Malariol Sal Amb 2006; 46: 137-148. [ Links ]
34. Portugal L, Fernandes L, César G, Santiago H, Oliveira D, Silva N, Silva A, Vieira J. Infection with Toxoplasma gondii increases atherosclerotic lesion in ApoE-Deficient mice. Infect Immunol 2004; 72: 3571-3576. [ Links ]
35. Lahita R, Rivkin E, Cavanagh I, Romano P. Low levels of total cholesterol, high density lipoprotein and apolipoprotein A1 in association with anticardiolipin antibodies in patients with systemic lupus erythematosus. Arthritis Rheum 1993; 36: 1566-1574. [ Links ]
36. Eckardstein V, Assmann N. High density lipoproteins and ateriosclerosis. Role of cholesterol efflux and reverse cholesterol transport. Arterioscler Thromb Vasc Biol 2001; 21: 13-27. [ Links ]
37. Pperumal T. Atherosclerosis, autoimmunity and systemic lupus erythematosus. Circul 2001; 104: 1876-1881. [ Links ]
38. Vincenzo P, Yeh E. A tale of two diseases. Atherosclerosis and Rheumatoid arthritis. Circul 1999; 100: 2124-2126. [ Links ]
39. Glueck C, Lang J, Tracy S, Wang P. Evidence that anticardiolipin antibodies are independent risk factor for atherosclerotic vascular disease. Am J Cardiol 1999; 83: 1490-1494. [ Links ]
40. Woolett L, Spady K, Dietschy J. Saturated and unsaturated fatty acids independently regulate low density lipoprotein receptor activity and production rate. J Lipid Res 1992; 33: 77-88. [ Links ]
41. Aster M, Scorza T, Gallardo L, Hamana N. Alteraciones bioquímicas en conejos alimentados con aceite de palma y maíz y su relación con los hallazgos morfológicos. Rev Fac Med 2004; 27: 1-19. [ Links ]
42. Espondaburu O. Hipertrigliceridinemia: influencia sobre parámetros que estiman el transporte reverso del colesterol. Act Bioquím Clin Lat 2006; 40: 165-172. [ Links ]
43. Figueiredo F, Marin J, Rossi M. The evolution of experimental Trypanosoma cruzi cardiomyopathy in rabbits: further parasitological, morphological and functional studies. Int J Cardiol 1986; 10: 277-290. [ Links ]
44. Rossi M, Carobrez S. Experimental Trypanosoma cruzi cardiomyopathy in BALB/c mice: histochemical evidence of hypoxic changes in the myocardium. J Exp Pathol 1985; 66: 155-160. [ Links ]
45. Cetron MS, Basilio FP, Moraes AP, Sousa AQ, Paes NJ, Kahn SJ, et al. Humoral and celular immune response of adults from northeastern Brazil with chronic Trypanosoma cruzi infection. Am J Trop Med Hyg 1993; 49:370-82. [ Links ]
46. Premoli G, Villarreal J. Proteína C reactiva como marcador de la inflamación en el proceso de aterosclerosis. Médicas UIS 2006; 19: 265-275. [ Links ]












 uBio
uBio